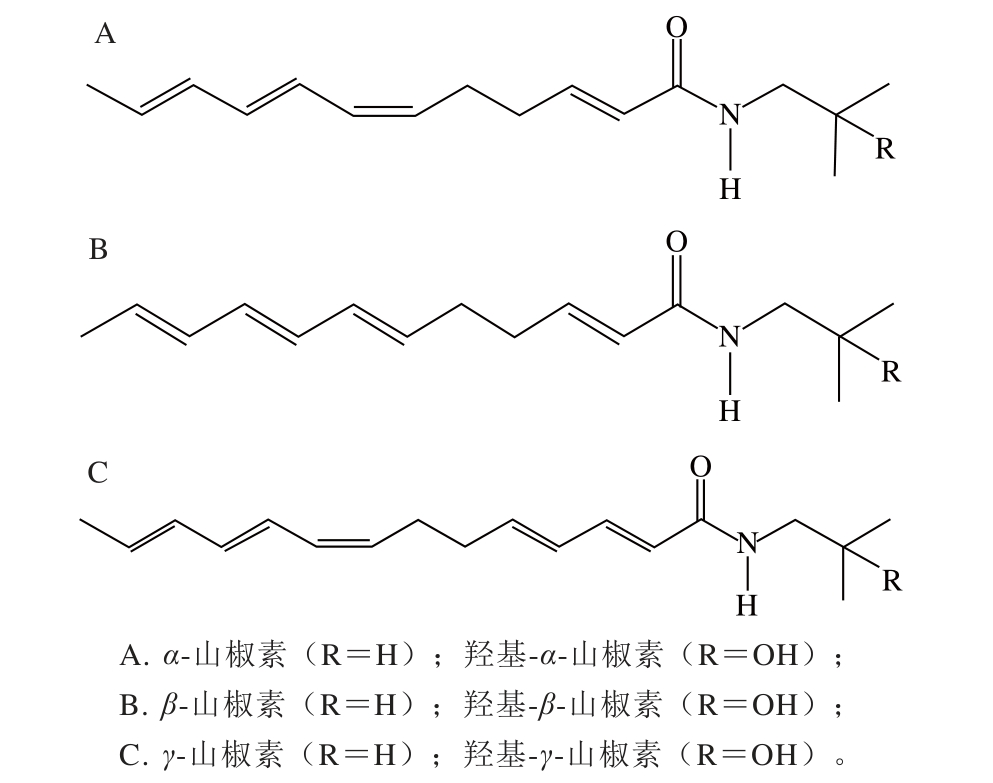
图1 花椒麻味物质的主要成分结构式
Fig. 1 Chemical structures of major numb-taste components inZanthoxylum bungeanum
李 耀1,陈晓龙1,罗 凯1,阚建全1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市农产品加工与贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
摘 要:为实现对花椒麻味物质经济高效的纯化制备,本实验采用分子印迹技术,以甲基丙烯酸为功能单体,花椒麻味物质为模板分子,合成对花椒麻味物质具有特异性识别和吸附能力的分子印迹聚合物(molecularly imprinted polymers,MIPs),并用MIPs制成固相萃取柱用于分离纯化花椒油树脂中的花椒麻味物质。吸附动力学实验结果显示,MIPs与花椒麻味物质接触约12 h后就达到吸附平衡,对花椒麻味物质识别因子α达到3.05;等温吸附实验表明,MIPs对花椒麻味物质的吸附量高于空白聚合物,在吸附过程中模板分子花椒麻味物质与MIPs形成两种结合位点,两种结合位点的解离常数分别为1.172×10-2mg/mL和3.585×10-2mg/mL,对花椒麻味物质最大表观吸附量分别为11.133 mg/g和15.802 mg/g;固相萃取实验表明,该固相萃取柱可以分离出相对纯度为94.09%的花椒麻味物质。
关键词:花椒麻味物质;分子印迹聚合物;固相萃取;提取纯化
Abstract:In order to develop an economical and efficient approach to prepare purified numb-taste compounds fromZanthoxylum bungeanum, molecularly imprinted polymers (MIPs) were synthesized by bulk polymerization, using the numb-taste components ofZanthoxylumas bungeanumas the template molecule and methylacrylic acid (MAA) as the functional monomer in this work, and they were used to develop a solid phase extraction (SPE) column. The experimental results of adsorption kinetics showed that the adsorption of the numb-taste components on MIPs could reach equilibrium in 12 h and the recognition factor (α) was 3.05. The adsorption isothermal c urve s of MIPs and non-molecularly imprinted polymers (NIPs) showed that the adsorption quantity of the numb-taste components into the cavity formed by MIPs was higher than into that formed by NIPs. Two distinct binding sites were observed between the imprinted polymer and the template (the num b-taste components). The dissociation constants (Kd) for the binding sites were 1.172 × 10-2and 3.585 × 10-2mg/mL, and the apparent maximum adsorption capacity (Qmax) were 11.133 and 15.802 mg/g, respectively. The numb-taste compounds with 94.09% purity fromZanthoxylumas bungeanumwere obtained using the MIP-based SPE column developed.
Key words:numb-taste components ofZanthoxylum bungeanum; molecularly imprinted polymers; solid phase extraction;extraction and purifi cation
花椒(Zanthoxylum bungeanumMaxim.)是家庭常用的烹饪调味料和中药配料,主要成分有挥发油、生物碱、酰胺、香豆素、木质素和脂肪酸等[1-2]。其中使花椒具有麻味的物质主要是不饱和脂肪酰胺,现在研究报道的主要是山椒素及其对应的羟基山椒素,它们均为链状不饱和脂肪酰胺(图1),这类酰胺物质被称为花椒麻味物质,羟基-α-山椒素是最能代表花椒引起麻辣感的成分。花椒麻味物质具有麻醉、兴奋、抑菌、祛风除湿、杀虫和镇痛等功效,具有很好的药用价值[3-4]。

图1 花椒麻味物质的主要成分结构式
Fig. 1 Chemical structures of major numb-taste components inZanthoxylum bungeanum
花椒麻味物质在空气中极易氧化,目前国内还没有市售的花椒麻味物质标准品,且由于不同花椒品种其不饱和脂肪酰胺种类和含量不尽相同,花椒酰胺的结构、性质、含量等方面还有许多工作有待完善,因此迫切需要对花椒麻味物质的分离、纯化进行研究,制备商品化的标准品[5-6]。花椒麻味物质的传统分离提取方法主要是水提法、有机溶剂提取法和超临界CO2萃取法[7-8]。但这些提取分离方法存在很多缺点,如水蒸气蒸馏仅能提取花椒中低沸点的挥发油;有机溶剂提取时间长、杂质含量高、风味成分损失大,还有溶剂残留等问题;超临界CO2萃取法提取工艺繁琐、对设备的要求很高、费用开销大,很难实现花椒麻味物质的规模化分离提取;同时这些方法提取的花椒麻味物质纯度不高,不能用于标准品。因此目前急需探索研究经济、高效的提取花椒麻味物质的方法[9-10]。分子印迹技术是指用化学的方法合成对某一特定目标化合物(模板或称印迹分子)具有特异性识别能力的高度交联聚合物的技术,制备的特异聚合物被称为分子印迹聚合物(molecularly imprinted polymers,MIPs)[11]。分子印迹技术现已广泛应用于食品中天然成分的提取和检测,但目前有关花椒麻味物质的分子印迹技术鲜见相关报道。本实验制备出对花椒麻味物质具有特异性识别与分离功能的MIPs,并对花椒麻味物质进行固相萃取研究,以期为高纯度花椒麻味物质的分离提取提供一种新的经济高效的方法。
1.1 材料与试剂
花椒麻味物质标准品(纯度95%以上),由本实验室按照逆流干柱层析法、制备型高效液相色谱(high performance liquid chromatography,HPLC)法等工序制备[12]。
花椒油树脂 重庆四面山骄王花椒开发有限责任公司;偶氮二异丁腈(azobisisobutyronitrile,AIBN)、乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EGDMA)、甲基丙烯酸(methacrylic acid,MAA)(均为分析纯) 美国Sigma公司;氯仿、甲醇、冰乙酸、乙腈(均为分析纯) 成都科隆试剂公司;实验用水为蒸馏水。
1.2 仪器与设备
HJ-3型数显恒温磁力搅拌器 常州国华电器有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;超声波清洗器 上海科导超声仪器有限公司;XMTD-6000型电子恒温水浴锅 北京长风仪器仪表有限公司;1260型HPLC仪 美国Agilent公司;CP214型电子天平 奥豪斯仪器上海有限公司;IR Prestige-21型傅里叶变换红外光谱仪 日本Shimadzu公司;S-3400N Ⅰ型扫描电子显微镜 日本Hitachi Science Systems有限公司;SHD-Ⅲ型循环水式多用真空泵 上海汗诺仪器有限公司。
1.3 方法
1.3.1 花椒麻味物质MIPs的制备
参考文献[13-14]的方法。称取65.8 mg(约0.25 mmol)花椒麻味物质于50 mL圆底烧瓶中,加入10 mL乙腈和2 mL乙醚溶解,加85.3 μL(约1.0 mmol)功能单体MAA,80 Hz超声30 min,使其充分溶解,5 ℃避光放置过夜,使模板分子和功能单体充分作用;加入941 μL(约5.0 mmol)交联剂EGDMA和12 mg引发剂AIBN,充分溶解后,盖上带有通气针的橡胶塞,向混合液中通氮气20 min,使瓶内保持惰性氛围,拔出通气针,在氮气保护下迅速用封口膜密封烧瓶口;于60 ℃恒温水浴锅内热引发聚合24 h,得乳白色块状聚合物,将聚合物反复研磨,过150 目标准检验筛;用丙酮自然沉降3 次,每次1 h,弃去上层浊液,以除去聚合物中过细小的粒子;将下层沉淀真空干燥后,以甲醇-乙酸(9∶1,V/V)为溶剂进行索氏提取除去模板分子,直至索氏提取器内溶液不含花椒麻味物质为止;再用甲醇反复洗涤聚合物以除去其中残留的乙酸,将处理好的MIPs放置于真空干燥箱内,50 ℃干燥至恒质量,即得花椒麻味物质MIPs。作为对照,实验制备了空白印迹聚合物(nonmolecularly imprinted polymers,NIPs)。NIPs的制备及处理方法与MIPs的相同,只是在聚合物合成过程中不加模板分子花椒麻味物质。
1.3.2 花椒麻味物质标准曲线的绘制及HPLC检测方法
称取5.0 mg花椒麻味物质标准品,在容量瓶中用三氯甲烷溶液定容至10 mL,得到0.5 mg/mL的花椒麻味物质氯仿溶液,再用氯仿将其逐渐稀释成0.40、0.20、0.10、0.05、0.02、0.01 mg/mL的标准工作液,将该系列标准溶液进行HPLC分析,以目标峰的平均总峰面积(y)对质量浓度(x/(mg/mL))绘制标准曲线。Excel计算得出花椒麻味物质标准曲线的线性回归方程为y=18 963x+576.8(R2=0.998)。
称取5.0 mg花椒麻味物质标准品,在容量瓶中用甲醇定容至10 mL,得到0.5 mg/mL的花椒麻味物质甲醇溶液,再用甲醇将其逐渐稀释成0.40、0.20、0.10、0.05、0.02、0.01 mg/mL的标准工作液,将该系列标准溶液进行HPLC分析,以目标峰的平均总峰面积(y)对质量浓度(x/(mg/mL))绘制标准曲线。Excel计算得出花椒麻味物质标准曲线的线性回归方程为y=20 460x+378(R2=0.995)。
HPLC色谱检测条件[15]:色谱柱:EclipseXDB-C18(4.6 mm×250 mm,5 μm);流动相:甲醇-水(体积比60∶40);流速:1 mL/min;保留时间:15 min;进样量:10 μL;柱温:40 ℃;紫外检测波长:254 nm。
1.3.3 MIPs和NIPs的吸附动力学实验
准确称取60.0 mg的MIPs和NIPs,分别置于10 mL容量瓶中,然后分别加入5 mL质量浓度为250 μg/mL的花椒麻味物质的氯仿溶液。混合溶液放入25 ℃水浴恒温振荡器中,使MIPs与花椒麻味物质分子相互作用,每隔一段时间(1、3、6、9、12、18、24 h)取出MIPs和NIPs上清液各一份,测定其中花椒麻味物质含量,绘制花椒麻味物质吸附量Q与吸附时间t之间的变化曲线[16]。
1.3.4 MIPs和NIPs的等温吸附实验
设定质量浓度为50、100、150、200、250 μg/mL的花椒麻味物质的氯仿溶液。称取多份等量已处理过的MIPs(60 mg)和NIPs(60 mg),分别置于10 mL容量瓶中,按质量浓度梯度在每个容量瓶中加入5 mL不同质量浓度的上述花椒麻味物质的氯仿溶液,于25 ℃恒温振荡器中振荡5 h,使聚合物与底物充分作用后取出,6 000 r/min高速离心5 min,取适量上层清液,用HPLC法测定其质量浓度,计算平衡吸附后MIPs对花椒麻味物质的吸附量[17]。根据平衡吸附前后溶液中花椒麻味物质质量浓度的变化可计算MIPs对底物的吸附量、特异结合量、识别因子。特异结合量(∆Q)的计算见式(1),识别因子(α)的计算见式(2)。

式中:QMIP为MIPs的吸附量;QNIP为NIPs的吸附量。
最后,用Scatchard模型作图法评价印迹聚合物的吸附性质[18],按式(3)计算。
式中:Kd为结合位点的解离平衡常数;Qmax为结合位点的最大表观吸附量/(mg/g);Q为MIPs对模板分子的吸附量/(mg/g);C为平衡时吸附液中模板分子的质量浓度/(mg/mL)。
1.3.5 花椒麻味物质MIPs形态结构的表征
花椒麻味物质MIPs在IR Prestige-21型傅里叶变换红外光谱仪上进行测定(KBr压片法,扫描范围500~4 000 cm-1);分别取处理过的花椒麻味物质MIPs和NIPs粉末,于S-3400N Ⅰ型扫描电子显微镜下观测样品表观形态。
1.3.6 固相萃取柱的制备
参考文献[19-20]的方法,用内径为22.5 mm,长为160 mm的带有滤板的聚丙烯空柱制成分子印迹固相萃取小柱。装填料前,先在底端放入聚乙烯筛板,往固相萃取小柱中装填约4.5 g MIPs,轻轻按压使柱子填充紧实,装柱高度为5 cm,装填料后,用甲醇润湿固相萃取柱,使表面平齐,在填料上表面固定聚乙烯筛板。
1.3.7 固相萃取实验
1.3.7.1 样品的处理
取2.0 g花椒油树脂置于100 mL氯仿中,于35 ℃条件下150 r/min振荡提取4 h,再将其转移到分液漏斗中,振摇2 min,静置分层后,收集氯仿萃取液。氯仿不溶部分再用少量氯仿萃取2~3 次,合并氯仿萃取液,定容于200 mL容量瓶中,将其作为固相萃取柱的上样液于4 ℃条件下避光保存待用。
1.3.7.2 花椒麻味物质的分离纯化
参考文献[21]的方法。1)活化:先逐滴加入10 mL纯水流过固相萃取柱,再逐滴加入10 mL甲醇使之缓慢过柱。2)上样:逐滴加入15 mL乙腈淋洗固相萃取柱,然后加入2 mL含有花椒麻味物质的氯仿溶液,使之缓慢流过固相萃取小柱进行富集。3)洗涤:待样液全部通过固相萃取柱后用10 mL乙腈洗涤固相萃取柱,将弱保留干扰化合物洗掉,弃去全部流出液。4)洗脱:用甲醇溶液洗脱花椒麻味物质,先快速放出5 mL洗脱液,平衡10 min后继续洗脱。洗脱液全部收集于250 mL圆底烧瓶中,于50 ℃条件下旋转蒸发至3~5 mL,将洗脱液定容于10 mL容量瓶中,并通过0.22 μm的微孔滤膜过滤,供HPLC检测。
1.4 数据统计分析
每个实验重复3 次,用Origin 8.0和Excel 2003软件处理实验数据并作图,结果以 ±s表示。
2.1 MIPs的傅里叶变换红外光谱分析
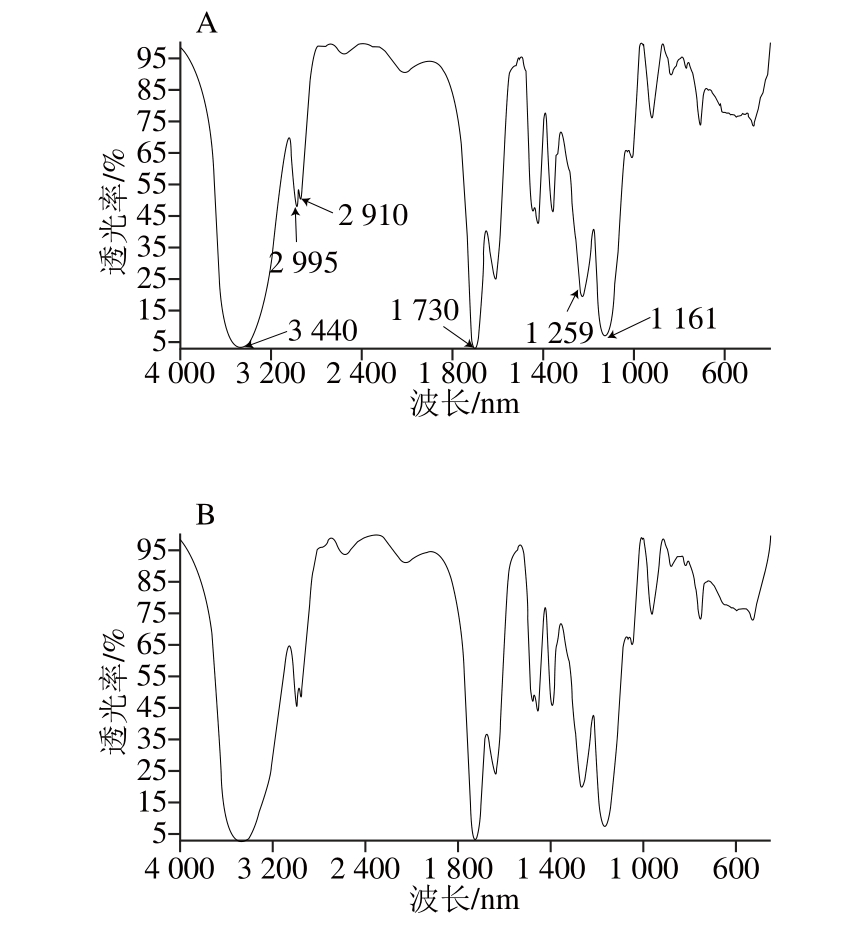
图2 MIPs(A)和NIPs(B)的傅里叶变换红外光谱图
Fig. 2 FTIR spectra of MIPs (A) and NIPs (B)
以甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂制得的MIPs和NIPs的傅里叶变换红外光谱图见图2,MIPs在3 440 cm-1左右处出现较宽较强的吸收峰,为羧酸基团的—OH伸缩振动峰;1 730 cm-1左右处出现的强峰,为C=O的伸缩振动峰,说明交联剂聚合得到的MIPs中存在可以和印迹分子作用的羧酸基团[22];MIPs与NIPs都有明显的酯基、(亚)甲基特征吸收峰,2 995 cm-1与2 910 cm-1处分别为—CH2、—CH3的伸缩振动峰,1 730 cm-1处为功能单体甲基丙烯酸和交联剂乙二醇二甲基丙烯酸酯上C=O的伸缩振动峰,1 259 cm-1与1 161 cm-1处为交联剂乙二醇二甲基丙烯酸酯上C—O—C的不对称和对称伸缩振动峰,这些说明功能单体和交联剂已进行了交联聚合[23]。从图2还可看出,MIPs与NIPs峰形和强度基本一致,说明两者成分相同,印迹模板得到了很好的洗脱。
2.2 花椒麻味物质MIPs的形态结构

图3 MIPs(A)和NIPs(B)的扫描电子显微镜图(×5 0000)
Fig. 3 SEM photos of MIPs (A) and NIPs (B) (×5 000)
由图3可知,MIPs与NIPs相比,表面凹凸不平,立体效果更加明显,有多孔的交联结构[23]。MIPs的分散性好,呈颗粒状和球状;而NIPs表面看起来颗粒之间相互黏结,形状不规则,有较大的随机性,而且有结块现象发生,成为絮状聚合物。经比较可看出,制备MIPs过程中加入花椒麻味物质作为模板分子,对其性能产生了非常重要的影响,有利于形成选择性吸附花椒麻味物质分子的空间结构,而制备NIPs时,没有加入模板分子则不能形成这样结构[24]。
2.3 MIPs的吸附动力学曲线
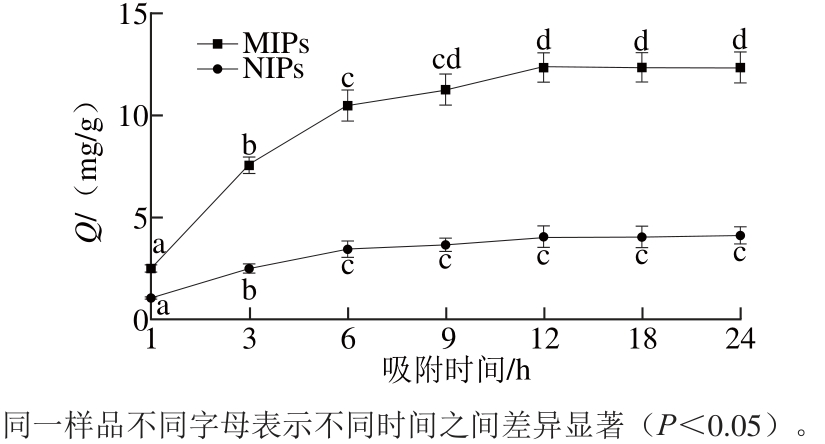
图4 MIPs及NIPs对花椒麻味物质吸附动力学分析
Fig. 4 Adsorption dynamics of MIPs and NIPs for the numb-taste components ofZanthoxylum bungeanum
由图4可知,MIPs对花椒麻味物质的吸附量随着时间的延长而增加,最后达到平衡。吸附过程可分为两个部分,一个是快速吸附过程,一个是缓慢吸附过程。6 h前属于快速吸附过程中,MIPs对花椒麻味物质的吸附速率较大,在随后的吸附过程中,吸附速率放缓。花椒麻味物质与MIPs接触时间约为12 h后就几乎达到平衡。这种现象的原因主要在于MIPs形成空穴时,不仅在聚合物的表面存在结合位点,在其内部也有结合位点的存在[25]。当刚开始吸附时,模板分子与位于聚合物表面的结合位点快速结合,但随着聚合物表面结合位点的饱和,由于空间位阻的原因,模板分子与聚合物内部的结合位点的结合速率就会变小,导致吸附速率在6 h以后增加缓慢,且吸附量变化较小。达到吸附平衡时,MIPs对花椒麻味物质识别因子α达到3.05,与同类型研究相比,该MIPs制备成功,对花椒麻味物质有较高特异性吸附能力。
2.4 MIPs的吸附等温线
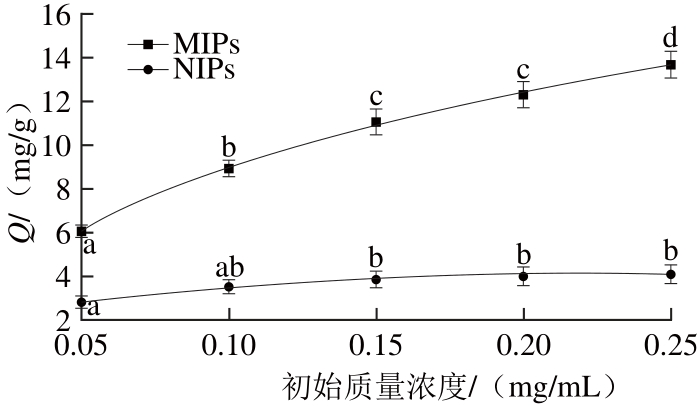
图5 MIPs和NIPs对花椒麻味物质的吸附等温线
Fig. 5 Adsorption isotherms of MIPs and NIPs for the numb-taste components ofZanthoxylum bungeanum
花椒麻味物质质量浓度从0.05 mg/mL变化到0.25 mg/mL,实验测定了花椒麻味物质在MIPs和NIPs的吸附等温线,MIPs的拟合等温吸附方程为y=1.918+97.86x-323.45x2+479.04x3,NIPs的拟合等温吸附方程为y=2.009+18.983x-42.829x2,其中y为吸附量Q,x为花椒麻味物质的初始质量浓度C。该拟合等温吸附方程为研究MIPs对花椒麻味物质的选择识别和吸附能力,并对其进行定量分析构建了理论模型。由图5及拟合等温吸附方程可知,随着花椒麻味物质初始质量浓度的增大,MIPs对花椒麻味物质的吸附量明显增大,而NIPs对花椒麻味物质的吸附容量增加缓慢,且明显低于MIPs的吸附量。这说明MIPs对模板分子花椒麻味物质有较强的特异性结合能力,而NIPs对花椒麻味物质的结合能力很弱。这是因为花椒麻味物质在MIPs中留下的空间结构以及MIPs与花椒麻味物质形成的结合位点决定了聚合物对模板分子的高度亲合力和特异识别性,而NIPs对花椒麻味物质的吸附主要是依靠聚合物表面的分子间作用力。根据图5结果计算,随着花椒麻味物质初始质量浓度的增大,MIPs对花椒麻味物质的吸附量逐渐增大,识别因子α也逐渐增加,花椒麻味物质初始质量浓度为50 μg/mL时α为2.14,250 μg/mL时α达到3.33,这是由于吸附过程与花椒麻味物质在MIPs的表面扩散有关[26],花椒麻味物质初始质量浓度增大时,浓度梯度增大,扩散速率增快,对吸附过程产生促进作用,使MIPs的特异性结合位点得到充分利用。
2.5 MIPs和NIPs的Scatchard模型分析
从图6可以看出,MIPs吸附花椒麻味物质的Scatchard拟合曲线整体上呈非线性关系,说明MIPs对花椒麻味物质的结合位点是非均一的,MIPs的Scatchard拟合曲线可分为两段,两条斜率不同的直线均呈现良好的线性关系。说明在花椒麻味物质初始质量浓度0.05~0.25 mg/mL范围内,MIPs对花椒麻味物质主要形成两种不同的结合位点,一类是较高亲和性的结合位点,另一类是较低亲合性的结合位点[24]。其原因可能是在非共价印迹过程中,印迹分子与功能单体要通过非共价键作用力结合为复合物,复合物的稳定性与非共价结合的作用力大小有关,由于结合过程是可逆的,在聚合过程中溶液的反应条件不均匀,会形成模板分子与功能单体比例不同的复合物,使得非共价结合的作用力大小不均匀[25]。以这两段线性关系为依据分别进行拟合,得到MIPs的Scatchard拟合线性方程Q/C=950.04-85.336Q(R2=0.996 6)和Q/C=440.824-27.896Q(R2=0.999 9),其中Q为MIPs对花椒麻味物质的吸附量、C为吸附平衡时花椒麻味物质的质量浓度。由Scatchard拟合线性方程的斜率和截距求得的MIPs对花椒麻味物质的结合参数为:高亲和力结合位点的解离常数Kd1=1.172×10-2mg/mL、结合位点的最大表观吸附量Qmax1=11.133 mg/g、低亲和力结合位点的解离常数Kd2=3.585×10-2mg/mL、结合位点的最大表观吸附量Qmax2=15.802 mg/g。NIPs的Scatchard曲线是一条线性直线,这是因为NIPs对花椒麻味物质只存在一种非特异性的吸附位点[27]。
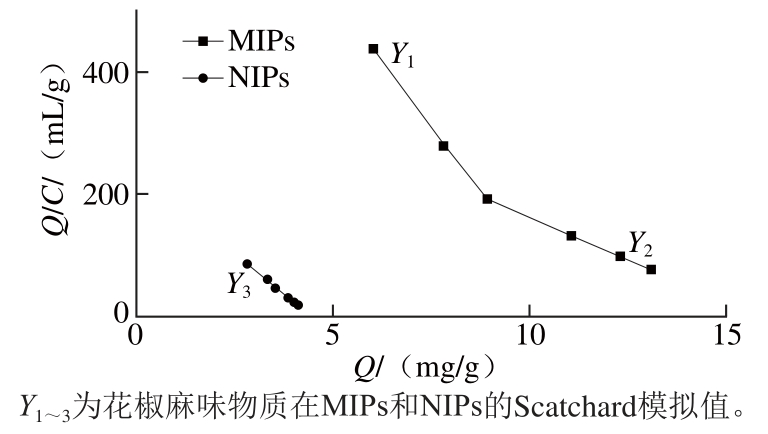
图6 花椒麻味物质在MIPs和NIPs的Scatchard分析图
Fig. 6 Scatchard plot analysis of MIPs and NIPs for the numb-taste components ofZanthoxylum bungeanum
2.6 固相萃取柱分离提取花椒油树脂中的花椒麻味物质
2.6.1 洗脱液用量的确定
用50 mL甲醇溶液进行洗脱,每隔10 mL收集一次洗脱液。由表1可以看出,收集到30 mL以后的洗脱液中已经不存在待测物花椒麻味物质,这说明30 mL甲醇可以将花椒麻味物质从固相萃取柱上全部洗脱下来。故洗脱液甲醇用量确定为40 mL。
表1 洗脱液分批收集实验结果
Table 1 Determination of optimal volume of elution solvent
注:肩标字母不同表示差异显著(P<0.05)。
2.6.2 MIPs固相萃取柱分离得到的花椒麻味物质的鉴定
采用HPLC对花椒麻味物质标准品和MIPs固相萃取柱分离纯化得到的产物进行定性确证,结果见图7。花椒麻味物质标准品的3 个峰的平均保留时间分别是9.599、9.787、10.181 min,MIPs固相萃取柱分离纯化得到的产物的3 个峰的平均保留时间分别是9.595、9.785、10.180 min,经均值差异检验,二者的平均保留时间相比无显著性差异(P>0.05);花椒麻味物质标准品的相对含量约为96.559%,MIPs固相萃取柱分离纯化得到的产物的相对含量约为94.089%;可确证分离纯化出的物质的主要成分是花椒麻味物质[28-30],结果表明通过MIPs固相萃取柱的分离纯化能够获得较高纯度的花椒麻味物质。
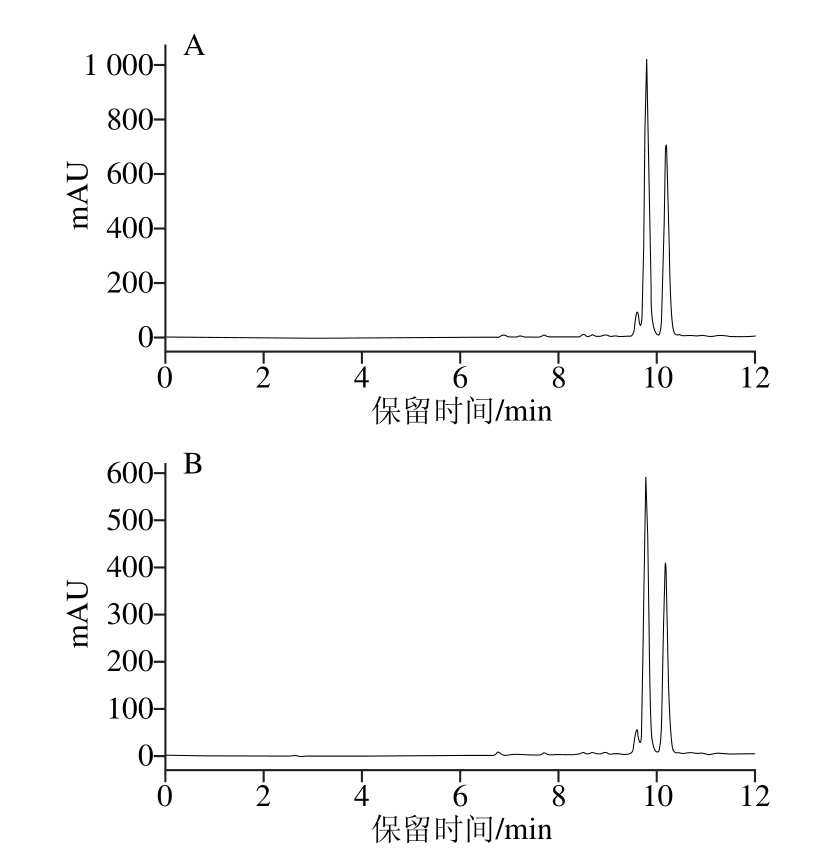
图7 花椒麻味物质标准品(A)和MIPs固相萃取柱分离产物(B)的HPLC图HPLC
Fig. 7 HPLC chromatograms of numb-taste compound standards (A)and eluate from MIP-based SPE column (B)
本实验以花椒麻味物质为模板分子,MAA为功能单体,采用本体聚合方法合成了花椒麻味物质MIPs。该MIPs与花椒麻味物质接触时间约12 h后就达到吸附平衡,对花椒麻味物质识别因子α可达到3.05;在吸附过程中花椒麻味物质与MIPs形成两种结合位点,两种结合位点的解离常数分别为1.172×10-2mg/mL和3.585×10-2mg/mL,对花椒麻味物质最大表观吸附量分别为11.133 mg/g和15.802 mg/g。用该MIPs制成固相萃取柱,对花椒油树脂中花椒麻味物质进行纯化制备。结果表明,该MIPs固相萃取柱对花椒麻味物质表现出优异的特异性吸附效果,可以分离出相对纯度为94.09%的花椒麻味物质。
参考文献:
[1] YANG Xiaogen. Aroma constituents and alkylamides of red and green huajiao (Zanthoxylum bungeanumandZanthoxylumschinifolium)[J].Journal of Agriculture and Food Chemisty, 2008, 56(5): 1689-1696.DOI:10.1021/jf0728101.
[2] KIM J H. Seasonal variations in the content and composition of essential oil fromZanthoxylum piperitum[J]. Journal of Ecology and Field Biology, 2012, 35(3): 195-201.
[3] WANG Ziming, DING Lan, LI Tiechun, et al. Improved solvent-free microwave extraction of essential oil from driedCuminum cyminumL.andZanthoxylum bungeanumMaxim.[J]. Journal of Chromatography A,2006, 1102(1/2): 11-17. DOI:10.1016/j.chroma.2005.10.032.
[4] 游玉明, 周敏, 王倩倩, 等. 花椒麻素的抗氧化活性[J]. 食品科学,2015, 36(13): 27-31. DOI:10.7506/spkx1002-6630-201513006.
[5] TEZUKA Y, IRIKAWA S, KANEKO T, et al. Screening of Chinese herbal drug extracts for inhibitory activity on nitric oxide production and identifi cation of an active compound ofZanthoxylum bungeanum[J]. Journal of Ethnopharmacology, 2001, 77(2/3):209-217. DOI:10.1016/S0378-8741(01)00300-2.
[6] WANG Shi, XIE Jianchun, YANG Wei, et al. Preparative separation and purifi cation of alkylamides fromZanthoxylum bungeanumMaxim.by high-speed counter-current chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2011, 34(20): 2640-2652.DOI:10.1080/10826076.2011.593219.
[7] XIA Lian, YOU Jinmao, LI Guoliang, et al. Compositional and antioxidant activity analysis ofZanthoxylum bungeanumseed oil obtained by supercritical CO2fluid extraction[J]. Journal of the American Oil Chemists Society, 2011, 88(1): 23-32.
[8] WEI Shigang, ZHANG Huihui, WANG Yeqiang. Ultrasonic nebulization extraction-heating gas flow transfer-headspace single drop microextraction of essential oil from pericarp ofZanthoxylum bungeanumMaxim.[J]. Journal of Chromatography A, 2011, 1218(29):4599-4605. DOI:10.1016/j.chroma.2011.05.047.
[9] 周婷, 蒲彪, 姜欢笑. 花椒麻味物质的研究进展[J]. 食品工业科技,2014, 35(10): 385-388.
[10] 王素霞, 赵镭, 史波林, 等. 花椒麻味化学基础的研究进展[J]. 中草药, 2013, 44(23): 3406-3412.
[11] ALLENDER C J, RICHARDSON C, WOODHOUSE B, et al.Pharmaceutical applications for molecularly imprinted polymers[J].International Journal of Pharmaceutics, 2000, 195(1/2): 39-43.DOI:10.1016/S0378-5173(99)00355-5.
[12] 罗凯, 胡江, 黄秀芳, 等. 花椒麻味物质的提取分离及其组分分析[J]. 食品科学, 2013, 34(24): 88-91. DOI:10.7506/spkx1002-6630-201324018.
[13] SUN Jing, PENG Ning, AO Wenxiang, et al. Preparation and binding characteristics of molecularly imprinted polymers for capsaicin[J].Advanced Materials Research, 2012, 430/431/432(4): 582-585.DOI:10.4028/www.scientifi c.net/AMR.430-432.582.
[14] MA Xiuli, JI Wenhua, CHEN Lingxiao, et al. Molecularly imprinted polymers with synthetic dummy templates for the preparation of capsaicin and dihydrocapsaicin from chili peppers[J]. Journal of Separation Science, 2015, 38(1): 100-107. DOI:10.1002/jssc.201400911.
[15] 阚建全, 屠大伟, 刘雄. 花椒麻味物质的检测方法-高效液相色谱法:DB50/T 32125259—2009[S]. 重庆: 重庆市质量技术监督局, 2009.
[16] 宋兴良, 王爱香, 刘晓泓, 等. 虚拟模板分子印迹微球的制备及其对水中微囊藻毒素的吸附性能[J]. 环境化学, 2016, 35(3): 451-459.DOI:10.7524/j.issn.0254?6108.2016.03.2015021301.
[17] 许苗苗, 王素素, 李辉, 等. 沉淀聚合法制备葛根素印迹微球及其固相萃取葛根粉[J]. 食品科学, 2015, 36(10): 11-15. DOI:10.7506/spkx1002-6630-201510003.
[18] 郭明, 殷欣欣, 杨萍, 等. 氨基甲酸乙酯分子印迹聚合物的制备表征及分子识别性能研究[J]. 中国食品学报, 2014, 14(3): 55-63.
[19] BEHBAHANI M, HASSANLOU P G, ZADEH S H, et al. Selective solid-phase extraction and trace monitoring of lead ions in food and water samples using new lead-imprinted polymer nanoparticles[J].Food Analytical Methods, 2015, 8(3): 558-568. DOI:10.1007/s12161-014-9924-5.
[20] YI Lingxiao, FANG Rou, CHEN Guanhua. Molecularly imprinted solid-phase extraction in the analysis of agrochemicals[J]. Journal of Chromatographic Science, 2013, 51(7): 608-618. DOI:10.1093/chromsci/bmt024.
[21] 高文惠, 王姣姣, 贾英民. 分子印迹固相萃取-液相色谱法测定食品中硝基呋喃类药物残留[J]. 中国食品学报, 2014, 14(9): 183-189.
[22] 张高奎, 杨建文, 王宗楠, 等. 洛克沙胂分子印迹聚合物的制备及其固相萃取研究[J]. 分析化学, 2013, 41(9): 1401-1405.
[23] 高文惠, 赵春娟. 烯唑醇分子印迹固相萃取膜的制备及其应用[J].现代食品科技, 2015, 31(11): 163-169; 176.
[24] 王遵臣, 于海宁, 沈生荣, 等. 辣椒素分子印迹聚合物的制备及其在固相萃取中的应用[J]. 食品科学, 2013, 34(12): 45-50. DOI:10.7506/spkx1002-6630-201312010.
[25] 贾竞夫, 于学雷, 孙向军, 等. 采用替代模板硅胶表面接枝制备棒曲霉素分子印迹聚合物及其性能研究[J]. 中国食品学报, 2011, 11(8):145-153.
[26] 任刚, 余燕, 彭素芬, 等. 铁锰氧化物改性沸石对CPZ和CTX的吸附研究[J]. 工业水处理, 2015, 35(9): 21-24.
[27] 孙妍, 王兵. 单一结合位点分子印迹聚合物的合成及性能[J]. 高分子材料科学与工程, 2012, 28(5): 8-11.
[28] 芮光伟, 曹蕊, 蒋珍菊. 花椒麻味物质的分离纯化和高效液相色谱法的测定[J]. 中国调味品, 2013, 38(9): 60-64.
[29] RAO R N, SRAVAN B, REDDY C K, et al. Molecularly imprinted polymer-based, solid-phase extraction followed by liquid chromatographic determination of lacosamide in rat plasma[J].Analytical Methods, 2014, 6(9): 3101-3107. DOI:10.1039/c3ay42186d.
[30] SANAGI M M, SALLEH S, IBRAHIM W A W I, et al. Molecularly imprinted polymer solid-phase extraction for the analysis of organophosphorus pesticides in fruit samples[J]. Journal of Food Composition and Analysis, 2013, 32(2): 155-161. DOI:10.1016/j.jfca.2013.09.001.
Preparation and Binding Characteristics of Molecularly Imprinted Polymers for the Numb-Taste Components of Zanthoxylum bungeanum
LI Yao1, CHEN Xiaolong1, LUO Kai1, KAN Jianquan1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Key Laboratory of Produce Processing and Storage, Laboratory of Quality & Safety Risk Assessment for Agro-Products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
DOI:10.7506/spkx1002-6630-201719007
中图分类号:S188
文献标志码:A
文献编号:1002-6630(2017)19-0035-07
引文格式:
李耀, 陈晓龙, 罗凯, 等. 花椒麻味物质分子印迹聚合物的制备及吸附特性[J]. 食品科学, 2017, 38(19): 35-41.DOI:10.7506/spkx1002-6630-201719007. http://www.spkx.net.cn
LI Yao, CHEN Xiaolong, LUO Kai, et al. Preparation and binding characteris tics of molecularly imprinted polymers for the numb-taste components ofZanthoxylum bungeanum[J]. Food Science, 2017, 38(19): 35-41. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719007. http://www.spkx.net.cn
收稿日期:2016-07-06
基金项目:国家自然科学基金面上项目(31371834);重庆市教委科技攻关项目(CSTC2014JCSF-JCSSX004)
作者简介:李耀(1991—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:18306052956@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学。E-mail:ganjq1965@163.com