李 伟1,2,程 超1,莫开菊1,2
(1.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族学院生物科学与技术学院,湖北 恩施 445000)
摘 要:比较凤头姜水溶和醇溶黄酮对超氧阴离子自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基的清除能力和总抗氧化能力(铁离子还原能力法),同时用VC和2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)作对照。结果表明:在DPPH自由基清除能力测定中,水溶黄酮的抗氧化效果强于醇溶黄酮和BHT,但弱于VC,水溶和醇溶黄酮的半抑制浓度(half maximal inhibitory concentration,IC50)分别为585.75 μg/mL和1 013.45 μg/mL;在ABTS+•、超氧阴离子自由基清除能力和总抗氧化能力测定中,醇溶黄酮的抗氧化效果均强于水溶黄酮、VC和BHT,醇溶和水溶黄酮对ABTS+•的IC50分别为21.90 μg/mL和87.54 μg/mL;在超氧阴离子自由基清除能力测定中,水溶和醇溶黄酮的IC50分别为26.56 μg/mL和22.29 μg/mL;在铁离子还原能力测定中,水溶黄酮和醇溶黄酮的TEAC1000分别为45.78 μg/mL和36.42 μg/mL。综合研究发现,凤头姜水溶黄酮和醇溶黄酮在不同抗氧化体系中的抗氧化效果存在差异。
关键词:凤头姜;水溶黄酮;醇溶黄酮;抗氧化
Abstract:The antioxidant activity, in terms of scavenging capacity against 1,1-diphenyl-2-picrylhydrazyl radical (DPPH),2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) cation radical (ABTS+·) and superoxide anion radical and total antioxidant capacity (TAC, as measured by the ferric-reducing antioxidant power (FRAP) method) of alcohol-soluble and water-soluble fl avonoids from Fengtou ginger rhizomes was determined and compared with that of VC and butylated hydroxytoluene (BHT). The results showed that the DPPH radical scavenging activity of the water-soluble flavonoids was better than that of BHT and the alcohol-soluble flavonoids, but weaker than that of VC, and the half maximal inhibitory concentrations (IC50) of the water-soluble and alcohol-soluble flavonoids were 585.75 and 1 013.45 μg/mL,respectively. In terms of ABTS+· and superoxide anion radical scavenging activity and TAC, the antioxidant effect of the alcohol-soluble fl avonoids was better than that of VC, BHT and the water-soluble fl avonoids. The IC50values of the water-soluble and alcohol-soluble fl avonoids for scavenging ABTS+· were 87.54 and 21.90 μg/mL, respectively, and the IC50values for scavenging superoxide anion radical were 26.56 and 22.29 μg/mL, respectively. In the FRAP assay, the Trolox equivalent antioxidant capacity (TEAC1000) of the water-soluble and alcohol-soluble flavonoids were 45.78 and 36.42 μg/mL, respectively. Overall, the antioxidant capacity of the fl avonoids from Fengtou ginger rhizomes had different antioxidant activities in different model systems.
Key words:Fengtou ginger rhizomes; water-soluble fl avonoids; alcohol-soluble fl avonoids; antioxidation
我国生姜种质资源非常丰富,品种众多,其中凤头姜是湖北省恩施州来凤县经选育成功的地方性优良生姜品种,具有非常好的品质特性[1],如无茎脆嫩、辛辣适中。目前关于凤头姜的开发主要集中在系列产品的研发如糟姜、姜粉、姜汁、糖姜片等[2-4],但随着这些加工产品的研发,增加高附加值产品以提高经济效益成为了企业发展的重中之重[5]。众所周知,生姜具有散寒解表、回阳通脉等功效[6],凤头姜也不例外。现已证明黄酮化合物是具有多种生理功能的活性成分,而前期研究发现生姜黄酮具有很好的抗氧化作用[7],但生姜黄酮的种类有很多,通过不同溶剂浸提出的黄酮类化合物的结构有差异[8],为了配合恩施地方特色资源的开发利用,本研究采用微量法和化学发光法对凤头姜不同种类黄酮的抗氧化效果进行了测定,以期为凤头姜的进一步开发利用提供参考。
1.1 材料与试剂
凤头姜购于恩施市农贸市场。
2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)(化学纯) 中国医药上海化学试剂公司;VC、氢氧化钠、硝酸铝、亚硝酸钠等(均为分析纯)国药集团化学试剂有限公司;无水乙酸钠(分析纯)天津市广成化学试剂有限公司;2,4,6–三吡啶基–1,3,5-三嗪(tripyridyltriazine,TPTZ) 梯希爱(上海)化成工业发展有限公司;鲁米诺 北京拜尔迪生物公司。
1.2 仪器与设备
旋转蒸发器 上海亚荣生化仪器厂;紫外-可见分光光度计 上海精密科学仪器有限公司;离心机 上海安亭科学仪器厂;GloMax®Multi Jr单管型功能检测机 美国Promega公司;infi nite M2000 PRO多功能酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 凤头姜黄酮提取
将新鲜的凤头姜去皮,榨取姜汁,新鲜的姜汁4 ℃条件下静置过夜,3 000 r/min离心15 min,取上清液,在上清液中加乙醇使其终体积分数为60%,浸提6 h后,10 000 r/min离心15 min,取上清液,上清液经旋转蒸发器浓缩,4 ℃条件下静置48 h,10 000 r/min离心15 min,分别收集沉淀部分和上清液部分,冷冻干燥后得到醇溶黄酮和水溶黄酮。
1.3.2 黄酮含量的测定
黄酮含量的测定参照Al(NO3)3-NaNO2-NaOH比色法[9-10]。芦丁标准曲线的制作:配制0.501 5 mg/mL芦丁标准液,取6 支试管编号1~6,依次向1~6号试管中加入芦丁标准溶液(0.0、0.4、0.8、1.2、1.6、2.0 mL)、5% NaNO2(均为0.3 mL)、10% Al(NO3)3(均为0.3 mL)、50%乙醇(5.4、5.0、4.6、4.2、3.8、3.4 mL)、4% NaOH(均为4.0 mL),混匀,于紫外-可见分光光度计510 nm波长处测定吸光度。以芦丁含量为横坐标(x),A510nm为纵坐标(y)绘制标准曲线,可得回归方程y=1.198 5x+0.005 3,R2=0.999 4。
将凤头姜不同黄酮分别配制成2 mg/mL溶液,分别取0.5 mL代替芦丁标准液进行黄酮含量的测定。样品黄酮含量计算如式(1)所示。
1.3.3 凤头姜黄酮的抗氧化能力测定
1.3.3.1 凤头姜黄酮对DPPH自由基清除能力的测定
采用微量法[11],依次在96 孔酶标板上滴加240 μL 6.5×10-5mol/L的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)溶液和10 μL体积分数60%的乙醇,总体积为250 μL,在酶标仪517 nm波长处测定吸光度,记作A0;加入240 μL 6.5×10-5mol/L的DPPH溶液和10 μL的不同质量浓度的水溶黄酮和醇溶黄酮溶液,此吸光度记作Ai;加入240 μL体积分数60%乙醇溶液和10 μL的待测试样溶液,此吸光度记作Aj。按式(2)计算凤头姜黄酮对DPPH自由基清除能力。同时以VC和BHT作对照。
1.3.3.2 凤头姜黄酮对ABTS+•清除能力的测定
采用微量2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)法[12],首先将5 mL 7 mmol/L ABTS溶液和88 μL的140 mmol/L过硫酸钾混合,室温条件下避光静置过夜,得到ABTS储备液。储备液用体积分数60%的乙醇稀释成工作液,工作液在734 nm波长处吸光度为0.70±0.02,记为A0;在酶标板上滴加240 μL的ABTS工作液和10 μL不同质量浓度的水溶黄酮和醇溶黄酮溶液,此吸光度记作Ai;240 μL体积分数60%的乙醇溶液和10 μL的待测试样溶液,此吸光度记作Aj。按照式(3)计算凤头姜黄酮对ABTS+•清除能力。同时以VC和BHT做对照实验。
1.3.3.3 凤头姜黄酮对O2-•清除能力的测定
采用邻苯三酚-鲁米诺化学发光法[13-19],用0.05 mol/L的NaOH溶液配制0.05 mol/L的鲁米诺溶液,避光保存,用前双蒸水稀释成1 mmol/L;用1 mmol/L HCl配成0.01 mol/L邻苯三酚溶液,4 ℃条件下保存,用前双蒸水稀释成6.25×10-4mol/L。0.05 mol/L pH 10.2 Na2CO3-NaHCO3缓冲液(含0.1 mmol/L乙二胺四乙酸)用前现配,实验前与1 mmol/L鲁米诺以2∶1(V/V)混合成鲁米诺和碳酸盐缓冲液混合物。空白组发光管中加50 μL的6.25×10-4mol/L邻苯三酚溶液和50 μL蒸馏水,最后加940 μL鲁米诺和碳酸缓冲液混合物启动反应;本底发光管中加入100 μL蒸馏水,940 μL的鲁米诺和碳酸缓冲液混合物启动反应;样品组发光管中加入50 μL的6.25×10-4mol/L邻苯三酚溶液,50 μL不同质量浓度的水溶黄酮和醇溶黄酮溶液,最后加940 μL的鲁米诺和碳酸缓冲液混合物启动反应。测试设定为1/1 s,进行400 次。同时以VC和BHT做对照实验。按照式(4)计算凤头姜黄酮对超氧阴离子自由基(O2-•)的清除能力。
式中:CL空白、CL本底、CL样品分别为空白组、本底、样品组的化学发光强度(chemiluminescence intensity,CL)。
1.3.3.4 凤头姜黄酮总抗氧化能力的测定
参照微型铁离子还原能力(ferric reducing antioxidant power,FRAP)法[20-23]对凤头姜黄酮的总抗氧化能力进行测定。工作液制备:溶液A为0.3 mol/L的醋酸缓冲液;溶液B为3.123 3 g TPTZ用40 mmol/L盐酸定容至1 000 mL;溶液C为0.02 mol/L的氯化铁溶液。把A、B、C 3 种溶液按照10∶1∶1的体积比进行混合,即可制得工作液。
Trolox标准曲线制作:在96 孔酶标板上滴加240 μL工作液,再分别添加10 μL的200、400、800、1 200、1 600、2 000 μmol/L的Trolox溶液,混匀后,在酶标仪中37 ℃保温10 min后,测定593 nm波长处吸光度,以Trolox溶液浓度为横坐标,吸光度A593nm为纵坐标绘制标准曲线。
样品的FRAP体系测定:在96 孔酶标板上滴加240 μL工作液,再分别添加10 μL不同质量浓度的水溶黄酮和醇溶黄酮试样,测定593 nm波长处的吸光度。把各实验样品的吸光度代入Trolox回归方程中,求出对应的Trolox当量(Trolox equivalent,TE),用Trolox当量抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)来表示总还原能力,联立TEAC值与试样质量浓度建立方程,计算出TEAC1000(TEAC等于1 000 μmol/L时试样质量浓度)。同时以VC和BHT做对照实验。
2.1 凤头姜水溶和醇溶黄酮对DPPH自由基的清除作用
为了更直观地比较出结果,引入半抑制浓度(half maximal inhibitory concentration,IC50),本实验中IC50指自由基清除能力为50%时样液质量浓度。并通过把两种凤头姜试样的抑制率与VC和BHT这两种抗氧化剂的抑制率进行比较,以评价凤头姜黄酮的抗氧化能力的优劣。
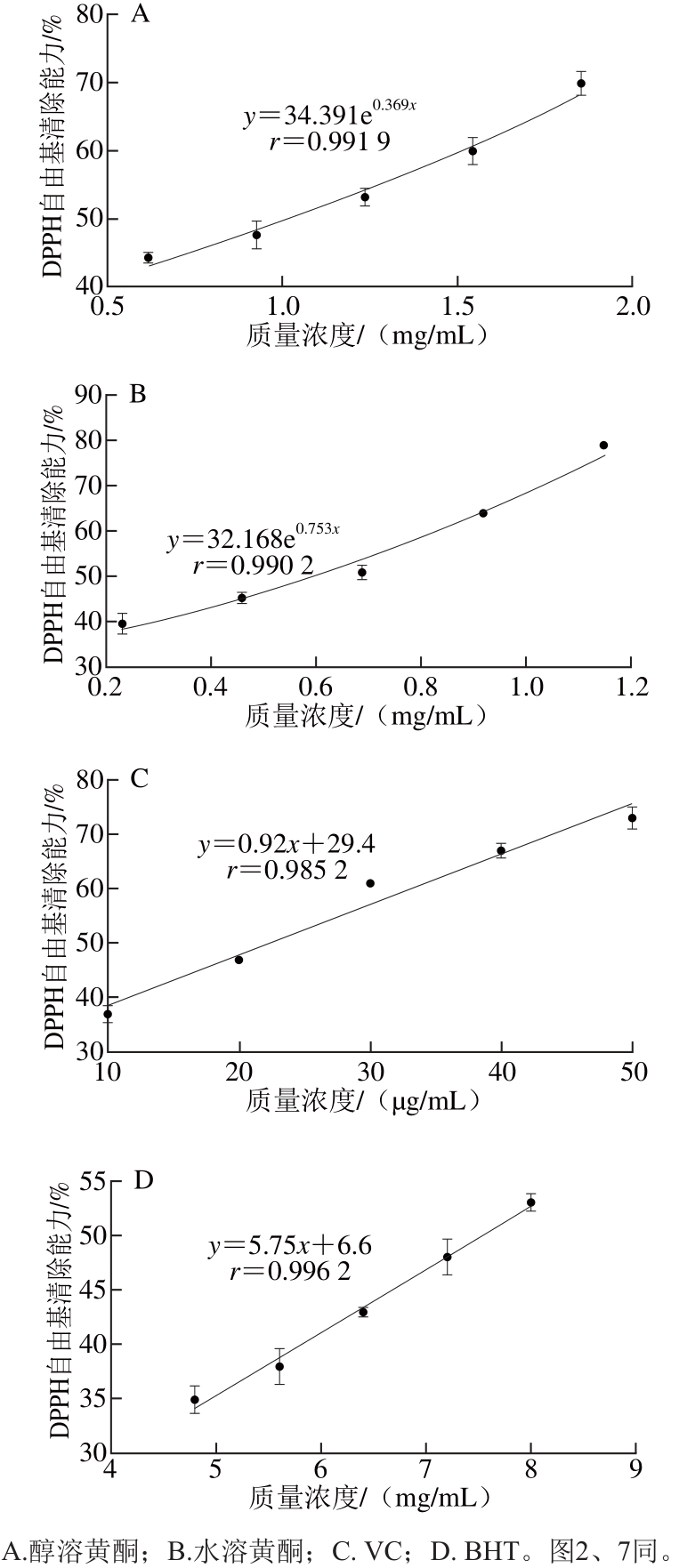
图1 凤头姜不同种类的黄酮对DPPH自由基的清除作用
Fig. 1 DPPH radical scavenging capacity of different fl avonoids from Fengtou ginger rhizomes
根据图1中的回归方程可以计算VC、BHT、水溶黄酮和醇溶黄酮对DPPH自由基的IC50分别为22.39、7 541.83、585.75、1 013.45 μg/mL。由此可见,凤头姜水溶黄酮对DPPH自由基的清除能力强于醇溶黄酮的,但二者均弱于VC强于BHT。
2.2 凤头姜水溶和醇溶黄酮对ABTS+•的清除作用
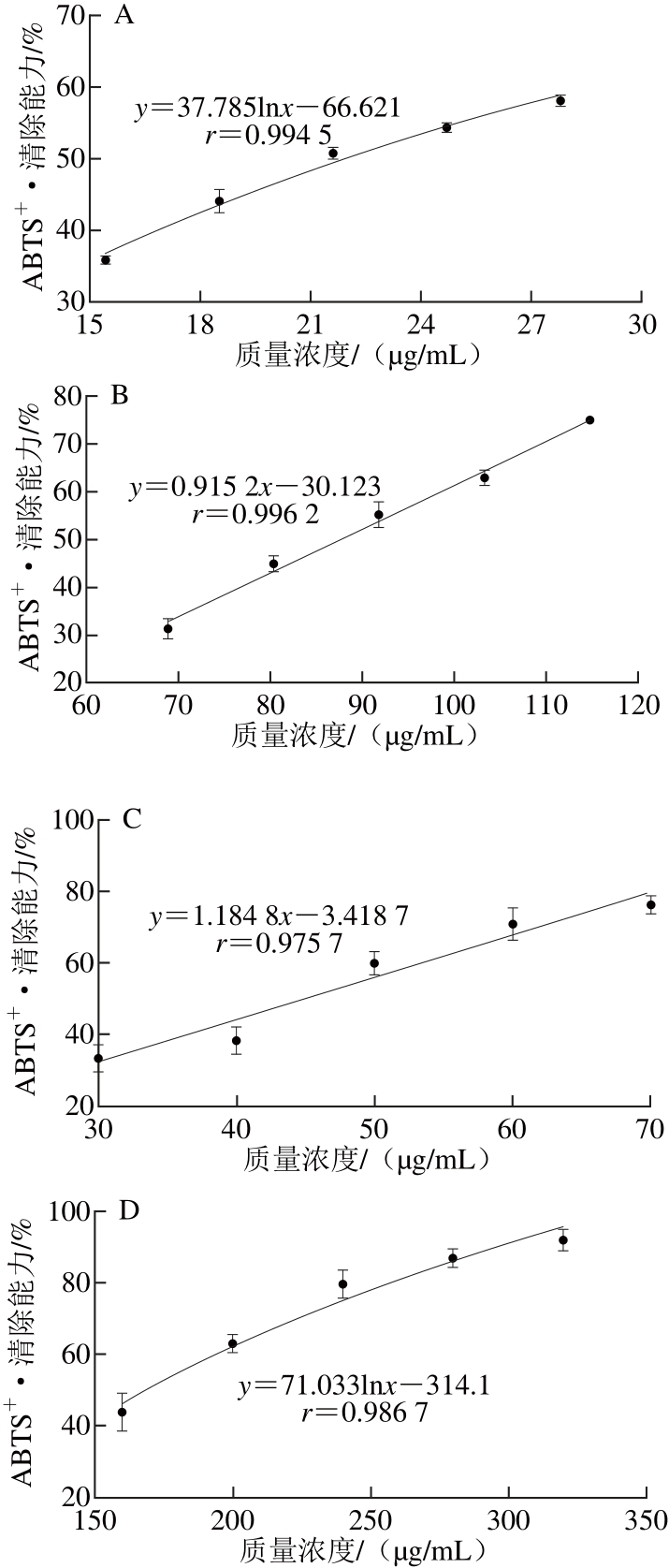
图2 凤头姜不同种类的黄酮对ABBTTSS+•的清除作用
Fig. 2 ABTS+· scavenging capacity of the water-soluble and alcoholsoluble fl avonoids from Fengtou ginger rhizomes
根据图2中的回归方程可以计算VC、BHT、水溶黄酮和醇溶黄酮对ABTS+•的IC50分别为45.09、168.31、87.54、21.90 μg/mL,凤头姜醇溶黄酮对ABTS+•的清除率强于水溶黄酮、VC和BHT,但水溶黄酮的效果介于VC和BHT之间。
2.3 凤头姜水溶和醇溶黄酮对O2-•的清除作用
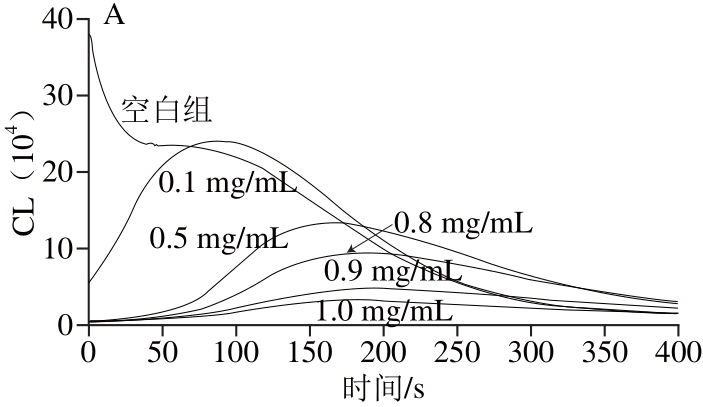

图3 VCC 对 OO-2•的清除作用
Fig. 3 Superoxide anion radical scavenging capacity of VC
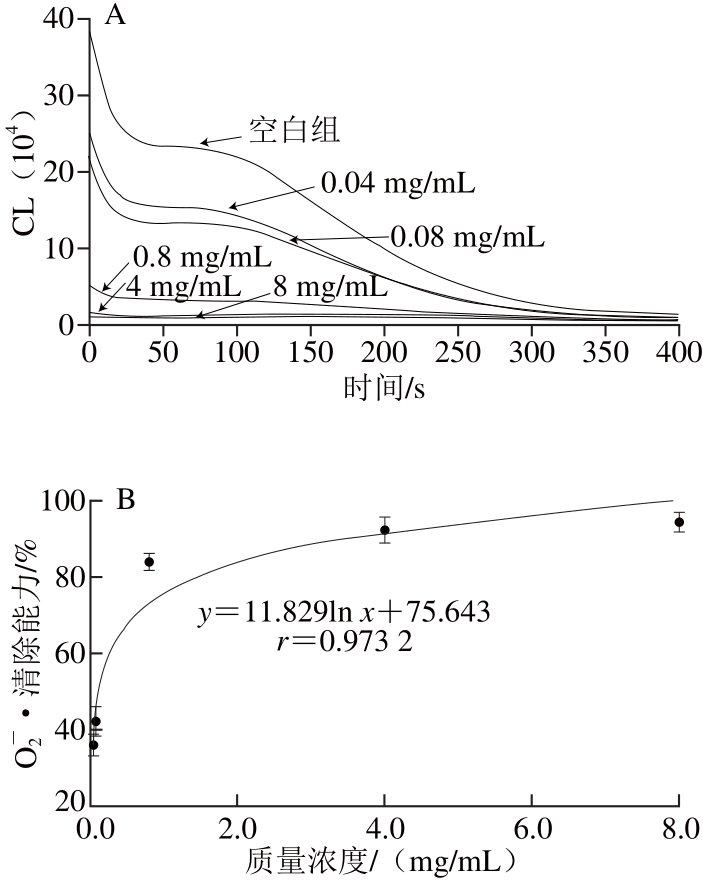
图4 BHTT 对 OO-2•的清除作用
Fig. 4 Superoxide anion radical scavenging capacity of BHT
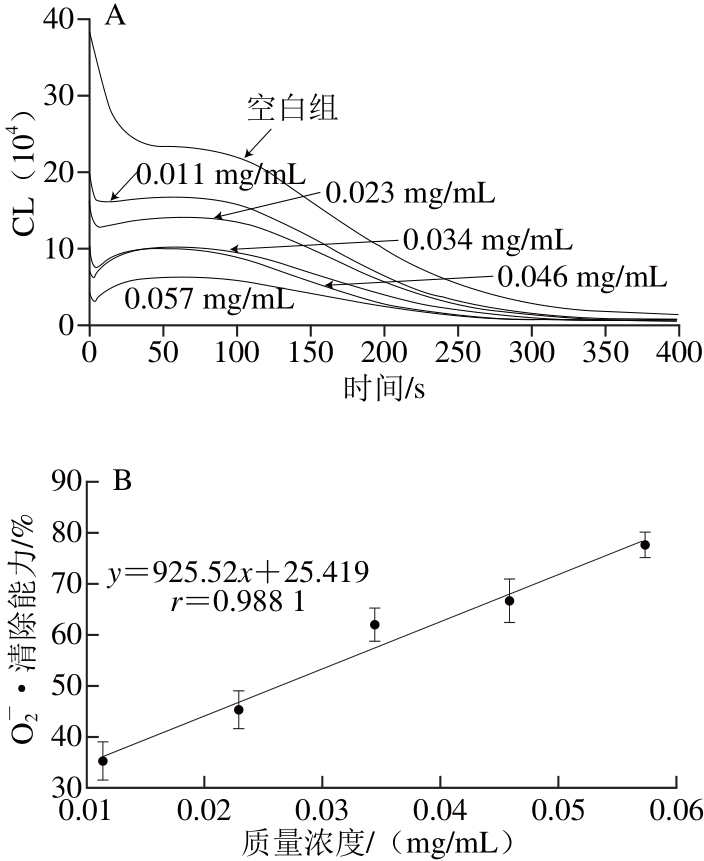
图5 水溶黄酮对OO-2•的清除作用
Fig. 5 Superoxide anion radical scavenging capacity of the water-soluble fl avonoids from Fengtou ginger rhizomes
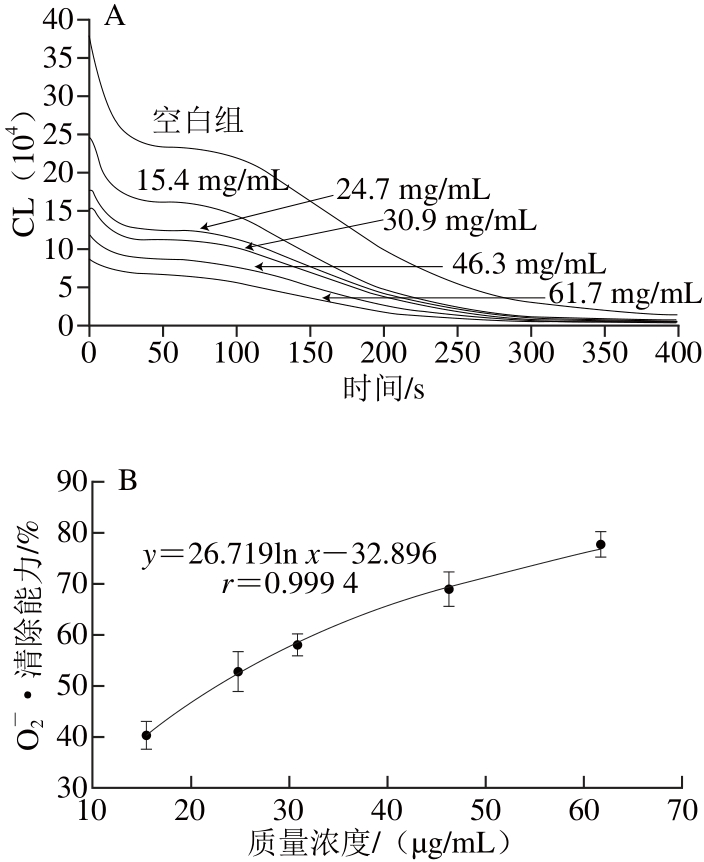
图6 醇溶黄酮对OO-2•的清除作用
Fig. 6 Superoxide anion radical scavenging capacity of the alcoholsoluble fl avonoids from Fengtou ginger rhizomes
根据图3~6中的回归方程可以计算VC、BHT、水溶黄酮和醇溶黄酮对O2-•的IC50分别为601.20 、114.43、26.56、22.29 μg/mL。由此可见,凤头姜醇溶黄酮和水溶黄酮对O2-•的清除效果相当,二者远远强于VC和BHT。
2.4 凤头姜黄酮的总抗氧化能力
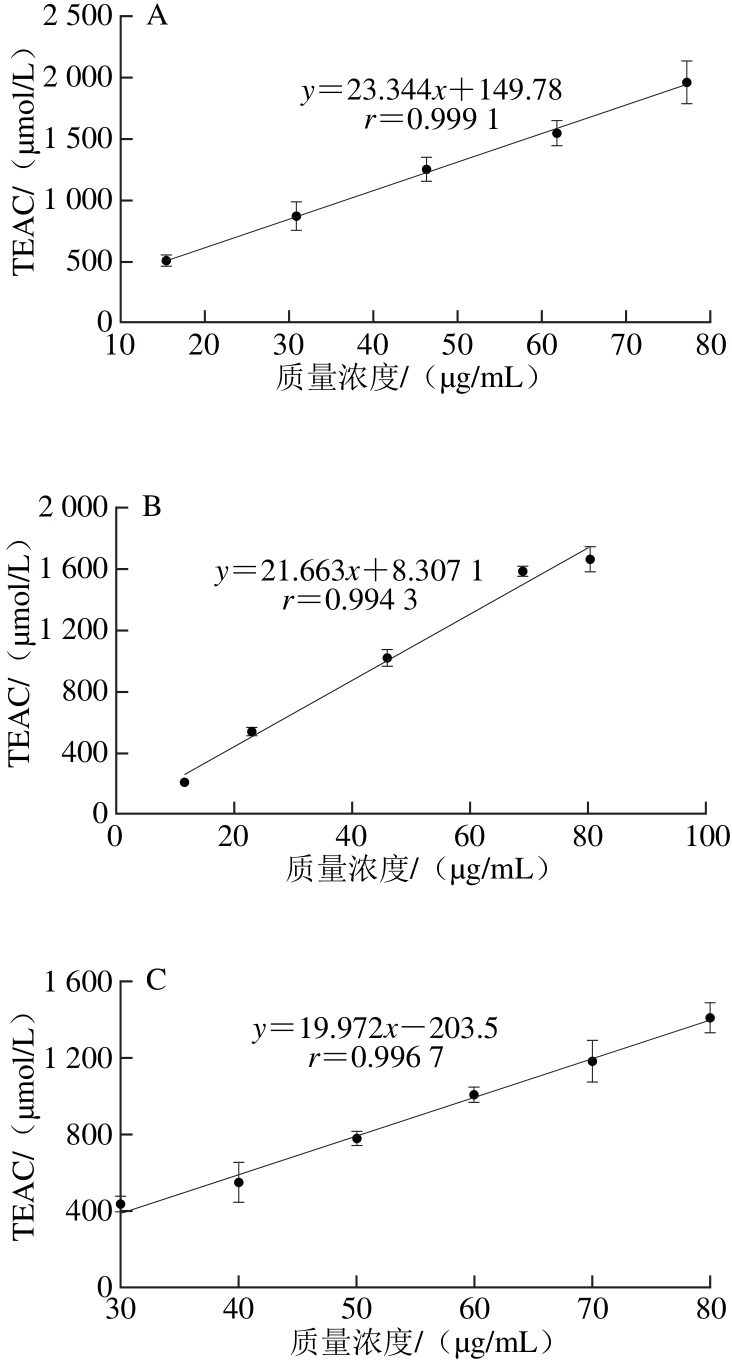
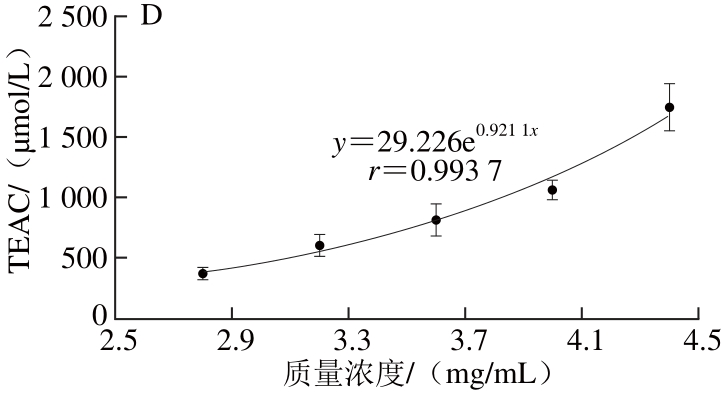
图7 凤头姜不同种类的黄酮的总抗氧化能力
Fig. 7 Total antioxidant activity of the water-soluble and alcohol-soluble fl avonoids from Fengtou ginger rhizomes
根据图7中的回归方程可以计算VC、BHT、水溶黄酮和醇溶黄酮的TEAC1000分别为60.26、3 835.22、45.78、36.42 μg/mL。因此在FRAP体系中,凤头姜水溶黄酮和醇溶黄酮的总抗氧化能力均强于VC和BHT的,但醇溶黄酮的总抗氧化能力强于水溶黄酮的。
2.5 凤头姜不同黄酮抗氧化能力的总体比较
根据凤头姜不同黄酮对不同自由基的IC50和TEAC1000,利用SPSS 16.0软件进行凤头姜黄酮类物质不同自由基清除效果的偏相关分析[24-25],具体结果见表1。
表1 凤头姜不同黄酮对自由基清除能力的偏相关分析
Table 1 Pearson correlation analysis of antioxidant properties of the fl avonoids
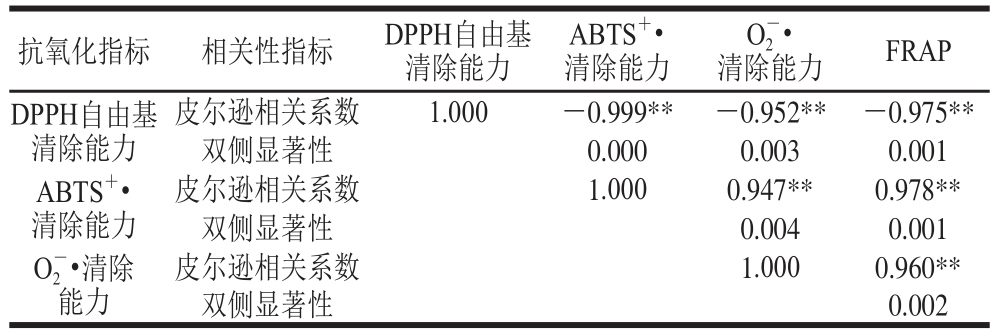
注:**.极显著相关(P<0.01)。
由表1可知,凤头姜黄酮类物质对ABTS+•、O2-•清除能力和总抗氧化能力之间相关性达到了极显著水平,但是三者与DPPH自由基清除能力却是负相关,这说明DPPH和ABTS+•、FRAP体系虽然均是基于电子转移的抗氧化性测定方法[26-27],但是凤头姜水溶和醇溶黄酮对其作用机理不同。当然这与自由基的种类也有一定的相关性,如ABTS+•和O2-•均属于带电荷的自由基,而DPPH自由基却并不带电荷[28],这也说明凤头姜水溶和醇溶黄酮清除荷电和非荷电自由基原理的不同。O2-•作为生物体中存在的自由基,其测定结果与总抗氧化能力及人工合成的ABTS+•的相关性极显著,这说明可以用简单地测定总抗氧化能力和对ABTS+•的清除能力来表示凤头姜的体内抗氧化能力。
凤头姜水溶黄酮和醇溶黄酮种类不同,在不同抗氧化体系中抗氧化能力也不同,普通生姜黄酮对ABTS+•非常敏感[4],而本实验中凤头姜黄酮却对O2-•最为敏感,对DPPH自由基最迟钝。有可能是因为本实验中仅是针对凤头姜水溶和醇溶粗黄酮进行了测定,另外同一种自由基测定体系也不同。但总体而言,凤头姜水溶和醇溶黄酮抗氧化效果非常好,尤其是对本研究中所涉及的O2-•清除能力和FRAP突出,凤头姜水溶和醇溶黄酮的具体种类值得进一步探讨,而水提和醇提黄酮中也有可能存在其他协同成分[29-31],因此凤头姜中其他成分对抗氧化作用的影响如何也有待进一步研究。
参考文献:
[1] 吴金平, 田延富, 郭凤领, 等. 武陵山区凤头姜产业现状及发展对策[J]. 中国园艺文摘, 2015, 31(10): 58-59; 109. DOI:10.3969/j.issn.1672-0873.2015.10.023.
[2] 莫开菊, 汪兴平, 程超. 糖姜片的无硫护色及加工工艺研究[J]. 农业工程学报, 2005, 21(1): 155-158. DOI:10.3321/j.issn:1002-6819.2005.01.035.
[3] 莫开菊, 罗祖友, 汪兴平, 等. 风味糟姜的护色技术研究[J]. 食品科学, 2002, 23(8): 101-105. DOI:10.3321/j.issn:1002-6630.2002.08.024.
[4] 郑凯. 姜汁浸提工艺的研究与姜汁饮料的开发[D]. 泰安: 山东农业大学, 2013: 20-23.
[5] 吴晓慧, 顾龚平, 张卫明, 等. 姜综合利用及深加工技术研究进展[J]. 中国野生植物资源, 2003, 22(3): 5-9. DOI:10.3969/j.issn.1006-9690.2003.03.002.
[6] 刘雪梅. 生姜的药理作用研究进展[J]. 中成药, 2002, 24(7): 539-540.DOI:10.3969/j.issn.1001-1528.2002.07.019.
[7] 莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学,2006, 27(9): 110-115. DOI:10.3321/j.issn:1002-6630.2006.09.022.
[8] 刘邻渭. 食品化学[M]. 北京: 中国农业出版社, 2000: 122.
[9] 李彩霞, 高海宁, 焦扬, 等. “黑美人”土豆黄酮提取及抗氧化活性[J].食品科学, 2013, 34(4): 88-93.
[10] 徐洪宇, 张京芳, 成冰, 等. 26 种酿酒葡萄中抗氧化物质含量测定及品种分类[J]. 中国食品学报, 2016, 16(2): 233-241. DOI:10.16429/j.1009-7848.2016.02.032.
[11] 高月红, 郑建普, 朱春赟, 等. 抗氧化能力检测方法评估及微型化[J]. 中国药学杂志, 2008, 43(24): 1863-1866. DOI:10.3321/j.issn:1001-2494.2008.24.007.
[12] KRIENGSAK T, UNAROJ B , CROSBY K, et al. Comparison of ABTS, DPPH, FRAP and ORAC assay for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19(6/7): 669-675. DOI:10.1016/j.jfca.2006.01.003.
[13] 郭蔼光, 王振镒. 邻苯三酚自氧化-化学发光法测定SOD活性[J]. 植物生理学通讯, 1989(3): 54-57.
[14] 程超, 薛峰, 李伟, 等. 3 种处理方式对葛仙米藻胆蛋白清除超氧阴离子自由基能力的影响[J]. 食品科学, 2014, 35(13): 26-31.DOI:10.7506/spkx1002-6630-201413005.
[15] 吕晓玲, 孙荣荣. 化学发光法测定匙羹藤提取物的抗氧 化能力[J]. 食品科学, 2006, 27(10): 514-516. DOI:10.3321/j.issn:1002-6630.2006.10.130.
[16] 侯冬岩, 回瑞华, 刘晓媛, 等. 荞麦、大麦和燕麦抗氧化性能的比较[J].食品科学, 2004, 25(10): 54-56. DOI:10.3321/j.issn:1002-6630.2004.10.007.
[17] 邓乾春, 陈春艳, 田斌强, 等. 化学发光法研究莲房原花青素的体外抗氧化活性和对DNA损伤的保护作用[J]. 天然产物研究与开发, 2007, 19(4): 563-567; 613. DOI:10.3969/j.issn.1001-6880.2007.04.005.
[18] 韩少华, 朱靖博, 王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造, 2009, 28(6): 155-157. DOI:10.3969/j.iss n.0254-5071.2009.06.050.
[19] 吴秋华, 李正平, 方正. 鲁米诺化学发光体系应用新进展[J]. 化学试剂, 2005, 27(4): 212-216. DOI:10.3969/j.issn.0258-3283.2005.04.006.
[20] SONI B, TRIVEDI U, MADAMWAR D. A novel method of single step hydrophobic interaction chromatography for the purification of phycocyanin fromPhormidium fragileand its characterization for antioxidant property[J]. Bioresource Technology, 2008, 99(1): 188-194.DOI:10.1016/j.biortech.2006.11.010.
[21] ARTS J T J M, DALLINGA S J, VOSS H, et al. A new approach to assess the total antioxidant capacity using the TEAC assays[J]. Food Chemistry,2004, 88(4): 567-570. DOI:10.1016/j.foodchem.2004.02.008.
[22] GLISZCZYṄSKA-ŚWIGIO A. Antioxidant activity of water soluble vitamins in the TEAC (Trolox equivalent antioxidant capacity) and the FRAP (ferric reducing antioxidant power) assays[J]. Food Chemistry,2006, 96(1): 131-136. DOI:10.1016/j.foodchem.2005.02.018.
[23] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma as a measure of antioxidant power: the FRAP method[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[24] 李华, 李佩洪, 王晓宇, 等. 抗氧化检测方法的相关性研究[J]. 食品与生物技术学报, 2008, 27(4): 6-11. DOI:10.3321/j.issn:1673-1689.2008.04.002.
[25] 赖国毅. SPSS 17中文版统计分析典型实例精粹[M]. 北京: 电子工业出版 社, 2010: 184.
[26] 杨继涛. 柿(Disospyros kakiL.)果实抗氧化能力的分析[D]. 杨凌: 西北农林科技大学, 2009: 10-12.
[27] 程超, 朱玉婷, 田瑞, 等. 喷雾冷冻干燥对葛仙米藻胆蛋白抗氧化特性的影响[J]. 食品科学, 2012, 33(13): 36-39.
[28] 刘志东, 郭本恒, 王荫榆. 抗氧化活性检测方法的研究进展[J]. 天然产物研究与开发, 2008(3): 563-567. DOI:10.3969/j.issn.1001-6880.2008.03.045.
[29] ALI B H, BLUNDEN G, TANIRA M O, et al. Some phytochemical,pharmacological and toxicological properties of ginger (Zingiber offi cinaleRoscoe): a review of recent research[J]. Food and Chemical Toxicology, 2007, 46(2): 409-420. DOI:10.1016/j.fct.2007.09.085.
[30] LI Y X, HONG Y, HAN Y Q, et al. Chemical characterization and antioxidant activities comparison in fresh, dried, stir-frying and carbonized ginger[J]. Journal of Chromatography B, 2016, 1011: 223-232.DOI:10.1016/j.jc hromb.2016.01.009.
[31] SHIRIN A P R, PRAKASH A. Chemical composition and antioxidant properties of ginger root (Zingiber offi cinale)[J]. Journal of Medicinal Plant Research, 2011, 4(24): 2674-2679. DOI:10.5897/JMPR09.464.
Antioxidant Activity of Water-Soluble and Alcohol-Soluble Flavonoids from Fengtou Ginger Rhizomes
LI Wei1,2, CHENG Chao1, MO Kaiju1,2
(1. Key Laboratory of Biological Resources Protection and Utilization of Hubei Province, Hubei University for Nationalities,Enshi 445000, China; 2. College of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China)
DOI:10.7506/spkx1002-6630-201719022
中图分类号:TS255.36
文献标志码:A
文章编号:1002-6630(2017)19-0137-06
引文格式:
李伟, 程超, 莫开菊. 凤头姜醇溶和水溶黄酮的抗氧化作用[J]. 食品科学, 2017, 38(19): 137-142. DOI:10.7506/spkx1002-6630-201719022. http://www.spkx.net.cn
LI Wei, CHENG Chao, MO Kaiju. Antioxidant activity of water-soluble and alcohol-soluble flavonoids from Fengtou ginger rhizomes[J]. Food Science, 2017, 38(19): 137-142. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719022. http://www.spkx.net.cn
收稿日期:2016-07-14
基金项目:湖北省自然科学基金项目(2014CFB611);湖北省教育厅产学研合作项目(C2010052)
作者简介:李伟(1975—),男,副教授,硕士,研究方向为生物资源的开发与利用。E-mail:754727485@qq.com