郭雅靖1,颜梦婷1,林圣楠1,杨雪娜1,付才力1,*,黄德建2,*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.新加坡国立大学理学院化学系食品科学与工程项目组,新加坡 新加坡 117542)
摘 要:以4 种不同来源的原花青素为研究对象,利用高通量淀粉浊度法测定其对α-淀粉酶和α-葡萄糖苷酶活力的抑制效果,研究其与常见食物原料之间的相互作用,为进一步开发降血糖主食提供理论依据。结果表明:葡萄籽与高粱麸皮原花青素对α-淀粉酶和α-葡萄糖苷酶活力抑制效果相对较好,蔓越莓与苹果原花青素对α-淀粉酶和α-葡萄糖苷酶活力抑制效果相对较差;食物中的主要成分与原花青素结合后会影响其对酶活力的抑制效果,常见食物中糯米、散装大米、高粱米等与葡萄籽原花青素结合明显,降低其对碳水化合物消化酶活力抑制效果,但玉米淀粉、木薯粉、马铃薯粉、生粉、米粉、小西米、小黄米、玉米片、红薯粉、黑米及黑豆与葡萄籽原花青素之间几乎不结合,是适宜发挥原花青素对碳水化合物消化酶活力抑制作用的食品原料。
关键词:原花青素;α-淀粉酶;α-葡萄糖苷酶;谷物;结合
Binding Interaction of Selected Proanthocyanidins Possessing Hypoglycemic Activity with Common Food Raw Materials
GUO Yajing1, YAN Mengting1, LIN Shengnan1, YANG Xuena1, FU Caili1,*, HUANG Dejian2,*
(1. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China; 2. Food Science & Technology Programme, Department of Chemistry, Faculty of Science, National University of Singapore, Singapore 117542, Singapore)
Abstract:Inhibitory activities of four proanthocyanidins from different botanical sources againstα-amylase andα-glucosidase were studied by using high-throughput starch turbidity method (HtST). Then the interaction between proanthocyanidins and common cereal fl ours and starches were researched for the purpose of providing a theoretical basis for further development of hypoglycemic staple foods. The results showed that proanthocyanidins from grape seeds and sorghum possessed higher inhibitory activities againstα-amylase andα-glucosidase than those from cranberry and apple. Binding of proanthocyanidins to the main food components affected the inhibitory activity of proanthocyanidins. The results indicated that glutinous rice, bulk rice, sorghum could bind grape seed proanthocyanidins and reduce the inhibitory activity of proanthocyanidins againstα-amylase andα-glucosidase. However, corn starch, tapioca starch, potato flour, commercial edible starch, rice flour, sago, millet, corn flake, sweet potato flour, black rice, and black bean almost had no binding interaction with grape seed proanthocyanidins, and thus they were ideal food materials to maintain or enhance the inhibitory activity of proanthocyanidins against carbohydrate digestive enzymes.
Key words:proanthocyanidins;α-amylase;α-glucosidase; cereals; binding interaction
原花青素是由黄烷醇聚合而成的重要生物黄酮,其复杂的结构、多样的生物功能,尤其是抗氧化、降血脂、预防心血管疾病、抗肿瘤、抗糖尿病等,受到学术界和食品工业的持续关注[1-5]。近年来,越来越多的科研工作者将目光聚焦到原花青素辅助治疗糖尿病方面的研究。原花青素不仅能够抑制人体内糖基化晚期终产物的形成[6],还能有效抑制碳水化合物消化过程中起关键作用的水解酶的活性,如α-淀粉酶、α-葡萄糖苷酶,能够减缓食物的水解进程,避免餐后体内血糖急剧升高,从而实现糖尿病预防和辅助治疗的作用。研究表明,葡萄籽、肉桂提取物能有效抑制α-淀粉酶和α-葡萄糖苷酶活性,其中葡萄籽提取物对α-淀粉酶活性的抑制效果相当于等量阿卡波糖抑制效果的4 倍[7-8]。蔓越莓原花青素、高粱麸皮提取的黄酮类物质及原花青素对α-淀粉酶活性具有良好的抑制效果[9-10]。前期研究表明,龙眼皮原花青素能显著抑制α-淀粉酶活性,其抑制类型为非竞争型可逆抑制[11]。
如果天然功能因子要发挥其对碳水化合物消化酶活性的抑制作用,首先必需考虑的是该组分能否与食物原料发生明显的结合,并产生拮抗作用。只有选择合适的食品原料,才能保证原花青素在人体胃肠道环境内能充分发挥其生物活性作用[12]。食物的主要成分不同,与原花青素结合后所产生的影响也可能有所差异。常见主食中碳水化合物的主要成分为淀粉,包括直链淀粉和支链淀粉,这两种淀粉微观结构不同,在形态、性质以及化学反应活性上也具有明显的差异,导致与原花青素结合的程度也不相同[13]。淀粉与原花青素结合力越强,能抑制碳水化合物消化酶的有效原花青素量就越少,对酶活性的抑制能力就越弱。研究常见食品原料与原花青素的结合情况,并以此来选择用于制备低血糖生成指数的主食,能针对性开发出适合糖尿病患者的膳食。据我们所知,目前谷物原料与原花青素的结合情况及对其生物效价的影响鲜有报道。
本研究利用高通量淀粉浊度法测定不同来源的原花青素对α-淀粉酶和α-葡萄糖苷酶的活力抑制效果,研究其抑制动力学,比较葡萄籽、高粱麸皮、蔓越莓、苹果4 种原花青素对碳水化合物消化酶活力抑制效果差异;并进一步利用具有较高酶活抑制能力的葡萄籽原花青素,测定其与常见食品原料的结合情况,并探究对葡萄籽原花青素的酶活力抑制能力的影响,为进一步选取合适谷物作为开发低血糖生成指数食品的原料,辅助糖尿病治疗提供理论依据。
1.1 材料与试剂
葡萄籽原花青素、蔓越莓原花青素、苹果原花青素、高粱麸皮原花青素(商业有效原花青素) 新加坡国立大学苏州研究院;各类谷物均购于当地永辉超市。
麦芽糖、葡萄糖、阿卡波糖、α-淀粉酶、α-葡萄糖苷酶(分析纯) 上海阿拉丁生化科技股份有限公司;葡萄糖测试剂 美国Sigma公司。磷酸钠、甲醇、硫酸等试剂均为分析纯。
1.2 仪器与设备
HWS24电热恒温水浴锅 上海一恒科技有限公司;THZ-82恒温振荡器 常州国华电器有限公司;PT2-003酶标仪 北京普天新桥技术有限公司;UB-7 pH计美国Denver Instrument公司;CF16RXII高速冷冻离心机日本Hitachi公司。
1.3 方法
1.3.1 原花青素抑制酶 活力效果的测定
1.3.1.1 样品的配制
制备2%的玉米淀粉溶液,加热搅拌后冷却至室温。
用0.1 mol/L pH 6.9的磷酸盐缓冲液(phosphate buffered saline,PBS)配制1 mg/mL的阿卡波糖储备液,根据实验需求稀释至一定的质量浓度。
原花青素溶解于甲醇后,再用PBS稀释至合适质量浓度,制成不同质量浓度的原花青素溶液。1.3.1.2 原花青素抑制α-淀粉酶效果测定
对α-淀粉酶活力的抑制测定参考Liu Tingting等[7]的方法并略作修改。用去离子水配制α-淀粉酶溶液(3 U/mL)。取不同质量浓度的原花青素溶液、α-淀粉酶溶液加入96 孔板中,于37 ℃保温15 min。然后加入玉米淀粉溶液进行酶解反应,随着反应进行,α-淀粉酶水解玉米淀粉,并引起玉米淀粉溶液的浊度发生变化。以阿卡波糖溶液为对照,于660 nm波长处测定120 min内溶液浊度的变化,每2 min测定一次,并根据浊度的变化情况测定不同原花青素对α-淀粉酶活力的抑制效果。每组质量浓度进行3 次平行。
1.3.1.3α-葡萄糖苷酶活力的测定
参考文献[14]的方法,将1 g鼠源葡萄糖苷酶溶解于40 mL PBS中,冰浴静置后离心。取稀释后的悬清液150 μL与同体积的PBS于37 ℃条件下混匀5 min,并加入适量的20 mg/mL的麦芽糖溶液再次混匀。每2 min取80 μL反应溶液放入沸水浴中终止反应,并将失活的反应液与葡萄糖测试剂混匀,于37 ℃条件下静置30 min。然后,加入80 μL 6 mol/L硫酸混匀,于540 nm波长处测定OD值。
测定α-葡萄糖苷酶活力标准曲线所用的质量浓度为5~25 μg/mL。酶活力单位定义为1 min内从原料释放1.0 μmol/L葡萄糖时的溶液质量浓度[15]。根据所得标准曲线y=0.014 2x-0.009 9(R2=0.998),计算出本实验所制备的α-葡萄糖苷酶活力为3.08 U。
1.3.1.4 原花青素抑制α-葡萄糖苷酶活力的测定
按1.3.1.2节反应体系,保持底物的质量浓度、操作条件不变,改变酶的类型,利用α-葡萄糖苷酶进行酶解反应,测定原花青素对α-葡萄糖苷酶活力的抑制效果,每组质量浓度进行3 个平行。
1.3.1.5 计算原花青素对α-淀粉酶、α-葡萄糖苷酶活力的抑制率
按照下式计算原花青素的抑制率。
式中:AUC空白为空白组曲线积分面积(area under the curve,AUC)/min-1;AUC样品为加入原花青素溶液的样品组的曲线积分面积/min-1。
半数抑菌浓度(half maximal inhibitory concentration,IC50)为抑制率为50%时的样品溶液质量浓度/(mg/mL)。
1.3.2 UV-VIS扫描测定谷物及原花青素的结合作用
紫外-可见吸收光谱(ultraviolet visible spectroscopy,UV-VIS)测定方法参考文献[16-17]。将不同种类的谷物,用高速粉碎机粉碎后,分别称取400 mg溶于100 mL PBS(0.1 mol/L,pH 6.9)中,配制成4 mg/mL的谷物粉溶液。
将0.2 mg/mL的葡萄籽原花青素溶液与谷物粉溶液混合(作为实验组),于37 ℃水浴保温15 min后,4 000×g离心力下离心5 min,取上清液于200~400 nm波长处测定其吸收光谱。为探究谷物与原花青素混合后是否结合而破坏其生理活性,以原花青素溶液与PBS混合为空白组,以PBS和谷物粉溶液混合为对照组。
2.1 不同来源原花青素对α-淀粉酶活力的抑制作用
研究表明,部分原花青素对α-淀粉酶具有很强的抑制效果[18-19],而阿卡波糖能有效抑制α-淀粉酶和α-葡萄糖苷酶力,通常作为参考标准[20-21]。不同来源的原花青素其抑制能力不同,反应后淀粉的浊度变化也不同,为使淀粉浊度呈现最佳的梯度变化,需要确定不同原花青素的最佳测定质量浓度。经多次实验后,确定不同原花青素的质量浓度:0.1、0.2、0.3、0.4、0.5、0.6 mg/mL葡萄籽原花青素;0.1、0.2、0.4、0.6、0.8、1.0 mg/mL高粱麸皮原花青素;0.1、0.2、0.4、0.6、0.8、1.0 mg/mL蔓越莓原花青素;0.5、1.0、2.0、3.0、4.0、5.0 mg/mL苹果原花青素。利用高通量淀粉浊度法测定原花青素对α-淀粉酶的活力抑制效果,在2 h的反应过程中,根据OD值的变化可得出淀粉浊度变化的动力学曲线(图1)及阿卡波糖和不同来源原花青素对α-淀粉酶活力的抑制效果(图2)。
在高通量淀粉浊度分析中,淀粉浊度下降速率越快,则α-淀粉酶活力越高,原花青素抑制活性越低,相反,淀粉浊度下降速率越慢,则α-淀粉酶活力越低,原花青素抑制活性越高[7,17]。通过计算、分析曲线下积分面积,可知原花青素质量浓度与抑制活性之间具有良好的量效关系,质量浓度越高,抑制活性越好。由图1A可知,随着阿卡波糖质量浓度的增加,玉米淀粉溶液浊度的变化速率逐渐递减。当阿卡波糖质量浓度为0.35 mg/mL时,玉米淀粉溶液被α-淀粉酶缓慢水解,120 min时才被水解完全,此时阿卡波糖的抑制效果最好。当葡萄籽原花青素质量浓度为0.1 mg/mL时,在前40 min内,玉米淀粉溶液的浊度迅速下降,说明α-淀粉酶活力高,40 min内能完全水解淀粉溶液,此时葡萄籽原花青素的抑制效果较差,当提高葡萄籽原花青素的质量浓度为0.2 mg/mL时,淀粉溶液浊度下降速率变缓,表现出良好的抑制性能(图1B)。不同于葡萄籽原花青素良好的抑制效果,高粱麸皮原花青素(图1C)在低质量浓度下(小于0.6 mg/mL),其抑制效果较差,玉米淀粉的浊度下降较快,直到质量浓度提高到0.6 mg/mL,抑制效果才有所改善。对于蔓越莓原花青素(图1D),其质量浓度的提高对其抑制活性的改善效果并不佳,在质量浓度为1.0 mg/mL时,玉米淀粉溶液的浊度依然迅速下降。苹果原花青素(图1E)的抑制效果最差,当质量浓度高达3 mg/mL时,其抑制效果才有所改善,抑制α-淀粉酶活力的能力显著低于葡萄籽原花青素和高粱麸皮原花青素。
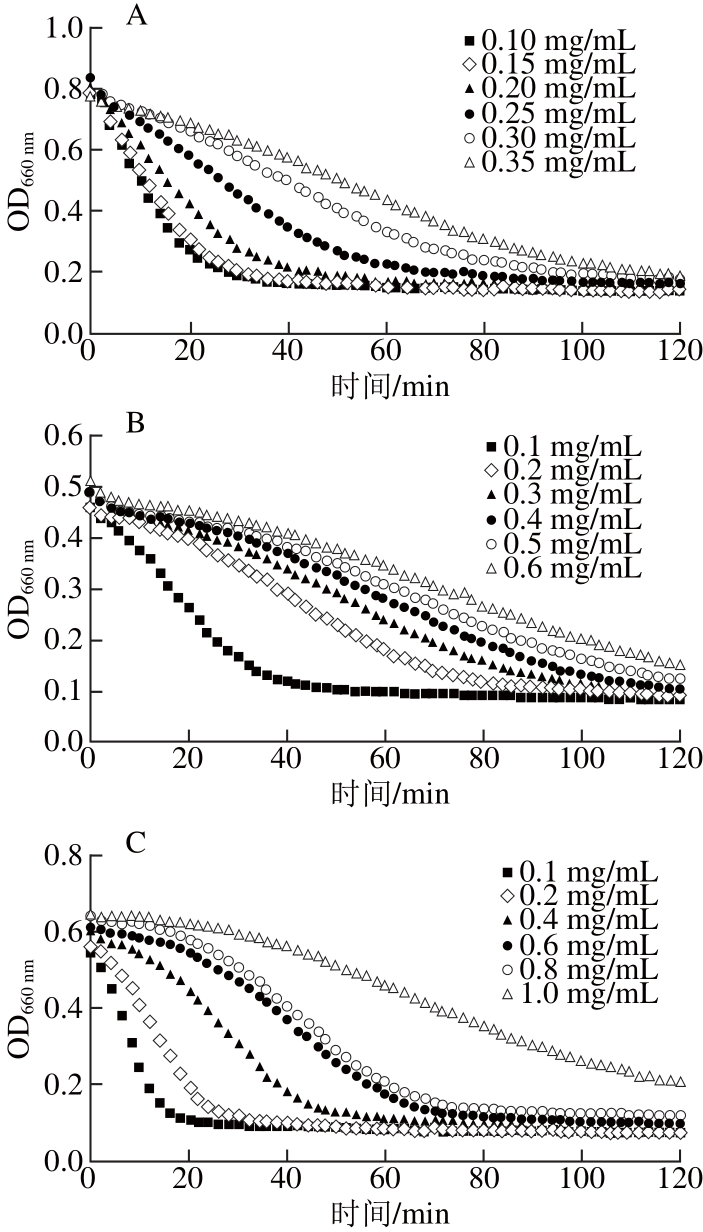
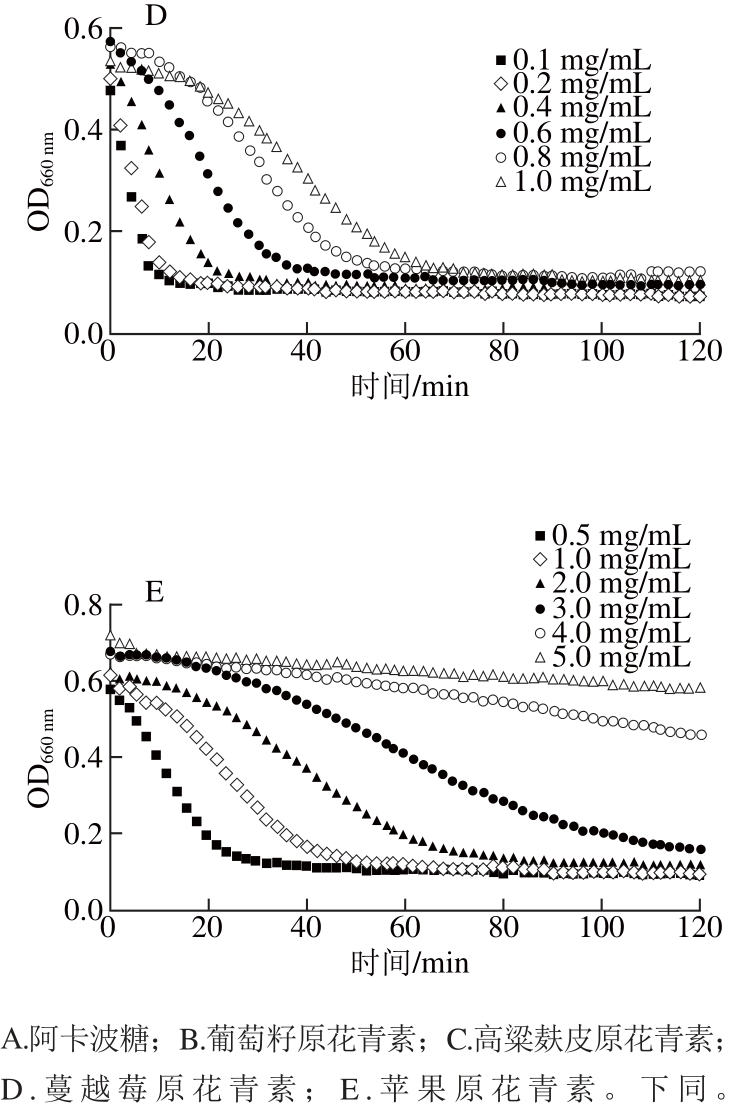
图1 阿卡波糖及不同来源的原花青素对α-淀粉酶活力的抑制动力学曲线
Fig. 1 Kinetic curves of starch hydrolysis byα-amylase in the presence of acorbose or different proanthocyanidins
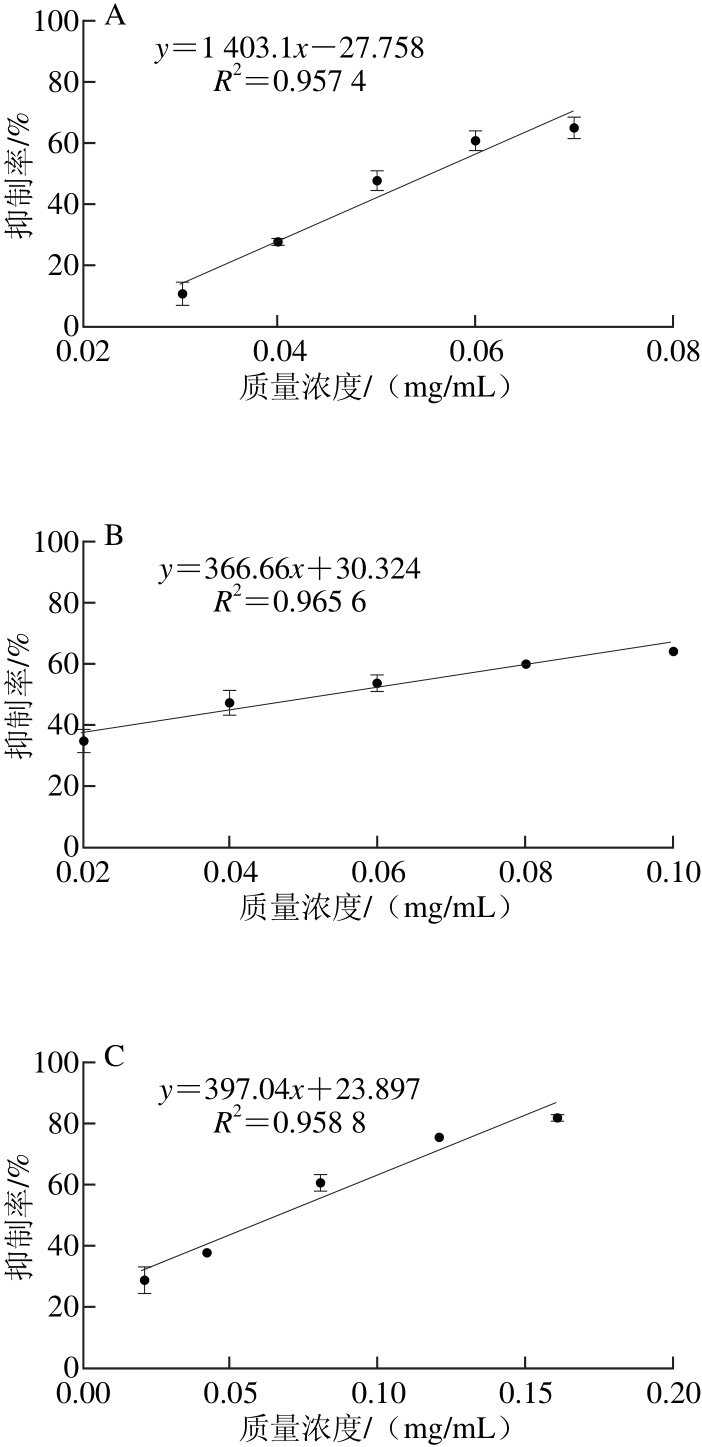
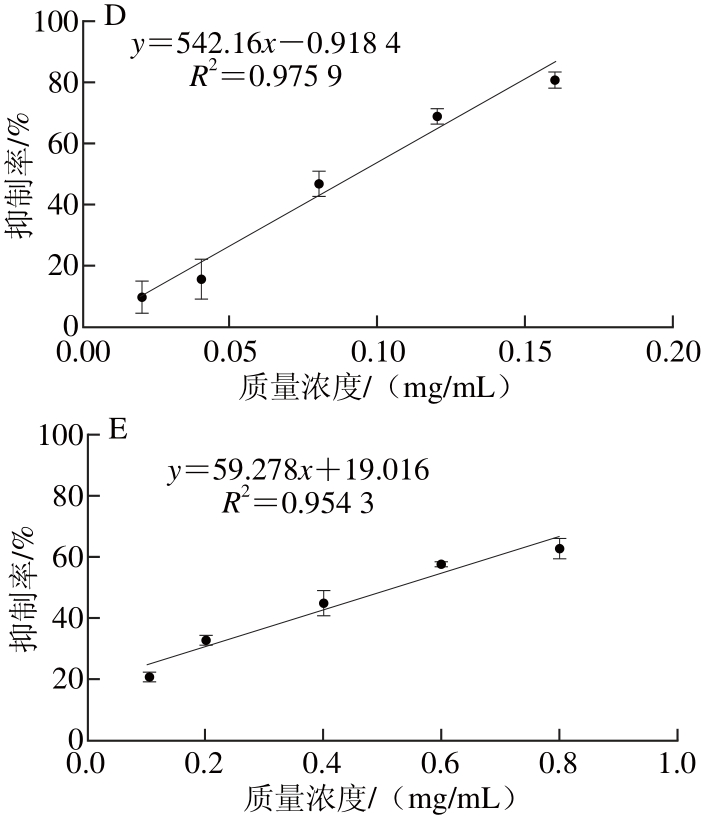
图2 阿卡波糖及不同来源的原花青素对α-淀粉酶活力的抑制作用
Fig. 2 Inhibitory effect of acorbose and different proanthocyanidins onα-amylase activity
图2 表明阿卡波糖和不同来源原花青素的质量浓度与抑制效果之间的关系,可见两者之间存在良好的量效关系,原花青素抑制剂质量浓度越大,对α-淀粉酶的抑制效果越好,淀粉浊度变化就越缓慢。原花青素因来源不同,生物效价和作用机理往往因其独特的结构特征出现差异,如龙眼皮原花青素对α-淀粉酶活力的抑制是典型的非竞争性和可逆性[11],但生物效价略低于人心果原花青素[19]。
2.2 不同来源原花青素对α-葡萄糖苷酶活力的抑制作用
经多次实验后,确定不同原花青素的质量浓度:0.1、0.2、0.3、0.4、0.5、0.6 mg/mL葡萄籽原花青素;0.1、0.2、0.3、0.4、0.5、0.6mg/mL高粱麸皮原花青素;0.1、0.2、0.4、0.6、0.8、1.0 mg/mL蔓越莓原花青素;0.5、1.0、2.0、3.0、4.0、5.0 mg/mL苹果原花青素。
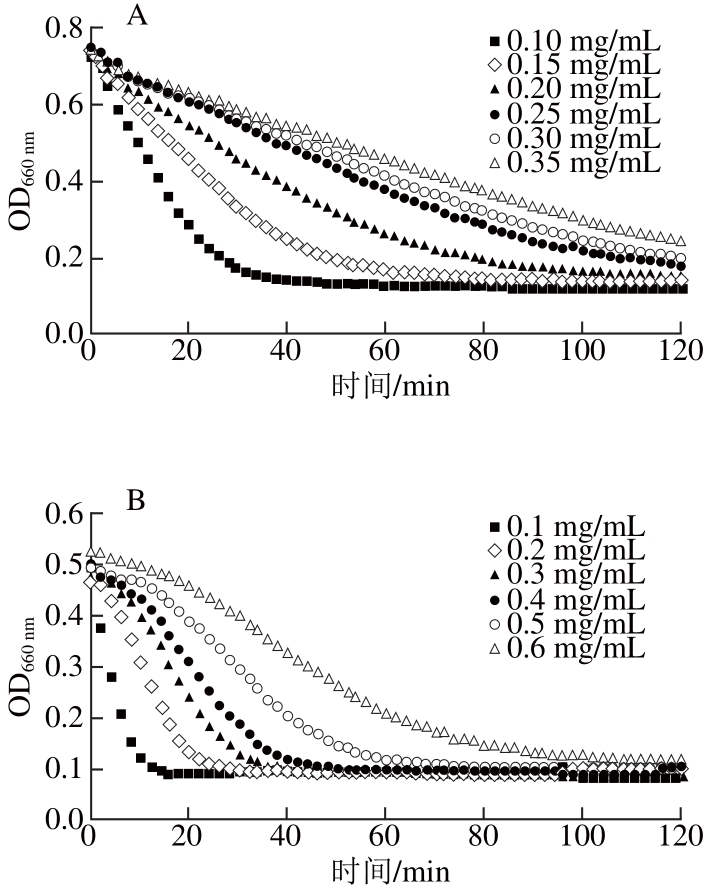
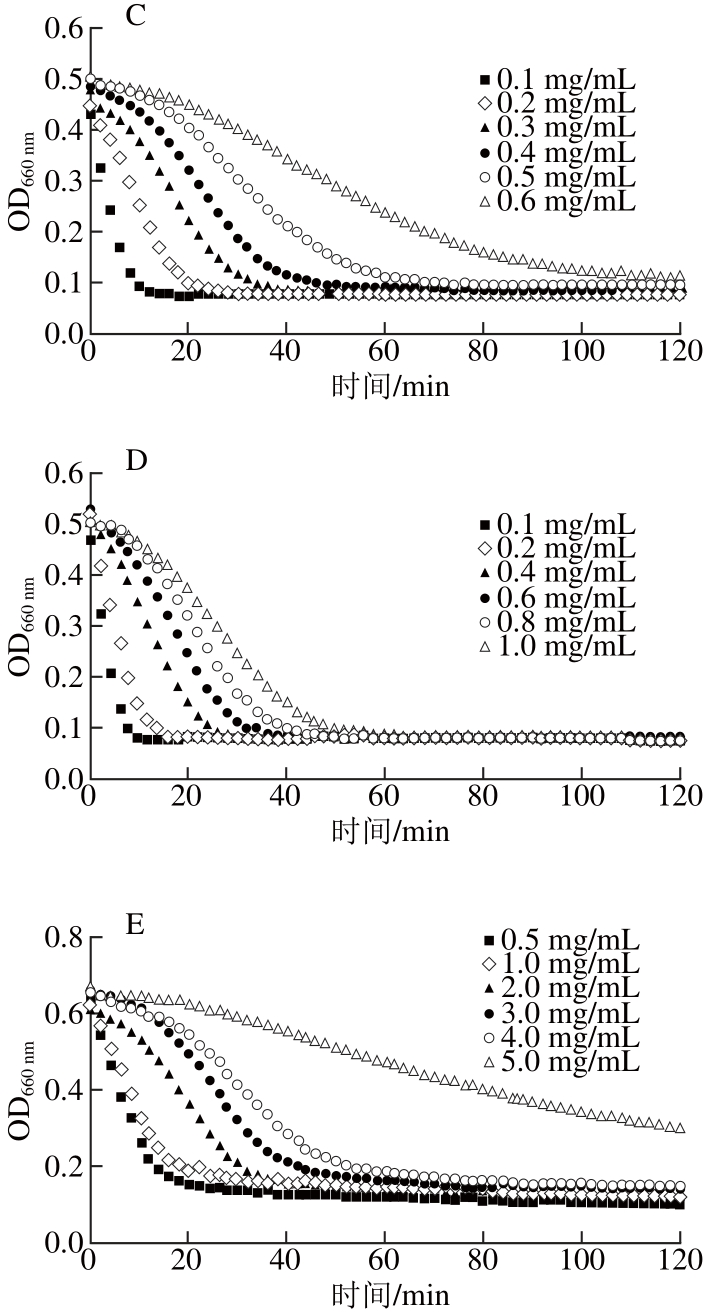
图3 阿卡波糖及不同来源的原花青素对α-葡萄糖苷酶活力的抑制动力学曲线
Fig. 3 Kinetic curves of starch hydrolysis byα-glucosidase in the presence of acorbose or different proanthocyanidins
由图3A可知,低质量浓度阿卡波糖(0.1 mg/mL)抑制α-葡萄糖苷酶活力的效果并不佳,玉米淀粉溶液的浊度在20 min内迅速下降;但当阿卡波糖质量浓度提高到0.2 mg/mL时,淀粉溶液浊度下降缓慢,具有良好的抑制效果。而由图3B可以看出,具有α-淀粉酶良好抑制效果的葡萄籽原花青素在质量浓度达0.6 mg/mL时,才表现出能抑制α-葡萄糖苷酶活力的能力,说明其对α-葡萄糖苷酶活力的抑制能力弱于对α-淀粉酶的抑制。有效抑制α-葡萄糖苷酶活力的高粱麸皮原花青素(图3C)的质量浓度(小于0.6 mg/mL)要低于抑制α-淀粉酶活力的质量浓度(小于1 mg/mL),说明高粱麸皮原花青素对α-葡萄糖苷酶抑制效果要优于α-淀粉酶。但对于蔓越莓原花青素(图3D),其对α-葡萄糖苷酶活力的抑制能力要低于葡萄籽原花青素和高粱麸皮原花青素,当质量浓度为1.0 mg/mL时,玉米淀粉溶液仍在50 min内被水解完全,此时抑制效果不佳。从图3E中可以看出,苹果原花青素在质量浓度为5 mg/mL时,玉米淀粉浊度才出现缓慢下降,而对于α-淀粉酶,苹果原花青素质量浓度仅为3 mg/mL时,就已出现良好的抑制效果,说明苹果原花青素对α-淀粉酶的抑制能力要优于对α-葡萄糖苷酶活力的抑制。

图4 阿卡波糖及不同来源原花青素对α-葡萄糖苷酶活力的抑制效果
Fig. 4 Inhibitory effect of acorbose and different proanthocyanidins onα-glucosidase activity
由图4可知,阿卡波糖和不同来源原花青素的质量浓度与抑制效果之间存在良好的量效关系,质量浓度越大,对α-葡萄糖苷酶活力的抑制效果越好,淀粉浊度变化就越缓慢。
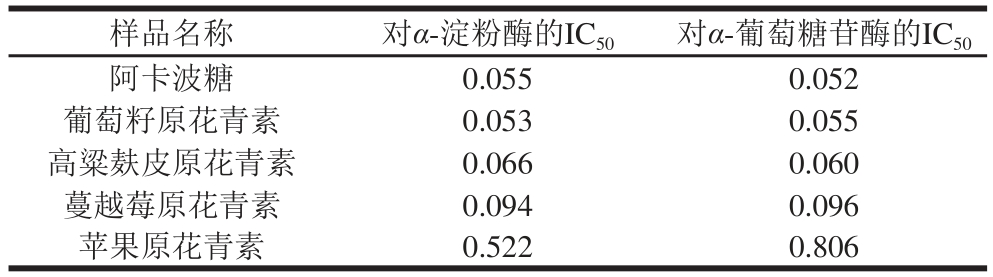
根据以上的测定及分析,得出不同来源的原花青素对α-淀粉酶、α-葡萄糖苷酶的IC50值,具体结果如表1所示。由IC50值可知几种原花青素对α-淀粉酶及α-葡萄糖苷酶活力的抑制能力由高到低依次均为:葡萄籽原花青素、高粱麸皮原花青素、蔓越莓原花青素、苹果原花青素。葡萄籽原花青素对碳水化合物消化酶活力的抑制也被别的研究组深入调查并推荐作为膳食补充剂[7]。总体来看,葡萄籽与高粱麸皮原花青素对α-淀粉酶、α-葡萄糖苷酶的抑制活性相对较强,蔓越莓与苹果原花青素的抑制活性相对较弱,因此后续实验选择葡萄籽原花青素作为筛选合适食品原料的底物。
表1 阿卡波糖及不同来源原花青素对α--淀 粉酶及α-葡萄糖苷酶的IC50
Table 1 IC50of acorbose and proanthocyanidins from different plants against α-amylase and α-glycosidase mg/mL
原花青素的生物活性与其来源及结构特点密切相关[22]。葡萄籽原花青素主要为B型表儿茶素和儿茶素多聚体、表没食子儿茶素和没食子儿茶素多聚体,高粱麸皮原花青素为纯粹的B型表儿茶素和儿茶素多聚体,蔓越莓原花青素则同时兼有A型和B型连接,而苹果原花青素主要为B型表儿茶素和儿茶素低聚体[23-24],这些原花青素在聚合度、单体组成及连接类型方面存在差异,导致它们呈现不同的特性及不同的对α-淀粉酶、α-葡萄糖苷酶活力抑制效果,这与Liu Tingting[7]及Fu Caili[11]等的研究结果一致。
2.3 不同食物原料与葡萄籽原花青素的结合情况
食物原料不同,其淀粉含量不同,淀粉中含有直链淀粉和支链淀粉,从而使其具有独特的微观结构和形态,因此很有可能在与原花青素混合中产生不同程度的交互作用。原花青素与谷物结合后,会减少能抑制酶活力的原花青素含量,进而降低对α-淀粉酶、α-葡萄糖苷酶的酶活力抑制效果。本实验采用了UV-VIS测定法[25-26],通过测定葡萄籽原花青素与不同谷物粉混合后,溶液中的原花青素含量来推断出二者是否产生作用,与原花青素结合较弱的谷物可以作为低血糖生成指数食品的原料[27]。首先选取最常见的大宗食品原料包括玉米淀粉、小麦粉、大米粉和糯米粉,考察其与葡萄籽原花青素的结合情况,其吸收光谱图如5所示。
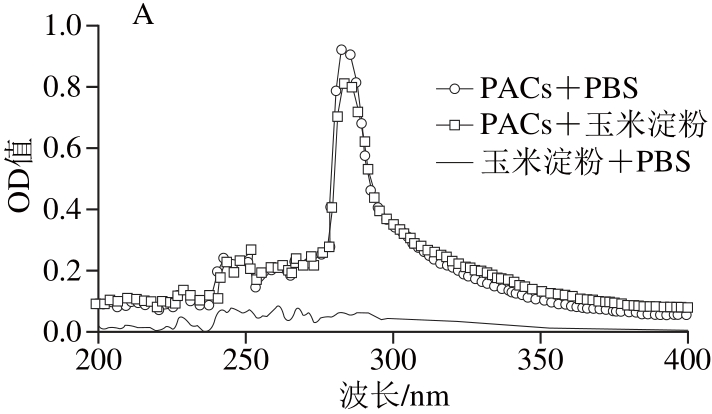
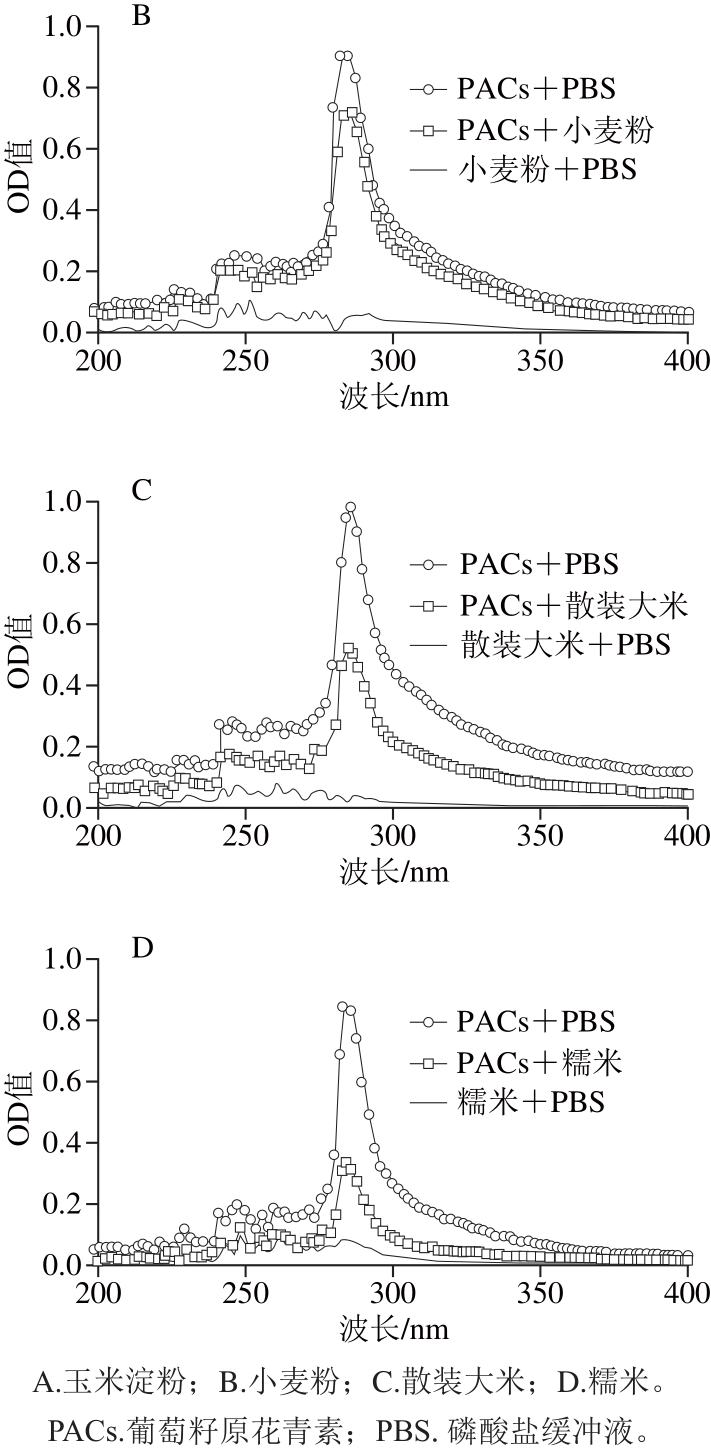
图5 葡萄籽原花青素溶液与谷物粉溶液混合前后吸收光谱
Fig. 5 Absorption spectra of grape seed proanthocyanidins before and after incubation with different cereal fl ours and starches
Liu Tingting等[7]研究发现,如果原花青素与谷物原料出现结合,则形成共聚物沉淀,从而减少溶液中原花青素的含量,并降低原花青素对碳水化合物消化酶活力的抑制效果。在图5A中,葡萄籽原花青素与PBS混合液以及葡萄籽原花青素与玉米淀粉混合液两条曲线几乎重合,说明混合液中葡萄籽原花青素含量没有发生显著变化,葡萄籽原花青素与玉米淀粉结合较弱,不影响其抑制活性;图5B中葡萄籽原花青素与小麦粉的混合液在270~300 nm波长区间的OD值略低于葡萄籽原花青素与PBS混合液;在图5C、D中,葡萄籽原花青素与散装大米及糯米粉的混合液在270~300 nm波长区间的OD值明显低于葡萄籽原花青素与PBS混合液,则说明葡萄籽原花青素与散装大米及糯米粉混合之后,溶液中的葡萄籽原花青素含量降低,即葡萄籽原花青素与两者能够发生结合,从而导致能抑制酶活力的葡萄籽原花青素含量减少,在此情况下,葡萄籽原花青素的抑制效果大大降低。根据以上4 种图谱,可将葡萄籽原花青素与谷物粉的结合情况分为结合(ΔOD值>0.4)、轻微结合(0.1<ΔOD值≤0.4)以及几乎不结合(ΔOD值≤0.1)3 种情况(其中,ΔOD值是指在270~300 nm波长区间空白组ODmax与实验组ODmax之差)。为保证原花青素能够在最小添加量下发挥最佳的抑制效果,应选择与原花青素结合程度最弱的谷物为低血糖生成指数食品的原料[28]。
经过将葡萄籽原花青素与血糯米、红米、高粱米、黑米等26 种谷物粉混合,测定其吸收光谱。根据吸收光谱图谱按结合类型分类,现将具体谷物与葡萄籽原花青素的结合情况总结于表2中。Liu Tingting等[7]的研究表明,直链淀粉和支链淀粉对原花青素的结合能力存在明显差异,支链淀粉对原花青素具有较强的亲和力。从表2也可以看出,常见主食糯米、散装大米、高粱米等虽然是良好的膳食原料,但当加入葡萄籽原花青素时,因与其结合明显,不能显著抑制碳水化合物酶的活力,可能与其含有的支链淀粉量有关[29-30],因此对于糖尿病患者来讲,不适合作为开发低血糖生成指数食品的原料。但玉米淀粉、木薯粉、马铃薯粉等与葡萄籽原花青素之间几乎不结合,是适宜发挥葡萄籽原花青素碳水化合物消化酶抑制活性的食品原料。
表2 葡萄籽原花青素与谷物粉结合情况
Table 2 Binding capacity of grape seed proanthocyanidins to different cereal fl ours and starches

通过高通量淀粉浊度法,研究4 种不同来源原花青素对α-淀粉酶和α-葡萄糖苷酶的活力抑制效果,根据相应的IC50,可知对α-淀粉酶活力的抑制能力由高到低依次为:葡萄籽原花青素(0.053 mg/mL)>高粱麸皮原花青素(0.066 mg/mL)>蔓越莓原花青素(0.094 mg/mL)>苹果原花青素(0.522 mg/mL);对α-葡萄糖苷酶活力的抑制能力由高到低依次为:葡萄籽原花青素(0.055 mg/mL)>高粱麸皮原花青素(0.060 mg/mL)>蔓越莓原花青素(0.096 mg/mL)>苹果原花青素(0.806 mg/mL)。
利用UV-VIS测定法研究葡萄籽原花青素与26 种谷物结合的能力,可知玉米淀粉、木薯粉、马铃薯粉、生粉、米粉、小西米、小黄米、玉米片、红薯粉、黑米及黑豆11 种谷物粉与原花青素几乎不结合,可选取为开发低血糖生成指数食品的原料,用于糖尿病的辅助治疗。
参考文献:
[1] CHEN M H, MCCLUNG A M, BERGMAN C J. Concentrations of oligomers and polymers of proanthocyanidins in red and purple rice bran and their relationships to total phenolics, flavonoids, antioxidant capacity and whole grain color[J]. Food Chemistry, 2016, 208: 279-287.DOI:10.1016/j.foodchem.2016.04.004.
[2] KATIYAR S K. Dietary proanthocyanidins inhibit UV radiationinduced skin tumor development through functional activation of the immune system[J]. Molecular Nutrition and Food Research, 2016,60(6): 1374-1382. DOI:10.1002/mnfr.201501026.
[3] MARTIN-FERNÁNDEZ B, DE LAS HERAS N, VALEROMUÑOZ M, et al. Beneficial effects of proanthocyanidins in the cardiac alterations induced by aldosterone in rat heart through mineralocorticoid receptor blockade[J]. PLoS ONE, 2013, 9(9):e111104. DOI:10.1371/journal.pone.0111104.
[4] 高璐, 王滢, 饶胜其, 等. 葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J]. 食品科学, 2014, 35(23): 253-256. DOI:10.7506/spkx1002-6630-201423049.
[5] 杨滢滢, 王雪青, 庞广昌, 等. 原花青素抗肿瘤作用机制研究进展[J]. 食品科学, 2008, 29(10): 694-697. DOI:10.3321/j.issn:1002-6630.2008.10.165.
[6] GONALEZ-ABUIN N, PINENT M, CASANOVA-MARTI A, et al.Procyanidins and their healthy protective effects against type 2 diabetes[J]. Current Medicinal Chemistry, 2015, 22(1): 39-50. DOI:10.2174/0929867321666140916115519.
[7] LIU Tingting, SONG Lixia, WANG Hongyu, et al. A high-throughput assay for quantification of starch hydrolase inhibition based on turbidity measurement[J]. Journal of Agricultural and Food Chemistry,2011, 59(18): 9756-9762. DOI:10.1021/jf202939d.
[8] EI-AIFY A T, AHMED A A, FATANI A J. Protective effect of red grape seeds proanthocyanidins against induction of diabetes by alloxan in rats[J]. Pharmacological Research, 2005, 52(3): 264-270.DOI:10.1016/j.phrs.2005.04.003.
[9] APOSTOLIDIS E, KWON Y I, SHETTY K. Potential of cranberrybased herbal synergies for diabetes and hypertension management[J].Asia Pacifi c Journal of Clinical Nutrition, 2006, 15(3): 433-441.
[10] 刘睿, 潘思轶, 刘亮, 等. 高粱原花青素对α-淀粉酶活力抑制动力学的研究[J]. 食品科学, 2005, 26(9): 189-192.
[11] FU Caili, YANG Xuena, LAI Shaojuan, et al. Structure,antioxidant andα-amylase inhibitory activities of longan pericarp proanthocyanidins[J]. Journal of Functional Foods, 2015, 14: 23-32.DOI:10.1016/j.jff.2015.01.041.
[12] SUI X, ZHANG Y, ZHOU W. Bread fortifi ed with anthocyanin-rich extract from black rice as nutraceutical sources: its quality attributes andin vitrodigestibility[J]. Food Chemistry, 2016, 196: 910-916.DOI:10.1016/j.foodchem.2015.09.113.
[13] LIAN X, ZHAO S, LIU Q, et al. A photographic approach to the possible mechanism of retrogradation of sweet potato starch[J]. International Journal of Biological Macromolecules, 2011, 48(1): 125-128.DOI:10.1016/j.ijbiomac.2010.10.008.
[14] HE N, WANG Z, YANG C, et al. Isolation and identification of polyphenolic compounds in longan pericarp[J]. Separation and Purification Technology, 2009, 70(2): 219-224. DOI:10.1016/j.seppur.2009.09.019.
[15] LEE M H, KIM Y W, KIM T J, et al. A novel amylolytic enzyme from Thermotoga maritima, resembling cyclodextrinase andα-glucosidase,that liberates glucose from the reducing end of the substrates[J].Biochemical and Biophysical Research Communications, 2002,295(4): 818-825. DOI:10.1016/S0006-291X(02)00748-9.
[16] PERKAMPUS H H. UV-VIS spectroscopy and its applications[M].Berlin Heidelberg: Springer-Verlag Berlin Heidelberg, 1992: 165-214.DOI:10.1007/978-3-642-77477-5.
[17] WANG H Y. Isolation, characterization and detection of bioactive components from botanical materials[D]. Singapore: National University of Singapore, 2013: 64-73.
[18] LEE Y A, CHO E J, TANAKA T, et al. Inhibitory activities of proanthocyanidins from persimmon against oxidative stress and digestive enzymes related to diabetes[J]. Journal of Nutritional Science and Vitaminology, 2007, 53(3): 287-292. DOI:10.3177/jnsv.53.287.
[19] WANG H, LIU T, SONG L, et al. Profi les andα-amylase inhibition activity of proanthocyanidins in unripeManilkara zapota(chiku)[J].Journal of Agricultural and Food Chemistry, 2012, 60(12): 3098-3104.DOI:10.1021/jf204715q.
[20] KRENTZ A J. New oral agents for type 2 diabetes[J]. Clinical Medicine, 2007, 7(2): 117-118. DOI:10.7861/clinmedicine.7-2-117.
[21] KAZAZ M A, DESSEAUX V, MARCHIS-MOUREN G, et al.The mechanism of porcine pancreaticα-amylase. inhibition of maltopentaose hydrolysis by acarbose, maltose and maltotriose[J].European Journal of Biochemistry, 1998, 252(1): 100-107.DOI:10.1046/j.1432-1327.1998.2520100.x.
[22] GU L, KELM M A, HAMMERSTONE J F, et al. Concentrations of proanthocyanidins in common foods and estimations of normal consumption[J]. Journal of Nutrition, 2004, 134(3): 613-617.
[23] GU L, KELM M A, HAMMERSTONE J F, et al. Screeing of foods containing proanthocyanidins and their structural characterization using LC-MS/MS and thiolytic degradation[J]. Journal of Agricultural and Food Chemistry, 2003, 51(25): 7513-7521. DOI:10.1021/jf034815d.
[24] ROPIAK H M, RAMSAY A, MUELLER H I. Condensed tannins in extracts from European medicinal plants and herbal products[J].Journal of Pharmaceutical and Biomedical Analysis, 2016, 121: 225-231.DOI:10.1016/j.jpba.2015.12.034.
[25] ZOBEL H F. Molecules to granules: a comprehensive starch review[J].1988, 40(2): 44-50. DOI:10.1002/star.19880400203.
[26] YU X, HOUTMAN C, ATALLA R H. The complex of amylose and iodine[J]. Carbohydrate Research, 1996, 292(96): 129-141.DOI:10.1016/S0008-6215(96)91037-X.
[27] BATES F L, FRENCH D, RUNDLE R E. Amylose and amylopectin content of starches determined by their iodine complex formation1[J].Journal of the American Chemical Society, 1943, 65(2): 142-148.DOI:10.1021/ja01242a003.
[28] SWANSON M A. Studies on the structure of polysaccharides: relation of the iodine color to the structure[J]. Journal of Biological Chemistry,1948, 172(2): 825-837.
[29] 杜双奎, 杨红丹, 于修烛, 等. 商品粳米、籼米、糯米品质特性和糊化特性比较研究[J]. 食品科学, 2010, 31(5): 78-81.
[30] 田晓红, 谭斌, 谭洪卓, 等. 20 种高粱淀粉特性[J]. 食品科学, 2010,31(15): 13-20.
DOI:10.7506/spkx1002-6630-201719025
中图分类号:TS231
文献标志码:A
文章编号:1002-6630(2017)19-0156-08
引文格式:
郭雅靖, 颜梦婷, 林圣楠, 等. 几种原花青素的降血糖作用及与常见食品原料的结合研究[J]. 食品科学, 2017, 38(19):156-163. DOI:10.7506/spkx1002-6630-201719025. http://www.spkx.net.cn
GUO Yajing, YAN Mengting, LIN Shengnan, et al. Binding interaction of selected proanthocyanidins possessing hypoglycemic activity with common food raw materials[J]. Food Science, 2017, 38(19): 156-163. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719025. http://www.spkx.net.cn
收稿日期:2016-09-01
基金项目:福建省自然科学基金项目(2016N0017);福建省星火计划项目(2016S0042);
福州市科技计划项目(2015-G-70)
作者简介:郭雅靖(1990—),女,硕士,研究方向为食品资源深加工。E-mail:1016354264@qq.com
*通信作者:付才力(1978—),男,副研究员,博士,研究方向为食品科学。E-mail:caili_fu@hotmail.com
黄德建(1967—),男,副教授,博士,研究方向为食品科学与工程。E-mail:chmhdj@nus.edu.sg