罗 磊,张冰洁,关宁宁,马丽苹,朱文学
(河南科技大学食品与生物工程学院,河南省农产品干燥 装备工程技术研究中心,河南 洛阳 471023)
摘 要:目的:研究金银花叶黄酮对衰老小鼠体内抗氧化系统的调节作用。方法:采用颈背部皮下注射D-半乳糖法构建衰老小鼠模型,用不同剂量(低、中、高剂量分别为50、100、200 mg/(kg•d))的金银花叶黄酮灌胃小鼠,观察小鼠体质量变化,并计算肝脏、脑、肾脏、脾脏及心脏指数,测定小鼠血清及肝脏、脑、肾脏及心脏组织中总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide d ismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)活力及丙二醛(malondialdehyde,MAD)、谷胱甘肽(glutathione,GSH)含量。结果:与空白组相比,模型组小鼠体质量和脏器指数显著下降,血清和各脏器组织中的T-AOC、SOD、GSH-Px、CAT活力及GSH含量均有所降低,MDA含量升高,且大部分差异显著(P<0.05),说明衰老小鼠模型构建成功。与模型组相比,金银花叶黄酮各剂量组小鼠体质量和脏器指数均有所升高,血清和脏器中的T-AOC、SOD、GSH-Px、CAT活力及GSH含量均有不同程度的回升,MDA含量降低,高剂量组效果最显著。结论:金银花叶黄酮能有效提高衰老小鼠的抗氧化能力,其抗氧化机制可能与提高机体抗氧化酶活性和还原性保护物质含量、降低脂质过氧化物含量有关。
关键词:金银花叶;黄酮;衰老模型小鼠;D-半乳糖;抗氧化能力
Abstract:Objective: To study the effect of honeysuckle leaf fl avonoids on the antioxidant defense system in various tissues of aging mice. Methods: An aging mouse model was established by subcutaneous injection ofD-galactose in the neck and back, and the aging mice were gavaged with different doses (50, 100 and 200 mg/(kg·d)) of honeysuckle leaf fl avonoids.Changes in body weight were observed over the 30-day administration period, and liver, brain, kidney, spleen and heart indexes and the contents of malondialdehyde (MDA) and glutathione (GSH) and the activities of total antioxidant capacity(T-AOC), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and catalase (CAT) in the liver, brain, kidney,heart and serum of mice were assessed. Results: Compared with the control group, the body weight and organ indexes of mice in the model group decreased signifi cantly, T-AOC, SOD, GSH-Px and CAT activities and GSH content in the serum and organs decreased, and MDA content increased, with signifi cant differences being observed for most of these parameters(P< 0.05), indicating successful construction of aging mice model. Compared with the model group, body weight, organ indexes and T-AOC, SOD, GSH-Px and CAT activities as well as GSH content in the serum and organ tissues were improved for all dose groups; on the other hand, MDA content was decreased. The most signifi cant effect was obtained at the high dose. Conclusion: Honeysuckle leaf fl avonoids can effectively improve the antioxidant defense capacity of aging mice through a mechanism related to the increased activities of antioxidant enzymes and the reduced contents of protective substances and lipid peroxide.
Key words:honeysuckle leaf; fl avonoids; aging mice;D-galactose; antioxidant capacity
生物体在生理代谢过程中会不断产生自由基,当自由基过多时,生物体处于氧化应激状态,自由基作用于大分子物质会生成大量有害物质,导致生物体组织和器官的损伤[1]。有研究报道,生物体内的各种抗氧化酶可以清除自由基,随着年龄的增长,抗氧化酶系活性下降,机体清除自由基能力降低,自由基堆积,代谢产物丙二醛(malondialdehyde,MAD)含量升高,加重机体受损程度,从而导致衰老的发生发展[2-4]。黄酮具有抗氧化、抗癌、抗衰老等多种功效,关于探究黄酮的抗氧化、抗衰老机制以及在食药方面的应用逐渐成为人们关注的焦点[5-6]。
我国金银花分布广泛,资源丰富,具有抑菌消炎、清热解毒、保肝利胆等功效[7-8],金银 花叶作为金银花的副产物,具有产量大、采集容易、活性成分丰富等优点,但通常被直接丢弃,造成了资源浪费。近年来的研究显示,金银花叶中含有黄酮、有机酸、萜类等多种生物活性成分,其中以黄酮含量最为丰富[9]。有报道指出,金银花叶中黄酮含量是金银花中的2.78 倍,且金银花叶黄酮具备良好的抗氧化、抗炎、抑菌等功效[10-12]。目前对金银花叶黄酮抗氧化方面的研究主要通过体外测定其对各种自由基的清除能力,而用动物衰老模型进行体内抗氧化的研究尚鲜见报道。因此,本研究用金银花叶黄酮灌胃由D-半乳糖皮下注射诱导的衰老模型小鼠,称量小鼠体质量及计算脏器指数,并测定其体内总抗氧化能力、多种抗氧化酶和代谢产物等生化指标,评价金银花叶黄酮对衰老模型小鼠抗氧化能力的影响,探索其抗氧化机制,为金银花叶资源的综合利用提供科学依据。
1.1 动物、材料与试剂
60 只8 周龄BALB/c SPF级小鼠,体质量(20±2)g,雌雄各半,购于华中科技大学同济医学院实验动物中心(许可证号:SCXK(鄂)2010-0009)。
金银花叶,品种为‘益丰一号’,2016年7月购于河南洛阳孟津金银花种植基地。选取新鲜无病虫害的金银花叶,于45 ℃恒温干燥箱中干燥至恒质量,粉碎,40 目过筛得金银花叶粉末,4 ℃保存备用。
芦丁(CAS号:153-18-4) 上海源叶生物科技有限公司;NKA-Ⅱ型大孔吸附树脂 沧州宝恩吸附材料科技有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、MAD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽(glutathione,GSH)和过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;D-半乳糖、无水乙醇、VC等其他试剂均为分析纯。
1.2 仪器与设备
680全自动酶标仪 美国Bio-Rad公司;UV2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;TGL-20M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;LDZX-50KB立式压力蒸汽灭菌器上海申安医疗器械厂;KQ-500DE型数控超声波清洗器昆山市超声仪器有限公司;微型旋涡混合仪 上海沪西分析仪器厂有限公司;HL-2D型恒流泵 上海圣科仪器设备有限公司;HH-S恒温水浴锅 江苏金坛市亿通电子有限公司。
1.3 方法
1.3.1 金银花叶黄酮的制备
1.3.1.1 金银花叶黄酮的提取
参考文献[13]的方法。准确称取金银花叶粉末100 g,石油醚脱脂处理1 h,用体积分数60%的乙醇按料液比1∶65(m/V)混合均匀,于超声功率250 W、提取温度46 ℃条件下超声提取30 min,抽滤,45 ℃条件下减压浓缩至无醇味,真空冷冻干燥成粉,备用。
1.3.1.2 金银花叶黄酮的纯化
预处理NKA-Ⅱ树脂,将1.3.1.1节中所得金银花叶黄酮配制成2.17 mg/mL的上样液,调节其pH值至2.82,以1.96 BV/h的流速通过NKA-Ⅱ树脂柱进行纯化,先用2.0 BV蒸馏水以2.0 BV/h的流速洗脱除杂,再用体积分数为75.36%的乙醇溶液以1.47 BV/h的流速洗脱,收集乙醇洗脱液,旋蒸,冻干后置于4 ℃保存,备用。
1.3.2 金银花叶黄酮对衰老模型小鼠的抗氧化作用
1.3.2.1 小鼠的分组和处理
小鼠适应性饲喂5 d后,按体质量随机分为6 组(每组10 只,雌雄各半):空白组、模型组、VC对照组、金银花叶黄酮低、中、高剂量组。各实验组小鼠(空白组除外)颈背部皮下注射灭菌D-半乳糖(200 mg/(kg·d)以体质量计,下同)构建衰老小鼠模型[14],注射体积为0.02 mL/g,空白组注射等体积的灭菌生理盐水,连续注射30 d。造模同时,金银花叶黄酮低、中、高剂量组按照50、100、200 mg/(kg·d)的剂量分别灌胃金银花叶黄酮,灌胃体积为20 mL/kg;VC对照组按照100 mg/(kg·d)剂量灌胃等体积的VC;空白组和模型组灌胃等体积生理盐水,连续灌胃30 d。每7 d 称体质量1 次,按体质量变化调整注射及灌胃剂量。实验期间,所有小鼠不限制进食和饮水,温度为(20±3)℃,相对湿度为(50±10)%。
1.3.2.2 血清和组织样品的制备
末次灌胃后,所有小鼠禁食不禁水12 h,称体质量后摘眼球取血,于4 ℃、3 000 r/min条件下离心10 min制备血清。断颈处死小鼠,在冰袋上迅速解剖取出小鼠肝脏、脑、肾脏、脾脏及心脏,棉签吸去浮血并称质量,随后用冰冷生理盐水清洗后滤纸吸干,用预冷生理盐水制备10%和1%的组织匀浆,于4 ℃、4 000 r/min离心10 min后取上清液。血清及组织匀浆样品置于-20 ℃冰箱中保存待测。
1.3.2.3 小鼠体质量及脏器指数的测定
每周固定时间,饲喂前称量每只小鼠体质量并记录。最后解剖小鼠后称量各脏器质量,脏器指数按照下式计算。
1.3.2.4 抗氧化指标的测定
小鼠血清及各脏器组织中T-AOC、SOD、GSH-Px、CAT活力及MDA、GSH含量的测定按照试剂盒说明书操作。
1.4 数据统计处理
利用DPS 7.5软件进行统计分析,测定数据以 ±s表示。采用单因素方差分析并用LSD法进行多重比较。
2.1 金银花叶黄酮提取与纯化结果
本实验中,金银花叶黄酮粗提物的提取率为15.67%。金银花叶黄酮经纯化后纯度为(79.82±0.47)%。
2.2 金银花叶黄酮对衰老小鼠体质量的影响
由图1可见,随着的灌胃时间的延长,各组小鼠体质量均有所上升。模型组小鼠体质量增长逐渐缓慢,且出现脱毛、炸毛、行动缓慢、嗜睡等现象。从第7天开始,模型组小鼠的体质量开始显著低于空白组小鼠(P<0.05),并且差异随时间延长而逐渐增大。从第14天开始,空白组小鼠与低剂量组小鼠体质量出现显著差异(P<0.05)。整个实验过程中,空白组小鼠体质量与VC对照组及中、高剂量组之间无显著差异(P>0.05)。这说明金银花叶黄酮未对小鼠生长发育造成不良影响。

图1 金银花叶黄酮对衰老小鼠体质量变化的影响
Fig. 1 Effect of honeysuckle leaf fl avonoids on body weight changes of aging mice
2.3 金银花叶黄酮对衰老小鼠脏器指数的影响
表1 金银花叶黄酮对小鼠脏器指数的影响
Table 1 Effects of honeysuckle leaf fl avonoids on organ indexes in mice mg/g
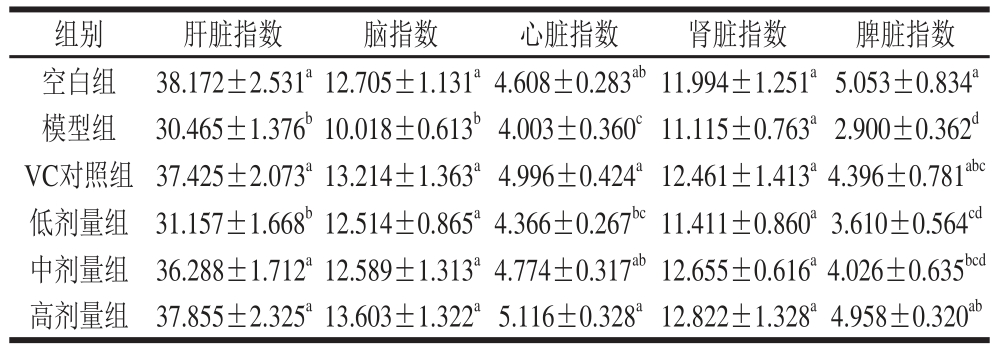
注:同列肩标字母不同表示差异显著(P<0.05),下同。
脏器质量的变化可以初步反映机体衰老程度。脑质量是反映动物神经组织在衰老过程中变化的主要指标。脾脏与体液免疫及细胞免疫均有密切关系,在免疫中发挥重要作用,脾脏萎缩会降低动物的免疫功能。肝脏和肾脏是重要的代谢器官,肝、肾脏质量下降会直接降低动物的代谢能力,同时肝脏也是动物的免疫器官之一[15]。由表1可知,与空白组相比,模型组小鼠的肝脏、脑、心脏、脾脏指数均显著下降(P<0.05)。各组小鼠的肾脏指数均无显著差异(P>0.05)。与模型组相比,VC对照组和高剂量组小鼠的肝脏、脑、心脏、脾脏指数均显著上升(P<0.05);中剂量组可以促进肝脏、脑、心脏指数的上升,且有显著差异(P<0.05),而对脾脏指数无显著影响(P>0.05);低剂量组可显著提高衰老小鼠的脑指数(P<0.05),对其他脏器无显著影响(P>0.05)。
由以上结果可以得出,金银花叶黄酮具有延缓小鼠脏器退化,提高免疫力及促进新陈代谢的作用。其机理推测可能与清除自由基和有害代谢产物,提高抗氧化酶活性有关。
2.4 金银花叶黄酮对衰老小鼠抗氧化指标的影响
2.4.1 金银花叶黄酮对衰老模型小鼠血清及脏器中T-AOC的影响
表2 小鼠血清及脏器组织中的T-AAOOCC
Table 2 Effect of honeysuckle leaf fl avonoids on T-AOC in serum and organ tissues of mice

机体防御体系中T-AOC的作用主要是维持内环境活性氧的动态平衡,清除过多的活性氧,使机体处于相对稳定的状态[16]。如表2所示,模型组小鼠的血清及各脏器组织中T-AOC均显著低于空白组(P<0.05)。与模型组相比,除血清、肝脏、心脏组织的低剂量组以及肾脏的高剂量组之外,其余各剂量组小鼠的血清及脏器组织中的T-AOC均显著升高(P<0.05)。小鼠肝脏、脑高剂量组中T-AOC显著高于VC对照组(P<0.05),而血清各剂量组T-AOC活力均显著低于VC对照组(P<0.05)。以上结果说明金银花叶黄酮能增强小鼠血清和各脏器中的T-AOC。
2.4.2 金银花叶黄酮对衰老模型小鼠血清及脏器中SOD活力的影响
表3 小鼠血清及脏器组织中SOD的活力
Table 3 Effect of honeysuckle leaf fl avonoids on SOD activity in serum and organ tissues of mice
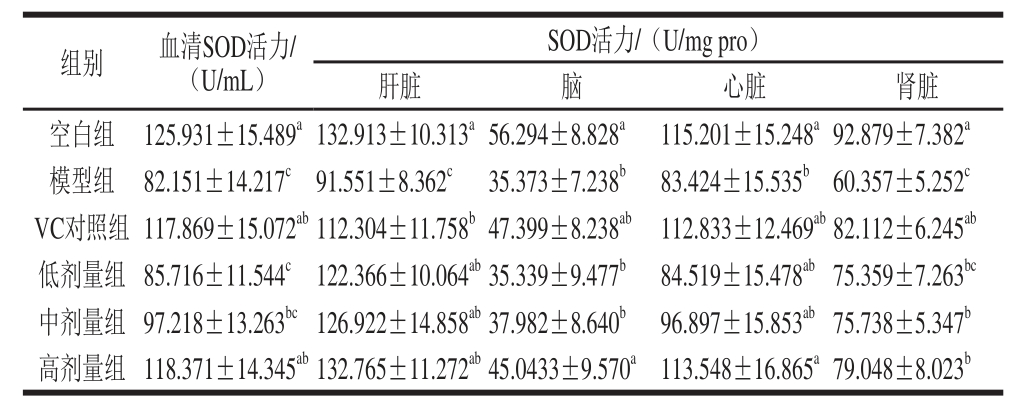
SOD几乎存在于所有生物细胞中,能够催化超氧化物通过歧化反应转化为O2和H2O2,其活性大小可以反映机体清除自由基能力[17]。如表3所示,与空白组相比,模型组小鼠的血清及各脏器组织中SOD活力均显著下降(P<0.05),表明衰老小鼠模型构建成功。与模型组相比,各剂量组SOD活力均升高,除了血清、脑、心脏组织的低、中剂量组以及肾脏的低剂量组之外,其余各剂量组小鼠的血清及脏器组织中的SOD活力均存在显著差异(P<0.05)。除了血清的低剂量组外,其余各剂量组小鼠的血清及各脏器组织中的SOD活力与VC对照组间均无显著差异(P>0.05)。以上结果说明金银花叶黄酮能够显著增强小鼠血清和各脏器中的SOD活力,且其作用接近VC对照。
2.4.3 金银花叶黄酮对衰老模型小鼠血清及脏器中MDA含量的影响
表4 小鼠血清及脏器组织中MDA的含量
Table 4 Effect of honeysuckle leaf fl avonoids on MDA content in serum and organ tissues of mice

MDA是膜脂过氧化最重要的产物之一,其含量的高低间接反映了机体被自由基攻击的受损程度[18]。如表4所示,与空白组相比,模型组小鼠的血清及各脏器组织中MDA含量均显著升高(P<0.05),表明模型建造成功。与模型组相比,各剂量组小鼠的MDA含量均有所下降,其中除血清的低、中剂量组及肝脏、心脏的低剂量组外,其余各剂量组小鼠的血清及脏器组织中的MDA含量均具有显著差异(P<0.05)。高剂量组小鼠血清及各脏器组织中MDA含量与VC对照组均无显著差异(P>0.05)。以上结果说明金银花叶黄酮可以显著降低血清和各脏器中的MDA含量,且高剂量组作用效果较好。
2.4.4 金银花叶黄酮对衰老模型小鼠血清及脏器中GSH-Px活力的影响
表5 小鼠血清及脏器组织中GSH-Px的活力
Table 5 Effect of honeysuckle leaf fl avonoids on GSH-Px activity in serum and organ tissues of mice

GSH-Px可以催化还原性GSH与H2O2反应生成对机体无害的水和氧化型GSH,从而保护细胞膜结构和功能的完整[19]。由表5可知,模型组小鼠的血清及各脏器组织中的GSH-Px活力均显著低于空白组(P<0.05)。与模型组相比,各剂量组小鼠GSH-Px活力均有所升高,其中除脑、心脏的低、中剂量组以及血清、肾脏的低剂量组外,其余各剂量组小鼠血清及脏器组织中的GSH-Px活力均显著高于模型组(P<0.05)。小鼠肝、心脏高剂量组中GSH-Px活力高于VC对照组,其他剂量组低于VC对照组。以上结果说明金银花叶黄酮能够显著增强小鼠血清和各脏器中GSH-Px活力。
2.4.5 金银花叶黄酮对衰老模型小鼠血清及脏器中GSH含量的影响
表6 小鼠血清及脏器组织中GSH的含量
Table 6 Effect of honeysuckle leaf fl avonoids on GSH content in serum and organ tissues of mice
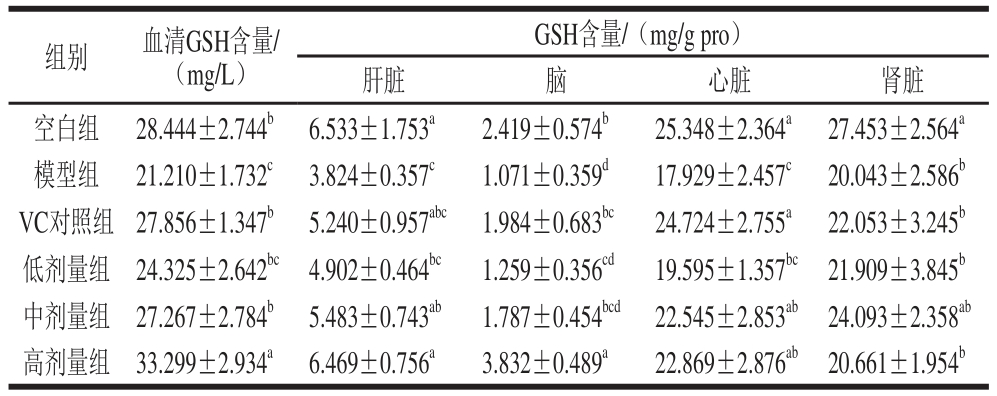
GSH是一种低分子质量清除剂,可清除O2-、H2O2、过氧化脂质,其含量多少是衡量机体抗氧化能力的重要因素[20]。如表6所示,与空白组相比,模型组小鼠的血清及各脏器组织中GSH含量均有所下降,且差异显著(P<0.05)。与模型组相比,各剂量组小鼠GSH含量均有所升高,其中小鼠血清、肝脏、心脏组织的中、高剂量组及脑的高剂量组中的GSH含量具有显著性差异(P<0.05)。小鼠血清、肝脏、脑高剂量组及肾脏中剂量组中GSH含量高于VC对照组,其他低于VC对照组。以上结果说明金银花叶黄酮可以显著升高血清和各脏器中的GSH含量,且中、高剂量组作用效果较好。
2.4.6 金银花叶黄酮对衰老模型小鼠血清及脏器中CAT活力的影响
表7 小鼠血清及脏器组织中CAT的活力
Table 7 Effect of honeysuckle leaf fl avonoids on CAT activity in serum and organ tissues of mice
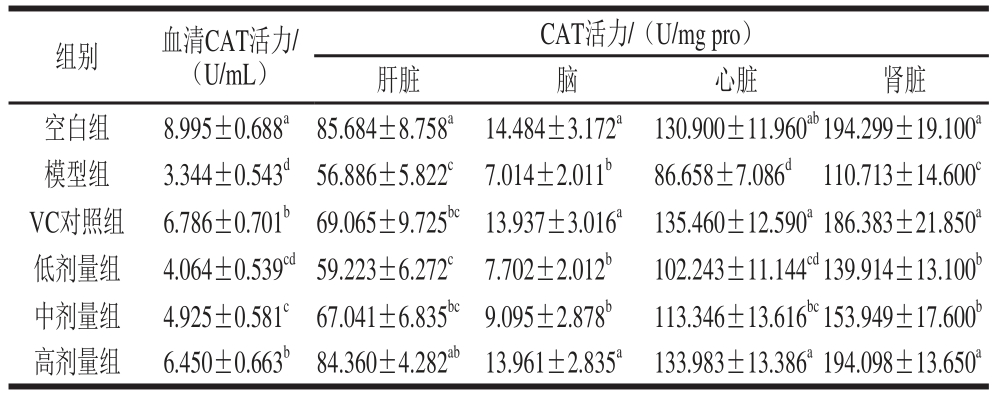
CAT普遍存在于生物机体内,它可以催化H2O2分解为H2O与O2,保护机体免受有害物质损伤[21]。如表7所示,模型组小鼠的血清及各脏器组织中CAT活力均低于空白组,且差异显著(P<0.05)。与模型组相比,各剂量组小鼠CAT活力均有所升高,其中除肝、脑组织的低、中剂量组以及血清、心脏的低剂量组之外,其余各剂量组小鼠血清及脏器组织中的CAT活力具有显著性差异(P<0.05)。小鼠肝脏、脑及肾脏高剂量组中CAT活力高于VC对照组,其他低于VC对照组。以上结果表明金银花叶黄酮能增强小鼠血清和各脏器中的CAT活力。
D-半乳糖亚急性衰老模型是研究抗衰老药物的经典模型[22]。连续大剂量皮下注射D-半乳糖会造成小鼠机体细胞内的半乳糖浓度增高,在醛糖还原酶的催化下,还原成半乳糖醇,半乳糖醇不能被细胞进一步代谢,堆积在细胞内,影响正常渗透压,导致细胞肿胀和功能障碍[23],从而引起机体免疫力降低、代谢紊乱、抗氧化物质活性下降、自由基堆积等现象[24-25],最终导致衰老的发生。本实验通过皮下注射D-半乳糖构建亚急性衰老小鼠模型,研究金银花叶黄酮的体内抗氧化活性。与空白组相比,模型组小鼠体质量和脏器指数显著下降,血清和各脏器组织中的T-AOC、SOD、GSH-Px、CAT活力及GSH含量均有不同程度的降低,MDA含量显著升高,说明衰老小鼠模型构建成功。
本实验结果表明金银花叶黄酮各剂量组能不同程度地促进小鼠体质量的增加,并增大肝脏指数、脾脏指数、心脏指数及脑指数,其中高剂量组效果最明显,说明金银花叶黄酮能有效增强衰老小鼠的体质,减缓小鼠脑萎缩及脏器功能的下降。
抗氧化试剂盒研究结果显示,不同剂量的金银花叶黄酮可以不同程度地提高衰老小鼠血清及各脏器中T-AOC、SOD、GSH-Px、CAT活力及GSH含量,并降低MDA含量。其中,低剂量组中的一些指标差异不显著(P>0.05),这可能是由于低剂量的金银花叶黄酮对机体抗氧化作用不明显且小鼠之间存在个体差异。随着金银花叶黄酮灌胃剂量的加大,小鼠血清和脏器中各抗氧化酶活力及GSH含量均显著升高,与模型组相比,大部分指标均存在显著差异(P<0.05)。另外,不同剂量的金银花叶黄酮对衰老小鼠血清和脏器中的MDA含量均表现出不同程度的降低,尤以脑和肾脏中的MDA含量降低得最为明显,这可能是由于金银花叶黄酮可以维持细胞膜结构的稳定、抑制脂质过氧化从而有效地降低小鼠体内MDA含量。
研究结果表明,金银花叶黄酮一方面通过提高机体总抗氧化能力,提高抗氧化酶活力和还原性保护物质GSH含量,清除机体中的有毒有害物质和自由基,从而减轻机体的损伤程度[26-27];另一方面通过减少机体中的有害物质MDA含量,降低脂质过氧化作用形成脂质过氧化物含量,减缓机体膜系统受氧自由基攻击后的损伤,从而间接增强机体抵抗自由基攻击的能力[28-29]。本研究为金银花叶在食药、保健品领域的开发利用提供了理论依据,也将促进金银花资源的充分利用。
参考文献:
[1] 范金波, 周素珍, 郑立红, 等. 丝胶抗氧化肽对H2O2诱导人脐静脉内皮细胞(ECV-304)损伤的保护作用[J]. 中国食品学报, 2014, 14(8):47-53.
[2] HARMAN D. About “origin and evolution of the free radical theory of aging: a brief personal history, 1954-2009”[J]. Biogerontology, 2009,10(6): 773-781. DOI:10.1007/s10522-009-9253-z.
[3] FINKEL T, HOLBROOK N J. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408: 239-247.
[4] 高璐, 王滢, 饶胜其, 等. 葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J]. 食品科学, 2014, 35(23): 253-256. DOI:10.7506/spkx1002-6630-201423049.
[5] 范红艳, 王艳春, 任旷, 等. 苦参总黄酮对异丙肾上腺素所致大鼠心肌纤维化的影响[J]. 中药药理与临床, 2013, 29(4): 76-78.
[6] CHOI C W, KIM S C, HWANG S S, et al. Antioxidant activity and free radical scavenging capacity between Korean medicinal plants and fl avonoids by assay-guided comparison[J]. Plant Science, 2002, 163:1161-1168. DOI:10.1016/S0168-9452(02)00332-1.
[7] 皮建辉, 谭娟, 胡朝暾, 等. 金银花黄酮对小鼠免疫调节作用的研究[J].中国应用生理学杂志, 2015, 31(1): 89-92. DOI:10.13459/j.cnki.cjap.2015.01.026.
[8] LIN L Y, WANG P P, DU Z Y, et al. Structural elucidation of a pectin from fl owers ofLonicera japonicaand its antipancreatic cancer activity[J]. International Journal of Biological Macromolecules, 2016,88: 130-137. DOI:10.1016/j.ijbiomac.2016.03.025.
[9] 武雪芬, 白雁. 金银花叶药用成分的提取及抑菌试验研究[J]. 中成药, 2001, 23(6): 448-449. DOI:10.3969/j.issn.1001-1528.2001.06.023.
[10] 李世传, 杜华英, 熊建华, 等. 金银花叶抑菌成分的提取及效果研究[J]. 食品研究与开发, 2015, 36(6): 6-10. DOI:10.3969/j.issn.1005-6521.2015.06.002.
[11] 杨鹏飞, 熊建华, 杜华英, 等. 金银花叶HPLC指纹图谱及最佳采收期的研究[J]. 江西农业大学学报, 2014(1): 68-75. DOI:10.3969/j.issn.1000-2286.2014.01.011.
[12] 黄荣, 向福, 马文静, 等. 微波辅助PEG提取金银花叶中绿原酸的工艺优化[J]. 中国酿造, 2015, 34(8): 119-124. DOI:10.11882/j.issn.0254-5071.2015.08.025.
[13] 罗磊, 张冰洁, 朱文学, 等. 响应面试验优化超声辅助提取金银花叶黄酮工艺及其抗氧化活性[J]. 食品科学, 2016, 37(6): 13-19.DOI:10.7506/spkx1002-6630-201606003.
[14] 孙荣花, 李爽, 邵莹, 等.D-半乳糖致小鼠亚急性衰老模型方法优化[J]. 中药药理与临床, 2015(4): 293-297. DOI:10.13412/j.cnki.zyyl.2015.04.104.
[15] 沙爱龙, 吴瑛, 盛海燕, 等. 昆仑雪菊黄酮对衰老模型小鼠脑及脏器指数的影响[J]. 动物医学进展, 2013, 34(7): 66-68. DOI:10.3969/j.issn.1007-5038.2013.07.014.
[16] WANG M, MENG X Y, YANG R L, et al.Cordyceps militarispolysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J]. Carbohydrate Polymers, 2012, 89(2):461-466. DOI:10.1016/j.carbpol.2012.03.029.
[17] 王建华, 刘鸿先, 徐同. 超氧物歧化 酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1): 1-7. DOI:10.13592/j.cnki.ppj.1989.01.001
[18] CUI J J, YUAN J F, ZHANG Z Q, et al. Anti-oxidation activity of the crude polysaccharides isolated fromPolygonum cillinerve(Nakai)Ohwi in immunosuppressed mice[J]. Journal of Ethnopharmacology,2010, 132(2): 512-517. DOI:10.1016/j.jep.2010.08.052.
[19] 刘乔, 管晓辉, 黄翠菊, 等. GA的提取分离工艺优化及其体内抗氧化活性作用[J]. 食品科学, 2015, 36(24): 89-94. DOI:10.7506/spkx1002-6630-201524015.
[20] WANG L, DING L, YU Z, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J]. Food Research International,2016, 90: 33-41. DOI:10.1016/j.foodres.2016.10.023.
[21] 迟晓星, 张涛, 郑丽娜, 等. 大豆异黄酮对青年雌性大鼠的抗氧化作用研究[J]. 中国食品学报, 2010, 10(5): 78-82. DOI:10.3969/j.issn.1009-7848.2010.05.012.
[22] 季文静, 张翠平, 魏文挺, 等. 蜂王浆酶解产物对D-半乳糖模型小鼠体内抗衰老的作用[J]. 中国食品学报, 2016, 16(1): 18-25.DOI:10.16429/j.1009-7848.2016.01.003.
[23] SONG X, BAO M, LI D, et al. Advanced glycation inD-galactose induced mouse aging model[J]. Mechanisms of Aging and Development,1999, 108(3): 239-251. DOI:10.1016/S0047-6374(99)00022-6.
[24] CUI X, ZUO P P, ZHANG Q, et al. Chronic systemicD-galactose exposure induces memory loss, neurodegeneration, and oxidative damage in mice: protective effects of R-alpha-lipoic acid[J]. Journal of Neuroscience Research, 2006, 84: 647-654. DOI:10.1002/jnr.20845.
[25] ZHOU D, AI Q, LIN L, et al. 5-Aminoimidazole-4-carboxamide-1-β-D-ribofuranoside-attenuates LPS/D-Gal-induced acute hepatitis in mice[J]. Innate Immunity, 2015, 21(7): 698-705.DOI:10.1177/1753425915586231.
[26] 宋家乐, 李贵节, 赵欣. 竹盐酿造酱油对H2O2诱发LLC-PKl细胞氧化损伤的保护作用[J]. 食品 科学, 2015, 36(9): 176-180. DOI:10.7506/spkx1002-6630-201509032.
[27] YANG X B, HUANG Z M, CAO W B, et al. Study on liver injury models induced by CCl4D-Gal and ANIT in mice[J]. World Journal of Gastroenterology, 1998, 4(1): 63-63.
[28] 杨溢烁, 曾德永, 刘艳, 等. 香菇多糖体内抗氧化活性研究[J]. 中国食物与营养, 2016, 22(8): 72-74. DOI:10.3969/j.issn.1006-9577.2016.08.017.
[29] HUANG X D, YING J, WANG Y C, et al. Anti-aging effects of deoxyschizandrin inD-galactose-induced aging rats[J]. Applied Mechanics and Materials, 2013, 423/424/425/426: 373-377.DOI:10.4028/www.scientifi c.net/AMM.423-426.373.
In VivoAntioxidant Activity of Honeysuckle Leaf Flavonoids in Aging Mice
LUO Lei, ZHANG Bingjie, GUAN Ningning, MA Liping, ZHU Wenxue
(Henan Agricultural Products Drying Equipment Engineering Technology Research Center, College of Food and Bioengineering,Henan University of Science and Technology, Luoyang 471023, China)
DOI:10.7506/spkx1002-6630-201719027
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)19-0171-06
收稿日期:2017-02-28
基金项目:国家自然科学基金联合基金项目(U1304330);河南省高校科技创新团队计划项目(17IRTSTHN016)
作者简介:罗磊(1976—),男,教授,博士,研究方向为食品干燥品质控制、食品营养成分与活性。
E-mail:13623896431@139.com
引文格式:
罗磊, 张冰洁, 关宁宁, 等. 金银花叶黄酮对衰老模型小鼠的体内抗氧化作用[J]. 食品科学, 2017, 38(19): 171-176.DOI:10.7506/spkx1002-6630-201719027. http://www.spkx.net.cn
LUO Lei, ZHANG Bingjie, GUAN Ningning, et al.In vivoantioxidant activity of honeysuckle leaf fl avonoids in aging mice[J]. Food Science, 2017, 38(19): 171-176. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719027.http://www.spkx.net.cn