王 海,连燕娜,周 游,黄姗婉,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100191)
摘 要:目的:研究低聚葡萄籽原花青素(oligomeric grape seed proanthocyanidins,O-GSP)联合顺铂对人肺腺癌细胞A549抗氧化、细胞凋亡及凋亡相关蛋白表达的影响。方法:细胞分为对照组、顺铂(5 mg/L)组、O-GSP(4 mg/L)组、O-GSP(4 mg/L)+顺铂(5 mg/L)组。硫代巴比妥酸法测定细胞中丙二醛(malondialdehyde,MDA)含量;二硫代二硝基苯甲酸法测定谷胱甘肽(glutathione,GSH)含量;黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活力;流式细胞术检测细胞内活性氧(reactive oxygen species,ROS)含量和细胞凋亡率;Western blot检测细胞凋亡相关蛋白Bcl-2、Bax和caspase-3的表达。结果:顺铂导致A549细胞MDA、ROS含量显著升高(P<0.05),GSH含量和SOD活力显著降低(P<0.05),O-GSP对细胞内MDA含量、GSH含量、SOD活力无显著影响(P>0.05)。O-GSP+顺铂组相对于顺铂组,细胞内MDA、GSH、SOD水平无显著性变化(P>0.05),而ROS含量明显降低(P<0.05)。顺铂、O-GSP以及两者联用均能显著促进细胞凋亡(P<0.05),并且能够显著提高Bax及Bax/Bcl-2值,顺铂和O-GSP+顺铂可显著降低Bcl-2的表达(P<0.05),同时激活caspase-3。结论:O-GSP联合顺铂可促进A549细胞的凋亡,其机制与O-GSP的抗氧化作用没有显著联系,而是与两者可共同调节凋亡相关蛋白基因表达有关。
关键词:低聚葡萄籽原花青素;顺铂;肺腺癌;细胞凋亡
Effect of Oligomeric Grape Seed Proanthocyanidins Combined with Cisplatin on the Apoptosis of Human Lung Adenocarcinoma Cell Line A549
WANG Hai, LIAN Yanna, ZHOU You, HUANG Shanwan, GAO Liping*
(Beijing Key Laboratory of Bioactive Substances and Functional Foods, College of Arts and Sciences,Beijing Union University, Beijing 100191, China)
Abstract:Objective: To study the effect of oligomericgrape seed proanthocyanidin (O-GSP) combined with cisplatin(CDDP) on antioxidant defense systems, cell apoptosis and apoptosis-related protein expression in human lung adenocarcinoma cell line A549. Methods: The cells were divided into control, CDDP (5 mg/L), O-GSP (4 mg/L), and O-GSP (4 mg/L) + CDDP (5 mg/L) groups. Malondialdehyde (MDA) content was measured by thiobarbituric acid method. Glutathione (GSH) content was determined by nitrobenzoic acid method. Superoxide dismutase(SOD) activity was examined by xanthine oxidase method. Flow cytometry was used to detect the intracellular ROS content and apoptosis rate. The expression of apoptosis-related proteins such as Bcl-2, Bax and caspase-3 were detected by Western blot. Results: CDDP resulted in a signifi cant increase of MDA and ROS in A549 cells (P< 0.05)and a signifi cant reduction of GSH content and SOD activity (P< 0.05), but O-GSP had no signifi cant effect on the levels of intracellular MDA, GSH and SOD (P> 0.05). Compared with the CDDP group, the levels of MDA, GSH and SOD in the O-GSP + CDDP group were not significantly changed (P> 0.05), while the content of ROS was significantly reduced (P< 0.05). CDDP, O-GSP and their combination could significantly promote cell apoptosis(P< 0.05). The combination of CDDP and O-GSP could increase Bax level and the ratio of Bax to Bcl-2, decrease Bcl-2 expression (P< 0.05), and activate caspase-3. Conclusion: Oligomeric grape seed proanthocyanidins combined with cisplatin can promote the apoptosis of A549 cells, and the apoptosis mechanism was not signifi cantly related to the antioxidant activity of oligomeric grape seed proanthocyanidins but related to the expression of apoptosis-related genes.
Key words:oligomeric grape seed proanthocyanidin (O-GSP); cisplatin; lung adenocarcinoma; cell apoptosis
肺癌发生于支气管黏膜上皮,近50 年来肺癌的发病率显著增高,在欧美工业发达国家和我国的一些工业大城市中,肺癌发病率在男性恶性肿瘤中已居首位,在女性发病率也迅速增高[1]。尽管在过去的几十年间,手术、放疗、化疗等常规治疗手段有了很大的进步,但在我国肺癌的5 年存活率仍不足15%。化疗在肺癌的综合治疗中占据着重要的地位,而顺铂则是其中治疗非小细胞肺癌应用最广泛的一线化疗药物[2]。然而其对正常组织的毒性作用特别是肾毒性影响了其疗效。研究表明,由冬虫夏草、生大黄、黄芪和木灵芝等组方的保元排毒丸能治疗顺铂引起的早期肾脏毒性作用[3]。用黄芪多糖对顺铂治疗S180荷瘤小鼠的研究表明,黄芪对顺铂治疗荷瘤小鼠有增效减毒作用[4]。灵芝多糖可通过抑制顺铂肾皮质脂质过氧化来减轻顺铂肾毒性,并可有效抑制顺铂引起的恶心呕吐,且不影响顺铂的抗肿瘤活性[5-6]。此外,芎黄汤、加黄连阿胶汤等都对顺铂所致肾毒性有预防和保护作用,这些中药成分可通过清除自由基或提高机体抗氧化能力等多种途径发挥增强肾功能、减轻顺铂肾毒性的作用[7-8]。
葡萄籽原花青素是从葡萄籽中提取的,由儿茶素、表儿茶素、表儿茶素没食子酸以及没食子酸酯缩合而成的聚合体的混合物。根据聚合度的不同,分为高聚葡萄籽原花青素(polymeric grape seed proanthocyanidins,P-GSP)和低聚葡萄籽原花青素(oligomeric grape seed proanthocyanidins,O-GSP)。其中生物活性最强的是O-GSP[9]。O-GSP具有强大的清除自由基、抗氧化、抗炎、抗动脉粥样硬化等作用[10-11]。研究表明,葡萄籽原花青素对人胚肾细胞HEK293[12]、大鼠心肌细胞H9c2[13]、小鼠睾丸支持细胞TM4[14]均有生长促进作用,且能够拮抗顺铂导致的氧化损伤。另外,O-GSP对肺癌、卵巢癌、皮肤癌、前列腺癌、结肠癌等都有不同程度的抑制作用,可以诱导细胞凋亡[15]。
前期研究显示O-GSP可增强顺铂对A549细胞的杀伤作用[12],但其作用机制不明,本实验通过探究O-GSP联合顺铂对人肺腺癌细胞A549抗氧化、细胞凋亡及凋亡相关蛋白表达的影响,探讨O-GSP联合顺铂抗癌作用及其分子机制,以期降低顺铂的毒副作用,改善癌症患者的生活质量。
1.1 材料与试剂
人肺腺癌细胞A549购于北京协和医院基础学院细胞中心。
顺铂注射用冻干粉剂(批号:406022CF) 齐鲁制药有限公司;O-GSP(原花青素纯度≥95%,色谱级,其中二聚体含量≥60%、原花青素B2含量≥4%) 天津尖峰天然产物研究开发有限公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT) 美国Sigma公司;丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;细胞凋亡试剂盒 美国Genview公司;Bax抗体、Bcl-2抗体、caspase-3抗体 中杉金桥生物技术有限公司;β-肌动蛋白抗体、HRP标记山羊抗兔IgG抗体、山羊抗鼠IgG抗体、BCA蛋白浓度测定试剂盒、高效化学发光(efficient chemiluminescence,ECL)试剂盒 北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
FACS Calibar流式细胞仪 美国BD公司;Powerpac HC电泳仪 美国Bio-Rad公司;ImageQuant RT ECL凝胶成像系统 美国通用电气公司。
1.3 方法
1.3.1 A549细胞的培养
用含双抗和10%胎牛血清的DMEM/F12培养基,置于37 ℃、5% CO2的饱和湿度培养箱中。胰酶消化后将细胞数按照1∶2的比例进行传代培养。选择对数生长期的细胞进行实验。
1.3.2 A549细胞内SOD活力、MDA和GSH含量的测定
将细胞(5×104个/mL)接种到6 孔板(2 mL/孔),待细胞生长到融合状态,根据前期的实验结果[16],选择顺铂质量浓度为5 mg/L,O-GSP质量浓度为4 mg/L,将细胞分为对照组、顺铂(5 mg/L)组、O-GSP(4 mg/L)组和O-GSP(4 mg/L)联合顺铂(5 mg/L)处理组。培养24 h后弃掉培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2 遍,低温裂解5 min,用细胞刮收集细胞,12 000 r/min离心10 min,取上清液用于实验。按照试剂盒的说明,测定各组细胞蛋白浓度及SOD活力、MDA和GSH的含量。
1.3.3 A549细胞ROS含量的测定
按照1.3.2节中细胞分组培养24 h后,弃掉培养液。用PBS冲洗6 孔板后,各组加入1 mL终浓度为10 μmol/L的二氯二氢荧光素-乙酰乙酸酯(2,7-dichlorodihydrofl uorescein diacetate,DCFH-DA),于37 ℃培养箱中孵育20 min,无血清培养基洗涤细胞3 次除去未进入细胞的探针DCFH-DA。然后胰酶消化收集细胞,1 000 r/mim离心5 min,500 μL PBS重悬后,200 目网过筛收集于流式管内,Cell Quest Pro软件测定活性氧(reactive oxygen species,ROS)平均荧光强度。
1.3.4 A549细胞凋亡率的检测
按照1.3.2节中的细胞分组,在培养箱中培养24 h后,收集细胞,按照试剂盒的说明,Annexin V-FITC和PI染色后,流式细胞仪检测分析。
1.3.5 Western bolt检测细胞凋亡相关蛋白的表达
取适量1.3.2节中各处理组用于实验的蛋白上清液,将5×上样缓冲液与蛋白样品按照1∶4(V/V)的比例混匀后煮沸。进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,转膜,5%脱脂奶粉室温封闭75 min,三羟甲基氨基甲烷-盐酸-吐温20缓冲液(Tris buffered saline and tween 20,TBST)洗3 次,分别加Bcl-2、Bax一抗(稀释比1∶1 000)4 ℃孵育过夜;TBST洗3 次后加入对应二抗(稀释比1∶10 000)37 ℃孵育75 min,TBST洗3 次,化学发光成像系统曝光,Quantity One 4.4.0软件测定蛋白条带灰度值。按照下式计算蛋白相对表达量。
1.4 数据统计分析
采用SPSS 19.0软件进行统计分析,结果表示为±s。单因素方差分析对数据进行Duncan检验,检测水平α=0.05。用Origin 9.1软件作图。
2.1 O-GSP联合顺铂对A549细胞内抗氧化指标的影响
由表1可知,顺铂作用下的A549细胞MDA、ROS含量相对于对照组显著升高(P<0.05),GSH含量和SOD活性显著降低(P<0.05),O-GSP对细胞内MDA、GSH、SOD水平没有显著影响(P>0.05),O-GSP+顺铂组细胞MDA、GSH含量和SOD活力与对照组相比有显著性差异(P<0.05),但与顺铂组比较无显著性差异(P>0.05)。O-GSP可明显降低细胞中的ROS含量,使顺铂诱导的较高ROS含量降低到趋于正常水平。
表1 O-GSPP联合顺铂对A549细胞内抗氧化指标的影响(n=55)
T
Taabbllee 11 EEffffeecctt ooff OO--GGSSPP ccoommbbiinneedd wwiitthh cciissppllaattiinn oonn aannttiiooxxiiddaanntt defense systems in A549 cells (n== 55))
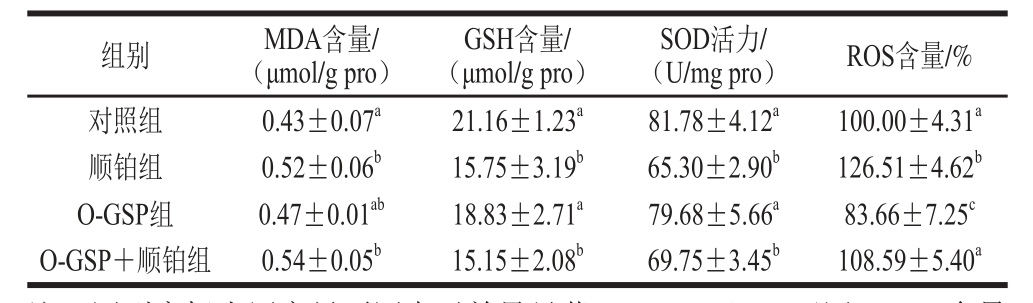
注:同列肩标小写字母不同表示差异显著(P<0.05),下同。ROS含量为与对照组的相对百分比。
2.2 O-GSP联合顺铂对A549细胞凋亡的影响
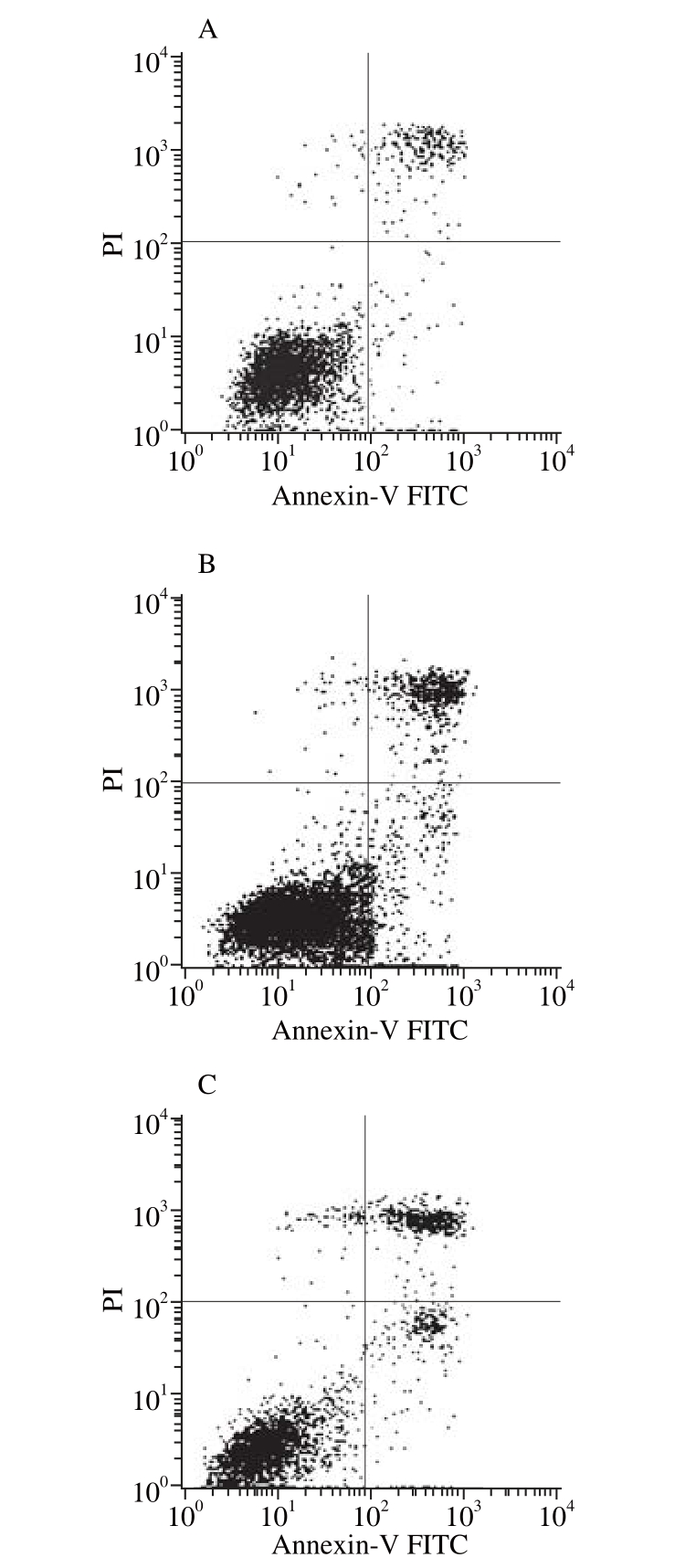
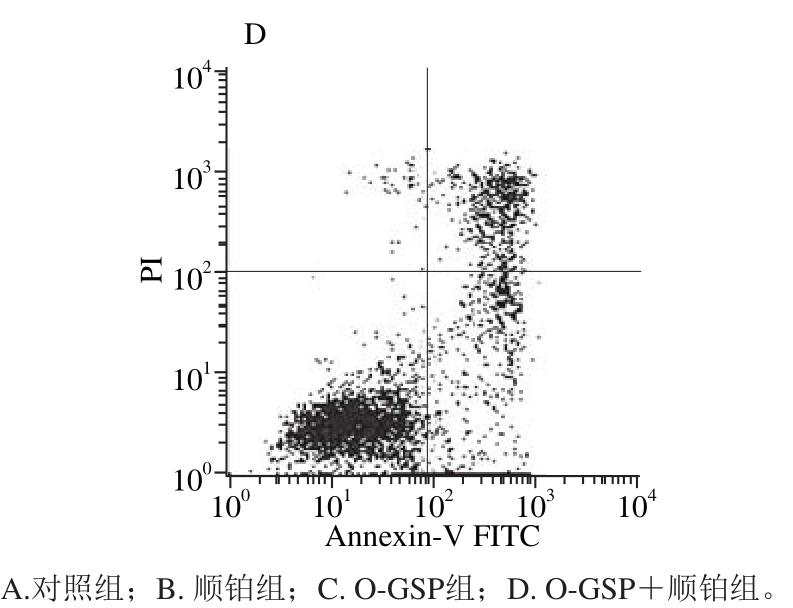
图1 O-GSPP 联 合顺铂对A549细胞凋亡的影响
Fig. 1 Effect of O-GSP combined with cisplatin on A549 cells apoptosis
表2 O-GSP联合顺铂对A549细胞凋亡的影响(n=5)
Table 2 Effect of O-GSP combined with cisplatin on A549 cells apoptosis (n=5)
如图1和表2所示,与对照组相比,顺铂组和O-GSP组的细胞凋亡率均显著提高(P<0.05),而顺铂组和O-GSP组相比无显著性差异(P>0.05)。O-GSP+顺铂组细胞凋亡率显著高于顺铂组和O-GSP组(P<0.05),说明顺铂和O-GSP单独作用均可以诱导细胞凋亡,且两者共同使用具有联合作用。
2.3 O-GSP联合顺铂对A549细胞凋亡相关蛋白表达的影响
表3 O-GSP联合顺铂对A549细胞凋亡相关蛋白表达的影响(n=5)
Table 3 Combined effect of O-GSP and cisplatin on the expression of apoptosis-related proteins in A549 cells (n= 5)

为更深入研究O-GSP联合顺铂对A549细胞凋亡的影响,采用Western blot检测Bcl-2、Bax、活性caspase-3和前体caspase-3等细胞凋亡相关蛋白表达。如表3所示,与对照组比较,顺铂和O-GSP均能够显著提高Bax蛋白表达量以及Bax/Bcl-2(P<0.05)。顺铂还能显著降低Bcl-2蛋白表达量同时增加活性caspase-3的蛋白表达量,而O-GSP组Bcl-2和活性caspase-3蛋白表达量与对照组相比无显著差异(P>0.05)。顺铂和O-GSP联合处理细胞后,与对照组和O-GSP组相比,细胞凋亡相关蛋白的表达均有显著性差异(P<0.05)。联合作用的结果显示,与顺铂组相比,除Bcl-2的表达外,其他蛋白水平均有显著性差异(P<0.05)。说明顺铂和O-GSP联合促进细胞凋亡与Bcl-2和caspase-3家族的细胞凋亡调控有关。
顺铂自用于癌症治疗以来表现出广泛的抗癌活性[17-19],且疗效显著,但顺铂在治疗过程中又会对人体造成许多毒副作用,其中肾毒性最为严重[20]。大量实验研究表明,运用化疗药物治疗癌症的过程中给予相关抗氧化剂,可显著提升抗癌药物治疗效果,同时降低毒副作用[21]。O-GSP作为一种活性较强的多酚类物质,具有强大的抗氧化和抗肿瘤作用。O-GSP的抗肿瘤机制如下:1)清除自由基和抗氧化作用;2)增强抗氧化酶(如谷胱甘肽-S-转移酶)活性;3)增加Bax/Bcl-2值,促进细胞色素酶c从线粒体内释放入胞质内,促进细胞凋亡;4)抑制蛋白激酶C和细胞增殖的作用;5)抑制上皮生长因子与其受体的相互作用;6)抗炎活性和加强细胞间连接。从与其他来源的原花青素相比,O-GSP具有水溶性好、生物利用度高、易被人体吸收等优点,作为天然抗肿瘤药物具有良好的应用前景。
在正常生理状况下,细胞内的抗氧化系统(如GSH、SOD等)能够通过清除多余的ROS使细胞内的氧化还原状态保持平衡。顺铂进入细胞后,可以通过损伤线粒体呼吸作用电子传递链,使细胞产生氧化应激反应,直接导致细胞内ROS水平升高[22]。另外顺铂也能通过降低GSH含量和SOD活性,打破细胞内抗氧化系统的平衡,使细胞内ROS水平进一步提高,导致癌细胞内ROS异常积累[23]。在癌细胞中,ROS的大量积累能够损伤细胞内DNA、蛋白以及细胞的膜系统,产生脂质过氧化,进一步破坏线粒体电子传递链,从而使细胞内产生更多的ROS,最终导致细胞裂解或死亡[24]。本研究结果显示,顺铂导致A549细胞内GSH含量和SOD的活力显著降低,MDA和ROS含量显著升高(P<0.05)。O-GSP和顺铂联合处理组与顺铂组相比,ROS含量显著降低(P<0.05),而GSH和MDA含量、SOD的活力无显著性变化(P>0.05)。提示顺铂可通过抑制抗氧化酶活力,使脂质过氧化物增加,诱导细胞氧化损伤。而O-GSP和顺铂联合处理细胞后,虽然没有逆转顺铂对细胞抗氧化系统的影响,但O-GSP有效清除了A549细胞中顺铂诱导产生的ROS。He Guodong[25]、Wang Ruxuan[26]等研究表明,ROS在顺铂的抗癌过程中具有一定的作用,使用ROS诱导剂增加细胞ROS水平可以增强顺铂的抗癌活性,相反,使用ROS抑制剂则可以使顺铂的抗癌活性降低。而在本研究结果中,O-GSP与顺铂联合用药后,虽然ROS水平降低,但O-GSP明显增强了顺铂所致的A549细胞凋亡,顺铂和O-GSP分别使细胞凋亡率从10.95%提升至21.36%和18.54%,两药联用后细胞凋亡率上升为39.57%,提示在O-GSP增强顺铂所致A549细胞凋亡过程中,氧化应激反应可能不起主导的作用。另外,张军[27]对ROS抑制剂NAC对结肠癌细胞顺铂化疗敏感性进行研究,其结果表明抑制细胞内ROS后可以增强结肠癌细胞对顺铂的敏感性,其机制可能与ROS作为第二信使,与激活下游AKT等信号通路有关。ROS在细胞中具有双重的功能,其既能通过DNA损伤和线粒体途径诱导细胞凋亡,也能通过激活其他信号通路来调节细胞的生存或死亡状态。因此,本研究中ROS在O-GSP与顺铂联合杀伤A549细胞过程中所起的作用机制还有待于进一步研究。
细胞凋亡是多基因调控的共同结果,在线粒体凋亡途径中,Bcl-2家族和Caspase家族发挥着极为重要的调控作用。Bcl-2家族可分为抑制细胞凋亡的蛋白(Bcl-2、Bcl-xL等)和促进细胞凋亡的蛋白(Bax等)[28]。凋亡相关基因Bax与Bcl-2的比例是调节细胞凋亡的关键[29]。李世清等[30]研究显示,顺铂可通过活化caspases-3和抑制Bcl-2的表达来诱导癌细胞的凋亡。本研究结果表明,顺铂单独处理的A549细胞内Bcl-2表达降低,Bax和caspase-3的表达增加,提示顺铂可通过典型的线粒体途径诱导细胞凋亡。O-GSP提高了A549细胞中Bax与Bcl-2的比例导致细胞凋亡率显著增加。本实验结果显示顺铂与O-GSP联合处理细胞后,活性caspase-3的表达量显著增加,同时Bax与Bcl-2的比值增大,提高了细胞凋亡率。提示顺铂与O-GSP的联合作用促进A549细胞凋亡的作用机制与其可以共同下调Bcl-2的表达、上调Bax以及激活caspases-3的表达有关。
综上所述,O-GSP可以增强顺铂对肿瘤的杀伤作用,降低化疗的毒副作用。两者联用可促进肺癌细胞凋亡,这种促进细胞凋亡的作用机制不是由O-GSP的抗氧化作用所主导,而是与调节细胞凋亡相关基因的蛋白表达有关。
参考文献:
[1] 姚晓军, 刘伦旭. 肺癌的流行病学及治疗现状[J]. 现代肿瘤医学,2014, 22(8): 1982-1986. DOI:10.3969/j.issn.1672-4992.2014.08.74.
[2] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013[J].A Cancer Journal for Clinicians, 2013, 63(1): 11-30. DOI:10.3322/caac.21208.
[3] 葛信国, 张福产, 蒋小燕, 等. 保元排毒丸对顺铂肾损害的不同证型的临床疗效观察[J]. 时珍国医国药, 2009, 20(3): 721-722.DOI:10.3969/j.issn.1008-0805.2009.03.112.
[4] 孙舒玉, 何小鹃, 罗丹, 等. 黄芪多糖对顺铂治疗S180荷瘤鼠的增效减毒作用[J]. 中国中医基础医学杂志, 2013, 19(9): 1031-1033.
[5] 王黎, 陈洁, 裴瑞, 等. 灵芝多糖预处理对顺铂肾毒性和抑瘤率的影响[J]. 河南职工医学院学报, 2004, 16(3): 212-214. DOI:10.3969/j.issn.1008-9276.2004.03.002.
[6] 颜艳, 白文忠, 王立安, 等. 灵芝多糖对顺铂引起的呕吐具抑制作用[J]. 菌物学报, 2009, 28(3): 456-462. DOI:10.13346/j.mycosystema.2009.03.024.
[7] 李戈. 芎黄汤改善顺铂肾毒性疗效观察[J]. 辽宁中医杂志, 2006,33(4): 425-426. DOI:10.3969/j.issn.1000-1719.2006.04.029.
[8] 杨桂染, 李淑贞, 刘娜. 加味黄连阿胶汤对顺铂所致大鼠肾毒性的影响[J]. 中国慢性病预防与控制, 2010, 18(2): 162-163.DOI:10.16386/j.cjpccd.issn.1004-6194.2010.02.015.
[9] 郭磊, 杨静玉, 王芳, 等. 葡萄籽提取物化学成分及药理活性的研究进展[J]. 沈阳药科大学学报, 2008(增刊1): 32-34. DOI:10.14066/j.cnki.cn21-1349/r.2008.s1.109.
[10] BAO L, CAI X, ZHANG Z, et al. Grape seed procyanidin B2 ameliorates mitochondrial dysfunction and inhibits apoptosis via the AMP-activated protein kinase-silent mating typeinformation regulation 2 homologue 1-PPARγ co-activator-1α axis in rat mesangial cells underhigh-dose glucosamine[J]. The British Journal of Nutrition, 2014,113(1): 1-10. DOI:10.1017/S000711451400347X.
[11] MACKENZIE G G, ADAMO A M, DECKER N P, et al. Dimeric procyanidin B2 inhibitsconstitutively active NF-κB in Hodgkin’s lymphoma cells independently of the presence of IκB mutations[J].Biochemical Pharmacology, 2008, 75(7): 1461-1471. DOI:10.1016/j.bcp.2007.12.013.
[12] 连燕娜, 高丽萍, 郭豫, 等. 低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J]. 食品科学, 2016, 37(7): 182-186.DOI:10.7506/spkx1002-6630-201607033.
[13] 郭培培, 郭卓雨, 赵艳萌, 等. 葡萄籽原花青素对顺铂导致H9c2细胞毒性的保护作用[J]. 食品科学, 2014, 35(3): 213-216. DOI:10.7506/spkx1002-6630-201403043.
[14] 郭卓雨, 高丽萍, 赵艳萌, 等. 葡萄籽原花青素对顺铂诱导小鼠睾丸支持细胞TM4损伤的保护作用[J]. 肿瘤防治研究, 2015, 42(2):136-141. DOI:10.3971/j.issn.1000-8578.2015.02.008.
[15] 江海洋, 张华. 葡萄籽原花青素的研究进展[J]. 临床误诊误治, 2012,25(11): 97-100. DOI:10.3969/j.issn.1002-3429.2012.11.038.
[16] 王海, 连燕娜, 高丽萍. 低聚葡萄籽原花青素联合顺铂对A549细胞增殖及细胞周期的影响[J]. 食品科学, 2017, 38(7): 213-218.DOI:10.7506/spkx1002-6630-201707001.
[17] KART A, CIGREMI Y, KARAMAN M, et al. Caffeic acid phenethyl ester (CAPE) ameliorates cisplatin-induced hepatotoxicity in rabbit[J].Experimental and Toxicologic Pathology, 2009, 62(1): 45-52.DOI:10.1016/j.etp.2009.02.066.
[18] YOUSEF M I, SAAD A A, EL-SHENNAWY L K. Protective effect of grape seed proanthocyanidin extract against oxidative stress induced by cisplatin in rats[J]. Food and Chemical Toxicology, 2009, 47(6):1176-1183. DOI:10.1016/j.fct.2009.02.007.
[19] KINTZEL P E. Anticancer drug-induced kidney disorders[J]. Drug Safety, 2001, 24(1): 19-38. DOI:10.2165/00002018-200124010-00003.
[20] DAUGAARD G, ABILDGAARD U. Cisplatin nephrotoxicity[J].Cancer Chemotherapy and Pharmacology, 1989, 25: 1-9. DOI:10.1007/BF00694330.
[21] ZHANG X Y, BAI D C, WU Y J, et al.Proanthocyanidin from grape seeds enhances anti-tumoreffect of doxorubicin bothin vitroandin vivo[J]. Pharinazie, 2005, 60(7): 533-538.
[22] 李贞, 高丽萍. 氧化应激在顺铂肾毒性中的作用[J]. 广东医学, 2010,31(19): 2600-2602. DOI:10.3969/j.issn.1001-9448.2010.19.052.
[23] DASARI S, TCHOUNWOU P B. Cisplatin in cancer therapy:molecular mechanisms of action[J]. European Journal of Pharmacology, 2014, 740: 364-378. DOI:10.1016/j.ejphar.2014.07.025.
[24] BROZOVIC A, AMBRIOVIC-RISTOV A, OSMAK M. The relationship between cisplatin-induced reactive oxygen species,glutathione, and BCL-2 and resistance to cisplatin[J]. Critical Reviews Toxicology, 2010, 40(4): 347-359. DOI:10.3109/10408441003601836.
[25] HE Guodong, HE Guoliang, ZHOU Riyong, et al. Enhancement of cisplatin-induced colon cancer cells apoptosis by shikonin, a natural inducer of ROSin vitroandin vivo[J]. Biochemical Biophysical Research Communications, 2016, 469(4): 1075-1082. DOI:10.1016/j.bbrc.2015.12.100.
[26] WANG Ruixuan, MA Lijie, WENG Dan, et al. Gallic acid induces apoptosis and enhances the anticancer effects of cisplatin in human small cell lung cancer H446 cell line via the ROS-dependent mitochondrial apoptotic pathway[J]. Oncology Reports, 2016, 35(5):3075-3083. DOI:10.3892/or.2016.4690.
[27] 张军. 应用ROS抑制剂增强顺铂化疗敏感性的实验研究[D]. 武汉:武汉大学, 2013: 5-9.
[28] PRITCHARD J R, GILBERT L A, MEACHAM C E, et al. Bcl-2 family genetic profiling reveals microenvironment-specific determinants of chemotherapeutic response[J]. Cancer Research, 2011,71(17): 5850-5858. DOI:10.1158/0008-5472.CAN-11-1014.
[29] HASSAN M, WATARI H, ABUALMAATY A, et al. Apoptosis and molecular targeting therapy in cancer[J]. BioMed Research International, 2014: 150845. DOI:10.1155/2014/150845.
[30] 李世清, 陈福敏, 罗君, 等. 顺铂对结肠癌细胞株Caco-2增殖凋亡和Bcl-2、Caspase3、Caspase9蛋白表达的影响[J]. 世界华人消化杂志, 2015, 23(9): 1460-1464. DOI:10.11569/wcjd.v23.i9.1460.
DOI:10.7506/spkx1002-6630-201719028
中图分类号:Q946.8
文献标志码:A
文章编号:1002-6630(2017)19-0177-05
收稿日期:2017-01-16
基金项目:北京市自然科学基金项目(7163211)
作者简介:王海(1992—),男,硕士研究生,研究方向为生物活性物质对机体的生化作用。E-mail:916319176@qq.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为生物活性物质对机体的生化作用。E-mail:gaolip62@163.com
引文格式:
王海, 连燕娜, 周游, 等. 低聚葡萄籽原花青素联合顺铂对人肺腺癌细胞A549凋亡的影响[J]. 食品科学, 2017, 38(19):177-181. DOI:10.7506/spkx1002-6630-201719028. http://www.spkx.net.cn
WANG Hai, LIAN Yanna, ZHOU You, et al. Effect of oligomeric grape seed proanthocyanidins combined with cisplatin on the apoptosis of human lung adenocarcinoma cell line A549[J]. Food Science, 2017, 38(19): 177-181. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719028. http://www.spkx.net.cn