表1 TNF-α、IL-6、iNOS、β-肌动蛋白引物序列
Table 1 Primer sequences for TNF-α, IL-6, iNOS and β-actin
夏 炎1,管晓辉1,崔艳艳1,高 超1,陈 玲1,董 然2,沈明浩1,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;
2.长春科技学院,长白山生态资源开发 工程研究 中心,吉林 长春 130600)
摘 要:探讨蒲公英糖蛋白(glycoprotein fromTaraxacum,TG)对由脂多糖引起的RAW264.7细胞炎症的抗炎效果,并阐明其活性的基本分子机制。利用脂多糖刺激RAW264.7细胞,建立体外炎症模型,采用噻唑蓝比色法检测TG对RAW264.7细胞的增殖毒性,Griess试剂法检测了一氧化氮(nitric oxide,NO)的分泌情况,反转录聚合酶链式反应检测炎症细胞因子——白细胞介素-6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA以及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)mRNA的表达水平,酶联免疫吸附测定法测定IL-6和TNF-α的分泌量,Western blot检测P-IκB-α蛋白的表达水平,用以研究TG对核转录因子-κB(nuclear factor-kappa B,NF-κB)信号转导通路的抑制作用。结果表明:TG能够显著甚至极显著地抑制NO的分泌,IL-6、TNF-α、iNOS的mRNA的表达,IL-6和TNF-α的分泌(P<0.05、P<0.01)。TG高度显著上调了IκB-α的蛋白表达(P<0.001),并显著下调了P-IκB-α的蛋白表达(P<0.05),且与TG质量浓度成正比。其中在TG质量浓度为250、500、1 000 μg/mL时对TNF-α分泌量的抑制率分别为28.6%、65.4%、89.3%,对IL-6分泌量的抑制率分别为32.3%、54.1%、85.7%。TG间接抑制了NF-κB信号转导途径,有显著的体外抗炎效果且抗炎效果与TG的质量浓度呈剂量依赖性。
关键词:蒲公英;糖蛋白;炎症因子;核转录因子-κB
Abstract:To investigate the inhibitory effect ofTaraxacumglycoprotein on lipopolysaccharide-induced (LPS-induced)infl ammation in RAW264.7 cells and elucidate the underlying molecular mechanism, anin vitromodel of infl ammation in RAW264.7 macrophages stimulated by LPS was established. The proliferation of RAW264.7 cells were detected by 3-(4,5-dimeth yl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide (MTT) method and the secretion of nitric oxide (NO)was detected by Griess reagent method. The inhibitory effect ofTaraxacumglycoprotein on the mRNA expression of LPS-induced infl ammatory cytokines such as tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and inducible nitric oxide synthase (iNOS) in RAW264.7 cells was examined using reverse transcription-polymerase chain reaction, and the effect ofTaraxacumglycoprotein on the secretion levels of LPS-induced inflammatory cytokines such as TNF-α and IL-6 was detected by enzyme-linked immunosorbent assay as well as the effect on its upstream signaling proteins including P-IκB-α and IκB-α by Western blot. Results:Taraxacumglycoprotein could significantly inhibit the secretion of NO,the mRNA expression of IL-6, TNF-α and iNOS and the secretion of IL-6 and TNF-α (P< 0.05,P< 0.01, respectively).Taraxacumglycoprotein resulted in a signifi cant up-regulation of IκB-α protein expression (P< 0.001) and a signifi cant down-regulation of P-IκB-α in a concentration-dependent manner (P< 0.05). The percentage inhibition of TNF-α secretionwas 28.6%, 65.4% and 89.3%, and the percentage inhibition of IL-6 secretion was 32.3%, 54.1% and 85.7%, respectively, at concentrations of 250, 500 and 1 000 μg/mL. Conclusion: The nuclear factor-kappa B signal transduction pathway is indirectly inhibited by dandelion glycoprotein, and it has a signifi cant anti-infl ammatory effectin vitroin a dose-dependent manner.
Key words:TaraxacumF.H.Wigg.; glycoprotein; infl ammatory factor; nuclear factor-kappa B
蒲公英Taraxacum mongolicumHand.-Mazz.为菊科(Asteracea)蒲公英属(TaraxacumF.H.Wigg.),多年生草本植物[1]。蒲公英属植物是临床常用的中药材,也是菊科舌状花亚科(Cichorioideae Kitam)最进化类群之一,全世界约有2 000多种。我国拥有70余种蒲公英,其中东北占有11 种。蒲公英属植物在药物、食品、饲料等方面得到了普遍的应用,并具有一定观赏价值[2]。蒲公英遍布全国各地区,主要生长于内蒙古、东三省、甘肃等地,大多于山坡草地、路旁及田野处生长[1]。总的来说,蒲公英的来源比较广泛,加上其采集与加工比较简单,也比较容易制备,是一种物美价廉且营养丰富的绿色蔬菜。蒲公英用途很广,可食用和药用,甚至还可以用于化妆品中等,是极具开发前途的野菜资源[3]。现代大量研究表明,蒲公英性味甘平、无毒,具有广谱抑菌和明显的杀菌作用,还具有利尿保肝、清热解毒、消炎养胃、消肿散结等作用,有“天然抗生素”之美称[4]。医学研究表明,蒲公英可治疗多种急性炎症、上呼吸道感染、痢疾及各种疔疮疖肿等疾病[4-6]。近几年来的综合研究发现,蒲公英同时具备抗感染、抗病毒、抗肿瘤作用[7-8]。
炎症反应由有害病原体如入侵的细菌、病毒和其他病原体触发,对机体造成损伤性变化,用以消除有害的刺激,以及启动受损组织的愈合和修复过程[9-11]。越来越多的证据表明,炎症因子如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin 6,IL-6)的失调与多种疾病的发病有关,包括充血性心力衰竭、冠状动脉粥样硬化、阿尔茨海默病等[12],因此,抑制炎症因子可作为控制炎症的一个关键策略。
巨噬细胞在通过炎性介质,如一氧化氮(nitric oxide,NO)和炎症因子IL-6、TNF-α,所引起的炎症反应启动中起关键作用[13-15]。巨噬细胞被活化的细菌产物,如脂多糖(lipopolysaccharide,LPS),诱导产生局部炎症,在严重感染时并可能导致感染性休克。LPS刺激巨噬细胞引起炎症反应后,参与调控LPS炎症反应的主要下游信号通路是核转录因子-κB(nuclear factor-kappa B,NF-κB)信号转导通路和丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)信号转导通路[16]。伞治豪[17]对蒲公英甾醇调节LPS诱导的乳腺炎抗炎作用及机制进行了研究。Park等[18-19]对蒲公英多糖通过调节RAW264.7细胞中的PI3K-Akt信号转导通路来抑制NF-κB诱导的炎症和促进Nrf 2诱导抗氧化的潜力进行了研究,并且也对蒲公英多糖减轻CCl4诱导的急性肝损伤进行了研究。平家奇[20]对蒲公英提取物的体内外抗炎作用进行了研究。但目前对蒲公英糖蛋白(glycoprotein fromTaraxacum,TG)的研究大多集中在对其抗氧化部分,对于其抗炎效果研究较少。
本实验以蒲公英为原料,提取TG并纯化,以LPS刺激小鼠RAW264.7巨噬细胞建立体外炎症模型,对TG的抗炎效果及其相关作用机制进行研究,为今后有关TG的抗炎效果及其机理的研究提供参考依据。
1.1 材料与试剂
RAW264.7小鼠巨噬细胞为中国人民解放军军事医学科学院军事兽医研究所刘文森研究员惠赠。
LPS、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT),均为分析纯美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(分析纯) 北京化工厂;RPMI1640培养液、胎牛血清、胰酶 美国Gibco公司;TNF-α、IL-6细胞因子酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 美国BioLegend公司;RNA提取试剂盒、反转录试剂盒、鼠二抗、兔二抗 生工生物工程(上海)股份有限公司;细胞蛋白抽提试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒长春鼎国生物科技公司;β-肌动蛋白(ab8226)、IκB-α(ab32518)、P-IκB-α(ab12135)单克隆抗体 英国Abcam公司;鲁米诺化学发光试剂盒 美国CE公司。其余试剂均为国产分析纯。
1.2 仪器与设备
HVE-50型高压蒸汽灭菌锅 日本Hirayama公司;BB150型CO2培养箱 美国Thermo公司;Sorvall Legend Micro 21型高速冷冻离心机 德国Thermo公司;DW-86L386型超低温冰箱、HR40-ⅡA2型生物安全柜青岛海尔有限公司;Infinite F500型多功能高端酶标仪奥地利Tecan公司;Trans-Blot SD型转印槽 美国Bio-Rad公司;AlphaImager HP高端凝胶成像系统 美国Alpha Lnnotech公司;G1000型基因扩增仪 杭州博日科技有限公司;CKX31型倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 蒲公英粗糖蛋白的提取
将蒲公英粉末脱色脱脂后风干并在干燥皿中贮存备用。准确称取经预处理的蒲公英100 g,置于1 000 mL的烧杯中,于80 ℃水浴中提取,真空抽滤、浓缩。采用Sevag法脱蛋白,Sevag试剂为体积比为5∶1的三氯甲烷∶正丁醇。提取液中加入适量无水乙醇,产生沉淀,醇沉后于3 000 r/min离心45 min得到的沉淀即为粗TG。
1.3.2 蒲公英粗糖蛋白的制备
TG的纯化依照文献[21-22]中的方法。利用DEAE-52纤维素柱(26 mm×40 cm)对粗糖蛋白进行纯化。先将提取得到的粗糖蛋白用蒸馏水配成质量浓度为0.5 g/mL的样液,上样量为10 mL,分别用蒸馏水、0.1、0.2、0.3 mol/L NaCl溶液洗脱;洗脱速率为0.5 mL/min,分管收集,每管10 mL。用紫外-可见分光光度计在280 nm波长处测量蛋白质吸收峰,同时用硫酸-蒽酮法在490 nm波长处测定糖吸收峰,收集多糖和蛋白重叠的峰所对应的产物,浓缩、透析、冷冻干燥可得到TG的纯品[23-24]。
1.3.3 糖含量的测定
采用硫酸-蒽酮法测定糖含量,以葡萄糖为标准品。糖含量测定中标准曲线的绘制:分别移取质量浓度为0.2 mg/mL的葡萄糖标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL置于7 支试管中,加水至2.0 mL,采用硫酸-蒽酮法测定葡萄糖含量,于490 nm波长处测定吸光度,以吸光度为纵坐标,以葡萄糖的质量浓度为横坐标,绘制标准曲线,并计算得出回归方程:y=0.289x-0.003,R2=0.997 0。
1.3.4 蛋白含量的测定
采用BCA法测定蛋白含量。标准曲线的绘制:分别移取质量浓度为0.5 mg/mL的蛋白标准品0.0、1.0、2.0、4.0、8.0、12.0、16.0、20.0 μL加到96 孔板中,每孔再加入磷酸盐缓冲液补足到20 μL,每孔加入BCA工作液200 μL(V(A液)∶V(B液)=50∶1),37 ℃孵育30 min,于562 nm波长处测量吸光度,以吸光度为纵坐标,以蛋白的质量浓度为横坐标,绘制标准曲线,并计算得出回归方程:y=1.956x-0.233,R2=0.999 0。
1.3.5 细胞培养
RAW264.7细胞在含8%胎牛血清的RPMI1640培养基中,于37 ℃、5% CO2恒温培养箱中常规培养。
1.3.6 MTT法测定TG对RAW264.7细胞活性的影响
向96 孔板的各孔中加入100 μL的浓度为7×104mL-1的RAW264.7细胞,放入37 ℃、5% CO2培养箱中培养过夜。吸去原培养液,加入不同质量浓度(0.0、62.5、125.0、250.0、500.0、1 000.0、2 000.0、4 000.0 μg/mL)的TG溶液,作用于RAW264.7细胞。每孔100 μL,设4 个重复,放入37 ℃、5% CO2培养箱中培养20 h。取出后,向各孔中加入10 μL质量浓度为5 μg/μL的MTT试剂,继续培养4 h。吸走原培养液,每孔加入100 μL DMSO,摇床振荡5~10 min,于490 nm波长处测定各孔吸光度。
1.3.7 Griess试剂法测定NO含量
取1.0 mL对数生长期的RAW264.7细胞(5×105mL-1)接种于6 孔板,于37 ℃、5% CO2培养箱中培养过夜。每孔分别加入1 mL TG(质量浓度根据1.3.6节的实验结果选择)和LPS(质量浓度为100 ng/mL)的混合液,作为TG组。同时,设LPS组(质量浓度为100 ng/mL的LPS)和空白对照组(只加培养液),每组3 个重复。TG组加入不同质量浓度的TG 1 h后,再加入LPS共同培养24 h。24 h后收集RAW264.7细胞,采用Griess试剂法测定TG组、LPS组和空白对照组的NO含量。
1.3.8 TNF-α、IL-6、iNOS、β-肌动蛋白mRNA表达含量的测定
取1.0 mL对数生长期的RAW264.7细胞(5×105mL-1)接种于6 孔板,于37 ℃、5% CO2培养箱中培养过夜。分组同1.3.7节。24 h后收集RAW264.7细胞,利用RNA提取试剂盒提取总RNA。采用Primer 5软件进行引物设计,并由生工生物工程(上海)股份有限公司进行引物合成,引物如表1所示。按反转录试剂盒进行逆转录,然后进行反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)。产物经电压为110 V、时间为25 min、1%的琼脂糖凝胶电泳,分析电泳结果,测定TNF-α、IL-6、iNOS、β-肌动蛋白的mRNA表达含量,用TNF-α、IL-6、iNOS与β-肌动蛋白mRNA表达含量的比值来表征TNF-α、IL-6、iNOS的mRNA相对表达水平。其中iNOS退火温度为58 ℃;TNF-α退火温度为58 ℃;IL-6退火温度为 59 ℃;β-肌动蛋白退火温度为55 ℃。
表1 TNF-α、IL-6、iNOS、β-肌动蛋白引物序列
Table 1 Primer sequences for TNF-α, IL-6, iNOS and β-actin

1.3.9 Western blot法检测P-IκB-α和IκB-α的表达
取3.0 mL对数生长期的RAW264.7细胞(1×107mL-1)接种于60 mm的孔板,于37 ℃、5% CO2培养箱中培养过夜。分组同1.3.7节。培养4 h后收集细胞,提取总蛋白。采用Western blot法测定蛋白含量。根据所提蛋白的大小制胶、点样、电泳,切取所需蛋白胶进行转膜、封闭、洗膜,将膜清洗后放入含有第一抗体的密封袋中,置于摇床上,4 ℃孵育过夜。第一抗体孵育完取出膜放入含有1×磷酸盐-吐温缓冲液的平皿中洗脱5 次,每次5 min,取出聚偏氟乙烯膜后,加入辣根过氧化物酶标记的第二抗体,室温孵育1 h,孵育完取出膜再用1×磷酸盐-吐温缓冲液洗涤5 次,每次l5 min。洗完后取出聚偏氟乙烯膜,利用鲁米诺化学发光试剂盒进行发光,放入仪器中扫描。用P-IκB-α和IκB-α与β-肌动蛋白含量的比值表征P-IκB-α和IκB-α的相对表达量。重复3 次实验。1.3.10 ELISA法测量TNF-α、IL-6的质量浓度
取200 μL对数生长期的RAW264.7细胞(5×105mL-1)接种于24 孔板,于37 ℃、5% CO2培养箱中培养过夜。分组同1.3.7节。培养24 h后收集细胞上清液,通过ELISA试剂盒对上清液中的TNF-α、IL-6质量浓度进行检测。重复3 次实验。按照下式计算TG对TNF-α或IL-6的抑制率(I)。
式中:ρn为LPS对照组中TNF-α或IL-6的质量浓度/(pg/mL);ρc为空白对照组中TNF-α或IL-6的质量浓度/(pg/mL);ρs为TG组中TNF-α或IL-6的质量浓度/(pg/mL)。
1.4 统计学分析
数据均采用 ±s表示,数据间差异显著性采用SPSS 17.0软件中的t检验完成。
2.1 TG对RAW264.7细胞活性的影响
结果如图1所示,TG质量浓度在0~1 000 μg/mL的范围内,对RAW264.7细胞活性没有影响,故选择TG质量浓度250、500、1 000 μg/mL作为低、中、高剂量,即TG组所用的质量浓度。

图1 TG对RAW264.7细胞活性的影响(n=55)
Fig. 1 Effect of TG on the viability of RAW264.7 cells (n= 5)
2.2 TG对RAW264.7细胞分泌NO的影响
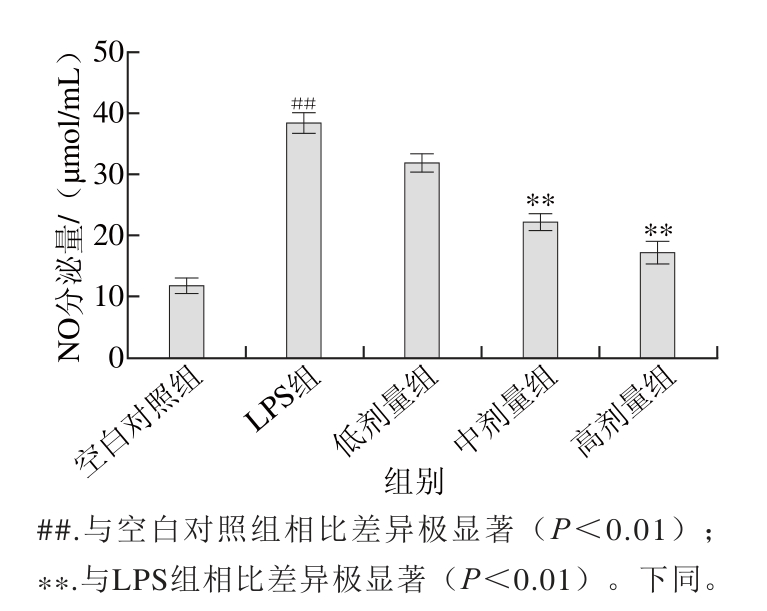
图2 TG对被LPS诱导的RAW264.7细胞分泌NO的影响(n=44)
Fig. 2 Ef fect of TG on LPS-induced secretion of NO in RAW264.7 cells (n= 4)
由图2可以看出,与空白对照组相比,100 ng/mL的LPS单独作用RAW264.7细胞24 h后,能极显著提高NO的分泌量(P<0.01)。TG预处理细胞1 h后,与LPS组相比,中、高剂量组处理均能极显著地降低NO的分泌量(P<0.01),而低剂量组与LPS组相比差异不显著(P>0.05)。
2.3 TG对RAW264.7细胞iNO S的mRNA表达的影响
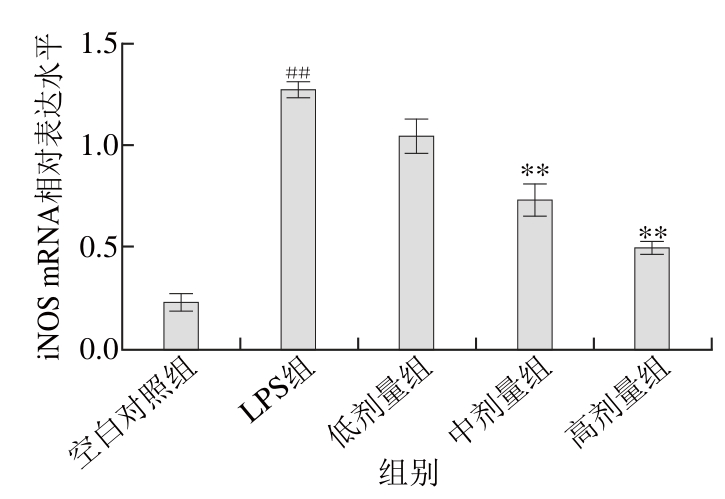
图3 TG对RAW264.7细胞iNOS的mRNA表达的影响(n=44)
Fig. 3 Effect of TG on iNOS mRNA expression in RAW264.7 cells stimulated by LPS (n= 4)
根据图3可知,在LPS刺激RAW264.7细胞24 h后,与空白对照组相比,其iNOS的mRNA表达水平有着极显著的提高(P<0.01)。TG组呈剂量依赖关系抑制iNOS的mRNA表达,与LPS组相比较,低、中、高剂量组均有一定的抑制作用,高、中剂量组的作用极显著(P<0.01),低剂量组无显著抑制作用(P>0.05)。
2.4 TG对RAW264.7细胞TNF-α的mRNA表达的影响
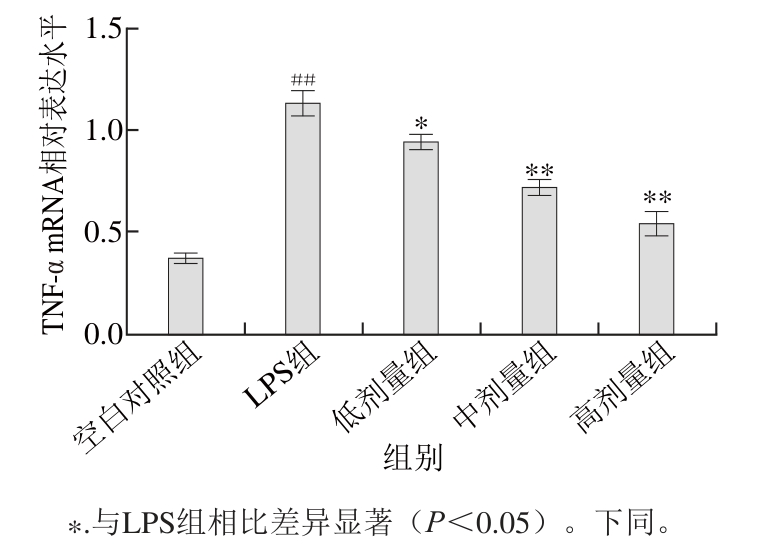
图4 TG对被LPS刺激的RAW264.7细胞TNNFF--α mmRRNNAA表达的影响(n=44)
Fig. 4 Effect of TG on TNF-α mRNA expression in RAW264.7 cells stimulated by LPS (n= 4)
根据图4可知,在LPS刺激RAW264.7细胞24 h后,与空白对照组相比,其TNF-α的mRNA的表达水平有着极显著的提高(P<0.01),TG组呈剂量依赖关系抑制TNF-α的mRNA的表达。与LPS组相比较,低剂量组的抑制作用显著(P<0.05),而高、中剂量组的抑制作用极显著(P<0.01)。
2.5 TG对RAW264.7细胞IL-6的mRNA表达的影响
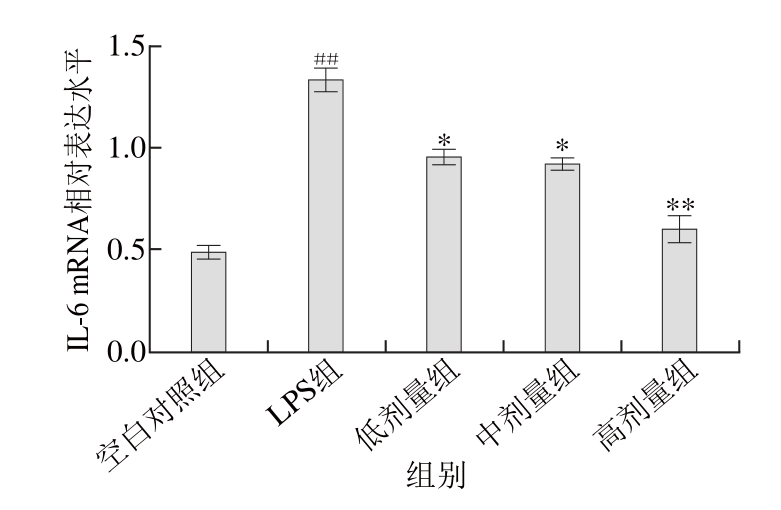
图5 TG对RAW264.7细胞IL-6的mRNA表达的影响(n=44)
Fig. 5 Effect of TG on IL-6 mRNA expression in RAW264.7 cells stimulated by LPS (n= 4)
根据图5可知,在LPS刺激RAW264.7细胞24 h后,与空白对照组相比,其IL-6的mRNA的表达水平有极显著提高(P<0.01),TG组呈剂量依赖关系抑制IL-6 mRNA的表达。与LPS组相比较,高剂量组的抑制作用极显著(P<0.01),低、中剂量组抑制作用显著(P<0.05)。
2.6 TG对RAW264.7细胞P-IκB-α和IκB-α蛋白表达的影响
根据图6A可知,小鼠RAW264.7细胞经LPS刺激4 h后,与空白对照组相比较,LPS组的P-IκB-α的表达极显著增高(P<0.01)。TG组呈剂量依赖关系抑制P-IκB-α蛋白的表达,与LPS组相比,低剂量组中P-IκB-α蛋白表达显著降低(P<0.05),中剂量组的抑制作用极显著(P<0.01),高剂量组的抑制作用高度显著(P<0.001)。
根据图6B可知,LPS组的IκB-α蛋白的表达量极显著降低(P<0.01),加入TG后,中、高剂量组的IκB-α的表达量高度显著增加(P<0.001)。结果表明TG可以有效抑制IκB-α的磷酸化。

图6 TG对RAW264.7细胞PP--II κBB--α(AA)和IIκBB--α(B)的蛋白表达的影响(n=33)
Fig. 6 Effect of TG on the expression of P-IκBB--α (A) and IκBB--α (B)proteins in RAW264.7 cells stimulated by LPS (n= 3)
2.7 TG对RAW264.7细胞TNF-α分泌的影响
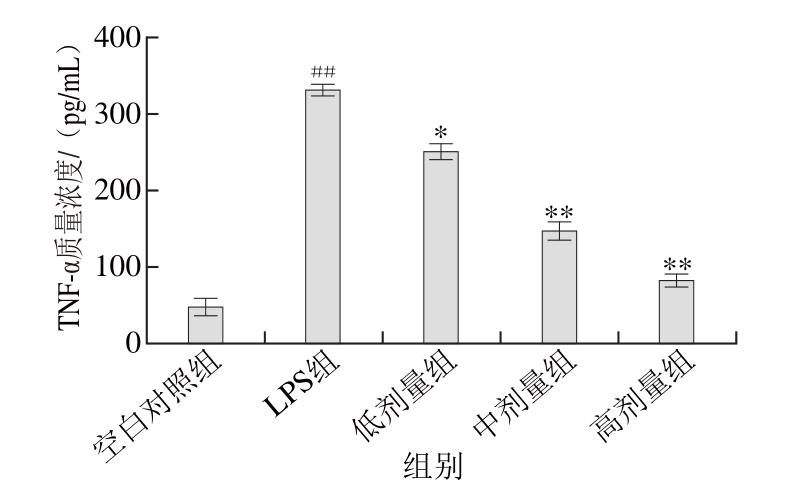
图7 TG对被LPS刺激的RAW264.7细胞TNNFF--α分泌的影响(n=44)
Fig. 7 Effect of TG on TNF-α secretion in RAW264.7 cells stimulated by LPS (n= 4)
根据图7可知,与空白对照组相比较,LPS刺激小鼠RAW264.7细胞24 h后,TNF-α含量极显著升高(P<0.01)。但是,TG组呈剂量依赖关系抑制TNF-α分泌,且差异显著(P<0.05)或极显著(P<0.01)。其中,250、500、1 000 μg/mL的TG处理时,与LPS组相比,对TNF-α分泌量的抑制率分别为28.6%、65.4%、89.3%。
2.8 TG对小鼠RAW264.7细胞IL-6分泌的影响

图8 TG对被LPS刺激的RAW264.7细胞IL-6分泌的影响(n=44)
Fig. 8 Effect of TG on IL-6 secretion in RAW264.7 cells stimulated by LPS (n= 4)
根据图8可知,与空白对照组相比较,LPS刺激小鼠RAW264.7细胞24 h后,IL-6水平极显著升高。但是,TG组呈剂量依赖关系抑制IL-6分泌,在高剂量组中下降极显著(P<0.01),在中、低剂量组中下降显著(P<0.05)。其中,在250、500、1 000 μg/mL的TG处理时,与LPS组相比,对IL-6分泌量的抑制率分别为32.3%、54.1%、85.7%。
糖蛋白是一类由糖类与多肽或蛋白质以共价键连接而形成的结合蛋白[25]。据报道,天然植物糖蛋白具有调节免疫、抗肿瘤、抗炎、降血糖、降 血脂、抗氧化、防衰老等功效[26]。师超等[27]研究发现黄肉甘薯糖蛋白对邻苯三酚自氧化产生的超氧阴离子自由基和Fe-H2O2体系产生的羟自由基和H2O2具有较高的清除活性。韩澄等[28]研究表明茶叶糖蛋白可通过促进细胞分泌NO和炎症因子,起到活化RAW264.7细胞和调节机体免疫的功效。钟洁[24]研究发现TG有较强的清除自由基和抗氧化活性能力。但目前对TG的研究大多集中在其抗氧化的研究,而本研究的目的是探讨TG对RAW264.7细胞的抗炎效果影响,并阐明其体外抗炎作用的基本作用机制。
LPS是革兰氏阴性细菌细胞壁的主要成分,能与Toll样受体4(Toll-like receptor 4,TLR4)结合,诱导巨噬细胞产生炎症[29]。LPS刺激后,巨噬细胞合成和释放炎症因子,其中主要的有TNF-α和IL-6,这些炎症因子不仅参与炎症反应,还加速炎症性疾病的发展。因此,阻断炎症因子是抑制炎症的一个有效治疗策略。如图3~5所示,LPS处理导致iNOS、TNF-α和IL-6的mRNA的表达极显著增加(P<0.01),而在TG处理能显著甚至极显著抑制了iNOS、TNF-α和IL-6的mRNA的表达水平(P<0.05,P<0.01),并且呈剂量依赖关系。在图7~8中LPS均能导致TNF-α和IL-6的分泌极显著增加(P<0.01),而在TG高剂量组处理均极显著抑制了TNF-α和IL-6的分泌(P<0.01),与RT-PCR结果一致。
最近的几项研究表明,被LPS诱导炎症的炎症因子的产生与NF-κB被激活有关[30],并认为NF-κB信号转导通路是LPS所介导的巨噬细胞炎症反应的中心环节[31]。NF-κB是主要的转录因子之一,在iNOS、TNF-α和IL-6等的表达中起着重要的作用。在静息状态下,IκB-α以失活状态被局限在细胞质中,在LPS刺激作用下,IκB发生磷酸化,NF-κB从IκBs复合物中分离,导致NF-κB持续活化并从细胞质转移到细胞核中,与靶基因的启动子结合并激活转录,从而导致NO、TNF-α、IL-6的合成和分泌,诱发炎症。因此,抑制NF-κB通路是抗炎药物的重要靶点。所以,可以通过研究TG影响IκB的磷酸化来确定其是否抑制NF-κB信号通路的活化,从而减少炎症因子等的生成。Western blot的结果表明TG明显抑制了IκB的磷酸化,且随着TG质量浓度的增加呈剂量依赖性,间接证明TG能通过抑制NF-κB信号转导通路的活化而起到了抗炎的作用。
向被LPS刺激的RAW264.7细胞加入不同质量浓度的TG,分析其对RAW264.7细胞的NO、TNF-α、IL-6分泌量及iNOS、TNF-α、IL-6的mRNA表达水平的影响。结果发现,TG能显著抑制RAW264.7细胞的NO、TNF-α和IL-6分泌和iNOS、TNF-α、IL-6的mRNA表达,且成剂量依赖关系;此外,TG的质量浓度与IκB-α蛋白磷酸化水平的抑制率呈正比关系。
综上所述,蒲公英糖蛋白对NF-κB信号途径有一定的调控作用,并且有显著的体外抗炎效果,为进一步深入研究蒲公英糖蛋白对巨噬细胞的体外抗炎活性及其相关机制提供参考。
参考文献:
[1] 林云, 江林, 蒋健, 等. 蒲公英的药理作用研究进展[J]. 中国现代中药, 2011, 13(8): 42-47. DOI:10.13313/j.issn.1673-4890.2011.08.023.
[2] 张建. 蒲公英属植物繁殖生物学研究[D]. 沈阳: 沈阳农业大学,2013: 1.
[3] 李景华, 刘玉芹, 王黎明. 蒲公英属植物研究进展[J]. 吉林医药学院学报, 2011, 32(3): 160-166. DOI:10.3969/j.is sn.1673-2995(2011)03-0160-07.
[4] 肖玫, 杨进, 曹玉华. 蒲公英的营养价值及其开发利用[J]. 中国食物与营养, 2005, 11(4): 47-48. DOI:10.3969/j.issn.1006-9577.2005.04.015.
[5] 翟彦民, 张秀玲, 于成华. 野生蔬菜蒲公英的开发利用[J]. 安徽农业科学, 2007, 35(12): 3529; 3540. DOI:10.3969/j.issn.0517-6611.2007.12.043.
[6] 唐美霞, 王福宁, 王涛. 蒲公英利用现状及开发前景的探讨[J]. 青海草业, 2015, 24(1): 39-44. DOI:10.3969/j.issn.1008-1445.2015.01.009.
[7] 杜军英, 姜东伯, 狄柯坪, 等. 蒲公英抑菌抗炎作用的研究进展[J].白求恩军医学院学报, 2012, 10(2): 128-131. DOI:10.3969/j.issn.1672-2876.2012.02.034.
[8] 吉枫, 丛晓东, 张云, 等. 蒲公英药理作用综述[J]. 亚太传统医药,2011, 7(9): 173-175. DOI:1673-2197(2011)09-0173-03.
[9] LEE F D. Cells tissues and disease[M]. New Jersey: Blackwell Science, 1996: 710.
[10] GOUWY M, STRUYF S, PROOST P, et al. Synergy in cytokine and chemokine networks amplifi es the infl ammatory response[J]. Cytokine and Growth Factor Reviews, 2005, 16(6): 561-580. DOI:10.1016/j.cytogfr.2005.03.005.
[11] MARIATHASAN S, MONACK D M. Inflammasome adaptors and sensors: intracellular regulators of infection and infl ammation[J]. Nature Reviews Immunology, 2007, 7(1): 31-40. DOI:10.1038/nri1997.
[12] 吴洪福, 耿排力. 炎症细胞因子网络与疾病[J]. 青海医学院学报,2003, 24(4): 267-270. DOI:10.3969/j.issn.1006-8252.2003.04.025.
[13] SUNG N Y, JUNG P M, YOON M, et al. Anti-inflammatory effect of sweetfish-derived protein and its enzymatic hydrolysate on LPS-induced RAW264.7 cells via inhibition of NF-κB transcription[J].Fisheries Science, 2012, 78(2): 381-390. DOI:10.1007/s12562-011-0461-5.
[14] WECKMANN A L, ALCOCERVARELA J. Cytokine inhibitors in autoimmune disease[J]. Semin Arthritis Rheum, 1996, 26(2): 539-557.DOI:10.1016/S0049-0172(96)80042-4.
[15] ELENKOV I J, CHROUSOS G P. Stress hormones, proinfl ammatory and antiinfl ammatory cytokines, and autoimmunity[J]. Annals of the New York Academy Sciences, 2002, 966(1): 290-303. DOI:10.1111/j.1749-6632.2002.tb04229.x.
[16] RIETSCHEL E T, BRADE H. Bacterial endotoxins[J]Scientific American, 1992, 267(2): 54-61. DOI:10.1038/scientifi camerican0892-54.
[17] 伞治豪. 蒲公英甾醇对LPS诱导的乳腺炎抗炎作用及调节机制研究[D].长春: 吉林大学, 2014: 13-71.
[18] PARK C M, CHO C W, SONG Y S. Top 1 and 2, polysaccharides fromTaraxacum officinale, inhibit NF-κB-mediated inflammation and accelerate Nrf2-induced antioxidative potential through the modulation of PI3K-Akt signaling pathway in RAW264.7 cells[J].Food and Chemical Toxicology, 2014, 66: 56-64. DOI:10.1016/j.fct.2014.01.019.
[19] PARK C M, YOUN H J, CHANG H K, et al. Top 1 and 2,polysaccharides fromTaraxacum offi cinale, attenuate CCl(4)-induced hepatic damage through the modulation of NF-κB and its regulatory mediators[J]. Food and Chemical Toxicology, 2010, 48(5): 1255-1261.DOI:10.1016/j.fct.2010.02.019.
[20] 平家奇. 蒲公英提取物体内外抗炎作用的研究[D]. 延吉: 延边大学,2010: 1-26.
[21] 陈双. 玉竹糖蛋白的分离纯化及抗氧化作用研究[D]. 西安: 陕西师范大学, 2010: 4-30.
[22] 范勇, 李宝宝, 毛苇, 等. 巨大型蒲公英小分子量糖蛋白的制备及抗氧化活性分析[J]. 南方农业学报, 2015, 46(3): 486-491.DOI:10.3969/j:issn.2095-1191.2015.3.486.
[23] 杜晓旭, 钟洁, 段玉峰, 等. 蒲公英糖蛋白的分离纯化及结构分析[J]. 食品工业科技, 2012, 33(8): 198-200. DOI:10.13386/j.issn1002-0306.2012.08.034.
[24] 钟洁. 蒲公英糖蛋白的分离纯化、结构表征及体外抗氧化研究[D].西安: 陕西师范大学, 2010: 1-45.
[25] 刘兴华, 赵浩如. 天然糖蛋白的提取、分离与纯化[J]. 药学进展,2006, 30(12): 542-547. DOI:10.3969/j.issn.1001-5094.2006.12.003.
[26] 张淑媛, 吴蕾, 庞广昌, 等. 植物糖蛋白的提取及其生物活性研究进展[J]. 食品研究与开发, 2010, 31(4): 174-176. DOI:10.3969/j.issn.1005-6521.2010.04.053.
[27] 师超, 林江涛, 卞科. 黄肉甘薯糖蛋白的抗氧化作用研究[J]. 安徽农学通报, 2013(18): 18-19. DOI:10.3969/j.issn.1007-7731.2013.18.011.
[28] 韩澄, 陈一晴, 黄丹菲, 等. 茶叶糖蛋白对RAW264.7细胞分泌作用的影响[J]. 北京联合大学学报(自然科学版), 2011, 25(4): 23-25.DOI:10.3969/j.issn.1005-0310.2011.04.009.
[29] ROSSOL M, HEINE H, MEUSCH U, et al. LPS-induced cytokine production in human monocytes and macrophages[J]. Critical Reviews in Immunology, 2011, 31(5): 379-446. DOI:10.1615/CritRevImmunol.v31.i5.20.
[30] PAN M H, LIN-SHIAU S Y, LIN J K. Comparative studies on the suppression of nitric oxide synthase by curcumin and its hydrogenated metabolites through down-regulation of IκB kinase and NF-κB activation in macrophages[J]. Biochemical Pharmacology, 2000,60(11): 1665-1676. DOI:10.1016/S0006-2952(00)00489-5.
[31] ZHANG G, GHOSH S. Molecular mechanisms of NF-κB activation induced by bacterial lipopolysaccharide through Toll-like receptors[J]. Journal of Endotoxin Research, 2000, 6(6): 453-457.DOI:10.1179/096805100101532414.
Inhibitory Effect ofTaraxacumGlycoprotein on Lipopolysaccharide-Induced Infl ammation via Regulating NF-κB Pathway
XIA Yan1, GUAN Xiaohui1, CUI Yanyan1, GAO Chao1, CHEN Ling1, DONG Ran2, SHEN Minghao1,*
(1. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China;2. Changbai Mountain Ecological Resources Development Engineering Research Center,Changchun Science and Technology College, Changchun 130600, China)
DOI:10.7506/spkx1002-6630-201719029
中图分类号:R966
文献标志码:A
文章编号:1002-6630(2017)19-0182-07
收稿日期:2016-08-14
基金项目:吉林省科技厅科技支撑项目(20100259)
作者简介:夏炎(1990—),男,硕士,研究方向为食品毒理与安全评价。E-mail:1426634384@qq.com
*通信作者:沈明浩(1963—),男,教授,博士,研究方向为胚胎毒理、实验动物模型、胚胎移植及食品安全评价。
E-mail:shenmh2003@163.com
引文格式:
夏炎, 管晓辉, 崔艳艳, 等. 蒲公英糖蛋白体外抗炎作用及对NF-κB信号通路的调控[J]. 食品科学, 2017, 38(19): 182-188.DOI:10.7506/spkx1002-6630-201719029. http://www.spkx.net.cn
XIA Yan, GUAN Xiaohui, CUI Yanyan, et al. Inhibitory effect ofTaraxacumglycoprotein on lipopolysaccharide-induced infl ammation via regulating NF-κB pathway[J]. Food Science, 2017, 38(19): 182-188. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719029. http://www.spkx.net.cn