表1 实验小鼠药剂分配
Table 1 Doses of normal saline, DMPS and MTs administered to experimental mmiiccee
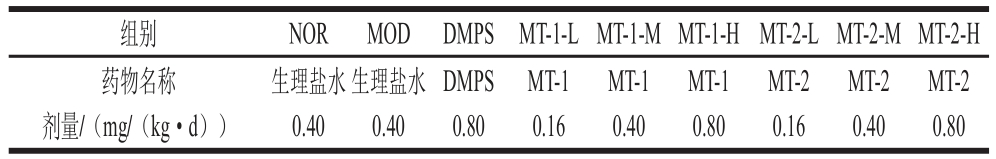
注:剂量均以体质量计。
王欣卉1,王 颖1,2,*,佐兆杭1,刘淑婷1,宫 雪1,徐炳政3,张东杰1,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.青岛琅琊台集团股份有限公司,山东 青岛 266400)
摘 要:目的:探讨两种具自主知识产权酵母源金属硫蛋白(metallothione in,MT)(MT-1、MT-2)对慢性汞中毒小鼠排汞及汞致肝脏损伤的修复作用。方法:慢性汞中毒模型通过实验小鼠自由饮用氯化汞去离子水溶液构建,经连续灌胃给予二巯基丙磺酸钠及不同剂量酵母源MT(0.16 、0.40 、0.80 mg/(kg·d))28 d后,测定实验小鼠体质量、肝脏脏器系数、血液及肝脏汞含量、4 项血常规(白细胞计数、红细胞计数、血小板计数、血红蛋白含量)、肝功能指示指标并观察慢性汞中毒小鼠肝脏组织病变程度。结果:与模型对照组比较,各灌胃给药组小鼠体质量均不同程度提高,肝脏脏器系数显著下降(P<0.05),血液及肝脏汞含量显著下降(P<0.05),白细胞、红细胞、血红蛋白含量及血小板计数均有不同程度恢复,其恢复效果与剂量呈正相关。与模型对照组比较,各酵母源MT灌胃给药组小鼠血清谷丙转氨酶及谷草转氨酶含量均有所下降,且综合肝脏组织病理学染色切片结果,酵母源MT可修复汞中毒小鼠肝脏组织,使水肿肝脏细胞恢复其正常形态,减少细胞间炎性浸润现象,且两种酵母源MT修复受损肝脏的能力与剂量呈正相关,高剂量酵母源MT对受损肝脏的修复效果更佳。结论:综合各项检测结果,两种酵母源MT对慢性汞中毒小鼠具有良好的排汞及修复汞致肝脏损伤效果,且酵母源MT-1对慢性汞中毒小鼠排汞及修复受损肝脏组织的效果好于酵母源MT-2及二巯基丙磺酸钠。
关键词:酵母源金属硫蛋白;汞中毒;排汞;肝脏;修复作用
Abstract:Purpose: To evaluate the effect of two metallothioneins from yeast (MT-1 and MT-2) with self-owned intellectual property right on mercury elimination and liver damage repair in mice with chronic mercury poisoning. Methods: A mouse model of chronic mercury poisoning was established by giving the mice free access to deionized water containing mercuric chloride, and then the mice were orally administered with MT or dimercaptopropansulfonate sodium (DMPS) for 28 days.Body weight, liver index, blood and liver mercury levels, blood physiological and biochemical indicators and liver function were measured after the last administration. Results: Compared with the model group, the body weights of mice administered with MT were increased, the liver indexes and blood mercury and liver mercury levels were decreased signifi cantly (P<0.05), and white blood cell (WBC), red blood cell (RBC), platelet (PLT) and hemoglobin (HGB) levels were restored to different extents in a dose-dependent manner. Compared with the model group, the levels of serum ALT and AST in mice administered with MT were decreased. Based on these fi ndings together with pathological examination, we found that MT could repair damaged liver tissues of mice with chronic mercury poisoning, restore liver cell edema to normal morphology,and reduce intercellular infl ammatory infi ltration and the effect was dose-dependent. Conclusions: Both metallothioneinsfrom yeast have good effi cacy in eliminating mercury and repairing damaged liver tissues in mice with chronic mercury poisoning, and MT-1 was superior to MT-2 and DMPS.
Key words:metallothionein from yeast; mercury poisoning; mercury elimination; liver; repair effect
近年来,汞作为全球危害性极强的污染物,已引起了各界学者们的广泛关注[1-3]。自然界的汞可通过食物链的富集作用进入人体,在人体中以Hg2+形式存在[4-5],Hg2+可与血液中红细胞及血红蛋白中的巯基结合,并随血液循环蓄积于肝脏等组织中[6],同时Hg2+可与肝脏细胞膜表面巯基蛋白结构结合,使之变性失活,并可使细胞内外Ca2+浓度差改变,造成细胞水肿,产生炎症损伤[7-9]。
金属硫蛋白(metallothionein,MT)为胞内功能性蛋白质,其结构内富含巯基,易与金属离子结合[10-13],具有排除体内重金属离子、抑制机体产生过氧化反应及修复重金属离子致机体受损组织的作用[14-15]。酵母源MT由Zn2+诱导酵母细胞表达产生,较比传统方生产的兔肝MT具有生产周期短,提取方法简单的特点[16]。本实验以二巯基丙磺酸钠(dimercaptopropansulfonate sodium,DMPS)为对照,探究具自主知识产权酵母源MT促排Hg2+及其对汞致肝脏损伤的修复作用,旨在为其在排出机体内Hg2+及修复受损肝脏组织提供理论依据及数据支持。
1.1 动物、材料与试剂
昆明雄性小鼠:SCXK(吉)2011-0003,体质量(18±2)g,由长春生物制品研究所有限责任公司提供。
酵母源MT(MT-1、MT-2,纯度95%) 黑龙江八一农垦大学食品学院自主提取;DMPS(纯度95%)上海研臣实业有限公司;HgCl2(纯度99.5%) 上海抚生生物技术有限公司;肝素钠、二甲苯、无水乙醇、氨水、苏木精、伊红染液 南京建成生物工程研究所。
1.2 仪器与设备
YB-P50001型电子天平 北京长拓锐新科技发展有限公司;AFS-920双道原子荧光光度计 北京吉天仪器有限公司;MEK-6318K全自动血细胞分析仪 日本光电工业有限公司;BS-330全自动生化分析仪 深圳麦瑞有限公司;组织包埋盒 江苏世泰实验器材有限公司;BT100-2J蠕动泵 保定兰格恒流泵有限公司;KD-TS3A生物组织脱水机 北京佳源兴业科技有限公司;KD-BM生物组织包埋机、KD-P摊片机 浙江省金华市科迪仪器设备有限公司;RM2016轮转式切片机 德国Leica公司;CK40型光学显微镜 日本Olympus公司。
1.3 方法
1.3.1 动物分组与模型建立
昆明雄性小鼠90 只,适应性饲养7 d后称质量,按照文献[17]对实验动物进行分组,选取10 只小鼠为正常对照组(NOR),其余小鼠构建慢性汞中毒模型,每组小鼠10 只,共分为8 组:模型对照组(MOD)、阳性对照组(DMPS)、酵母源MT灌胃给药组(MT-1-L、MT-1-M、MT-1-H、MT-2-L、MT-2-M、MT-2-H)。实验小鼠饲养于动物实验专用塑料鼠笼,实验期间以标准饲料饲喂,室温(24±2)℃,相对湿度(45±3)%,光照12 h/d。
NOR组小鼠每日自由饮用去离子水,其余各组小鼠每日自由饮用含50 nmol/L HgCl2的去离子水溶液,28 d构建慢性汞中毒小鼠模型,各组小鼠每日在同一时间灌胃给药28 d,各组小鼠具体药剂情况如表1所示。
表1 实验小鼠药剂分配
Table 1 Doses of normal saline, DMPS and MTs administered to experimental mmiiccee

注:剂量均以体质量计。
1.3.2 指标测定
小鼠末次给药后禁食24 h后称量体质量,每组随机抽取5 只小鼠摘除眼球取血分离血清,全自动生化分析仪测定血清中谷丙转氨酶(alanine aminotransferase,ALT)与谷草转氨酶(aspartate transaminase,AST)水平,并取肝脏组织称质量后按下式计算肝脏脏器系数,双道原子荧光光度计测定Hg2+含量;每组剩余小鼠取全血肝素钠抗凝,测定Hg2+含量及白细胞、红细胞、血小板计数及血红蛋白含量4 项血常规指标,并取肝脏组织制成病理学组织切片,光学显微镜观察肝脏组织病变程度。
式中:m1为肝脏鲜质量/g;m为小鼠体质量/g。
1.4 数据统计分析
数据采用 ±s表示,采用SAS 9.1统计学软件进行统计学分析,P<0.05有统计学意义。Origin 8.5软件绘制相关图表。
2.1 酵母源MT对慢性汞中毒小鼠体质量及肝脏脏器系数的影响
表2 实验小鼠体质量及肝脏脏器系数
Table 2 Body weights and liver indexes of mice
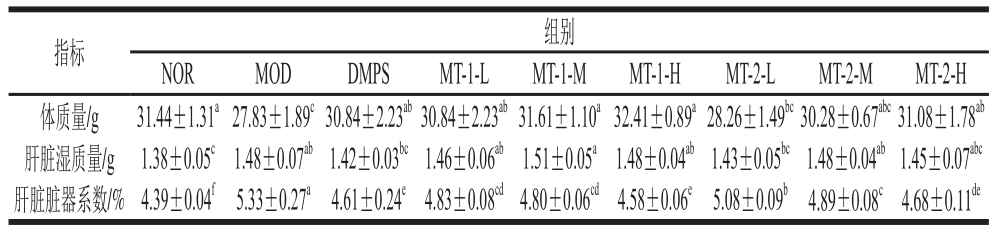
注:同行肩标小写字母不同表示同一指标相比差异显著(P<0.05)。
各实验组小鼠体质量及肝脏脏器系数如表2所示,MOD组小鼠体质量显著低于NOR组(P<0.05),除MT-2-L组外各灌胃给药组小鼠体质量与NOR组无显著差异(P>0.05)。比较各组脏器系数,小鼠经慢性汞中毒建模后,MOD组小鼠肝脏湿质量及脏器系数指标相较NOR组显著升高(P<0.05)。灌胃给药后,相较于MOD组小鼠,各灌胃给药组小鼠肝脏脏器系数均不同程度下降,且呈一定的剂量-效应关系,其中DMPS组及酵母源MT高剂量组小鼠肝脏脏器系数接近NOR组小鼠,综合比较各组小鼠肝脏脏器系数,酵母源MT-1-H对小鼠肝脏脏器系数的改善效果最佳。
2.2 酵母源MT对慢性汞中毒小鼠血液及肝脏汞含量的影响
如图1所示,MOD组小鼠血液及肝脏汞含量显著高于NOR组(P<0.05),表明汞进入机体内可稳定存在于血液及肝脏组织当中,不易被机体排出。经MT灌胃给药后,各给药组小鼠血液及肝脏汞含量较MOD组显著下降(P<0.05),且酵母源MT对降低血液及肝脏中汞含量的作用效果与剂量呈正相关,高剂量酵母源MT对降低血液及肝脏汞含量的作用效果显著优于其他剂量组(P<0.05)。DMPS组小鼠血液汞含量与MT-1-M组无显著性差异(P>0.05),DMPS降低肝脏汞含量的作用效果与两种酵母源MT高剂量组无显著性差异(P>0.05)。
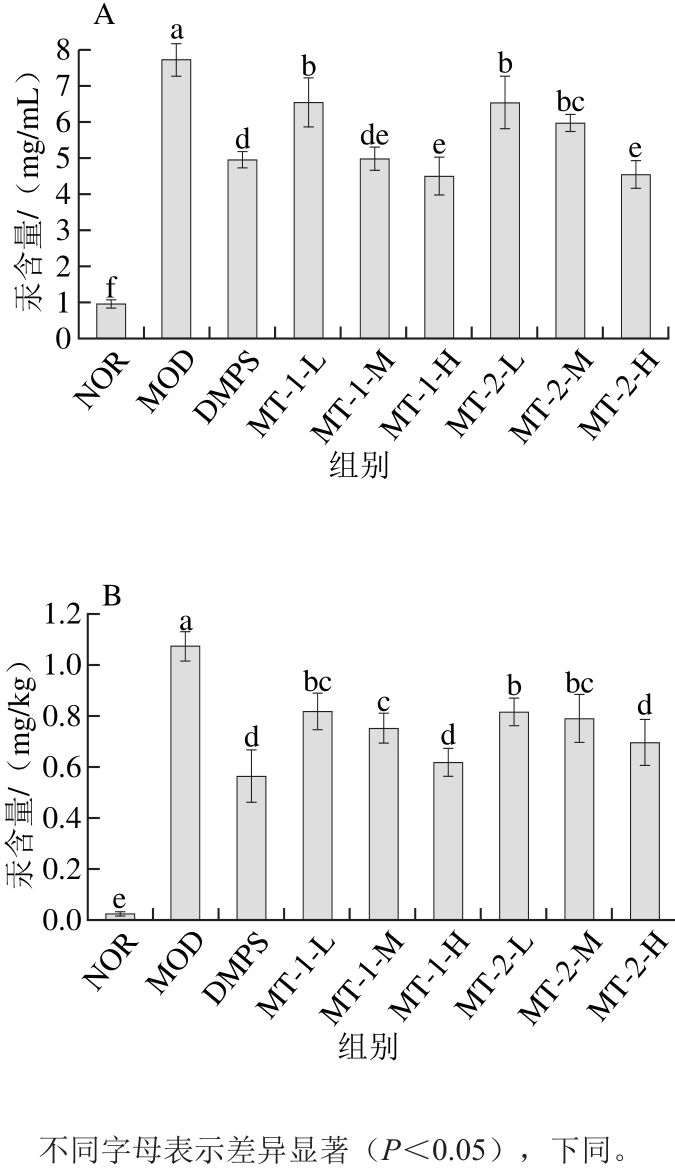
图1 实验小鼠血液(A)及肝脏(B)汞含量
Fig. 1 Blood (A) and liver (B) mercury levels of experimental mice
2.3 酵母源MT对慢性汞中毒小鼠血常规的影响
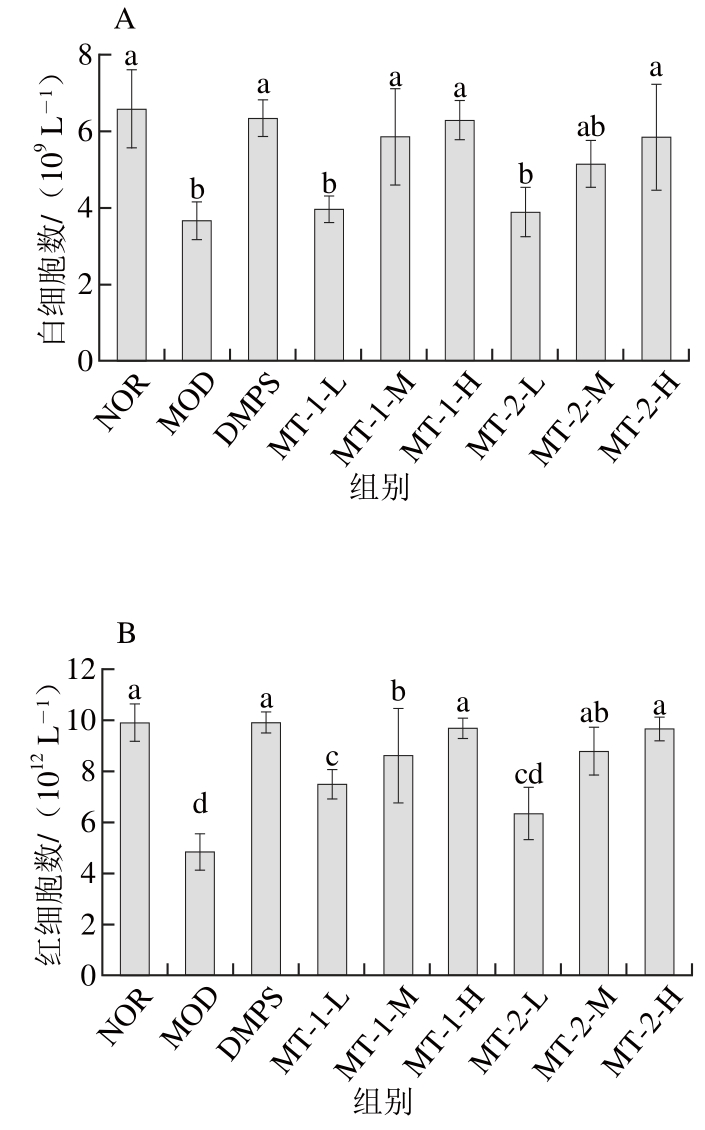
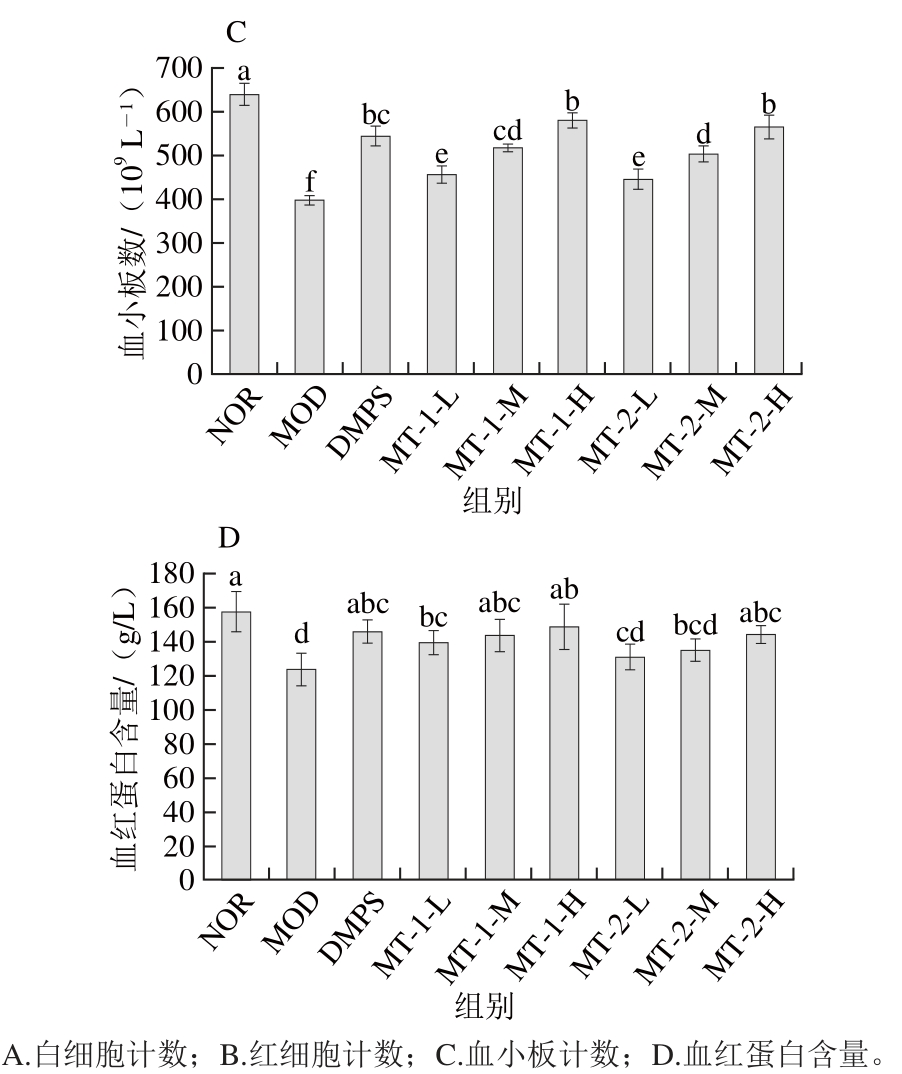
图2 酵母源MT对慢性汞中毒小鼠血常规的影响
Fig. 2 Effect of yeast MT on blood physiological and biochemical indicators of experimental mice
如图2所示,与NOR组比较MOD组小鼠4 项血常规指标均显著下降(P<0.05),灌胃给药后,与MOD组比较,两种酵母源MT灌胃给药组小鼠各项血常规指标均不同程度改善,且呈一定的剂量-效应关系。其中酵母源MT中、高剂量灌胃给药组白细胞、红细胞水平较比低剂量组显著升高(除MT-2-M组)(P<0.05),各酵母源MT灌胃给药组小鼠(除MT-2-L组)血小板计数及血红蛋白含量较比模型组小鼠均显著升高(P<0.05)。结果表明,两种酵母源MT对慢性汞中毒小鼠4项血常规指标具有良好的改善作用。
2.4 酵母源MT对慢性汞中毒小鼠肝功能指标的影响
如图3所示,与NOR组小鼠比较,MOD组小鼠经汞染毒后血清ALT、AST活力显著升高(P<0.05),灌胃给药后,各给药组小鼠血清AST、ALT活力较MOD组显著下降(P<0.05),且两种酵母源MT对两项肝功能指标的改善作用与剂量呈正相关,高剂量给药对降低肝功能指标的效果最佳。DMPS对慢性汞中毒小鼠肝功能指标改善的作用效果与酵母源MT中、高剂量无显著性差异(P>0.05)。
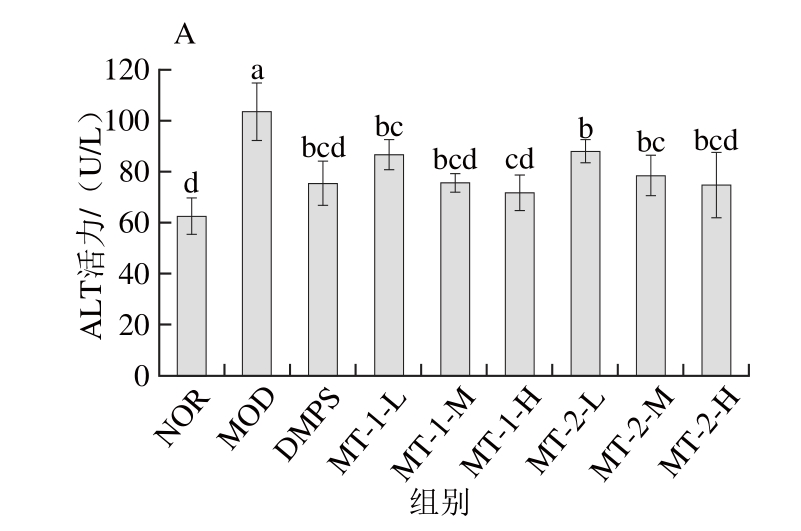
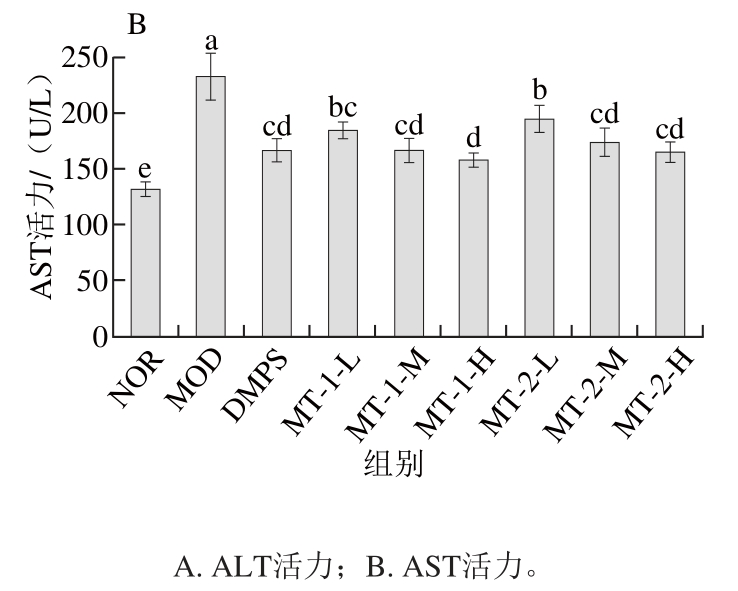
图3 酵母源MT对慢性汞中毒小鼠肝功能的影响
Fig. 3 Effect of yeast MT on liver function indices of experimental mice
2.5 酵母源MT对慢性汞中毒小鼠肝组织病理学的影响
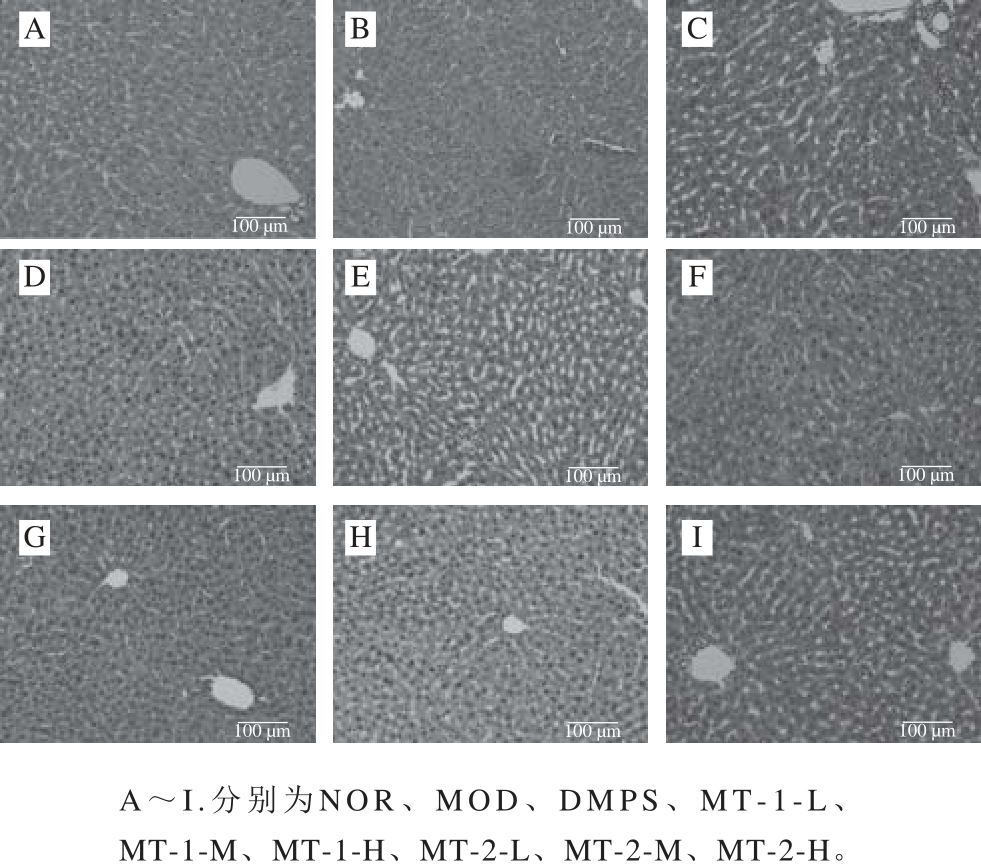
图4 实验小鼠肝组织病理学观察结果(×20000)
Fig. 4 Pathological observation of liver tissues in experimental mice (×200)
实验小鼠肝脏组织病理学染色切片如图4所示,NOR组小鼠肝细胞形态饱满,细胞核大小均一,肝小叶结构完整,肝索放射状排列脉络清晰。MOD组小鼠肝脏组织出现病灶坏死块,汇管区有明显出血点,细胞严重水肿,细胞核核仁弥散,此现象表明汞可造成肝脏组织及细胞损伤。经灌胃给药28 d后,各灌胃给药组小鼠肝脏组织切片显示其肝脏损伤较MOD组明显好转,DMPS组小鼠肝脏组织间隙虽仍有炎性细胞浸润现象,但细胞水肿程度减轻。酵母源MT低剂量组细胞肿胀程度稍减轻,细胞结构完整无坏死块产生,切片观察显示酵母源MT-1-L对受损肝脏组织的修复效果好于MT-2-L。酵母源MT中、高剂量组对受损肝脏组织表现出良好的修复效果,酵母源MT-1-M伴有炎性细胞团块,但细胞形态正常,肝索脉络清晰,其对肝脏组织细胞水肿病症的改善效果好于MT-2-M组。MT-2-H组与MT-1-H组小鼠肝脏组织结构及细胞形态与NOR组小鼠相近,但MT-2-H组小鼠肝细胞间隙仍存在少量炎性细胞。综合以上结果,酵母源MT对汞致肝脏损伤具有一定的修复作用,且与剂量呈正相关。
本实验以自由饮用HgCl2去离子水溶液的方式构建慢性汞中毒小鼠模型,以DMPS驱汞药物为对照,探究了两种具有自主知识产权酵母源MT对汞中毒小鼠排汞及汞致肝脏损伤的修复作用。实验结果显示,与NOR组比较,MOD组小鼠显示慢性汞接触可对机体肝脏组织造成明显的损伤,且Hg2+可在血液及肝脏组织中稳定存在,不易被机体排出。经灌胃给予不同剂量的酵母源MT后,与MOD组小鼠比较,各灌胃给药组小鼠肝脏脏器系数、血液及肝脏汞含量均不同程度下降,且下降的程度与MT剂量相关,同时两种高剂量酵母源MT对慢性汞中毒小鼠4 项血常规指标(白细胞计数、红细胞计数、血小板计数、血红蛋白含量)均有良好的提高作用。综合慢性汞中毒小鼠肝脏脏器系数、血液及肝脏汞含量、血常规指标、肝功能指标及肝脏病理学组织切片观察结果,两种酵母源MT对慢性汞中毒小鼠具有良好的排汞及修复受损肝脏的作用,且高剂量酵母源MT的修复效果更好,且酵母源MT-1比MT-2对汞中毒小鼠排汞及肝脏修复效果更佳。
通常机体摄入汞后,以离子的形式存在,并且可结合胃黏膜上皮细胞及小肠绒毛细胞细胞膜上的巯基结构,造成细胞膜功能部分丧失,损伤细胞体最终导致机体正常消化吸收食物的功能紊乱,体质量下降[18]。Hg2+在血液中可与红细胞及血小板膜表面的糖蛋白结构结合[19-20],导致细胞膜糖蛋白结构失活,膜透通性及流动性增强,造成细胞内容物流出,导致细胞死亡,细胞数量锐减。Hg2+可使血红蛋白中的血红素辅机脱离,造成其三级机构和四级结构的改变,从而导致血红蛋白运输氧功能丧失,造成机体细胞缺氧并产生炎症,机体白细胞数量减少并出现细胞间隙炎性细胞浸润现象[21]。肝脏是Hg2+蓄积的主要靶器官之一[22-23],实验结果表明Hg2+可稳定蓄积于肝脏,造成肝脏脏器系数增加,肝组织受损,ALT、AST活力两项肝脏指示指标明显增加,其主要损害肝组织机制与Hg2+易与细胞膜表面巯基结合有关,Hg2+与细胞膜表面巯基蛋白结合,导致蛋白结构改变,细胞膜功能性损伤,膜通透性失常,同时Hg2+可造成肝细胞内外Ca2+浓度失衡,胞内Ca2+浓度升高,导致细胞水肿严重最终凋亡[24]。
MT为胞内功能性蛋白质,其内含巯基结构,可结合Hg2+,减少Hg2+对机体的损伤[25]。酵母源MT由Zn2+诱导合成[26],结构内含大量金属巯基簇合物,通过外源摄入酵母源MT可大量结合机体内的Hg2+,并形成稳定结合物随尿液排出,防止Hg2+结合细胞膜表面巯基蛋白结构,维持细胞膜稳定,平衡Ca2+浓度差,抑制细胞水肿并修复受损细胞[27]。同时酵母源MT结合Hg2+的同时可释放自身所携带Zn2+,参与调节机体金属离子稳态,使机体内金属离子保持稳定状态[28-29]。从本实验结果可以看出,两种酵母源MT对慢性汞中毒小鼠具有良好的排汞及修复受损肝脏的效果,此结果与课题组前期研究的酵母源MT促排铅及修复铅致机体损伤的实验得到了相类似的效果[14,30],相信酵母源MT在机体重金属离子促排及修复重金属离子致机体损伤领域具有更广阔的发展空间,有待学者们更进一步的开发与利用。
参考文献:
[1] DRISCOLL C T, MASON R P, CHAN H M, et al. Mercury as a global pollutant: sources, pathways, and effects[J]. Environmental Science &Technology, 2013, 47(10): 4967-4983. DOI:10.1021/es305071v.
[2] KIM D S, CHOI K. Global trends in mercury management[J]. Journal of Preventive Medicine and Public Health, 2012, 45(6): 364-373.DOI:10.3961/jpmph.2012.45.6.364.
[3] 魏艳红, 郭建强, 陈志明, 等. 环境汞污染对人体健康的影响及预防措施[J]. 大众科技, 2014(3): 59-61. DOI:10.3969/j.issn.1008-1151.2014.03.020.
[4] FARINA M, AVILA D S, ROCHA J B T D, et al. Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury[J]. Neurochemistry International, 2013, 62(5): 575-594.DOI:10.1016/j.neuint.2012.12.006.
[5] 许秀艳, 朱红霞, 于建钊, 等. 环境中汞化学形态分析研究进展[J]. 环境化学, 2015, 34(6): 1086-1094. DOI:10.7524/j.issn.0254-6108.2015.06.2014102902.
[6] POLLACK A Z, SCHISTERMAN E F, GOLDMAN L R, et al.Relation of blood cadmium, lead, and mercury levels to biomarkers of lipid peroxidation in premenopausal women[J]. American Journal of Epidemiology, 2012, 175(7): 645-652. DOI:10.1093/aje/kwr375.
[7] 陈洁, 云扬, 雷克成. 汞肾毒性作用机制的研究进展[J]. 中国医药指南, 2011, 9(23): 223-224. DOI:10.3969/j.issn.1671-8194.2011.23.164.
[8] APAYDIN F G, BAS H, KALENDER S, et al. Subacute effects of low dose lead nitrate and mercury chloride exposure on kidney of rats[J].Environmental Toxicology and Pharmacology, 2016(41): 219-224.DOI:10.1016/j.etap.2015.12.003.
[9] DIEZ S. Human health effects of methylmercury exposure[J]. Reviews of Environmental Contamination and Toxicology, 2009, 198: 111-132.DOI:10.1007/978-0-387-09647-6_3.
[10] CONG M, WU H, LIU X, et al. Effects of heavy metals on the expression of a zinc-inducible metallothionein-Ⅲ gene and antioxidant enzyme activities inCrassostrea gigas[J]. Ecotoxicology, 2012, 21(7):1928-1936. DOI:10.1007/s10646-012-0926-z.
[11] RUTTKAY N B, NEJDL L, GUMMULEC J, et al. The role of metallothionein in oxidative stress[J]. International Journal of Molecular Sciences, 2013, 14(3): 6044-6066. DOI:10.3390/ijms14036044.
[12] TRINCHELLA F, ESPOSITO M G, SCUDIERO R. Metallothionein primary structure in amphibians: insights from comparative evolutionary analysis in vertebrates[J]. Comptes Rendus Biologies,2012, 335(7): 480-487. DOI:10.1016/j.crvi.2012.05.003.
[13] 杨利荣, 张敏红. 金属硫蛋白与应激反应[J]. 动物营养学报, 2011,23(7): 1079-1084. DOI:10.3969/j.issn.1006-267x.2011.07.002.
[14] 徐炳政, 张东杰, 王颖, 等. 酵母源金属硫蛋白对急性铅中毒小鼠的排铅及过氧化损伤修复作用[J]. 中国生物制品学杂志, 2015, 28(11):1142-1146. DOI:10.13200/j.cnki.cjb.001108.
[15] 王颖, 徐炳政, 王欣卉, 等. 酵母源金属硫蛋白对慢性铅中毒小鼠排铅及肝脏保护作用[J]. 现代食品科技, 2015, 31(8): 12-17.
[16] 李冰, 王颖, 徐炳政, 等. 超声波辅助提取酵母源类金属硫蛋白工艺的优化[J]. 食品与机械, 2014, 30(3): 194-197. DOI:10.3969/j.issn.1003-5788.2014.03.047.
[17] 赵伟, 孙国志. 常用实验动物随机分组方法[J]. 畜牧兽医科技信息,2009(4): 61-62. DOI:10.3969/j.issn.1671-6027.2009.04.042.
[18] 刘晓玲, 王汉斌, 孙成文,等. 汞中毒92 例临床分析[J]. 中华内科杂志, 2011, 50(8): 687-689. DOI:10.3760/cma.j.issn.0578-1426.2011.08.020.
[19] 李艳艳, 熊光仲. 汞中毒的毒性机制及临床研究进展[J]. 中国急救复苏与灾害医学杂志, 2008, 3(1): 57-59. DOI:10.3969/j.issn.1673-6966.2008.01.025.
[20] CARVALHO C M, CHEW E H, HASHEMY S I, et al. Inhibition of the human thioredoxin system. a molecular mechanism of mercury toxicity[J]. Journal of Biological Chemistry, 2008, 283(18): 11913-11923.DOI:10.1074/jbc.M710133200.
[21] WORMSER U, BRODSKY B, MILATOVIC D, et al. Protective effect of a novel peptide against methylmercury-induced toxicity in rat primary astrocytes[J]. Neurotoxicology, 2011, 33(4): 763-768.DOI:10.1016/j.neuro.2011.12.004.
[22] 沈伟, 邱泽武, 彭晓波. 汞中毒的现状及诊治研究进展[J]. 中国临床医生, 2012, 40(8): 24-26. DOI:10.3969/j.issn.1008-1089.2012.08.009.
[23] ALATTAR A M. Vitamin E attenuates liver injury induced by exposure to lead, mercury, cadmium and copper in albino mice[J]. Saudi Journal of Biological Sciences, 2011, 18(4): 395-401. DOI:10.1016/j.sjbs.2011.07.004.
[24] 黄宝圣, 王希英. 汞毒生物作用机制及其防治策略[J]. 绿色科技,2010(10): 70-74. DOI:10.3969/j.issn.1674-9944.2010.10.031.
[25] 汤晓燕, 陈丽杰, 袁文杰. 金属硫蛋白应用于重金属吸附的研究进展[J]. 现代化工, 2014, 34(6): 32-36.
[26] 苗兰兰. 产金属硫蛋白菌株的诱变育种及蛋白的分离提纯[D]. 大庆: 黑龙江八一农垦大学, 2013: 23-47.
[27] 徐炳政. 酵母源金属硫蛋白排铅及对铅致氧化损伤修复作用的研究[D]. 大庆: 黑龙江八一农垦大学, 2015: 33-42.
[28] DONG G, CHEN H, QI M, et al. Balance between metallothionein and metal response element binding transcription factor 1 is mediated by zinc ions (review)[J]. Molecular Medicine Reports, 2014, 11(3): 1582-1586.DOI:10.3892/mmr.2014.2969.
[29] 徐炳政, 张东杰, 王颖, 等. 金属硫蛋白及其重金属解毒功能研究进展[J]. 中国食品添加剂, 2014(5): 171-175. DOI:10.3969/j.issn.1006-2513.2014.05.020.
[30] 王颖, 徐炳政, 王欣卉, 等. 酵母源金属硫蛋白对铅致肾脂质过氧化损伤的拮抗作用[J]. 中国食品学报, 2016, 16(6): 37-43.DOI:10.16429/j.1009-7848.2016.06.006.
Effect of Metallothionein from Yeast on Mercury Elimination and Liver Protection in Mice with Chronic Mercury Poisoning
WANG Xinhui1, WANG Ying1,2,*, ZUO Zhaohang1, LIU Shuting1, GONG Xue1, XU Bingzheng3, ZHANG Dongjie1,*
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. National Coarse Cereals Engineering Research Center, Daqing 163319, China; 3. Qingdao Langyatai Co. Ltd., Qingdao 266400, China)
DOI:10.7506/spkx1002-6630-201719031
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)19-0195-06
收稿日期:2016-09-28
基金项目:黑龙江省教育厅青年创新人才项目(2016-KYYWF-0175);
黑龙江八一农垦大学青年创新人才项目(CXRC2016-15);黑龙江省应用技术研究与开发计划重大项目(GA15B301);
黑龙江八一农垦大学研究生创新科研项目(YJSCX2017-Y56;YJSCX2017-Y57)
作者简介:王欣卉(1992—),女,硕士研究生,研究方向为食品科学及食品质量安全。E-mail:w604466213@163.com
*通信作者:王颖(1979—),女,副教授,博士,研究方向为农产品加工与贮藏工程及食品质量安全。E-mail:wychen156@163.com
张东杰(1966—),男,教授,博士,研究方向为农产品加工与安全。E-mail:byndzdj@126.com
引文格式:
王欣卉, 王颖, 佐兆杭, 等. 酵母源金属硫蛋白对慢性汞中毒小鼠排汞及肝脏损伤修复作用[J]. 食品科学, 2017, 38(19):195-200. DOI:10.7506/spkx1002-6630-201719031. http://www.spkx.net.cn
WANG Xinhui, WANG Ying, ZUO Zhaohang, et al. Effect of metallothionein from yeast on mercury elimination and liver protection in mice with chronic mercury poisoning[J]. Food Science, 2017, 38(19): 195-200. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719031. http://www.spkx.net.cn