刘 佩1,徐欣欣1,刘同信2,王 璇1,王庆国1,*
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018;2.山东营养源食品科技有限公司,山东 济南 251400)
摘 要:‘黄冠’梨低温贮藏过程中果皮褐变严重,为解决果皮褐变问题,开发控制果皮褐变的新技术,本研究分别采用3、20 mmol/L的过氧化氢(H2O2)水溶液浸泡处理‘黄冠’梨,探讨H2O2预处理对梨果皮细胞抗氧化防护体系、低温贮藏期间果皮褐变、果实品质的影响。结果表明,与对照组(未经H2O2处理)相比,20 mmol/L的H2O2显著降低了‘黄冠’梨果皮褐变率及褐变指数,抑制了多酚氧化酶(polyphenol oxidase,PPO)的活性和果皮酚类物质尤其是单体绿原酸、儿茶素和熊果苷的消耗,不同程度地提高了过氧化物酶、超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶活力以及果皮自由基清除能力,降低了丙二醛积累,有效地增强了果皮抗氧化防护能力,并且能够使果实在低温贮藏后的货架期间保持较高的硬度、可滴定酸含量、糖酸比及总可溶性固形物含量,食用感官综合品质在低温贮藏和货架期间均优于对照组。研究表明,采后‘黄冠’梨经H2O2预处理,可以诱导性地增强果皮抗氧化酶活性,抑制PPO酶活性和酚类物质消耗而减少低温贮藏过程中果皮褐变的发生。
关键词:过氧化氢;‘黄冠’梨;果皮褐变;感官品质
Abstract:Severe skin browning of ‘Huangguan’ pears usually occurs during long-term cold storage. In order to develop a new technique to solve this problem, the effect of dipping treatment with 3 or 20 mmol/L H2O2on cellular antioxidant defense systems, skin browning and fruit quality during postharvest cold storage of ‘Huangguan’ pear fruits. The results showed that compared with control (without H2O2treatment), the treatment with 20 mmol/L H2O2reduced markedly skin browning spot index, decreased polyphenol oxidase (PPO) activity and polyphenol contents especially chlorogenic acid,arbutin and catechins, increased peroxidase (POD), superoxide dismutase (SOD), catalase (CAT) and ascorbate peroxidase(APX) activity as well as DPPH radical scavenging capacity, decreased MDA content, and maintained higher firmness,titratable acid (TA), acid-to-sugar ratio, and total soluble solids (TSS) content, thereby resulting in better overall sensory quality during cold storage and shelf life. In sum, the treatment with 20 mmol/L H2O2could reduce skin browning of‘Huangguan’ pear during long-term storage through inducing antioxidant defense, inhibiting PPO activity , and reducing polyphenol contentss.
Key words:hydrogen peroxide; ‘Huangguan’ pear; skin browning; sensory quality
‘黄冠’梨有外观美、汁液多、口味好、营养价值高等优点,深受广大消费者喜爱[1]。但‘黄冠’梨在低温贮藏期间,果皮表面易出现不规则的褐斑,严重影响果实外观品质并大大降低其商品价值,易造成较大的经济损失[2-3]。‘黄冠’梨果皮褐变与果皮组织缺钙和酚类物质代谢失调有密切的关系[4-7],通过壳聚糖、氯化钙、茉莉酸甲酯、低温锻炼等处理可明显减轻采后果皮褐变发病率[8-10],钙和1-甲基环丙烯(1-methylcyclopropene,1-MCP)结合处理,能有效提高果实低温贮藏品质[8],但成本较高,且效果有限。
低温贮藏过程中由于冷害影响,‘黄冠’梨果皮褐变发病严重,生产上主要运用缓慢降温技术控制[11-13],但在实际操作过程中,需根据果实成熟度、采前果皮发病严重程度、采后包装方式等及时调整‘黄冠’梨入库温度、降温速率以及冷库最终的温湿度等[14],其过程繁琐、能耗大并且控制效果不稳定,因此开发稳定、简便、高效的果皮褐变控制新技术为产业所需。
过氧化氢(H2O2)是一种无色、无臭、稳定的活性氧,在食品行业的各个领域有着广泛的应用[15-16],低浓度的H2O2用于果蔬保鲜,具有无污染、无残留的特点。外源H2O2处理植物,会形成氧化胁迫,而适度的氧化胁迫会激活植物体内H2O2信号,再经受诸如冷害、高温、盐胁迫和水分胁迫条件时,抗氧化防护能力会增强[17-20]。研究表明,外源H2O2处理可以诱导性地增强植物体内保护酶的活性、保护膜结构的完整性,增强多种果蔬如樱桃、番茄、芒果、香蕉、柿子和青花菜等的抗寒能力,有效延缓冷害症状的发展[20-23]。
在探讨几种褐变控制技术对‘黄冠’梨品质影响的过程中[24],外源H2O2处理可有效减轻采后‘黄冠’梨果皮褐变,并在此基础上探讨了H2O2对采后‘黄冠’梨果皮褐变的控制机理及其对‘黄冠’梨低温贮藏和货架期品质的影响。
1.1 材料与试剂
实验用‘黄冠’梨采自河北省藁城马庄果园,采摘时挑选大小均匀、无果皮褐变、无机械伤、无病虫害的果实为材料,单果套网套,装入内衬保鲜袋的纸箱中,次日常温运至山东农业大学食品科学与工程学院果蔬保鲜实 验室。
1.2 仪器与设备
Pal-1手持折光仪 日本ATAGO公司;FDK32硬度计 意大利Wagner Instruments公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;2004-21(501)超级恒温水浴锅 国华仪器有限公司;Allegra 64R高速冷冻离心机 美国Beckman公司;-80℃超低温冰箱 中科美菱低温科技有限责任公司;超声波振荡器 上海生析超声仪器有限公司;微型冷库 济南科达尔实业有限公司。
1.3 方法
1.3.1 样品的制备
分别配制浓度为3、20 mmol/L的2 组H2O2水溶液,将梨果完全没入溶液(水温20℃)中,浸泡处理3 min,捞出,吸干表面溶液,重新进行商品化包装,转入-1~0 ℃冷库中低温贮藏。每组处理6 箱梨,每箱48 个果,清水浸泡3 min作为对照。每组处理做3 次重复,低温贮藏20、40、100d,统计果皮褐变率及褐变指数;低温贮藏100 d后于20 ℃放置10 d进行货架期实验,每箱取6 个梨,测定总可溶性固形物(total soluble solid,TSS)含量、可滴定酸(titratable acid,TA)含量、糖酸比、硬度,每箱取10 个梨进行感官综合品质。另外3 箱,每箱取6 个梨,低温贮藏18 d内,每3 d取一次样,进行果皮多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)的活力及丙二醛(malondialdehyde,MDA)含量、总酚含量、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhy drazyl,DPPH)自由基清除率等指标测定。
1.3.2 果皮褐变率及褐变指数测定
果皮褐变率及褐变指数通过公式(1)、(2)计算[10]。依据梨果表面褐变程度(褐变面积占比)划分为5 个等级。0级,果皮无褐变;1级,出现褐变且褐变面积占比小于15%;2级,褐变面积占比15%~30%;3级,褐变面积占比30%~50%;4级,褐变面积占比大于50%。
1.3.3 酚类物质含量测定
Folin-酚法测定总酚含量[25]。样品总酚提取:称取4 g‘黄冠’梨果皮,加入16 mL 70%的丙酮,匀浆;避光条件下,浸提3 h,4 ℃、10 000 r/min条件下离心15 min,取上清液用于总酚及各种单体酚含量的测定。
总酚标准曲线制作:精确称取没食子酸标准品0.01g,蒸馏水溶解并定容至100 mL,得质量浓度为0.1 mg/mL的标准液;准确吸取标准液5 mL,定容至10 mL,得质量浓度为0.05 mg/mL的标准溶液。分别准确量取上述0.05 mg/mL的标准溶液0、0.2、0.4、0.6、0.8、1.0 mL于10 mL容量瓶中,加入0.5 mL Folin-酚试剂,振荡摇匀后静置4 min,分别加入0.5 mL 10% Na2CO3溶液,蒸馏水定容至10 mL,摇匀后,25 ℃水浴1 h,在765 nm波长处测定吸光度,建立总酚标准曲线。
样品总酚含量测定:吸取0.2mL待测样液,按照标准曲线制作方法于765 nm波长处测定吸光度,根据总酚标准曲线计算总酚含量。
各种酚类物质标准曲线制作:分别精确称取0.05 g绿原酸、儿茶素和熊果苷标准品,用70%乙醇溶解、定容至100 mL,得质量浓度为0.5 mg/mL标准液,备用。分别准确量取上述标准液0、0.2、0.4、0.6、0.8、1.0 mL于10 mL容量瓶中,70%乙醇定容至10 mL,以空白试剂为对照,分别在327、260、225 nm波长处测定吸光度,建立标准曲线。
绿原酸、儿茶素和熊果苷含量测定:各吸取0.2 mL待测样液,按标准曲线制作方法分别于327、260、225nm波长处测定吸光度,根据标准曲线分别计算含量。
1.3.4 PPO酶活力测定
称取4 g‘黄冠’梨果皮,加入16 mL pH 6.8磷酸缓冲液(含2.5%的可溶性聚乙烯聚吡咯烷酮),冰浴条件下研磨成匀浆,4 ℃、10000 r/min离心10 min,上清液即为粗酶提取液[26]。
PPO酶活力测定参考Jiang Yueming等[27]的方法并加以改进。依次向试管中加入2.5 mL pH 6.8的磷酸缓冲液、0.5 mL 20 mmol/L邻苯二酚溶液,37 ℃预热10 min后,加入0.1 mL‘黄冠’梨果皮粗酶提取液,混匀后,立即测定在410 nm波长处的吸光度每30 s的变化,测定连续6组数据。以1 g‘黄冠’梨果皮(鲜质量)在1 min内吸光度变化为1个酶活力单位(U)。
1.3.5 抗氧化酶活力测定
称取4 g‘黄冠’梨果皮的冷冻样品加入8 mL预冷的50 mmol/L磷酸缓冲液(含5%聚乙烯吡咯烷酮和3 mmol/L乙二胺四乙酸二钠,pH 7.0),4 ℃条件下充分研磨后,于12 000r/min离心10 min,上清液用于抗氧化酶活力测定。
POD酶活力的测定采用愈创木酚比色法[28];SOD活力的测定采用氮蓝四唑光还原法[28];APX活力的测定采用紫外吸光光度法[29];CAT活力的测定采用比色法[28]。
1.3.6 DPPH自由基清除率测定
称取打浆果皮5g,用95%乙醇定容至25mL。50℃超声振荡30min,过滤。DPPH自由基清除率测定[30]:取2 mL样品,加2 mL 0.2 mol/L DPPH溶液,混匀,室温静置30 min,在517 nm波长处测其吸光度,记做Ai;取2 mL 0.2 mol/L DPPH溶液、95%乙醇2 mL,混匀,在517 nm波长处测其吸光度,记做At。DPPH自由基清除率按式(3)计算。
1.3.7 MDA含量测定
MDA含量参照硫代巴比妥酸煮沸法测定[28]。
1.3.8 硬度、TSS、TA含量测定
硬度用FDK32硬度计(8 mm探头)测定[29];TSS含量使用Pal-1手持折光仪测定[29];TA含量参照氢氧化钠滴定法测定[31]。
1.3.9 综合品质评价
按照表1所示评定标准打分[9],每次每组处理取10个果实,每次评定由6~8名经过训练的专业人员打分,并取其打分平均值。
表1 ‘黄冠’梨感官评价标准
Table 1 Criteria for sensory evaluation of‘Huangguan’ peeaarrss

1.4 数据统计分析
用Excel 2010软件进行方差分析,结果表示为±s。采用Sigmaplot 12.5进行主成分分析,SPSS 17.0进行显著性分析,显著水平为P<0.05。
2.1 H2O2对低温贮藏期间‘黄冠’梨果皮褐变的影响
如图1所示,未经H2O2处理的对照组‘黄冠’梨果实在低温贮藏过程中,果皮褐变发病较严重,20 d时果皮褐变率已达57.0%,褐变指数达24.3%;果皮褐变随着贮藏时间延长而逐渐加重,到40 d果皮褐变率已达68.5%,褐变指数达33.7%;之后发病率增幅不大。低温贮藏时间相同时,经3 mmol/L和20 mmol/L H2O2处理后的梨果果皮褐变指数和果皮褐变率均小于对照组,其中20mmol/L H2O2预处理效果明显,在低温贮藏20、40、100 d时,果皮褐变率与对照组比分别降低了30.4%、37.3%和39.1%。结果表明,采后用20 mmol/L H2O2预处理‘黄冠’梨,能够有效抑制其在低温贮藏期间果皮褐变。

图1 H2O2处理对低温贮藏期间‘黄冠’梨果皮褐变率(A)及
褐变指数(B)的影响
Fig. 1 Effect of H2O2treatment on peel browningrate (A) and peel browning index (B) of ‘Huangguan’ pears
2.2 H2O2对低温贮藏期间‘黄冠’梨果皮酚类物质含量及PPO酶活力的影响
低温贮藏过程中,‘黄冠’梨果皮酚类物质含量的大幅度降低以及PPO酶活力的增强是导致‘黄冠’梨果皮褐变的直接原因[7]。作为‘黄冠’梨果皮含量较多的酚类物质,绿原酸、儿茶素等是‘黄冠’梨果实中PPO酶氧化作用的主要底物[32],在低温贮藏过程中变化较大。由2.1节可知,20 mmol/L H2O2预处理能极显著降低‘黄冠’梨低温贮藏期间的果皮褐变(P<0.01)。因此,本实验分别测定了对照组和20 mmol/L H2O2处理组的‘黄冠’梨果皮中PPO酶活力和总酚、绿原酸、熊果苷、儿茶素等游离酚酸的含量,结果见图2、3。
由图2可知,对照组‘黄冠’梨在低温贮藏18 d内,PPO酶活力一直持续增加;低温贮藏3 d后,20 mmol/L H2O2处理组‘黄冠’梨果皮PPO酶活力呈降低趋势,低温贮藏9 d后,PPO酶活力略有增加,但均一直极显著低于对照组(P<0.01)。
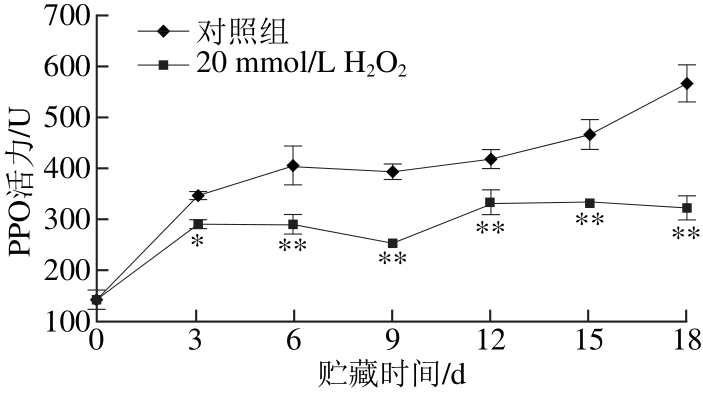
图2 H H2O2处理对低温贮藏期间‘黄冠’梨果皮PPO酶活力的影响
Fig. 2 Effect of H2O2treatment on PPO activity of ‘Huangguan’ pears
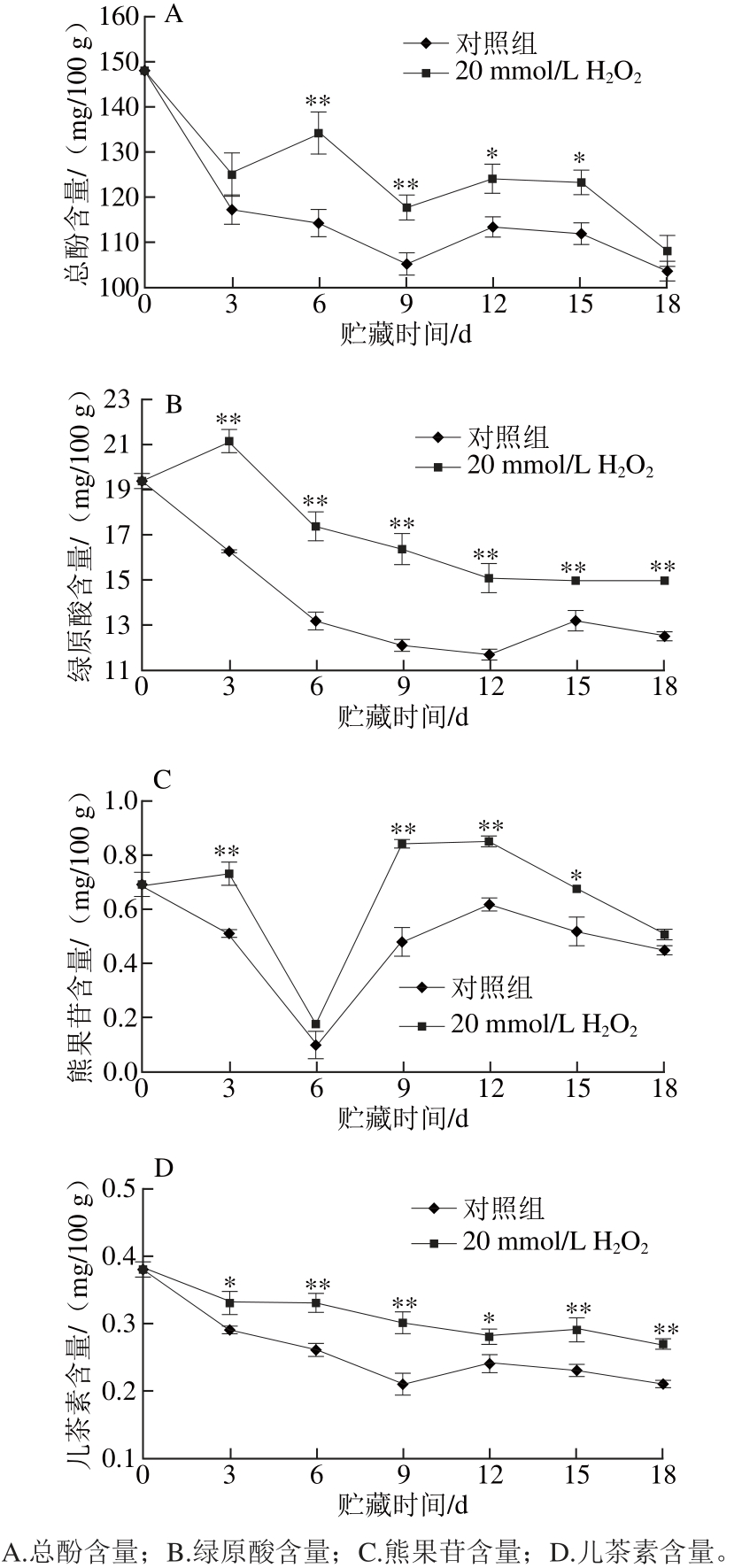
图3 H H2O2处理对低温贮藏期间‘黄冠’梨果皮酚类物质含量的影响
Fig. 3 Effect of H₂O₂ treatment on phenolics contents of ‘Huangguan’ pears
由图3A~D可知,对照组‘黄冠’梨在低温贮藏的18 d内,果皮总酚含量随着时间的延长呈降低趋势,其中绿原酸、儿茶素等游离酚酸含量在低温贮藏9 d内迅速下降,熊果苷含量低温贮藏6 d内快速降低。而经20 mmol/L H2O2处理后的梨果低温贮藏期间,果皮总酚、游离的绿原酸、儿茶素和熊果苷的含量均一直显著高于对照组(P<0.05,P<0.01)。
图2、3表明,采后20 mmol/L H2O2的预处理能够通过抑制‘黄冠’梨低温贮藏期间果皮PPO酶的活性,减缓‘黄冠’梨果皮中酚类物质尤其是绿原酸、儿茶素等单体酚的消耗速率,从而降低果皮褐变的发生。
2.3 H2O2对低温贮藏期间‘黄冠’梨果皮抗氧化酶活性的影响
20 mmol/L H2O2处理后,‘黄冠’梨果皮低温贮藏期间POD、SOD、CAT和APX活力的变化见图4。
低温贮藏期间,‘黄冠’梨果皮POD酶活力总体呈先下降后上升的趋势。而20 mmol/L H2O2预处理显著地抑制了低温贮藏6 d内POD酶活力的降低和促进了低温贮藏6 d后的POD酶活力的升高,从而使得20 mmol/L H2O2预处理后的‘黄冠’梨果皮POD酶活力一直极显著高于对照组(P<0.01)。
低温贮藏期间,‘黄冠’梨果皮SOD酶活力总体呈先上升后下降的趋势。而H2O2预处理显著的促进了低温贮藏12d SOD酶活力的升高和抑制了低温贮藏12 d后SOD酶活力的降低,从而使得20 mmol/L H2O2预处理后的‘黄冠’梨果皮SOD酶活力一直显著高于对照组。
CAT和APX能分解代谢冷害产生的H2O2,从而有效地清除自由基。低温贮藏期间,对照组和20 mmol/L H2O2处理组的‘黄冠’梨果皮CAT酶活力均呈上升趋势,经H2O2预处理的‘黄冠’梨果皮CAT活力一直显著高于对照组。果皮APX酶活力均呈现缓慢下降然后上升的趋势,而H2O2预处理显著抑制了低温贮藏12d内APX酶活力的下降和促进了12d后活力的升高,并使得处理组APX酶活力一直显著高于对照组(P<0.05)。
H2O2作为一种重要的外源活性氧,在植物细胞内的作用具有两面性,大量的H2O2可以产生氧化胁迫而引起细胞损伤,而适量H2O2的存在可以维持植物细胞内的氧化平衡[33]。另外,H2O2是植物细胞的信号分子,生物和非生物胁迫促使植物细胞产生H2O2,通过H2O2信号与乙烯、水杨酸、脱落酸等信号分子之间的相互作用应答胁迫,进而产生一系列生理生化反应,增强植物抗氧化防护体系,提高植物抗性[34-37]。外源低浓度H2O2对植物生长以及耐受胁迫的能力呈现正相关,如经H2O2处理过的玉米幼苗耐盐能力增强、大豆耐旱性增加、水稻的耐热性增强等[38-41]。
上述结果表明,用20 mmol/L H2O2对采后的‘黄冠’梨预处理,有效抑制了低温贮藏初期POD和APX酶活力的降低,促进了SOD和CAT酶活力的升高,与对照相比,20 mmol/L H2O2处理组均显著提高了POD、SOD、CAT和APX抗氧化酶的活力,有利于维持低温贮藏期间果皮中活性氧代谢的平衡。

图4 H H2O2处理对低温贮藏期间‘黄冠’梨果皮抗氧化酶活性的影响
Fig. 4 Effect of H2O2treatment on POD activity of ‘Huangguan’ pears
2.4 H2O2对低温贮藏期间‘黄冠’梨果皮MDA含量和DPPH自由基清除率的影响
由图5A可知,对照组‘黄冠’梨低温入库3 d内,果皮MDA含量快速上升,可见‘黄冠’梨低温下很快发生脂质过氧化反应;随着果实对低温逐渐适应,低温贮藏3 d后MDA含量开始下降,15 d后逐渐趋于平稳。而采后经20 mmol/L H2O2预处理后的‘黄冠’梨低温入库后,6 d内MDA含量增幅不显著,随后降低,在低温贮藏15 d后趋于平稳,并且MDA含量一直显著低于对照组。结果可知,20 mmol/L H2O2预处理显著降低了‘黄冠’梨低温贮藏期间果皮MDA的积累,抑制了‘黄冠’梨果皮脂质过氧化反应,对‘黄冠’梨膜脂具有一定的保护作用。
由图5B可知,低温贮藏过程中‘黄冠’梨果皮DPPH自由基清除率均呈下降趋势,但20 mmol/L H2O2预处理显著抑制了低温贮藏期间DPPH自由基清除率的降低,有利于维持细胞抗氧化能力。
‘黄冠’梨低温贮藏过程中,易遭受冷害,而低温导致细胞膜结构的损伤是产生冷害的根本原因。MDA是膜脂过氧化的主要产物之一,其积累量的多少可以反应膜损伤的程度;而DPPH自由基清除率可以反应细胞抗氧化能力。黄冠梨低温贮藏过程中,果皮褐变发生严重,而由图4、5可知,20 mmol/L H2O2预处理有效提高了POD、SOD、CAT和APX等抗氧化酶的活力,抑制了DPPH自由基清除率的降低和MDA的积累,有利于维持低温贮藏期间果皮中活性氧代谢的平衡,保护细胞膜的完整性。
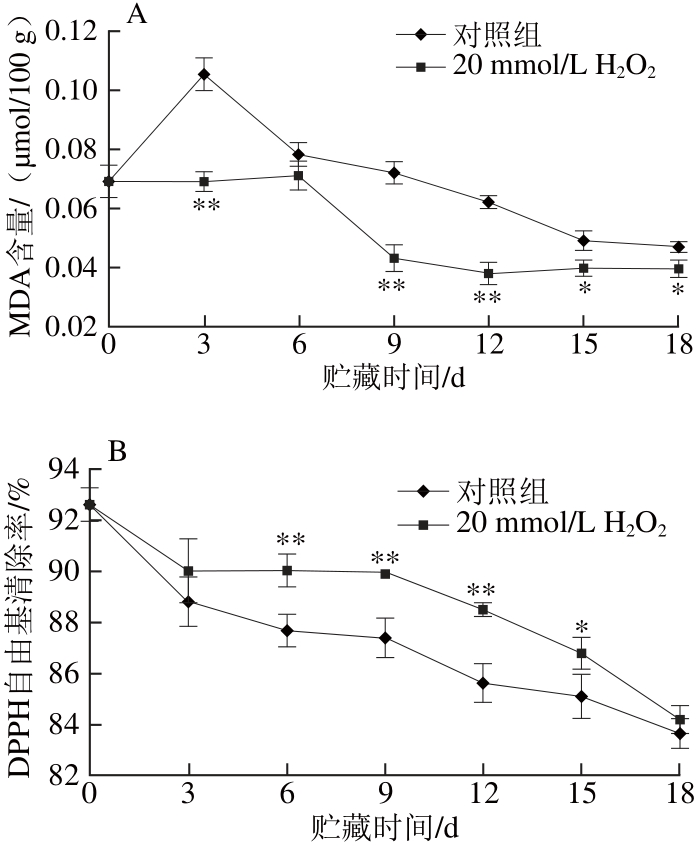
图 55 HH2O2处理对低温贮藏期间‘黄冠’梨果皮MDA含量(AA)及DPPH自由基清除率(B)的影响
Fig. 5 Effect of H2O2treatment on MDA content (A) and DPPH radical scavenging capacity (B) of ‘Huangguan’ pears
2.5 H2O2对‘黄冠’梨果实TSS含量、TA含量、糖酸比、硬度以及综合品质的影响
将TSS含量、TA含量、糖酸比及硬度等作为主要指标可评价梨果的成熟度、食用品质及消费者的可接受程度[42]。由表2可知,低温贮藏100 d时,20 mmol/L H2O2处理‘黄冠’梨果实TSS含量、TA含量、糖酸比与对照1无明显差异,果实硬度与综合品质显著高于对照组。低温贮藏100d后经常温20 ℃货架10 d,20 mmol/L H2O2处理果实的TA含量与对照组无明显差异(P>0.05),TSS含量、糖酸比、果实硬度及综合品质显著高于对照组(P<0.05);由表2结果可知,H2O2预处理可提高采后‘黄冠’梨低温贮藏期间果实硬度以及低温贮藏后的常温20 ℃货架期间(10 d)果实TSS含量、糖酸比及果实硬度,并能够有效地保持低温贮藏及货架期间较优的感官综合品质。
表 2 H2O2处理对‘黄冠’梨低温贮藏后期及货架期间果实品质的影响
Table 2 Effect of H2O2treatment on sensory quality of‘Huanguan’pears during cold storage and shelf life

注:同列肩标小写字母不同表示差异显著(P<0.05);对照1表示未经处理的‘黄冠’梨低温贮藏100 d;对照2表示未经处理的‘黄冠’梨低温贮藏100 d后,常温货架贮藏10 d;100+货架10表示低温贮藏100 d后常温20 ℃货架贮藏10 d。
外源H2O2预处理显著降低了PPO酶活力以及酚类物质包括绿原酸、儿茶素等物质的消耗(P<0.05),从而减少了果皮褐变的发生。此外,H2O2预处理诱导了采后‘黄冠’梨果皮的防御反应,增加了低温贮藏期间抗氧化酶包括SOD、POD、CAT、APX酶活力,从而可以增强对低温贮藏期间低温造成的修复与抵抗能力;H2O2预处理抑制了梨果果皮自由基清除能力的降低,果皮MDA积累量的减少表明H2O2预处理可以降低低温引发的自由基对细胞膜产生的伤害。因此H2O2预处理可以通过影响活性氧代谢和酚类物质代谢来降低采后‘黄冠’梨低温贮藏期间低温造成的果皮褐变的发生,并能够达到减少‘黄冠’梨鸡爪病、延长贮藏期和保持新鲜品质的目的。
参考文献:
[1] 赵京献, 刘俊, 吕润航, 等. 黄冠梨鸡爪病综合防治技术研究[J]. 中国果树, 2008(4): 20-22. DOI:10.16626/j.cnki.issn1000-8047.2008.04.010.
[2] 周娴, 郁志芳, 杜传来, 等. 几种林果低温贮藏的冷害及其调控研究进展[J]. 南京林业大学学报(自然科学版), 2004, 28(3): 105-110.DOI:10.3969/j.jssn.1000-2006.2004.03.027.
[3] 王文辉, 贾晓辉, 杜艳民, 等. 我国梨果生产与贮藏现状、存在的问题与发展趋势[J]. 保鲜与加工, 2013, 13(5): 1-8. DOI:10.3969/j.issn.1009-6221.2013.05.001.
[4] KOU X H, WU M S, LI L, et al. Effects of CaCl2dipping and pullulan coating on the development of brown spot on ‘Huangguan’ pears during cold storage[J]. Postharvest Biology & Technology, 2015, 99:63-72. DOI:10.1016/j.postharvbio.2014.08.001.
[5] LIU P, XUE C, WU T T, et al. Molecular analysis of the processes of surface brown spot (SBS) formation in pear fruit (Pyrus bretschneideriRehd. cv. Dangshansuli) byde novotranscriptome assembly[J]. PLoS ONE, 2013, 8(9): 74217. DOI:10.1371/journal.pone.0074217.
[6] DONG Y, GUAN J F, MA S J, et al. Calcium content and its correlated distribution with skin browning spot in baggedHuangguanpear[J].Protoplasma, 2015, 252: 165-171. DOI:10.1007/s00709-014-0665-5.
[7] 李磊, 寇晓虹. 黄冠梨贮藏期间果皮酚类物质代谢与鸡爪病发生的关系[J]. 河南工业大学学报(自然科学版), 2011, 32(4): 74-79.DOI:10.16433/j.cnki.issn1673-2383.2011.04.003.
[8] 龚新明, 关军锋, 张继澍. 黄冠梨采后1-MCP和CaCl2处理对品质和果皮褐斑发生的影响[J]. 园艺学报, 2010, 37(3): 375-382.DOI:10.16420/j.issn.0513-353x.2010.03.006.
[9] 邢丹丹, 牟文良, 王庆国. 茉莉酸甲酯抑制采后黄冠梨果皮褐变的研究[J]. 食品与发酵科技, 2013, 49(2): 20-24. DOI:10.3969/j.issn.1674-506X.2013.02-006.
[10] 王静静, 王庆国. 冷锻炼对黄冠梨采后果实品质的影响[J]. 食品与发酵工业, 2011, 37(7): 235-239. DOI:10.13995/j.cnki.11-1802/ts.2011.07.051.
[11] 关军锋. 黄冠梨采后商品化处理与贮藏保鲜关键技术[J]. 保鲜与加工, 2013, 13(5): 59-61. DOI:10.3969/j.issn.1009-6221.2013.05.013.
[12] 郝永菲, 王娟, 叶晓春, 等. 黄冠梨销地急速降温条件下适宜贮藏温湿度的筛选[J]. 食品研究与开发, 2014, 35(18): 91-95. DOI:10.3969/j.issn.1005-6521.2014.18.024.
[13] 曹军合, 赵京献, 杜子春, 等. 冷藏条件下包装处理对黄冠梨品质的影响[J]. 河北林业科技, 2014(1): 8-10. DOI:10.16449/j.cnki.issn1002-3356.2014.01.020.
[14] 郝永菲. 黄冠梨采后运输特性及销地适宜贮藏条件的研究[D]. 太古: 山西农业大学, 2015: 13-54.
[15] 石晶, 王金美, 孟一娟, 等. 食品级过氧化氢及其在食品工业中的应用[J]. 中国食品添加剂, 2009(4): 62-64. DOI:10.3969/j.issn.1006-2513.2009.04.011.
[16] 庞伟, 姜明洪, 薛英喜. 食品级过氧化氢在桶装水生产中的应用[J].饮料工业, 2014, 17(1): 33-34; 39.
[17] MILLER G, SUZUKI N, CIFTCI-YILMAZS, et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant, Cell & Environment, 2010, 33(4): 453-467.DOI:10.1111/j.1365-3040.2009.02041.x.
[18] LIANG Y S, WONGMETHA O, WU P S, et al. Influence of hydrocooling on browning and quality of litchi cultivar Feizixiao during storage[J]. International Journal of Refrigeration, 2013, 36(3):1173-1179. DOI:10.1016/j.ijrefrig.2012.11.007.
[19] 刘杨. H2O2对冷敏型果蔬采后抗冷性的影响[D]. 天津: 天津大学,2009: 18-45.
[20] 李文波. 1-MCP、MeSA、H2O2对脱涩柿果实冷害的影响[D]. 淄博:山东理工大学, 2012: 32-54.
[21] 赵习姮, 刘扬, 李进才, 等. H2O2处理对采后樱桃番茄和芒果抗冷性的影响[J]. 天津大学学报, 2010, 43(9): 844-848. DOI:10.3969/j.issn.0493-2137.2010.09.015.
[22] 潘少丽, 黄椿颖, 王海波, 等. 过氧化氢诱导采后香蕉耐冷性的研究[J].华南农业大学学报, 2007, 28(4): 34-37. DOI:10.3969/j.issn.1001-411X.2007.04.009.
[23] 陈双颖, 赵习姮, 刘洪竹, 等. 水杨酸和H2O2处理对鲜切青花菜抗氧化特性的影响[J]. 食品科学, 2015, 36(2): 260-264. DOI:10.7506/spkx1002-6630-201502050.
[24] 徐欣欣. 几种褐变控制技术对黄冠梨采后品质的影响[D]. 泰安: 山东农业大学, 2014: 20-26.
[25] SLINKARD K, SINGLETON VL. Total phenol analysis: automation and comparison with manual methods[J]. American Journal of Enology and Viticulture, 1977, 28(1): 49-55. DOI:10.1007/s10068-012-0049-6.
[26] 袁根良, 杨公明, 余铭超, 等. 超高压处理对香蕉果肉多酚氧化酶和过氧化物酶活性抑制的研究[J]. 食品科学, 2010, 31(10): 64-68.
[27] JIANG Yueming, FU Jiarui, ZAUBERMAN G, et al. Purification of polyphenol oxidase and the browning control of litchi fruit by glutathione and citric acid[J]. Journal of the Science of Food &Agriculture, 1999, 79(7): 950-954. DOI:10.1002/(SICI)1097-0010(19990515)79:7.
[28] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2001: 164-167.
[29] 曹建康, 姜微波, 赵玉梅, 等. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 29-105.
[30] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[31] 聂继云. 果品质量安全分析技术[M]. 北京: 化学工业出版社,2009: 30-38.
[32] 李磊, 谢冰, 寇晓虹. 高效液相色谱-串联质谱测定黄冠梨果皮中主要酚类物质[J]. 食品工业, 2012, 33(5): 132-135.
[33] BARBA-ESPIN G, DIAZ-VIVANCOS P, CLEMENTE-MORENO M J, et al. Interaction between hydrogen peroxide and plant hormonesduring germination and the early growth of pea seedlings[J].Plant Cell and Environment, 2010, 33(6): 981-994. DOI:10.1111/j.1365-3040.2010.02120.x.
[34] SALLEH F M, MARIOTTI L, SPADAFORA N D, et al. Interaction of plant growth regulators and reactive oxygen species to regulate petal senescence in wallfl owers (Erysimum linifolium)[J]. BMC Plant Biology, 2016, 16: 77-91. DOI:10.1186/s12870-016-0766-8.
[35] 侯媛媛, 朱璇, 王英, 等. 水杨酸处理对杏果实冷害及活性氧代谢的影响[J]. 食品科学, 2014, 35(4): 195-199. DOI:10.7506/spkx1002-6630-201404040.
[36] WANG Y, LI J L, WANG J Z, et al. Exogenous H2O2improves thechilling tolerance of manilagrass and mascarenegrass by activatingthe antioxdative system[J]. Plant Growth Regulation, 2010,61(2): 195-204. DOI:10.1007/s10725-010-9470-0.
[37] HOSSAIN M A, BHATTACHARJEE S, ARMIN S M , et al. Hydrogen peroxide priming modulates abiotic oxidative stress tolerance: insights from ROS detoxifi cation and scavenging[J]. Frontiers in Plant Science,2015, 6: 420. DOI:10.3389/fpls.2015.00420.
[38] 陈颖, 杨华, 乐利, 等. 过氧化氢对银杏悬浮细胞黄酮含量及抗氧化酶活性的影响[J]. 中南林业科技大学学报, 2014, 34(12): 40-45.DOI:10.3969/j.issn.1673-923X.2014.12.008.
[39] ISHIBASHI Y, YAMAGUCHI H, YUASA T, et al. Hydrogen peroxide spraying alleviates drought stress in soybean plants[J].Journal of Plant Physiology, 2011, 168(13): 1562-1567. DOI:10.1016/j.jplph.2011.02.003.
[40] DE AZEVEDO NETO A D, PRISCO J T, ENÉAS-FILHO J, et al.Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants[J]. Journal of Plant Physiology, 2005, 162(10):1114-1122. DOI:10.1016/j.jplph.2005.01.007.
[41] UCHIDA A, JAGENDORF A T, HIBINO T, et al. Effects of hydrogenperoxide and nitric oxide on both salt and heat stress tolerance in rice[J]. Plant Science, 2002, 163(3): 515-523. DOI:10.1016/S0168-9452(02)00159-0.
[42] 赵佳丽, 李惠卓, 高如泰, 等. 河北省鸭梨品质的评价和相关性分析[J].北方园艺, 2010(4): 26-28.
Effects of H2O2Treatment on Postharvest Quality and Skin Browning of ‘Huangguan’ Pears
LIU Pei1, XU Xinxin1, LIU Tongxin2, WANG Xuan1, WANG Qingguo1,*
(1. Key Laboratory of Food Processing Technology and Quality Control in Shandong Province, College of Food Science and Engineering, Shandong Agricultural University, Tai’an 271018, China;2. Shandong Nutrition and Food Technology Co. Ltd., Jinan 251400, China)
DOI:10.7506/spkx1002-6630-201719039
中图分类号:TS255.36
文献标志码:A
文章编号:1002-6630(2017)19-0241-07
收稿日期:2016-10-13
基金项目:山东省2014年度农业重大应用技术创新课题“安全保鲜剂的创制”;
“十二五”国家科技支撑计划项目(2015BAD16B03)
作者简介:刘佩(1983—),女,讲师,博士,研究方向为食品生物技术及果蔬采后贮藏与加工。E-mail:liupei83224@163.com
*通信作者:王庆国(1965—),男,教授,硕士,研究方向为果品蔬菜贮藏及加工理论与技术。E-mail:wqgyyy@126.com
引文格式:
刘佩, 徐欣欣, 刘同信, 等. 过氧化氢处理对采后‘黄冠’梨果皮褐变及果实品质的影响[J]. 食品科学, 2017, 38(19):241-247. DOI:10.7506/spkx1002-6630-201719039. http://www.spkx.net.cn
LIU Pei, XU Xinxin, LIU Tongxin, et al. Effects of H2O2treatment on postharvest quality and skin browning of ‘Huangguan’pears[J]. Food Science, 2017, 38(19): 241-247. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719039.http://www.spkx.net.cn