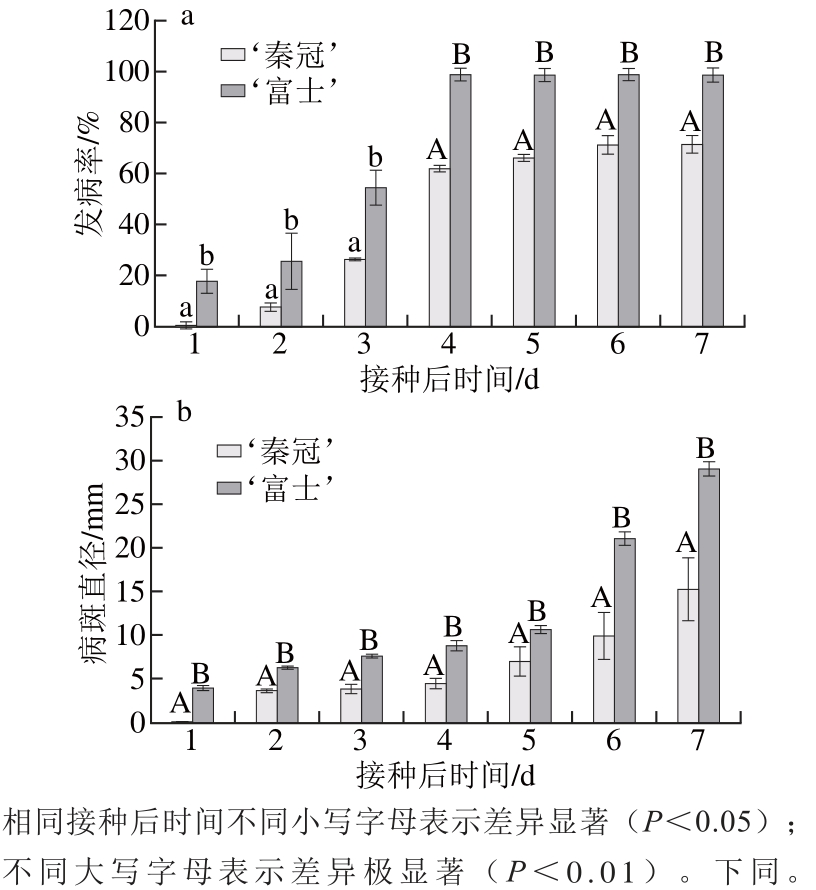
图1 不同品种苹果接种B. cinereeaa后常温(16±1)℃条件下发病率(a)和病斑直径(b)的变化
Fig. 1 Disease incidence (a) and lesion diameters (b) of different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
唐永萍,石亚莉,贺军花,马利菁,周会玲*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:以‘秦冠’、‘富士’苹果果实为材料,对损伤接种灰葡萄孢(Botrytis cinereaPers.)后果肉组织抗病相关物质及酶活力变化进行分析测定,揭示苹果采后灰霉病抗性差异的生理机制。结果表明:接种B. cinerea后,两种果实的发病率和病斑直径存在差异,其中‘秦冠’苹果发病率和病斑直径显著小于‘富士’苹果(P<0.05);进一步研究发现抗病品种果肉组织中苯丙氨酸解氨酶、过氧化物酶、多酚氧化酶、几丁质酶、β-1,3-葡聚糖酶活力均高于感病品种,从而促进抗病品种果肉中类黄酮和木质素的积累,降低膜脂过氧化程度,减少丙二醛的产生,提高了果实的抗病性,但总酚含量‘秦冠’苹果低于‘富士’苹果。研究结果可以为苹果灰霉病抗性鉴定和筛选抗灰霉病苹果资源提供理论指导。
关键词:苹果;灰霉病;抗病性;生理
Abstract:This study aimed to investigate the physiological mechanism behind the resistance of apples to postharvest gray mold. ‘Qinguan’ and ‘Fuji’ apple fruits were wounded and inoculated withBotrytis cinereaPers. The changes in compounds and enzyme activities related to the disease resistance in fl esh tissue were measured during subsequent storage. The results indicated that disease incidence and lesion diameters in ‘Qinguan’ apples were signifi cantly less than those in ‘Fuji’ apples after inoculation (P< 0.05). Moreover, the activities of phenylalanine solution ammonia lyase (PAL), peroxidase (POD),polyphenol oxidase (PPO), chitinase (CHI) andβ-1,3-glucanase (GLU) in the pulp of resistant varieties were higher than in susceptible varieties, facilitating the accumulation of flavonoids and lignin, reducing membrane lipid peroxidation,decreasing the production of malondialdehyde (MDA) and consequently increasing the disease resistance of fruits. However,the total phenolic content of ‘Qinguan’ apples was lower than that of ‘Fuji’ apples. These results provide a theoretical guidance for identifying the resistance of apples to postharvest gray mold and for screening resistant varieties.
Key words:apple; gray mold; resistance; physiology
苹果酸甜适口,营养丰富,无论是生食或加工制成的各种产品,都深受人们的喜爱。此外,苹果还具有较高的经济价值,不仅给农民群众带来可观的收益,大量苹果产品的出口,也给国家带来很大利益[1]。但苹果在采收、贮藏、包装及后期加工等一系列过程中容易遭受机械损伤,从而导致腐烂变质,给生产者和消费者带来巨大的损失[2]。苹果采后腐烂大多是由真菌引起[3],这些真菌可从花期潜伏到采收后发病,或直接从果实表面的伤口入侵,危害果实。灰霉病即是这些常见的真菌性病害之一[4-5],其致病菌灰葡萄孢(Botrytis cinereaPers.)具有很强的耐低温能力,即使在冷藏条件下也可导致苹果腐烂,且果实一旦发病,病斑会很快扩及全果,而且还会造成接触性传染,危及更多果实,造成严重损失。因此,探究安全有效的病害防治措施意义重大。目前生产上多使用保鲜剂、防腐剂、植物提取物等来延长苹果贮藏期。保鲜剂、防腐剂的使用大多对人体健康及环境带来不良影响,已经不适合现代人们对与食品安全和环保的要求,而植物提取物虽然较为安全,但是由于受到自然资源和提取工艺的限制,成本较高[1]。因此增强植物自身的抗病性是防治植物病害最根本最有效的途径。
前人研究表明,同一作物不同品种间抗性存在差异。田路明等[6]研究指出各种梨及其品种间对轮纹病抗性存在差异,依据两年182 个品种平均发病率进行抗性评价分级,72 个品种为高抗、63 个品种为抗、25 个品种为中抗、14 个品种为低抗、8 个品种为不抗。沙月霞等[7]针对葡萄对霜霉病的抗性不同,将16 个酿酒葡萄品种划分为4 类和19 个鲜食葡萄品种划分为4 类,分别为抗性稍强品种、抗性中等品种、稍感病品种、感病品种。有一些研究指出不同苹果品种的抗病性也存在差异。如胡小平等[8]对我国15 个主要苹果种质资源果实黑星病抗性进行了评价,结果表明高度抗病包括‘秦冠’等2 个品种,中度抗病品种1 个,中度感病品种6 个,高度感病品种6 个。张玉经等[9]对279 份苹果种质资源的果实对轮纹病的抗病性进行室内接种,鉴定得出‘珍宝’、‘金沙依拉姆’和‘红玉’为高抗材料;‘詹姆斯格里斯’、‘红夏’、‘耍红’、‘伊朗桃苹’、‘超等蔷薇’和‘极早红’为高感材料。
为探究不同品种间抗性差异的机理,很多学者展开了研究。如韩珊等[10]发现几丁质酶(chitinase,CHI)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)、植物保卫素是板栗愈伤组织抵抗栗疫菌Cp-毒素的内在机制,而游离脯氨酸含量变化不是引起品种抗性差异的重要因子。刘海英等[11]发现苹果果实所含的酚类物质对抵抗轮纹病菌侵入和扩展都有作用,而酸类物质主要抑制轮纹病菌在果实内的扩展,在幼果期钙的含量是果实发病的关键因子[10]。汪良驹等[12]的研究结果表明,苹果苦痘病果实钙离子含量明显低于正常果实。而对于苹果采后灰霉病抗性差异的生理鲜见详细报道。为此,本研究通过对‘秦冠’、‘富士’2 个品种采后灰霉病抗性比较,探讨采后灰霉病抗性差异,并通过对抗病相关物质及酶活性变化进行分析测定,揭示苹果采后灰霉病抗性差异的生理机制,以期为苹果灰霉病抗性鉴定和筛选抗灰霉病资源提供理论指导。
1.1 材料与试剂
灰葡萄孢(Botrytis cinereaPers.)由西北农林科技大学植物保护学院提供。
‘秦冠’、‘富士’苹果,于2015年10月22日采自西北农林科技大学白水实验站。挑选果形端正,大小、色泽基本一致,无机械损伤,无自然病虫害的果实,采摘当天运回实验室,放置24 h散去田间热。
葡萄糖、琼脂、无水乙醇、愈创木酚、十二水合磷酸氢二钠、二水合磷酸二氢钠、β-巯基乙醇、L-苯丙氨酸、葡萄糖、30%过氧化氢、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-Na2)、邻苯二甲酸氢钾、硼砂、无水醋酸钠、TritonX-100、浓盐酸、冰醋酸、硼酸均为国产分析纯。
1.2 仪器与设备
BCD-236DT型冰箱 青岛海尔股份有限公司;AUY220分析天平 日本岛津公司;SW-CJ-LB型无菌操作台 苏净集团安泰公司;3K15型高速冷冻离心机美国Sigma公司;HHS 21-4电热恒温水浴锅 北京长安科学仪器厂;UV-1800紫外-可见分光光度计 科大中佳公司;KQ-500DB数控超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 灰葡萄孢菌液制备
将菌种在PDA培养基上进行继代培养,23 ℃条件下恒温避光培养7 d后,用含0.05% Tween-80的无菌水冲洗培养皿将菌落上的分生孢子冲洗下来,采用血球计数板制成浓度约为1×106个/mL的孢子悬浮液。
1.3.2 接种灰葡萄孢菌液
接种前先用70%乙醇轻轻擦拭苹果,对果皮进行消毒,自然晾干。然后在每个苹果的赤道部位阴阳两面用无菌不锈钢铁钉(Φ=3 mm)扎2 个均匀、大小一致的伤口(3 mm×3 mm)。待伤口处汁液晾干后,分别接种20 μL 1×106个/mL灰葡萄孢悬浮液。晾干后,放入消毒过的聚氯乙烯保鲜袋(用70%的乙醇擦拭消毒),于常温(16±1)℃平铺实验台。
固定50 个果实,每天统计发病率和测量病斑直径,用于研究不同品种苹果对灰霉病的抗性,重复3 次。接种后0、1、2、3、4、5、6、7 d分别取样,每次取15 个苹果,取病斑周围1 cm范围内健康果肉组织混匀,用液氮研磨仪研成粉末后锡箔纸包裹,于-80 ℃保存,用于测定抗性相关物质及酶活力。
1.3.3 指标测定
1.3.3.1 发病率和病斑直径测定
发病率:发病伤口数占总接种伤口数的百分比,以病斑直径不小于3.5 mm确定为发病;病斑直径:利用游标卡尺进行十字交叉法测定,取平均值。
1.3.3.2 苯丙氨酸解氨酶活力测定
参考曹建康等[13]方法测定苯丙氨酸解氨酶(phenylalanine amonialyase,PAL)活力,略有改动;称取1.0 g左右果肉,加入5 mL、0.1 mol/L、pH 8.8的硼酸提取缓冲液(含40 g/L聚乙烯吡咯烷酮、2 mmol/L EDTA和5 mmol/Lβ-巯基乙醇),冰浴条件下研磨成匀浆,于4 ℃、12 000×g离心30 min,取上清液测定。取2 支试管,均分别加入3 mL 50 mmol/L、pH 8.8 硼酸缓冲液和0.05 mL粗酶提取液,然后一支试管加入0.05 mL 20 mmol/LL-苯丙氨酸,另一支加入0.05 mL蒸馏水作为对照。将2 支试管于37 ℃温水中保温60 min,使生成反式肉桂酸,结束时均立即加入0.1 mL 6 mol/L盐酸溶液以终止反应。290 nm波长处分别测定反应管和对照管的吸光度,以每小时酶促反应体系吸光度增加1作为一个酶活力单位,结果以U/g表示,重复3 次。
1.3.3.3 过氧化物酶、多酚氧化酶活力测定
过氧化物酶(peroxidase,POD)活力测定采用邻苯二酚法。取1 g左右粉末样品,加入5 mL预冷(4 ℃)的pH 7.0 的磷酸缓冲液,充分混匀后静置提取1 h,期间摇动数次,然后在4 ℃、12 000×g冷冻离心30 min,取上清液作为粗酶液测定相应酶活力。反应体系为:2 mL pH 7.0 磷酸缓冲液加1 mL邻苯二酚(用50 mmol/L、pH 7.0磷酸缓冲液配制),再加0.05 mL粗酶液,混匀后15 s在420 nm波长处测定OD值。酶活力单位(U)以每克鲜样每分钟OD变化值表示,重复3 次。
多酚氧化酶(polyphenol oxidase,PPO)活力测定采用愈创木酚法。PPO粗酶液的提取方法同POD,愈创木酚与H2O2均用pH 5.5乙酸乙酸钠缓冲液溶解,反应体系为:200 μL H2O2加3 mL的愈创木酚,再加入0.05 mL 粗酶液,混匀后15 s在470 nm波长处测定OD值。酶活力单位(U)以每克鲜样每分钟OD变化值表示,重复3 次。
1.3.3.4 几丁质酶、β-1,3-葡聚糖酶活力测定
CHI活力测定:参考袁仲玉等[14]方法,称取1 g 左右果肉,加入5 mL、pH 5.0、0.1 mol/L的醋酸缓冲液(含1 mmol/L EDTA-Na2和5 mmol/LL-巯基乙醇)冰浴研磨呈匀浆后,在4 ℃、12 000×g离心30 min,取上清提取液来测定酶活力。取0.05 mL粗酶提取液与0.3 mL 10 g/L的胶状几丁质悬浮液混合,在37 ℃保温1 h后加入0.1 mL质量分数为3%的脱盐蜗牛酶,继续在37 ℃保温1 h,使生成N-乙酰葡萄糖胺(N-acetylglucosamine,Glc-NAc)单体。然后加入0.2 mL 0.6 mol/L的四硼酸钾溶液,沸水浴5 min后迅速冷却。再加入2 mL质量分数2%二甲基胺硼烷溶液,在37 ℃温水中保温10 min 显色,最后在585 nm波长处测定反应液的吸光度。用煮沸5 min的酶液作对照,计算Glc-NAc的生成量。以每分钟每克蛋白分解胶状几丁质产生的1×10-9mol Glc-NAc为一个酶活力单位,即(U/g)。重复3 次。
GLU活力测定:粗酶提取液制备方法同上,采用蒽酮法测定620 nm波长处的OD值,计算糖的生成量。以每分钟每克果肉催化底物产生1 nmol的葡萄糖为一个酶活力单位(U)。重复3 次。
1.3.3.5 总酚和类黄酮含量测定
称取果肉样品1.0 g左右,加入预冷体积分数为1%盐酸-甲醇溶液5 mL,冰浴下研磨呈匀浆,在4 ℃条件下提取1 h后,于4 ℃、12 000×g离心30 min。取上清液分别在280 nm和325 nm波长处测定总酚、类黄酮的吸光度。分别参考Toor[15]、González-Aguilar[16]等方法测定,以没食子酸、芦丁制作标准曲线,分别计算总酚和类黄酮的含量。1.3.3.6 木质素含量测定
参考周会玲等[17]方法,木质素含量以每克鲜质量果肉在280 nm波长处的OD值表示。
1.3.3.7 丙二醛含量测定
丙二醛(malondialdehyde,MDA)含量参照高俊凤[18]的测定方法。
1.4 数据处理
数据统计分析应用SPSS 17.0软件进行单因素方差分析,作图采用Excel软件,采用邓肯氏多重比较法进行差异显著性分析。
2.1 不同品种苹果灰霉病抗性比较

图1 不同品种苹果接种B. cinereeaa后常温(16±1)℃条件下发病率(a)和病斑直径(b)的变化
Fig. 1 Disease incidence (a) and lesion diameters (b) of different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
如图1a所示,‘秦冠’和‘富士’接种B. cinerea后,发病情况明显不同。‘富士’苹果接菌后第1天发病率达到18.1%,然后发病率持续增高,至第4天达到98.5%,而‘秦冠’苹果接菌第1天,发病率仅为0.7%,然后缓慢上升,至第4天发病率增加到61.9%,且不再增加。‘秦冠’的发病率始终显著低于‘富士’(P<0.05),且在第4~7天差异达到极显著(P<0.01)。如图1b所示,与发病率相似,接种B. cinerea后,‘富士’的病斑直径极显著高于‘秦冠’(P<0.01),在接种第7天,‘富士’的病斑直径达到29.2 mm,而‘秦冠’仅为15.3 mm,远低于‘富士’。因此,‘秦冠’对灰霉病的抗性较‘富士’强。
2.2 苹果接种B. cinerea后PAL活力的变化

图2 不同品种苹果接种B. cinerea后在常温(16±1)℃条件下果实
PAL活力的变化
Fig. 2 PAL activity in different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
PAL是植物在抗病反应时酚类代谢中莽草酸途径的关键酶和限速酶,其对于木质素、植保素和酚类物质的合成积累都起着至关重要的作用。接种B. cinerea后,‘秦冠’和‘富士’的PAL活力整体呈显先升高后下降的趋势(图2),但‘秦冠’的PAL活力始终高于‘富士’,尤其是接种第3天,‘秦冠’的PAL活力达到高峰,与‘富士’差异达到极显著(P<0.01)。结果表明抗灰霉病的苹果在受到B. cinerea侵染时果肉的PAL活力的迅速升高,从而提高苹果抗病性。
2.3 苹果接种B. cinerea后POD和PPO活力的变化
PPO和POD参与酚类物质氧化和活性氧代谢。如图3a所示,‘富士’POD活力在整个时期变化不大,但两者的POD活力的变化均呈先上升后下降趋势且在4 d达到活力高峰。‘秦冠’的POD活力变化平均值约是‘富士’的50 倍,‘秦冠’的POD活力始终极显著高于‘富士’(P<0.01)。‘秦冠’苹果在受到B. cinerea侵染后POD活力前3 d缓慢增加,第3天时迅速升高,在第4天达到最大值,而后快速下降然后保持平稳并一直处于较高水平。如图3b所示,在接种B. cinerea常温(16±1)℃贮藏条件下,‘秦冠’的PPO活力迅速上升,在第6天时达到活力高峰,而后快速下降;‘富士’的PPO活力在0~1 d和5~6 d这两个阶段迅速升高,其他阶段缓慢增加,至6 d达到高峰值,然后迅速下降;整个时期,‘秦冠’、‘富士’的PPO活力差异显著(P<0.05),均是‘秦冠’高于‘富士’。

图3 不同品种苹果接种B. cinerea后在常温(16±1)℃条件下果实POD(a)、PPO(b)活力的变化
Fig. 3 POD (a) and PPO (b) activities in different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
2.4 苹果接种B. cinerea后CHI和GLU活力的变化
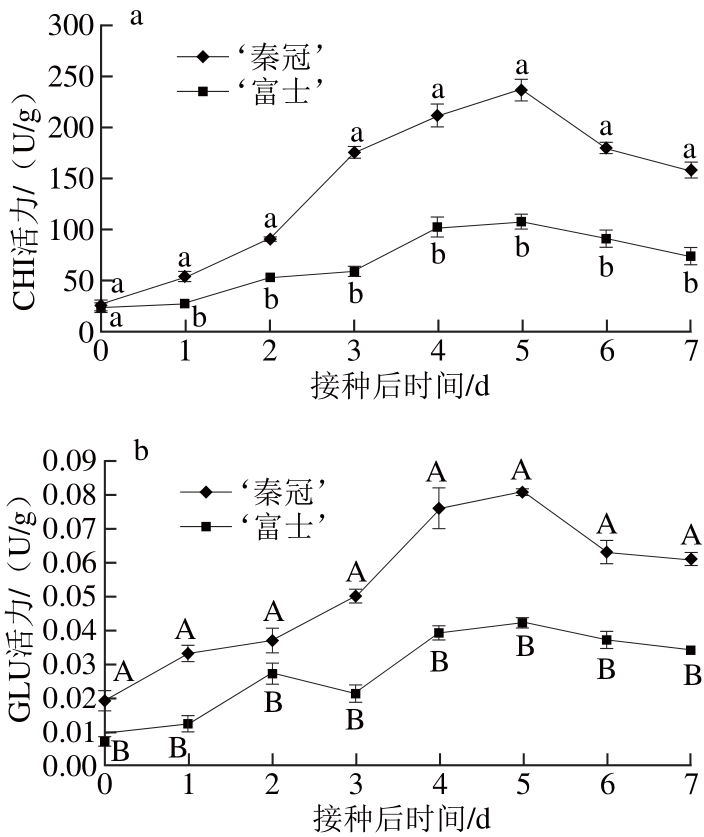
图4 不同品种苹果接种B. cinerea后在常温(16±1)℃条件下果实CHI(a)、GLU(b)活力的变化
Fig. 4 CHI (a) and GLU (b) activities in different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
CHI能够破坏病原菌的细胞壁结构,与植物抵御病原菌入侵的防御机制密切相关。接种灰葡萄孢后,CHI活力均呈现性迅速升高,然后呈下降趋势。如图4a所示,‘秦冠’的CHI活力在整个观察期始终显著高于‘富士’(P<0.05)。GLU作为一种病程相关蛋白,受病原菌侵染、机械损伤和环境胁迫条件的诱导。‘秦冠’和‘富士’果实接种B. cinerea后,GLU活力均呈现先升高后下降的趋势,但变化幅度不尽相同。如图4b所示,‘秦冠’的GLU活力在接种后大幅上升,达到峰值后缓慢下降,在整个贮藏期始终极显著高于‘富士’(P<0.01),而‘富士’的GLU活力变化则较缓慢,两者的GLU活力均在接种后5 d达到最大值。
2.5 不同品种苹果的总酚和类黄酮含量变化
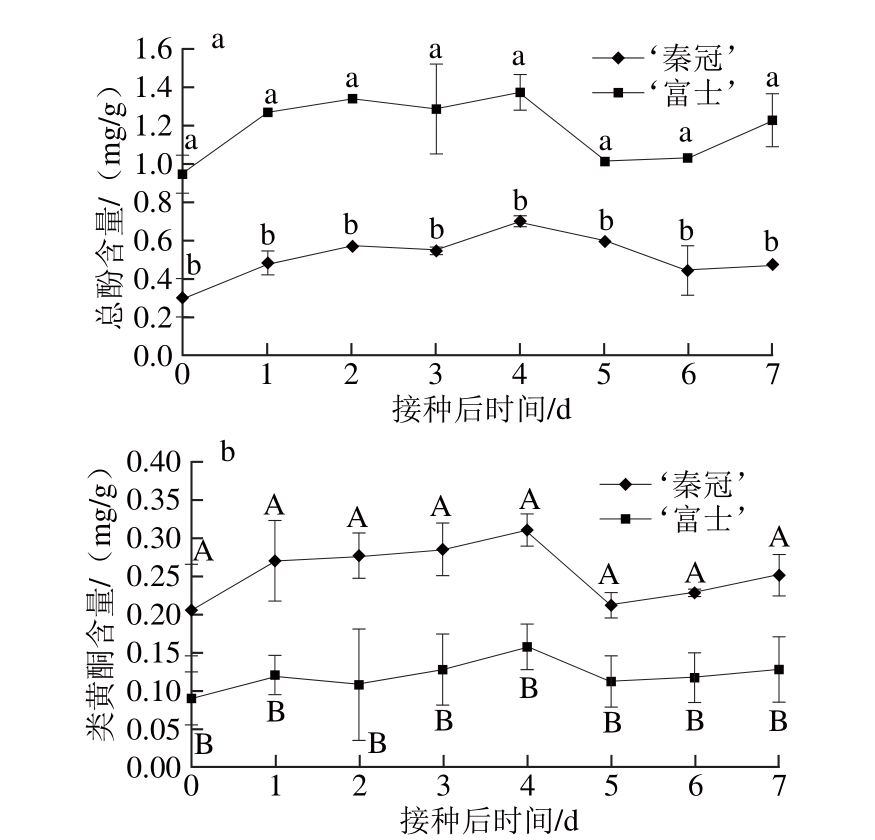
图5 不同品种苹果接种B. cinereeaa后在常温(16±1)℃条件下果实总酚(a)、类黄酮(b)含量的变化
Fig. 5 Total phenols (a) and total fl avonoids (b) contents of different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
从图5a可以看出,接种B. cinerea后,‘秦冠’和‘富士’总酚含量的变化整体呈先升高后下降趋势。‘秦冠’和‘富士’总酚含量缓慢增加,到4 d时增加到高峰值;‘富士’的总酚含量始终显著高于‘秦冠’(P<0.05)。类黄酮含量的变化整体表现与总酚含量变化相似(图5b)。‘秦冠’和‘富士’到4 d时类黄酮含量增加到高峰值,在受到灰霉侵染时‘秦冠’较‘富士’的类黄酮上升的速率快而后两者都缓慢下降;‘秦冠’的类黄酮含量始终极显著高于‘富士’(P<0.01)。
2.6 不同品种苹果的木质素含量变化
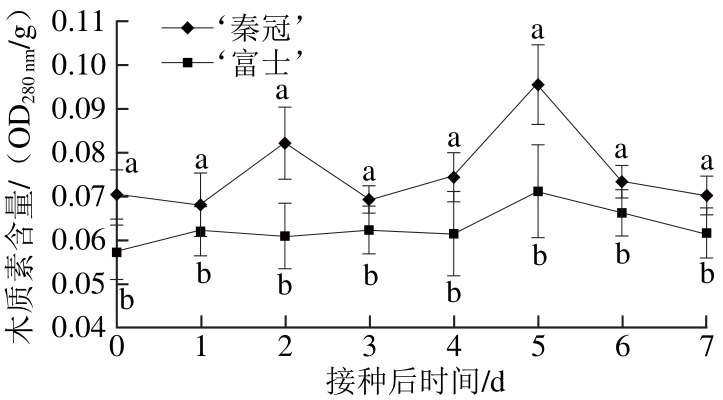
图6 不同品种苹果接种B. cinerea后在常温(16±1)℃条件下果实木质素含量的变化
Fig. 6 Lignin contents of different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
木质素作为植物体内一种重要的物理抗菌物质,它与富含羟脯氨酸的糖蛋白(hydroxyproline-rich glycoprotein,HRDP)一起作为一道屏障,强固细胞壁、保护细胞免受病原菌侵害,增强植物对于病害的抗性。如图6所示,接种B. cinerea后,木质素含量整体呈先升高后下降趋势,‘富士’在5 d时木质素含量增加到高峰值之后缓慢降低,‘秦冠’有两个含量高峰,分别是2、5 d;‘秦冠’的木质素含量自始至终高于‘富士’,且差异显著(P<0.05)。说明苹果受到B. cinerea侵染时,木质素在宿主细胞内快速合成与积累是苹果阻止病原菌扩张的重要抗性机制。
2.7 不同品种苹果的MDA含量变化
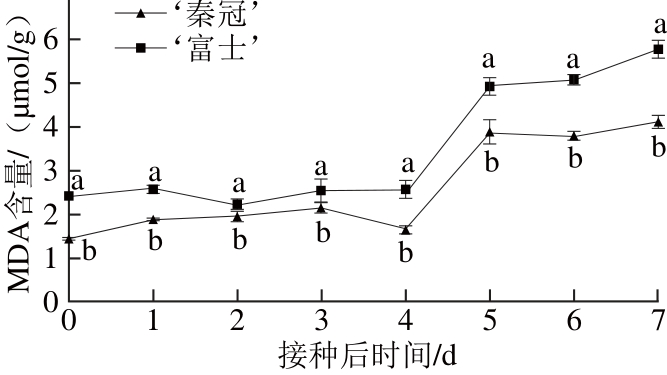
图7 不同品种苹果接种B. cinerea后在常温(16±1)℃条件下果实MDA含量的变化
Fig. 7 MDA contents of different apple varieties inoculated withB. cinereaand stored at (16±1) ℃
MDA作为果实膜脂过氧化的中间产物,它的产量的多少常常用来衡量膜脂过氧化程度。由于打孔损伤导致各处理MDA含量呈现上升趋势。如图7所示,接种B. cinerea后,‘秦冠’和‘富士’MDA含量在前中期变化较为缓慢,后期增加迅速,但‘秦冠’的MDA含量始终低于‘富士’(P<0.05)。由此表明,‘秦冠’有效抑制了苹果果肉膜脂过氧化的进程。
发病率和病斑直径的大小是抗病性评价的重要指标,抗病性材料表现为发病率低、病斑小[9]。接种B. cinerea后,在常温条件下,‘秦冠’的发病率和病斑直径均显著小于‘富士’(P<0.05),因此‘秦冠’和‘富士’对灰霉病抗性表现出明显的差异,‘秦冠’对灰霉病抗性较‘富士’强。
POD、PAL、PPO是植物抗病过程中3 种重要的防御酶,当植物体受病原菌侵染后,POD、PAL、PPO活力升高,并与抗病性呈正相关,可作为衡量植物抗病性的指标[19]。本实验研究发现,接种B. cinerea后,‘秦冠’的PAL、POD、PPO活力显著高于感病品种‘富士’(P<0.05),这与陈年来等[19]在甜瓜上的研究结果相一致。接种B. cinerea后,在‘秦冠’和‘富士’的PAL、POD、PPO 3 种酶中,POD活力差异最大,‘秦冠’的POD活力变化平均值约是‘富士’的50 倍。POD是寄主植物细胞内抵御活性氧伤害的一种主要保护酶类,在清除活性氧、阻止活性氧的形成等方面起着重要作用,其活性可间接反映植物体内活性氧的代谢变化,与植物的抗病性反应密切相关[21];且POD活力较高还对于加强植物体内酚类物质氧化产生醌类和木质素、植保素等抗性物质的合成起一定作用。因此认为POD活力越高,对灰霉病抗性越强,这与易龙等[22]在脐橙柑橘溃疡病上的研究结果相一致。
CHI和GLU作为病程相关蛋白,能够直接破坏病原菌的细胞结构,在抵御病原菌侵染中起着重要的防卫作用。本研究中,‘秦冠’的CHI和GLU活力均显著高于‘富士’(P<0.05),在抵御灰霉菌的侵染中发挥了重要作用,最终大大抑制了病斑的扩展,显著降低了果实的发病率,这与前人在芒果[23]、柑橘[24]、桃[25]和草莓[26]等的研究相一致。
植保素、木质素和酚类化合物等在内的次生抗病物质具有杀菌、抗病毒、清除自由自等多种生物活性,参与果实的防御反应。Matern等[27]研究认为,植物防御病原物侵染的第一步反应就是诱导产生酚类化合物。Dicko等[28]的研究结果指出,植物体内原有的酚含量与其抗病性无关,总酚含量并不能作为判定植物抗病性的生理指标,但是与诱导生成的酚含量具有相关性。本实验研究结果表明,受到灰霉病菌侵染后,‘秦冠’和‘富士’的总酚含量较接菌前都有所增加,但‘秦冠’诱导生成的总酚含量却低于‘富士’,可能是不同品种苹果果肉酚类物质组成和含量存在基因型差异[29],而不同的酚类物质组分的抗病性又存在差异如李丽梅等[30]研究指出绿原酸和表儿茶素较熊果苷对1,1-二苯基-2-三硝基苯肼自由基、羟自由基清除能力强,且王思新等[31]研究指出‘秦冠’苹果果肉的绿原酸含量高于‘富士’。‘秦冠’的类黄酮和木质素含量自始至终均显著高于‘富士’(P<0.05),由此可见‘秦冠’、‘富士’的类黄酮和木质素含量与它们的抗病性呈正相关,这与乔宝营等[32]对葡萄霜霉病抗性的研究结果一致。
MDA是膜脂过氧化作用的主要产物之一,损伤细胞膜结构,从而使细胞内的电解质外渗,降低植物体的抗逆性并加速其衰老,常被作为衡量膜脂过氧化程度的指标[33]。本实验结果发现,抗性品种‘秦冠’果实MDA含量较低,抑制了苹果果肉膜脂过氧化的进程从而减弱MDA对果实的伤害。
接种B. cinerea后,‘秦冠’和‘富士’对灰霉病抗性表现出明显的差异,抗病品种‘秦冠’的防御酶PAL、PPO、POD、CHI和GLU活力显著高于‘富士’(P<0.05),从而减少膜脂过氧化产物MDA积累,促进次生代谢物质类黄酮以及木质素的合成与积累,但总酚含量‘秦冠’低于‘富士’,因此,对苹果采后酚类物质具体组分与抗病相关性有待进一步研究。
参考文献:
[1] 尹明安, 李玉娟, 任小林. 低剂量短波紫外线照射提高采后苹果抗病性[J]. 农业工程学报, 2015, 31(2): 324-332. DOI:10.3969/j.issn.1002-6819.2015.02.045.
[2] RAMOS B, MILLER F A, BRANDÃO T R S, et al. Fresh fruits and vegetables: an overview on applied methodologies to improve its quality and safety[J]. Innovative Food Science & Emerging Technologies, 2013, 20(1): 1-15. DOI:10.1016/j.ifset.2013.07.002.
[3] XU Lingfei, DU Yanmin. Effects of yeast antagonist in combination with UV-C treatment on postharvest diseases of pear fruit[J].BioControl, 2012, 57(3): 451-461. DOI:10.1007/s10526-011-9400-8.
[4] 李鹏霞, 邵世达, 冯俊涛, 等. 丁香精油和丁香酚对苹果贮藏期病害及果实品质的影响[J]. 农业工程学报, 2006, 22(6): 173-177.DOI:1002-6819( 2006) 06-0173-05.
[5] TANG W, DING Z, ZHOU Z Q, et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China isBotryosphaeria dothidea[J]. Plant Disease, 2012, 96: 486-496.DOI:10.1094/PDIS-08-11-0635.
[6] 田路明, 董星光, 曹玉芬, 等. 梨品种资源果实轮纹病抗性的评价[J].植物遗传资源学报, 2011, 12(5): 796-800. DOI:10.13430/j.cnki.jpgr.2011.05.028.
[7] 沙月霞, 王国珍, 樊仲庆, 等. 宁夏贺兰山东麓不同葡萄品种对霜霉病的抗性鉴定[J]. 果树学报, 2007, 24(6): 803-809. DOI:10.3969/j.issn.1009-9980.2007.06.017.
[8] 胡小平, 梁振宇, 杨家荣, 等. 我国主要苹果种质抗黑星病评价[J].中国生态农业学报, 2008, 16(5): 1192-1196. DOI:10.3724/SP.J.1011.2008.01192.
[9] 张玉经, 王昆, 王忆, 等. 苹果种质资源果实轮纹病抗性的评价[J].园艺学报, 2010, 37(4): 539-546. DOI:10.16420/j.issn.0513-353x.2010.04.015.
[10] 韩珊, 朱天辉, 谯天敏, 等. 板栗愈伤组织对栗疫菌Cp-毒素的抗性响应[J]. 南京林业大学学报(自然科学版), 2015, 39(5): 1-6.DOI:10.3969/j.issn.1000-2006.2015.05.001.
[11] 刘海英, 李川, 范永山, 等. 影响苹果果实轮纹病抗性的寄主因素及相关性分析[J]. 河北农业大学学报, 2003, 26(1): 56-60.DOI:10.3969/j.issn.1000-1573.2003.01.015.
[12] 汪良驹, 姜卫兵, 何岐峰, 等. 苹果苦痘病的发生与钙、镁离子及抗氧化酶活性的关系[J]. 园艺学报, 2001, 28(3): 200-205.DOI:10.3321/j.issn:0513-353X.2001.03.003.
[13] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[J]. 北京: 中国轻工业出版社, 2007: 1-12. DOI:10.1002/app.33935.
[14] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-263. DOI:10.7607/j.issn.1004-1389.2013.12.016.
[15] TOOR R K, SAVAGE G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International, 2005, 38(5): 487-494.DOI:10.1016/j.foodres.2004.10.016.
[16] GONZÁLEZ-AGUILAR G A, VILLEGAS-OCHOA M A,MARTÍNEZ-TÉLLEZ M A, et al. Improving antioxidant capacity of fresh-cut mangoes treated with UV-C[J]. Journal of Food Science,2007, 72(Suppl 3): 197-202. DOI:10.1111/j.1750-3841.2007.00295.x.
[17] 周会玲, 袁仲玉, 吴主莲, 等. 壳聚糖涂膜对机械伤苹果抗性生理特征的影响[J]. 西北植物学报, 2013, 33(7): 1415-1420. DOI:1000-4025(2013)07-1415-06.
[18] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006:210-211.
[19] 陈年来, 胡敏, 代春艳, 等. 诱抗处理对甜瓜叶片酚类物质代谢的影响[J]. 园艺学报, 2010, 37(11): 1759-1766. DOI:10513-353X(2010)04-0539-08.
[20] 周晓婉, 唐永萍, 石亚莉, 等. 1-MCP对低温贮藏苹果灰霉病抗性的诱导作用[J]. 食品科学, 2016, 37(12): 254-260. DOI:10.7506/spkx1002-6630-201612046.
[21] MEHDY M C, SHARMA Y K, SATHASIVAN K, et al. The role of activated oxygen species in plant disease resistance[J].Physiologia Plantarum, 1996, 98(2): 365-374. DOI:10.1034/j.1399-3054.1996.980219.x.
[22] 易龙, 夏宜林, 赖爱萍, 等. 脐橙品种‘赣南早’与‘纽荷尔’对柑橘溃疡病的抗性比较[J]. 果树学报, 2016, 33(4): 466-472. DOI:10.13925/j.cnki.gsxb.20150308.
[23] HU M J, YANG D P, HUBER D J, et al. Reduction of postharvest anthracnose and enhancement of disease resistance in ripening mango fruit by nitric oxide treatment[J]. Postharvest Biology and Technology,2014, 97(1): 115-122. DOI:10.1016/j.postharvbio.2014.06.013.
[24] LUO Y, ZENG K, MING J. Control of blue and green mold decay of citrus fruit by pichia membrane faciens and induction of defense responses[J]. Scientia Horticulturae, 2012, 135(24): 120-127.DOI:10.1016/j.scienta.2011.11.031.
[25] LIU J, SUI Y, WISNIEWSKI M, et al. Effect of heat treatment on inhibition ofMonilinia fructicolaand induction of disease resistance in peach fruit[J]. Postharvest Biology and Technology, 2012, 65(1):61-68. DOI:10.1016/j.posthar vbio.2011.11.002.
[26] SHAO X, WANG H, XU F, et al. Effects and possible mechanisms of tea tree oil vapor treatment on the main disease in postharvest strawberry fruit[J]. Postharvest Biology and Technology, 2013, 77(1):94-101. DOI:10.1016/j.postharvbio.2012.11.010.
[27] MATERN K. Phenolic compounds in plant disease resistance[J].Phytoparasitica, 1988, 16(2): 153-170. DOI:10.1007/BF02980469.
[28] DICKO M H, GRUPPEN H, BARRO C, et al. Impact of phenolic compounds and related enzymes in sorghum varieties for resistance and susceptibility to biotic and abiotic stresses[J]. Journal of Chemical Ecology, 2005, 31(11): 2671-2688. DOI:10.1007/s10886-005-7619-5.
[29] 乜兰春, 孙建设. 不同品种苹果果实主要酚类物质含量的研究[J]. 中国食品学报, 2005, 5(3): 118-121. DOI:1009-7848(2005)03-0118-04.
[30] 李丽梅, 赵哲, 何近刚, 等. 不同品种梨果实酚类物质和抗氧化性能分析[J]. 食品科学, 2014, 35(17): 83-88. DOI:10.7506/sPkx1002-6630-201417017.
[31] 王思新, 刘杰超, 焦中高, 等. 苹果中多酚物质及其在果实发育过程中的变化[J]. 果树学报, 2003, 20(6): 427-431. DOI:10.3969/j.issn.1009-9980.2003.06.001.
[32] 乔宝营, 黄海帆, 刘崇怀, 等. 几种理化因素与葡萄霜霉病抗性的关系[J]. 果树学报, 2014, 31(5): 901-905. DOI:10.13925/j.cnki.gsxb.20130450.
[33] POSMYK MM, BAILLY C, SZAFRAŃSKA K, et al. Antioxidant enzymes and isoflavonoids in chilled soybean (Glycine max(L.)Merr.) seedlings[J]. Journal of Plant Physiology, 2005, 162: 403-412.DOI:10.1016/j.jplph.2004.08.004.
Cultivar Differences in Postharvest Grey Mould Disease Resistance and Physiological of Apples
TANG Yongping, SHI Yali, HE Junhua, MA Lijing, ZHOU Huiling*
(College of Horticulture, Northwest A & F University, Yangling 712100, China)
DOI:10.7506/spkx1002-6630-201719040
中图分类号:S661.1
文献标志码:A
文章编号:1002-6630(2017)19-0248-06
引文格式:
唐永萍, 石亚莉, 贺军花, 等. 苹果采后灰霉病抗性生理差异分析[J]. 食品科学, 2017, 38(19): 248-254. DOI:10.7506/spkx1002-6630-201719040. http://www.spkx.net.cn
TANG Yongping, SHI Yali, HE Junhua, et al. Cultivar differences in postharvest grey mould disease resistance and physiological of apples[J]. Food Science, 2017, 38(19): 248-254. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719040. http://www.spkx.net.cn
收稿日期:2016-08-28
基金项目:国家现代农业(苹果)产业技术体系建设专项(nycylx-08-05-02)
作者简介:唐永萍(1991—),女,硕士研究生,研究方向为园艺产品采后生理及贮藏保鲜。E-mail:1540031309@qq.com
*通信作者:周会玲(1969—),女,副教授,博士,研究方向为园艺产品采后处理及贮藏保鲜。E-mail:zhouhuiling@nwsuf.edu.cn