表1 正交试验因素与水平设计
Tabllee 11 Factors and their coded levels used for orthogonal array dessiiggnn
张 婕1,凡先芳1,姚世响1,2,邓丽莉1,2,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:研究李果实褐腐病病原菌产生细胞壁降解酶的种类及其产酶最佳条件,并探讨其导致果实发病的作用机制。以Monilinia fructicola为研究菌株,通过 单因素试验和正交试验优化M. fructicola产生细胞壁降解酶条件;通过损伤接种粗酶液,研究其对李果实的致病作用。结果表明:M. fructicola产细胞壁降解酶的最佳条件为:培养时间6 d、培养基pH 6.0、碳源 为3.5%蔗糖、氮源为2.5%硝酸钾;粗酶液处理能够导致李果实发生褐腐病,同时引起果实多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲基半乳糖醛酸酶(pectin methylgalacturonase,PMG)活力的上升,使果实原果胶物质转化为可溶性果胶,同时造成其纤维素含量下降,加速果实的软化腐烂进程。
关键词:褐腐病;细胞壁降解酶;李果实;致病机理
Abstract: The aims of this study were to optimize the culture conditions of Monilinia fructicola for the production of cell wall degrading enzymes (CWDE) and to clarify the role of the culture supernatant obtained as crude CWDE in the pathogenesis of brown rot caused by Monilinia fructicola in postharvest plums. The optimization of the culture conditions was carried out using one-factor-at-a-time and orthogonal array design methods. Besides, the pathogenesis was investigated by wounding and inoculating plum fruits w ith the crude CWDE and observing the incidence of brown rot. The results showed that the optimal culture conditions were as follows∶ culture time, 6 d; pH, 6.0; 3.5% sucrose as carbon source; and 2.5% KNO3as nitrogen source. The crude enzymes produced by M. fructicola could cause brown rot of plum fruits. In addition, the activities of polygalacturonase (PG), pectin methylgalacturonase (PMG) in the fruits inoculated with the crude enzymes were enhanced, thereby leading to the conversion of insoluble protopectin to soluble pectin and cellulose reduced cellulose content and consequently accelerating the softening and rotting process.
Key words: brown rot; cell wall degrading enzymes; plum; pathogenesis
青脆李属蔷薇科核果类,是我国西南地区的特色水果之一。其肉质致密、味甜汁多、营养丰富,是李树的优良品种,深受消费者喜爱。青脆李果实成熟时期正值盛夏高温、高湿季节(每年7~8月),加之其果皮较薄,汁液丰富,损伤后极易受病原微生物的侵染导致腐烂。其中由Monilinia spp.引起的褐腐病是李果实采后的主要侵染性病害[1]。Monilinia spp.主要分为以下3 种:美澳型核果褐腐病菌(M. fructicola (Winter) Honey)、果生链核盘菌(Monilinia fructigena (Aderh. et Ruhl.)Honey)、核果链核盘菌(Monilinia laxa (Aderh. et Ruhl.)Honey),其中,M. fructicola是李果实褐腐病的最主要致病菌[2-4]。
病原菌致病因子研究是人们探索植物与病原菌互作关系的重要内容之一。宿主细胞壁是阻止病原真菌侵入的一道屏障。病原真菌通过分泌多种细胞壁降解酶,降解组成宿主细胞壁的各种多糖物质,从而破坏细胞壁和胞间层,或导致细胞分离,组织溃散[5]。细胞壁降解酶具有双重作用,一方面作为病原物侵染宿主的致病因子,另一方面酶解产物能诱导宿主防御反应,为寄主-病原物之间的互作提供一定的参考[6]。大多数病原真菌都能分泌各种细胞壁降解酶,主要包括果胶酶、纤维素酶等[5,7]。果胶酶是作用于果胶质的一类酶的总称,主要功能是通过裂解或消去作用切断果胶质中的糖苷键,使果胶质裂解为多聚半乳糖醛酸。其主要分为果胶酯酶、原果胶酶、果胶裂解酶 和聚半乳糖醛酸酶等几大类[8]。病原菌主要可以分泌果胶酶中的多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲基半乳糖醛酸酶(pectin methylgalacturonase,PMG),破坏果实的细胞壁。Chiu等[9]研究表明,褐腐菌在致病的过程中,与PG相关的果胶基因大量的表达,这证实了果胶酶在致病过程中发挥了重要的作用。纤维素酶是一类能降解纤维素的水解酶。纤维素酶是一组由几种酶构成的一类酶,分别为内1,2-β-D-葡聚糖酶(endoglucanase,EG)、1,4-β-D-葡聚糖纤维二糖水解酶(4-β-D-glucanase,CX)和β-葡萄糖苷酶[7]。薛莲等[10]发现活体外苹果炭疽菌产生的胞外酶中均能够检测到羧甲基纤维素酶(4-β-D-glucanase,CX),并且活体内接种有炭疽病的果实CX活力显著高于健康果实,这在一定程度上证实了CX在炭疽病病原菌致病过程中的作用。另外,在果实软化早期,β-半乳糖苷酶含量丰富,能够参与降解细胞壁半乳糖苷键,导致细胞壁的不完整性[11]。
然而,不同的病原菌所分泌的细胞壁降解酶是不同的,并且不同的降解酶在致病过程中发挥的作用也不同。目前,对于影响病原菌产酶作用的报道并不多。有研究表明,环境pH值和碳、氮源种类均会对病原分泌细胞壁水解酶产生影响[12-13]。已有研究表明,褐腐菌在侵入果实组织后,会产生相关细胞壁水解酶[14],但是对褐腐菌产生细胞壁降解酶的培养条件、主要产生何种酶以及其对果实结构物质的影响鲜见相关报道。因此,本实验以褐腐菌为研究对象,从培养时间、培养基pH值、碳源、氮源4方面先后进行单因素试验、正交试验,研究褐腐菌产生细胞壁降解酶的最佳条件以及产酶种类;同时,将制得的粗酶液损伤接种青脆李果实,研究其对果实发病以及相关结构物质含量的影响,为进一步明确褐腐菌产生细胞壁降解酶的致病作用提供理论支持。
1.1 材料与试剂
本实验所用李果实品种为“青脆李”(Prunus salicina Lindell cv. ‘Qingcuili’),于2015年 7月采收于重庆市北碚区缙云山果园,所有果实均采收当天运至实验室,挑选大小均匀、成熟度一致、无机械伤和无病虫害的果实,预冷后,放入0 ℃冷库中贮藏待用。
褐腐病病原菌(M. fructicola)为本实验室自行分离、鉴定和保存菌种。
葡萄糖、蔗糖、果糖、羧甲基纤维素(carboxymethyl cellilose,CMC)(均为分析纯) 成都科龙化工试剂厂。
1.2 仪器与设备
BS-4G振荡培养箱 金坛市富华仪器有限公司;dHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;BXM-30R立式压力蒸汽灭菌锅 上海东亚压力容器制造有限公司;680温控型酶标仪 美国基因公司。
1.3 方法
1.3.1 培养基组成
种子培养基:分别称取酵母膏5 g、蛋白胨5 g、NaCl 5 g,用蒸馏水溶解后,定容至1 000 mL,然后分装于250 mL三角瓶中,121℃条件下灭菌15 min。
液体培养基:KCl 0.5 g,KNO32.0 g,K2HPO41.0 g,FeSO40.01 g,MgSO4·7H2O 0.5 g,CMC 10 g,蒸馏水1 000 mL。培养液pH值调至5.0后,分装于250 mL三角瓶中,每瓶装50 mL,121 ℃条件下灭菌15 min。
1.3.2 粗酶液制备
将褐腐菌接种在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(200 g去皮马铃薯加水煮沸20 min后过滤,滤液中加入20 g葡萄糖、20 g琼脂粉,定容至1 000 mL,121 ℃灭菌15 min)上,于25 ℃条件下培养6 d后,挑取大小均匀的菌块接入种子培养基中,在22 ℃、140 r/min条件下培养2 d,用灭菌纱布滤去菌液,用无菌水冲洗两遍,将菌丝研磨后用灭菌蒸馏水配成5%菌悬液。吸取1 mL菌悬液接入液体培养基,于22 ℃、140 r/min条件下培养6 d,真空抽滤除去菌丝,于4 ℃、10 000 r/min条件离心15 min,弃去沉淀,留上清液(粗酶液)备用。
1.3.3 单因素试验设计
1.3.3.1 培养时间对褐腐菌产酶的影响
在50 mL液体培养基中接入1 mL的种子液,于22 ℃、140 r/min摇床中分别培养0、2、4、6、8 d,按照1.3.2节的方法提取粗酶液,测定PG、PMG、CX和β-葡萄糖苷酶的活力。每个处理重复3 次。
1.3.3.2 培养基起始pH值对褐腐菌产酶的影响
分别在pH 2.0、3.0、4.0、5.0、6.0的50 mL液体培养基中接入1 mL的种子液,于22 ℃、140 r/min摇床中按照1.3.3.1节得出的最适培养温度和培养时间培养。按照1.3.2节的方法提取粗酶液,测定PG、PMG、CX和β-葡萄糖苷酶的活力。每个处理重复3 次。
1.3.3.3 碳源对褐腐菌产酶的影响
改变液体培养基中碳源种类和用量:蔗糖、葡萄糖、果糖、CMC(质量分数1.0%、1.5%、2.0%、2.5%、3.0%),于140 r/min摇床中,在1.3.3.1、1.3.3.2节得出的最佳培养时间、pH值条件下培养。按照1.3.2节的方法提取粗酶液,测定PG、PMG、CX和β-葡萄糖苷酶的活力。每个处理重复3 次。
1.3.3.4 氮源对褐腐菌产酶的影响
以1.3.3.3节得出的最佳结果为碳源,改变培养基中氮源种类和用量:蛋白胨、酵母膏、尿素、销酸钾(质量分数0.5%、1.0%、1.5%、2.0%),于140 r/min摇床中,按照1.3.3.1、1.3.3.2节得出的最佳培养时间、pH值条件下培养。按照1.3.2节的方法提取粗酶液,测定PG、PMG、CX和β-葡萄糖苷酶的活力。每个处理重复3 次。
1.3.4 正交试验设计
在单因素试验的基础上,选择培养时间(A)、培养基起始pH值(B)、碳源用量(C)、氮源用量(D)为4 个试验因素,按正交表L16(45)设计正交试验,分别测定PG、PMG、CX和β-葡萄糖苷酶的活力,如表1所示。
表1 正交试验因素与水平设计
Tabllee 11 Factors and their coded levels used for orthogonal array dessiiggnn

1.3.5 粗酶液中纤维素酶、果胶酶活力测定
纤维素酶CX、β-葡萄糖苷酶,果胶酶PG、PMG活力测定参考董小梅[15]的方法。
1.3.6 粗酶液对采后李果实发病情况的影响
按照1.3.4节得到的条件培养褐腐菌,得到菌悬液,并按照1.3.2节操作制得粗酶液,备用。将李果实用清水清洗,自然晾干。用无菌打孔器在果实赤道部位均匀刺2个孔(直径5 mm,深3 mm),在每个伤口分别接种40 μL以下溶液:Ⅰ无菌水(对照);Ⅱ粗酶液。待液体吸收后,单果包装,贮藏在20 ℃、相对湿度85%~90%环境下,并用PE膜覆盖保湿处理。每天统计发病率和病斑直径。每个处理10 个果实,重复3 次。
1.3.7 粗酶液对采后李果实细胞壁降解酶以及相关结构物质的影响
1.3.7.1 样品的处理
果实用自来水冲洗干净,自然晾干。用无菌铁钉在果实赤道部位均匀刺2 个孔(直径5 mm,深3 mm),在每个伤口分别接种40 μL以下溶液:Ⅰ无菌水(对照);Ⅱ粗酶液。待处理液吸收干净后,单果包装,贮藏在20 ℃、相对湿度85%~90%环境下,于贮藏0、12、24、36、48、60、72、84 h取果实伤口处组织进行各项相关指标测定。每个处理重复3 次,每个重复10 个果实,整个实验重复2 次。
1.3.7.2 果实中纤维素酶、果胶酶的测定
纤维素酶CX、β-葡萄糖苷酶和果胶酶PG、PMG活力测定参考董小梅[15]的方法。1.3.7.3 果胶物质的测定
果实原果胶和可溶性果胶含量参照Manganaris等[16]的方法测定。
1.3.7.4 纤维素的测定
采用质量法测定李果实纤维素含量[17]。
1.4 数据分析
Excel 2016统计分析所得数据,并计算标准误、制图;用SPSS 21.0软件对数据进行方差分析(ANOVA),利用邓肯式多重比较对差异显著性进行比较分析,P<0.05表示差异显著。
2.1 培养时间、培养基pH值对褐腐菌产细胞壁降解酶的影响


图1 培养时间(A)和培养基pH值(B)对褐腐菌产生细胞壁水解酶的影响
Fig. 1 Effect of culture time and pH of culture medium on CWDE production
由图1A可知,褐腐菌在培养8 d内均可产生纤维素酶和果胶酶,PG和PMG两种酶活力呈先上升、后下降趋势,而β-葡萄糖苷酶、CX活力变化不明显。其中果胶酶活力明显高于纤维素酶,培养6 d时,β-葡萄糖苷酶、PG、PMG 3种酶活力达到峰值,随后下降。由以上结论可知,褐腐菌产生胞壁降解酶的培养时间选择6 d最好。由图1B可知,褐腐菌在pH 2.0~6.0范围内都会产生CX、β-葡萄糖苷酶、PG和PMG。其中果胶酶活力明显高于纤维素酶。当pH 4.0时,4 种酶活力均达到峰值,分别达到6.01、6.26、16.44、22.84 U/mL。由以上结论可知,褐腐菌产生胞壁降解酶的培养基pH 4.0较好。
2.2 碳源对褐腐菌产细胞壁降解酶的影响

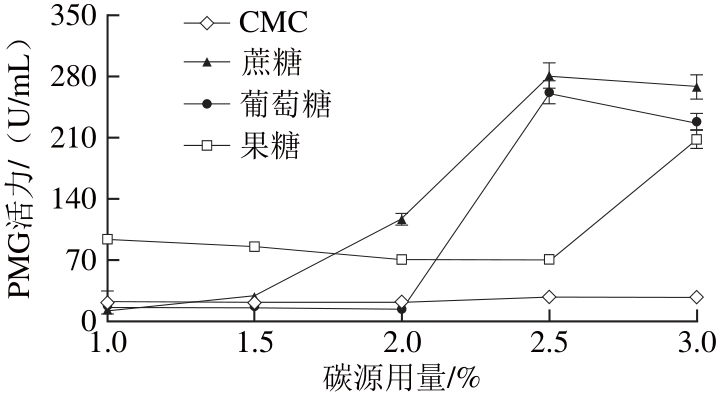
图2 碳源对褐腐菌产细胞壁降解酶活力的影响
Fig. 2 Effect of carbon source in the culture medium on the activities of CX, β-glycosidase, PG, and PMG produced by M. fructicola
由图2可知,褐腐菌在4 种不同碳源(CMC、蔗糖、葡萄糖、果糖)培养基中均能产生CX、β-葡萄糖苷酶、PG和PMG。在以蔗糖为碳源的培养基中,CX、β-葡萄糖苷酶、PMG 3种酶活力均表现为较高水平,PG活力则在以葡萄糖为碳源的培养基中表现为较高水平。且当蔗糖用量为2.5%时,CX、β-葡萄糖苷酶和PMG活力均达较高水平,分别为257.68、303.96、280.55 U/mL,PG则在2%达到最高水平132.63 U/mL。在以CMC为碳源的培养滤液中,CX、β-葡萄糖苷酶、PG和PMG 4 种酶活力均为最低。由以上结论可知,2.5%蔗糖为褐腐菌产生细胞壁降解酶的最佳碳源。
2.3 氮源对褐腐菌产细胞壁降解酶的影响
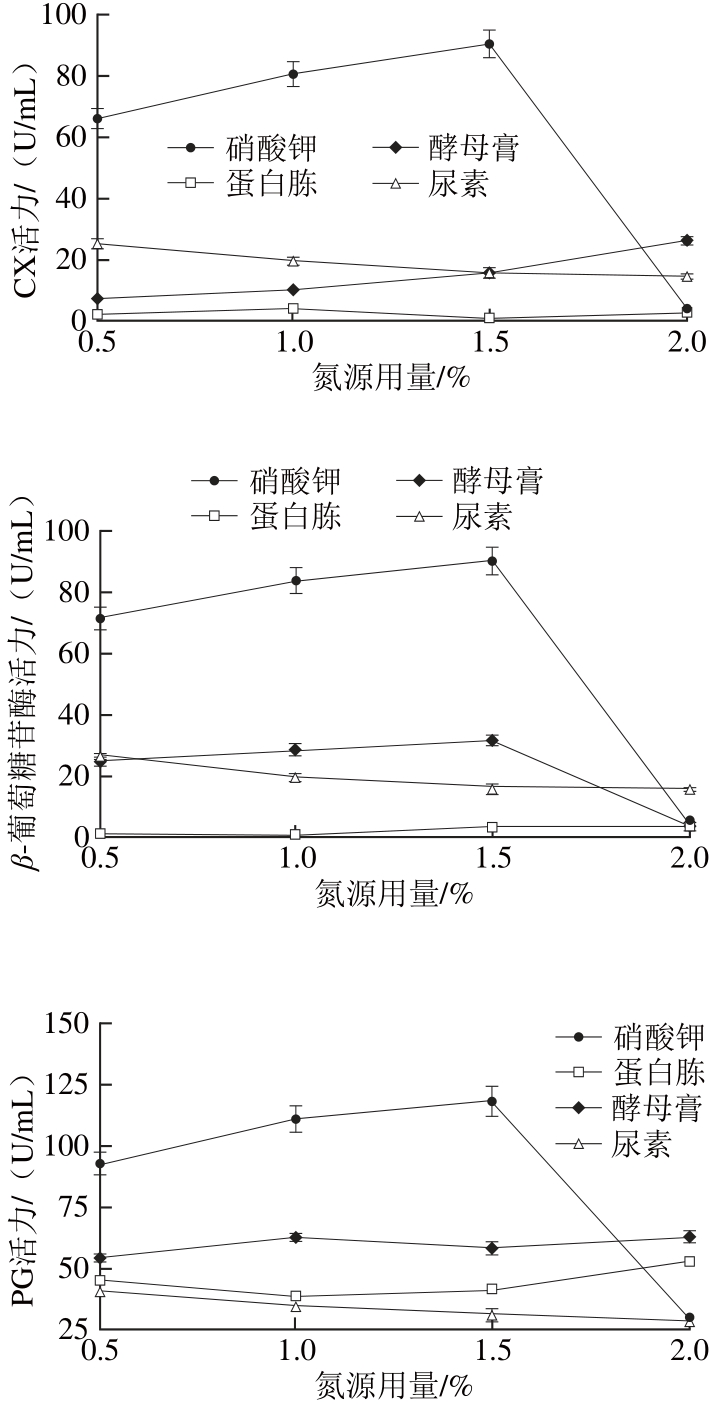
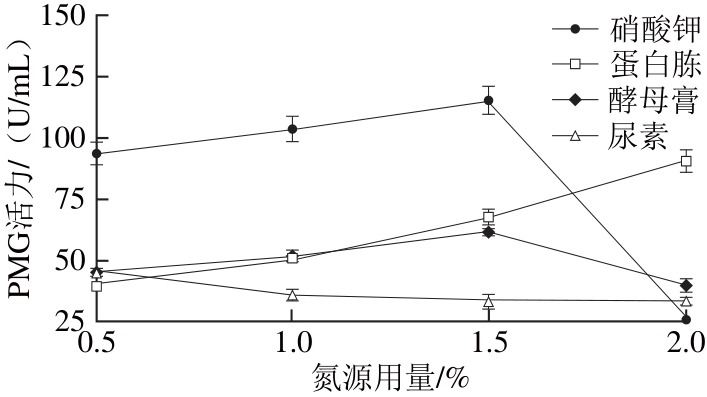
图3 氮源对褐腐菌产细胞壁降解酶的影响
Fig. 3 Effect of nitrogen source in the culture medium on the activities of CX, β-glycosidase, PG, and PMG produced by M. fructicola
由图3可知,褐腐菌在4 种不同氮源(硝酸钾、蛋白胨、酵母膏、尿素)培养基中均能产生CX、β-葡萄糖苷酶、PG和PMG。在以硝酸钾为氮源培养的滤液中,4 种酶活力显著高于其他3种氮源培养基,且在1.5%硝酸钾为氮源时, CX、β-葡萄糖苷酶、PG和PMG 4 种酶活力最高,分别达到90.35、89.97、118.31、115.04 U/mL。此外,尿素最不利于PG和PMG的产生,蛋白胨最不利于CX、β-葡萄糖苷酶的产生。由以上结论可知,1.5%硝酸钾为褐腐菌产生细胞壁降解酶的最佳氮源。
2.4 褐腐菌分泌细胞壁降解酶条件优化
表2 正交试验设计与结果
Table 2 Orthogonal array design with experimental results

从表2可以看出,培养时间、pH值、碳源用量、氮源用量这4 种不同因素对褐腐菌产生细胞壁降解酶活力的影响各不相同。以各酶总活力为指标,得到最优组合为A2B4C3D2,CX、β-葡萄糖苷酶、PG和PMG活力分别为567.55、503.07、509.21 U/mL和560.27 U/mL。因此,培养时间6 d、培养基pH 6.0、3.5%蔗糖、2.5%硝酸钾为褐腐菌产生细胞壁降解酶的最佳培养条件。
2.5 粗酶液对采后李果实发病情况的影响

图4 粗酶液对采后李果实发病情况的影响
Fig. 4 Disease incidence and lesion diameter of plum fruits treated with the crude enzymes
由图4可以看出,对照组李果实在整个贮藏期间未发病,粗酶液处理组李果实在发病随时间变化呈上升趋势。贮藏48 h,粗酶液处理组果实开始发病,在96 h时发病率达到95%,病斑直径达到34.77 mm。由照片也可以看出,经过粗酶液处理的果实发病情况较对照组明显。这表明,粗酶液处理可以导致李果实发病,酶液是导致李果实褐腐病发病的关键因素之一。
2.6 粗酶液对采后李果实纤维素酶和果胶酶活力的影响
由图5A可以看出,贮藏前期,粗酶液处理组果实CX活力呈波动性,但是整体变化不大,对照组果实CX活力在贮藏60 h后呈先上升、后下降趋势,这一阶段对照组果实CX活力较粗酶液处理组高。由图5B可知,贮藏前72 h,对照组和粗酶液处理组李果实β-葡萄糖苷酶活力未呈明显规律性,贮藏72 h后,粗酶液处理组果实β-葡萄糖苷酶活力较对照组高。由图5C可知,整个贮藏期间粗酶液处理组果实PG活力显著高于对照组(P<0.05)。由图5D可知,贮藏12~60 h内,对照组和粗酶液处理组PMG活力无明显差异(P>0.05);贮藏60~84 h内,粗酶液处理组果实PMG活力逐渐上升,而对照组果实呈先下降后上升趋势,且粗酶液处理组果实PMG活力显著高于(P<0.05)对照组。

图5 粗酶液对采后李果实CX(AA)、β-葡萄糖苷酶(BB)、PG(C)、PMG(D)活力的影响
Fig. 5 Effect of inoculation with the crude enzymes on the activities of CX (A), β-glycosidase (B), PG (C), and PMG (D) in postharvest plum fruits during storage
2.7 粗酶液对采后李果实果胶物质的影响
由图6A可以看出,贮藏36 h内,粗酶液处理组果实可溶性果胶含量较对照组高;贮藏36~84 h内,粗酶液处理组果实可溶性果胶含量较对照组低。由图6B可以看出,贮藏48 h内,粗酶液处理组果实原果胶含量较对照组果实低;贮藏48~84 h内,粗酶液处理组果实原果胶含量较对照组高。

图6 粗酶液对采后李果实可溶性果胶(A)和原果胶(B)含量的影响
Fig. 6 Effect of inoculation with the crude enzymes on the contents of pectin and protopectin in postharvest plum fruits during storage
2.8 粗酶液对采后李果实纤维素的影响

图7 粗酶液对采后李果实纤维素的影响
Fig. 7 Effect of inoculation with the crude enzymes on cellulose activity of postharvest plum fruits during storage
由图7可以看出,贮藏48 h内,对照组李果实纤维素含量显著高于粗酶液处理组(P<0.05)。贮藏12 h时,粗酶液处理组果实纤维素质量分数较对照组果实低74%。贮藏48~84 h内,对照组和粗酶液处理组之间纤维素含量差异不显著(P>0.05)。
本实验研究表明,M. fructicola在离体条件下可以产生果胶酶和纤维素酶,这些酶类对采后李果实相关结构物质有降解作用,是M. fructicola的重要致病因子。这与Manganaris等[16]将M. fructicola接入桃果实后作用结果相似。在入侵寄主的过程中,M. fructicola首先产生的细胞壁降解酶,如果胶酶和纤维素酶,破坏李果实细胞壁结构和相关组织,加速了病原菌的入侵与营养吸收作用,后与果实建立寄生关系,大量繁殖,进而导致李果实褐腐病的发生。
环境条件会影响病原菌产生细胞壁降解酶。本研究单因素试验研究结果表明,以培养时间和培养基pH值为变量因子时,果胶酶(PG、PMG)活力高于纤维素酶(CX、β-葡萄糖苷酶);以培养基中碳源和氮源为变量因子时,4 种酶活力均变化较大,其中以蔗糖为碳源、硝酸钾为氮源的培养基中,M. fructicola产酶能力最强。酸性条件下,褐腐菌产生细胞壁降解酶的能力增强,从而其致病性也增强,这一结果与de Cal等[12]的研究一致。Chou等[13]研究发现,半乳糖醛酸或葡萄糖作为碳源培养褐腐真菌时,果胶酶相关的基因获得较高的表达,这一结果与本实验研究不相符,可能原因为果胶酶相关的基因表达受培养环境pH值的调控,pH值在3.5~5之间时,果胶酶基因表达加强,而本实验所采用的最佳pH 6.0,因此其基因表达出现差异。此外,当真菌在硝酸铵或酵母提取物作为氮源培养时,与果胶相关的基因表达也显著升高,因此,硝酸盐是有利于M. fructicola和生长以及分泌胞外酶[18]。此外,在正交试验中可以得出,M. fructicola分泌果胶酶和纤维素酶的最佳条件为:培养时间6 d、pH 6.0、碳源3.5%蔗糖、氮源2.5%硝酸钾。
本实验中,将粗酶液接种到李果实后,李果实发生褐腐病,这与杨海清等[19]研究结果不一致,在其实验中,果胶酶液不能使桃果实发生褐腐病,可能原因为:本实验采用的是混合酶液,而杨海清等[19]使用的是单一的果胶酶液,然而为何混合酶液会对果实产生致病作用,具体原因需进一步研究得出。接入酶液后,李果实中PG和PMG活力明显升高,而CX和β-葡萄糖苷酶未成明显规律性,可能是由于李果实组织中果胶物质含量较高,胞外酶表现底物特异性,因此,PG、PMG活力较强。这一结论同时说明,褐腐菌主要产生果胶酶发挥致病作用,而纤维素酶作用不强[20]。外源果胶酶能影响果实果胶多糖成分、特殊片段以及化学结构,甚至导致果实直接遭受病害[21-22]。
李果实接种粗酶液后其关结构物质发生变化。结果表明,粗酶液处理能够引起果实果胶和纤维素含量发生改变。这一结果与Faulkner[23]、Skamnioti[24]等研究结果一致。许多真菌穿透宿主细胞表皮层之后,通过细胞壁相关降解酶分解果皮、果肉组织中的果胶和纤维素,最后导致二者的降解,胞外纤维素酶则通过绑定到外层膜组分降解纤维素[25]。然而,真菌侵染是一个复杂的过程,涉及其他细胞壁降解酶和毒素等致病因素,如激发子、胞外多糖等,这些物质是如何协同发挥作用导致李果实褐腐病的发生,需进一步的研究[26-30]。
由以上研究可以得出:M. fructicola产细胞壁降解酶的最佳条件为:培养时间6 d、pH 6.0、碳源3.5%蔗糖、氮源2.5%硝酸钾;粗酶液能够导致李果实发生褐腐病,使果实快速腐烂;酶液引起果实PG、PMG活力的上升,加速果实可溶性果胶物质的溶出,以及原果胶物质转化为可溶性果胶,同时,会引起李果实纤维素含量的下降,加速果实的软化腐烂进程。
参考文献:
[1] KARACA H, PÉREZ-GAGO M B, TABERNER V, et al. Evaluating food additives as antifungal agents against M. fructicola in vitro and in hydroxypropyl methylcellulose–lipid composite edible coatings for plums[J]. International Journal of Food Microbiology, 2014, 179∶ 72-79. DOI∶10.1016/j.ijfoodmicro.2014.03.02.
[2] LATORRE B A, DIAZ G A, VALENCIA A L, et al. First report of Monilinia fructicola causing brown rot on stored Japanese plum fruit in Chile[J]. Plant Disease, 2014, 98(1)∶ 160. DOI∶10.1094/PDIS-06-13-0647-PDN.
[3] VASIC M, DUDUK N, IVANOVIC M S. First report of brown rot caused by Monilia polystroma on apple in Serbia[J]. Plant Disease,2013, 97(1)∶ 145. DOI∶10.1094/PDIS-07-12-0670-PDN.
[4] YIN Liangfen, CHEN Shuning, CHEN Guokang, et al. Identifi cation and characterization of three Monilinia species from plum in China[J]. Plant Disease, 2015, 99(12)∶ 1775-1783. DOI∶10.1094/PDIS-12-14-1308-RE.
[5] MÄKELÄ M R, DONOFRIO N, VRIES R P, et al. Plant biomass degradation by fungi[J]. Fungal Genetics and Biology, 2014, 72∶ 2-9.DOI∶10.1016/j.fgb.2014.08.010.
[6] 赵蕾, 张天宇. 植物病原茵产生的降解酶及其作用[J]. 微生物学通报, 2002, 29(1): 89-93. DOI:10.3969/j.issn.0253-2654.2002.01.022.
[7] NAGENDRAN S, HALLEN-ADAMS H E, PAPER J M, et al.Reduced genomic potential for secreted plant cell-wall-degrading enzymes in the ectomycorrhizal fungus Amanita bisporigera, based on the secretome of Trichoderma reesei[J]. Fungal Genetics & Biology,2009, 46(5)∶ 427-435. DOI∶10.1016/j.fgb.2009.02.001.
[8] JAROSZUK-SCISEL J, KUREK E, SLOMKA A, et al. Activities of cell wall degrading enzymes in autolyzing cultures of three Fusarium culmorum isolates∶ growth-promoting, deleterious and pathogenic to rye (Secale cereale)[J]. Mycologia, 2011, 103(5)∶ 929-945.DOI∶10.3852/10-300.
[9] CHIU C M, YOU B J, CHOU C M, et al. Redox status-mediated regulation of gene expression and virulence in the brown rot pathogen M. fructicola[J].Plant Pathology, 2013, 62(4)∶ 809-819. DOI∶10.1111/ppa.12006.
[10] 薛莲, 檀根甲, 徐先松, 等. 苹果炭疽病菌对苹果果实致病机制初探[J]. 安徽农业大学学报, 2006, 33(4): 522-525. DOI:10.3969/j.issn.1672-352X.2006.04.019.
[11] AND R L F, BENNETT A B. Role of Cell wall hydrolases in fruit ripening[J]. Annual Review of Plant Biology, 2003, 42(4)∶ 675-703.DOI∶10.1146/annurev.pp.42.060 191.003331.
[12] DE CAL A, SANDÍN-ESPAÑA P, MARTINEZ F, et al. Role of gluconic acid and pH modulation in virulence of M. fructicola on peach fruit[J]. Postharvest Biology and Technology, 2013, 86∶ 418-423. DOI∶10.1016/j.postharvbio.2013.07.012.
[13] CHOU Chienming, YU Fa ngyi, YU Peiling, et al. Expression of five endopolygalacturonase genes and demonstration that MfPG1 overexpression diminishes virulence in the brown rot pathogen M. fructicola[J]. PLos One, 2015, 10(6)∶ e 0132012. DOI∶10.1371/journal.pone.0132012.
[14] PRING R J, BYRDE R J W, WILLETTS H J. An ultrastructuralstudy of the infection of pear fruit by Monilinia fructigena[J].Physiologic al Plant Pathology, 1981, 19(1): 1-6. DOI:10.1016/S0048-4059(81)80002-1.
[15] 董小梅. 龙眼焦腐病菌细胞壁降解酶及其致病机理的研究[D].福州: 福建农林大学, 2010. DOI:10.7666/d.d116169.
[16] MANGANARIS G A, VASILAKAKIS M, MIGNANI I, et al.The effect of preharvest calcium sprays on quality attributes,physicochemical aspects of cell wall components and susceptibility to brown rot of peach fruits (Prunus persica L. cv. Andross)[J]. Scientia Horticulturae, 2005, 107: 43-50. DOI:10.1016/j.scienta.2005.06.005.
[17] 曹建康, 姜微波. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[18] BARAD S, HOROWITZ S B, MOSCOVITZ O, et al. A Penicillium expansum glucose oxidase-encoding gene, GOX2, is essential for gluconic acid production and acidification during colonization of deciduous fruit[J]. Molecular Plant-Microbe Interactions: MPMI,2012, 25(6): 779-788. DOI:10.10 94/MPMI-01-12-0002.
[19] 杨海清. 桃褐腐病菌致病性及拮抗细菌生防机制的研究[D]. 呼和浩特: 内蒙古农业大学, 2007. DOI:10.7666/d.y1137957.
[20] AKIMITSU K, ISSHIKI A, OHTANI K, et al. Sugars and pH: A clue to the regulation of fungal cell wall-degrading enzymes in plants[J].Physiological & Molecular Plant Pathology, 2005, 65(6): 271-275.DOI:10.1016/j.pmpp.2005.03.001.
[21] BHATTACHARYA S, RASTOGI N K. Rheological properties of enzyme-treated mango pulp[J]. Journal of Food Engineering, 1998,36(3): 249-262. DOI:10.1016/S0260-8774(98)00067-3.
[22] KERMANI Z J, SHPIGELMAN A, BERNAERTS T M M, et al.The effect of exogenous enzymes and mechanical treatment on mango purée: effect on the molecular properties of pectic substances[J]. Food Hydrocolloids, 2015, 50: 193-202. DOI:10.1016/j.foodhyd.2015.03.033.
[23] FAULKNER C, ROBATZEK S. Plants and pathogens: pu tting infection strategies and defence mechanisms on the map[J]. Current Opinion in Plant Biology, 2012, 15(6): 699-707. DOI:10.1016/j.pbi.2012.08.009.
[24] SKAMNIOTI P, GURR S J. Magnaporthe grisea cutinase2 mediates appressorium diffe rentiation and host penetration and is require d for full virulence[J]. The Plant Cell, 2007, 19(8): 2674-2689.DOI:10.1105/tpc.107.051219.
[25] WILSON D B. Evidence for a novel mechanism of microbial cellulose degradation[J]. Cellulose, 2009, 16(4): 723-727. DOI:10.1007/s10570-009-9326-9.
[26] JANISIEWICZ W J, BUYER J S. Culturable bacterial microflora associated with nectarine fruit and their potential for control of brown rot[ J]. Canadian Journal of Microbiology, 2010, 56(6): 480-486.DOI:10.1139/w10-031.
[27] JANISIEWICZ W J, JURICK Ⅱ W M, VICO I, et al. Culturable bacteria from plum fruit surfaces and their potential for controlling brown rot after harvest[J]. Postharvest Biology and Technology, 2013,76(2): 145-151. DOI:10.1139/w10-031.
[28] PIMENTA R S, DA SILVA J F M, BUYER J S, et al. Endophytic fungi from plums (Prunus domestica) and their antifungal activity against Monilinia fructicola[J]. Journal of Food Protection, 2012, 75(10):1883-1889. DOI:10.4315/0362-028X.JFP-12-156.
[29] JANISIEWICZ W J, JURICK Ⅱ W M, VICO I, et al. Culturable bacteria from plum fruit surfaces and their potential for controlling brown rot after harvest[J]. Postharvest Biology and Technology, 2013,76: 145-151. DOI:10.1016/j.postharvbio.2012.10.004.
[30] JANISIEWICZ W J, JURICK W M, PETER K A, et al. Yeasts associated with plums and their potential for controlling brown rot after harvest[J]. Yeast, 2014, 31(6): 207-218. DOI:10.1002/yea.3009.
Optimization of Culture Conditions of Monilinia fructicola for the Production of Cell Wall Degrading Enzymes and Their Involvement in Brown Rot Pathogenesis of Postharvest Plums
ZHANG Jie1, FAN Xianfang1, YAO Shixiang1,2, DENG Lili1,2, ZENG Kaifang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Engineering Research Center for Special Food, Chongqing 400715, China)
DOI:10.7506/spkx1002-6630-201720003
中图分类号:S436.639
文献标志码:A
文章编号:1002-6630(2017)20-0012-08
引文格式:
张婕, 凡先芳, 姚世响, 等. 李果实褐腐病病原菌产生细胞壁降解酶条件优化及其致病机理[J]. 食品科学, 2017, 38(20):12-19. DOI:10.7506/spkx1002-6630-201720003. http://www.spkx.net.cn
ZH ANG Jie, FAN Xianfang, YAO Shixiang, et al. Optimization of culture conditions of Monilinia fructicola for the production of cell wall degrading enzymes and their involvement in brown rot pathogenesis of postharvest plums[J]. Food Science, 2017,38(20)∶ 12-19. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720003. http∶//www.spkx.net.cn
收稿日期:2016-11-23
基金项目:国家公益性行业(农业)科研专项(201303075);重庆市研究生科研创新项目(CYS16071)
作者简介:张婕(1990—),女,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:zhangjie_libra@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com