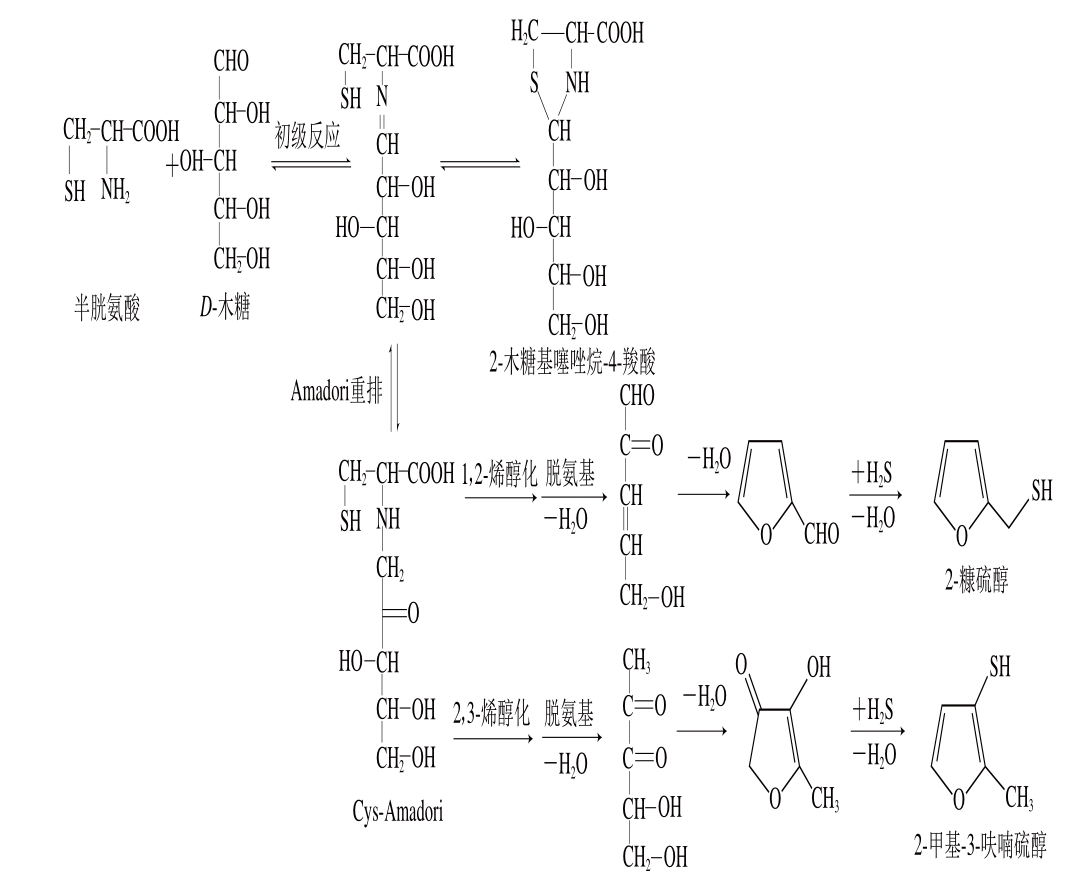
图1 pH 5~6条件下半胱氨酸和D-木糖反应生成2--糠硫醇和2-甲基-3--呋喃硫醇
Fig. 1 At pH 5-6, 2-furfurylthiol and 2-methyl-3-furanthiol are formed from the reaction of cysteine with D-xylose
赵 健1,赵梦瑶1,曹长春1,甄大卫2,王佳欣1,李 力1,谢建春1,*
(1.北京食品营养与人类健康高精尖创新中心,食品质量与安全北京实验室,北京市食品风 味化学重点实验室,北京工商大学,北京 100048;2.太原理工大学化学化工学院,山西 太原 030024)
摘 要:为研究脂肪醛对“半胱氨酸-木糖”美拉德反应进程及肉香物质形成的影响,设计“半胱氨酸-木糖”及“半胱氨酸-木糖”中分别添加己醛、反-2-庚烯醛、反,反-2,4-癸二烯醛的4 个反应体系,在温度90 ℃、pH 5.5条件下反应5 h,液相色谱-蒸发光散射检测监测反应原料(半胱氨酸、木糖)和初期反应中间体(半胱氨酸的Amadori重排化合物(Cys-Amadori)、2-木糖化噻唑烷-4-羧酸)随反应时间的浓度变化,同时还监测反应液pH值及波长294、420 nm处紫外-可见吸光度随反应时间的变化,并且采用固相微萃取-气相色谱-质谱联机分析比较3 h反应产物的挥发性风味物质组成。添加3 种脂肪醛后,形成的Cys-Amadori重排化合物、2-木糖化噻唑烷-4-羧酸中间体浓度均下降,表明均对“半胱氨酸-木糖”初期美拉德反应有抑制作用,且相比之下抑制强弱为反-2-庚烯醛>反,反-2,4-癸二烯醛>己醛。但添加己醛时,反应液于波长294、420 nm处的吸光度下降,表明中、末期美拉德反应也受到抑制;而加入反-2-庚烯醛、反,反-2,4-癸二烯醛时,反应液于波长294、420 nm处的吸光度却增加,表明中、末期美拉德反应被促进,且相比之下反,反-2,4-癸二烯醛的促进作用大于反-2-庚烯醛。另外,比较挥发性风味组成发现,加入反-2-庚烯醛、反,反-2,4-癸二烯醛的体系,含硫化合物的总量增多,检测到醛参与美拉德反应或醛自身受美拉德反应影响而形成的多种带烷基侧链的含硫化合物和呋喃化合物如2-己基噻吩和2-丙基呋喃。
关键词:脂质氧化;美拉德反应;肉香味;己醛;反-2-庚烯醛;反,反-2,4-癸二烯醛;Amadori重排化合物
Abstract: The effect of aliphatic aldehydes on Maillard reaction and meaty fl avor formation was investigated i n cysteinexylose model systems. The Maillard reaction in the absence and presence of hexanal, (E)-2-heptenal, or (E,E)-2,4-decadienal,was carried out at 90 ℃, pH 5.5 for 5 h. Changes in the concentrations of xylose, cysteine, initial reaction intermediates(2-threityl-4-carboxythiazolidine and Amadori rearrangement product of cysteine (Cys-Amadori)) with reaction time were determined by high performance liquid chromatography with evaporate light scattering detection (HPLC-ELSD).Also, changes in the pH and absorbance values at 294 and 420 nm of the reaction mixtures were monitored. Volatile fl avor compounds in the 3 h reaction mixtures were compartaively analyzed by solid phase microextraction coupled with gas chromatography and mass spectrometry (SPME-GC-MS). As indicated by decreased concentrations of Cys-Amadori and 2-threityl-4-carboxythiazolidine in the presence of aliphatic aldehydes, all the three aldehydes showed inhibitory effects on the initial stage of the Maillard reaction, among which (E)-2-heptenal was the stongest inhibitor, followed by(E,E)-2,4-decadienal and hexanal. Additionally, hexanal also showed inhibitory effect on the intermediate and fi nal stages of the Maillard reaction, as indicated by decreased absorbance at 294 and 420 nm. However, (E)-2-heptenal and (E,E)-2,4-decadienal accelerated both the intermediate and fi nal stages, as indicated by increased absorbance values at 294 and 420 nm,with the latter being more effective than the former. On the other hand, the reaction systems in the presence of (E)-2-heptenal and (E,E)-2,4-decadienal produced a relatively greater amount of total volatile sulfur-containing compounds than the blank model system, and additionally produced some new alkyl chain sulfur-containing compounds and furane derivatives such as 2-hexylthiophene and 2-propylfuran as detected by GC-MS analysis, due to participation of the aldehydes in cysteine-xylose reaction and reaction of the aldehydes themselves in the buffered cysteine-xylose solution.
Key words: lipid oxidization; Maillard reaction; meaty flavor; hexanal; (E)-2-heptenal; (E,E)-2,4-decadienal; Amadori compound
DOI∶10.7506/spkx1002-6630-2017200010
脂质氧化降解和美拉德反应是肉香味形成的两大反应[1]。半胱氨酸是肉香味形成的重要前体,基于“半胱氨酸-还原糖”模型美拉德反应,研究脂质氧化降解对美拉德反应肉香味形成的影响方面已有较多报道[2-9],这些报道集中于对热反应产物挥发性物质组成影响方面[4-10]。如Farmer等[7]采用“半胱氨酸-核糖”模型体系研究了磷脂和甘三酯的影响;Elmore等[9]采用“半胱氨酸-核糖”模型体系研究了多不饱和脂肪酸的影响,本课题组采用“半胱氨酸-葡萄糖”体系研究了鸡脂和氧化鸡脂的影响[4-6]。

图1 pH 5~6条件下半胱氨酸和D-木糖反应生成2--糠硫醇和2-甲基-3--呋喃硫醇
Fig. 1 At pH 5-6, 2-furfurylthiol and 2-methyl-3-furanthiol are formed from the reaction of cysteine with D-xylose
按照Hodge[10]理论,美拉德反应主要包括初期、中期、末期3 个反应阶段。如图1所示,“半胱氨酸-还原糖”反应时,初期美拉德反应阶段主要形成2-糖基噻唑烷-4-羧酸及半胱氨酸的Amadori重排化合物(Cys-Amadori)两中间体。在受热条件下,2-糖基噻唑烷-4-羧酸将不断转化成Cys-Amadori化合物,随之Cys-Amadori化合物发生降解反应包括1,2-或2,3-烯醇化等,产生2-甲基-3-呋喃硫醇、2-糠硫醇等含硫肉香化合物[11-12]。如上所述,尽管从挥发性物质组成变化上,较多研究了脂质氧化存在对“半胱氨酸-还原糖”间美拉德反应的影响,但脂质氧化究竟如何影响美拉德反应进程(基于3 个反应阶段),进而影响热反应挥发性肉香味物质的产生,还需进一步研究。
己醛、反-2-庚烯醛、反,反-2,4-癸二烯醛是脂质(磷脂、脂肪)氧化降解产生的主要反应活性物。本实验基于“半胱氨酸-木糖”模型反应体系,通过对比分析分别添加和不添加3 种脂肪醛时,反应原料、初期反应中间体、pH值及反应产物的紫外-可见吸收等随反应时间的变化趋势及添加醛后反应产物的挥发性物质组成变化,研究脂肪醛对“半胱氨酸-木糖”美拉德反应进程及肉香味物质形成产生的影响。研究结果可为肉类食品烹制加工及热反应肉味香精的制备提供理论指导。
1.1 材料与试剂
L-半胱氨酸(纯度99%)、D-(+)-木糖(纯度99%)(生化试剂)、己醛、反-2-庚烯醛、反,反-2,4-癸二烯醛(纯度≥98%) 百灵威科技有限公司;磷酸二氢钠、氢氧化钠、甲酸铵(均为分析纯) 国药集团化学试剂北京有限公司;乙腈(色谱纯) 德国Fisher Scientific公司;手动固相微萃取手柄、75 μm碳分子筛/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取纤维、15 mL样品瓶 美国Supelco公司;15 mL高温耐压反应管 美国Synthware公司;AG 50W-X4 H-型阳离子交换树脂 美国Bio-Rad公司。
1.2 仪器与设备
7890A/5975C气相色谱-质谱联用仪、1100高效液相色谱仪 美国Agilent公司;SEDEX75蒸发光散射检测器法国Sedere公司;BS-100A自动液相色谱分离层析仪上海青浦沪西仪器厂;Parallel synthesis Poly-BLOCK4反应器 英国HEL公司。
1.3 方法
1.3.1 模型反应
在15 mL耐压密封管中,加入5 mL缓冲溶液(氢氧化钠滴加到磷酸二氢钠溶液中配制,0.2 mol/L,pH 5.5)、L-半胱氨酸2 mmol(0.242 g)、D-(+)-木糖2 mmol(0.300 g)。然后3 种脂肪醛分别加入0.5 mmol,包括反-2-庚烯醛(0.061 g)、己醛(0.050 g)、反,反-2,4-癸二烯醛(0.076 g),90 ℃分别反应0.5、1、2、3、4 h和5 h。
到达反应时间后,迅速水流冷却。测吸光度、pH值,以及木糖、半胱氨酸、2-木糖化噻唑烷-4-羧酸、Cys-Amadori的浓度。同时做空白实验。每个体系平行3 次,结果取平均值。
1.3.2 吸光度及pH值的测定
反应溶液在波长294 nm和420 nm处测吸光度,比色池光径为1 cm。根据需要将反应液进行不同倍数稀释到最佳测量范围后测定。测得的结果乘以稀释倍数,记为吸光度结果。平行测定3 次,结果以平均值计。平行样品实验结果标准偏差在5%以内。
取0.5 mL反应溶液稀释至3 mL,在室温(25 ℃)条件下,测定溶液的pH值。
1.3.3 高效液相色谱-蒸发光散射检测器分析
Waters Xbridge Amide色谱柱(4.6 mm×150 mm,3.5 μm);流动相为0.01 mol/L甲酸铵水溶液(pH 6)与乙腈的混合溶液(25∶75,V/V),等度洗脱,流速1 mL/min,运行10 min,柱温45 ℃。蒸发光散射检测器检测,蒸发管温度40 ℃,雾化气(空气)流速3.5 bar,增益值5。0.45 μm滤膜过滤后,进样2 μL。
按照文献[13]方法制备Cys-Amadori和2-木糖化噻唑烷-4-羧酸,作为标准品。反应液中木糖、半胱氨酸、Cys-Amadori、2-木糖化噻唑烷-4-羧酸的浓度采用外标法定量。工作曲线分别为:2-木糖化噻唑烷-4-羧酸,y=49 119x-4 516;Cys-Amadori,y=24 024.1x-143.9;木糖,y=61 719x-587.1;半胱氨酸,y=38 046x-311.57。y为峰面积;x为浓度(mol/L)。回归系数R2均大于0.99。
反应液样品采用同样方法进行高效液相色谱-蒸发光散射检测器分析,所得峰面积按照标准曲线计算浓度(mol/L)。平行测定3 次,结果以平均值计。平行样品实验结果标准偏差在5%以内。
1.3.4 固相微萃取-气相色谱-质谱分析
萃取纤维提前老化。将反应3 h的反应液置于15 mL固相微萃取样品瓶中,30 ℃电磁搅拌平衡10 min,然后30 ℃顶空吸附30 min,待气相色谱-质谱分析。
气相色谱条件:HP-5MS色谱柱(30 m×0.25 mm,0.25 μm);升温程序:起始温度40 ℃,保持2 min,然后以2 ℃/min升至100 ℃,再以4 ℃/min升至150 ℃,保持2 min,再以20 ℃/min升至280 ℃。DB-Wax色谱柱(30 m×0.25 mm,0.25 μm);升温程序:起始温度40 ℃,保持2 min;然后以3 ℃/min升至80 ℃,保持3 min;再以4 ℃/min升至120 ℃,保持2 min;再以10 ℃/min升至230 ℃,保持2 min。载气为H e,流速1.0 mL/min。进样口温度250 ℃,不分流模式进样,萃取纤维脱附5 min。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围45~350 u。
在相同气相色谱-质谱分析条件下,进样C6~C30正构烷烃,计算保留指数。根据检索NIST 2011质谱库、人工解谱和保留指数鉴定化合物。化合物的含量用总离子流图中峰面积表示。3 个平行样品在HP-5MS、DB-WAX柱上的分析结果取平均值,记为实验结果,平行样品间标准偏差15%以内。
2.1 3 种脂肪醛对美拉德反应进程的影响
固定其他条件,对3 种醛的其他添加浓度如0.1 mmol进行初步实验,所得结论与添加0.5 mmol类似,但醛的添加量较多时,相对于空白体系,液相色谱检测到木糖、半胱氨酸和初始中间体(2-木糖化噻唑烷-4-羧酸、Cys-Amadori)的浓度变化较大,使观察的现象较为明显,因此本实验中3 种醛的添加量选择0.5 mmol。
“半胱氨酸-木糖”体系中分别添加及不添加0.5 mmol的3 种脂肪醛,检测到的各指标随反应时间的变化曲线见图2。

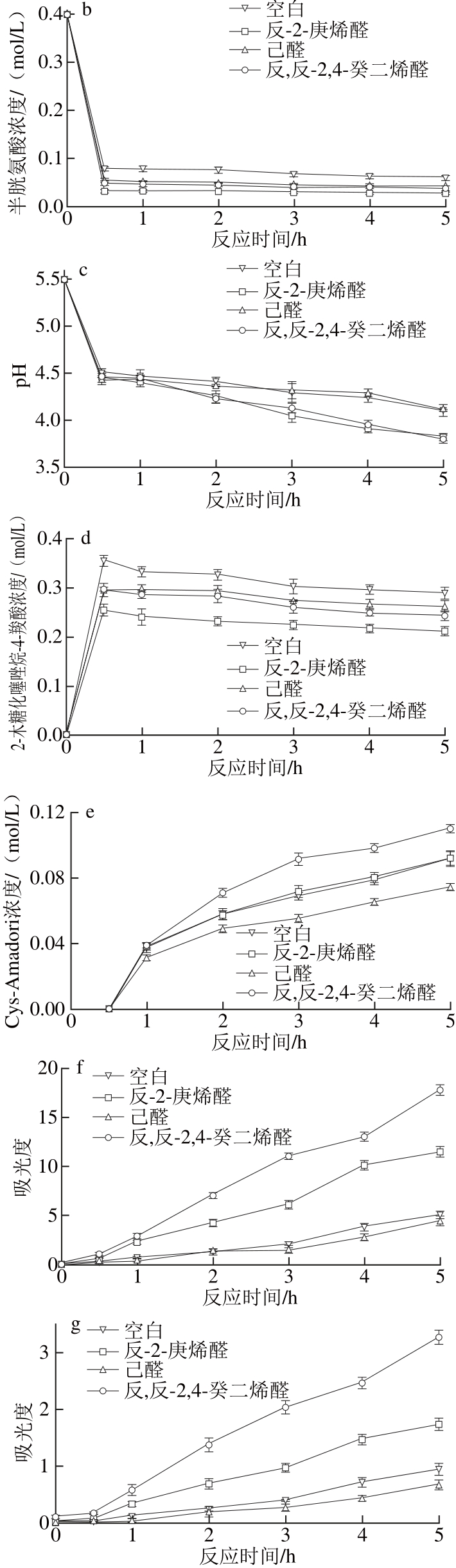
图2 反应液中木糖(a)、半胱氨酸(b)、pH值(c)、2-木糖化噻唑烷-4-羧酸(d)、Cys-Amadori(e)、294 nm吸光度(f)、4200 nnmm吸光度(g)随时间的变化趋势
Fig. 2 Changes in the concentrations of xylose (a), cysteine (b), pH (c),2-threityl-4-carboxythiazolidine (d) and Cys-Amadori (e), and absorbance values at 294 nm (f) and 420 nm (g) in the reaction mixtures with or without aliphatic aldehydes as a function of reaction time
2.1.1 初期美拉德反应
美拉德反应中,反应液的pH值下降与美拉德反应初期阶段氨基被消耗和高级阶段有机酸的形成有关[14-16]。由图2a~c可知,对于所有体系,在反应开始0.5 h内氨基酸和还原糖发生缩合反应速率较高,因而氨基酸和还原糖的浓度迅速下降;同时因氨基被快速消耗,pH值也迅速下降。
Cys-Amadori和2-木糖化噻唑烷-4-羧酸为美拉德初期反应阶段形成的中间体,其浓度大小既与其生成速率有关,还与其降解或转化的速率有关,因而可检测到的仅为它们的积累量。由图2d可知,对于所有体系,反应开始0.5 h内由于氨基酸和还原糖以较高速率发生缩合反应,从而检测到2-木糖化噻唑烷-4-羧酸的浓度也迅速上升。0.5 h后随着半胱氨酸和木糖浓度降低到较低水平,2-木糖化噻唑烷-4-羧酸的浓度开始呈下降趋势,表明此时转化成Cys-Amadori的速率大于生成速率。由于Cys-Amadori是由2-木糖化噻唑烷-4-羧酸转化形成,因而反应0.5 h后才检测到Cys-Amadori的存在(图2e)。随着2-木糖化噻唑烷-4-羧酸不断地转化成Cys-Amadori,Cys-Amadori的浓度呈升高趋势。
脂肪醛也可与半胱氨酸发生“羰-氨”反应,因而与空白体系相比,图2b、c中无论加入哪种脂肪醛,半胱氨酸的消耗均增加、pH值下降幅度均增大。另一方面,脂肪醛与半胱氨酸结合时,与木糖存在竞争,从而对“半胱氨酸-还原糖”之间的缩合反应有抑制作用。由于竞争性抑制的存在,与空白体系相比,加入醛后糖的消耗均减小(图2a),检测到的2-木糖化噻唑烷-4-羧酸的浓度均减小(图2d)。从糖的消耗减小看,反-2-庚烯醛的抑制作用最大,其次为反,反-2,4-癸二烯醛,而己醛的抑制作用最小。这是因为不饱和醛反应活性高于饱和醛;而与反,反-2,4-癸二烯醛相比,反-2-庚烯醛分子由于空间位阻较小且亲水性大于反,反-2,4-癸二烯醛,因此在含缓冲盐的水相体系中反应活性更大。
值得注意的是,相比空白体系,加入己醛后,检测到的Cys-Amadori浓度降低,这是因为加入己醛时形成的2-木糖化噻唑烷-4-羧酸浓度降低造成。但与空白体系相比,加入反-2-庚烯醛或反,反-2,4-癸二烯醛后,检测到的Cys-Amadori浓度却升高,这可能是因为Cys-Amadori含有巯基、氨基等基团,反应活性较高的烯醛也可与Cys-Amadori结合[17],从而使Cys-Amadori的降解速率变慢造成。与反-2-庚烯醛相比,加入反,反-2,4-癸二烯醛时,Cys-Amadori浓度的升高更为显著,这可能与反,反-2,4-癸二烯醛发生逆羟醛缩合反应,可产生更多具有较高反应活性的其他烯醛有关[18]。
2.1.2 中、末期美拉德反应
波长294 nm处吸光度大小与美拉德反应中期阶段生成的无色中间体产物(如双羰基化合物)的含量有关,波长420 nm处吸光度大小与美拉德反应高级阶段生成的褐变产物(类黑精)含量有关[16,19]。对于所有体系(空白体系及添加脂肪醛),随着美拉德反应进行,中期阶段产物和末期阶段产物不断积累,波长294、420 nm吸光度均一直呈升高趋势[20-21]。图2f、g中波长294 nm处吸光度曲线的变化趋势与波长420 nm的相似,表明美拉德反应中期阶段生成的多数无色中间体产物,进一步发生反应时生成了类黑精物质[16,22-23]。
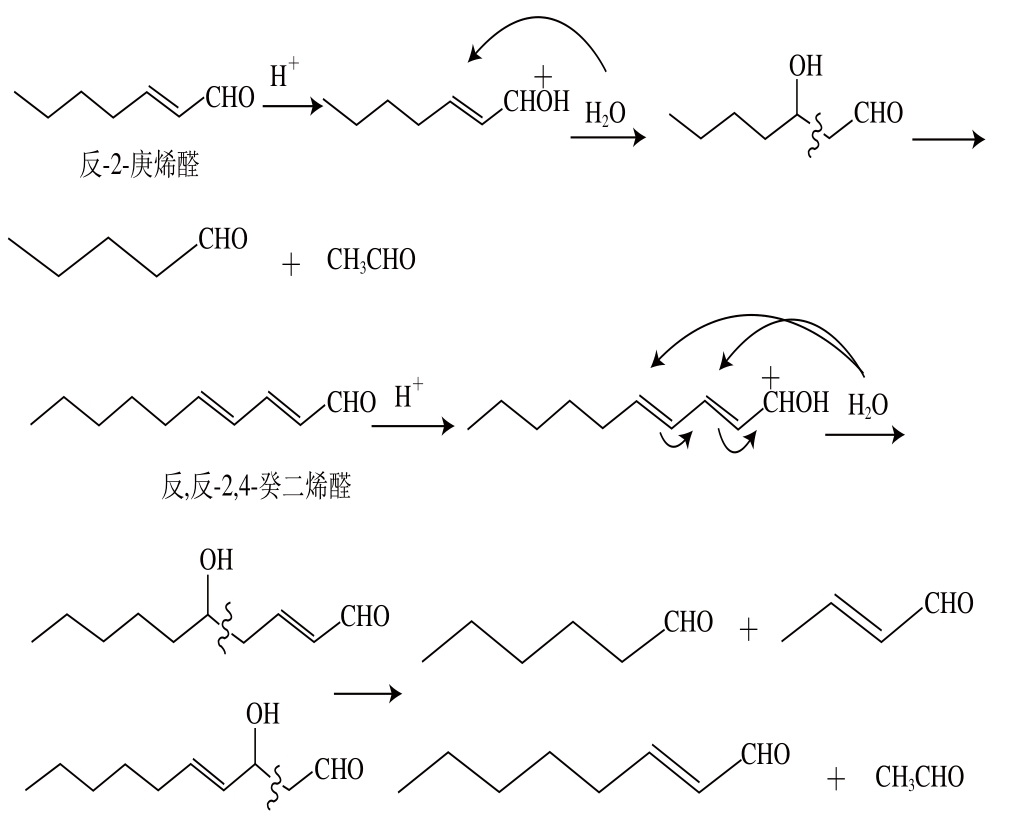
图3 反-2-庚烯醛、反,反-2,4-癸二烯醛发生逆羟醛缩合反应产生新的醛
Fig. 3 Formation of new aliphatic aldehydes from (E)-2-heptenal and(E,E)-2,4-decadienal via hydration and retro-aldol reaction
与空白体系相比,添加己醛后,反应液波长294、420 nm处的吸光度下降。这是因为初期阶段己醛与木糖的竞争对“木糖-半胱氨酸”间美拉德反应产生了抑制,使生成的2-木糖化噻唑烷-4-羧酸及Cys-Amadori浓度降低造成。而添加反-2-庚烯醛、反,反-2,4-癸二烯醛后,反应液294、420 nm处吸光度却升高。这是因为反-2-庚烯醛、反,反-2,4-癸二烯醛不仅易于参与美拉德反应,还易于发生逆羟醛缩合反应造成[18]。如图3所示,反-2-庚烯醛发生逆羟醛缩合反应时,可生成戊醛、乙醛;反,反-2,4-癸二烯醛发生逆羟醛缩合反应时,可生成2-丁烯醛、己醛或2-辛烯醛、乙醛[18]。发生逆羟醛缩合反应产生的新的脂肪醛与原有的反-2-庚烯醛、反,反-2,4-癸二烯醛一样是活性中间体,可进一步发生类似的许多反应,包括:自身或与其他醛发生羟醛缩合反应、与糖降解产生的双羰基化合物和还原酮等产物发生缩合反应、作用于氨基酸使氨基酸发生Strecker降解反应[24-25]、与半胱氨酸降解产生的氨、硫化氢发生反应等[1,18,26]。以上这些复杂反应将造成体系中生成的无颜色中间体产物及类黑素等末期反应产物增多,从而在波长294、420 nm处吸光度增大,表现为烯醛对中、末期美拉德反应有促进作用。反-2-庚烯醛与反,反-2,4-癸二烯醛相比,反,反-2,4-癸二烯醛含有2 个双键,发生逆羟醛反应时可生成更多种醛,反应产物更为复杂,因而加入反,反-2,4-癸二烯醛体系于波长294、420 nm处吸光度又比加入反-2-庚烯醛大。
2.2 添加脂肪醛对挥发性风味物质形成的影响
由于反应3 h时所得产物的气味已较浓郁,且由图2可知,反应渐趋平稳,为此采用极性、弱极性两色谱柱,对3 h反应产物进行固相微萃取-气相色谱-质谱联机分析见表1。
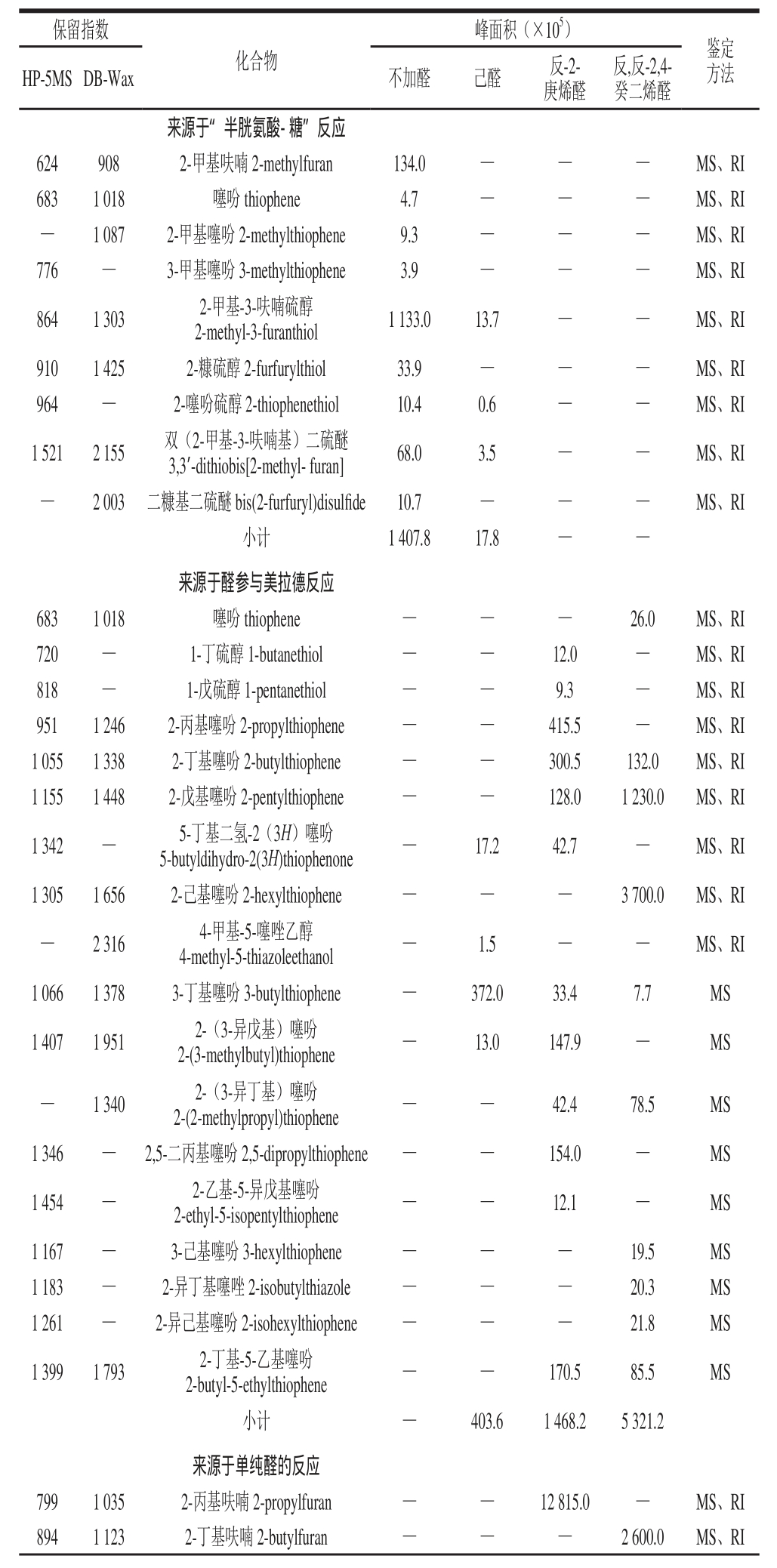
表1 添加、不添加3 种脂肪醛反应3 h产物检测到的挥发性物质
Table 1 Volatile compounds found in the 3 h reaction mixtures with or without three aliphatic aldehydes by GC-MS
续表1
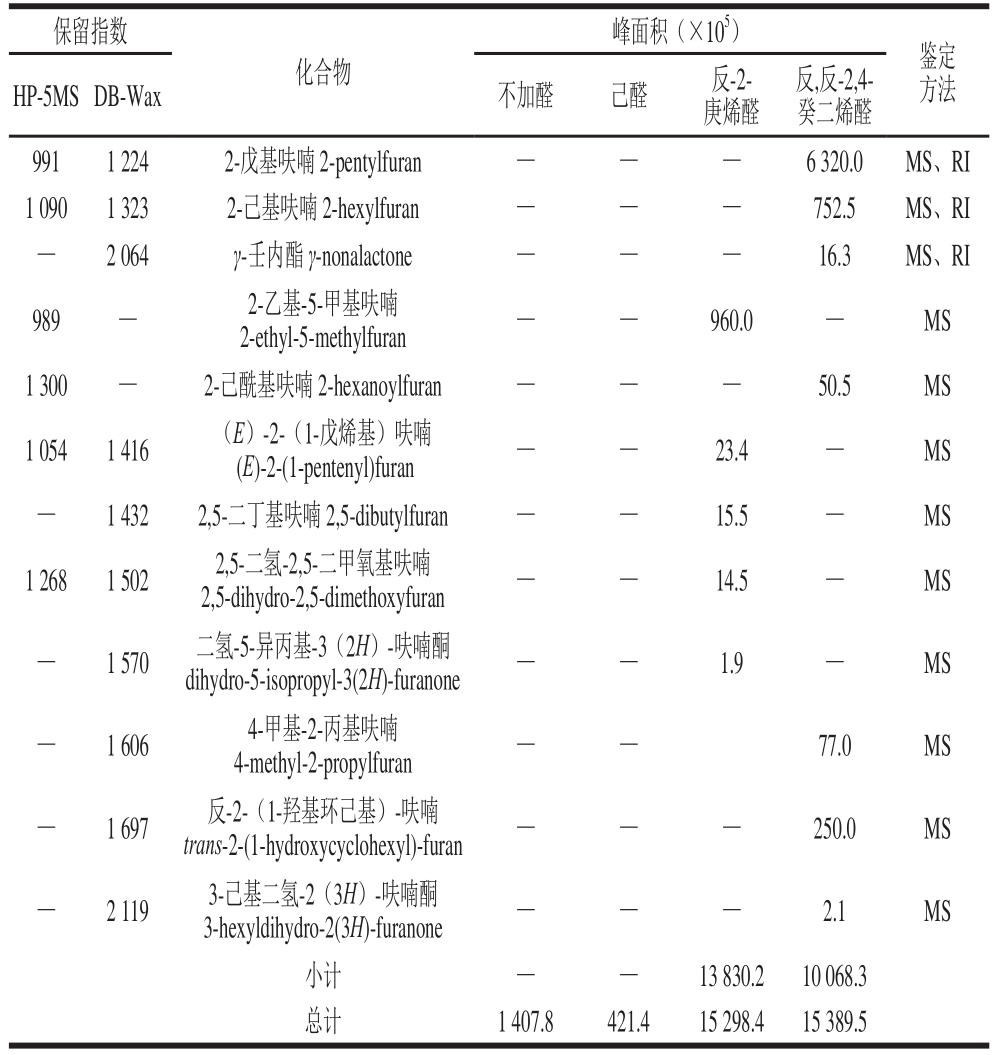
注:保留指数为实验测得;—.未检出;峰面积为HP-5MS和DB-Wax两柱检测出的化合物峰面积平均值;鉴定方法中MS为检索NIST 2011谱库及人工解谱鉴定,RI为与NIST 2011谱库保留指数核对鉴定。
研究表明[4-9],在脂质氧化存在的“半胱氨酸-还原糖”模型反应中,一方面脂质氧化使产生于“半胱氨酸-还原糖”间美拉德反应的2-甲基-3-呋喃硫醇、2-糠硫醇等含硫化合物含量降低,并有新的带烷基侧链的杂环化合物生成;另一方面,美拉德反应使产生于脂质氧化降解的脂链醇类、烷基呋喃类化合物含量升高。由表1可见,不加脂肪醛时,“半胱氨酸-木糖”美拉德反应生成的含硫化合物包括硫醇类、硫醚类、噻吩类等,其中占主要含量(峰面积表示,下同)的为2-甲基-3-呋喃硫醇、2-糠硫醇及它们的二聚体双(2-甲基-3-呋喃基)二硫醚和二糠基二硫醚。这4 个化合物是目前公认的具有强势气味活性的肉香化合物[27-29],尤其双(2-甲基-3-呋喃基)二硫醚具有极低的气味阈值,为0.02 ng/L(空气)[30]。但从表1可知,加入己醛后,4 个化合物中仅有2-甲基-3-呋喃硫醇及其二聚体双(2-甲基-3-呋喃基)二硫醚被检测到,而加入反-2-庚烯醛和反,反-2,4-癸二烯醛后来源于“半胱氨酸-木糖”美拉德反应形成的化合物均未检测到。这与2.1节所述的反-2-庚烯醛、反,反-2,4-癸二烯醛反应活性高,对“半胱氨酸-木糖”间美拉德反应的抑制作用强有关。
由表1可见,加入反-2-庚烯醛、反,反-2,4-癸二烯醛后,由于醛参与美拉德反应及醛本身的一些反应,产生了带有烷基链的新化合物,包括烷基含硫化合物(如1-丁硫醇、2-己基噻吩)和烷基呋喃类化合物(如2-丁基呋喃)。如图4所示,含量较高的2-丙基噻吩、2-己基噻吩,可分别由反-2-庚烯醛、反,反-2,4-癸二烯醛与半胱氨酸降解反应产生的硫化氢作用形成[1];含量较高的2-丙基呋喃、2-丁基呋喃可分别由反-2-庚烯醛、2-辛烯醛(由反,反-2,4-癸二烯醛逆羟醛缩合反应生成)发生反应形成[18,24-25]。由于烯醛类化合物发生逆羟醛缩合反应产生的短链醛,还可进一步发生缩合反应生成其他种类的醛,因此添加反-2-庚烯醛、反,反-2,4-癸二烯醛的体系检测到了多种具有不同烷基侧链的新化合物,其中添加反,反-2,4-癸二烯醛体系中的噻吩,可由反,反-2,4-癸二烯醛逆羟醛缩合反应产生的2-丁烯醛与硫化氢反应形成。而在“半胱氨酸-木糖”体系中,噻吩则可由木糖降解产生的丁二醛与硫化氢缩合形成,2-甲基呋喃可由Cys-Amadori经烯醇化、环合、脱水等反应形成(图1)[31]。但己醛由于反应活性低,加入己醛的体系,生成的带烷基链化合物较少(表1)。这与2.1节所述的添加己醛时表现为对美拉德反应的抑制,而添加反-2-庚烯醛、反,反-2,4-癸二烯醛却表现为对中、末期美拉德反应的促进作用相一致。
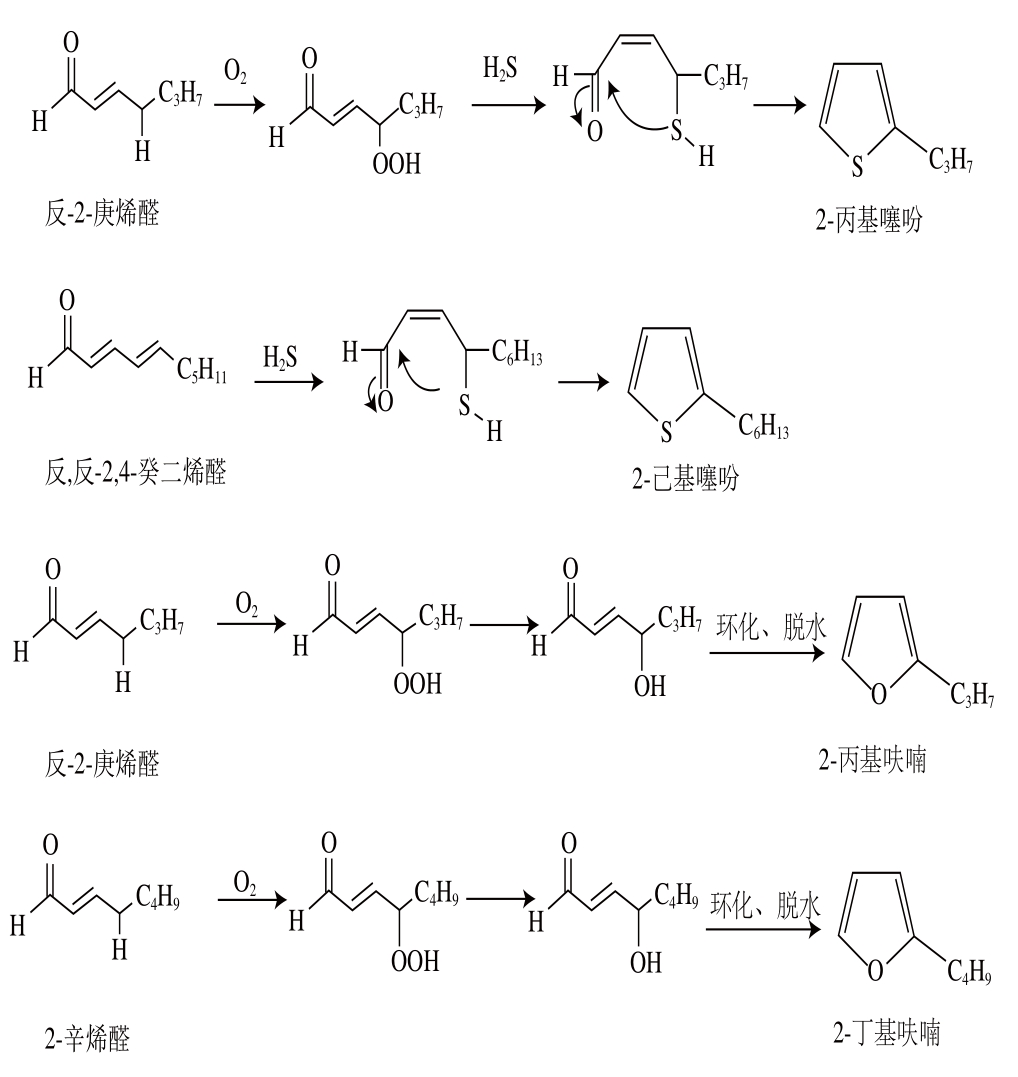
图4 “半胱氨酸-木糖”中添加反-2-庚烯醛、反,反-2,4-癸二烯醛反应时检测到的烷基呋喃(2-丙基呋喃、2-丁基呋喃)及烷基噻吩(2-丙基2-噻吩、2-己基噻吩)的可能形成途径
Fig. 4 Proposed pathways for the formation of the alkyl furanes,e.g. 2-propylfuran and 2-butylfuran, and alkyl thiophenes, e.g.2-propylthiophene and 2-hexylthiophene detected by GC-MS in the reaction systems with (E)-2-heptenal and (E,E)-2,4-decadienal
己醛、反-2-庚烯醛、反,反-2,4-癸二烯醛均对“半胱氨酸-木糖”体系的初期美拉德反应有抑制作用,抑制从强到弱顺序为反-2-庚烯醛、反,反-2,4-癸二烯醛、己醛。加入己醛的体系,初期美拉德反应受到抑制后,随之中、末期阶段美拉德反应速率低于“半胱氨酸-木糖”体系,从而造成产生的含硫肉香味物质的总量大幅度减少。
反-2-庚烯醛、反,反-2,4-癸二烯醛反应活性高,可与半胱氨酸降解产生的硫化氢、氨作用,并可发生逆羟醛反应产生其他种类有较高反应活性的醛,从而对中、末期美拉德反应表现促进作用,其中二烯醛(反,反-2,4-癸二烯醛)的促进效应又大于单烯醛(反-2-庚烯醛)。挥发性化合物分析表明,这种促进效应尤其使较多具有烷基链的新含硫化合物生成,从而导致体系中的含硫肉香化合物总量大于单纯“半胱氨酸-木糖”体系。
参考文献:
[1] MOTTRAM D S. Flavour formation in meat and meat products∶ a review[J]. Food Chemistry, 1998, 62(4)∶ 415-424. DOI∶10.1016/S0308-8146(98)00076-4.
[2] 杨峥, 张玲, 王蒙, 等. 氧化及未氧化脂肪对“半胱氨酸-葡萄糖”体系非(难)挥发性反应产物的影响[J]. 中国食品学报, 2016, 16(2)∶76-84. DOI∶10.16429/j.1009-7848.2016.02.012.
[3] 杨峥, 张玲, 都荣强, 等. 氧化及未氧化脂肪对热反应水溶性产物的影响[J]. 食品科学技术学报, 2015, 33(2)∶ 34-41. DOI∶10.3969/j.issn.2095-6002.2015.02.007.
[4] 谢建春, 孙宝国, 刘晶鑫. 氧化及未氧化脂肪对半胱氨酸-核糖体系热反应肉香味形成的影响[J]. 食品与发酵工业, 2009, 35(3)∶ 1-5.
[5] 靳林溪, 潘翠芳, 王石, 等. “氧化鸡脂-半胱氨酸”反应体系的肉香味物质及其形成机制[J]. 食品科学, 2011, 32(19)∶ 1-6.
[6] YANG Z, XIE J, ZHANG L, et al. Aromatic effect of fat and oxidized fat on a meat-like model reaction system of cysteine and glucose∶aromatic effect of fat on meat-like model reaction system[J]. Flavour& Fragrance Journal, 2015, 30(4)∶ 320-329. DOI∶10.1002/ffj.3248.
[7] FARMER L J, MOTTRAM D S. Interaction of lipid in the maillard reaction between cysteine and ribose∶ the effect of a triglyceride and three phospholipids on the volatile products[J]. Journal of the Science of Food and Agriculture, 1990, 53(4)∶ 505-525. DOI∶10.1002/jsfa.2740530409.
[8] XU Y, CHEN Q, LEI S, et al. Effects of lard on the formation of volatiles from the Maillard reaction of cysteine with xylose[J]. Journal of the Science of Food and Agriculture, 2011, 91(12)∶ 2241-2246.DOI∶10.1002/jsfa.4445.
[9] ELMORE J S, CAMPO M M, ENSER M, et al. Effect of lipid composition on meat-like model systems containing cysteine, Ribose,and polyunsaturated fatty acids[J]. Journal of Agricultural & Food Chemistry, 2002, 50(5)∶ 1126-1132. DOI∶10.1021/jf0108718.
[10] HODGE J E. Dehydrated foods. Chemistry of browning reactions in model systems[J]. Journal of Agricultural & Food Chemistry, 1953,1(15)∶ 928-943.
[11] DE ROOS K B, WOLSWINKEL K, SIPMA G. Amadori compounds of cysteine and their role in the development of mat flavor[M]//In Process and Reaction Flavors. ACS Symposium Series. Washington DC∶ American Chemical Society, 2005∶ 117-129. DOI∶10.1021/bk-2005-0905.ch009.
[12] 公敬欣, 曹长春, 侯莉, 等. 热反应肉味香精制备体系半胱氨酸产生肉香味的初始Maillard反应途径[J]. 中国食品学报, 2016, 16(2)∶68-75. DOI∶10.16429/j.1009-7848.2016.02.011.
[13] 曹长春, 梁晶晶, 王蒙, 等. 亲水色谱柱对氨基酸及其美拉德反应初始中间体的分离[J]. 食品科学, 2016, 37(2)∶ 63-71. DOI∶10.7506/spkx1002-6630-201602011.
[14] LIU S C, YANG D J, JIN S Y, et al. Kinetics of color development,pH decreasing, and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J]. Food Chemistry, 2008,108(2)∶ 533-541. DOI:10.1016/j.foodchem.2007.11.006.
[15] LEIVA G E, NARANJO G B, MALEC L S. A study of different indicators of Maillard reaction with whey proteins and different carbohydrates under adverse storage conditions[J]. Food Chemistry,2017, 215∶ 410-416. DOI∶10.1016/j.foodchem.2016.08.003.
[16] AJANDOUZ E H, TSCHIAPE L S, DALLE O F, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Journal of Food Science, 2001, 66(7)∶ 926-931.DOI∶10.1111/j.1365-2621.2001.tb08213.x.
[17] YAYLAYAN V A, HUYGHUES-DESPOINTES A, FEATHER D M S. Chemistry of amadori rearrangement products∶ analysis,synthesis, kinetics, reactions, and spectroscopic properties[J]. Critical Reviews in Food Science and Nutrition, 1994, 34(4)∶ 321-369.DOI∶10.1080/10408399409527667.
[18] ADAMS A, KITRYTĖ V, VENSKUTONIS R, et al. Model studies on the pattern of volatiles generated in mixtures of amino acids, lipidoxidation-derived aldehydes, and glucose[J]. Journal of Agricultural &Food Chemistry, 2011, 59(4)∶ 1449-1456. DOI∶10.1021/jf104091p.
[19] LERICI C R, BARBANTI D, MANZANO M, et al. Early indicators of chemical changes in foods due to enzymic or nonenzymic browning reaction. 1∶ Study on heat-treated model systems[J]. Lebensmittel-Wissenschaft and Technologie, 1990, 23∶ 289-294.
[20] CARABASA-GIRIBET M, IBARZ-RIBAS A. Kinetics of colour development in aqueous glucose systems at high temperatures[J].Journal of Food Engineering, 2000, 44∶ 181-189. DOI∶10.1016/S0260-8774(00)00027-3.
[21] 杨锋, 陈锦屏, 林心怡. 美拉德反应对醋蛋多肽抗氧化活性的影响[J].食品科学, 2013, 34(3)∶ 137-140.
[22] JISANG K, YOUNGSOON L. Study of Maillard reaction products derived from aqueous model systems with different peptide chain lengths[J]. Food Chemistry, 2009, 116(4)∶ 846-853. DOI∶10.1016/j.foodchem.2009.03.033.
[23] SUN L, ZHUANG Y. Characterization of the Maillard reaction of enzyme-hydrolyzed wheat protein producing meaty aromas[J]. Food and Bioprocess Technology, 2012, 5(4)∶ 1287-1294. DOI∶10.1007/s11947-010-0406-5.
[24] ADAMS A, BOUCKAERT C, VAN LANCKER F, et al. Amino acid catalysis of 2-alkylfuran formation from lipid oxidation-derived α,β-unsaturated aldehydes[J]. Journal of Agricultural & Food Chemistry, 2011, 59(20)∶ 11058-11062. DOI:10.1021/jf202448v.
[25] HIDALGO F J, ZAMORA R. Amino acid degradations produced by lipid oxidation products[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(8)∶ 1242-1252. DOI:10.1080/10408398.2012.761173.
[26] ELMORE J S, MOTTRAM D S. The role of lipid in the flavour of cooked beef[J]. Developments in Food Science, 2006, 43∶ 375-378.DOI∶10.1016/S0167-4501(06)80089-0.
[27] HOFMANN T, SCHIEBERLE P. Evaluation of the key odorants in a thermally treated solution of ribose and cysteine by aroma extract dilution techniques[J]. Journal of Agricultural & Food Chemistry,1995, 43(8)∶ 2187-2194. DOI∶10.1021/jf00056a042.
[28] HOFMANN T, SCHIEBERLE P. Identification of potent aroma compounds in thermally treated mixtures of glucose/cysteine and Rhamnose/cysteine using aroma extract dilution techniques[J].Journal of Agricultural & Food Chemistry, 1997, 45(3)∶ 898-906.DOI:10.1021/jf960456t.
[29] 王蒙, 侯莉, 曹长春, 等. 清炖猪肉汤香气物质的分析鉴定[J]. 食品科学, 2015, 36(24)∶ 105-111. DOI∶10.7506/spkx1002-6630-201524018.
[30] GASSER U, GROSCH W. Primary odorants of chicken broth[J].European Food Research and Technology, 1990, 190(1)∶ 3-8.DOI∶10.1007/BF01188254.
[31] HOU L, XIE J, ZHAO J, et al. Roles of different initial Maillard intermediates and pathways in meat flavor formation for cysteinexylose-glycine model reaction systems[J]. Food Chemistry, 2017, 232∶135-144. DOI∶10.1016/j.foodchem.2017.03.133.
Effect of Aliphatic Aldehydes on Maillard Reaction between Cysteine and Xylose and Meaty Flavor Formation
ZHAO Jian1, ZHAO Mengyao1, CAO Changchun1, ZHEN Dawei2, WANG Jiaxin1, LI Li1, XIE Jianchun1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Laboratory for Food Quality and Safety,Beijing Key Laboratory of Flavor Chemistry, Beijing Technology & Business University (BTBU), Beijing 100048, China;2. College of Chemistry and Chemical Engineering, Taiyuan University of Technology, Taiyuan 030024, China)
中图分类号:TQ656.1
文献标志码:A
文章编号:1002-6630(2017)20-0063-07
收稿日期:2017-03-23
基金项目:国家自然科学基金面上项目(31371838;31671895);北京市自然科学基金面上项目(6172004);“十三五”国家重点研发计划重点专项(2017YFD0400106)
作者简介:赵健(1992—),男,硕士研究生,研究方向为食品风味化学。E-mail:jian3597@163.com
*通信作者:谢建春(1967—),女,教授,博士,研究方向为食品风味化学。E-mail:xjchun@th.btbu.edu.cn
引文格式:
赵健, 赵梦瑶, 曹长春, 等. 脂肪醛对“半胱氨酸-木糖”美拉德反应进程及肉香物质形成的影响[J]. 食品科学, 2017,38(20)∶ 63-69. DOI∶10.7506/spkx1002-6630-201720010. http∶//www.spkx.net.cn
ZHAO Jian, ZHAO Mengyao, CAO Changchun, et al. Effect of aliphatic aldehydes on Maillard reaction between cysteine and xylose and meaty fl avor formation[J]. Food Science, 2017, 38(20)∶ 63-69. (in Chinese with English abstract)DOI∶10.7506/spkx1002-6630-201720010. http∶//www.spkx.net.cn