郭宇星1,薛逸秋1,姜潇潇1,吴 振2,曾小群2,孙杨赢2,潘道东1,2,*
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
摘 要:本实验以脂质体作为包埋载体,研究血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽Arg-Leu-Ser-Phe-Asn-Pro(RLSFNP)脂质体的制备工艺。以包封率为考察指标,采用单因素试验和响应面试验优化RLSFNP脂质体的制备工艺。得出最优制备条件为:大豆卵磷脂用量120.0 mg、胆固醇用量24.6 mg、 RL SFNP用量15.3 mg、乙醚用量15.0 mL、磷酸盐缓冲液(pH 7.4)用量5.8 mL、探头超声时间5.2 min。在此条件下制备的脂质体平均粒径在168 nm左右,电位为-31.2 mV,实际包封率为(67.5±0.8)%,由脂质体包埋后的RLSFNP具有一定的缓释效果。
关键词:血管紧张素转换酶抑制肽;脂质体;包封率;生物利用率
Abstract: The objective of the present study was to optimize the preparation of liposomes incorporating the angiotensin converting enzyme (ACE) inhibitory peptide Arg-Leu-Ser-Phe-Asn-Pro (RLSFNP) using combination of one-factor-ata-time method and response surface methodology. The response variable was the entrapement effi ciency. The optimum preparation conditions were determined as follows∶ soy lecithin, 120.0 mg; cholesterol, 24.6 mg; RLSFNP, 15.3 mg; ether,15 mL; PBS buffer (pH 7.4), 5.8 mL; and ultrasonication time, 5.2 min. Under these conditions, the average diameter,potential and entrapement effi ciency of liposomes were 168 nm, –31.2 mV and (67.5 ± 0.8) %, respectively. The liposomes could sustainably release RLSFNP.
Key words: angiotensin converting enzyme (ACE) inhibitory peptides; liposomes; entrapement effi ciency; bioavailability
DOI∶10.7506/spkx1002-6630-201720020
在人体生理过程中,血压的调节主要受到肾素-血管紧张素调节系统和激肽释放酶-激肽系统[1]相互作用控制的,血管紧张素转换酶(angiotensin converting enzyme,ACE)在血压调节和电解质平衡中有重要作用[2-3],是这2个系统中的关键酶[3],2个系统在ACE的协同作用下会造成人体内血压的升高[4]。目前大量研究表明,如果可以抑制ACE的活性作用,就能起到降血压作用[5]。高血压患者通过服用含有ACE抑制剂降低ACE的活性,可以有效地降低血压[6]。ACE抑制肽就是通过抑制ACE的作用达到抗血压升高的功效[7]。
脂质体是由磷脂等材料为膜材形成的双分子层膜的微囊[8],大小从直径几十纳米到几十微米不等,在脂质体的水相和膜内可以包裹多种物质,是一种新型药物载体。可以用作靶向细胞特定给药,减少系统毒副作用[9]。脂质体作为药物控释系统既可以携带水溶性药物,将药物包封在微水相内;也可以携带油溶性药物,将药物整合于双层膜中[10]。目前,脂质体在食品方面也有了越来越多的应用,脂质体可以保护包埋物的功能成分,并可提高包埋功能成分的稳定性[11],如Maherani等[12]发现通过纳米脂质体包封天然二肽抗氧化剂(L-肌肽)可以解决例如减少活性物质在食品体系复杂反应中的氧化、降低发生在食品表面微生物引起的变质以及氧化酸败等食品保鲜的相关问题。此外,脂质体包埋还可实现功能食品的缓释,保护功能性食品免受胃肠道水解,提高生物利用度[13]。如Liu Weilin等[14]采用薄膜分散法制备乳铁蛋白脂质体,保护乳铁蛋白,避免其在胃液消化时受胃蛋白酶的影响,使其在小肠部位进行消化吸收,进而达到控制释放的特性及提高乳铁蛋白的利用率。
Pan Daodong等[15]利用瑞士乳杆菌蛋白酶水解乳清蛋白,从乳清蛋白水解物中分离纯化出一种新的ACE抑制肽Arg-Leu-Ser-Phe-Asn-Pro(RLSFNP),是β-乳球蛋白的148~153片段。祝倩[16]以Caco-2细胞为模型,研究了六肽RLSFNP的模拟小肠吸收,研究发现RLSFNP易被肠道刷状缘膜存在的肽酶水解,口服生物利用度较低。因此,本实验利用胆固醇和大豆卵磷脂为脂质体的膜材料,采用逆相蒸发法制备RLSFNP脂质体,以包封率为指标,通过单因素试验和响应面试验优化RLSFNP的脂质体的制备条件,旨在提供一种RLSFNP脂质体的制备方法,提高RLSFNP的口服生物利用度,为乳源功能肽利用与功能性食品市场提供一定的理论支持。
1.1 材料与试剂
Arg-Leu-Ser-Phe-Asn-Pro(RLSFNP)(纯度>95%) 杭州中肽生化有限公司;大豆卵磷脂 生工生物工程(上海)股份有限公司;胆固醇 中国医药(集团)化学试剂有限公司;曲拉通X-100 南京赛吉科技有限公司;透析袋(截留分子质量8~14 kD) 南京荣世德贸易有限公司;无水乙醚 国药集团化学试剂有限公司;磷酸盐缓冲液(phosphate buffer solution,PBS) 北京索莱宝科技有限公司。
1.2 仪器与设备
PHS-3C型pH计 上海三信仪器厂;超声波细胞粉碎机 宁波新芝生物科技股份有限公司;BS210S型电子天平 上海浦春计量仪器有限公司;旋转蒸发仪上海亚荣生化仪器厂;纳米粒度ZETA电位仪 英国马尔文仪器有限公司;电热恒温水浴槽 天津市泰斯特仪器有限公司;循环水式真空泵 南京科尔仪器设备有限公司;GL-22M型超速冷冻离心机 赛特湘仪离心机仪器有限公司;G100A型紫外分光光度计 上海元析仪器有限公司;JEM-2100(HR)型透射电子显微镜 日本Jeol公司。
1.3 方法
1.3.1 RLSFNP含量的测定
1.3.1.1 测定波长的选择
精密称取10 mg RLSFNP于试管中,加入10 mL PBS(pH 7.4)配成1 mg/mL的RLSFNP母液。将母液稀释至质量浓度梯度为0.01、0.02、0.03、0.04、0.05、0.06 mg/mL。分别在紫外光区与可见光区作全波长扫描(190~700 nm),发现吸收峰位于205 nm波长处,扫描图谱重现性好,故以205 nm作为检测波长[17]。
1.3.1.2 标准曲线的绘制
配制1 mg/mL的RLSFNP母液,将母液稀释至质量浓度梯度为0.01、0.02、0.03、0.04、0.05、0. 06 mg/mL[17-18]。以PBS(pH 7.4)为空白,在最大吸收的波长下分别测定吸光度,将RLSFNP浓度(X)与对应吸光度(Y)进行直线回归,绘制RLSFNP含量测定的标准曲线,得回归方程为Y=23.692X+0.008 06,平均相关系数R2为0.999 35,结果表明RLSFNP在0.01~0.06 mg/mL质量浓度范围内线性关系良好。根据标准曲线方程计算脂质体中RLSFNP的含量,从而计算包封率。
1.3.2 RLSFNP脂质体的制备与形态表征
1.3.2.1 RLSFNP脂质体的制备
采用逆相蒸发法制备RLSFNP脂质体[19]。大豆卵磷脂与胆固醇按照一定的比例置于50 mL小烧杯中,加入适量乙醚将其溶解,为有机相。称取一定量的RLSFNP溶解于适量的PBS中,为水相。在有机相液面以下用注射器将水相缓慢注入有机相。将上述混合液在冰水浴,超声功率为400 W、工作时间为5 s、间隙时间为7 s的条件下探头超声一段时间。将超声后的乳液置于50 mL的圆底烧瓶中,减压旋转蒸发除去有机溶剂,直至形成均匀的胶状物。再加入PBS水化至胶状物完全从壁上脱落。将所得混悬液在同样的超声强度下探头超声形成粒径和粒度分布均匀的RLSFNP脂质体。
1.3.2.2 包封率的测定
取5 mL制得的RLSFNP脂质体装入透析袋内,透析袋两头扎紧后置于100 mL PBS的烧杯中,4 ℃透析4 h[19-20]。4 h后取适量透析液,按照1.3.1节所述方法测定吸光度,计算游离RLSFNP的含量。包封率计算如式(1)所示:
式中:m总为初始称取的RLSFNP总质量/mg;m游离为游离RLSFNP质量/mg。
1.3.2.3 脂质体粒径和电位的测定
取适量RLSFNP脂质体,适量PBS稀释后用纳米激光粒度电位分析仪进行粒径及电位的测定,经动态光散射处理软件处理[21-22]。
1.3.2.4 脂质体的形态观察
滴2 滴透析后的RLSFNP脂质体于专用铜网上,自然晾干后用2.5 g/100 mL的磷钨酸负染,自然挥干,使粒子在铜网上浓缩沉积,用透射电子显微镜观察并照相[23]。
1.3.2.5 脂质体体外释药性能测定
取5 mL RLSFNP脂质体装入透析袋中,置于100 mL PBS的烧杯中进行透析,同时取5 mL含同样含量RLSFNP的PBS于透析袋中,在100 mL PBS中进行透析做对比,其中透析温度为(37±0.5)℃,在磁力搅拌器上进行,搅拌速度为100 r/min,分别在0.25、0.5、1、2、4、6、8、10、12、24 h定时取5 mL烧杯中的溶液,同时补加5 mL PBS溶液,采用紫外分光光度计在205 nm波长处测定不同时间透析液中RLSFNP吸光度,计算其含量,各个时间点脂质体的释放率计算如式(2)所示[19]:
式中:mn是第n次累积释放的RLSFNP质量/mg;m是初始包埋在脂质体中的RLSFNP总质量/mg。
1.3.3 RLSFNP脂质体制备工艺优化
1.3.3.1 大豆卵磷脂与胆固醇质量比对包封率的影响
制备大豆卵磷脂与胆固醇质量比分别为2∶1、3∶1、4∶1、5∶1、6∶1的5 组脂质体,其中大豆卵磷脂质量均为120 mg,RLSFNP质量为15 mg,有机相体积为15 mL,水相体积为5 mL,两次超声时间均为5 min,PBS pH值为7.4,分别测定5 组脂质体的包封率。
1.3.3.2 大豆卵磷脂与RLSFNP质量比对包封率的影响
制备大豆卵磷脂与RLSFNP质量比分别为6∶1、8∶1、10∶1、12∶1、14∶1的5 组脂质体,其中大豆卵磷脂质量均为120 mg,胆固醇质量为30 mg,有机相体积为15 mL,水相体积为5 mL,两次超声时间均为5 min,PBS pH值为7.4,分别测定5 组脂质体的包封率。
1.3.3.3 有机相(乙醚)与水相(PBS)体积比对包封率的影响
制备有机相与水相体积比分别为2∶1、3∶1、4∶1、5∶1、6∶1的5 组脂质体,其中有机相的体积固定为15 mL,大豆卵磷脂质量为120 mg,胆固醇质量为30 mg,RLSFNP质量为15 mg,两次超声时间均为5 min,PBS pH值为7.4,分别测定5 组脂质体的包封率。
1.3.3.4 超声时间对包封率的影响
制备第1次探头超声时间分别为2、5、8、11、14 min的5 组脂质体,其中大豆卵磷脂质量均为120 mg,胆固醇质量为30 mg,RLSFNP质量为15 mg,有机相体积为15 mL,水相体积为5 mL,第2次超声时间为5 min,PBS pH值为7.4,分别测定5 组脂质体的包封率。
1.3.3.5 PBS pH值对包封率的影响
制备PBS pH值分别为6.2、6.6、7.0、7.4、7.8的5 组脂质体,其中大豆卵磷脂质量均为120 mg,胆固醇质量为30 mg,RLSFNP质量为15 mg,有机相体积为15 mL,水相体积为5 mL,两次超声时间均为5 min,分别测定5 组脂质体的包封率。
1.3.3.6 响应面法对最佳包封率优化
分析以上单因素试验结果,运用Box-Behnken试验原理,选择X1、X2、X3、X44 个变量,以包封率为响应值,采用四因素三水平的响应面试验,因素与水平设计见表1,数据分析利用软件Design-Expert 8。
表1 响应面试验因素与水平
Table 1 Level and code of independent variables used for Box-Behnken dessiiggnn

1.4 数据处理
利用软件SPSS 19.0统计软件进行统计学分析,单因素方差分析检验组间显著性差异,数据用 ±s表示,组间差异显著性用q检验。
2.1 RLSFNP脂质体制备的单因素试验结果
2.1.1 大豆卵磷脂与胆固醇质 量比对脂质体包封率的影响

图1 大豆卵磷脂与胆固醇质量比对脂质体包封率的影响
Fig. 1 Effect of ratio of soy lecithin to cholesterol on the entrapement effi ciency of lipsomes
由图1可以看出,大豆卵磷脂与胆固醇的质量比对包封率有一定影响(P<0.05)。当大豆卵磷脂与胆固醇质量比为5∶1时,包封率最高为(63.5±0.5)%,在质量比2∶1~5∶1范围内,包封率随质量比增大而升高,在质量比5∶1~6∶1范围内,包封率随质量比增大而降低。有文献报道,胆固醇比例过低会造成磷脂膜韧性不足,而胆固醇比例过高会使磷脂膜的流动性下降[24],这些都会增加磷脂双分子层卷曲化难度,从而造成药物包封率下降。同时,胆固醇作为脂质体的“流动性缓冲剂”,对脂质体的药物释放和脂质膜对水的渗透性也具有重要的调节作用[24-25]。
2.1.2 大豆卵磷脂与RLSFNP质量比对脂质体包封率的影响
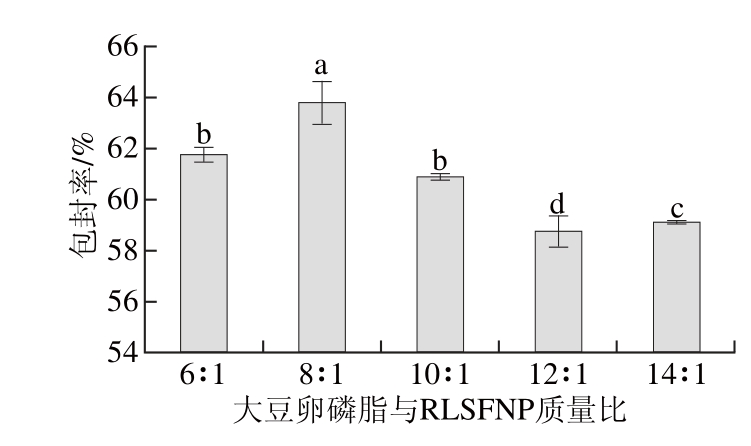
图2 大豆卵磷脂与RLSFNP质量比对脂质体包封率的影响
Fig. 2 Effect of ratio of soy lecithin to RLSFNP on the entrapement effi ciency of lipsomes
由图2可以看出,当大豆卵磷脂与RLSFNP质量比为8∶1时,包封率最高;在质量比6∶1~8∶1范围内,包封率随质量比增大而升高;在8∶1~14∶1范围内,包封率随质量比增大而降低。
2.1.3 乙醚与PBS体积比对脂质体包封率的影响
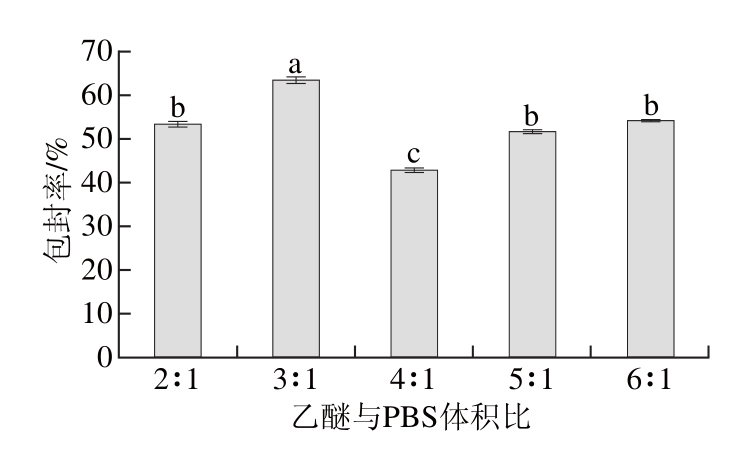
图3 乙醚与PBS体积比对脂质体包封率的影响
Fig. 3 Effect of ratio of ethyl ether to PBS buffer on the entrapement effi ciency
由图3可以看出,当乙醚与PBS体积比为3∶1时,包封率最高,在2∶1~3∶1范围内,包封率随体积比增大而升高,在3∶1~6∶1范围内,包封率随体积比增大而降低。实验结果表明制备初乳时有机相乙醚/水相PBS体积比较低可以产生较高的包封率。可能是因为有机相和水相的比例会影响到初乳的形成,而当水相比例增加时可以提高初乳的分散性,导致更小更细的乳滴的形成,使初乳体系更加稳定,有利于提高脂质体的包封率。
2.1.4 超声时间对脂质体包封率的影响

图4 超声时间对脂质体包封率的影响
Fig. 4 Effect of ultrasonication time on the entrapement effi ciency of lipsomes
由图4可以看出,当超声时间为8 min时,包封率最高,当超声时间在2~8 min范围内,包封率随时间的延长而升高,在8~10 min内,包封率随时间延长而逐渐稳定,并且8 min和10 min包封率差异不显著。如果超声时间太短,有机相与水相没有完全形成乳液,初乳体系不稳定,使包封率降低,当超声时间为8 min时,已经超声至分散均匀的初乳,而当超声时间更长时,已经稳定的乳液被再次破坏,且超声时间过长可能使RLSFNP活性受损。
2.1.5 PBS pH值对脂质体包封率的影响

图5 PBS pH值对脂质体包封率的影响
Fig. 5 Effect of pH of phosphate buffer on the entrapement effi ciency
由图5可知,当缓冲液pH值为6.2、6.6时,RLSFNP的PBS在205 nm波长处无最大吸光度,最大吸收峰发生偏移,而当pH值在7.0~7.8的范围内,pH值为7.4时包封率最高。
综合图1~5可知,各因素对脂质体的包封率都有一定影响。根据各单因素试验的结果,利用软件SPSS 19.0进行最小显著性差异分析。在大豆卵磷脂与胆固醇质量比因素中,不同比例的大豆卵磷脂和胆固醇对脂质体包封率的影响差异显著;在大豆卵磷脂与RLSFNP质量比因素中,比例为8∶1组影响极显著,6∶1、10∶1组显著;在乙醚与PBS体积比因素中,比例为3∶1组影响极显著,2∶1、5∶1和6∶1组较显著;在超声时间因素中,8 min与10 min组为极显著;在pH因素中,pH值为7.4组对脂质体包封率影响极显著,pH值为7.0组对脂质体包封率影响较显著。因此,选择大豆卵磷脂与胆固醇质量比、大豆卵磷脂与RLSFNP质量比、乙醚与PBS体积比、超声时间为进行响应面优化的4 个因素,虽然PBS pH值对脂质体包封率也有影响,但影响程度没有其他4 个因素大,根据单因素试验结果发现,pH值为7.4时包封率最高,所以将缓冲液pH值定为7.4。
2.2 响应面试验优化结果
由单因素试验结果,选择大豆卵磷脂与胆固醇质量比、大豆卵磷脂与RLSFNP质量比、乙醚与PBS体积比、超声时间4 个因素为变量,以包封率为响应值,采用四因素三水平的响应面试验对脂质体包封率进行优化,结果见表2。
表2 Box-Behnken试验设计及结果
Table 2 Box-Behnken design with experimental results

根据表2结果,利用软件Design-Expert 8进行非线性多元回归拟合,得包封率的编码二次多项式拟合方程:
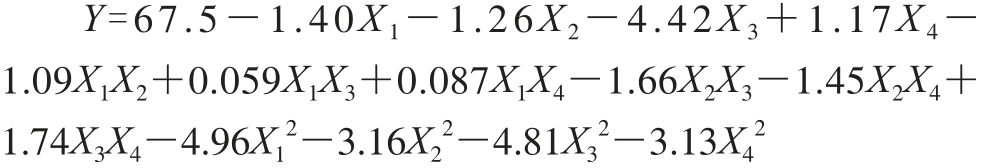
模型的回归系数见表3,根据P值的判断,本实验选用的二次多项式模型显著性很高(P<0.01)。由表3可知,X1、X2、X3、X4,交互项X1X2、X2X3、X2X4、X3X4及二次项式X12、X22、X32、X42均对Y影响显著。由表4可以看出,包封率的RA2dj为0.962 0,失拟项P值为0.151,说明模型拟合程度合适。
表3 RLSFNP脂质体包封率的回归系数
Table 3 Estimated regression coeffi cients for the entrapement effi ciency of RLSFNP liposomes

注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。下同。
表4 RLSFNP脂质体包封率的方差分析
Table 4 ANOVA for the encapsulation effi ciency of RLSFNP liposomes



图6 各因素交互作用对脂质体包封率的响 应面和等高线图
Fig. 6 Response surface plots and contour plots showing the interactive effects of variables on the entrapement effi ciency of RLSFNP lipsomes
任意2 个因素的交互作用对脂质体包 封率的影响如图6所示,利用Design-Expert 8进行分析,确定制备的RLSFNP脂质体的最佳工艺条件为大豆卵磷脂用量120.0 mg、胆固醇用量24.6 mg、 RLSFNP用量15.3 mg、乙醚用量15.0 mL、PBS用量5.8 mL、探头超 声时间5.2 min,理论包封率为67.8%,根据最优条件进行验证,进行3 组平行实验,结果发现脂质体实际包封率为(67.5±0.8)%,与理论误差在1.5%之内,实验值与预测值接近,说明工艺优化有效。
2.3 脂质体的粒径和Zeta电位分析

图7 RLSFNP脂质体粒径(半径)分布图
Fig. 7 Particle size distribution (radius) of RLSFNP lipsomes
由图7可知,RLSFNP脂质体平均粒径在168 nm左右,粒度分布较为均匀,蒲传奋等[26]报道了抗菌肽APG-K脂质体的制备,抗菌肽脂质体的平均粒径为(128.27±2.69)nm,抗菌肽的包封率为 62.83%,与实验结果相似。由图8可知,RLSFNP脂质体测得的Zeta电位为-31.2 mV,这与张冕等[27]采用逆相蒸发法制备胸腺五肽脂质体的Zeta电位(-48 mV)接近。Zeta电位是衡量电荷多少的一个重要指标,通常Zeta电位的绝对值越大,体系就越稳定。一般认为,Zeta电位的绝对值大于30 mV,体系是稳定的[28],因为在此电位下的脂质体混悬液体系比较稳定。
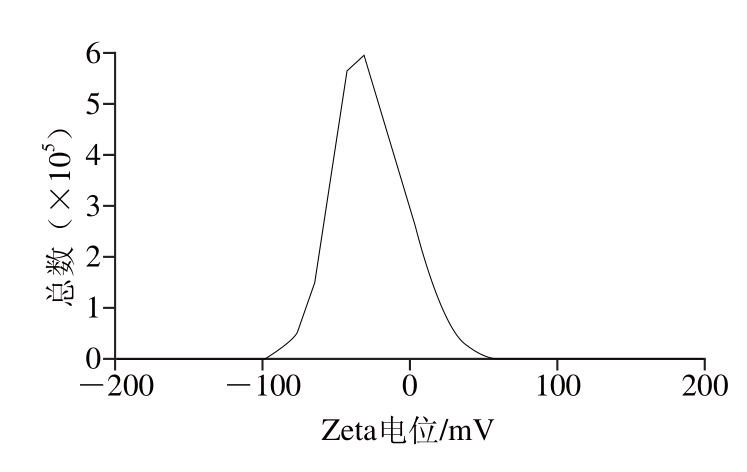
图8 RLSFNP脂质体Zeta电位图
Fig. 8 Zeta potential of RLSFNP liposomes
2.4 脂质体的形态
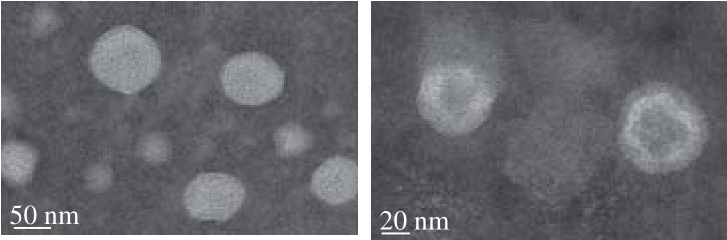
图9 脂质体的透射电镜观测图
Fig. 9 Transmission electron microscopy images of liposomes
脂质体电镜观测采用负染法,负染法的原理是将样品的背景染色以突显样品[29],一般是电子密度高,本身不会显示任何结构,又不和样品起反应的物质。实验所用磷钨酸负染,其钠盐 将样品包围,能显示外形。从图9可以看出,在优化条件下制备的RLSFNP脂质体为类球形结构,形态较为圆整,从整体观察可以发现脂质体分散较为均匀,有较少脂质体之间有黏连。但其大小不均,原因可能是采用逆向蒸发法并不能像挤出法[30]一样制得大小完全均一的脂质体。
2.5 脂质体体外释放率分析

图10 RLSFNP及RLSFNP脂质体的体外释放
Fig. 10 Release of RLSFNP and RLSFNP liposomes in vitro
由图10可知,RLSFNP原料药释放较快,在2.5 h左右累积释药率将近100%;而RLSFNP脂质体前期释药较快,后期释放缓慢,体外释放24 h时累积释药率为94.92%,相比RLSFNP原料药具有明显的缓释作用。关于脂质体具有缓释性能已有相关报道,蒲传奋等[26]利用脂质体包埋抗菌肽APG-K后,可以实现抗菌肽的缓释作用。
本实验对乳源ACE抑制肽RLSFNP进行了脂质体包埋研究,以提高RLSFNP的口服生物利用度。通过单因素试验和响应面优化,得到了制备ACE抑制肽RLSFNP脂质体的最优条件为大豆卵磷脂用量120.0 mg、胆固醇用量24.6 mg、RLSFNP用量15.3 mg、乙醚用量15.0 mL、PBS用量5.8 mL、探头超声时间5.2 min,制备出的脂质体平均粒径在168 nm左右,电位为-31.2 mV,实际包封率为(67.5±0.8)%。对最优制备条件下制作的脂质体进行了体外释放率的研究,发现RLSFNP脂质体具有明显的缓释效果。
参考文献:
[1] 陈河如, 徐志诚. 测定心血管紧张素转化酶抑制剂体外抑制动力学的反相HPLC法[J]. 分析测试学报, 1999, 18(1)∶ 69-71. DOI∶10.3969/j.issn.1004-4957.1999.01.022.
[2] DOUGLAS R G, SHARMA R K, MASUYER G, et al. Fragmentbased design for the development of N-domain-selective angiotensin-1-converting enzyme inhibitors[J]. Clinical Science, 2014, 126(4)∶305-313. DOI∶10.1042/CS20130403.
[3] 赵俊良, 卢海鹏, 芒来, 等. 乳酸菌盐溶性蛋白培养物中血管紧张素转化酶抑制活性肽的测定及分离[J]. 食品科学, 2016, 37(9)∶ 170-174. DOI∶10.7506/spkx1002-6630-201609032.
[4] 赵海珍, 陆北新, 刘战民. 天然食品来源的血管紧张素转换酶抑制肽的研究进展[J]. 中国生化药物杂志, 2004, 25(5)∶ 315-317.DOI∶10.3969/j.issn.1005-1678.2004.05.021.
[5] VERMEIRSSEN V, VANDER B A, VAN C J, et al. A quantitative in silico analysis calculates the angiotensin Ⅰ converting enzyme (ACE)inhibitory activity in pea and whey protein digests[J]. Biochimie, 2004,86(3)∶ 231-239. DOI∶10.1016/j.biochi.2004.01.003.
[6] TANZADEHPANAH H, ASOODEH A, MAHAKI H, et al. Bioactive and ACE binding properties of three synthetic petides assessed by various spectroscopy techniques[J]. Process Biochemistry, 2016,12(51)∶ 2067-2075. DOI∶10.1016/j.procbio.2016.09.017.
[7] 王建国, 闫冰雨, 雷楗勇, 等. 合成二肽ACE抑制活性及抗高血压初步研究[J]. 食品工业科技, 2016, 37( 4)∶ 160-164. DOI∶10.13386/j.issn1002-0306.2016.04.023.
[8] 梁汉萦, 刘成梅, 刘伟. 食源性ACE抑制肽的研究进展[J]. 食品研究与开发, 2007(8)∶ 156-158. DOI∶10.3969/j.issn.1005-6521.2007.08.051.
[9] BARTNECK M, SCHEYDA K M, WARZECHA K T, et al.Fluorescent cell-traceable dexamethasone-loaded liposomes for the treatment of inflammatory liver diseases[J]. Biomaterials, 2015, 37∶367-382. DOI∶10.1016/j.biomaterials.2014.10.030.
[10] WOODLE M C, LASIC D D. Sterically stabilized liposomes[J].Biochimica Et Biophysica Acta, 1992, 1113(2)∶ 171-199.DOI∶10.1016/0304-4157(92)900038-C.
[11] 郭夏丽, 蓝雅惠, 邹艺红, 等. 蜂胶醇提物脂质体制备及表征[J].食品科学, 2016, 37(13)∶ 47-52. DOI∶10.7506/spkx1002-6630-201613009.
[12] MAHERANI B, ARABTEHRANY E, KHEIROLOMOOM A, et al. Influence of lipid composition on physicochemical properties of nanoliposomes encapsulating natural dipeptide antioxidant L-carnosine[J]. Food Chemistry, 2012, 134(2)∶ 632-640. DOI∶10.1016/j.foodchem.2012.02.098.
[13] 李秀英, 曾凡, 赵曜, 等. 脂质体药物递送系统的研究进展[J]. 中国新药杂志, 2014(16)∶ 1904-1911.
[14] LIU W L, YE A Q, LIU W C, et al. Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J]. Journal of Dairy Science, 2013,96(4)∶ 2061-2070. DOI∶10.3168/jds.2012-6072.
[15] PAN D D, GUO Y X. Optimization of sour milk fermentation for the production of ACE-inhibiti ory peptides and purification of a novel peptide from whey protein hydrolysate[J]. Inteinational Dairy Journal,2010, 20(7)∶ 472-479. DOI∶10.1016/j.idairyj.2010.01.007.
[16] 祝倩. 利用Caco-2细胞研究乳源ACE抑制肽的小肠转运机制[D].南京 ∶ 南京师范大学, 2014∶ 40-50.
[17] 曹金娜. 多糖包覆的脂质体用于疫苗口服传递[D]. 沈阳∶ 沈阳药科大学, 2010∶ 41-59.
[18] 赵勇, 胡志和, 孙振刚, 等. RP-HPLC法测定酪蛋白水解物中ACE抑制肽的含量[J]. 食品工业科技, 2015, 36(10)∶ 54-58. DOI∶10.13386/j.issn1002-0306.2015.10.002.
[19] WANG W X, FENG S S, ZHENG C H. A comparison between conventional liposome and drug-cyclodextrin complex in liposome system[J]. International Journal of Pharmaceutics, 2016, 513(1/2)∶387-392. DOI∶10.1016/j.ijpharm.2016.09.043.
[20] 郑媛, 纪晓峰, 郑兰红, 等. 扇贝多肽脂质体制备工艺的优化与表征[J]. 食品工业科技, 2013, 34(24)∶ 309-311.
[21] 杨水兵, 刘成梅, 刘伟, 等. VC脂质体的制备与稳定性测定[J].食品科学, 2010, 31(20)∶ 230-234. DOI∶10.7506/spkx1002-6630-201020046.
[22] JAIN S, KUMAR D, SWARNAKAR N K, et al. Polyelectrolyte stabilized multilayered liposomes for oral delivery of paclitaxel[J].Biomaterials, 2012, 33(28)∶ 6758-6768. DOI∶10.1016/j.biomaterials.2012.05.026.
[23] MICHAEL K, PAULINE C. 脂质体的粒度及Zeta电位表征研究[J]. 上海化工, 2014, 39(11)∶ 34-35. DOI∶10.3969/j.issn.1004-017X.2014.11.010.
[24] 裴斐, 宋宏新, 张风龙, 等. 胸腺五肽脂质体的研制[J]. 中国药房,2011, 22(17)∶ 1595-1597.
[25] 杨斌. 胆固醇衍生物脂质体作为药物载体的研究[D]. 上海∶ 上海交通大学, 2012∶ 17.
[26] 蒲传奋, 唐文婷. 抗菌肽G-K脂质体的制备工艺优化及其抑菌性质[J].食品科学, 2017, 38(6)∶ 229-235. DOI∶10.7506/SPKX1002-6630-201706036.
[27] 张冕, 罗磊, 万芳. 胸腺五肽脂质体的处方及制备工艺研究[J]. 中国生化药物杂志, 2012, 33(4): 427-429.
[28] 范一文, 鲁群, 李地才, 等. 茶多酚脂质体的制备和物化性质研究[J]. 现代食品科技, 2011, 27(10)∶ 1187-1190. DOI∶10.3969/j.ssn.1673-9078.2011.10.004.
[29] HIANIK T, KÜPCÜ S, SLEYTR U B, et al. Interaction of crystalline bacterial cell surface proteins with lipid bilayers in liposomes. A sound velocity study[J]. Colloids & Surfaces A Physicochemical &Engineering Aspects, 1999, 147(3)∶ 331-339. DOI∶10.1016/S0927-7757(98)00665-7.
[30] 吴韶敏, 曹劲松. 脂质体技术应用于食品工业的最新研究进展[J]. 中国油脂, 2007, 32(3)∶ 43-44. DOI∶10.3321/j.issn∶1003-7969.2007.03.010.
Optimization of Preparation of Angiotensin Converting Enzyme (ACE) Inhibitory Peptide RLSFNP Liposomes
GUO Yuxing1, XUE Yiqiu1, JIANG Xiaoxiao1, WU Zhen2, ZENG Xiaoqun2, SUN Yangying2, PAN Daodong1,2,*
(1. Jinling College, Nanjing Normal University, Nanjing 210097, China;2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2017)20-0139-07
引文格式:
郭宇星, 薛逸秋, 姜潇潇, 等. 血管紧张素转换酶抑制肽RLSFNP脂质体的制备工艺优化[J]. 食品科学, 2017, 38(20)∶139-145. DOI∶10.7506/spkx1002-6630-201720020. http∶//www.spkx.net.cn
GUO Yuxing, XUE Yiqiu, JIANG Xiaoxiao, et al. Optimization of preparation of angiotensin converting enzyme (ACE)inhibitory peptide RLSFNP liposomes[J]. Food Science, 2017, 38(20)∶ 139-145. (in Chinese with English abstract)DOI∶10.7506/spkx1002-6630-201720020. http∶//www.spkx.net.cn
收稿日期:2016-12-07
基金项目:国家自然科学基金面上项目(31571852;31471598;31671869;31601487);江苏省自然科学基金项目(BK20151544);
2017年江苏省第五期 “333工程”培养资金资助项目(BRA2017450)
作者简介:郭宇星(1981—),女,副教授,博士,主要从事乳品功能因子开发研究。E-mail:guoyuxing1981@163.com
*通信作者:潘道东(1964—),男,教授,博士,主要从事畜产品加工研究。E-mail:daodongpan@163.com