
郑 雯,王 远,袁田青,蔡珺珺,宫兴文*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
摘 要:为增加植物甾醇(phytosterol,PS)的水溶性,拓宽其在食品领域中的应用,本研究采用羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)对植物甾醇进行包合,达到增大其水溶性的目的。采用差热扫描分析、傅里叶红外光谱和X射线衍射对包合后的产物进行检测。同时,采用单因素和响应面试验对包合工艺进行优化,得到最佳包合工艺为HP-β-CD与PS物质的量比4.27∶1、包合温度47 ℃、包合时间11.93 h,得到的包合率为96.57%。考虑到实际操作的便利,将其修正为:HP-β-CD与PS物质的量比4.30∶1、包合温度47 ℃、包合时间12 h,并在此修正条件下进行3 次平行实验,其平均包合率为97.25%。结果表明在包合状态下,经改造后的PS在 37 ℃水中的溶解度得到了大幅度提高,达到了8.31 mg/mL,是其原来(0.027 mg/mL)的307.90 倍。
关键词:植物甾醇;羟丙基-β-环糊精;包合;溶解度
Abstract: In this study, phytosterol (PS) was included with hydroxypropyl-β-cyclodextrin (HP-β-CD) to improve its solubility and thereby broaden the range of its application in the food industry. The inclusion complex was tested by differential scanning calorimetry (DSC), Fourier transform infrared (FT-IR) spectroscopy and X-ray diffraction. The inclusion process was optimized using response surface methodology. The optimum conditions obtained were as follows:molar ratio between PS and HP-β-CD, 4.27:1; temperature, 47 ℃; and inclusion time, 11.93 h, yielding an inclusion rate of 96.57%. However, to improve operating convenience, these parameters were modified as 4.30:1, 47 ℃, and 12 h,respectively. Triplicate experiments carried out under these conditions gave an average inclusion rate of up to 97.25%. At 37 ℃, the water solubility of HP-β-CD/PS clathrate reached an average of 8.31 mg/mL, which was 307.90 times of its original solubility (0.027 mg/mL).
Key words: phytosterol; hydroxypropyl-β-cyclodextrin; inclusion; solubility
随着人们生活水平的不断提高,高脂肪和高能量膳食的大量摄入,使得患肥胖症和高脂血症的人越来越多,所以开发出一款安全、无毒的天然降血脂药物具有非常重要的现实意义。植物甾醇(phytosterol,PS)属于天然活性物质,其以环戊烷全氢菲为骨架,可以降低血清中总胆固醇的含量与低密度脂蛋白胆固醇水平,在食品、化妆品、医药等领域有着广泛的用途[1],具有非常好的市场前景。但是植物甾醇的水不溶性限制了它在食品工业中的应用,因此,开发出水溶性植物甾醇,解决其水溶性问题,不仅使患肥胖症和高脂血症的人群受益,而且还可以促进相关功能性食品等行业的发展。对于植物甾醇的安全性,2000年9月,美国食品与医药管理局批准添加了植物甾醇和植物甾醇酯的食品可以使用“有益健康”的标签[2],规定推荐摄入量为每天至少摄入3.40 g植物甾烷醇或1.30 g植物甾醇酯,并且 业界人士普遍建议对于植物甾醇的摄入每天不要超过2.00 g。
近些年,已有人利用化学改性的方法来提高植物甾醇的水溶性,但是采用环糊精包合的方式却鲜有报道,而环糊精被应用于包合黄酮类药用物质已有多年的历史[3],因而通过环糊精包合植物甾醇改善其水溶性也同样具有实际的意义,当包合样品进入人体后,在消化的过程中外面的环糊精结构就会被破坏,进而释放出植物甾醇,因此当把包合物添加到一些功能性食品比如饮料中时,可以很好地起到抑制人体对胆固醇吸收的作用。
羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)是一种优良的药用辅料,不仅水溶性好,而且无毒无害,对碱、光和热稳定,是一种非常好的包合材料[4],本研究依据HP-β-CD增溶难溶性药物的成功范例[5-6],利用HP-β-CD包合PS,其非极性空腔为甾醇的非极性碳链部分提供很好的包裹空间,进而甾醇自身固有的羟基基团部分暴露在外端,和环糊精本身所具有的羟基共同增加了整体的亲水特性[7],从而改善了甾醇在水中的溶解性。
1.1 材料与试剂
植物甾醇(质量分数>95%,主要成分豆甾醇)合肥博美生物科技有限责任公司;HP-β-CD(质量分数>98%) 萨恩化学技术(上海)有限公司。
二氯甲烷、甲醇、无水乙醇 天津市永大化学试剂有限公司;氯仿、浓硫酸、浓磷酸 上海凌峰化学试剂有限公司;FeCl3·6H2O 上海展云化工有限公司;以上试剂均为分析纯。1.2 仪器与设备
旋转蒸发仪 上海知信实验仪器技术有限公司;85-2恒温磁力搅拌器 杭州惠创仪器设备有限公司;UV-2550紫外-可见分光光度计 上海精密科学仪器有限公司;差热分析仪 岛津国际贸易(上海)有限公司;D8 Advance型X-射线衍射仪 日立高新技术有限公司;Nexus傅里叶变换红外光谱仪 美国Thermo Nicolet公司。
1.3 方法
1.3.1 样品制备
PS与HP-β-CD物理混合样品的制备:准确称取一定质量的PS和HP-β-CD,并配制物质的量比为1∶4的样品,放在研钵中混合研磨均匀,然后放在干燥器中作为对照品备用。
HP-β-CD/PS包合物的制备:配制PS和HP-β-CD物质的量比为1∶4的样品,分别用二氯甲烷和甲醇完全溶解,将各自溶解好的样品混合均匀,放在恒温磁力搅拌器中,以中档的搅拌速度搅拌,设置温度为45 ℃,反应12 h后,取下样品,进行旋转蒸发,待蒸发到固体状态时放在干燥器中干燥得到HP-β-CD/PS包合物。
1.3.2 HP-β-CD/PS包合物的检测
差热扫描(differential scanning calorimetry,DSC)[8]分析:分别称量PS、HP-β-CD、PS与HP-β-CD物理混合物和HP-β-CD/PS包合物样品3.00~5.00 mg放入铝质坩埚中进行压片密封,进行分别测定,其条件为N2流速40.00 mL/min,以10 ℃/min的升温速率在30~300 ℃条件下测定样品的热性质。
X射线衍射(X-ray diffractomer,XRD)[9]分析:分别取PS、HP-β-CD、PS与HP-β-CD物理混合物以及HP-β-CD/PS包合物样品,使用XRD进行样品分析,衍射角度范围0°~180°。
傅里叶红外光谱(fourier transform infrared spectroscopy,FT-IR)[10]分析:分别取PS、HP-β-CD、PS与HP-β-CD物理混合物以及HP-β-CD/PS包合物样品,以KBr压片技术,FT-IR进行扫描。仪器参数:分辨率为4 cm-1,扫描次数为32。
1.3.3 HP-β-CD/PS包合物中PS的含量及包合率的测定
1.3.3.1 HP-β-CD/PS包合物中PS含量的测定
HP-β-CD/PS包合物中PS含量的测定采取硫磷铁法[11-12],其原理是当PS在三价铁和浓硫酸共同作用的条件下会产生一种呈紫色、较稳定的化合物,而且这种紫色化合物在520~550 nm的波长下会显现出特征吸收峰,其中吸光度与PS的含量成正比,所以考虑用分光光度计对包合物中PS的含量进行测定。具体操作如下:
铁贮存液配制:精确称取FeCl3·6H2O 2.50 g加入质量分数85%的浓磷酸,并定容至100 mL,得到铁贮存液,贮存于棕色瓶中,在室温可长期保存。
硫磷铁显色剂配制:量取上述配好的铁贮存液8 mL,用浓硫酸将其定容至100 mL。
最大吸收波长的确定:精确称取PS 2.50 mg,加入无水乙醇使其溶解并定容至25 mL。移取5 mL于10 mL具塞刻度试管中,然后沿管壁缓缓加入硫磷铁显色剂5 mL,振摇30 次使其混匀,冷却至室温,以无水乙醇+硫磷铁显色剂为空白,于350~750 nm波长范围内扫描,确定其最大吸收波长。
PS标准曲线的绘制:分别准确量取0、1、2、3、4、5 mL的0.10 mg/mL PS溶液置于10 mL具塞刻度试管中,各加入无水乙醇5、4、3、2、1、0 mL,然后在每支试管中各加入5 mL硫磷铁显色剂,摇匀,冷却至室温,于最大吸收波长处测定吸光度。横坐标为各管样品的浓度,纵坐标为对应的吸光度,以此来绘制PS溶液的标准曲线。
1.3.3.2 PS包合率的测定
以PS的包合率和包合效率作为指标考察HP-β-CD/PS包合物的包合效果,计算如式(1)~(3)所示:

1.3.4 HP-β-CD/PS包合工艺的优化
1.3.4.1 物质的量比对包合效果的影响
改变HP-β-CD与PS物质的量比,固定包合温度为45 ℃,包合溶剂分别用甲醇与二氯甲烷溶解,包合时间为12 h,以包合率和包合效率为指标,考察HP-β-CD与PS物质的量比分别为2∶1、3∶1、4∶1、5∶1和6∶1时的包合效果,确定最佳包合效果的物质的量比。
1.3.4.2 溶剂对包合效果的影响
考虑到本实验的包合方法是HP-β-CD与PS各自用合适的有机溶剂溶解,之后再混合,混合后的两种溶剂不能分层,所以PS考虑用二氯甲烷或三氯甲烷,HP-β-CD用甲醇或乙醇。固定物质的量比为4∶1,包合温度为45 ℃,包合时间为12 h,以HP-β-CD/PS的包合率与包合效率作为指标,筛选一组较为合适的溶剂。
1.3.4.3 包合温度对包合效果的影响
选用上述实验得出的优化条件下的物质的量比和筛选出的较好的包合效果的一组溶剂,包合时间为12 h,控制反应温度变量,考察包合温度分别为30、35、40、45、50、55、60 ℃对HP-β-CD/PS包合效果的影响。
1.3.4.4 包合时间对包合效果的影响
选用之前实验得出的优化条件下的物质的量比和温度以及筛选出的较好的包合效果的一组溶剂,改变包合时间,设置6、8、10、12、14 h 5 个因素水平,考察不同的反应时间对包合效果的影响。
1.3.5 HP-β-CD与PS包合的响应面试验
在单因素试验的基础上根据Box-Behnken试验的设计原理采用三因素三水平响应面法优化[13-14]HP-β-CD包合PS的包合条件,以包合率为评价指标,试验因素和水平见表1。
表1 响应面试验设计因素与水平
Table 1 Coded levels of independent variables used in response surface analysis

1.3.6 HP-β-CD/PS包合物水中溶解度的测定
称取过量的PS、HP-β-CD/PS物理混合 物以及包合样品分别置于10 mL的容量瓶中,加水配制成过饱和溶液,旋涡混合5 min后于3 7 ℃的摇床中振荡平衡24 h。取出一部分溶液以0.45 μm的水膜过滤,精密吸取0.50 mL过滤后的溶液,用纯净水稀释到适当倍数后,置于10 mL的容量瓶中,在548 nm波长处测定吸光度,将其代入PS溶液标准曲线方程,计算PS、HP-β-CD/PS物理混合物以及包合样品在水中的溶解度。
2.1 最大吸收波长的确定
波长扫描见图1,确定植物甾醇的最大吸收波长为548 nm。
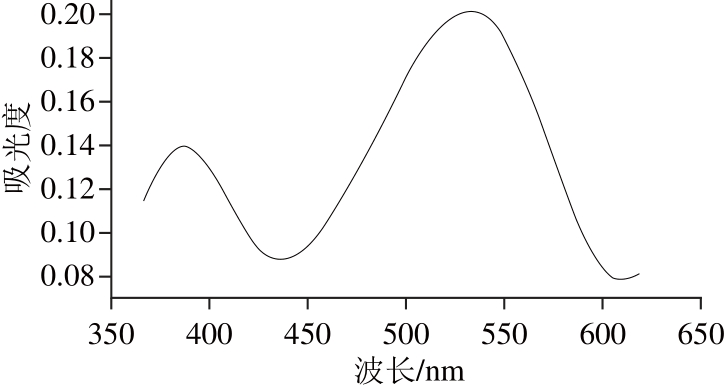
图1 植物甾醇波长扫描
Fig. 1 Visible absorption spectrum of phytosterol
2.2 植物甾醇溶液标准曲线的绘制
以植物甾醇溶液质量浓度(mg/mL)为横坐标,548 nm波长处的吸光度为纵坐标绘制标准曲线。植物甾醇标准曲线的线性拟合方程为Y=1.234 86X+0.023 29,相关系数R2为0.994 23。
2.3 HP-β-CD/PS包合物的验证
2.3.1 DSC验证实验
由图2可知,PS在140 ℃显示了一个强的吸热峰,而HP-β-CD属于无定型粉末,在50~110 ℃有吸热峰,可能是由HP-β-CD脱水作用引起的[15],而HP-β-CD/PS物理混合物的图谱,既显示了PS的吸热峰,又出现HP-β-CD的吸热峰,但峰值和单纯的PS和HP-β-CD的峰值不同,可能是因为在物理混合物中存在着两者之间物理相互作用的影响,说明了物理混合物并不起包合作用。而HP-β-CD/PS包合物的图谱表明在实验温度范围内并没有任何尖锐的峰值出现,证实了包合物的形成,因为在包合物中PS是以无定形状态分散在HP-β-CD中,从而使得它们原有的吸热峰消失[16]。
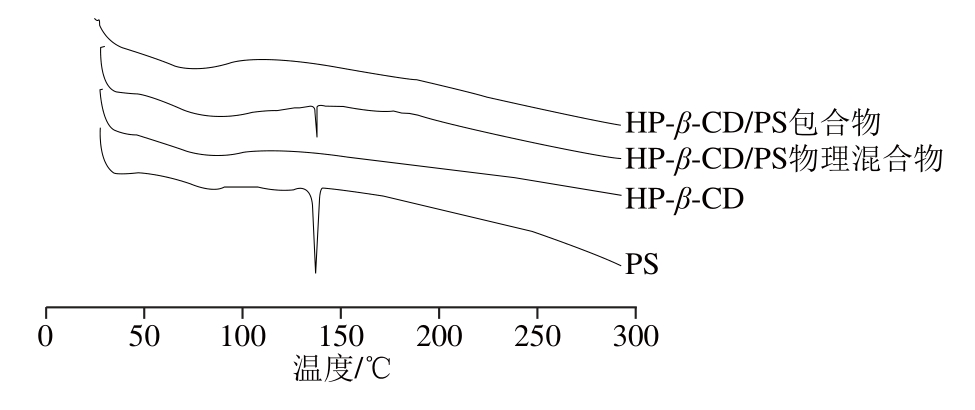
图2 HP-β-CD、PS、物理混合物及包合物的DDSSCC图谱
Fig. 2 DSC spectra of HP-β-CD, PS, HP-β-CD mixture and HP-β-CD/PS inclusion complex
2.3.2 XRD验证实验
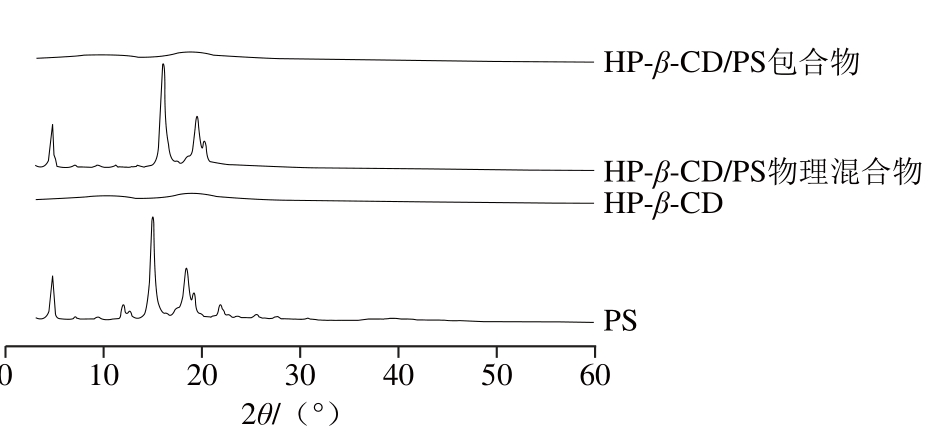
图3 XRD图谱
Fig. 3 XRD graphs of samples
为了进一步验证HP-β-CD/PS包合物的形成,进行了XRD分析。图3中PS出现了强而尖的衍射峰,HP-β-CD则没有任何的晶型峰,表现为弥散衍射峰,表明它是一种无定型的粉末,这与DSC分析的结果相吻合。由HP-β-CD/PS物理混合物的XRD图谱可知,PS在5°~25°处的强衍射峰依然存在,并且图谱是PS与HP-β-CD双重衍射峰的一个叠加[17],因为HP-β-CD的无定形使得混合物峰的强度有所下降。然而在HP-β-CD/PS包合物的XRD图谱中没有显示任何尖锐的峰值,表现为弥散衍射峰,这是因为PS被HP-β-CD包合后,其自身的特征消失,形成了新的无定形物质,和单纯的主客体结构相比有着明显的不同,也因此表明了包合物的成功形成[18]。
2.3.3 FT-IR验证实验
图4结果表明,在包合物中,PS在2 900 cm-1与1 500 cm-1的吸收峰均消失[19],在物理混合物中PS的这些特征吸收峰却表现很突出,而在包合物中并未显现,说明物理混合物并没有起到包合的作用,而且包合物的吸收峰与HP-β-CD的吸收峰大体相同,可以表明HP-β-CD可以识别PS,验证了包合物的形成[20]。
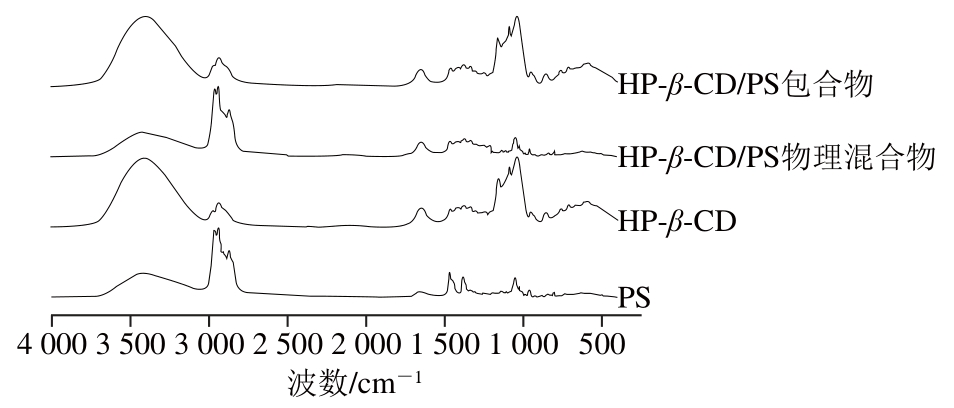
图4 FT-IR图
Fig. 4 FT-IR spectra of samples
2.4 HP-β-CD/PS包合工艺优化
2.4.1 HP-β-CD与PS物质的量比对包合效果的影响

图5 HHPP--β-CD与PS的物质的量比对包合效果的影响
Fig. 5 Effect of molar ratio of HP-β-CD to PS on the inclusion effi ciency of PS
从图5可知,在一定范围内,无论是包合率还是包合效率,都随着HP-β-CD与PS物质的量比的增大而增大。但超过了一定的物质的量比,包合率和包合效率都有所下降,原因可能在于当HP-β-CD超过一定量后,分子的运动性受阻不利于PS的包合。HP-β-CD与PS不同的物质的量比对包合效率的影响不大,差异很小,而当两者的物质的量比为4∶1时包合率最大,因此确定HP-β-CD与PS物质的量比为4∶1。
2.4.2 包合溶剂对包合效果的影响

图6 包合溶剂对HHPP--β--CCDD/PS包合效果的影响
Fig. 6 Infl uence of inclusion solvents on the inclusion effi ciency of HP-β-CD/PS
如图6所示,当二氯甲烷与甲醇组合即PS用二氯甲烷溶解、HP-β-CD用甲醇溶解时,其包合率和包合效率都是最高的,因此确定选用溶剂为二氯甲烷和甲醇。
2.4.3 包合温度对包合效果的影响
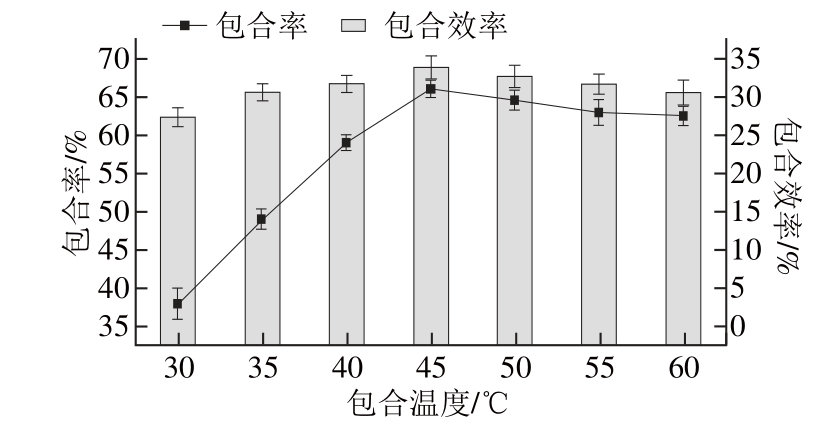
图7 包合温度对HHPP--β--CCDD/PS包合效果的影响
Fig. 7 Effect of temperature on the inclusion effi ciency of HP-β-CD/PS
由图7可知,随着温度的升高,包合率和包合效率都呈上升趋势,在45 ℃时包合率和包合效率均为最高,但当温度超过45 ℃,包合率和包合效率都趋于平缓,甚至下降,原因可能因为在包合的过程中,低温度时分子运动不够剧烈,HP-β-CD与PS的碰撞机会小,而当温度过高时分子的运动过于强烈而使PS不易被包合[21]。在整个过程中温度对包合效率的影响并不大,包合效率之间的差值很小。因此确定包合温度为45 ℃。
2.4.4 包合时间对包合效果的影响
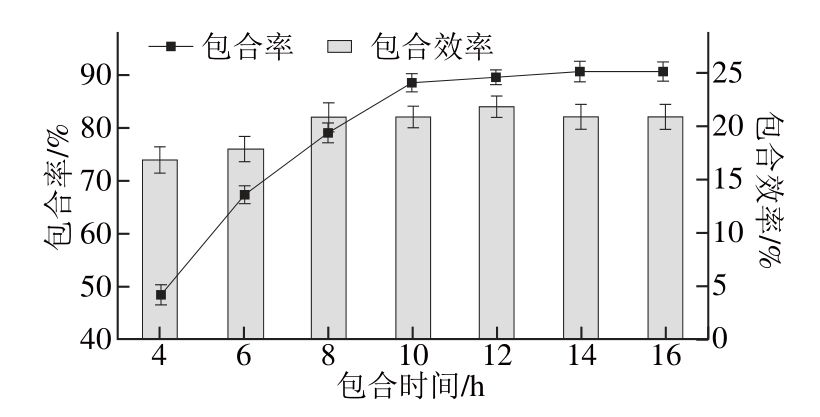
图8 包合时间对HHPP--β--CCDD/PS包合效果的影响
Fig. 8 Infl uence of reaction time on the inclusion effi ciency of HP-β-CD/PS
由图8可知,随着包合时间的延长,包合率逐渐增大,达到一定值后趋于平稳,虽然包合效率也呈现增加的趋势,但是整体看来,包合效率的差异并不大,因此主要考虑包合率。当包合时间超过12 h,包合率几乎不再增大,因此确定包合时间为12 h。
2.5 HP-β-CD与PS包合的响应面试验结果
2.5.1 构建模型及显著性分析检验
根据响应面试验设计[22-23],试验结果见表2,由Design-Expert V8.0.6.1软件处理得到的回归模型的方差分析及显著性检验见表3。
利用统计分析软件得出的HP-β-CD与PS物质的量比、包合温度、包合时间之间的二次多项回归模型方程如下:
由表3的方差分析可知,该数学模型P值小于0.000 1,说明该模型极其显著。失拟项P值大于0.05,表明不显著,即该数学模型在被分析的整个回归区域内拟合较好。该方程的多元相关系数R2为0.989 6,说明试验操作是可行的。因此,回归方程可以较好地描述各因素与响应值(包合率)之间的真实关系,可以利用该回归方程找出HP-β-CD包合PS的最优条件。
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
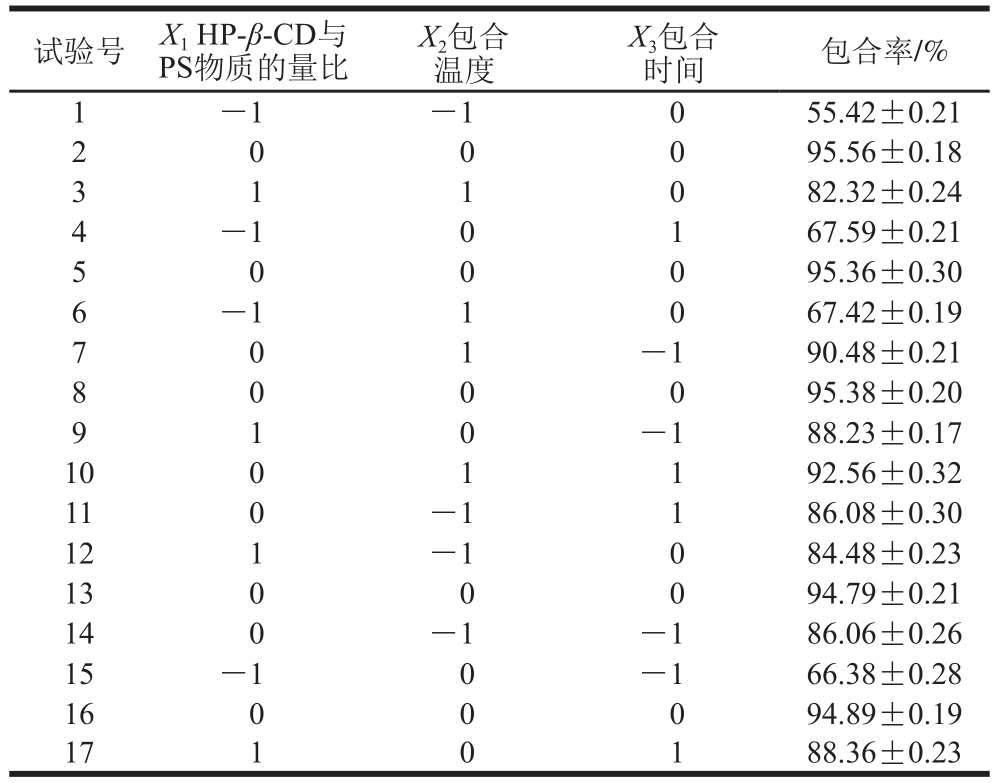
表3 回归模型的方差分析及显著性检验
Table 3 Analysis of variance and signifi cance test of the regression mooddeell
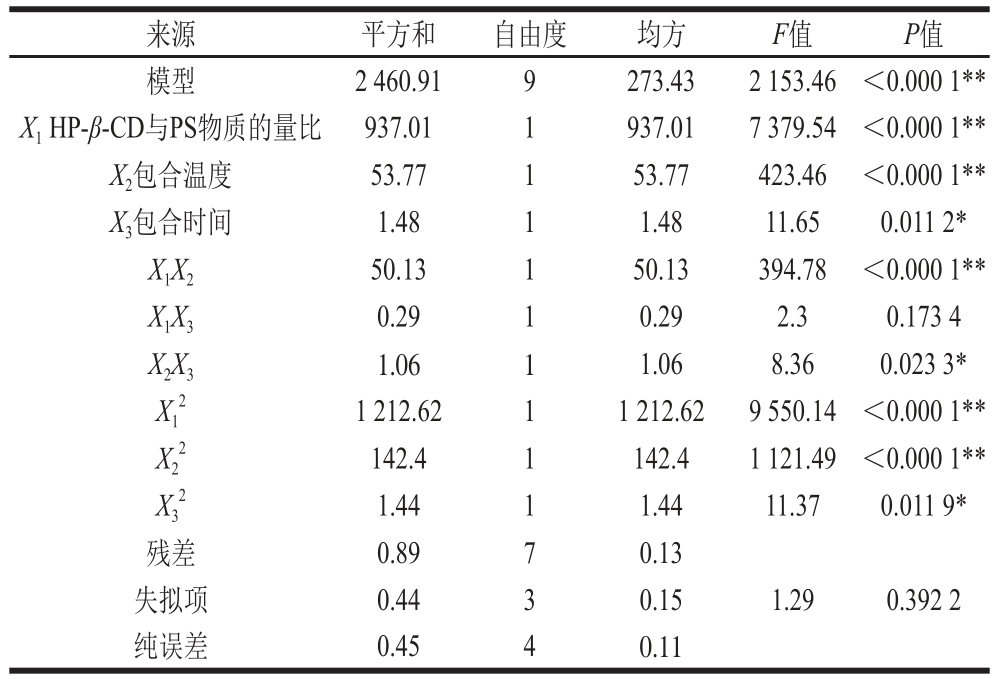
注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。
2.5.2 包合工艺的响应面分析与优化
用Design-Expert V8.0.6.1软件,依据回归方程式得出响应面和等高线图[24-25]。
图9a显示包合时间为11 h时,HP-β-CD与PS物质的量比和包合温度对包合率的影响。HP-β-CD与PS 物质的量比较低时(如2∶1),包合率随温度的升高而增大,但随物质的量比的增加,包合率呈现先增大后减小的趋势。同理,在包合温度较低的时候(如30 ℃),包合率随物质的量比的增大而增大,但达到一定温度后,包合率又开始下降。从响应面3D图和等高线图可以看出,在最小椭圆里存在极大值。
图9b显示包合温度为45 ℃时,HP-β-CD与PS物质的量比和包合时间对包合率的影响。包合初始,包合率随HP-β-CD与PS物质的量比的增大而增大,但当时间达到一定值后,包合率又开始下降。同样,当HP-β-CD与PS物质的量比较低时,包合率随包合时间的延长而增大,但随物质的量比的增加,包合率开始下降,但是下降的速率小于HP-β-CD与PS物质的量比较低时的速率。原因可能是在物质的量比较高时,分子运动受阻,阻碍了包合过程的进行。
图9c显示HP-β-CD与PS物质的量比为4∶1时,包合温度和包合时间对包合率的影响。不同包合温度下,包合率均随包合时间的延长呈先增大后减小的趋势;不同包合时间的情况下,随包合温度的升高,包合率也是同样的出现先增大后减小的趋势。且在响应面图的最高点和椭圆中心处存在极大值。

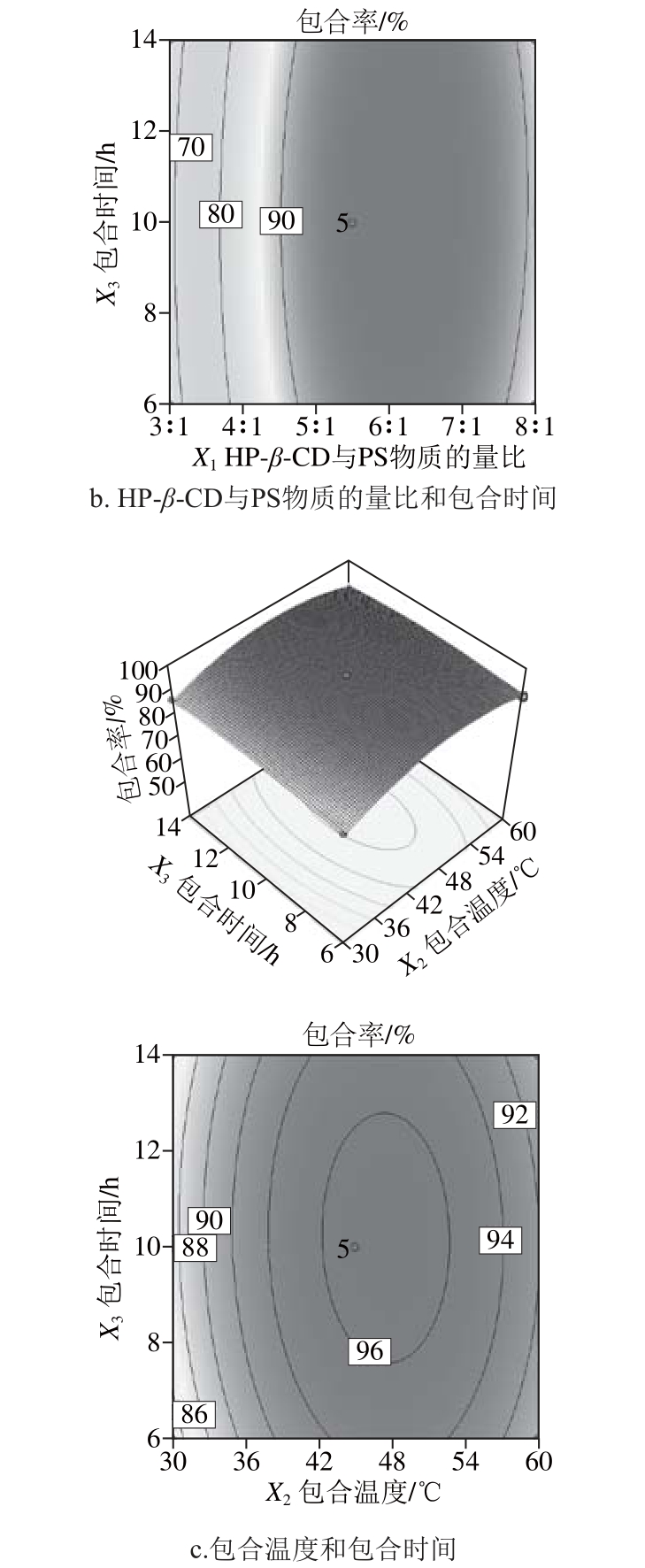
图9 各因素交互作用对包合率影响的响应面图
Fig. 9 Respo nse surface and contour plots showing the interactive effect of factors on inclusion rate
2.6 HP-β-CD与PS包合工艺条件的确定
在选取的各因素范围内,由Design-Expert V8.0.6.1软件分析可以得到,包合工艺的最佳包合条件为HP-β-CD与PS物质的量比4.27∶1、包合温度47 ℃、包合时间11.93 h,得到的包合率为96.57%。但考虑到实际操作的便利,将包合工艺的工艺条件修正为:HP-β-CD与PS物质的量比4.30∶1、包合温度47 ℃、包合时间12 h。在此修正条件下,重复3 次实验,得到包合工艺的平均包合率为97.25%,与预测值96.57%基本一致,实际测定值比理论预测值高0.68%,说明该数学模型能很好的预测各因素同包合率之间的关系。
2.7 PS水中溶解度的测定结果
按1.3.6节所描述方法把测得的数据代入标准曲线方程[26-27],经计算得到PS、HP-β-CD/PS物理混合物和HP-β-CD/PS包合物中,PS在37 ℃水中的溶解度,见表4。
表4 37 ℃条件下各样品PS在水中的溶解度
Table 4 Water solubility of PS, its physical mixture and inclusion complex with HP-β-CD at 37 ℃
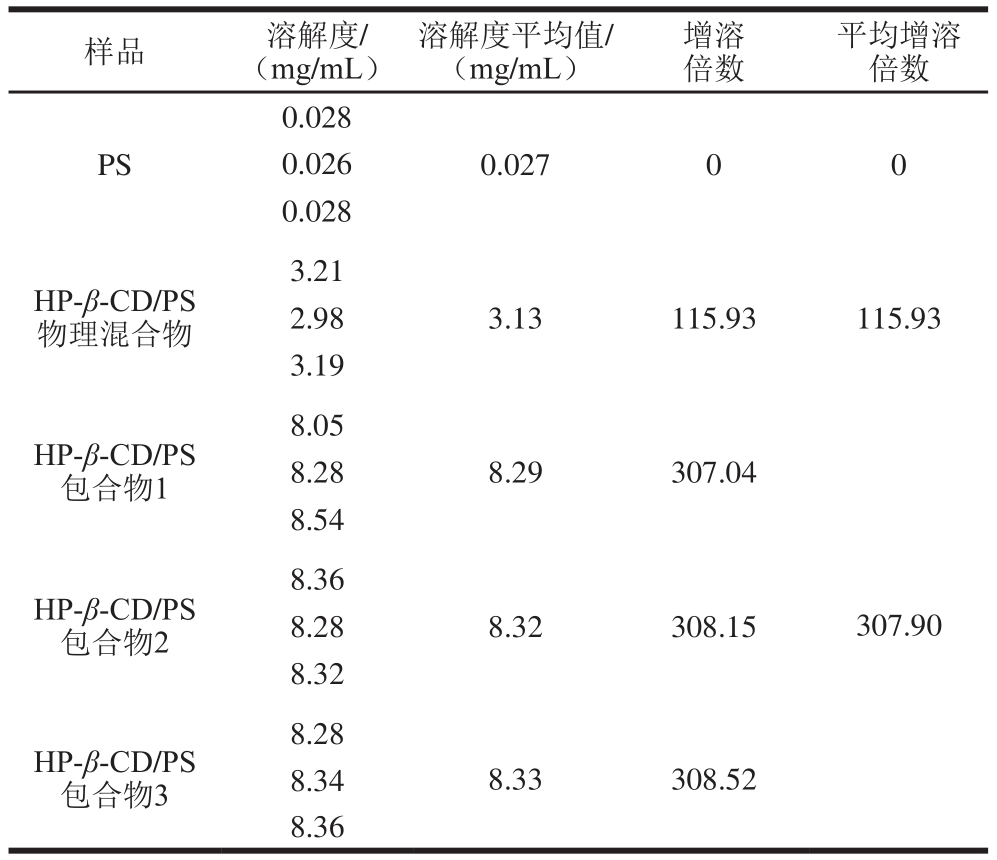
由表4可知,物理混合物和包合物样品中PS在水中的溶解度都有所改善,但是改善的程度并不相同,相比包合物来讲,物理混合物改善的并不明显[28],而包合物中PS溶解度是原来PS在水中溶解度的300多倍,也证明了本实验方法的可靠性,当包合反应发生后,因为HP-β-CD的空腔外部为亲水性的羟基,间接地提高了PS在水中的溶解性,因此当PS被包合以后,其水溶性得到了显著的提高[29-30]。
本研究通过HP-β-CD包合PS,并采用DSC、XRD和FT-IR对得到的 包合物进行分析鉴定,证实了包合物的存在;单因素试验得到各个因素的最佳添加量,并根据Box-Behnken试验设计原理,在单因素试验的基础上采用三因素三水平响应面法优化HP-β-CD包合PS条件,确定最佳包合工艺为HP-β-CD与PS物质的量比4.27∶1、包合温度47 ℃、包合时间11.93 h,得到的包合率为96.57%。但考虑到实际操作的便利,将包合工艺的工艺条件修正为:HP-β-CD与PS物质的量比4.30∶1、包合温度47 ℃、包合时间12 h。在此修正条件下,重复3 次实验,得到包合工艺的平均包合率为97.25%;最后测定了PS、HP-β-CD/PS物理混合物、HP-β-CD/PS包合物在37 ℃条件下在相同体积水中的溶解度,结果表明在包合状态下,PS的水溶性得到大幅度的提高,水溶性平均值达到8.31 mg/mL,是其原来(0.027 mg/mL)的307.90 倍。
参考文献:
[1] PHI LLIPS K M, RUGGIO D M, ASHRAF-KHORASSANI M.Phytosterol composition of nuts and seeds commonly consumed in the United States[J]. Journal of Agricultural and Food Chemistry, 2005,53(24): 9436-9445. DOI:10.1021/jf051505h.
[2] 吕晓玲, 温娟, 陶东川, 等. 植物甾醇及其环糊精包合物对高血脂小鼠降血脂实验研究[J]. 食品工业科技, 2011, 32(9): 393-395.DOI:10.13386/j.issn1002-0306.2011.09.010.
[3] YUE M E, JIANG T F, SHI Y P. Fast determination of fl avonoids in Hippophae rhamnoides and its medicinal preparation by capillary zone electrophoresis using dimethyl-beta-cyclodextrin as modifi er[J].Talanta, 2004, 62(4): 695-69 9. DOI:10.1016/j.talanta.2003.09.024.
[4] 陈鑫涛, 王罗新, 蔡静平, 等. 环糊精在聚合反应中的应用研究进展[J]. 天津工业大学学报, 2010, 29(6): 54-57. DOI:10.3969/J.ISSN.1671-024X.2010.06.015.
[5] SCHUCHERT A, MUTO C, MAOUNIS T, et al. Lead complications,device infections, and clinical outcomes in the first year after implantation of cardiac resynchronization therapy-defibrillator and cardiac resynchronization therapy-pacemaker[J]. EP Europace, 2013,15(1): 71-76. DOI:10.1093/europace/eus247.
[6] CENSI R, GIGLIOBIANCO M R, DUBBINI A, et al. New nanometric solid dispersions of glibenclamide in neusilin® UFL2[J]. Aaps Pharmscitech, 2016, 17(5): 1-9. DOI:10.1208/s12249-015-0457-z.
[7] DI C M, STEIN P C, SKALKOBASNET N, et al. Solubilization of ibuprofen with β-cyclodextrin derivatives:energetic and structural studies[J]. Journal of Pharmaceutical & Biomedical Analysis, 2011,55(3): 446-451. DOI:10.1016/J.JPBA.2011.02.022.
[8] SZENTE L, SZEJTLI J. Cyclodextrins as food ingredients[J].Trends in Food Science and Technology, 2004, 15(3/4): 137-142.DOI:10.1016/J.TIFS.2003.09.019.
[9] REKHARSKY M V, INO UE Y. Thermodynamics of cucurbituril complexation in aqueous solutions[J]. Netsu Sokutei, 2007, 34(5):232-243. DOI:10.11311/JSCTA1974.34.232.
[10] 雍国平, 李光水. β-环糊精包合物的结构研究[J]. 高等学校化学学报,2000, 21(7): 1124-1126. DOI:10.3321/J.ISSN:0251-0790.2000.07.040.
[11] 宋占军, 刘炳玉, 钱小红, 等. 应用光谱分析技术研究碘与β-环糊精结合物的结构特征[J]. 光谱学与光谱分析, 2001, 21(5): 603-606.DOI:10.3321/J.ISSN:1000-0593.2001.05.008.
[12] LI N, ZHANG Y H, WU Y N, et al. Inclusion complex of trimethoprim with β-cyclodextrin[J]. Journal of Pharmaceutical& Biomedical Analysis, 2005, 39(3/4): 824-829. DOI:10.1016/j.jpba.2005.05.011.
[13] 余德顺. β-环糊精包埋技术及研究进展[J]. 重庆理工大学学报(自然科学版), 2010, 24(11): 44-49. DOI:10.3969/j.issn.1674-8425-B.2010.11.009.
[14] GEBREMARIAM M M, ZARNKOW M, BECKER T. Effect of drying temperature and time on alpha-amylase, beta-amylase, limit dextrinase activities and dimethyl sulphide level of teff (Eragrostis tef)malt[J]. Food and Bioprocess Technology, 2013, 6(12): 3462-3472.DOI:10.1007/s11947-012-1025-0.
[15] LOFTSSON T, BREWSTER M E. Pharmaceutical applications of cyclodextrins: effects on drug permeation through biological membranes[J]. Journal of Pharmacy and Pharmacology, 2011, 63(9):1119-1135. DOI:10.1111/j.2042-7158.2011.01279.x.
[16] BETTINETTI G P, SORRENTI M S, FERRARI F, et al.Assessment of solid-state interactions of naproxen with amorphous cyclodextrin derivativ es by DSC[J]. Journal of Pharmaceutical &Biomedical Analysis, 2002, 30(4): 1173-1179. DOI:10.1016/S0731-7085(02)00421-1.
[17] ROCHA B A, RODRIGUES M R, BUENO P C P, et al. Preparation and thermal characterization of inclusion complex of Brazilian green propolis and hydroxyprop yl-β-cyclodextrin[J]. Journal of Thermal Analysis and Calorimetry, 2012, 108(1): 87-94. DOI:10.1007/s10973-011-1713-4.
[18] 张境, 刘万毅, 张霞. β-环糊精-苯甲酰二茂铁缩氨基硫脲包合物特征及微环境效应研究[J]. 光谱学与光谱分析, 2006, 26(3): 517-521.DOI:10.3321/J.ISSN:1000-0593.2005.10.009.
[19] AMMAR H O, SALAMA H A, GHORAB M, et al. Formulation and biological evaluation of glimepiride-cyclodextrin-polymer systems[J].International Journal of Pharmaceutics, 2006, 309(1/2)∶ 129-138.DOI∶10.1016/j.ijpharm.2005.11.024.
[20] LI W, LU B, SHENG A , et al. Spectroscopic and theoretical study on inclusion complexation of beta-cyclodextrin with permethrin[J].Journal of Molecular Structure, 2010, 981(1/2/3): 194-203.DOI:10.1016/j.molstruc.2010.08.008.
[21] 周阳. 植物甾烷醇油溶性及水溶性的改性研究[D]. 无锡: 江南大学,2013: 34-35.
[22] PARLAK O, ZORBA O, KURT S. Modelling with response surface methodology of the effects of egg yolk, egg white and sodium carbonate on some textural properties of beef patties[J]. Journal of Food Science & Technology, 2014, 51(4): 780-784.
[23] YU Z J, FISHER K C, WHEELWRIGHT B M, et al. PVMirror: a new concept for tandem solar cells and hybrid solar converters[J].Photovoltaics IEEE Journal of Photovoltaics, 2015, 5(6): 1791-1799.DOI:10.1109/JPHOTOV.2015.2458571.
[24] GERUO A, WAHR J, ZHONG S. Computations of the viscoelastic response of a 3-D compressible earth to surface loading: an application to glacial isostatic, adjustment in Antarctica and Canada[J]. Geophysical Journal International, 2013, 192(2): 557-572.DOI:10.1093/gji/ggs030.
[25] GE Y, WEI B, WANG S, et al. Optimization of anthraquinone dyes decolorization conditions with response surface methodology by Aspergillus[J]. Korean Chemical Engineering Research, 2015, 53(3):327-332. DOI:10.9713/kcer.2015.53.3.327.
[26] 胡奕俊, 徐妍, 马超, 等. 联苯菊酯-β-环糊精包合物的制备及其光谱研究[J]. 农药学学报, 2010, 12(3): 92-96. DOI:10.3969/j.issn.1008-7303.2010.03.16.
[27] CHARUMANEE S, OKONOGI S, SIRITHUNYALUG J, et al.Effect of cyclodextrin types and co- solvent on solubility of a poorly water soluble drug[J]. Scientia Pharmaceutica, 2016, 84(4): 694-704.DOI:10.3390/scipharm84040694.
[28] 代金玲. 苯乙酮-β-环糊精包合物的制备及其紫外吸收光谱研究[J]. 科学技术与工程, 2011, 11(28): 6934-6935. DOI:10.3969/j.issn.1671-1815.2011.28.032.
[29] YUHSIN T, HSIEHHO T, WU C P, et al. Preparation, characterisation and activity of the inclusion complex of paeonol with β-cyclodextrin[J]. Food Chemistry, 2010, 120(3): 837-841. DOI:10.1016/j.foodchem.2009.11.024.
[30] BAI L, ZHAO Q, WANG J, et al. Mechanism study on pH-responsive cyclodextrin capped mesoporous silica: effect of different stalk densities and the type of cyclodextrin[J]. Nanotechnology, 2015,26(16): 165704. DOI:10.1088/0957-4484/26/16/165704.
Optimization of Preparation of Inclusion Complex of Phytosterol with Hydroxypropyl-β-Cyclodextrin for Improved Water Solubility by Response Surface Methdology
ZHENG Wen, WANG Yuan, YUAN Tianqing, CAI Junjun, GONG Xingwen*
(School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
DOI:10.7506/spkx1002-6630-201720023
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)20-0161-08
引文格式:
郑雯, 王远, 袁田青, 等. 响应面试验优化羟丙基-β-环糊精包合植物甾醇的水溶性改性工艺[J]. 食品科学, 2017, 38(20):
161-168.
DOI:10.7506/spkx1002-6630-201720023. http://www.spkx.net.cn
ZHENG Wen, WANG Yuan, YUAN Tianqing, et al. Optimization of preparation of inclusion complex of phytosterol with hydroxypropyl-β-cyclodextrin for improved water solubility by response surface methdology[J]. Food Science, 2017, 38(20)∶161-168. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720023. http∶//www.spkx.net.cn
收稿日期:2016-12-22
基金项目:浙江省自然科学基金项目(LY12C19011);食品科学与工程浙江省重中之重一级学科资助项目(JYTSP20141052)
作者简介:郑雯(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:zhengwen0412@163.com
*通信作者:宫兴文(1971—),男,副研究员,博士,研究方向为食品生物技术。E-mail:gongxingwen@163.com