李 荣,于 君,姜子涛*,黄 贤勇
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:在微波辅助的条件下,利用碱性蛋白酶和风味蛋白酶分步对紫苏饼粕蛋白进行水解,应用正交试验确定了最佳的酶解条件。通过Sephadex G-15凝胶层析、反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法和电子舌技术对酶解液成分与鲜味的变化进行了表征。结果表明,在微波功率400 W条件下,第1步碱性蛋白酶最佳酶解条件为酶添加量1 600 U/g、pH 10.0、 微波温度60 ℃、微波时间35 min;第2步风味蛋白酶的最佳酶解条件为酶添加量1 600 U/g、pH 6.5、微波温度65 ℃、微波时间40 min,分步酶解最终水解度为44.86%。最后通过凝胶层析、RP-HPLC与电子舌表征,证明微波辅助分步酶解法快速、高效,且与单独酶解所得产物相比,其产物鲜味改善明显。
关键词:分步酶解;微波;凝胶层析;RP-HPLC;电子舌;鲜味肽
Abstract: Umami peptide was prepa red by microwave-assisted sequential enzymatic hydrolysis of perilla seed meal prote in with alcalase followed by fl avorzyme. Optimization of the hydrolysis conditions was performed using an orthogonal array design. Sephadex G-15 gel permeation chromatography, reversed phase-high performance liquid chromatography (RP-HPLC)and electronic tongue were applied to characterize the changes in peptide composition and umami taste during the hydrolysis process. The results showed that the optimum conditions for alcalase hydrolysis were as follows∶ microwave power, 400 W;enzyme dosage, 1 600 U/g; pH, 10.0; temperature, 60 ℃; and hydrolysis time, 35 min, and the optimum conditions for fl avorzyme hydrolysis were as follows∶ enzyme dosage, 1 600 U/g; pH, 6.5; temperature, 65 ℃; and hydrolysis time, 40 min.A degree of hydrolysis of 44.86% was obtained under the optimized conditions. Compared with single enzymatic hydrolysis,the microwave-assisted stepwise enzymatic hydrolysis was quicker and more effi cient and show ed improved taste.
Key words: step-wise enzymatic hydrolysis; microwave; gel permeation chromatography; RP-HPLC; electronic tongue;umami peptide
DOI∶10.7506/spkx1002-6630-201720024
肽作为蛋白质的水解产物,不仅具有与蛋白质几乎一致的氨基酸组成,而且更容易被人体消化吸收,同时还具有良好的加工特性、营养功能和生理活性,在食品的呈味中具有重要作用。鲜味肽亦称为风味提升肽,是一类补充或增强食品原有风味的呈味肽类物质。鲜味肽具有增强鲜味或产生鲜味的作用[1],且不影响食品的其他味觉(酸、甜、苦、咸),因此在各种蔬菜、肉类、乳类、水产类乃至酒类增味方面都有良好的效果[2]。蛋白经酶水解得到的水解产物是由多种肽类化合物(或氨基酸)构成的混合物,利用凝胶体积 排阻色谱的原理,可以将待分离的混合肽溶液按相对分子质量大小筛分开[3-5]。由于肽的滋味主要与肽链长度、氨基酸的组成与顺序有关[6-7],因此利用凝胶色谱层析不仅能够表征酶解前后分子质量大小的变化,还能够分离纯化混合肽,如Su Guowan等[8]将花生蛋白水解后产生的肽通过凝胶层析后,使用反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法与基质辅助激光解吸电离飞行时间质谱鉴定出一个鲜味肽和一个鲜味增强肽。Zhang Meixiu等[9]从河豚鱼(暗纹东方鲀)的肉中提取了风味肽。Toelstede等[10]发现含有谷氨酸片段的呈味肽成分使豪达奶酪的口味更具有奶酪的浓厚感。Aristoy等[11]的研究表明,一些小分子肽具有一 定的鲜味。
紫苏饼粕是紫苏榨油后的副产品,其富含蛋白质,且气味芳香,适口性好,其中鲜味氨基酸在紫苏蛋白的组成中含量较高[12],是制备鲜味肽的优质蛋白质资源。目前对于紫苏肽的研究,仅见有单酶水解[13]和制备高F值低聚肽方面的报道[14],而对于应用微波辅助进行分步酶解制备紫苏鲜味肽,进而分离纯化的研究鲜见报道。本研究以紫苏饼粕蛋白作为底物,采用碱性蛋白酶与风味蛋白酶的分步酶解,利用微波辅助技术代替常规水浴加热,大大地缩短了蛋白质的酶解时间,提高了酶解效率[15-16]。应用凝胶层析、RP-HPLC表征酶解成分的变化,且为进一步验证分步酶解对制备紫苏鲜味肽的积极作用,利用电子舌技术对制备出的紫苏肽呈鲜味的效果进行对比,以期为肽类在食品调味料的应用提供理论依据。
1.1 材料与试剂
紫苏饼粕 天津东方雷格工贸有限公司;紫苏饼粕蛋白(纯度为质量分数91.74%) 本实验室自制[17];碱性蛋白酶、风味蛋白酶 北京索莱宝科技有限公司;Sephadex G-15 美国Pharmacia公司;甲醛溶液 天津赢达稀贵化学试剂厂;乙腈(色谱纯) 天津市科密欧化学试剂有限公司;纯净水 杭州娃哈哈集团有限公司。
1.2 仪器与设备
Multi SYNTH微波合成仪 意大利Milestone公司;ASTREE电子舌 法国Alpha MOS公司;1100系列高效液相色谱仪 美国安捷伦公司;Vydac-C18色谱柱(250 mm×4.6 mm,5 μm) 美国Grace公司;80-1离心机 上海医疗设备(集团)有限公司手术器械厂;LGJ-10型冷冻干燥机 北京松源华兴科技发展有限公司;HD-5型核酸蛋白检测仪 南京大学普阳科学仪器研究所;FA1104N型电子天平 上海精密仪器有限公司;RE52-86A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 分步酶解工艺流程
将紫苏饼粕蛋白溶于水中制成质量浓度3g/100 mL的溶液,加入适量的NaOH调节至溶液的pH值为10,之后加入1 600 U/g的碱性蛋白酶,在70 ℃、微波400 W的条件下进行酶水解25 min。灭酶后利用HCl调节水解液的pH值为6.5,然后再加入1 200 U/g的风味蛋白酶,在65 ℃、微波400 W的条件下继续进行酶水解30 min,灭酶后将水解混合物迅速冷却,经冷冻干燥后即可得到混合紫苏肽的材料。
1.3.2 酶活性的测定
参照GB/T 23527—2009 《蛋白酶制剂》方法测定。
1.3.3 碱性蛋白酶水解度测定
按照pH-stat法测定碱性蛋白酶的水解度[18],见公式(1)。由于在酶解过程中pH值迅速下降,使酶活力降低,所以应每隔5 min加入已标定的0.1 mol/L NaOH溶液维持pH值至实验值。
式(1)中:V为NaOH溶液的体积/mL;c为NaOH溶液的浓度/(mol/L);α为α-氨基的离解常数;mp为底物中蛋白质的质量/g;htot为每克原料蛋白中肽键的毫摩尔数/(mmol/g),本实验取7.219。
1.3.4 风味蛋白酶水解度测定
采用甲醛滴定法测定风味蛋白酶水解度[19-20]。由于风味蛋白酶的最适pH值介于中性与弱酸性之间;而在酸性环境下,肽键断裂时产生的—NH3上的质子无法游离出来,不可用pH-stat法测定水解度,因此本研究采用甲醛滴定法测定蛋白的水解度,计算如式(2)所示:
式(2)中:c为NaOH溶液的浓度/(mol/L);V1为滴定样品时所消耗的NaOH溶液体积/mL;V2为空白试验时所消耗NaOH溶液体积/mL;htot为每克原料蛋白中肽键的毫摩尔数/(mmol/g),本实验取7.219;V为所取水解液的体积/mL;m为未水解时蛋白质的质量浓度/(mg/mL)。
1.3.5 酶解条件的确定
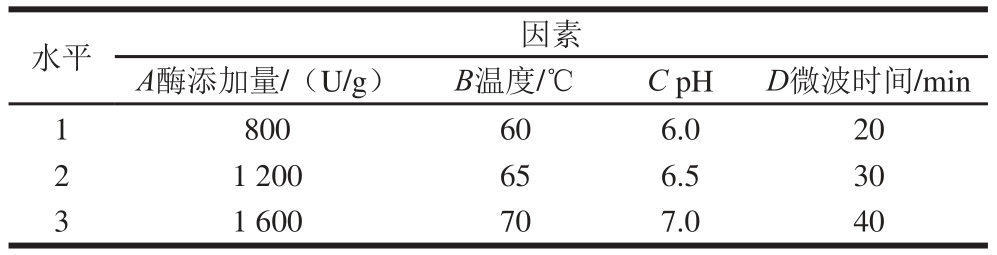
以水解度为指标,对酶添加量、pH值、温度、微波时间、微波功率在合适的范围值内进行单因素试验,在单因素试验的基础上选择L9(34)表进行正交试验。碱性蛋白酶和风味蛋白酶酶解条件正交试验因素及水平见表1和表2。
表1 碱性蛋白酶酶解条件L9(34)正交试验因素与水平设计
Table 1 Factors and their coded and actual levels used in L9(34))orthogonal array design for the optimization of alcalase hydrolysis
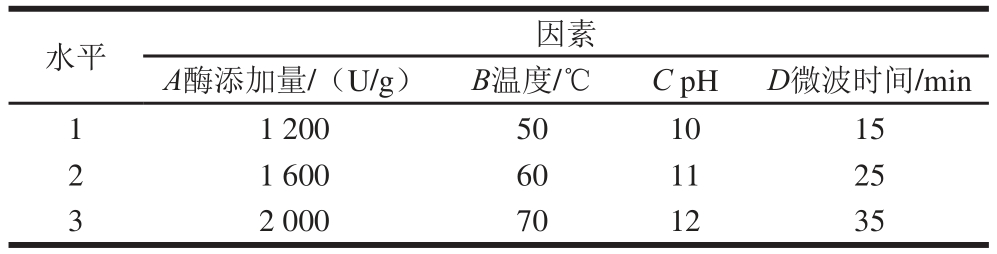
表2 风味蛋白酶酶解条件L9(34)正交试验因素与水平设计
Table 2 Factors and their coded and actual levels used in L9(34))orthogonal array design for the optimization of fl avourzyme hydrolysis
1.3.6 Sephadex G-15柱层析分离纯化
将活化后的Sephadex G-15装柱(1.2 cm×60 cm),经蓝色葡聚糖基准物测定,空水体积为26.2 mL。水解液样品用超纯水配制为质量浓度20 mg/mL的溶液,上样量为1 mL。以超纯水作为洗脱液,流速为0.5 mL/min,检测器波长为220 nm,收集各洗脱峰组分。
1.3.7 RP-HPLC分析条件
流动相为乙腈(A)-水(B),梯度洗脱条件:0~5 min,体积分数3% A;5~10 min,体积分数5% A;10~15 min,体积分数7% A;15~25 min,体积分数40% A。进样量5 μL;流速0.8 mL/min;柱温30 ℃;检测器波长220 nm。
1.3.8 电子舌滋味测定
将碱性蛋白酶单酶水解液、风味蛋白酶单酶水解液、分步酶解水解液经冷冻干燥后,分别取0.50 g,溶解在100 mL去离子水中,完全溶解后过滤。取25 mL溶解后的样品于进样烧杯中,编辑进样序列。传感器经预平衡、校准、诊断后测样。
2.1 碱性蛋白酶酶解条件的优化
2.1.1 微波时间、酶添加量、pH值及微波功率对水解度的影响
微波通过高频变化的电场使分子内部极性分子进行剧烈运动,短时间内即可产生大量的热,使体系达到酶解反应温度,因此微波法与传统的水浴加热法有着明显的不同。在紫苏分离蛋白的底物质量分数为3%的条件下,分别测定了不同微波时间、碱性蛋白酶添加量、pH值及微波功率对紫苏分离蛋白水解度的影响,结果见图1。
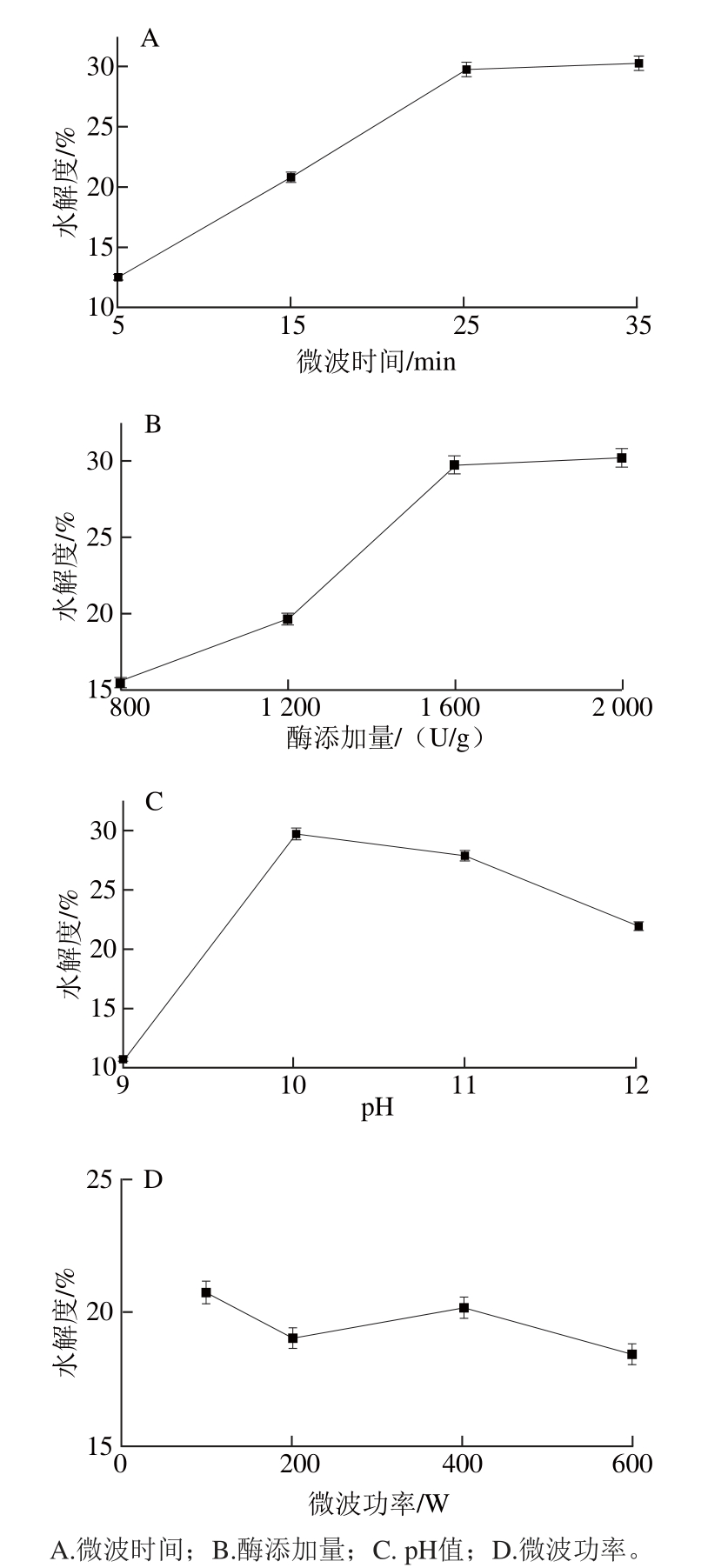
图1 微波时间、酶添加量、pH值及微波功率对水解度的影响(碱性蛋白酶)
Fig. 1 Effects of microwave irradiation time, enzyme dosage, pH and microwave power on degree of hydrolysis with alcalase
由图1A可知,微波时间在5~25 min之间时,蛋白 的水解度快速提升,蛋白质底物浓度不断降低;当微波时间达到25 min以上时,酶水解速率变缓,水解度仅有微弱的上升;可见在微波25 min条件下,紫苏饼粕分离蛋白的酶水解已基本完全,而继续延长水解时间是不经济的。因此,选择微波时间为25 min。
随着碱性蛋白酶添加量的增加(图1B),水解度不断增大;而1 600 U/g的酶添加量与2 000 U/g的添加量 相比,水解度趋于稳定,仅有微弱幅度增长。这是因为随着酶添加量的增加,使得蛋白质分子中肽键与酶的接触几率增加,在一定时间内被水解的肽键数不断增加,但当酶添加量达到一定值后,酶与底 物的接触几乎达到饱和,因此 水解度增长的趋势渐缓。因此,选定碱性蛋白酶的最佳添加量为1 600 U/g。
碱性蛋白酶对溶液的pH值十分敏感,其最适pH值范围为9~12。由图1C可知,在微波的作用下,当pH值为10时水解度达到最大值。因此,选定碱性蛋白酶的水解紫苏蛋白的最适pH值为10。
如图1D所示,微波功率的大小对紫苏蛋白的水解度有一定的影响;此外,微波功率的大小直接影响达到水解温度所用的时间。综合考虑蛋白的水解度和微波时间,选择最佳微波功率为400 W。
2.1.2 微波温度对水解度的影响
温度对酶促反应速率的影响表现在两个方面,一方面是当温度升高时,与一般化学反应一样,反应 速率加快。另一方面由于酶是蛋白质,随着温度升高,使酶蛋白逐渐变性而失活,引起酶反应速率下降。因此酶所表现的最适温度是这两种影响的综合结果。最适温度随着酶促作用时间的长短而改变,由于温度使酶蛋白变性是随时间累加的。一般来说反应时间长,酶的最适温度低,反应时间短则最适温度就高[21-23]。如图2所示,在微波短时间作用下碱性蛋白酶作用的最适温度高至70 ℃,随后在80 ℃时酶活力开始大幅降低,到90 ℃时接近失活,水解度迅速降低,而普通水浴的最适温度为50~60 ℃左右[6],从而充分证明了微波辅助酶解能够极大的缩短酶解时间,提高酶解效率。

图2 微波温度对水解度的影响
Fig. 2 Effect of temperature on degree of hydrolysis with alcalase
2.1.3 碱性蛋白酶酶解条件的正交试验结果
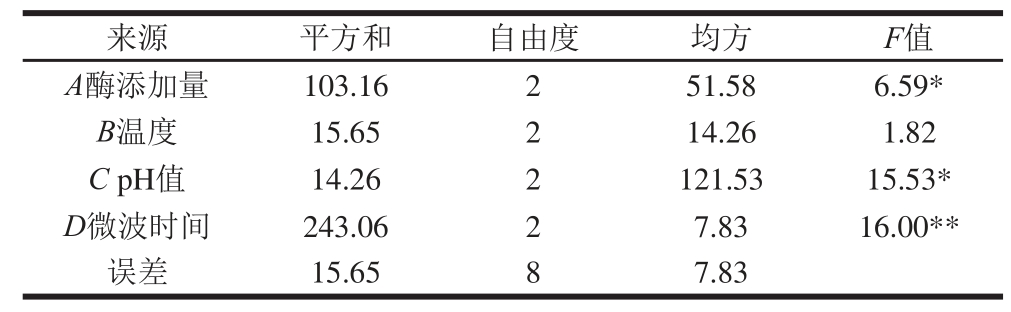
在单因素试验的基础上,对影响水解度的4 个因素酶添加量、pH值、温度、微波时间进行L9(34)正交试验,确定最佳的酶解条件,并进行方差分析。由表3和表4可知,各因素对微波酶解效果影响程度的大小顺序为D>C>A>B,最佳工艺条件为A2B2C1D3。即在酶添加量1 600 U/g、微波温度60 ℃、pH 10.0、微波时间35 min条件下,微波辅助碱性蛋白酶酶解紫苏饼粕分离蛋白水解度最高为31.79%。
表3 碱性蛋白酶酶解条件优化正交试验结果
Table 3 Orthogonal array design with experimental results for the optimization of alcalase hydrolysis

表4 碱性蛋白酶酶解条件优化正交试验方差分析结果
Table 4 Analysis of variance for degree of hydrolysis with alcalase as a function of operating parameters
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。下同。
2.2 风味蛋白酶酶解条件的优化
2.2.1 微波时间、酶添加量、pH值及温度对水解度的影响
利用碱性蛋白酶水解蛋白时,能够将蛋白中的一些疏水性氨基酸暴露出来,水解产物常常带有异味或苦味[11]。而外切酶能够将蛋白质或多肽分子末端的氨基酸肽键水解,从而使这些疏水性氨基酸从蛋白或多肽的末端断掉。利用风味蛋白酶中含有外切酶对水解产物进一步水解,不但可以提高蛋白的水解度,同时还可以降低异味,并通过协同作用增加水解液的风味[24-26]。
按1.3.5节方法进行酶解,固定其他条件,先采用碱性蛋白酶最佳酶解条件酶解后,再加入一定量风味蛋白酶,分别测定在不同微波时间、酶添加量、pH值及温度下蛋白质的水解度。


图3 微波时间、酶添加量、pH值及温度对水解度的影响(风味蛋白酶)
Fig. 3 Effects of microwave irradiation time, enzyme dosage, pH and temperature on degree of hydrolysis with fl avourzyme
由图3可知,在反应时间为10~30 min之间时,水解度不断上升。当反应时间在30 min以上时,酶解速率减缓,水解度增长微弱,因此从高效节能的角度考虑,选取微波时间为30 min为反应最佳时间。随着酶添加量的增加,水解度不断增大,当酶添加量大于1 200 U/g时,酶与底物的接触几乎达到饱和,因此可选择1 200 U/g的酶添加量为最佳条件。水解度受到pH值的影响,呈现先增加后降低的趋势,因此选择pH值为6.5为最适条件。在微波短时间作用下,风味蛋白酶的最适温度为65 ℃,随后在70 ℃时酶活力大幅下降,水解度迅速降低。
2.2.2 风味蛋白酶酶解条件优化正交试验
在单因素试验的基础上,对影响水解度的4 个因素微波时间、酶添加量、pH值、温度进行L9(34)正交试验,确定最佳的酶解条件,并对正交试验结果做极差分析与方差分析,结果见表5和表6。
由表5和表6可知,各因素对微波酶解效果影响程度的大小顺序为B>C>A>D,最佳工艺条件为A3B2C2D3。即在酶添加量1 600 U/g、温度65 ℃、pH 6.5、微波时间40 min条件下,微波辅助分步酶解紫苏饼粕分离蛋白水解度为44.86%。
表5 风味蛋白酶酶解条件优化正交试验设计及结果
Table 5 Orthogonal array design with experimental results for the optimization of fl avorzyme hydrolysis

表6 风味蛋白酶酶解条件优化正交试验方差分析结果
Table 6 Analysis of variance for degree of hydrolysis with fl avorzyme as a function of operating parameters
2.3 紫苏肽的分离纯化与表征
2.3.1 凝胶层析分离酶解液
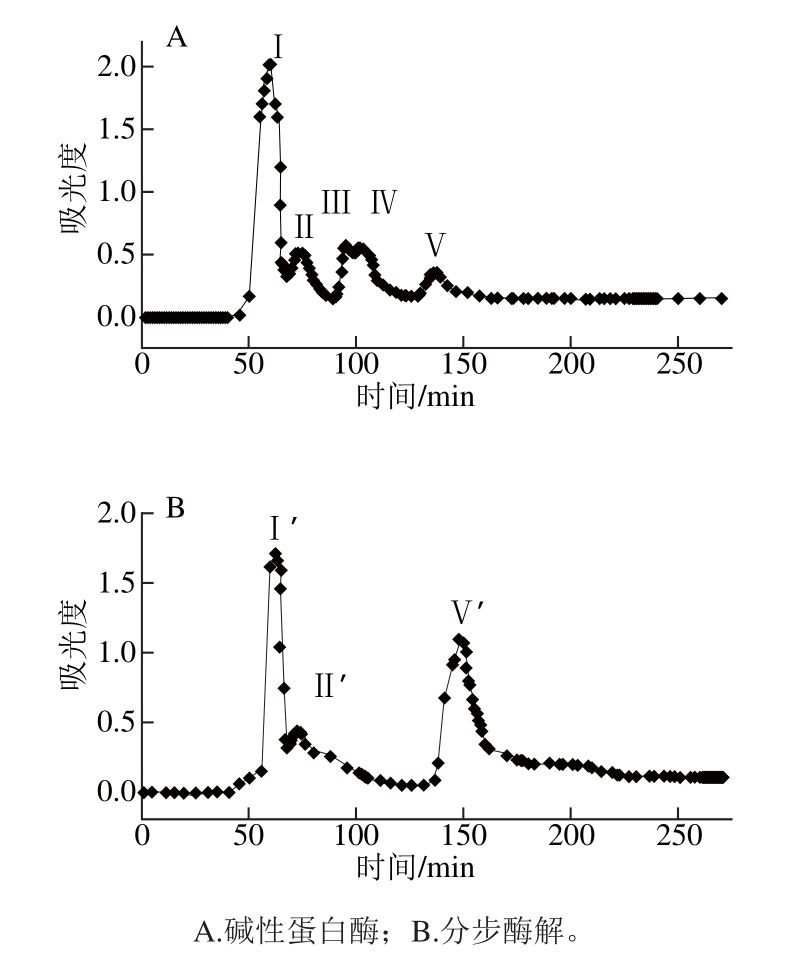
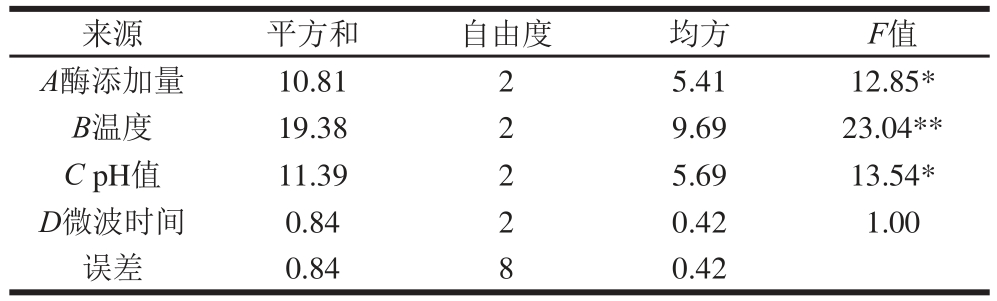
图4 碱性蛋白酶与分步酶解水解液的Sephadex G-15凝胶色谱洗脱图
Fig. 4 Elution profi les of hydrolysatses produced by sequential enzymatic hydrolysis and with alcalase alone by Sephadex G-15 gel permeation chromatography
由图4A可知,单酶酶解结束后的洗脱峰分成5 个组分,分别编号Ⅰ~Ⅴ,洗脱总体积约为90 mL。跟其他组分相比,组分Ⅰ的吸收峰强度最大,为分子质量最大的部分,组分Ⅱ分子质量其次,组分Ⅲ和Ⅳ的保留时间表现出很小的差异,由此可以推断这两部分分子质量差异不大,第Ⅴ组分分离效果最好,分子质量为最小。由图4B可知,分步酶解的水解液洗脱峰主要包含3 个组分,分别编号为Ⅰ’、Ⅱ’和Ⅴ’,洗脱总体积约为120 mL。不同于单酶洗脱图谱的是,分步酶解中分子质量处于中间位置的洗脱峰Ⅲ和Ⅳ消失,分子质量较小的组分Ⅴ’含量大幅增加,证明了分步酶解将肽分解为更小的肽段,且分离出的3 个组分可进一步鉴定鲜味肽。
2.3.2 RP-HPLC对酶解前后成分变化的表征
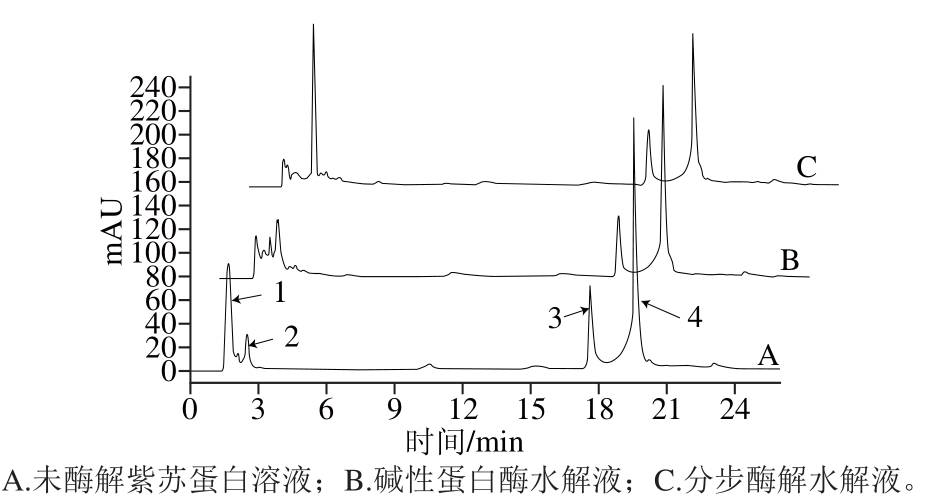
图5 酶解前后成分变化在RP-HPLC中的表征
Fig. 5 RP-HPLC chromatograms of hydrolysatses produced by sequential enzymatic hydrolysis and with alcalase alone
如图5所示,相同样品浓度下,紫苏蛋白在保留时间为1.59、2.52、17.59、19.54 min有4 个较强的吸收峰,分别将其标记为1、2、3和4号化合物。经过碱性蛋白酶酶解后,1和4号化合物吸收峰明显降低,3号化合物吸收峰略有降低,2号化合物吸收峰升高,在风味蛋白酶进行第2步酶解后,2号化合物明显升高,而1、3和4号化合物较第1步水解后又明显降低了,说明经过分步酶解,蛋白含量降低,分子质量较小的肽段含量增加,水解程度增大。
这个结果与图4凝胶色谱表征的酶解效果,即分步酶解水解液相比于碱性蛋白酶水解液的Ⅴ号化合物峰明显增强相对应。将二者比较可得,第2步酶解中风味蛋白酶将第1步水解液水解为更小的肽段,且效果较为明显,充分证明了微波辅助分步酶解紫苏饼粕分离蛋白是快速且有效的。
2.3.3 单酶酶解物与分步酶解物的呈味特性
从图6可以看出,第1主成分与第2主成分的贡献率分别为91.611%、8.084%,二者之和达到了99.695%,故能够代表样品本身绝大部分的信息并能很好地反映样品的实际情况。且3 种样品的主成分分析的识别指数为97,说明3 种样品在滋味间存在差异,并通过电子舌能够很好地区分开来。样品A在右侧,与在左侧的样品B、C距离较远,说明滋味差别比较大。
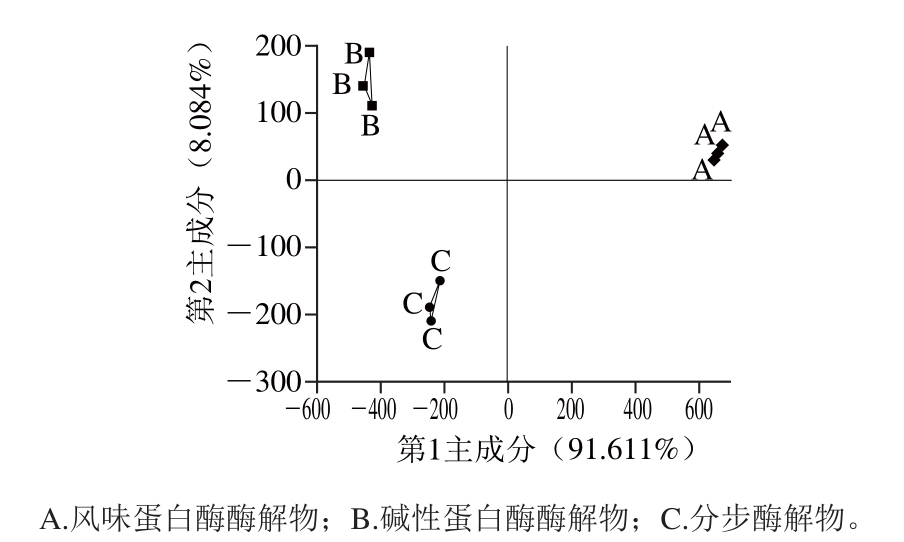
图6 单酶酶解物与分步酶解物主成分分析
Fig. 6 PCA plots for hydrolysatses produced by sequential enzymatic hydrolysis and with alcalase alone
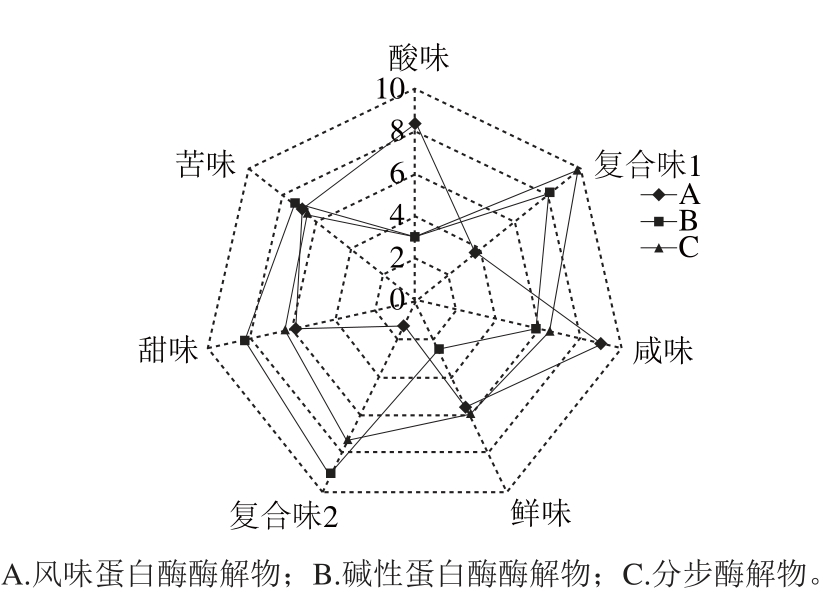
图7 单酶酶解物与分步酶解物滋味雷达图谱
Fig. 7 Radar charts showing taste profi les of hydrolysatses produced by sequential enzymatic hydrolysis and with alcalase alone
图7 为样品A(风味蛋白酶酶解物)、B(碱性蛋白酶酶解物)、C(分步酶解物)3 种紫苏肽处理样品在电子舌第5套传感器上各种滋味的相对强度,电子舌通过软件对信号值的分析,能够在0~12的刻度上比较不同样品间的各种滋味的相对强度,而图中给出的数值为相对强度值。从图7中可以直观地看出鲜味、咸味与酸味的相对强度大小顺序,其余4 根传感器数值为不同侧重的综合滋味大小。其中鲜味的大小顺序为:C>A>B,且B的鲜味明显小于其余二者,证明了第1步碱性蛋白酶酶解达到深度水解目的的同时,产生了较差的风味,通过第2步风 味蛋白酶将氨基或羧基末端的肽键剪切下来,明显改善碱性蛋白酶酶解后的鲜味,且2 种酶合作使用的效果均大于单独使用时的鲜味,因此证明了利用分步酶解水解紫苏蛋白制备鲜味肽是可行且有效的。
利用微波辅助分步酶解的方法以紫苏饼粕蛋白为原料制备紫苏肽,第1步使用碱性蛋白酶水解时间为35 min,第2步酶解使用风味蛋白酶水解时间为40 min,与文献[13-14]所报道的水解时间4 h相比,使用微波辅助分步酶解的方法制备紫苏肽可使水解时间缩短大约3.3 h,且紫苏蛋白水解度分别为38.75%和34.8%,而本实验利用微波辅助分步酶解方法水解度达到44.86%。蛋白酶的水解产物具有非常明显的鲜味,经过凝胶层析对酶水解液中不同分子质量肽段进行分离纯化,结合RPHPLC表征,最后应用电子舌测定鲜味大小,优化了紫苏鲜味肽的最佳工艺条件,证明了微波辅助分步酶解相比于单酶水解是一种快速且有效的方法[27-30],本研究为获得高品质、高产率、水解度较高和成本较低的鲜味肽提供了较充分的理论依据。
参考文献:
[1] 周雪松, 赵谋明. 肽的呈味功能研究[J]. 中国调味品, 2005(6) ∶ 38-42.DOI∶10.3969/j.issn.1000-9973.2005.06.009.
[2] 仇春泱, 王锡昌, 刘源. 食品中的呈味肽及其分离鉴定方法研究进展[J]. 中国食品学报, 2013, 13(12)∶ 129-137. DOI∶10.16429/j.1009-7848.2013.12.035.
[3] CARERI M, MANGIA A. Analysis of food proteins and peptides by chromatography and mass spectrometry[J]. Journal of Chromatography A, 2003, 1000(1/2)∶ 609-635. DOI∶10.1016/S0021-9673(03)00237-1.
[4] SAMARAKOON K M, O-NAM K, KO J Y, et al. Purification and identification of novel angiotensin-Ⅰ converting enzyme (ACE)inhibitory peptides from cultured marine microalgae (Nannochloropsis oculata) protein hydrolysate[J]. Journal of Applied Phycology, 2013,25(5)∶ 1595-1606. DOI∶10.1007/s10811-013-9994-6.
[5] LE E S J, KIM E K, HWANG J W, et al. Purif ication and characterization of an antioxidative peptide from enzymatic hydrolysates of duck processing by-products[J]. Food Chemistry,2010, 123(2)∶ 216-220. DOI∶10.1055/s-0028-10845 62.
[6] 曹雁平. 食品调味技术[M]. 北京∶ 化学工业出版社, 2002∶ 91-93.
[7] SCHLICHTHERLE-C EMY H, AMADO R. Analysis of tasteactive compounds in an enzymatic hy drolysate of deamidated wheat gluten[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6)∶1515-1522. DOI∶10.1021/jf010989o.
[8] SU G W, CUI C, ZHENG L, et al. Isolation and identification of two novel umami and umami-enhancing peptides from peanut hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS[J]. Food Chemistry, 2012, 135(2)∶ 479-485. DOI∶10.1016/j.foodchem.2012.04.130.
[9] ZHANG M X, WANG X C, LIU Y. et al. Isolation and identifi cation of fl avor peptides from puffer fi sh (Takifugu obscurus) muscle using an electronic tongue and MALD I-TOF/TOF MS/MS[J]. Food Chemistry,2012, 135(3)∶ 1463-1470. DOI∶10.1016/j.foodchem.2012.06.026.
[10] TOELSTEDE S, DUNKEL A, HOFMANNA T. A series of kokumi peptides impart the long-lasti ng mouthfulness of matured Gouda cheese[J]. Journal of Agricultural a nd Food Chemistry, 2009, 57(4)∶1440-1448. DOI∶10.1021/jf803376d.
[11] ARISTOY M C, TOLDRA F. Isolation of flavor peptides from raw pork meat and dry-cured ham[J]. Developments in Food Science,1995, 37∶ 1323-1344. DOI∶10.1016/S0167-4501(06)80236-0.
[12] 谢超, 朱国君, 赵国华. 紫苏饼粕浓缩蛋白的制备及理化性质研究[J].中国粮油学报, 2009, 24(11)∶ 83-86.
[13] 盛彩虹, 李思朦, 刘晔, 等. 紫苏肽制备工艺研究[J]. 中国油脂, 2011,36(10)∶ 20-24.
[14] 童波, 刘大川, 刘晔. 紫苏高F值低聚肽的制备研究[J]. 食品科学,2009, 30(20)∶ 178-181.
[15] 肖碧, 董绪燕, 魏芳, 等. 微波连续化辅助酶解大豆分离蛋白的工艺研究[J]. 食品研究与开发, 2012, 33(10)∶ 54-58.
[16] 陈晶, 刘友明, 熊善柏, 等. 复合蛋白酶与风味蛋白酶分步水解鱼骨蛋白工艺的优化[J]. 华中农业大学学报, 2007, 26(5)∶ 704-708.DOI∶10.13300/j.cnki.hnlkxb.2007.05.028.
[17] 石玮婷, 李荣, 姜子涛. 紫苏籽蛋白的提取及纯化研究[J]. 中国食品添加剂, 2013(4)∶ 68-74. DOI∶10.3969/j.issn.1006-2513.2013.04.003.
[18] 陈季旺, 刘英, 夏文水, 等. 大米降压肽酶法制备工艺及其性质研究[J]. 农业工程学报, 2007, 23(5)∶ 210-213. DOI∶10.3321/j.issn∶1002-6819.2007.05.041.
[19] 赵新淮, 冯志彪. 大豆蛋白水解物水解度测定的研究[J]. 东北农业大学学报, 1995, 26(2)∶ 178-181.
[20] 张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 北京∶ 人民教育出版社, 1983∶ 113-115.
[21] 王镜岩. 生物化学[M]. 北京∶ 高等教育出版社, 2002∶ 378-379.
[22] SELJE-ASSMANN N, HOFFMANN E M, BECKER K. A batch incubation assay to screen plant samples and extracts for their ability to inhibit rumen protein degradation[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4)∶ 302-318. DOI∶10.1016/j.anifeedsci.2007.05.047.
[23] KAR S K, JANSMAN A J M, BOEREN S. Protein, pept ide, amino acid composition, and potential functional properties of existing and novel dietary protein sources for monogastrics[J]. Journal of Animal Science, 2016, 94∶ 30-39. DOI∶10.2527/jas2015-9677.
[24] 刘大川. 多肽的功能特性及其制备[J]. 粮食科技与经济, 2013,38(3)∶ 45-48. DOI∶10.3969/j.issn.1007-1458.2013.03.018.
[25] ARAI S, YAMASHITA M, KATO H, et al. Applying proteolytic enzymes on soybean[J]. Agricultural and Biological Chemistry, 1970, 34(5)∶ 321-330. DOI∶10.1271/bbb1961.34.1338.
[26] 张根生, 何丽莹, 岳晓霞, 等. 风味蛋白酶与复合蛋白酶分步水解脱脂碎肉粉工艺的优化[J]. 中国调味品, 2011, 36(1)∶ 17-21.
[27] PRAMANIK B N, MIRZA U A, HAIN Y, et al. Microwave-enhanced enzyme reaction for protein mapping by mass spectrometry∶ a new approach to protein digestion in minutes[J]. Protein Science, 2002,11(11)∶ 2676-2687. DOI∶10.1110/ps.0213702.
[28] IZQUIERDO F J, ALLI I, GAMEZ R, et al. Effects of high pressure and microwave on pronase and α-chymotrypsin hydrolysis of β-lactoglobulin[J]. Food Chemistry, 2005, 92(4)∶ 713-719.DOI∶10.1016/j.foodchem.2004.09.006.
[29] 刘静, 陈均志. 微波双酶协同水解大豆分离蛋白制备小分子肽的研究[J]. 食品研究与开发, 2006, 27(8)∶ 9-12. DOI∶10.3969/j.issn.1005-6521.2006.08.003.
[30] 李菊芳, 魏芳, 董绪燕, 等. 微波辅助分步酶解菜籽粕制备菜籽多肽的研究[J]. 中国油脂, 2010, 35(3)∶ 18-22.
Preparation of Umami Peptide by Microwave-Assisted Stepwise Enzymatic Hydrolysis of Perilla Seed Meal Protein
LI Rong, YU Jun, JIANG Zitao*, HUANG Xianyong
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
中图分类号:TS229
文献标志码:A
文章编号:1002-6630(2017)20-0169-07
引文格式:
李荣, 于君, 姜子涛, 等. 微波辅助分步酶解紫苏饼粕蛋白制备鲜味肽[J]. 食品科学, 2017, 38(20)∶ 169-175.DOI∶10.7506/spkx1002-6630-201720024. http∶//www.spkx.net.cn
LI Rong, YU Jun, JIANG Zitao, et al. Preparation of umami peptide by microwave-assisted stepwise enzymatic hydrolysis of perilla seed meal protein[J]. Food Science, 2017, 38(20)∶ 169-175. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720024. http∶//www.spkx.net.cn
收稿日期:2016-12-02
基金项目:天津市自然科学基金项目(12JCZDJC34100;13JCYBJC18700)
作者简介:李荣(1962—),女,教授,学士,研究方向为分析化学与食品分析。E-mail:lirong@tjcu.edu.cn
*通信作者:姜子涛(1956—),男,教授,博士,研究方向为食品添加剂。E-mail:ztjiang@tjcu.edu.cn