表1 多反应监测模式下6 种农药的质谱参数
Table 1 Mass spectral parameters for six pesticides under the multiple reaction-monitoring mmooddee

注:*.定量离子对。
赵风年,郑鹭飞,佘永新*,张 超,洪思慧,李 辉,曹晓林,王珊珊,金茂俊,金 芬,邵 华,王 静*
(中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081)
摘 要:建立 生姜、红 薯、土豆、荔枝中 多菌灵、 吡虫啉、涕灭威、三唑酮、乙草胺、苯醚甲环唑的液相色谱-串联质谱检测方法。样品经乙腈溶液提取,50 mg N-丙基乙二胺吸附剂、25 mg十八烷基键合硅胶(C18)净化,C18色谱柱分离,0.1%甲酸溶液-甲醇作为流动相进行梯度洗脱,在电喷雾正离子电离模式下,质谱多离子监测模式定量分析,基质标准曲线外标法定量。结果表明,6 种农药在10~500 μg/L范围内呈良好的线性关系,相关系数(r)均大于0.995。3 个加标水平下,6 种农药的平均回收率为87.9%~110.3%,相对标准偏差不大于14.6%。该方法简单、快速、灵敏度高,能够满足小宗作物农药残留的监控要求。
关键词:小宗作物;液相色谱-串联质谱;农药残留;分散固相萃取
Abstract: A simple analytical method was established using dispersive solid phase extraction combined with liquid chromatography-positive mode electrospray ionization-tandem mass spectrometric (LC-MS/MS) for the determination of six pesticide residues in ginger, sweet potato, potato, and litchi, including carbendazim, imidacloprid, aldicarb, triadimefon,acetochlor and difenoconazole. The analytes were extracted with acetonitrile and cleaned up using primary secondary amine(PSA) and octadecyl silane (C18). Qualitative analysis of six analytes was carried out under the positive scanning model after the chromatographic separation on a reversed phase C18column with gradient elution using a mobile phase composed of methanol and 0.1% formic acid aqueous solution. A good linearity was observed for the six pesticides in the range of 10–500 μg/L with a coeffi cient of determination (r) of greater than 0.995. The recoveries of the pesticides in four classical minor crops were in the range of 87.9%–110.3% at three spiked concentration levels, and the precision, as indicated by relative standard deviations (RSDs, n=5), was not more than 14.6%. The method is simple, rapid and sensitive, and can meet the requirements for the determination of pesticide residues in min or c rops.
Ke y wo rds: minor crops; liquid chromatography-tandem mass spectrometry (LC-MS/MS); pesticide residues;dispersive solid phase extraction
DOI∶10.7506/spkx1002-6630-201720028
ZHAO Fengnian, ZHENG Lufei, SHE Yongxin, et al. Determination of six pesticide residues in classic minor crops by liquid chromatography-tandem mass spectr ometry with dispersive solid phase extraction[J]. Food Science, 2017, 38(20)∶197-202. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-20172 0028. http∶//www.spkx.net.cn
小宗作物是除水稻、小麦、棉花、油菜等大宗农作物以外多种农作物的总称,具有营养价值高、口味丰富、区域特色明显、经济效益高等优点[1-2]。相比较大宗农产品而言,我国的小宗农产品因种植规模较小,区域生产条件苛刻,标准化生产相对滞后,农药残留限量方法及质量监控措施相对匮乏,导致了许多如海南“毒豇豆”、山东“毒生姜”、湖南“毒金银花”等安全事件的发生。因此,结合小宗作物样品基质的特点,开展我国小宗农产品农药使用情况调查和残留分析研究,加强小宗农产品农药残留监控体系建设已刻不容缓[3]。
多菌灵是一种高效低毒、广谱、内吸性杀菌剂,对真菌引起的病害有防治效果[4-5];吡虫啉是硝基亚甲基类超高效杀菌剂[6-7],可用于生姜、马铃薯[10]等小宗作物的防治;涕灭威是一种高效、剧毒、广谱、内吸性氨基甲酸酯类杀虫剂[8],易被氧化成毒性更高的代谢产物涕灭威亚砜及涕灭威砜[9-10],通过食物链对人体健康构成潜在威胁;乙草胺对一年生禾本科杂草和部分小粒种子的阔叶杂草有良好的防治效果[11-12],是生姜、马铃薯等作物种植过程中常用的除草剂;三唑酮和苯醚甲环唑同为三唑类杀菌剂,除了有效防治荔枝的霜疫病[13]外,对小宗作物常见的黑星病、白腐病以及白粉病等均有明显的防治效果[14-15]。目前我国国家标准规定多菌灵、吡虫啉、涕灭威、三唑酮、乙草胺和苯醚甲环唑在食品中的最大残留限量(maximum residue limit,MRL)范围分别为 3~5、0.05~5、0.02~0.1、0.05~5、0.05~0.2 mg/kg和0.02~10 mg/kg[16]。按照《农业部小宗作物病虫草害使用药剂产品清单》规定,上述6 种农药在小宗作物种植等过程中均可以推荐使用,但其在小宗作物农药残留限量规定尚不具体,并且暂无上述6 种农药在小宗作物中的国家标准分析方法。因此,开展多种联合使用农药在小宗作物的残留动态研究具有重要的现实意义。
分散固相萃取技术由于快速简单、成本低、环保等特点,目前已广泛用于水果蔬菜粮谷中农药的多残留检测[7,17-21]。结合小宗作物样品基质特点和上述6 种农药的理化性质,本研究以生姜、红薯、土豆、荔枝4 种典型小宗作物为研究对象,采用分散固相萃取技术净化,筛选和优化了提取溶剂、分散固相萃取吸附剂等前处理条件,评价不同小宗作物基质对添加6 种农药的回收率的影响,建立了基于N-丙基乙二胺(primary secondary amine,PSA)、C18混合分散固相萃取技术,结合液相色谱-串联质谱条件的优化,实现了生姜、红薯、土豆以及荔枝中多菌灵、吡虫啉等6 种农药的同步检测。
1.1 材料与试剂
生姜、红薯、土豆空白及实际样品均采购于山东某地,荔枝样品来源于广西某地,实验前均在-4 ℃冰箱内贮藏。
多菌灵、吡虫啉、乙草胺标准品(质量浓度均为100 mg/L,纯度均大于99%) 农业部环境保护科研检测研究所;三唑酮、苯醚甲环唑、涕灭威(纯度均大于99%) 德国Dr. Ehrenstofer公司;乙腈、甲醇(均为色谱纯) 美国Fisher科技公司;甲酸(色谱纯) 北京Dikma公司;PSA、C18和石墨化碳黑(graphitized carbon black,GCB) 天津博纳艾杰尔公司;无水硫酸镁、氯化钠(均为分析纯) 北京化工厂;其他试剂为分析纯;实验用水为Milli-Q超纯水。
1.2 仪器与设备
1200液相色谱仪 美国Agilent公司;API2000串联四极杆质谱 美国Sciex公司;Multiquik3食品料理机 德国Braun公司;N-EVAPTM111氮吹仪 美国OA公司;KQ-500DB型数控超声波清洗器 昆山市超声仪器有限公司;高速冷冻离心机 美国Thermo公司;Vortex Genie 2涡旋振荡器 美国Scientifi c Industries公司。1.3 方法
1.3.1 样品前处理
生姜、红薯、土豆、荔枝(去壳去核只保留果肉)新鲜样品置于料理机里粉碎。称取5.00 g(精确至0.01 g)于50 mL聚四氟乙烯离心管中,加入10 mL乙腈,涡旋5 min,然后加入2 g无水硫酸镁和0.5 g氯化钠,涡旋3 min,将离心管置于离心机中5 000 r/min离心5 min。取1 mL离心上清液于10 mL塑料离心管中,向其加入50 mg PSA和25 mg C18,涡旋3 min,5 000 r/min离心5 min。过0.22 μm有机相滤膜,供液相色谱-串联质谱分析。
1.3.2 仪器条件
1.3.2.1 色谱条件
采用Waters X-bridge C18色谱柱(150 mm×2.1 mm,5 μm),柱温35 ℃;进样体积5 μL。流动相A为0.1%甲酸溶液,B为甲醇,流速为400 μL/min,梯度洗脱程序:0~3 min,95%~70% A;3~5 min,70%~50% A;5~8 min,50%~30% A;8~9 min,30%~5% A;9~10 min,5% A;10~11 min,5%~95% A;11~13 min,95% A。
1.3.2.2 质谱条件
监测方式:多重反应监测模式;离子源:电喷雾离子源;扫描方式:正离子模式;喷雾电压:+5 500 V;离子源温度:500℃;气帘气:35 psi;碰撞气压力:5 psi;雾化气:25 psi;辅助加热气:50 psi。射入电压:10 V;碰撞室入口电压:20 V;碰撞室出口电压:4 V。6 种农药的质谱参数详见表1。
表1 多反应监测模式下6 种农药的质谱参数
Table 1 Mass spectral parameters for six pesticides under the multiple reaction-monitoring mmooddee

注:*.定量离子对。
2.1 质谱条件的优化
根据6 种物质的不同性质,采用正离子扫描模式,结果表明:在正离子模式下,当6 种物质进入一级质谱后,很容易产生稳定的[M+H]+准分子离子峰。多菌灵的母离子为m/z 192.0,[M+H]+离子作为母离子进入二级质谱后发生断裂,产生不同的子离子。m/z 160.0特征碎片是由母体脱去—OCH3后生成,进一步脱去—C=O生成m/z 132.2特征离子,其中m/z 160.0特征离子响应值高且稳定,因此将m/z 192.0/160.0作为定量离子对。吡虫啉的母离子为m/z 256.3,[M+H]+离子作为母离子进入二级质谱后发生断裂或重排等反应,产生不同的碎片离子,二级质谱的特征碎片m/z 174.8和208.9,其中m/z 208.9的响应值高且稳定,因此将m/z 256.3/208.9作为定量离子对。同理,选择m/z 213.3/88.9作为涕灭威的定量离子对,选择m/z 294.2/197.2作为三唑酮的定量离子对,选择m/z 270.3/224.1作为乙草胺的定量离子对,选择m/z 406.2/251.0作为苯醚甲环唑的定量离子对。各种离子质谱图及结构式如图1所示。

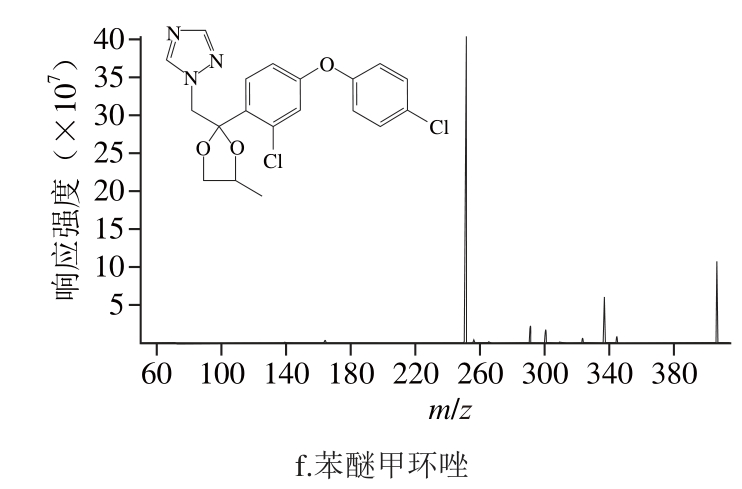
图1 6 种农药的二级质谱图及结构式
Fig. 1 Product ion spectra and structural formulas of six pesticides
2.2 流动相的优化
本研究比较水-甲醇/乙腈、甲酸溶液-甲醇/乙腈溶液组成的不同配比的流动相,在梯度洗脱条件下的多菌灵、吡虫啉、涕灭威、三唑酮、乙草胺和苯醚甲环唑的色谱分离效果。结果表明,上述6 种物质在水-甲醇/乙腈组成的流动相条件下,均能很好在色谱柱上保留,但不能有效分离或响应值较低;当采用0.1%甲酸溶液-乙腈/甲醇组成流动相后,6 种物质的响应值得到了很大提高。因此,本实验选择流动相0.1%甲酸溶液-甲醇。
2.3 提取溶剂的优化
分别选用乙腈与1%乙酸-乙腈溶液作为提取剂,比较了两种提取剂对生姜、红薯、土豆以及荔枝4种基质中目标物的提取效果。结果表明,1%乙酸-乙腈作为提取溶剂时,低添加水平下土豆和荔枝的最低回收率仅为62.2%、61.0%,生姜和红薯提取效果好;而乙腈作为提取剂时,土豆和荔枝的最低回收率提高到68.9%、70.1%,平均回收率为82.1%、86.3%。因此,本研究选用乙腈作为提取溶剂。
2.4 净化剂的选择及优化
本实验比较了GCB、PSA和C18的净化效果,设计了3 组净化剂组合,分别是20 mg GCB+150 mg无水硫酸镁,25 mg PSA+25 mg C18,50 mg PSA+25 mg C18。结果表明,当使用GCB作为净化吸附剂时,吡虫啉因所含的吡啶基易被GCB吸附[19],导致其回收率小于40%;当PSA的使用量由25 mg增加到50 mg时,目标物最低回收率由70%提高到80%以上,这是由于PSA是一种阴离子交换吸剂,且具有伯胺和仲胺功能基团,可以通过离子交换或者氢键等作用力消除样品中的有机酸、脂肪酸和糖等干扰物,有效提高PSA对上述6 种农药的净化效果;C18是一种非极性的、广谱性的净化吸附剂,虽然它除杂能力没有PSA好,但能够有效地去除小宗作物提取物中微量的脂肪、胆固醇、甾醇、维生素及其他复杂的成分,并且对目标物不具有吸附效果[22-23]。因此,实验选择50 mg PSA和25 mg C18作为吸附剂进行净化。
2.5 基质效应、线性范围和检出限
表2 不同基质中6 种农药的线性范围、线性方程、相关系数、斜率比和LOD
Table2 Linear ranges, regression equations, correlation coefficients (r),slope of matrix/slope of solvent ratio (k) and limit of detection (LOD) for six pesticides in different matrices

以乙腈、生姜、红薯、土豆及荔枝空白样品提取液分别配制质量浓度为10~250 μg/L(多菌灵和涕灭威质量浓度为20~500 μg/L)的混合标准溶液,以6 种农药质量浓度为横坐标和定量离子对峰面积为纵坐标进行线性回归计算,所得的相关系数(r)均大于0.995(表2),相关色谱图见图2。采用基质标准曲线斜率和溶剂标准曲线斜率之比(k)评价基质效应[24-25]:当k大于1.1时为基质增强效应,小于0.9为基质减弱效应,而当k在0.9~1.1之间时,基质效应不明显。由表2可知,4 种基质对多菌灵有明显的基质减弱效应,对吡虫啉、苯醚甲环唑有明显的基质增强效应,其余几种农药的基质效应随不同基质呈现不同情况。取信噪比为3所对应的待测物质质量浓度作为该方法的检出限(limit of detection,LOD),10 倍信噪比作为该方法的定量限(limit of quantification,LOQ)[26-28]。本研究中6 种农药的最低方法LOD为1.0 μg/L,低于GB/T 20700—2008《粮谷中486 种农药及相关化学品残留量的测定》[29]测定粮谷中376 种农药及相关化学品的最低方法LOD为20 μg/kg;最低LOQ(3.5 μg/L)低于GB 23200.8—2016《水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法》[30]中测定的水果蔬菜中500 种农药及相关化学品的最低LOQ为25 μg/kg。

图2 生姜样品中6 种农药(80 μg/kg)的总离子色谱图
Fig. 2 Total ion chromatogram of six pesticides (80 μg/kg) in ginger samples
2.6 方法的回收率和精密度
表3 不同基质中6 种农药的添加回收率及相对标准偏差(n=5)
Table 3 Recoveries and relative standard deviations (RSDs) for six pesticides in different matrices (n=5)
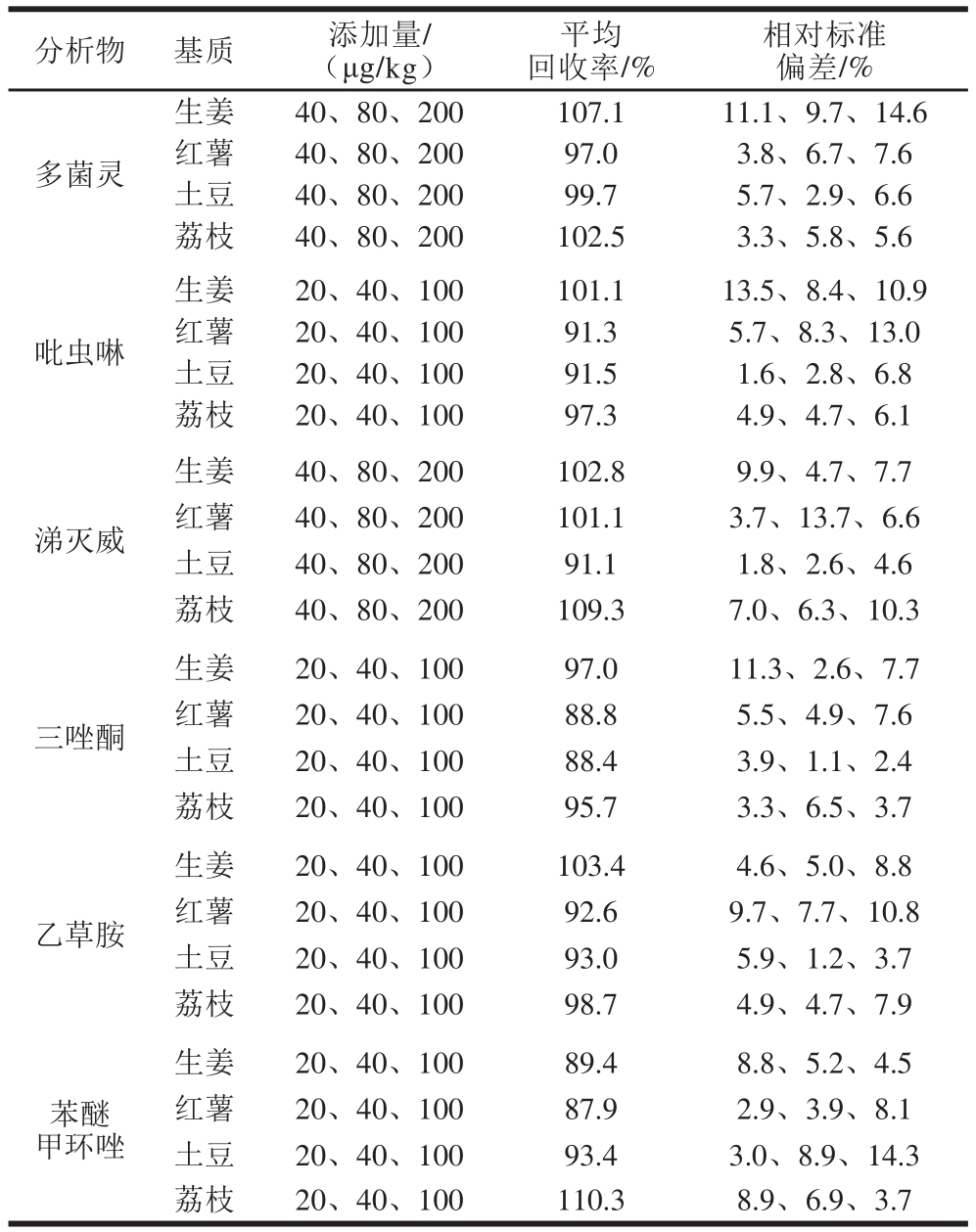
采用生姜、红薯、土豆及荔枝空白样品,进行加标回收率及精密度实验。参考MRL标准[25],样品分别添加3 个水平的6 种农药标准溶液,按照本实验方法进行处理,用液相色谱-串联质谱进行测定,外标法定量。在3 个加标量(表3)条件下,6 种农药的平均回收率为87.9%~110.3%,相对标准偏差不大于14.6%(n=5)。
2.7 实际样品测定结果
采用本方法对2015年7月份采自山东某地各4 种不同品种的生姜、土豆及红薯各10 份,以及2015年6月份广西产的10 份荔枝进行检测,实际样品中均未检出6 种农药残留。
本实验通过对小宗作物的样品前处理方法和色谱质谱条件的筛选和优化,建立生姜、红薯、土豆以及荔枝4 种典型小宗作物中多菌灵、吡虫啉、涕灭威、三唑酮、乙草胺及苯醚甲环唑6 种常用农药残留的液相色谱-串联质谱同步检测方法。该方法操作简单、线性关系良好、准确可靠,能够满足国内外限量检测要求。
参考文献:
[1] KIM B M, PARK J, CHOI J, et al. Residual determination of clothianidin and its metabolites in three minor crops via tandem mass spectrometry[J]. Food Chemistry, 2012, 131(4)∶ 1546-1551.DOI∶10.1016/j.foodchem.2011. 09.134.
[2] 殷琛. 日本小宗作物农药登记对策初探[J]. 农药科学与管理, 2014,35(10)∶ 15-18.
[3] GAST R E. Industry views of minor crop weed control[J]. Weed Technology, 2008, 22(2)∶ 385-388. DOI∶10.1614/WT-07-103.1.
[4] POURREZA N, RASTEGARZADEH S, LARKI A. Determination of fungicide carbendazim in water and soil samples using di spersive liquid-liquid microextraction and m icrovolume UV-vis spectrophotometry[J]. Talanta, 2015, 134∶ 24-29. DOI∶10.101 6/j.tala nta.2014.10.056.
[5] 丁丽, 曾绍东, 魏晓奕, 等. 超高效液相色谱-质谱法测定豆芽中多菌灵、2,4-二氯苯氧乙酸、恩诺沙星残留[J]. 食品科学, 2014, 35(22)∶169-175. DOI∶10.7506/spkx1002-6630-201422032.
[6] TOTTI S, FERNANDEZ M, GHINI S, et al. Application of matrix solid phase dispersion to the determination of imi dacloprid,carbaryl, aldicarb, and their main metabolites in honeybees by liquid chromatography-mass spectrometry detection[J]. Talan ta, 2006, 69(3)∶724-729. DOI∶10.1016/j.talanta.2005.11.012.
[7] 路海燕, 李斌, 陈忠正, 等. 基质固相分散-HPLC检测绿茶茶汤中吡虫啉和啶虫脒残留[J]. 食品科学, 2013, 34(20)∶ 203-206.DOI∶10.7506/spkx1002-6630-201320043.
[8] 陈冬东, 侯士聪, 代汉慧, 等. 固相萃取/高效液相色谱-串联质谱法测定食品中涕灭威及其代谢产物涕灭 威亚砜与涕灭威砜残留量[J]. 分析测试学报, 2011, 30(12)∶ 1367-1371. DOI∶10.3969/j.is sn.1004-4957.2011.12.007.
[9] 丁葵英, 吕文刚, 孙军, 等. 分散固相萃取/高效液相色谱法检测大葱中虫酰肼、涕灭威及其衍生物的农药残留[J]. 分析测试学报, 2011,30(3)∶ 312-315. DOI∶10.3969/j.issn.1004-4957.2011.03.016.
[10] 丁葵英, 许文娟, 李凯, 等. 液相色谱-串联质谱法研究涕灭威及其代谢物在白菜中的动态行为[J]. 色谱, 2016, 34(2)∶ 165-169.DOI∶10.3724/SP.J.1123.2015.08018.
[11] HU J Y, ZHEN Z H, DENG Z B. Simultaneous determination of acetochlor and propisochlor residues in corn and soil by solid phase extraction and gas chromatography with electron capture detection[J].Bulletin of Environmental Contamination and Toxicology, 2011,86(1)∶ 95-100.
[12] 刘志聪, 谷方红, 王德良, 等. 固相萃取-气相色谱-质谱联用法测定啤酒大麦中抗蚜威、乙草胺、三唑酮的残留量[J]. 食品与发酵工业, 2009, 35(4)∶ 158-162.
[13] 蒋金花, 吴声敢, 陈江滨, 等. 三唑酮对斑马鱼和稀有鮈鲫不同生长阶段的急性毒性比较[J]. 生态毒理学报, 2015, 10(5)∶ 150-156.DOI∶10.7524/AJE.1673-5897.20141118002.
[14] 张帅, 李世雄, 杨太新, 等. 苯醚甲环唑和吡唑醚菌酯混合物对炭疽病菌的联合毒力及药效[J]. 植物保护, 2013, 39(6)∶ 160-163.DOI∶10.3969/j.iss n.0529-1542.2013.06.031.
[15] 刘艳萍, 孙海滨, 刘景梅. 三唑酮在荔枝果实和果园土壤的残留动态分析[J]. 广东农业科学, 2007(6)∶ 60-62.
[16] 农业部, 国家卫生计生委. 食品中农药最大残留限量∶ GB 2763—2014[S]. 北京∶ 中国标准出版社, 2014.
[17] 沈伟健, 余可垚, 桂茜雯, 等. 分散固相萃取-气相色谱-串联质谱法测定蔬菜中107 种农药的残留 量[J]. 色谱, 2009, 27(4)∶ 391-400.
[18] 施家威, 李继革, 王玉飞, 等. 分散固相萃取-气相色谱-三重四级杆质谱分析蔬菜中112 种农药残留[J]. 色谱, 2012, 30(6)∶ 602-612.DOI∶10.3724/SP.J.1123.2012.02019.
[19] 金芬, 史晓梅, 于志勇, 等. 分散固相萃取-液相色谱-串联质谱法测定水果中19 种酸性农药[J]. 分析化学, 2013, 41(3)∶354-359.DOI∶10.3724/SP.J.1096.2013.20750.
[20] HE Z Y, WANG L, PENG Y, et al. Multiresidue analysis of over 200 pesticides in cereal using a QuEChERS and gas chromatographytandem mass spectrometry-based method[J]. Food Chemistry, 2015,169(15)∶ 372-380. DOI∶10.1016/j.foodchem.2014.07.102.
[21] BIZIUK M, STOCKA J. Multrresidue methods for determination of currently used pesticides in fruits and vegetables using QuEChERS technique[J]. International Journal of Environmental Science and Development, 2015, 6(1)∶ 18-22. DOI∶10.7763/IJESD.2015.V6.554.
[22] 闫震, 聂继云, 徐国锋, 等. 超高效液相色谱-串联质谱法对比4 种净化方式对不同色素含量基质中19 种农药残留检测的影响[J]. 分析测试学报, 2014, 33(9)∶ 1000-1009. DOI∶10.3969/j.issn.1004-4957.2014.09.004.
[23] 沈伟健, 桂茜雯, 余可奎, 等. 气相色谱-负化学离子源质谱测定大豆和玉米中12 种三唑类杀菌剂的残留量[J]. 色谱, 2009, 27(1)∶ 91-95.
[24] 江泽军, 张鹏, 李永飞, 等. 分散固相萃取-高效液相色谱-串联质谱法测定水稻和土壤中的福美双与甲霜灵残留[J]. 农药学学报, 2015,17(3)∶ 313-320. DOI∶10.3969/j.issn.1008-7303.2015.03.10.
[25] 黄宝勇, 潘灿平, 张微, 等. 应用分析保护剂补偿基质效应与气相色谱-质谱快速检测果蔬中农药多残留[J]. 分析测试学报, 2006, 25(3)∶ 11-16.
[26] 国家质量监督检验检疫总局. 分析方法检出限和定量限的评估∶GB/T 27415—2013[S]. 北京∶ 中国标准出版社, 2013.
[27] 郑姝宁, 李凌云, 林桓, 等. 超快速液相色谱-串联质谱法快速筛查蔬菜中176 种农药的残留量[J]. 色谱, 2013, 31(1)∶ 71-78. DOI∶10.3724/SP.J.1123.2012.07033.
[28] 褚能明, 孟霞, 康月琼, 等. 分散固相萃取-气相色谱-串联质谱法测定茉莉花茶中86 种农药残留[J]. 食品科学, 2016, 37(24)∶ 239-246.DOI∶10.7506/spkx1002-6630-201624038.
[29] 标准化管理委员会, 质量监督检验检疫总局. 粮谷中486 种农药及相关化学品残留量的测定∶ GB/T 20770—2008[S]. 北京∶ 中国标准出版社, 2008.
[30] 农业部, 国家计生委, 食品药品监督管理总局. 水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法∶ GB 23200.8—2016[S]. 北京∶ 中国标准出版社, 2016.
Determination of Six Pesticide Residues in Classic Minor Crops by Liquid Chromatography-Tandem Mass Spectrometry with Dispersive Solid Phase Extraction
ZHAO Fengnian, ZHENG Lufei, SHE Yongxin*, ZHANG Chao, HONG Sihui, LI Hui, CAO Xiaolin,WANG Shanshan, JIN Maojun, JIN Fen, SHAO Hua, WANG Jing*
(Key Laboratory for Agro-Product Quality and Safety, Ministry of Agriculture, Institute of Quality Standard and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
中图分类号:O657.6;S482.3
文献标志码:A
文章编号:1002-6630(2017)20-0197-06
引文格式:
赵风年, 郑鹭飞, 佘永新, 等. 分散固相萃取-液相色谱-串联质谱法测定典型小宗作物中6 种农药残留[J]. 食品科学,2017, 38(20)∶ 197-202. DOI∶10.7506/spkx1002-6630-201720028. http∶//www.spkx.net.cn
收稿日期:2016-11-04
基金项目:国家自然科学基金面上项目(31471654);“十二五”国家科技支撑计划项目(2014BAD13B05-05);
中央级公益性科研院所基本科研业务费专项(1610072006009)
作者简介:赵风年(1992—),女,硕士研究生,研究方向为食品安全与检测技术。E-mail:zf_nian@126.com
*通信作者:佘永新(1972—),男,研究员,博士后,研究方向为食品安全与检测技术。E-mail:0891syx@163.com
王静(1963—),女,教授,博士,研究方向为食品安全与检测技术。E-mail:w_jing2001@126.com