刘慧琳,倪天鸿,周凯文,王 静*
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
摘 要:通过一步聚合法制备以双氰胺为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸为交联剂,偶氮二异丁腈为引发剂的分子印迹聚合物。通过扫描电子显微镜、红外光谱、紫外光谱等对材料的物理及化学性能进行表征。采用分子印迹固相萃取结合高效液相色谱法检测实际奶粉样品中的双氰胺残留。该方法的线性范围为0.01~2.00 mg/L,线性相关系数R2为0.999 4,呈现良好的线性关系,检出限(RSN=3)为0.57×10-2mg/L,样品加标回收率为102.5%~104%,相对标准偏差在0.21%~0.86%之间。
关键词:双氰胺;分子印迹聚合物;固相萃取;高效液相色谱
Abstract: A novel molecularly imprinted polymer was developed by a one-step polymerization using dicyandiamide as template, methacrylic acid as functional monomer, ethylene glycol dimethylacrylate as cross-linker, and azobisisobutyronitrile as initiator. The physicochemical properties of the prepared material were characterized by scanning electron microscopy, Fourier transform infrared spectroscopy, and ultraviolet spectroscopy. A molecularly imprinted solid phase extraction coupled with high performance liquid chromatography method was developed using this material to detect dicyandiamide in real milk powder samples. The linear range of this method was from 0.01 to 2.00 mg/L, with a correlation coeffi cient (R2) equal to 0.999 4, which had a good linear relationship. The limit of detection (LOD) was 0.57 × 10-2mg/L(RSN= 3). The recovery was ranged from 102.5% to 104%, and the relative standard deviation was between 0.21% and 0.86%.
Key words: dicyandiamide; molecularly imprinted polymers (MIP); solid-phase extraction; high performance liquid chromatography (HPLC)
DOI∶10.7506/spkx1002-6630-201720029
双氰胺(dicyandiamide,DCD),又称二氰二胺,是一种溶于水的白色粉末状物质。DCD常作为硝化抑制剂[1]来缓解氮肥的分解和转化[2-3],以提高对氮肥的利用率[4-6]。但残留的DCD会通过食物链会进入奶牛体内从而对奶源造成污染[7]。2014年新西兰的DCD污染事件引起了国内外的广泛关注。DCD的积累会对人体尤其是婴幼儿的健康产生危害[8-9],因此需要建立一种快速高效的检测机制。
到目前为止,已有多种方法可用于DCD残留的检测,包括高效液相色谱(high performance liquid chromatograph,HPLC)法[10-11]、光谱法[12]、液相色谱-质谱联用法[13-15]、气相色谱法、荧光检测法[16]、拉曼光谱法[17]等。HPLC法预处理步骤较多且样品易受杂质干扰;紫外检测法前处理简单方便,但灵敏度较低;气相色谱法灵敏度高,但需进行衍生化处理,不够便捷;液相色谱-质谱联用法成本较高且需要复杂的预处理过程。
分子印迹技术作为一项新兴技术,其合成的分子印迹聚合物(molecularly imprinted polymers,MIP)具有高选择性、高稳定性、高适用性等特点[18-21]。固相萃取技术作为一种吸附萃取技术,因其能良好地适应各种成分复杂的实际样品且试剂用量较少而被广泛使用[22-23]。将两者相结合不仅可以除去实际样品中的干扰基质,而且能够有效地解决各种复杂实际样品的内源性干扰。样品经过处理后可直接进入HPLC等仪器中进行检测。最近,分子印迹固相萃取(molecularly imprinted solid phase extraction,MISPE)由于其简单方便、成本低廉、精准快速[24-26],已成为一个新的研究热点[27-30]。
本实验采用MISPE的方法,选取DCD为模板分子,甲基丙烯酸(methacrylic acid,MAA)为功能单体,乙二醇二甲基丙烯酸(ethylene glycol dimethacrylate,EGDMA)为交联剂,偶氮二异丁腈(azobisisobutyronitrile,AIBN)为引发剂通过一步聚合法制备得到MIP。通过与固相萃取-HPLC技术联用,高效、灵敏、准确地分离检测奶粉中的DCD残留。本方法为复杂基质中小分子有机物的分离富集提供了一种新型、高效的检测方法。
1.1 材料与试剂
乙腈(分析纯) 赛默飞世尔科技有限公司;无水甲醇、二水合磷酸二氢钠(均为分析纯) 西陇化工股份有限公司;乙二醇二甲基丙烯酸酯(纯度99%) 北京索莱宝科技有限公司;甲基丙烯酸(纯度99%)、氨水(分析纯) 国药集团化学试剂有限公司;偶氮二异丁腈(纯度99%)、DCD(纯度99%)、氰胺(纯度99%)、三聚氰胺(纯度99%)、三聚氰酸(纯度99%)北京百灵威科技有限公司;十二水合的磷酸氢二钠(分析纯) 北京化工厂。
1.2 仪器与设备
SHZ-82A恒温振荡器 常州国华电器有限公司;WG9220A电热鼓风干燥箱 天津市通利信达仪器厂;Cary 100 UV-Vis紫外分光光度计 安捷伦科技有限公司;VELOCITY 18R大容量冷冻离心机 澳大利亚Dynamica公司;DF-101S集热式恒温加热磁力搅拌器予华仪器有限责任公司;Vertex 70傅里叶红外光谱仪德国Bruker公司;S-4800扫描电子显微镜 日立集团;MX-F涡旋振荡器 大龙兴创实验仪器有限公司;LC-20AT HPLC仪 日本岛津公司;UGC-24M氮吹仪北京优晟联合科技有限公司。
1.3 方法
1.3.1 HPLC条件
色谱柱:Inertsil ODS-SP(4.6 mm×150 mm,5 μm);柱温30 ℃;流速0.2 mL/min,流动相:B相(乙腈)-A相(水)(3∶7,V/V),进样体积5 μL。
1.3.2 MIP制备
将DCD 84.08 mg与MAA 0.945 mL和EGDMA 0.945 mL按1∶4∶5的比例依次加入25 mL的圆底烧瓶中并加入45 mL的引发剂AIBN,密封后将其置于60 ℃的恒温油浴锅中反应24 h。最后得到白色块状的固体,充分研磨后过筛,直到所有的MIP均能被筛下。最后用甲醇经索氏提取器洗模板分子10~20 h,洗后将聚合物烘干备用。作为对照实验,制备了非印迹聚合物(non-imprinted polymer,NIP)其操作过程除不加模板分子DCD之外,一切操作皆和上述步骤相同。
1.3.3 pH7.5缓冲溶液的配制
取二水合磷酸二氢钠6.2 g溶于蒸馏水中并定容至200 mL,并将其作为A液。再取14.3 g的二水合磷酸氢二钠溶于蒸馏水中,定容至200 mL作为B液。取A液8 mL和B液42 mL充分搅拌、混匀后再取混合液20 mL并加蒸馏水定容至200 mL制成浓度为0.02 mol/L、pH 7.5的磷酸缓冲溶液。
1.3.4 标准溶液的配制
取200 mg的DCD溶于蒸馏水中,充分混匀,静置20 min,最后定容至200 mL容量瓶中制成1 g/L的DCD母液。临用时通过梯度稀释配制成质量浓度0.01~5 mg/L的标准溶液。三聚氰胺、三聚氰酸、氰胺的标准溶液配制过程皆同上述操作步骤相同。
1.3.5 MIP吸附性检测
1.3.5.1 MIP的静态吸附
取20 mg的MIP加入到5 mL的DCD溶液中。该DCD溶液是取不同质量DCD溶于pH7.5缓冲溶液之中而制成,质量浓度范围为0.001~1 mg/mL。将其放入恒温振荡器中室温振荡24 h。再放入大容量离心机中,在5 000 r/min离心20 min,离心后过滤,取上清溶液,稀释200 倍,放入紫外分光光度计中检测。测出的吸光度通过标准溶液曲线算出DCD所对应的质量浓度,根据下式确定所对应的吸附量(Q):
式中:C0为该溶液的标准质量浓度;Cfree为所测得的吸光度对应质量浓度;V为DCD溶液的体积;W为所添加聚合物的质量。
1.3.5.2 MIP的动态吸附
取20 mg的MIP加入到1 mg/mL的DCD溶液中。在室温的条件下经过不同的振荡时间(5、10、20、30、60、90、120、180、240 min),在5 000 r/min离心20 min,过滤,取上清液并稀释200 倍。最后加入1 cm石英比色皿,以pH 7.5的缓冲溶液作为空白试剂,放入紫外分光光度计内测得吸光度。所得的吸光度根据标准曲线得出相对应的质量浓度。
1.3.5.3 MIP的竞争性吸附
选取DCD、三聚氰胺、氰胺、三聚氰酸,各配制成0.01、0.001 mg/mL两种质量浓度的溶液,再分别在两种浓度的溶液中添加20 mg的MIP和NIP,后放入恒温振荡器中振荡24 h。在5 000 r/min离心20 min,过滤,取上层清液,稀释200 倍。分别加入1 cm比色皿中,以pH 7.5的缓冲溶液作为空白试剂,4 种分析物分别在波长为219、212、205、194 nm的条件下进行吸光度检测。通过标准曲线得出不同的质量浓度。
1.3.6 MISPE预处理
1.3.6.1 MISPE柱的制备
准确称取70 mg MIP添加到准备好的固相萃取空柱之中,使萃取柱内的聚合物不泄出。作为对照实验,制取非印迹固相萃取(non-imprinted polymer solid phase extraction,NISPE)柱,其操作除添加的柱料是NIP外皆同上述步骤相同。
1.3.6.2 MISPE柱洗脱液优化
取1 g/L的DCD溶液,梯度稀释成2 mg/L的标准溶液充当MISPE的上样液,以乙腈-甲醇(3∶1,V/V)为淋洗液,洗脱液分别为纯甲醇、甲醇-氨水(9∶1,V/V)、甲醇-氨水(8∶2,V/V)为洗脱液。以相同质量浓度的DCD溶液充当NIP固相萃取柱的洗脱液,淋洗液相同,洗脱液为纯甲醇。收集后,在50 ℃条件下氮吹,随后以乙腈复溶,进行HPLC仪检测。
1.3.7 实际样品的处理
1.3.7.1 奶粉样品的处理
取2 g奶粉样品加入到10 mL乙腈中,振荡1 min,再超声20 min后,在10 000 r/min条件下离心20 min。过滤,取上层清液,以此上清液为上样液。乙腈-甲醇(9∶1,V/V)为淋洗液,洗脱液为甲醇-氨水(9∶1,V/V)。收集洗脱液并在氮吹浓缩仪中吹干,乙腈复溶后进行HPLC检测。
1.3.7.2 奶粉样品的加标处理
取不同量的DCD溶于乙腈之中,制成质量浓度2、1、0.5 mg/L的DCD溶液,将其分别加入到上述处理的奶粉样品中,进行HPLC加标回收检测。
1.4 数据统计分析
本实验皆重复3 次取平均值,实验数据以 ±s表示。采用OriginPro 8.5.1软件进行绘图,采用SPSS Statistics 17.0进行显著性分析。
2.1 结构表征
2.1.1 扫描电镜检测结果

图1 MIP(a)和NIP(b)的扫描电镜图
Fig. 1 Scanning electron micrographs of MIP (a) and NIP (b)
由图1可以看出,MIP的表面结构较为粗糙,这是因为当制备好的MIP经过洗模板后,目标物分子DCD被洗脱下来,MIP内部形成一个特异性的空穴结构。而NIP表面较为光滑,没有很强的凹凸感,排列也相对致密一点,则是因为其并没有参与洗脱模板分子的过程。
2.1.2 傅里叶红外光谱检测
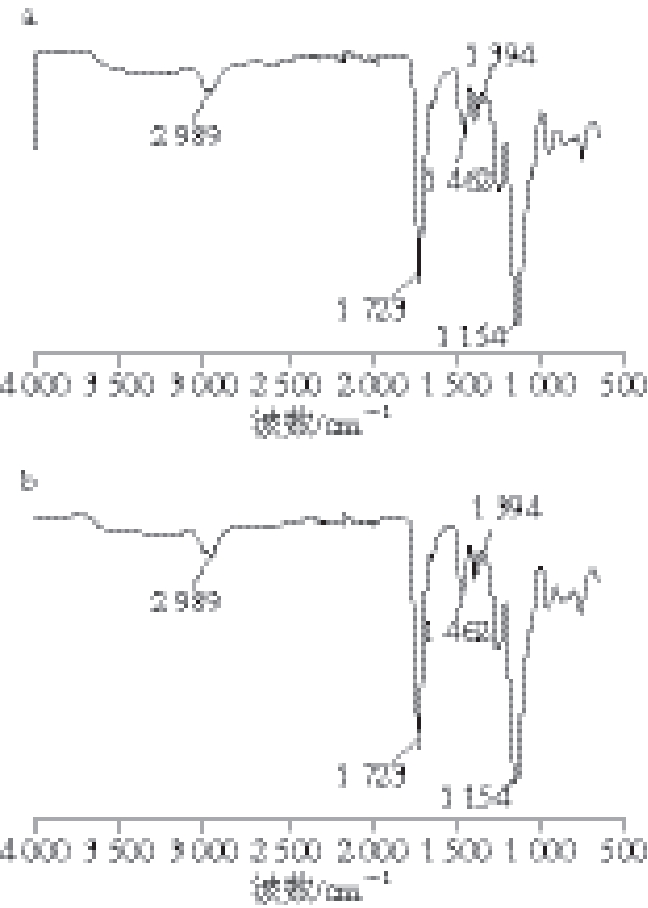
图2 MIP(a)和NIP(b)傅里叶红外光谱图
Fig. 2 FT-IR spectra of MIP (a) and NIP (b)
从图2可以看出,二者具有一些相同的特征吸收峰,这是由于MIP和NIP本身具有相同的化学组成成分,1 723 cm-1处是—C=O键的伸缩振动特征吸收峰,代表着MIP和NIP都存在—COOH键。2 941 cm-1和2 989 cm-1(C—H),1 651 cm-1(C=C),1 462 cm-1(带芳香环C=C),1 394 cm-1(C—O),1 154 cm-1(C—N),1 723 cm-1(C=O),这些说明交联剂乙二醇二甲基丙烯酸酯已经成功地将印迹聚合物进行了交联。
2.2 MIP的吸附性能分析
2.2.1 MIP的静态吸附分析

图3 DCD对MIP和NIP的静态吸附曲线
Fig. 3 Binding isotherms of MIP and NIP for DCD
如图3所示,MIP和NIP对DCD的吸附性随着初始质量浓度的增加而增加。在0.001~0.1 mg/mL之间其聚合物吸附量的增加速率基本稳定,而在0.1 mg/mL之后吸附量的增长速率逐渐减少,吸附量趋于平衡。由此可以看出在质量浓度0.1 mg/mL左右聚合物基本吸附完成。
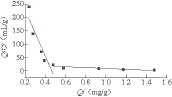
图4 MIP的Scatchard方程分析图
Fig. 4 Scatchard equation analysis of MIP
如图4所示,两条直线是对图中散点分两部分进行线性回归制成的,其方程分别为Q/C=405.81-865.16Q和Q/C=17.72-9.89Q,其中C为吸附后的平衡质量浓度(mg/mL)。根据两个方程的截距和斜率可以得出其最大吸附量Qmax分别为0.61 mg/g和1.79 mg/g,以及其解离常数Kd分别为0.001 2 mg/mL和0.101 mg/mL。可以看出Q/C和Q并不是呈线性关系。这是因为当质量浓度较低时,吸附还未完全,主要是通过物理手段来进行吸附的,所以Qmax值比较低。而质量浓度较高时,吸附已经完成,则是通过化学位点结合的方式完成吸附,吸附效果较好,Qmax值就较高。
2.2.2 MIP的动态吸附分析
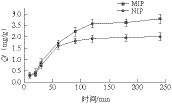
图5 DCD对MIP和NIP的动态吸附曲线
Fig. 5 Binding kinetic curves of MIP and NIP for DCD
如图5可知,DCD对MIP和NIP的吸附程度随着时间的延长而增加。在0~120 min内的吸附量增长速率基本趋于恒定,而在超过120 min后增长速率突然减少,其曲线趋于平缓。聚合物在120 min左右的时间内可以完成吸附。
2.2.3 MIP的竞争性吸附分析

图6 不同基质对MIP和NIP(0.01 mg/mL)吸附对比
Fig. 6 Binding behaviors of different substrates on MIP and NIP (0.01 mg/mL)

图7 不同基质对MIP和NIP(0.001 mg/mL)吸附对比
Fig. 7 Binding behaviors of different substrates on MIP and NIP (0.001 mg/mL)
表1 不同质量浓度的印迹因子和选择性因子
Table 1 Imprinting factor and selectivity factor at different concentrations

注:QMEL、QCA、QCM分别为MIP对三聚氰胺、三聚氰酸、氰胺的吸附量。
为了评价所制备材料的性能,选择DCD结构类似物氰胺、三聚氰胺和三聚氰酸进行研究。实验选择0.01 mg/mL和0.001 mg/mL两个质量浓度,如图6、7所示,两个质量浓度下MIP对于DCD的选择性较好,均大于其结构类似物的选择性。对其选择性因子和印迹因子进行计算,结果如表1所示,两种质量浓度下DCD的选择性因子均大于1.7。说明所制备的MIP对于目标物DCD具有较好的吸附效果,其原因在于MIP在制备过程中,加入了模板分子,洗脱后在聚合物的内部及表面形成了对目标物DCD的特异性孔穴。NIP在两个质量浓度下对DCD的吸附值相较于MIP均降低至原来的1/2,对其余竞争物的吸附效果也不明显,计算印迹因子均大于2,说明所制备的MIP的吸附性能远大于NIP。由此可以看出该MIP对DCD的特异选择性良好,可用于充当MISPE的柱料对DCD进行分离、提取。
2.3 MISPE提取液优化分析
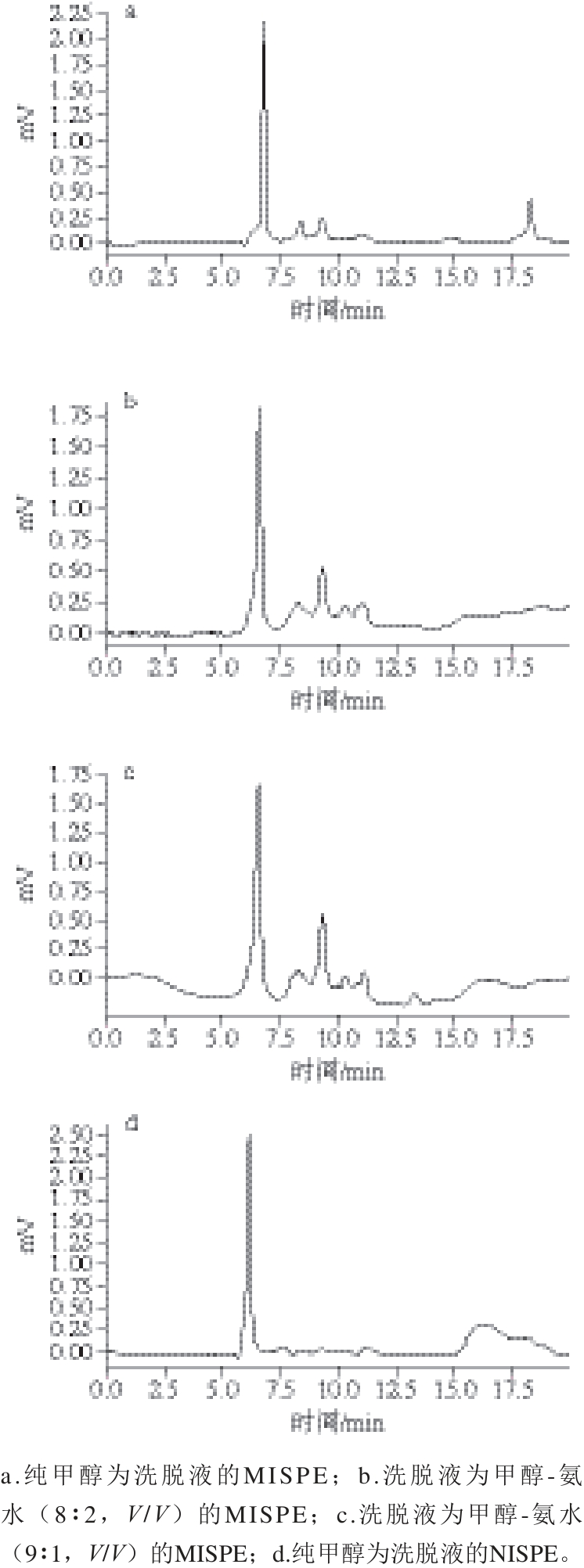
图8 不同甲醇-氨水比例洗脱液MISSPPEE/NISPE的HHPPLLCC
Fig. 8 MISPE/NISPE liquid chromatography with methanol-ammonia mixtures at different ratios as elution solutions
由图8可知,在9.28~9.30 min时有明显的峰面积出现。而相同质量浓度下以甲醇-氨水(9∶1,V/V)为洗脱液的MISPE在HPLC中的峰面积最大,回收率为86%,而以纯甲醇为洗脱液的MISPE所测得的回收率为34.5%,以甲醇-氨水(8∶2,V/V)为洗脱液的MISPE所测得的回收率为77%,由此可知以甲醇-氨水(9∶1,V/V)为洗脱液的洗脱效果最佳。而由图8d可知,以纯甲醇为洗脱液的NISPE所测得的色谱峰面积非常小,回收率仅为3%。以此相比,以相同洗脱液的MISPE回收率远高于NISPE。证明以MISPE的柱料较好,且洗脱液为甲醇-氨水(9∶1,V/V)最好。
2.4 DCD标准曲线
DCD的标准曲线方程为y=79 278x-849.827,线性范围为0.01~2.00 mg/L,R2为0.999 4,检出限(RSN=3)为0.57×10-2mg/L。
2.5 实际样品HPLC分析
2.5.1 奶粉样品的HPLC分析

图9 奶粉样品的HPLC图
Fig. 9 Liquid chromatogram of milk powder sample
从图9可以看出,在9.28~9.30 min之间皆无明显的峰面积。以此可知在实际样品中DCD的含量非常微小,不足以被HPLC仪检测出来。从图9a可以看出,未过固相萃取的色谱图杂峰较多,峰形较宽。而图9b的色谱峰的杂峰较少且峰形较好,由此可以看出MISPE的效果良好。
2.5.2 奶粉样品加标的HPLC分析
为了验证所建立方法的准确性,进行了加标回收实验。由表2可知,添加量分别为2、1 mg/L和0.5 mg/L,每个添加水平重复3 次。平均回收率别为102.5%、103%和104%,相对标准偏差在0.21%~0.86%之间,样品回收率较好。证明MISPE充当吸附柱料对DCD的特异选择性较好,所开发的方法可以用于实际样品中DCD的检测研究。
表2 奶粉中DCD的加标回收率(n=3)
Table 2 Recoveries of DCD spiked in milk powder (n=3)

此外,将所建立的分子印迹-固相萃取-HPLC技术与传统的HPLC技术相比较,本实验的线性范围明显更宽,检出限降低了2个数量级,说明所制备的分子印迹吸附材料具有较好的选择特异性,将其作为固相萃取填料后,可以提高方法的精密度与准确性。
在乳制品中残留的痕量DCD会对人体健康构成威胁,因此,本实验以MIP作为固相萃取吸附剂,结合HPLC技术,建立了一种DCD的检测方法。该方法的线性范围为0.01~2.00 mg/L,相关系数R2为0.999 4,检出限为0.57×10-2mg/L。对于复杂样品中DCD的检测具有满意的回收率和精确性,可用于实际样品中对DCD残留的测定。该方法的建立为开展DCD污染控制和形成机制研究提供一定的理论基础和技术支持。
参考文献:
[1] MONAGHAN R M, SMITH L C, DE KLEIN C A M. The effectiveness of the nitrification inhibitor dicyandiamide (DCD)in reducing nitrate leaching and nitrous oxide emissions from a grazed winter forage crop in southern New Zealand[J]. Agriculture,Ecosystems & Environment, 2013, 175∶ 29-38.
[2] 刘源, 钱薇, 徐仁扣. 双氰胺对施氮肥引起的红壤酸化的抑制作用[J].生态与农村环境学报, 2013(1)∶ 76-80.
[3] 宁建凤, 崔理华, 艾绍英, 等. 两种硝化抑制剂对土壤氮转化的影响[J].农业工程学报, 2015, 31(4)∶ 144-151.
[4] 戴宇, 贺纪正, 沈菊培. 双氰胺在农业生态系统中的应用效果及其影响因素[J]. 应用生态学报, 2014(1)∶ 279-286.
[5] 张立亚. 奶粉中双氰胺的风险评估及其实时直接分析检测技术研究[D]. 北京∶ 北京化工大学, 2015.
[6] DUNCAN E G, O’SULLIVAN C A, SIMONSEN A K, et al.A composite guanyl thiourea (GTU), dicyandiamide (DCD)inhibitor improves the efficacy of nitrification inhibition in soil[J]. Chemosphere, 2016, 163∶ 1-5. DOI∶10.1016/j.chemosphere.2016.07.103.
[7] CHEN D, SUTER H C, ISLAM A, et al. Influence of nitrification inhibitors on nitrifi cation and nitrous oxide (N2O) emission from a clay loam soil fertilized with urea[J]. Soil Biology and Biochemistry, 2010,42(4)∶ 660-664. DOI∶10.1016/j.soilbio.2009.12.014.
[8] 周长美, 周靖平, 吴健, 等. 高效液相色谱测定工作场所空气中双氰胺方法的验证[J]. 江苏预防医学, 2009, 20(3)∶ 63-64. DOI∶10.3969/j.issn.1006-9070.2009.03.039.
[9] 周靖平, 金念祖. 双氰胺及其测定[J]. 中国卫生检验杂志, 2007(10)∶1921-1922.
[10] 徐继建, 刘华, 尚丽江. 高效液相色谱法测定复方二甲双胍格列本脲片中杂质双氰胺的含量[J]. 中国药房, 2006, 17(13)∶ 1015-1016.
[11] 王金平, 李红星, 陈建英, 等. HPLC法测定盐酸二甲双胍中有关物质双氰胺的含量[J]. 重庆中草药研究, 2011, 63(1)∶ 21-24.
[12] 史俊, 郑宏军, 刘祥, 等. Biacetyl反应在双氰胺光度法测定中的应用[J].西安石油学院学报(自然科学版), 1997, 12(5)∶ 46-48.
[13] 王祖翔, 蒋俊, 孙莉, 等. 高效液相色谱-串联质谱法测定食品中的尿素、缩二脲与双氰胺[J]. 分析测试报, 2012, 31(5)∶ 593-599.DOI∶10.3969/j.issn.1004-4957.2012.05.016.
[14] INOUE K, SAKAMOTO T, MIN J Z, et al. Determination of dicyandiamide in infant formula by stable isotope dilution hydrophilic interaction liquid chromatography with tandem mass spectrometry[J]. Food Chemistry, 2014, 156∶ 390-393. DOI∶10.1016/j.foodchem.2014.01.124.
[15] 桂茜雯, 余可垚, 袁芳, 等. 高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定乳制品中的双氰胺和三聚氰胺[J]. 环境化学,2013(12)∶ 2413-2415.
[16] LIU S Y, PANG S, HUANG H, et al. 3-Aminophenylboronic acidfunctionalized CuInS2quantum dots as a near-infrared fluorescence probe for the detection of dicyandiamide[J]. Analyst, 2014, 139(22)∶5852-5857. DOI∶10.1039/c4an01065e.
[17] LIN X, LOU X T, LIN D Y, et al. Direct and quantitative detection of dicyandiamide (DCD) in milk using surface-enhanced Raman spectroscopy[J]. Analytical Methods, 2015, 7(9)∶ 3869-3875.DOI∶10.1039/c5ay00313j.
[18] LI X X, PAN J M, DAI J D, et al. Removal of cefalexin using yeast surface-imprinted polymer prepared by atom transfer radical polymerization[J]. Journal of Separation Science, 2012, 35(20)∶ 2787-2795. DOI∶10.1002/jssc.201200397.
[19] LIN Z G, HE Q L, WANG L X, et al. Preparation of magnetic multifunctional molecularly imprinted polymer beads for determining environmental estrogens in water samples[J]. Journal of Hazardous Materials, 2013, 252∶ 57-63. DOI∶10.1016/j.jhazmat.2013.02.041.
[20] WEI F D, XU G H, WU Y Z, et al. Molecularly imprinted polymers on dual-color quantum dots for simultaneous detection of norepinephrine and epinephrine[J]. Sensors and Actuators B-Chemical, 2016, 229∶ 38-46. DOI∶10.1016/j.snb.2016.01.113.
[21] XIAO N, DENG J, CHENG J L, et al. Carbon paste electrode modifi ed with duplex molecularly imprinted polymer hybrid fi lm for metronidazole detection[J]. Biosensors & Bioelectronics, 2016, 81∶ 54-60. DOI∶10.1016/j.bios.2016.02.041.
[22] 陆克祥, 隋铭皓, 高乃云. 固相萃取-超高压液相色谱-串联质谱测定水中19 种抗生素[J]. 分析测试学报, 2010, 29(12)∶ 1209-1214.DOI∶10.3969/j.issn.1004-4957.2010.12.017.
[23] 吴仕辉, 陈昆慈, 戴晓欣, 等. 分散固相萃取/高效液相色谱法测定水产品中氯苯胍的残留量[J]. 分析测试学报, 2011, 30(12)∶ 1356-1361.DOI∶10.3969/j.issn.1004-4957.2011.12.005.
[24] CARO E, MAARCE R M, BORRULL F, et al. Application of molecularly imprinted polymers to solid-phase extraction of compounds from environmental and biological samples[J]. Trac-Trends Analytical Chemistry, 2006, 25(2)∶ 143-154. DOI∶10.1016/j.trac.2005.05.008.
[25] HE C Y, LONG Y Y, PAN J L, et al. Application of molecularly imprinted polymers to solid-phase extraction of analytes from real samples[J]. Journal of Biochemical and Biophysical Methods, 2007,70(2)∶ 133-150. DOI∶10.1016/j.jbbm.2006.07.005.
[26] ZHOU W H, GUO X C, ZHAO H Q, et al. Molecularly imprinted polymer for selective extraction of domoic acid from seafood coupled with high-performance liquid chromatographic determination[J].Talanta, 2011, 84(3)∶ 777-782. DOI∶10.1016/j.talanta.2011.02.004.
[27] 胡艳云, 徐慧群, 姚剑, 等. 分子印迹固相萃取-液相色谱-质谱法测定果蔬中20 种三唑类农药残留[J]. 分析化学, 2014, 42(2)∶ 227-232.DOI∶10.3724/SP.J.1096.2014.30788.
[28] 汤凯洁, 罗秋水, 余瑞龙, 等. 分子印迹固相萃取/高效液相色谱法测定猪肝中盐酸克伦特罗的方法研究[J]. 分析测试学报, 2016, 35(1)∶115-118. DOI∶10.3969/j.issn.1004-4957.2016.01.020.
[29] REN C. Molecular imprinting technique and its application in food industry[J]. Agricultural Science & Technology, 2016, 17(7)∶ 1533-1540. DOI∶10.16175/j.cnki.1009-4229.2016.07.005.
[30] JI S L, ZHANG F F, LUO X, et al. Synthesis of molecularly imprinted polymer sorbents and application for the determination of aminoglycosidess antibiotics in honey[J]. Journal of Chromatography A, 2013, 1313(19)∶ 113-118. DOI∶10.1016/j.chroma.2013.08.072.
Molecularly Imprinted Solid-Phase Extraction Coupled with High Performance Liquid Chromatography for the Detection of Dicyandiamide in Milk Powder
LIU Huilin, NI Tianhong, ZHOU Kaiwen, WANG Jing*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology & Business University (BTBU), Beijing 100048, China)
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)20-0203-06
引文格式:
刘慧琳, 倪天鸿, 周凯文, 等. 分子印迹固相萃取-高效液相色谱法检测奶粉中的双氰胺[J]. 食品科学, 2017, 38(20)∶203-208. DOI∶10.7506/spkx1002-6630-201720029. http∶//www.spkx.net.cn
LIU Huilin, NI Tianhong, ZHOU Kaiwen, et al. Molecularly imprinted solid-phase extraction coupled with high performance liquid chromatography for the detection of dicyandiamide in milk powder[J]. Food Science, 2017, 38(20)∶ 203-208. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720029. http∶//www.spkx.net.cn
收稿日期:2016-10-14
基金项目:国家自然科学基金青年科学基金项目(31501559);国家自然科学基金面上项目(31571940);
北京市教委一般项目(201610011004)
作者简介:刘慧琳(1987—),女,讲师,博士,研究方向为食品安全。E-mail:liuhuilin@btbu.edu.cn
*通信作者:王静(1976—),女,教授,博士,研究方向为食品营养与安全。E-mail:wangjing@th.btbu.edu.cn