王建华1,葛敏敏2,张慧丽2,林 洪2,汤志旭1,李 立3,*
(1.山东出入境检验检疫局检验检疫技术中心,山东 青岛 266002;2.中国海洋大学食品科学与工程学院,山东 青岛 266100;3.中国检验检疫科学研究院,北京 100176)
摘 要:样品经乙腈提取,C18吸附剂和石墨化碳黑分散固相萃取净化,液相色谱-三重四极杆串联质谱在动态多反应监测模式下检测,基质匹配标准曲线外标法进行定量,建立了蔬菜中7 种农药及其代谢物的多残留分析方法。在10、20 μg/kg 7种农药及其添加物添加水平下,农药及其代谢物的平均回收率为71.9%~117.8%,相对标准偏差为0.8%~9.6%,定量限为0.2~10 μg/kg。该方法简便、快速、灵敏,适用于蔬菜中多种农药及其代谢物的同时检测。
关键词:液相色谱-串联质谱;蔬菜;农药及其代谢物
Abstract: A method was developed for the simultaneous determination of 7 pesticide and metabolite residues in vegetables by employing quick, easy, cheap, effective, rugged and safe (QuEChERS) extraction coupled with liquid chromatography triple quadrupole mass spectrometry (LC-MS/MS). Samples were extracted with acetonitrile, and then the extract was purified by dispersive solid phase extraction (SPE) using graphite carbon black (GCB) and C18sorbent. The analytes were monitored by liquid chromatography-tandem triple quadrupole mass spectrometry in the dynamic multiple reaction monitoring (DMRM) mode, and quantifi cation was carried out by the external standard method with matrix-match standard solution. The recove ries at spiked levels of 10 and 20 μg/kg were in the range from 71.9% to 117.8% and the precision,expressed as relative standard deviation (RSD, n=3), ranged from 0.8% to 9.6% under the selected conditions. The limits of quantifi cation (LOQs) were in the range of 0.2–10 μg/kg. The method proved to be simple, fast, sensitive and useful for the analysis of the 7 pesticides and their metabolite residues in vegetables.
Key words: liquid chromatography-tandem mass spectrometry (LC-MS/MS); vegetables; pesticides and metabolites
为防止病虫害,农业经营者经常在蔬菜上使用各种农药,而造成残留。GB 2763—2014《食品中农药最大残留限量》[1]中包含多种蔬菜农药残留检测的方法,主要是针对农药母体的研究,很少关注农药代谢产物的同时检测,尽管有些多农残检测项目涉及代谢物,但是只含1~5 种农药及其代谢物[2-6]或者代谢物不全[7-10]。也有专门针对蔬菜水果中农药及其代谢物检测的研究报道[11-18],Hingmire等[11]建立了乙酸乙酯提取、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法测定秋葵中氟虫腈及其代谢物残留的检测方法。Plá cido等[12]采用QuEChERS法进行处理,建立了香蕉中甲硫威及其代谢甲 硫威砜和甲硫威亚砜检测的液相色谱-二极管阵列检测器法。吴成等[13]以乙腈作提取剂,采用LC-MS/MS建立了芹菜中甲拌磷及其代谢物甲拌磷亚砜和甲拌磷砜残留的快速检测方法。贺敏等[14]采用乙腈提取,固相萃取柱净化,超高效液相色谱-串联质谱(ultra high performance liquid chromatographytandem mass spectrometry,UHPLC-MS/MS)测定韭菜中氟虫腈及其代谢物。刘祥萍等[15]采用键合硅固相萃取吸附剂 (primary secondary arnine,PSA)+石墨化碳黑(graphitized carbon black,GCB)吸附剂、UHPLC-MS/MS测定芦蒿中7 种氨基甲酸酯类农药及其代谢物残留。马立利等[16]建立了多壁碳纳米管滤过型净化柱净化、HPLC-MS/MS同时测定生姜中涕灭威及其代谢物的分析方法。
实验选取7 种常见的农药涕灭威、克百威、苯线磷、倍硫磷、氟虫腈、甲硫威和甲拌磷,在农业生产中为经常使用的杀虫剂,GB 2763—2014以及欧盟等对其在蔬菜中的限量要求均包含代谢物,而国内关于蔬菜中多农药残留检测建立的方法中常常只有农药母体,较少关注代谢物的同时检测,部分有机磷农药代谢产物在食品中的残留富集对人体的伤害要远高于农药母体。农药及其代谢物的检测,对食品安全具有更重要的价值,是未来农药残留检测的热点和难点。要满足国内外关于具有代谢物的农药相关现行法规的限量要求,必须建立农药及其代谢物的同时检测方法。
目前,QuEChERS法已广泛应用于蔬菜水果农药残留分析中[19-22],LC-MS/MS具有较好的选择性和灵敏度[25]。本研究对QuEChERS法净化条件、MS/MS参数和流动相体系进行优化,选择C18吸附剂+GCB吸附剂对样品进行分散固相萃取净化,建立了蔬菜中7 种农药及其代谢物(涕灭威、涕灭威砜、涕灭威亚砜、克百威、3-羟基克百威、苯线磷、苯线磷砜、苯线磷亚砜、倍硫磷、倍硫磷砜、倍硫磷亚砜、氟虫腈、氟虫腈砜、氟虫腈亚砜、甲硫威、甲硫威砜、甲硫威亚砜、甲拌磷、甲拌磷砜、甲拌磷亚砜)检测的LC-MS/MS方法,该方法操作简单、快速,灵敏度较高,可完全满足欧盟、日本和美国的要求。
1.1 材料与试剂
十八烷基键合相硅胶(ODS C18-N)分散固相萃取吸附剂(粒径40~60 μm) 美国Agilent公司;石墨化碳黑(graphitized carbon blacks,GCB)粉吸附剂 天津艾杰尔公司;乙腈和甲醇(色谱纯) 德国Merck公司;甲酸、乙酸铵(均为色谱纯) 德国Fluka公司;农药及其代谢物(纯度均大于95%)购自德国Dr.Ehrenstorfe公司、美国Sigma Aldrich公司、美国Accu Standard公司。
1.2 仪器与设备
1200高效液相色谱、6430三重四极杆MS/MS、Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm)美国Agilent公司;MS3 Basic旋涡振荡器、HS501水平振荡器 德国IKA公司;KQ-300DE型数控超声仪清洗器 昆山市超声仪器有限公司;CR21 G冷冻离心机日本Hitachi公司;PL303电子天平 瑞士Mettler Toledo公司;Milli-Q超纯水装置(>18.3 MΩ) 美国Millipore公司。
1.3 方法
1.3.1 提取
称取10 g(精确至0.01 g)打碎均匀、浆状的蔬菜试样于50 mL具塞离心管中,准确加入10 mL纯乙腈,立即振荡,然后加入萃取盐包(含4 g MgSO4、1 g NaCl、1 g Na3Cit•2H2O、0.5 g Na2Cit•1.5H2O),剧烈振荡30 s,在水平振荡器上振荡20 min。8 000 r/min离心5 min后待净化。
1.3.2 净化
取6 mL乙腈提取液转移至装有900 mg硫酸镁、150 mg C18和60 mg GCB吸附剂的离心管中,盖紧离心管,涡旋10 min,8 000 r/min离心5 min,取净化液过0.22 μm滤膜后,取500 μL在氮气下吹干,加入500 μL甲醇-水(1∶1,V/V)混匀后上机分析。此净化方法适用于胡萝卜、冬瓜、南瓜、生姜和白萝卜等多种蔬菜样品。
1.3.3 LC-MS/MS条件
1.3.3.1 色谱条件
色谱柱:Agilent Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm);柱温30 ℃;进样量5 μL;流动相:A相为含0.1%(V/V)甲酸的5 mmol/L乙酸铵溶液,B相为纯甲醇;二元梯度洗脱分离,洗脱程序:0~3 min,95% A~75% A;3~10 min,75% A~40% A;10~21 min,40% A~2% A。
1.3.3.2 质谱条件
采用电喷雾离子源(electrospray ion source,ESI):电喷雾电压3 500 V,雾化气压力275.9 kPa,干燥气温度300 ℃,干燥气流速11.0 L/min(氮气);采集方式采用动态多反应监测(dynamic multiple reaction monitoring,DMRM)模式,正负离子同时扫描;氟虫腈砜和氟虫腈亚砜采用负离子扫描,其余化合物均采用正离子扫描。
2.1 MS/MS参数的优化结果
在ESI+模式下,涕灭威、氟虫腈和3-羟基克百威的[M+NH4]+峰稍高于[M+H]+峰,因此选择[M+NH4]+作为母离子,贺敏等[14]采用乙腈-甲酸溶液作为流动相,氟虫腈在ESI+模式下无响应,但在本研究条件下,氟虫腈在ESI+模式下的响应高于ESI-模式,这可能是因为流动相的不同;涕灭威亚砜、克百威、苯线磷、苯线磷亚砜、倍硫磷、倍硫磷亚砜、甲硫威、甲硫威亚砜、甲拌磷、甲拌磷亚砜的[M+H]+峰高于[M+NH4]+,因此选择[M+H]+作为母离子;氟虫腈亚砜和氟虫腈砜在ESI+模式下均无响应,在ESI-模式下,均有响应较高的[M-H]-峰,因此选择[M-H]-作为母离子。然后对子离子的选择、碎裂电压、碰撞能量等参数进行优化。
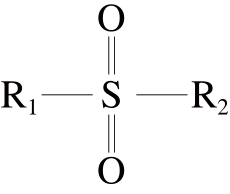
文献[4]中的涕灭威砜、苯线磷砜、甲硫威砜、甲拌磷砜选择[M+NH4]+作为母离子,倍硫磷砜选择[M+H]+作为母离子;文献[8]中的涕灭威砜、苯线磷砜、倍硫磷砜选择[M+H]+作为母离子;文献[9]中的涕灭威砜、苯线磷砜、甲拌磷砜选择[M+NH4]+作为母离子,倍硫磷砜和甲硫威砜选择[M+H]+作为母离子;以上文献报道和本研究的流动相中都含有甲酸铵或者乙酸铵,本实验在优化过程中,发现涕灭威砜、苯线磷砜、倍硫磷砜、甲硫威砜、甲拌磷砜5 种代谢物在全扫描中虽然母离子[M+H]+峰响应高于[M+NH4]+峰,但在子离子优化过程中[M+NH4]+峰母离子与其子离子的响应明显高于[M+H]+峰母离子与其子离子的响应,是其2.0~7.4 倍,如 涕灭威砜提取离子对色谱图见图1,因此选择母离子[M+NH4]+与其子离子作为分析离子对。以上5 种代谢物均为砜类化合物,通式为:

在铵离子环境下,砜类农药代谢物的这种现象可能与其结构有关。
另外,对于倍硫磷砜来说,[M+NH4]+作为母离子,只有一个子离子的响应高于[M+H]+与其子离子,因此倍硫磷砜选择母离子[M+NH4]+与其子离子(328.0>311.0)作为定量离子对,[M+H]+与其子离子(311.1>128.0)作为定性离子对。具体质谱条件数据见表1。
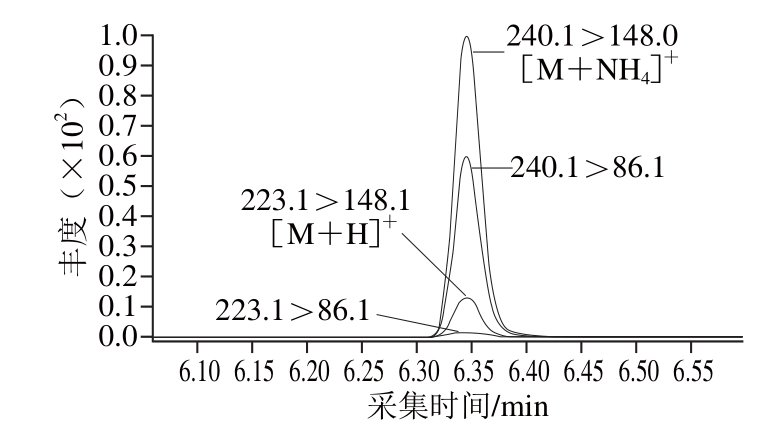
图1 涕灭威砜[M+H]+和[[M + NH4]+母离子及其子离子色谱图
Fig. 1 Chromatograms of the precursor ion [M+H]+and [M+NH4]+and their product ions of aldicarb-sulfone
表1 7 种农药及其代谢物的保留时间及质谱分析参数
Table 1 Retention time and mass spectral parameters for each compound
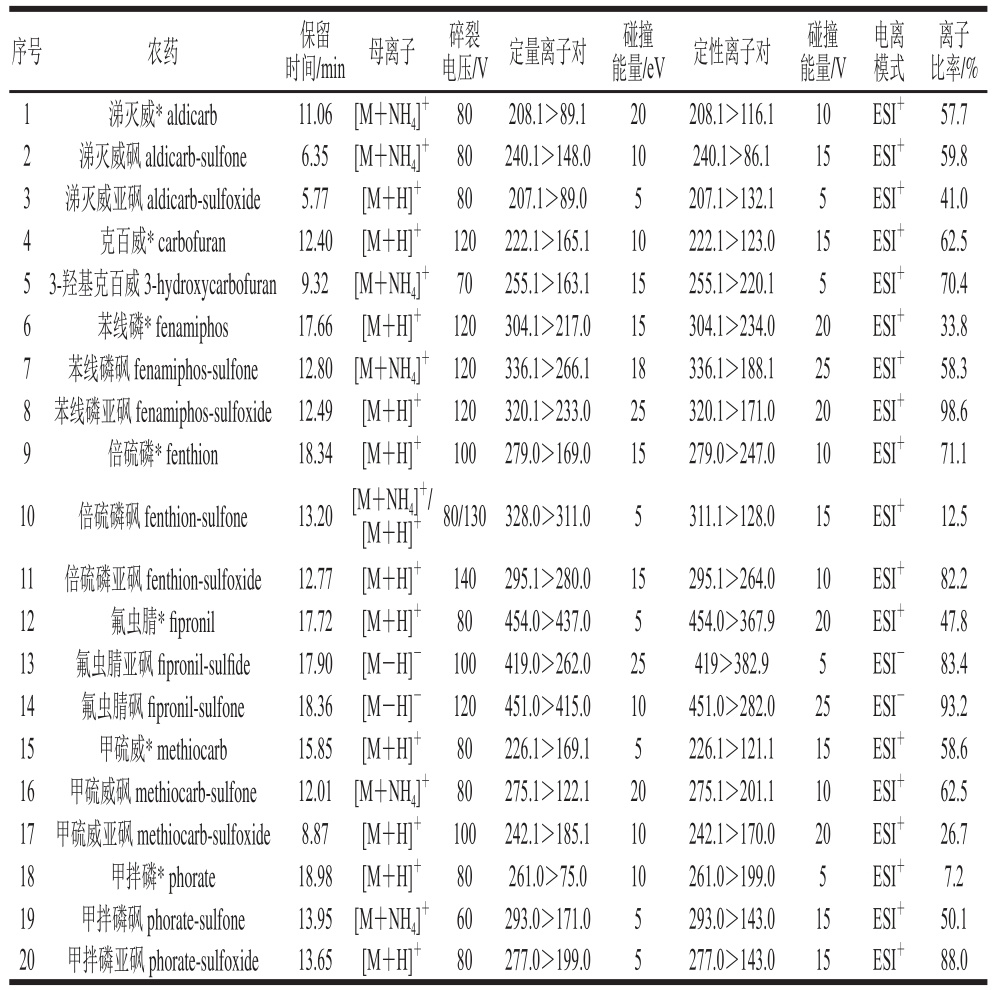
注:*.农药母体。
2.2 流动相的优化
为保证各农药化合物具有良好的峰形和足够的灵敏度,考察体系A:甲醇-含体积分数0.1%甲酸5 mmol/L乙酸铵溶液、体系B:乙腈-含体积分数0.1%甲酸5 mmol/L乙酸铵溶液、体系C:甲醇-5 mmol/L乙酸铵溶液3 种流动相体系,以7 种农药及其代谢物的质量浓度为20 μg/L为实验条件,3 种流动相体系下农药的峰面积比较见图2。
大部分农药及其代谢物在流动相体系C中的峰面积较高,苯线磷及其代谢物苯线磷砜和苯线磷亚砜、倍硫磷及其代谢物倍硫磷砜和倍硫磷亚砜、氟虫腈及其代谢物氟虫腈砜和氟虫腈亚砜、甲硫威、甲拌磷及其代谢物甲拌磷砜和甲拌磷亚砜13 种农药的峰面积在有机相为甲醇的流动相体系中是有机相为乙腈体系中的1.5~7.3 倍;其余7 种农药在体系A中的峰面积是体系B中的0.9~1.4 倍。在含甲酸和不含甲酸的流动相体系中,大部分农药的峰面积和峰形无明显变化,倍硫磷、甲拌磷亚砜的峰面积在不含甲酸的流动相体系中是含甲酸流动相的1.4 倍和2.9 倍,苯线磷、苯线磷砜、倍硫磷砜、倍硫磷亚砜、氟虫腈、氟虫腈亚砜的峰面积在含甲酸的流动相体系中是不含甲酸的流动相体系的1.2~1.6 倍。综合考虑最终选择甲醇-含0.1%甲酸5 mmol/L乙酸铵溶液作为流动相。
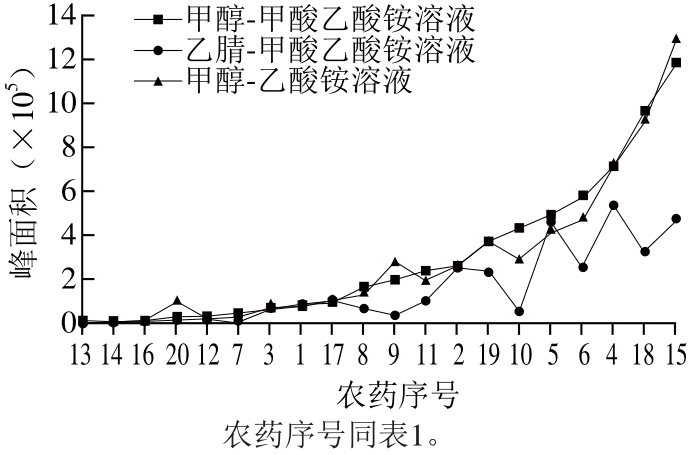
图2 流动相对目标化合物色谱峰响应值的影响
Fig. 2 Effect of mobile phase composition on peak area response for target compounds
2.3 样品溶剂对色谱峰峰形的影响
由于前处理中样品采用乙腈提取,农药及其代谢物的最终溶剂为乙腈,但是上机分析发现,流出较早的涕灭威亚砜(5.74 min)出现峰展宽、峰分叉现象,峰面积重现性差,取500 μL净化液在氮气下吹干,加入500 μL甲醇-水(1∶1,V/V)混匀后上机分析,涕灭威亚砜峰形显著改善,峰面积显著提高,如图3所示。
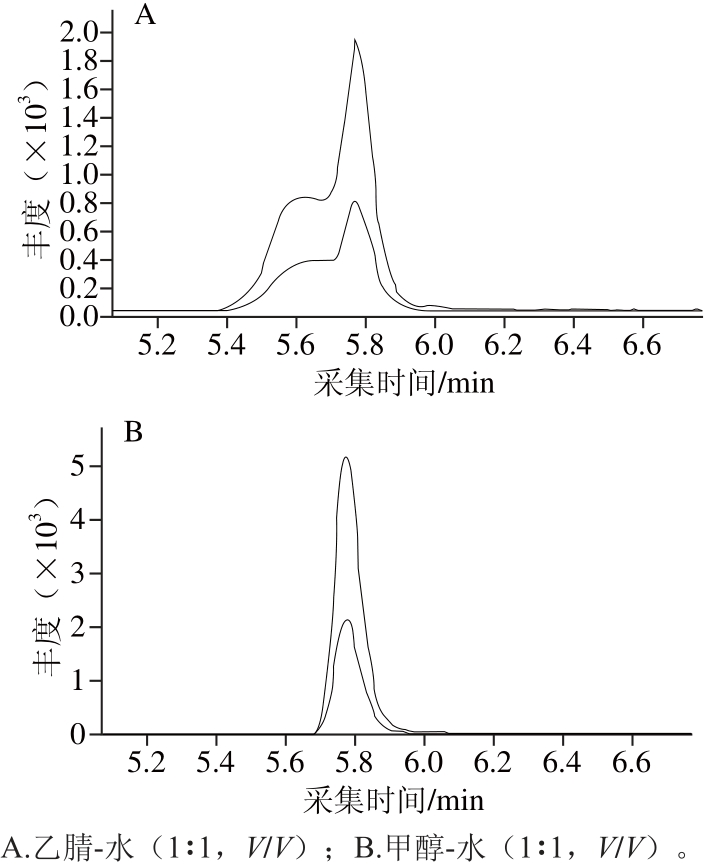
图3 不同溶液配制的10 μg/L标准溶液中涕灭威亚砜的提取离子色谱图
Fig. 3 Extracted ion chromatograms of aldicarb-sulfoxide at 10 μg/LL in different solutions
在反相高效液相色谱中,溶剂强度顺序:水(最弱)<甲醇<乙腈<乙醇<四氢呋喃<丙醇<二氯甲烷(最强)[23],当样品溶剂的洗脱强度强于流动相的洗脱强度时,就会产生峰的变形及柱效的降低,即溶剂效应。高效液相色谱测定时以流动相或者相近的溶剂溶解样品为最佳;或者用强溶剂溶解样品后,再用等体积的流动相稀释;还可以采用梯度洗脱的方法,延长目标组分的相对保留时间,以降低强溶解溶剂的影响[24]。
2.4 净化条件的选择
考察单独C18吸附剂和C18+GCB混合吸附剂对菠菜样品的净化效果和农药吸附情况,菠菜样品采用1.3节所述方法进行前处理,提取液颜色为墨绿色,采用单独C18吸附剂和C18+GCB混合吸附剂净化后,净化液的颜色分别为深绿色和浅绿色。GCB可以有效地去除基质中的色素,但也有文献[25]报道GCB对片状农药(如克百威)有一定的吸附性。菠菜样品添加水平为0.02 mg/kg,基质匹配标准曲线进行定量,2 种净化方式下7 种农药及其代谢物的回收率情况见图4。采用单独C18吸附剂净化,7 种农药及其代谢物的回收率在86.5%~124.4%范围内,相对标准偏差(relative standard deviations,RSD)为3.0%~9.0%;采用C18+GCB混合吸附剂净化,7 种农药及其代谢物的回收率在71.9%~113.1%范围内,RSD为0.8%~8.0%。从回收率来看,采用C18+GCB净化,所有农药及其代谢物的回收率均在合理范围(70%~120%)内。在本研究中,C18和GCB对目标农药均无明显吸附作用,因此,本实验最终采用C18+GCB作为分散固相萃取吸附剂。
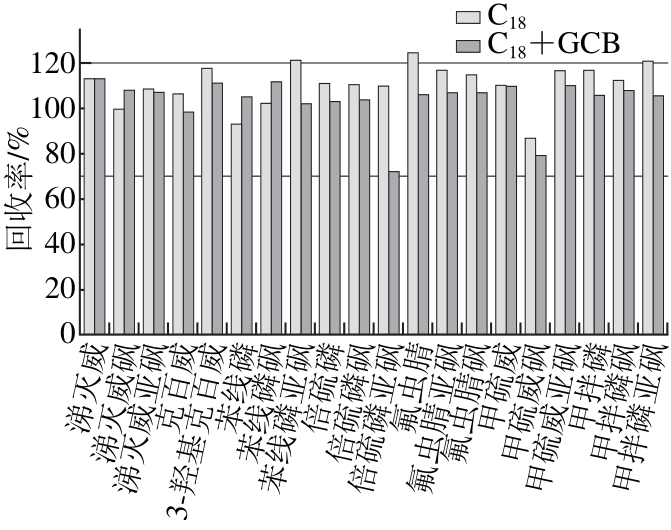
图4 2 种净化方式下7 种农药及其代谢物的回收率情况
Fig. 4 Effect of d-SPE sorbents on recovery of pesticides (n = 3) spiked at 20 μg/kg in spinach
2.5 基质效应
当采用ESI时,样品基质的存在会对目标物的电离产生抑制而增强的作用,即基质效应。基质效应的存在会相应地影响所建方法的性能参数[26],例如检出限、定量限、线性、精密度等。本研究以农药在基质中的信号峰面积与在溶剂标准溶液中的信号峰面积比值计算基质效应,若在85%~115%之间则认为不存在基质效应[27]。由图5可知,采用单独C18吸附剂净化时,氟虫腈、苯线磷表现为基质抑制效应,倍硫磷亚砜、甲硫威、甲硫威亚砜表现为基质增强效应,剩余的15 种农药不存在基质效应;采用C18+GCB净化时,大部分农药的基质效应适当减小,甲硫威砜和甲硫威亚砜仍表现为基质增强效应,剩余的18 种农药均不存在基质效应。为了更精确地定量甲硫威砜和甲硫威亚砜,选择基质匹配标准曲线进行定量。
表2 7 种农药及其代谢物的定量限、线性方程、相关系数、加标回收率和精密度
Table 2 Limits of quantitatiion, correlation coeffi cients, calibration curves, recoveries and relative standard deviations for 7 pesticides and their metabolites in spinach
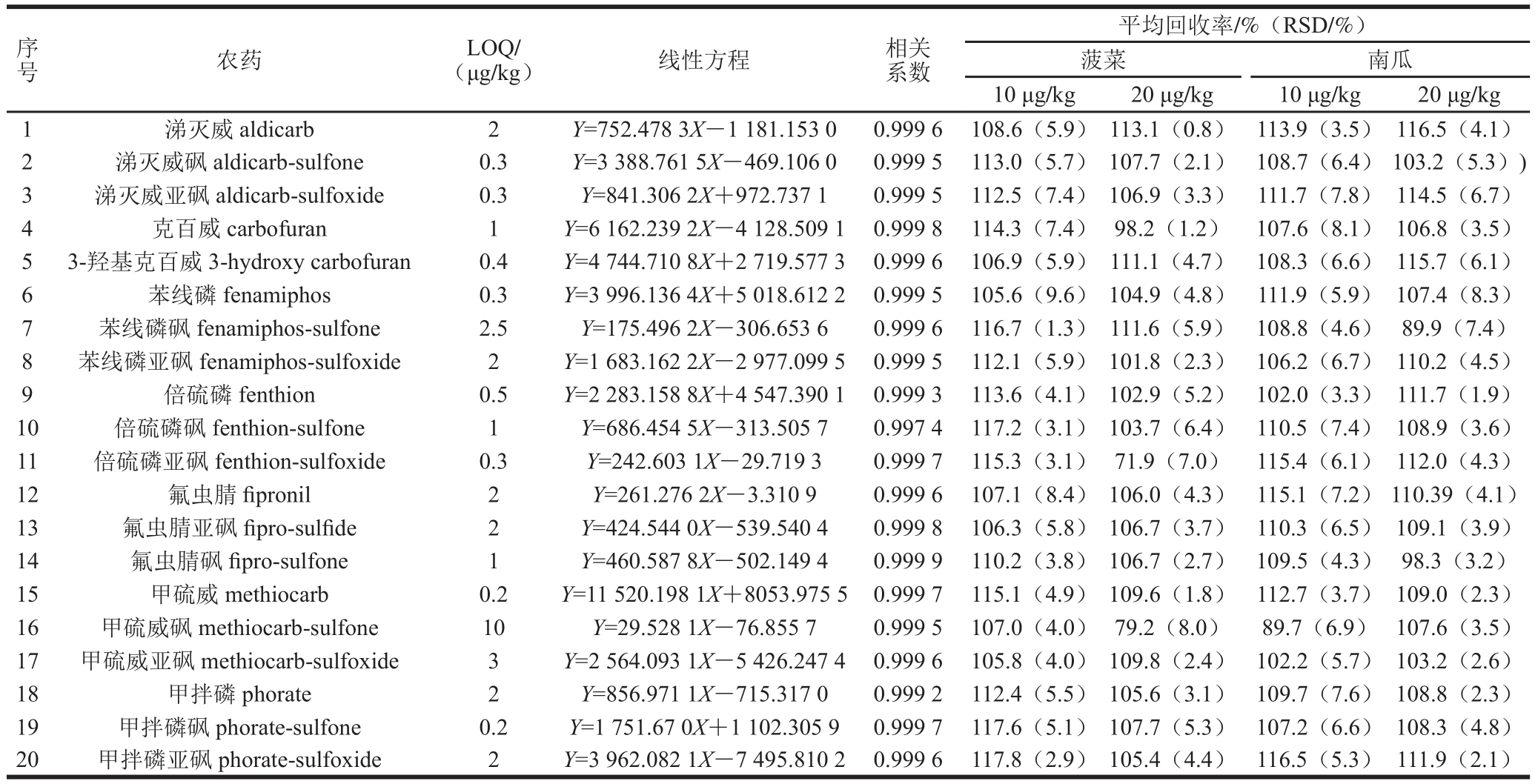
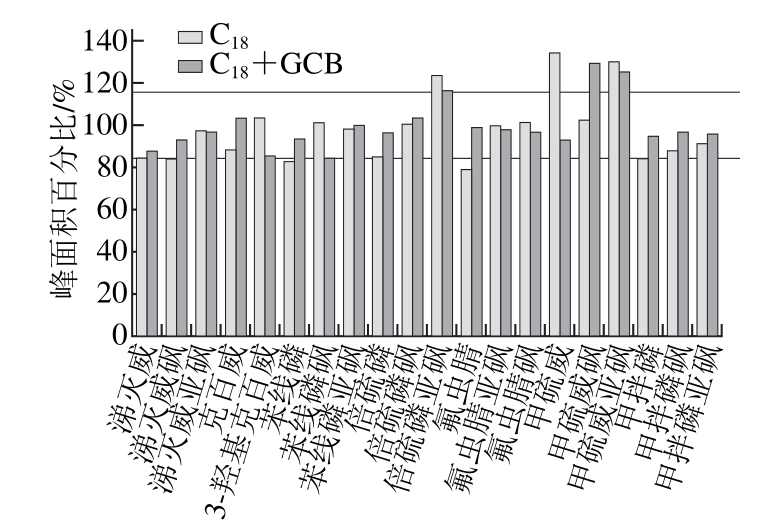
图5 2 种净化方式下7 种农药及其代谢物的基质效应情况
Fig. 5 Infl uence of d-SPE sorbents on matrix effect of pesticides
2.6 方法验证
2.6.1 线性关系与定量限
由表2可知,7 种农药及其代谢物的基质匹配标准曲线在5~100 μg/L质量浓度范围内均能呈现出较好的线性关系,相关系数R2大于0.999 0,以10 倍信噪比确定各农药化合物的定量限(limit of quantitation,LOQ),所有农药及其代谢物的定量限为0.2~10 μg/kg。
2.6.2 回收率和精密度
向空白菠菜样品中添加10、20 μg/kg的混合标准工作液,需要高、中、低3 个添加量,并考虑LOQ和最大残留限量,每个水平设置6 个平行样,并做一个样品空白试验。按1.3节样品前处理方法进行提取和净化,LC-MS/MS测定其含量,样品空白基质未出现目标峰。由表2可知,7 种农药及其代谢物的回收率在71.9%~117.8%范围内,RSD在0.8%~9.6%范围内。
2.7 实际样品检测结果
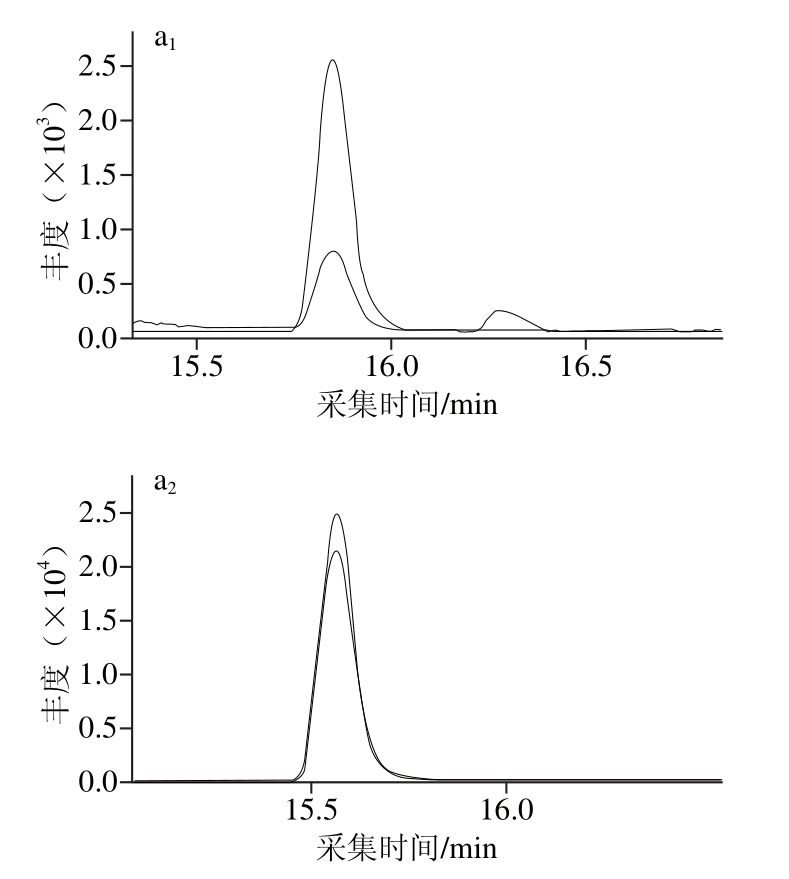
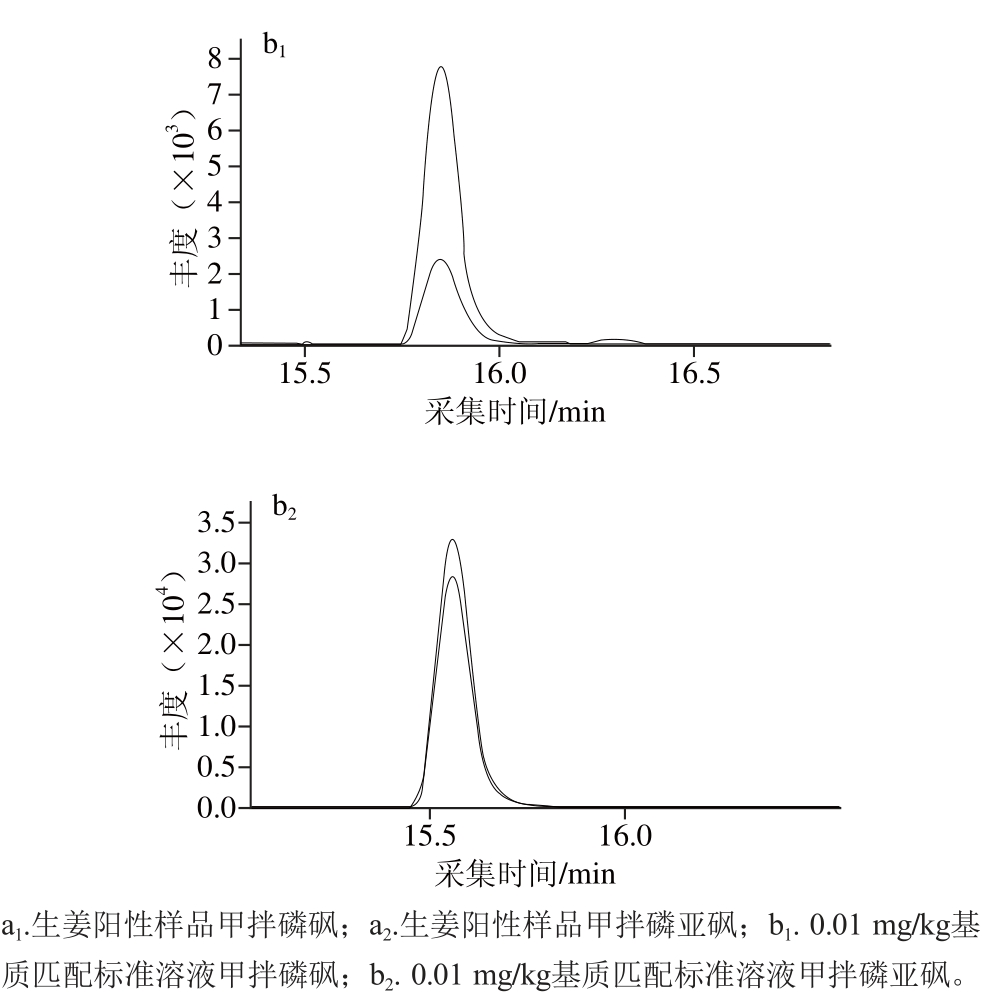
图6 甲拌磷砜和甲拌磷亚砜的提取离子色谱图
Fig. 6 Extracted ion chromatograms of phorate-sulfone and phorate-sulfoxide
应用建立的方法对胡萝卜、冬瓜、南瓜、生姜和白萝卜样品进行检测。分别称取以上样品各10 g(精确到0.01 g)于50 mL离心管中,按1.3节方法进行前处理,LC-MS/MS上机分析,其中1 份生姜样品检出甲拌磷砜和甲拌磷亚砜,含量分别为0.004 mg/kg和0.008 mg/kg,在生姜中的总残留量为0.012 mg/kg,超出了GB 2763—2014中对生姜中甲拌磷最大残留限量为0.01 mg/kg的要求。生姜阳性样品和0.01 mg/kg基质标准中甲拌磷砜和甲拌磷亚砜特征色谱图见图6。
本研究采用乙腈振荡提取,C18+GCB分散固相萃取吸附剂净化,液相色谱-三重四极杆串联质谱的动态多反应监测模式分析,建立了蔬菜中7 种农药及其代谢物的多残留分析方法。本方法快速、高效、稳定性好,可作为蔬菜中7 种农药及其代谢物残留的定性和定量检测手段。
参考文献:
[1] 国家卫生和计划生育委员会, 农业部. 食品中农药最大残留量: GB/T 2763—2014[S]. 北京: 中国标准出版社, 2014.
[2] BANERJEE K, UTTURE S, DASGUPTA S, et al. Multiresidue determination of 375 organic contaminants including pesticides,polychlorinated biphenyls and polyaromatic hydrocarbons in fruits and vegetables by gas chromatography-triple quadrupole mass spectrometry with introduction of semi-quantification approach[J].Journal of Chromatography A, 2012, 1270(24): 283-295. DOI:10.1016/j.chroma.2012.10.066.
[3] WANG J, LEUNG D. Determination of 142 pesticides in fruit and vegetable based infant foods by liquid chromatography/electrospray ionization-tandem mass spectrometry and estimation of measurement uncertainty[J]. Journal of AOAC International, 2008, 92(1): 279-301.
[4] CHUNG S W C, CHAN B T P. Validation and use of a fast sample preparation method and liquid chromatography-tandem mass spectrometry in analysis of ultra-trace levels of 98 organophosphorus pesticide and carbamate residues in a total diet study involving diversified food types[J]. Journal of Chromatography A, 2010,1217(29): 4815-4824. DOI:10.1016/j.chroma.2010.05.043.
[5] MUÑOZ E, MUÑOZ G, PINEDA L, et al. Multiresidue method for pesticide residue analysis in food of animal and plant origin based on GC or LC and MS or MS/MS[J]. Journal of AOAC International,2012, 95(6): 1777-1796. DOI:10.5740/jaoacint.11-036.
[6] 陈国峰, 王乐凯, 刘峰, 等. 冷藏与家庭处理对黄瓜中7 种农药残留的影响[J]. 食品科学, 2016, 37(10): 203-207. DOI:10.7506/spkx1002-6630-201610035.
[7] KOESUKWIWAT U, LEHOTAY S J, LEEPIPATPIBOON N. Fast,low-pressure gas chromatography triple quadrupole tandem mass spectrometry for analysis of 150 pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2011, 1218(39): 7039-7050. DOI:10.1016/j.chroma.2011.07.094.
[8] CARNEIRO R P, OLIVEIRA F A S, MADUREIRA F D, et al.Development and method validation for determination of 128 pesticides in bananas by modified QuEChERS and UHPLC-MS/MS analysis[J]. Food Control, 2013, 33(2): 413-423. DOI:10.1016/j.foodcont.2013.02.027.
[9] HANOT V, GOSCINNY S, DERIDDER M. A simple multi-residue method for the determination of pesticides in fruits and vegetables using a methanolic extraction and ultra-high-performance liquid chromatography-tandem mass spectrometry: optimization and extension of scope[J]. Journal of Chromatography A, 2015, 1384:53-66. DOI:10.1016/j.chroma.2015.01.040.
[10] HE Z, CHEN S, WANG L, et al. Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2015, 407(9): 2637-2643. DOI:10.1007/s00216-015-8485-9.
[11] HINGMIRE S, OULKAR D P, UTTURE S C, et al. Residue analysis of fipronil and difenoconazole in okra by liquid chromatography tandem mass spectrometry and their food safety evaluation[J]. Food chemistry, 2015, 176: 145-151. DOI:10.1016/j.foodchem.2014.12.049.
[12] PLÁ CIDO A, PAÍGA P, LOPES D H, et al. Determination of methiocarb and its degradation products, methiocarb sulfoxide and methiocarb sulfone, in bananas using QuEChERS extraction[J].Journal of Agricultural and Food Chemistry, 2013, 61(2): 325-331.DOI:10.1021/jf304027s.
[13] 吴成, 赵志强. 液相色谱/串联质谱法测定芹菜中甲拌磷及其代谢物残留[J]. 分析科学学报, 2016, 32(2): 294-296. DOI:10.13526/j.issn.1006-6144.2016.02.031.
[14] 贺敏, 宋丹, 董丰收, 等. UPLC-MS/MS快速检测韭菜和土壤中氟虫腈及其代谢物残留[J]. 环境化学, 2016, 35(5): 925-932.DOI:10.7524/j.issn.0254-6108.2016.05.2015112002.
[15] 刘祥萍, 孙文芳, 黄薇, 等. 超高效液相色谱-串联质谱法测定芦蒿中7 种氨基甲酸酯类农药及其代谢物残留量[J]. 理化检验(化学分册),2016, 52(11): 1262. DOI:10.11973/lhjy-hx201611005.
[16] 马立利, 贾丽, 周欣燃, 等. 多壁碳纳米管滤过型净化柱净化-超高效液相色谱/串联质谱法同时测定生姜中的涕灭威及其代谢物[J].色谱, 2014, 32(6): 635-639. DOI:10.3724/sp.j.1123.2014.02016.
[17] 何华丽, 徐小民, 吕美玲, 等. 液相色谱-串联质谱法测定生姜中的氨基甲酸酯类农药及其代谢物残留[J]. 分析测试学报, 2014, 33(2):197-202. DOI:10.3969/j.issn.1004-4957.2014.02.014.
[18] 张慧丽, 王建华, 李馨, 等. 气相色谱串联质谱法测定蔬菜中甲拌磷和克百威及其代谢物的残留量[J]. 化学分析计量, 2016, 25(1): 10-14.DOI:10.3969/j.issn.1008-6145.2016.01.003.
[19] GOLGE O, KABAK B. Evaluation of QuEChERS sample preparation and liquid chromatography-triple-quadrupole mass spectrometry method for the determination of 109 pesticide residues in tomatoes[J]. Food Chemistry, 2015, 176: 319-332. DOI:10.1016/j.foodchem.2014.12.083.
[20] BIZIUK M, STOCKA J. Multiresidue methods for determination of currently used pesticides in fruits and vegetables using QuEChERS technique[J]. International Journal of Environmental Science and Development, 2015, 6(1): 18. DOI:10.7763/IJESD.2015.V6.554.
[21] DONKOR A, OSEI-FOSU P, NYARKO S, et al. Validation of QuEChERS method for the determination of 36 pesticide residues in fruits and vegetables from Ghana, using gas chromatography with electron capture and pulsed flame photometric detectors[J]. Journal of Environmental Science and Health, Part B, 2015, 50(8): 560-570.DOI:10.1080/03601234.2015.1028833.
[22] CHRISTIA C, BIZANI E, CHRISTOPHORIDIS C, et al. Pesticide residues in fruit samples: comparison of different QuEChERS methods using liquid chromatography-tandem mass spectrometry[J].Environmental Science and Pollution Research, 2015, 22(17): 13167-13178. DOI:10.1007/s11356-015-4456-0.
[23] 王丽, 申兰慧, 陈国清. 浅谈样品溶剂对高效液相色谱行为的影响[J]. 中国药事, 2013, 27(2): 163-166. DOI:10.3969/j.issn.1002-7777.2013.02.012.
[24] LAYNE J, FARCAS T, RUSTAMOV I, et al. Volume-load capacity in fast-gradient liquid chromatography: effect of sample solvent composition and injection volume on chromatographic performance[J].Journal of Chromatography A, 2001, 913(1): 233-242. DOI:10.1016/S0021-9673(00)01199-7.
[25] 贾玮, 黄峻榕, 凌云, 等. 高效液相色谱-串联质谱法同时测定茶叶中290 种农药残留组分[J]. 分析测试学报, 2013, 32(1): 9-22.DOI:10.3969/j.issn.1004-4957.2013.01.002.
[26] PATEL D. Matrix effect in a view of LC-MS/MS: an overview[J].International Journal of Pharma and Bio Sciences, 2011, 2: 559-564.
[27] MATUSEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Analytical Chemistry, 2003, 75(13): 3019-3030. DOI:10.1021/ac020361s.
Determination of 7 Pesticide and Metabolite Residues in Vegetables Using QuEChERS and Liquid Chromatography-Tandem Mass Spectrometry
WANG Jianhua1, GE Minmin2, ZHANG Huili2, LIN Hong2, TANG Zhixu1, LI Li3,*
(1. Inspection and Quarantine Technical Center, Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266002, China;2. College of Food Science and Engineering, Ocean University of China, Qingdao 266100, China;3. Chinese Academy of Inspection and Quarantine, Beijing 100176, China)
DOI:10.7506/spkx1002-6630-201720034
中图分类号:S859.7
文献标志码:A
文章编号:1002-6630(2017)20-0235-07
引文格式:
王建华, 葛敏敏, 张慧丽, 等. QuEChERS法-液相色谱-串联质谱法测定蔬菜中7 种农药及其代谢物的残留量[J]. 食品科学,2017, 38(20): 235-241. DOI:10.7506/spkx1002-6630-201720034. http://www.spkx.net.cn
WANG Jianhua, GE Minmin, ZHANG Huili, et al. Determination of 7 pesticide and metabolite residues in vegetables using QuEChERS and liquid chromatography-tandem mass spectrometry[J]. Food Science, 2017, 38(20)∶ 235-241. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720034. http∶//www.spkx.net.cn
收稿日期:2017-02-14
基金项目:公益性行业(质检)科研专项(201410177;201210012)
作者简介:王建华(1968—),男,研究员,博士,研究方向为食品安全分析。E-mail:whywrs9@163.com
*通信作者:李立(1968—),女,研究员,学士,研究方向为食品安全分析。E-mail:ytciqli@163.com