陈 倩1,陈荫楠1,2,陈东海1,林海虹1,石贤爱1,3,*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.泉州医学高等专科学校基础医学部,福建 泉州 362000;3.福建省医疗器械和医药技术重点实验室,福建 福州 350108)
摘 要:目的:为快速检测呋喃唑酮(furazolidone,FZD)在动物性食品中的残留量。方法:基于单链抗体的间接竞争酶联免疫吸附实验法建立了FZD检测方法。结果:最佳抗原工作质量浓度为2 μg/mL,最佳抗体稀释倍数为1∶500,一抗最佳反应时间为60 min,二抗最佳反应时间为45 min,四甲基联苯胺最佳显色时间为20 min。FZD检测试剂盒在10~100 ng/mL范围具有较好的线性关系,IC50值为13.01 ng/mL,检出限为1.28 ng/mL,回收率为73.38%~84.52%。结论:与抗FZD单克隆抗体相比,所建立的检测试剂盒检测范围更广,且具有很高的灵敏度以及很好的特异性和稳定性。
关键词:呋喃唑酮;单链抗体;酶联免疫检测
Abstract: Aim∶ This study aimed to develop an enzyme-linked immunosorbent assay (ELISA) method for detecting the residues of furazolidone (FZD) in animal food. Method∶ The indirect competitive ELISA method based on single chain fragment antibody was established. Result∶ The optimal antigen mass concentration was 2 μg/mL, and the optimal antibody dilution ratio was 1∶500, and the optimal reaction time of primary antibody, the optimal reaction time of secondary antibody and the optimal reaction time of TMB were 60 min, 45 min, and 20 min, respectively. The good linearity was seen in the range of 10-100 ng/mL of FZD, with the IC50value being 13.01 ng/mL, and the lowest detection limit (LOD) being 1.28 ng/mL, and the recovery rates being 73.38%-84.52%. Conclusion∶ Compared with the monoclonal antibody against FZD, the detection kit based on single chain fragment antibody displayed wider detection range, higher sensitivity, better specifi city and detection stability.
Key words: furazolidone; single chain fragment antibody; enzyme-linked immunosorbent assay
DOI∶10.7506/spkx1002-6630-201720035
药物残留一直是影响食品安全的问题之一。硝基呋喃类药物是一种人工合成的广谱抗菌药物[1-2],因具有良好的抗球虫及抗菌作用[3],曾被广泛应用于家禽、水产等动物传染病的预防与治疗[4-5]。呋喃唑酮(furazolidone,FZD)是硝基呋喃类药物的一种,由于其具有严重的致癌、致突变等毒副作用[6],我国在2002年将其列为在动物饲养中禁止使用的药物,规定在动物性食品中不得检出[7-8]。
目前,用于检测FZD在动物性食品中残留量的方法主要有分光光度法、高效液相色谱法[9]、液相色谱-质谱联用法[10-11]、酶联免疫吸附实验法(enzyme-linked immunosorbent assays,ELISA)[12-13]、荧光免疫法等。传统的仪器法虽然能进行精确的定量检测,但成本高,前处理繁琐、操作复杂,无法满足快速检测大批量样品的要求[14]。基于抗原抗体反应的ELISA等快速免疫分析方法因其操作简单、成本低和特异性强等优点[15],成为快速检测农兽药残留相关研究的热点。如Zhu Huaping等[16]通过间接竞争ELISA来检测FZD及其代谢物3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone,AOZ),检测限为2.0 mg/L和2.5 mg/L。宋娟等[17]建立了间接竞争ELISA法来测定食品中呋喃它酮代谢物的含量,半抑制浓度(the half maximal inhibitory concentration,IC50)值为1.86 ng/mL,样品加标回收率为75.6%~112.2%。石贤爱等[18]在抗3-(4-羧基苯亚甲基)-氨基-2-恶唑烷酮(3-{[(4-carboxyphenyl)methylene]-amino}-2-oxazolidinone,CPAOZ)和抗AOZ的单克隆抗体的基础上,分别建立了ELISA检测试剂盒。其中CPAOZ检测试剂盒在1.0~100.0 ng/mL范围具有较好的线性,IC50值为14.6 ng/mL,检测限为6.56 ng/mL;AOZ检测试剂盒在0.5~12.5 ng/mL范围具有良好线性,IC50值为3.9 ng/mL,检测限为0.45 ng/mL。陈荫楠等[19]建立了抗FZD单克隆抗体的ELISA检测方法,其检测范围为10~500 ng/mL,IC50值为0.06 μg/mL,检出限为6.92 ng/mL。
然而,使用该方法的前提是需要获得相应的抗体,其制备主要采用免疫动物获得多克隆抗体血清或杂交瘤技术获得单克隆抗体。但是,多克隆抗体其免疫球蛋白类别及亚类不均一,特异性较差,无法实现稳定的大批量生产[4]。而单克隆抗体虽然具有组分单一、灵敏度高、特异性强等明显优势[20],但制备技术较复杂,周期长,应用范围受到局限。单链抗体是通过人工合成的亲水性、柔性连接肽(Linker)将抗体重链可变区(variable region of heavy chain,VH)和轻链可变区(variable region of light chain,VL)连接形成重组抗体[21-22],它不包含抗体恒定区,但仍能表现出和抗原的结合活性。相比于完整的单克隆抗体,单链抗体具有分子质量小[23],免疫性低,穿透力强的特点[24-25],使其应用范围更广,经济效益更大,是近年来的研究热点[26-27]。如张倩[28]成功制备了具有良好免疫原性的抗鲫鱼IgM单链抗体,并建立了间接ELISA检测方法,重复性实验的变异系数均小于10%,所建立的方法重现性和稳定性良好。本实验建立了基于抗FZD单链抗体的间接竞争ELISA检测法,并将其与基于单克隆抗体的相关方法进行比较,从而为实现FZD的低成本、可重复的免疫快速检测提供理论支持。
1.1 材料与试剂
FZD单链抗体、呋喃唑酮鸡卵清白蛋白偶联物(furazolidone coupled with ovalbumin,FZD-OVA)本实验室制备保存(单链抗体制备方法同文献[29]);FZD、呋喃它酮(furaltadone,FTD)、呋喃妥因(nitrofurantion,NFT)、呋喃西林(nitrofurazone,NFZ)、氨基脲(semicarbazide,SEM)、AOZ 德国Dr. Ehrenstorfer GmbH公司;HRP标记的抗His-tag抗体英国Abcam公司;HRP标记羊抗小鼠IgG(H+L) 美国Thermo公司;四甲基联苯胺(tetramethylbenzidine,TMB) 北京天根公司;鱼饲料 福建天马公司。
1.2 仪器与设备
SH-1000全波长酶标仪 日本Corona公司;隔水式恒温培养箱、DHK-501A超级恒温水槽 上海精宏公司;XH-C旋涡混合器 常州迈科诺仪器有限公司。
1.3 方法
1.3.1 可溶性ScFv抗体的亲和力分析
通过间接竞争ELISA法分析纯化后的单链抗体的亲和力。1)用10 μg/mL FZD-OVA包被酶标板,4 ℃过夜;倾去包被液,含0.05% Tween-20的磷酸盐缓冲液(phosphate buffer saline with 0.05% Tween-20,PBST)洗涤3 次,5 min/次;5%的脱脂奶封闭过夜,洗涤。2)加一抗:将标准品溶液倍比稀释后与经磷酸缓冲盐溶液(phosphate buffer saline,PBS)稀释的ScFv抗体等体积混合,37 ℃孵育2 h后加板,100 μL/每孔,同时设置阳性对照、阴性对照和空白对照组,37 ℃孵育2 h;倾去混合液,洗涤3 次;3)加二抗:每孔加入HRP标记的抗His-tag抗体(1∶5 000)100 μL,37 ℃孵育1 h,洗涤方法同上。4)显色:每孔加入100 μL TMB,37 ℃避光反应30 min。每孔加入100 μL 2 mol/L H2SO4溶液,终止反应,用酶标仪测定波长450 nm处吸光度(A450nm)。5)结果判定:结合率为纵坐标,以FZD的质量浓度的对数值为横坐标,绘制竞争曲线,以A450nm值判断抗FZD单链抗体与FZD的竞争反应情况,判断单链抗体的特异性。以抗FZD特异性抗体对FZD的竞争抑制率为纵坐标,以FZD质量浓度的对数值为横坐标,绘制标准竞争曲线。在标准竞争曲线上计算出抑制率为50%时混合液中FZD的标准质量浓度作为竞争抑制率IC50。结合率、抑制率按公式(1)、(2)计算:
式中:A为加入不同质量浓度的底物FZD的吸光度(A450nm);A0为不加底物FZD的吸光度(A450nm);A空白为不加底物FZD、不加抗血清的吸光度(A450nm)。
抑制率/%=100%-结合率 (2)
1.3.2 ScFv抗体的交叉反应性分析
分别将FTD、NFT、NFZ、SEM以及AOZ这5 种结构类似物标准液倍比稀释,每个质量浓度取50 μL与等体积的ScFv抗体于37 ℃反应2 h,其余步骤同间接竞争ELISA。最后以FTD、NFT、NFZ、SEM和AOZ的IC50与FZD的IC50百分比可得该单链抗体与各结构类似物的交叉反应率。交叉反应率按公式(3)计算:
式中:IC50,FZD为当FZD对抗血清抑制率为50%时,FZD的标准质量浓度/(ng/mL);IC50,结构类似物为当FZD结构类似物对抗血清抑制率达到50%时,FZD结构类似物的标准质量浓度/(ng/mL)。
1.3.3 抗FZD酶联免疫检测方法的建立
1.3.3.1 最佳包被抗原及单链抗体工作质量浓度的确定
采用方阵实验法,将重氮法制备的FZD-OVA作为包被抗原和抗FZD单链抗体分别做系列稀释,抗原质量浓度分别稀释为10、5、2、1、0.2 μg/mL,按100 μL/孔包被在酶标板中,4 ℃过夜;用脱脂奶37 ℃封闭3 h;将单链抗体作100、200、500、1 000、2 000倍稀释后加入酶标板中。其余步骤同1.3.1节。根据检测得到的A值,确定实验最佳的包被抗原和单链抗体的最佳稀释倍数。
1.3.3.2 一抗最佳反应时间的确定
包被酶标板,4 ℃过夜,洗涤3 次后加脱脂奶封闭3 h。洗涤后,分别加入高浓度抗体(稀释5倍)、低浓度抗体(稀释20 倍)、阴性抗体(空质粒表达的蛋白)、空白(PBS)(均设3 个平行)。设定一抗反应时间分别为30、60、120 min。其余步骤同间接ELISA方法。根据读取的A450nm,比较各个时间段对结果的影响,确定一抗的最佳作用时间。
1.3.3.3 二抗最佳反应时间的确定
包被,封闭,选择一抗的最佳反应时间进行反应,一抗的梯度与1.3.3.2节中相同。分别设定二抗的反应时间为30、45、60 min。其余步骤同间接ELISA方法。根据读取的A450nm,比较各个时间段对结果的影响,确定二抗最佳时间。
1.3.3.4 TMB显色时间的确定
在最优的抗原抗体工作质量浓度、一抗反应时间、二抗反应时间条件下,分别设定显色时间为加入TMB后37 ℃反应5、10、20、30 min。
1.3.3.5 检测方法的检出限分析
从包被的10 块板中随机选择10 个孔,加入50 μL零标准品和50 μL稀释到工作质量浓度的抗FZD单链抗体,应用建立的间接竞争ELISA法进行测定。求得10 个孔的标准品标准差,在标准曲线上对应3倍标准差/A0的标准品质量浓度即为此方法的检出限,标准差按公式(4)、(5)计算:

式中:Ai为第i孔底物FZD的吸光度(A450nm);A0为i 个孔吸光度(A450nm)的平均值。
1.3.3.6 间接竞争ELISA检测方法的精密度测试
取3 个不同质量浓度的FZD标准品,进行间接竞争ELISA分析,每个质量浓度每天做1 次分析,综合5 次测定的抑制率,求出变异系数。
1.3.3.7 样品加标回收率
将空白鱼饲料样本研磨粉碎,过筛备用。取适量样品于50 mL离心管中,按10.0、50.0、100.0 μg/g的添加量分别加入适量的FZD标准品。然后加入甲醇-乙腈(3∶7,V/V)提取液,剧烈振荡30 min。静置一段时间后,离心取上清液进行还原(方法同文献[19])。待冷却至室温后采用间接竞争ELISA法进行检测。最后,根据FZD竞争抑制标准曲线,计算加标回收率。
2.1 ScFv抗体的亲和力分析
采用间接竞争ELISA法,检测ScFv抗体的亲和力。以FZD-OVA作为检测抗原,与游离抗原FZD竞争结合抗体的结合位点。当FZD质量浓度在10~100 ng/mL之间时,抑制率呈较好的线性关系,以FZD添加质量浓度的对数值为横坐标,抑制率为纵坐标,拟合标准曲线后得到线性方程:y=42.24x+2.930 2(R2=0.990 2)。当抑制率为50%时,IC50值为13.01 ng/mL。陈荫楠等[19]制备的单克隆抗体,其线性范围为10~500 ng/mL,IC50值为60 ng/mL,与之相比(所采用的计算方法、样品种类及样品前处理方法均一样),本实验中所制备的单链抗体IC50值较小,灵敏度更高。
2.2 ScFv抗体的交叉反应性分析
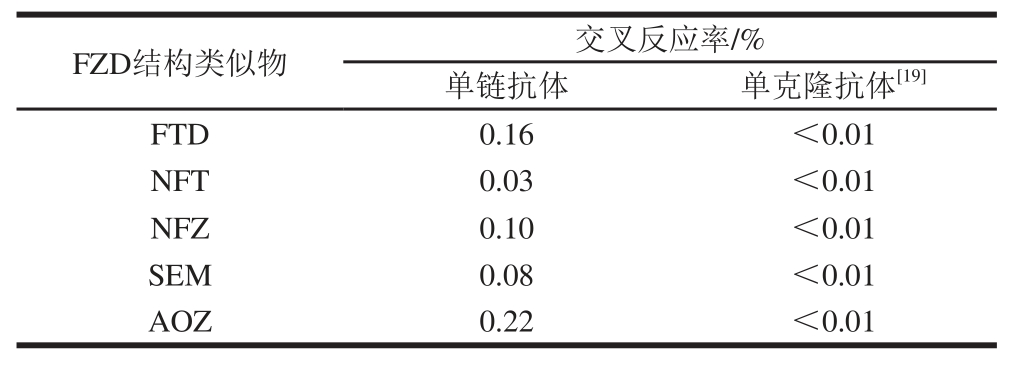
以FZD-OVA作为包被抗原,将FTD、NFT、NFZ、SEM和AOZ分别倍比稀释,采用间接竞争ELISA法检测,得出抗FZD单链抗体FZD-ScFv与各FZD结构类似物的IC50值,计算出交叉反应率,如表1所示,得出抗FZD单链抗体FZD-ScFv对5 种硝基呋喃抗生素的交叉反应率均低于1%,有较好的特异性。但与陈荫楠等[19]制备的单克隆抗体相比(交叉反应率均低于0.01%),特异性稍差。
表1 抗体与FZD结构类似物的交叉反应性的对比
Table 1 Comparison in the cross-reactivity of antibodies against analoogguueess
2.3 最佳反应条件的确定
2.3.1 最佳包被抗原及单链抗体工作质量浓度的确定
采用方阵滴定法来确定最佳的包被抗原浓度与抗体稀释倍数。实验采用间接非竞争ELISA测定,得出最佳抗原工作质量浓度为2 μg/mL,在此包被质量浓度条件下,抗体稀释倍数在1∶500时吸光度(A450nm)在1.0附近,故选择1∶500作为抗体最佳稀释倍数。
2.3.2 一抗最佳反应时间的确立
用2 μg/mL的FZD-OVA包被酶标板,一抗分别为FZD-ScFv稀释5 倍、FZD-ScFv稀释20 倍、阴性对照(空质粒表达的蛋白)、空白(PBS)4 个梯度。分别在37 ℃反应30、60、120 min,二抗孵育1 h,TMB显色30 min,如图1所示。
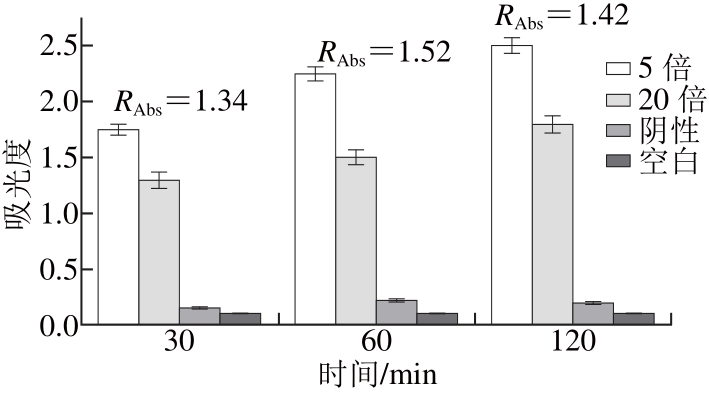
图1 一抗反应时间的考察
Fig. 1 Optimum reaction time for primary antibody
从图1可以看出,随着反应时间的延长,吸光度也不断升高。令RAbs=(A1-A0)/(A2-A0),其中A1为稀释5 倍的吸光度,A2为稀释20 倍的吸光度,A0为阴性的吸光度。阴性空质粒表达的蛋白吸光度也随时间增加,30min的吸光度为0.147,120min的吸光度为0.223。30、60、120 min时,RAbs值分别为1.34、1.52、1.42。RAbs,60min值最大,且空白对照低,因此,一抗反应60 min最佳。
2.3.3 二抗最佳反应时间的确立
一抗反应60 min后,加入二抗37 ℃分别反应30、45、60 min,如图2所示。在这3 个时间段中,随着二抗反应时间的延长,吸光度不断升高,60 min时吸光度达到最高值,但比较RAbs值发现,RAbs,45min值最大,因此二抗最佳反应时间为45 min。

图2 二抗反应时间的考察
Fig. 2 Optimum reaction time for secondary antibody
2.3.4 TMB显色时间的确立
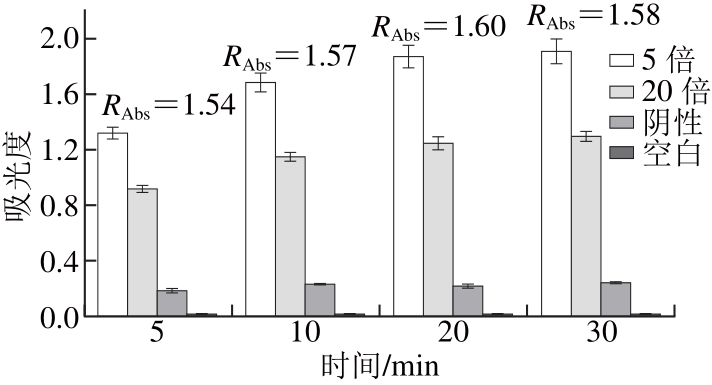
图3 TMB反应时间的考察
Fig. 3 Optimum reaction time for TMB
一抗反应60 min,二抗反应45 min,分别显色5、10、20、30 min后,如图3所示,单链抗体稀释5 倍时,30 min时吸光度最高,为1.906。随着显色时间的延长,吸光度也出现了较大幅度的增加,但显色20 min和30 min的吸光度差别不大,但RAbs,20min大于RAbs,30min,同时鉴于该试剂盒是用于快速检测的,选择20 min即可。
2.3.5 检出限分析
从包被好的酶标孔板中随机挑选10 孔,按建立好的间接竞争ELISA模式做零标准的实验,求所得10 个A值的标准差,在标准曲线上对应3 倍标准差/A0的标准品质量浓度即为此方法的检出限。由此得到3 倍标准差/A0位置相应的抑制率和检出限为7.47%和1.28 ng/mL,并与陈荫楠等[19]制备的抗FZD单克隆抗体的相应数值比较如表2所示。本实验制备的抗FZD单链抗体检出限更低,检测范围更广,效果更佳。
表2 检出限测试对比
Table 2 Comparison in the detection limit of detection kit among different antibodies
2.3.6 间接竞争ELISA检测方法的精密度结果
重复做5 次FZD的竞争抑制曲线,每次做3 个质量浓度,每个质量浓度做3 个平行孔,以平行孔的均值作为每次每个质量浓度条件下的抑制率,对比结果见表3。
表3 精密度测试结果
Table 3 Test of detection precision of detection kit based on single chain fragment antibody
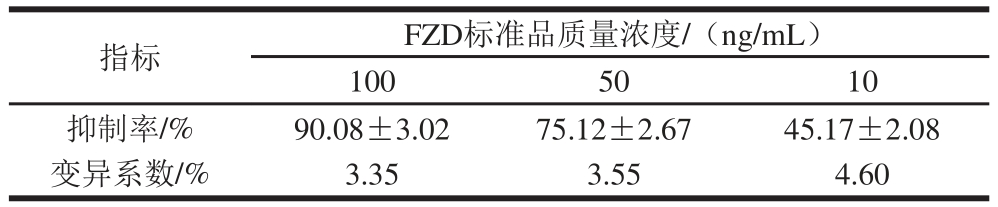
注:抑制率数据为 ±s。
表4 精密度对比结果
Table 4 Comparison in detection precision of detection kit among different antibodies

结合表3、4可以看出,每个质量浓度条件下的变异系数均小于10%,平均误差为3.83%。这比陈荫楠等[19]建立的检测方法的平均误差小,重复性更好。
2.3.7 样品加标回收率的测定结果
往不含FZD的饲料中分别加入FZD使其添加量为10.0、50.0、100.0 μg/g,样品经提取后进行ELISA检测,每个添加量重复检测3 次,计算加标回收率,结果见表5。数据显示,FZD样品的加标回收率为73.38%~84.52%,变异系数6.81%~9.41%。而陈荫楠等[19]所制得单克隆抗体的FZD样品加标回收率为76.84%~88.31%,变异系数9.36%~15.79%,二者相比样品加标回收率差别不大,但本实验所制得FZD单链抗体变异系数更小。
表5 FZD加标回收率结果
Table 5 Recovery rates of FZD from samples of detection kit based on single chain fragment antibody
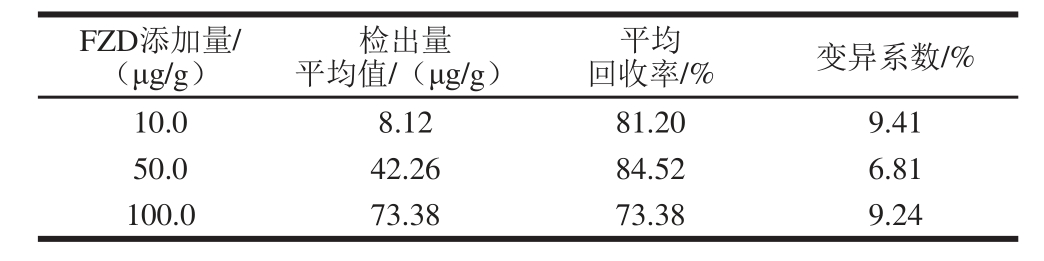
表6 加标回收率对比结果
Table 6 Comparison in recovery rate of detection kits among different antibodies

用纯化后获得的单链抗体建立的间接竞争ELISA检测方法的检测范围为10~100 ng/mL,IC50值为13.01 ng/mL。与FZD结构类似物(FTD、NFT、NFZ、SEM、AOZ)的交叉反应率均小于1%,说明单链抗体的灵敏度和特异性均很高。
建立了基于抗FZD单链抗体的间接竞争ELISA检测方法,最佳抗原工作质量浓度为2 μg/mL,最佳抗体稀释倍数为1∶500。在一抗反应60 min、二抗反应45 min、TMB显色20 min条件下,计算得到检出限为1.28 ng/mL。所建立的方法重现性较好,平均误差为3.83%,加标回收率为73.38%~84.52%,变异系数为6.81%~9.41%。
综上所述,相比单克隆抗体,本实验制备的单链抗体IC50值和检出限较小,平均误差较小,变异系数较小,样品加标回收率差别不大,虽然交叉反应率稍低于单克隆抗体,但足以满足检测的要求,且灵敏度更高,检测范围更广,稳定性较好。
利用基因工程手段制备单链抗体免疫原性低,对人体不会引起抗异种蛋白反应,半衰期短,且分离纯化方法简单,制备所需时间短[30-31],同时抗体易于改造以用于不同用途。因此,基于单链抗体的免疫检测方法具有更广的应用范围和应用前景。
参考文献:
[1] 周克楠, 唐勇, 蓝彩凤, 等. 呋喃唑酮代谢物单克隆抗体及其新型免疫层析检测试纸条的制备[J]. 中国生物制品学杂志, 2014, 27(7)∶927-931. DOI∶10.13200/j.cnki.cjb.000454.
[2] 陈威风, 陈敬鑫. 肉制品中硝基呋喃类药物残留的研究进展[J]. 肉类研究, 2011, 25(12)∶ 53-57. DOI∶10.3969/j.issn.1001-8123.2011.12.014.
[3] 葛宝坤, 王云凤, 贺信. 高效液相色谱法测定鸡肉、水产品中呋喃西林和呋喃唑酮残留量的研究[J]. 中国卫生检验杂志, 2002, 12(6)∶661-662. DOI∶10.3969/j.issn.1004-8685.2002.06.008.
[4] 刘迎春, 蒋蔚, 陈永军, 等. 呋喃它酮代谢物人工抗原及多克隆抗体的制备[J]. 畜牧与兽医, 2013, 45(2)∶ 69-73.
[5] 傅国, 李宁毅. 硝基呋喃类和硝基咪唑类药物的研究进展 [J]. 青岛大学医学院学报, 2003, 39(4)∶ 486-488. DOI∶10.11712/qdyxy200304061.
[6] ALI B H. Pharmacological, toxicol ogical and therapeutic properties of furazolidone∶ some recent research[J]. Veterinary Research Communications, 1999, 23(6)∶ 18-23. DO I∶10.1023/A∶1006333608012.
[7] 李子颖, 郑婷, 袁志刚, 等. 呋喃唑酮代谢物AOZ的抗体制备及初步应用[J]. 食品科技, 2013, 38(4)∶ 309-313. DOI∶10.13684/j.cnki.spkj.2013.04.070.
[8] 王烈喜, 陈黎斌, 姚玉静. 呋喃妥因代谢物海特因单克隆抗体的制 备[J]. 广东化工, 2015, 42(1)∶ 41-42. DOI∶10.3969/j.issn.1007-1865.2015.01.020.
[9] KANIOU I, ZACHARIADIS G, KAL LIGAS G, et al. Separation and determination of carbadox, nitrofurazone, nitrofuratoin, furazolidone,furaltadone in their mixtures by thin layer and high performance liquid chromatography[J]. Journal of Liquid Chromatography, 2012, 17(6)∶1385-1398.
[10] 朱坚. 高效液相色谱-质谱法检测肉和水产品中硝基呋喃类药物的代谢物残留量[J]. 质谱学报, 2003, 24(增刊1)∶ 121-122.DO I∶10.3969/j.issn.1004-2997.2003.z1.061.
[11] 刘辉, 梁德沛, 花铁果, 等. 食品中硝基呋喃类药物及其代谢物残留检测技术的研究进展[J]. 食品安全质量检测学报, 2013, 4(2)∶384-389.
[12] 王重庆. 分子免疫学基 础[M]. 北京∶ 北京大学出版社, 2008∶ 4.
[13] 徐顺清, 刘衡川. 免疫学检验[M]. 北京∶ 人民卫生出版社, 2015∶ 15.
[14] 任海涛, 沈玉栋, 徐振林, 等. 呋喃唑酮代谢物单克隆抗体制备及酶联免疫吸附分析方法[J]. 分析化学研究报告, 20 15, 40(5)∶ 745-751.DOI∶10.3724/SP.J.1096.2012.10409.
[15] LI J, LIU J, ZHANG H C, et al. Broad specificity indirect competitive immunoassay for determination of nitrofurans in animal feeds[J]. Analytica Chimica Acta, 2010, 678(1)∶ 1-6. DOI∶10.1016/j.aca.2010.07.025.
[16] ZHU H P, L IU T T, LIU B, et al. Antigens synthesis and antibodies preparation for furazolidone and its metabolite 3-amino-2-oxazolidinone[J]. Chinese Chemical Lette rs, 2010, 21(9)∶ 1049-1052.DOI∶10.1016/j.cclet.2010.04.001.
[17] 宋娟, 王玉珍, 邓安平. 测定食品中呋喃它酮代谢物3-氨基-5-吗啉甲基-2-恶唑烷酮的酶联免疫吸附法[J]. 食品安全质量检测 学报,2012, 3(5)∶ 77-81.
[18] 石贤爱, 裴世锋, 李向楠, 等. 基于不同半抗原的呋喃唑酮代谢物免疫 检测方法的建立与比较[J]. 食品科学, 2014, 35(8)∶ 174-180.DOI∶10.7506/spkx1002-6630-201408035.
[19] 陈荫楠, 陈华, 石贤爱, 等. 抗呋喃唑酮单克隆抗体的制备及其应用[J]. 食品科学, 2016, 37(3)∶ 157-163. DOI∶10.7506/spkx1002-6630-201603029.
[20] 刘萍, 陈苗苗, 刘学荣, 等. 单克隆抗体研究进展[J]. 中国畜牧兽 医,2012, 39(1)∶ 67-70. DOI∶10.3969/j.issn.1671-7236.2012.01.016.
[21] 郭海涛, 杨光勇, 何光志. 单链抗体的研究进展及其应用[J]. 黑龙江畜牧兽医, 2015(13)∶ 76-79. DOI∶10.13881/j.cnki.hljxmsy.2015.1053.
[22] 齐永华, 董永军, 宁红梅, 等. 单链抗体技术在农兽药残留检测方面的研究进展[J]. 东北农业大学学报, 2011, 42(9)∶ 7-11. DOI∶10.3969/j.issn.1005-9369.2011.09.002.
[23] 刘燕. 单链抗体的研究进展及其应用前景[J]. 2003, 37(11)∶ 42-44.DOI∶10.3969/j.issn.1002-1280.2003.11.012.
[24] 李菁, 林彤, 宋帅, 等. 基因工程抗体研究进展[J]. 生物技术通报,2009, 25(10)∶ 40-44. DOI∶10.7506/spkx1002-6630-201603029.
[25] 霍萍萍, 张聪敏, 赵宝华. 单链抗体制备技术及应用的研究进展[J].细胞与分子免疫学杂志, 2011, 27(10)∶ 1154-1156. DOI∶10.13423/j.cnki.cjcmi. 006175.
[26] 王秀红, 周素芳. 基因工程抗体研究进展[J]. 生物技术通讯, 2007,18(2)∶ 304-306. DOI∶10.3969/j.issn.1009-0002.2007.02.039.
[27] 马颖, 邹全明. 单链抗体及其在生物医学中的应用[J]. 免疫学杂志,2006, 22(增刊1)∶ 1-4. DOI∶10.3969/j.issn.1000-8861.2006.z1.001.
[28] 张倩. 鲫鱼IgM单链抗体的制备及嗜水气单胞菌抗体间接ELISA检测方法的建立[D]. 南京∶ 南京农业大学, 2013. DOI∶10.7666/d.Y252734 1.
[29] 田江红. 核糖体展示人单链抗体库的构建及抗HCV NS5B蛋白的ScFv的筛选[D]. 西安∶ 第四军医大学, 2010.
[30] 王溪桥. 大容量人源肝癌核糖体展示单链抗体库的构建[D]. 兰州∶兰州大学, 2010.
[31] 韩亚萍. 大容量人源胃癌核糖体展示抗体库的构建、鉴定及筛选[D].兰州∶ 兰州大学, 2009.
Establishment of Enzyme-Linked Immunosorbent Assay Method for Detecting Furazolidone Based on Single Chain Fragment Antibody
CHEN Qian1, CHEN Yinnan1,2, CHEN Donghai1, LIN Haihong1, SHI Xian’ai1,3,*
(1. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China;2. Basic Medicine Programme, Quanzhou Medical College, Quanzhou 362000, China;3. Fujian Key Laboratory of Medical Instrument and Pharmaceutical Technology, Fuzhou 350108, China)
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)20-0242-06
引文格式:
陈倩, 陈荫楠, 陈东海, 等. 基于单链抗体的呋喃唑酮酶联免疫检测方法的建立[J]. 食品科学, 2017, 38(20): 242-247.DOI:10.7506/spkx1002-6630-201720035. http://www.spkx.net.cn
CHEN Qian, CHEN Yinnan, CHEN Donghai, et al. Establishment of enzyme-linked immunosorbent assay method for detecting furazolidone based on single chain fragment antibody[J]. Food Science, 2017, 38(20)∶ 242-247. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720035. http∶//www.spkx.net.cn
收稿日期:2017-01-06
基金项目:国家海洋局海洋公益性行业科研专项(201205022-3);福建省科技重大专项(2013NZ0003);福建省海洋与渔业厅重点项目(闽海渔合同[2010]2-27号)
作者简介:陈倩(1991—),女,硕士,研究方向为抗体研发与产业化。E-mail:121131347@qq.com
*通信作者:石贤爱(1971—),男,教授,博士,研究方向为高灵敏度生物检测。E-mail:shixa@fzu.edu.cn