表1 不同实验组的质谱基质液配比
Table 1 Composition of matrix solutions for mass spectrometry

屠博文1,吉俊敏1,杜 强1,黎俊宏1,唐宏兵1,熊吉滨2,韩晓冬3
(1.常州市疾病预防控制中心,江苏 常州 213022;2.泰州医药高新技术产业园区疫苗工程中心,江苏 泰州 225300;3.南京大学医学院,江苏 南京 210093)
摘 要:目的:通过VITEK MS微生物检测系统对养殖场及市售活鸡来源的空肠弯曲菌和单核细胞性李斯特菌进行激光解析飞行质谱鉴定,建立两种致病菌的质谱鉴定方法。方法:从样品中分离获得疑似的空肠弯曲菌和单核细胞性李斯特菌,经不同配比的基质液处理后进行质谱鉴定。通过分析检出菌特征峰及相对丰度差异来评价不同配比基质液对两种致病菌检测的影响。结果:空肠弯曲菌和李斯特菌对基质液配比要求具有明显差异,前者不需要经过甲酸裂解,而对三氟乙酸含量敏感,后者鉴定结果受到甲酸裂解制约。基质液含水量控制在体积分数30%可以有效避免特征峰缺失并提高检出率。结论:控制基质液的含水量、基质浓度和三氟乙酸含量可以增加空肠弯曲菌和李斯特菌的特征峰数量,增强相对丰度,提高致病菌检出率。基质液配比优化研究有助于增强食源性致病菌快速鉴定能力,有助于提高疾病预防和食源性风险监测的时效性。
关键词:VITEK MS微生物检测系统;空肠弯曲菌;单核细胞性李斯特菌;基质液配比;微生物质谱检测方法
Abstract: Objective∶ To establish a matrix-assisted laser desorption ionization time of fl ight mass spectrometry (MALDITOF-MS) method to detect Campylobacter jejuni and Listeria monocytogenes in environmental samples from a chicken farm and samples from commercial live chickens using VITEK MS. Methods∶ The suspicious colonies of both bacteria were separated from the samples, and then suspended in matrix solutions consisting of mixtures of different proportions of ethanol, acetonitrile and water before identifi cation by MALDI-TOF-MS. The effect of matrix solution composition on the bacterial detection was evaluated by examining the differences in characteristic peak value and relative abundance. Results∶Signifi cantly different matrix solutions were needed for the detection of Campylobacter jejuni and Listeria monocy togenes;the former did not require cracking by formic acid and was sensitive to trifl uoroacetic acid (TFA), but the latter were just the opposite. A 30% water content in matrix solution (V/V) could avoid the lack of characteristic peak and enhance the detection rate. Conclusion∶ Control of the water content in matrix solution, TFA concentration and matrix concentration can enhance the number and relative abundance of characteristic peaks, and detection rate. The optimized matrix solution enables the rapid identifi cation of foodborne pathogens, which was able to improve the timeliness of disease prevention and food-borne risk monitoring.
Key words: VITEK MS microbe identification system; Campylobacter jejuni; Listeria monocytogenes; matrix solution composition; mass spectrometric detection of microbes
DOI∶10.7506/spkx1002-6630-201720038
随着食源性监测工作的全覆盖,从食品中检出的致病菌种类和数量增加,快速检测技术运 用于食品风险评估工作成为食源性监测的亮点。基质辅助激光解析飞行质谱(matrix assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF-MS)技术是微生物快速检测技术的新成员,越来越多的生物标志物的发现使得质谱检测技术更加准确和可靠[1-2],核糖体蛋白是MALDI-TOF-MS的主要分子标志物[3-4],此外酶、外膜蛋白及毒性蛋白等构成了物种水平特征峰标志物[5]。经大量实验证明微生物质谱检测的种水平识别能力在80%~100%[6-7]。
空肠弯曲菌是一种的重要食源性人兽共患病原菌[8-9],很多动物可正常携带弯曲菌,通过食物链传递给人而致病。大量研究表明家禽是该菌重要的传染源,禽肉食用与空肠弯曲菌的传播紧密相关[10]。空肠弯曲菌感染后能够引起急性肠炎、格林巴利综合症、反应性关节炎等多种疾病[11]。由于生物量少、培养条件苛刻、暴露在高氧环境后极易死亡,空肠弯曲菌在日常食源性风险监测工作中极难检出。空肠弯曲菌在体外极易进入休眠态,需要通过活化培养方能检出。空肠弯曲菌的食源性检测是食源性风险监测工作中的难点。李斯特菌也是一种重要的人畜共患病原菌,低温环境下仍极易污染食品,引起急性腹泻、发热、脑膜炎、败血症等疾病,死亡率极高[12]。由于单核细胞性李斯特菌是引起人李斯特菌病的元凶,在食品检测过程中尤为受到关注。
目前,以上两种致病菌临床鉴定主要通过传统培养法和PCR法检测,使用质谱技术进行检测的案例在国内外罕见[13-14]。VITEK MS微生物鉴定的准确性和检测容量取决于质谱数据库中该种微生物图谱的完整性和兼容性[15-16]。分析并补充难培养和难检测致病菌的图谱数据有助于提高该种微生物的快速检测效率。VITEK MS是一种全自动微生物快速鉴定系统,微生物检出质量与菌种类别、培养条件、基质液配比及蛋白结晶化操作流程都有很大的关系。本研究对不同配方基质液作用下的空肠弯曲菌和李斯特菌进行MALDI-TOF-MS峰值分析,对比各自的质谱峰形差异,一方面以此寻找关键的生物标识峰,另一方面确定两种微生物最适的基质液配比。研究不同配比基质液对质谱检测的影响,有助于完善基于VITEK MS系统的食源性致病菌快速检测方法,提高检出效率并有效完成食源性致病菌快速检测任务。
1.1 材料与试剂
根据《中国人民共和国食品安全法》及《食品微生物及其致病因子监测工作手册》的要求,对养殖场及市售活鸡进行致病菌检测;标准菌株大肠杆菌ATCC8739美国ATCC菌种保藏中心。
甲酸(批号:251364)、乙腈(批号:271004)、乙醇(批号:1012768)、三氟乙酸(trifluoroacetic acid,TFA,批号:1C41k054) 美国Sigma公司;α-氰-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,α-CHCA,批号:16553) 法国生物梅里埃公司;营养琼脂平板(批号:150422) 科玛嘉生物技术有限公司。
1.2 仪器与设备
VITEK MS MALDI-TOF质谱仪、WGZ-200麦氏浊度仪 法国生物梅里埃公司;GNP-9160隔水式恒温培养箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 菌株培养及样品制备
表1 不同实验组的质谱基质液配比
Table 1 Composition of matrix solutions for mass spectrometry

按照GB/T 4789.9—2014《食品微生物检验 空肠弯曲菌检验》方法分离纯化获得的空肠弯曲菌,接种至营养琼脂,42 ℃培养48 h。按照GB/T 4789.30—2016《食品微生物检验 单核细胞增生李斯特氏菌检验》的方法分离纯化获得单核细胞性李斯特菌,接种至营养琼脂,30 ℃培养24 h,各自获得对应的菌落以便进行质谱鉴定。挑取两种菌株单个纯菌落,按照表1分组用0.85%生理盐水稀释成菌悬液,配成麦氏浊度3.0~3.5的菌悬液。吸取5.0 μL的菌悬液滴加至质谱靶板对应孔中,常温干燥5 min。按照表1所示配方在C3、C4、L3和L4组样品孔中滴加1.0 μL的甲酸溶液处理干燥10 min,随后加入不同配比的基质液,干燥10 min待测。
1.3.2 VITEK MS鉴定
参数调整:激光强度47 Hz,每孔采样率100 次,分子质量范围2 000~20 000 D,有效检测范围3 000~16 000 D,峰值调整模式为线性。
质控校准:选取大肠杆菌ATCC8739作为质控菌。采用RUO软件对采集的样品图谱进行比对分析,与Myla肽指纹数据库中的对应标准菌株的超级图谱和参考图谱进行多重比对,以检出率表示为鉴定结果。指纹图谱对比分析调用Myla数据库中的超级图谱和参考图谱与样品质谱数据进行对比。
1.4 统计学处理
每组样品菌进行3 次重复鉴定,将每组质谱峰图荷质比及相对丰度分别统计,并计算同一个荷质比的平均丰度值及方差,通过SPSS统计软件(14.0)计算不同实验组之间的相似性,统计特征峰和缺失峰。
2.1 质谱分析结果
VITEK MS中以检出率为检测结果可靠性的评判标准。其中低于80.00%的认为检出结果较不可靠,80.00%~90.00%为检出结果较可靠,有待进一步判别,高于90.00%表示检测结果可靠,高于99.00%则表示检测结果极可靠。
通过不同配比的基质液处理待测菌,其质谱检出率存在差异(表2)。检出结果及检出率可见,革兰氏阴性菌空肠弯曲菌质谱鉴定结果受到基质液配比差异的影响较小,其中L1~L4组的乙醇、水及乙腈比例与空肠弯曲菌的检出率和结果没有明显关联,但C1、C2和C3组的TFA体积分数则与检出率呈现正相关,TFA体积分数不小于0.5%时,检出率达到99.99%。
表2 不同配比的基质液处理后鉴定结果及检出率差异
Table 2 Results of bacterial identifi cation and detections rates with different matrix solutions

而革兰氏阳性菌李斯特菌的检测则受到较大的影响。首先,甲酸处理与否直接影响检出结果和检出率,未处理导致只能检出为李斯特菌属而无法鉴定到种水平。L3和L4组结果可见,基质液含水可以显著提高检出率。检测结果显示其中C3及L4组的检出率均大于99%,质谱检测结果极可靠。
2.2 肽质量图谱分析结果
经过质谱鉴定得到空肠弯曲菌(图1)和单核细胞性李斯特菌的质量图谱(图2)。将所得质谱数据中的特征峰峰值(m/z)及相对丰度值(峰高)进行统计,同峰值的丰度值进行计算,得到不同基质液配比作用下特征峰及相对丰度值的质谱峰图谱。

图1 空肠弯曲菌经不同配比基质液处理后的质谱图谱
Fig. 1 Mass spectra for Campylobacter jejuni with different matrix solutions
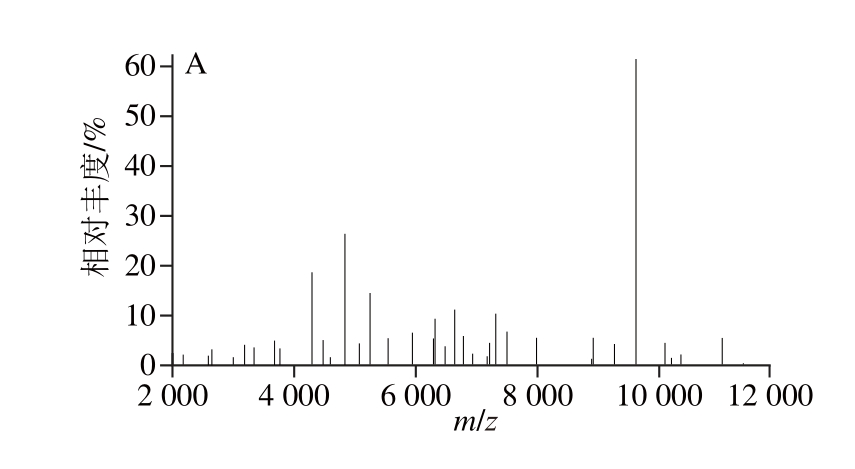
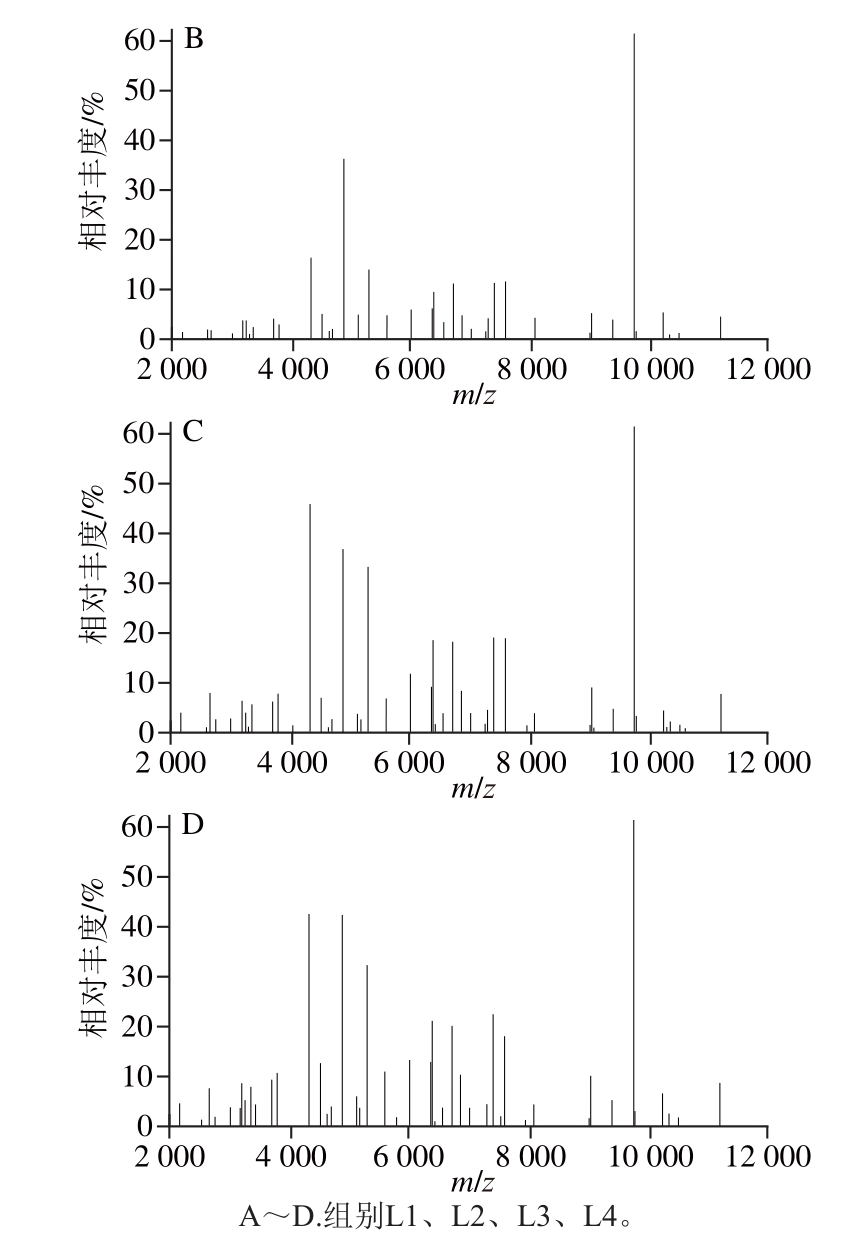
图2 单核细胞性李斯特菌经不同配比基质液处理后的质谱图谱
Fig. 2 Mass spectra for Listeria monocytogenes with different matrix solutions
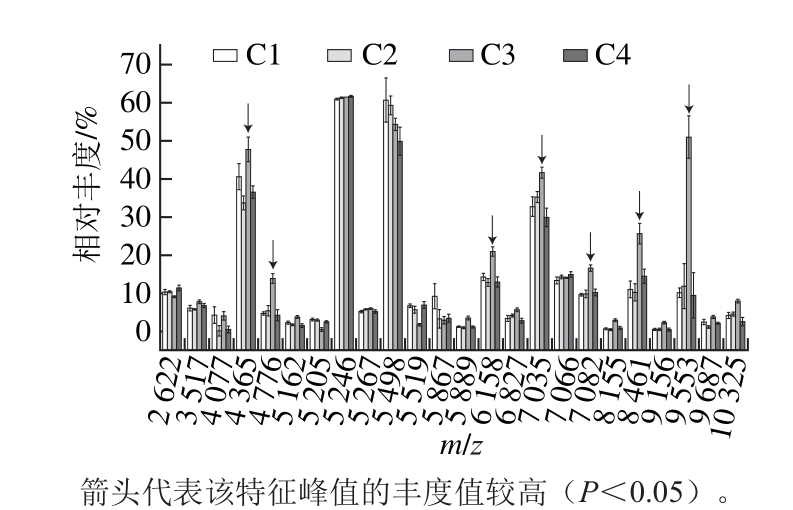
图3 不同配比基质液处理空肠弯曲菌后质量图谱特征峰及相对丰度对比
Fig. 3 Characteristic peaks and relative abundance for Campylobacter jejuni with different matrix solutions
空肠弯曲菌质谱数据分析显示(图3),各组的质谱峰图谱极其相似,各组检出峰未出现缺失现象。其中C3组特征峰m/z 4 365、4 776、6 158、7 035、7 082、8 461、9 553的相对峰强度较其他组更高,其中高峰值区的特征峰具有更高的峰强度,而低峰值区则没有显著的差异(P<0.05)。基质液的含水量对空肠弯曲菌质谱峰形有一定的影响,C4组含水较高可能由此降低了高峰值特征峰的相对峰强度,使得检出率小幅度下降。CHCA体积分数的高低对质谱结果的影响不明显,而TFA体积分数达到0.5%可以增加空肠弯曲菌的检出率,而TFA体积分数高于0.5%后检出峰相对峰强度增强不明显(结果未给出)。甲酸裂解处理后峰值强度没有明显增强,空肠弯曲菌不能通过甲酸裂解处理提高检出。m/z 4 365、5 267、5 498、7 035的相对峰强度较高,可能是空肠弯曲菌的特异性生物标志峰。

图4 不同配比基质液处理单核细胞性李斯特菌后质量图谱特征峰及丰度值对比
Fig. 4 Characteristic peaks and relative abundance for Listeria monocytogenes with different matrix solutions
单核细胞性李斯特菌的质谱峰图谱与空肠弯曲菌不同(图4)。所有组的图谱呈现明显的中高峰值区聚集现象,低峰值区的峰相对强度很低。L3和L4组的特征峰m/z 4 519、4 877、6 009、6 389、6 717、7 404和7 591的峰相对强度较高,峰形更突出,可见甲酸裂解后的实验组其各特征峰峰强度均有显著的提高,甲酸处理是革兰氏阳性菌质谱鉴定的关键。L3组基质液无水,导致m/z 3 714、5 118和5 172等特征峰缺失,而L1组基质液中缺乏并未出现类似空肠弯曲菌的检出率下降的现象,可见TFA体积分数对革兰氏阳性李斯特菌的影响较低。m/z 4 324、4 877和9 755特征峰峰强度较高,可以作为单核细胞性李斯特菌质谱检测的特异性生物标志。
以此配方对其他菌种进行了质谱分析(表3),发现检出菌都呈现C3和L4组实验组检出率较高的现象。大部分革兰氏阳性菌样品未用甲酸处理都难以检出。肺炎克雷伯菌、肺炎链球菌及蜡样芽孢杆菌使用改进后的基质液处理后,检出率没有得到显著改善(表3)。
表3 革兰氏阳性及阴性菌使用基质液配方与检出率
Table 3 Detection rates of Gram positive and negative bacteria using matrix solutions

注:—.未检出,检出率低于70%;*.最适配比组。
传统的微生物培养和鉴定是耗时又复杂的,由于不稳定的试剂、血清及培养条件的影响,鉴定结果往往具有显著的人为差异。采用自动化鉴定技术及快速鉴定技术,可以有效的减少人为、环境和培养条件带来的误差,实现精准鉴定。李斯特菌和空肠弯曲菌感染是严重危害人类健康的食源性疾病之一。空肠弯曲菌致病性具有很强的隐蔽性,它通过正常携带不致病方式隐藏在禽类肠道等内脏中,能够在厌氧条件生长,这些特征都极大的干扰了检测工作[17-19]。单核细胞性李斯特菌的致病性很强,冷冻食品中的单增细胞性李斯特菌对与免疫力低下的病人具有很强的致病性病死率较高,是全球重点关注的食源性致病菌[20-23]。建立快速、准确的疑难致病菌检测和鉴定方法,尤其是针对性的快速鉴定方法,对保证食品安全和人类健康具有重要意义。目前针对这两种致病菌的方法很多,我国检测领域目前常用的检测技术有传统表型鉴定、生化反应鉴定和特异性平板筛选等。但由于这两种致病菌培养慢,条件苛刻,较难检出,传统微生物鉴定技术不具备明显的优势。
新型微生物质谱技术能在短时间内直接检出单菌落种属水平信息。文献报道的VITEK MS微生物质谱分析的准确率在92.5%~99.0%之间,显著高于API生化分析法(78.5%)、显色培养鉴定法(59.3%)[24-26]。VITEK MS能快速、准确、高效地鉴定微生物。其中较为突出的是传统方法很难鉴定到种的酵母菌和真菌。据报道通过VITEK MS检测1058株酵母实验中,只有3%未检出,1%检出错误,有12 株菌株信息在VITEK MS数据库中缺失。通过ITS测序对比,发现VITEK MS的检出率达到96%[27]。大部分实验报道中,VITEK MS未能检出微生物的原因主要是数据库中图谱较少或缺失。随着该技术的广泛推广应用,质谱数据库将得到不断补充完善,鉴定结果更加准确和可靠[28-30]。
通过对空肠弯曲菌及李斯特菌质谱鉴定基质液的比较分析,本实验发现菌株前处理优化对于微生物质谱分析至关重要。革兰氏阳性菌李斯特菌及阴性菌空肠弯曲菌对基质液要求不同,李斯特菌需要甲酸破壁处理却对TFA含量要求较低,而空肠弯曲菌的基质液则需要将TFA体积分数提高至0.5%以上方能显著提高检出,而无需甲酸破壁处理。质谱基质液含水量控制在30%能够减少特征峰缺失,有效地提高检出率。为了降低成本,质谱分析用空肠弯曲菌基质液最优配方为:V(乙醇)∶V(乙腈)∶ V(水)=1∶1.5∶1,2.5% CHCA,0.2%~0.5% TFA;李斯特菌基质液最优配方为:V(乙醇)∶V(乙腈)∶V(水)=1∶1∶1,1.0% CHCA。阳性菌:取麦氏浊度3.0~3.5的菌液1.0 μL置于10 μL离心管,加入0.5 μL甲酸溶液破壁5 min,吸出混合液涂布于点样孔。加入1.0 μL的阳性菌基质液,25 ℃干燥10 min。阴性菌:取麦氏浊度1.0~1.5的菌液1.0 μL置于10 μL离心管直接涂布于点样孔。加入1.5 μL的阴性菌基质液,25 ℃干燥10 min。制定待测菌株的质谱检测处理流程(图5),可以完善常见食源性致病菌快速检测的平台,更有效地应对突发公共卫生事件的处理。通过改进基质液,针对革兰氏阴性和阳性菌进行区别处理,可以显著提高食源性致病菌的检出率。但是某些致病菌的质谱检测依然困难,VITEK MS很难检出志贺菌,同时肺炎克雷伯菌、肺炎链球菌和蜡样芽孢杆菌的质谱检测灵敏度较低。根据菌株特性推测,菌株的生长特征可能制约着质谱检测的检出。肺炎克雷伯菌具有很强的黏性,而CHCA基质液处理后结晶化程度较差,由此可能导致质谱检测灵敏度下降。蜡样芽孢杆菌和肺炎链球菌菌落干燥,且硬度较高,需要进行更有效的破壁处置。食源性致病菌在VITEK MS鉴定过程中对基质液的要求有差异,优化基质液配比和处理程序可以优化食源性致病菌质谱检测效率,提高质谱微生物鉴定的优势。进一步对不同食源性致病菌质谱鉴定过程中基质液的优化配比进行研究十分必要。
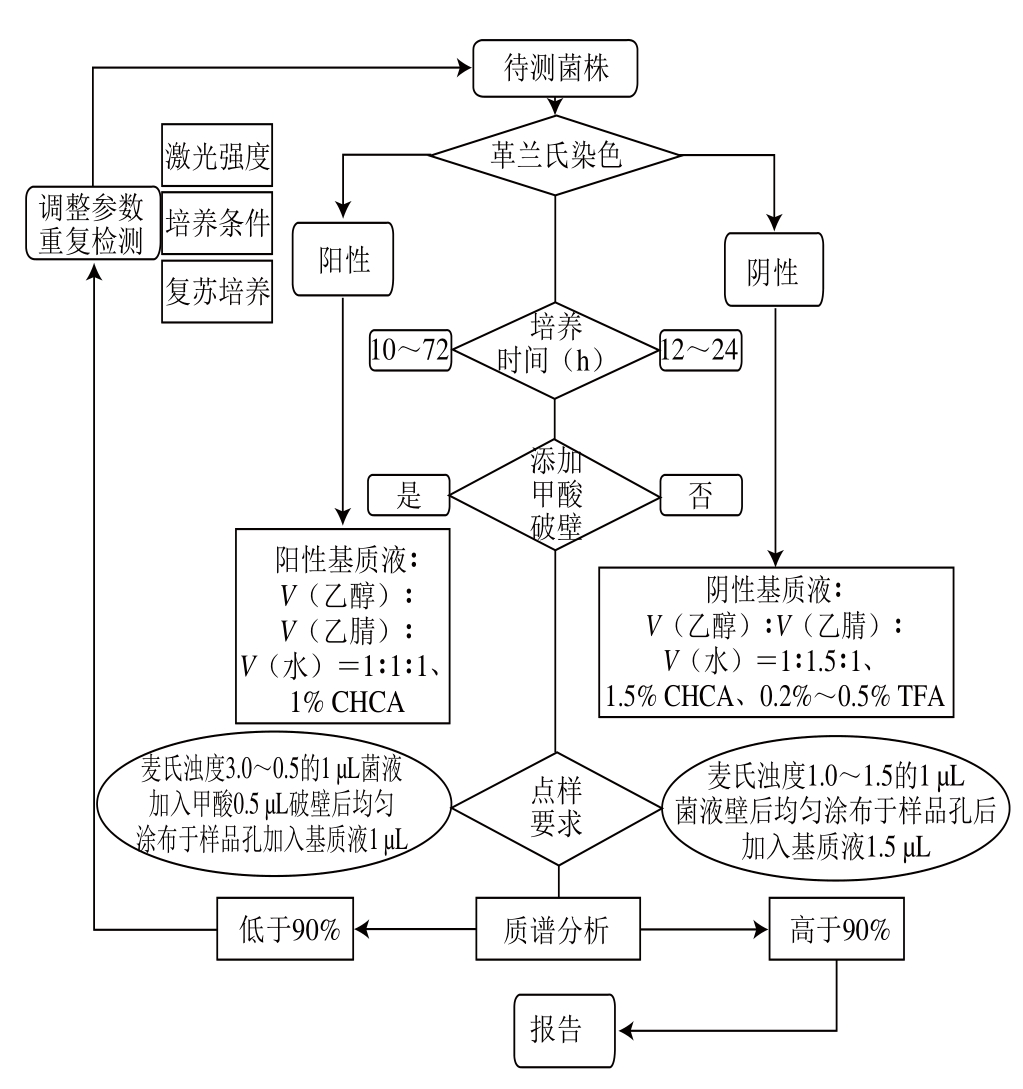
图5 革兰氏阳性和阴性菌VITEK MS检测流程
Fig. 5 Flow chart for VITEK MS detection process of Gram positive and negative bacteria
参考文献:
[1] VANERT M, HOFSTADLER A, JIANG Y, et al. Mass spectrometry provides accurate characterization of two genetic marker types in Bacillus anthracis[J]. Biotechniques, 2004, 37(4)∶ 642-644.
[2] BRIESE T, PALACIOS G, KOKORIS M, et al. Diagnostic system for rapid and sensitive differential detection of pathogens[J].Emerging Infectious Diseases, 2005, 11(2): 310-313. DOI:10.3201/eid1102.040492.
[3] SUH M, HAMBURG D, GREGORY S, et al. Extending ribosomal protein identifi cations to unsequenced bacterial strains using matrixassisted laser desorption/ionization mass spectrometry[J]. Protemics,2005, 5(18): 4818-4831. DOI:10.1002/pmic.200402111.
[4] CHRISTENSEN J, DARGIS R, HAMMER M, et al. Matrixassisted laser desorption ionization-time of fl ight mass spectrometry analysis of Gram-positive, catalase-negative cocci not belonging to the Streptococcus or Enterococcus genus and benefits of database extension[J]. Journal of Clinical Microbiology, 2012, 50(5): 1787-1791. DOI:10.1128/JCM.06339-11.
[5] XIAO D, ZHAO F, LV M, et al. Rapid identification of microorganisms isolated from throat swab specimens of communityacquired pneumonia patients by two MALDI-TOF MS systems[J].Diagnostic Microbiology & Infectious Disease, 2012, 73(4): 301-307.DOI:10.1016/j.diagmicrobio.2012.04.004.
[6] FERREIRA L, SANCHEZ F, GARCIA P, et al. MALDI-TOF mass spectrometry is a fast and reliable platform for identification and ecological studies of species from family Rhizobiaceae[J]. PLoS ONE,2011, 6(5): e20223. DOI:10.1371/journal.pone.0020223.
[7] VERROKEN A, JANSSENS M, BERHIN C, et al. Evaluation of matrix-assisted laser desorption ionization-time of flight mass spectrometry for identification of Nocardia species[J]. Journal of Clinical Microbiology, 2010, 48(11): 4015-4021. DOI:10.1128/JCM.01234-10.
[8] BLASER M J. Epidemiologic and clinical features of Campylobacter jejuni infections[J]. Journal of Infectious Diseases, 1997, 176(Suppl 2):103-105.
[9] SENOK A, YOUSIF A, MAZI W, et al. Pattern of antibiotic susceptibility in Campylobacter jejuni isolates of human and poultry origin[J]. Japanese Journal of Infectious Diseases, 2007, 60(1): 1-4.
[10] HOOD A M, PEARSON A D, SHAHAMAT M. The extent of surface contamination of retailed chickens with Campylobacter jejuni serogroups[J]. Epidemiol Infect, 1988, 100(1): 17-25.
[11] ACHESON D, ALLOS B M. Campylobacter jejuni infections: update on emerging issues and trends[J]. Clinical Infectious Diseases, 2001,32(8): 1201-1206. DOI:10.1086/319760.
[12] MENGAUD J, VICENTE M F, CHENEVERT J, et al. Expression in Escherichia coli and analysis of the listeiolysin O determinant of Listeria monocytogenes[J]. Infection and Immunity, 1998, 56(4): 766-772.
[13] 龚艳清, 陈信忠, 杨俊萍, 等. 基质辅助激光解吸电离飞行时间质谱在李斯特菌检测和鉴定中的应用[J]. 食品科学, 2012, 33(6):209-214.
[14] 杨捷琳, 魏黎明, 顾鸣, 等. 食源性李斯特菌蛋白质双向电泳图谱及稳定生长期细菌蛋白质分析[J]. 中国卫生检验杂志, 2009, 19(3):491-494.
[15] ZHU B Q, XIAO D, ZHANG H F, et al. MALDI-TOF MS distinctly differentiates nontypable Haemophilus influenza from Haemophilus haemolyticus[J]. PLoS ONE, 2013, 8(2): e56139. DOI:10.1371/journal.pone.0056139.
[16] MURUGAIYAN J, AHRHOLDT J, KOWBEL V, et al. Establishment of a matrix-assisted laser desorption ionization time-of-flight mass spectrometry database for rapid identification of infectious achlorophyllous green micro-algae of the genus Prototheca[J]. Clinical Microbiology and Infection, 2012, 18(5): 461-467. DOI:10.1111/j.1469-0691.2011.03593.x.
[17] CAPOOR M R, NAIR D, DEB M, et al. Enteric fever perspective in India: emergence of high-level ciprofl oxacin resistance and rising MIC to cephalosporins[J]. Journal of Medical Microbiology, 2006,55(Pt 11): 1533-1538. DOI:10.1099/jmm.0.47170-0.
[18] 徐君怡, 曹际娟, 郑秋月, 等. 变性高效液相色谱检测沙门氏菌、空肠弯曲菌和肠出血性大肠杆菌[J]. 生物技术通报, 2009, 3(16): 127-131.
[19] 翟海华, 王娟, 王君伟, 等. 空肠弯曲菌的致病性及致病机制研究进展[J]. 动物医学进展, 2013, 34(12): 164-169. DOI:10.3969/j.issn.1007-5038.2013.12.038.
[20] WALECK A E, MOLEND A J, BANIA J. The impact of environmental stress on Listeria monocytogenes virulence[J]. Polish Journal of Veterinary Sciences, 2009, 12(4): 575-579.
[21] 王耀, 曹际娟, 赵昕单, 等. 增李斯特氏菌MALDI-TOF-MS鉴定与分型研究[J]. 食品科学, 2012, 33(3): 194-198.
[22] 吕淑霞, 徐彬, 于晓丹, 等. EMA-LAMP方法快速鉴别检测单增李斯特菌[J]. 食品与生物技术学报, 2012, 31(9): 951-956.
[23] 曹玮, 王宁, 王晓英, 等. 单增李斯特菌PCR-ELISA 快速检测技术研究[J]. 卫生研究, 2009, 38(6): 662-666.
[24] BADER O, WEIG M, TAVERNE G L, et al. Improved clinical laboratory identifi cation of human pathogenic yeasts by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J].Clinical Microbiology and Infection, 2011, 17(9): 1359-1365.DOI:10.1111/j.1469-0691.2010.03398.x.
[25] SALAH Z, GÜLAY G, STINA B, et al. Identification of clinical Pasteurella isolates by MALDI-TOF-a comparison with VITEK 2 and conventional microbiological methods[J]. Diagnostic Microbiology & Infectious Disease, 2013, 77(2): 96-98. DOI:10.1016/j.diagmicrobio.2013.06.024.
[26] VAN VEEN S Q, CLAAS E C, KUIJPER E J. High-throughput identifi cation of bacteria and yeast by matrix-assisted laser desorption ionization time of flight mass spectrometry in conventional medical microbiology laboratories[J]. Journal of Clinical Microbiology, 2010,48(3): 900-907. DOI:10.1128/JCM.02071-09.
[27] 梁铮, 柏彩英, 罗娅莎, 等. MALDI-TOF-MS技术快速鉴定临床酵母样真菌的应用评价[J]. 检验医学与临床, 2015, 12(18): 2659-2663.DOI:10.3969/j.issn.1672-9455.2015.18.005.
[28] MELLMANN A, CLOUD J, MAIER T, et al. Evaluation of matrixassisted laser desorption ionization-time-of-fl ight mass spectrometry in comparison to 16S rRNA gene sequencing for species identifi cation of nonfermenting bacteria[J]. Journal of Clinical Microbiology, 2008,46(6)∶ 1946-1954. DOI∶10.1128/JCM.00157-08.
[29] SAUER S, KLIEM M. Mass spectrometry tools for the classifi cation and identifi cation of bacteria[J]. Nature Reviews Microbiology, 2010,8(1)∶ 74-82. DOI∶10.1038/nrmicro2243.
[30] SENG P, DRANCOURT M, GOURIET F, et al. Ongoing revolution in bacteriology∶ routine identifi cation of bacteria by matrix-asisted laser desorption ionization time-of-flight mass spectrometry[J]. Clinical Infectious Diseases, 2009, 49(4)∶ 543-551. DOI∶10.1086/600885.
Matrix-Assisted Laser Desorption Ionization Time of Flight Mass Spectrometry for the Detection of Campylobacter jejuni and Listeria monocytogenes
TU Bowen1, JI Junmin1, DU Qiang1, LI Junhong1, TANG Hongbing1, XIONG Jibin2, HAN Xiaodong3
(1. Changzhou Centers for Disease Control and Prevention, Changzhou 213022, China;2. The Vaccine Engineering Center of Taizhou Medical Hi-tech Industrial Park, Taizhou 225300, China;3. School of Medical, Nanjing University, Nanjing 210093, China)
中图分类号:R446.5
文献标志码:A
文章编号:1002-6630(2017)20-0262-06
收稿日期:2016-10-27
基金项目:江苏省自然科学基金项目(BK20150250);江苏省卫生计生委科研项目(Y2015016);
常州市科技项目(CE20165042)
作者简介:屠博文(1984—),男,助理研究员,博士,主要从事病原微生物质谱检测和院内感染超级细菌的基因分型研究。
E-mail:tbwchangzhou@163.com
引文格式:
屠博文, 吉俊敏, 杜强, 等. 基质辅助激光解析飞行质谱法检测空肠弯曲菌及李斯特菌[J]. 食品科学, 2017, 38(20):262-267. DOI:10.7506/spkx1002-6630-201720038. http://www.spkx.net.cn
TU Bowen, JI Junmin, DU Qiang, et al. Matrix-assisted laser desorption ionization time of fl ight mass spectrometry for the detection of Campylobacter jejuni and Listeria monocytogenes[J]. Food Science, 2017, 38(20)∶ 262-267. ( in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720038. http∶//www.spkx.net.cn