
图1 二氰蒽醌的结构式
Fig. 1 Structural formula of dithianon
秦 旭,徐应明*,赵立杰,黄青青,王 林,孙约兵,梁学峰
(农业部环境保护科研监测所,天津 300191)
摘 要:建立苹果和土壤样品中二氰蒽醌的快速提取及高效液相色谱检测法。样品采用乙腈提取,改进的QuEChERS法净化,安捷伦Eclipse XDB-C18色谱柱进行分离,检测波长250 nm,基质匹配标准品外标法定量分析。二氰蒽醌在0.02~5.00 mg/L质量浓度范围内线性关系良好,在苹果和土壤中的平均回收率为74%~92%,相对标准偏差为1.02%~6.20%,最小检出量(RSN>3)为0.005 ng,检出限为0.02 mg/kg。田间实验结果表明,二氰蒽醌在苹果和土壤中的消解半衰期分别为3.8~12.6 d和1.0~8.3 d,在收获期苹果中的残留量均低于我国规定的最大残留限量5 mg/kg,推荐采收安全间隔期为14 d。
关键词:二氰蒽醌;QuEChERS;高效液相色谱;苹果;土壤;残留
Abstract: A method was developed for the determination of dithianon residues in apple and soil by using high performance liquid chromatography (HPLC). The residues in samples were extracted with acetonitrile, cleaned up by a modifi ed quick,easy, cheap, effective, rugged and safe (QuEChERS) method, separated on an Agilent Eclipse XDB-C18column, and then analyzed by HPLC with variable-wavelength detection (VWD) at a wavelength of 250 nm. The analyte was quantifi ed by the matrix-matched external standard method. Under the optimal conditions, the calibration curve showed good linearity in the range of 0.02–5.00 mg/L for dithianon. The average recoveries of dithianon were in the range of 74%–92%, with relative standard deviations (RSDs) of 1.02%–6.20%. The limit of detection (LOD, RSN> 3) of dithianon was 0.005 ng, and the limit of quantitation (LOQ) was 0.02 mg/kg. The half-life of dithianon was 3.8–12.6 and 1.0–8.3 days in apple and soil,respectively. At harvest, apple samples were found to contain dithianon levels below the maximum residue limit (MRL) in China (5 mg/kg). The harvest interval was recommended to be 14 days after the last application.
Key words: dithianon; QuEChERS; high performance liquid chromatography (HPLC); apple; soil; residue
DOI∶10.7506/spkx1002-6630-201720040
苹果(Malus domestica)是最常见的水果之一,营养丰富,在我国广泛种植。中国也是世界上最大的苹果生产国和消费国,其种植面积和产量均占世界总量的40%以上,在世界苹果产业中占有重要地位。但苹果树在种植及果实生长过程中极易感染多种病害,如斑点落叶病、白粉病、果树腐烂病、褐斑病、轮纹病、黑星病和炭疽病等。目前,已有研究表明在苹果树上喷施杀菌剂二氰蒽醌可以有效防治上述病症,且无药害[1-2]。
二氰蒽醌(又名二噻农,化学式见图1),化学名称为2,3-二氰基-1,4-二硫代蒽醌,分子式为C14H4N2O2S2,相对分子质量为296.32。二氰蒽醌是一种用于仁果、核果等多种叶部病害的优秀保护性杀菌剂[3-4],在我国得到广泛应用。但由于二氰蒽醌对非靶标生物具有一定的毒性[3,5],存在一定的膳食和生态风险,所以对其在苹果中的消解动态及残留情况进行有效监测不仅对于保障我国苹果安全生产及人民的身体健康具有重要意义,也是全面评估其膳食及生态风险的重要基础。

图1 二氰蒽醌的结构式
Fig. 1 Structural formula of dithianon
目前,分析二氰蒽醌应用的仪器主要有高效液相色谱(high performance liquid chromatography,HPLC)和HPLC-串联质谱,涉及的基质有梨[6]、苹果[6-8]、山药[9]、辣椒[10]、草莓[11]、柑橘[12]、葡萄[5,12]、谷物[13]等农作物以及农田土壤[14-15],此外还有利用表面增强拉曼光谱建立了其在橙皮和柠檬皮中的残留方法[16]以及利用凝胶渗透色谱和核磁共振检测其在土壤中残留量[17-18]的报道。而关于二氰蒽醌在农作物中的残留行为情况则报道较少[19],苹果中二氰蒽醌的消解动态及最终残留情况则尚未见报道。本实验对广泛应用的QuEChERS(quick,easy,cheap,effective,rugged,safe)法[20-22]进行改进并用于苹果和土壤样品的提取和净化,使用HPLC-可变波长检测器对样品进行基质外标法定量检测,建立了简便、快速的二氰蒽醌在苹果和土壤中的残留分析方法,方法的灵敏度、准确度和精密度均符合农药残留检测的相关要求,同时结合2013—2014年在天津市、山东省和陕西省进行的两年三地的田间实验,探明了二氰蒽醌在苹果园中的消解行为及残留特征,并为其生态风险评价及安全合理使用提供帮助。
1.1 材料与试剂
二氰蒽醌标准品(纯度为99%) 德国Dr.Ehrenstorfer GmbH公司;70%二氰蒽醌水分散粒剂 陕西美邦农药有限公司;乙腈(色谱纯) 德国Merck公司;NaCl、KCl、CaCl2、苯二甲酸盐(C6H4CO2HCO2K)、磷酸盐(KH2PO4、Na2HPO4)、Na2B4O7、K2Cr2O7、H2SO4、FeSO4、邻菲罗啉(C12H8N2)、无水MgSO4和N-丙基乙二胺(primary secondary amine,PSA)均为分析纯;实验用水为自制超纯水。
1.2 仪器与设备
Dionex Ultimate 3000型HPLC仪(配可变波长检测器) 美国赛默飞世尔科技公司;Eclipse XDB-C18反相色谱柱(25 cm×4.6 mm,5 μm) 美国安捷伦科技公司;FW-100高速万能粉碎机 天津泰斯特公司;H2050R-1高速冷冻离心机、WTL-6K迷你离心机 湖南湘仪集团;MTV-100多管旋涡混合仪 杭州奥盛仪器有限公司;MX-S可调式混匀仪 中国大龙兴创仪器有限公司;Milli-Q超纯水仪 美国密理博公司;AE240电子天平 瑞士梅特勒-托利多公司;MR 3001型pH计德国Heidolph公司;PB-10磁力搅拌器 德国赛多利斯公司;Eppendorf系列移液枪 德国艾本德公司。
1.3 方法
1.3.1 田间实验
1.3.1.1 实验点信息
参照《农药残留试验准则》[23]的相关要求,分别于2013年7—9月和2014年7—9月在天津市、山东省烟台市和陕西省咸阳市进行了70%二氰蒽醌水分散粒剂在苹果上的残留消解动态实验和最终残留实验。实验地点信息见表1。
表1 田间实验地点信息
Table 1 Information about locations where fi eld experiments where fi eld experiments were carried out

1.3.1.2 消解动态实验
在供试苹果园中设3 个重复小区,每小区3 棵果树[23],施药剂量为533 倍稀释液,在苹果生长至1/3大小时全株均匀喷药1 次,直至苹果和树叶有液滴滴下时停止喷药。再选一块10 m2表面平整、墒情适中且不种植任何植物的地块做土壤消解动态实验,与苹果上消解动态实验同时施药,施药剂量为533 倍稀释液,喷雾器兑水1 L,将药液全部喷施于地表。施药后2 h,1、3、7、14、21 d及28 d采用五点法在每个实验小区随机采集2 kg生长正常、无病害的苹果,切碎、混匀后采用四分法留样0.25 kg;用土钻采集0~10 cm的土壤1~2 kg,除去土壤中的碎石、杂草和植物根茎等杂物,混匀后采用四分法留样0.25 kg。所有样品均装入塑料密封袋中,贴好标签并编号,贮存于-20 ℃冰柜中[26]。
1.3.1.3 最终残留实验
设置两个施药剂量,分别为推荐剂量800 倍稀释液和1.5 倍推荐剂量533 倍稀释液,两个剂量各设3 次和4 次施药处理,两次施药间隔为10 d,每个处理设3 个重复小区,每个小区3 棵苹果树[23]。在苹果生长至1/3大小时开始第1次施药,直至苹果和树叶有液滴滴下时停止喷药。距最后1 次施药处理14、21 d和28 d每小区以随机多点方式采集苹果和0~15 cm深的土壤样品,在苹果收获期时每小区以五点法随机采集苹果2 kg,切碎、混匀后按四分法留样0.25 kg;每小区以五点法随机采集土壤(0~15 cm)2 kg,去除杂物后充分混匀,按四分法各留样0.25 kg,所有样品均用塑料密封袋封装、编号,-20 ℃以下低温冰柜保存待测[26]。
1.3.1.4 空白对照实验
在实验点附近选取未施药的苹果地,采集土壤和苹果作为空白对照。
1.3.2 样品的提取和净化
称取搅碎的苹果和土壤样品各5.0 g于50 mL塑料大离心管中,依次加入10 mL水(苹果样品不加水)、10 mL乙腈和3 g NaCl,涡旋提取5 min,然后以3 800 r/min转速离心5 min。
称取150 mg无水MgSO4和80 mg PSA于2 mL塑料小离心管中,将大离心管中的上层清液移取1.5 mL置于小离心管中,然后将小离心管涡旋1 min,以6 000 r/min转速离心1 min,从上清液中移取1 mL过滤于进样小瓶中待测。
1.3.3 色谱条件
Agilent Eclipse XDB-C18反相色谱柱(4.6 mm×250 mm,5 μm);柱温:30 ℃;流动相:乙腈-水(55∶45,V/V);流速:1 mL/min;进样量:10 μL;检测波长:250 nm。在此条件下,二氰蒽醌的保留时间为10.6 min。
2.1 仪器条件及前处理方法优化
2.1.1 检测波长的选择
对二氰蒽醌的标准品进行紫外全波长扫描(图2),发现二氰蒽醌在低波长190~205 nm处有较大的吸收峰,但考虑到其他杂质在此波长处也有较大吸收,会对二者的分析产生干扰。而二氰蒽醌在250 nm波长处的吸收峰也较大,且杂质干扰相对较小,故选择250 nm作为检测波长,标准品HPLC见图3。
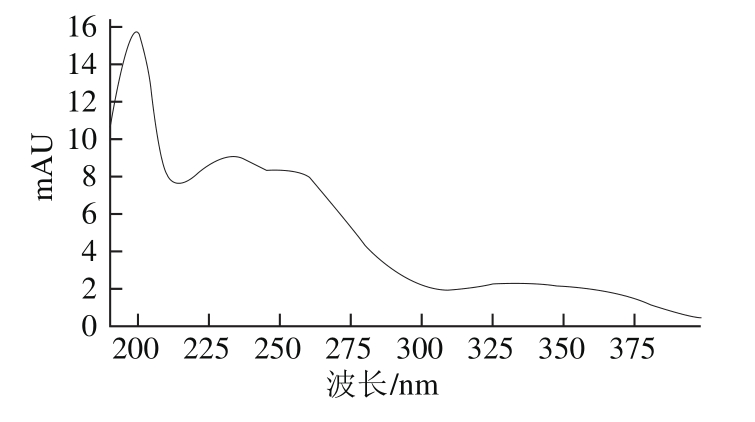
图2 二氰蒽醌的紫外吸收光谱图
Fig. 2 UV absorption spectrum of dithianon

图3 二氰蒽醌标准品HPLC图(0.1 mg/L)
Fig. 3 HPLC of dithianon standard (0.1 mg/L)
2.1.2 样品前处理条件的优化
本实验的样品前处理选择了简单、可靠的QuEChERS法,并进行了适当的优化。在苹果样品前处理方法摸索过程中,通过对比PSA、弗罗里硅土(Florisil)、硅胶(Silica)、石墨化炭黑(graphitizing of carbon black,GCB)和C18等几种常见净化剂的净化效果及方法回收率,发现净化剂的种类对实验结果有较为明显的影响(表2)。综合净化效果、方法回收率和实验成本等多种因素,最后确定PSA作为净化剂。土壤样品由于基质较为简单、杂质较少,可与苹果样品选用相同的净化剂。
表2 苹果样品中净化剂种类对方法回收率和净化效果的影响
Table 2 Infl uence of different adsorbents on recovery and purifi cation of dithianon in apple samples

2.2 方法学评价
2.2.1 线性关系
分别用乙腈、土壤基质和苹果基质配制二氰蒽醌系列标准工作液,并按优化后的色谱条件进行分析,以进样质量浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线,结果如表3所示。结果表明,在0.02~5 mg/L的质量浓度范围内,二氰蒽醌的响应值与其质量浓度的线性关系良好(R2>0.999)。
表3 二氰蒽醌在不同基质中的标准曲线参数
Table 3 Calibration curves for dithianon in different matrix solvents

2.2.2 灵敏度、准确度与精密度实验结果
在1.3.2节色谱条件下,当信噪比(RSN)为3时,确定二氰蒽醌的最小检出量为0.005 ng。通过向空白样品中添加不同质量浓度的二氰蒽醌标准品进行添加回收实验,确定二氰蒽醌在苹果和土壤中的检出限均为0.020 mg/kg。
向空白的苹果和土壤中分别进行3 个水平的二氰蒽醌加标回收实验,每个添加水平均重复5 次,计算回收率和相对标准偏差(relative standard deviations,RSD)(表4)。二氰蒽醌在苹果中的平均回收率为74%~86%,RSD为1.02%~4.68%;在土壤中的平均回收率为86%~92%,RSD为1.14%~6.20%,HPLC图见图4。方法的准确性和精密度均能满足农药残留分析的相关要求[17]。
表4 方法的添加回收率和RSD
Table 4 Recoveries and RSDs of dithianon in various samples

采用1 mg/L二氰蒽醌标准溶液连续进样5 次,测得其峰面积的RSD为0.26%,表明仪器具有良好的稳定性。
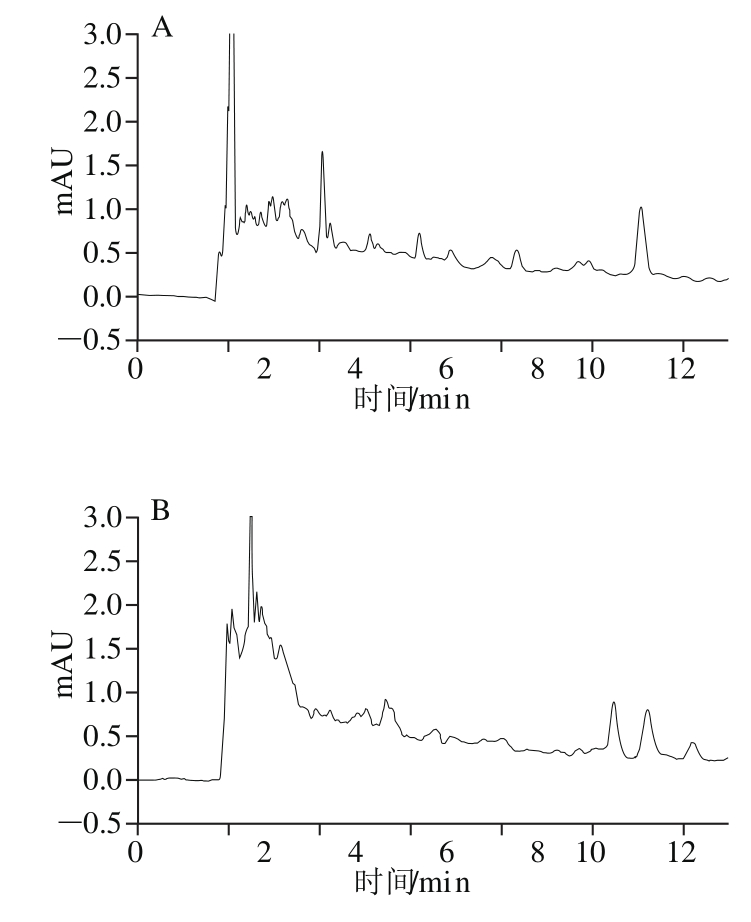

图4 二氰蒽醌的HPLC图
Fig. 4 HPLC of dithianon in blank and spiked samples
2.3 田间实验结果
2.3.1 消解动态实验结果

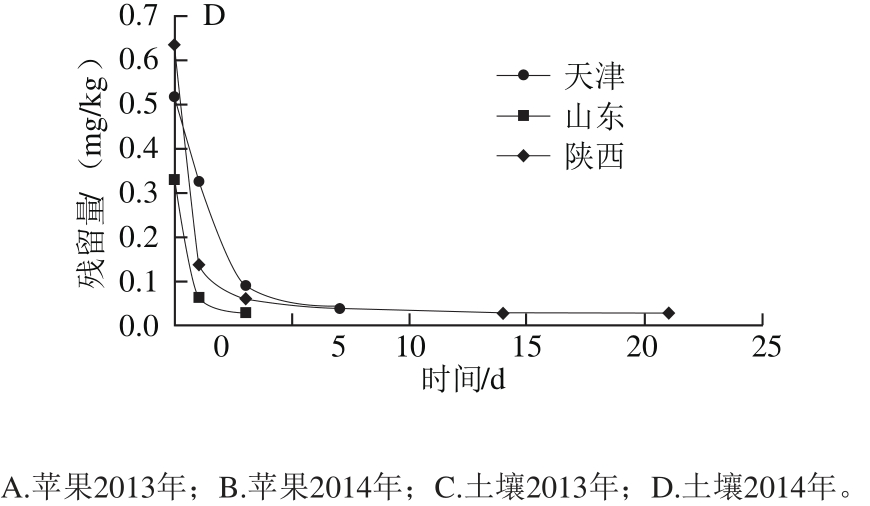
图5 二氰蒽醌在样品中的消解动态曲线
Fig. 5 Degradation curves of dithianon in samples
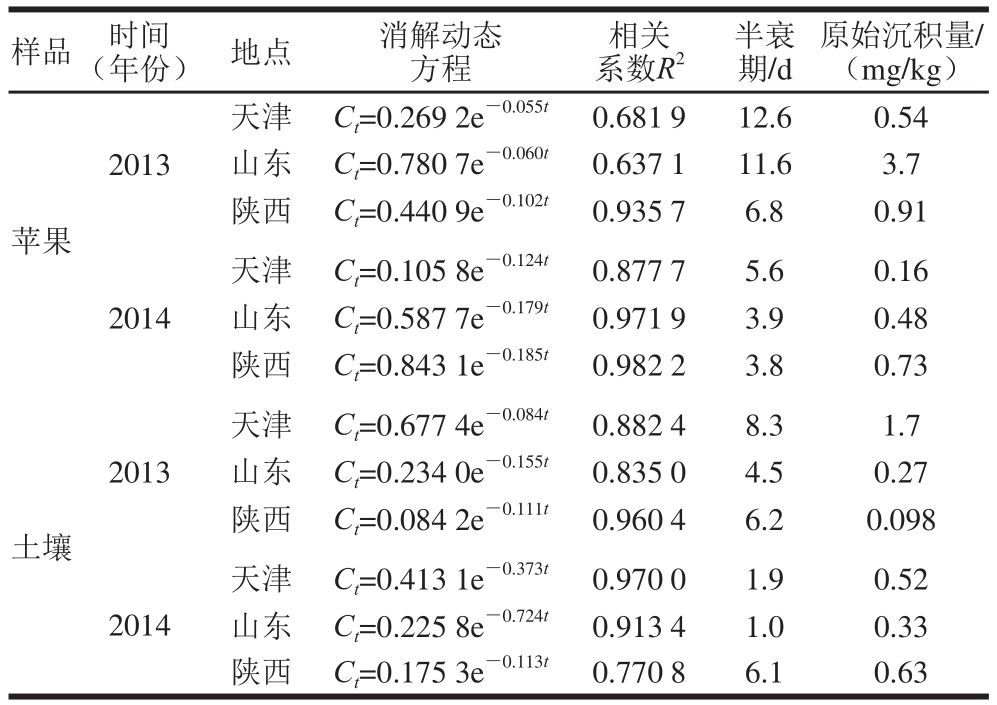
2013—2014年二氰蒽醌在天津、山东和陕西三地苹果和土壤中的消解动态情况如图5和表5所示。二氰蒽醌在苹果和土壤中半衰期分别为3.8~12.6 d和1.0~8.3 d,施药后28 d消解率均大于90%,可以看出,二氰蒽醌在苹果和土壤中的消解速率均较快,残留量均随着时间的推移而逐渐下降,消解规律符合一级动力学曲线。从表5可以看出,二氰蒽醌在天津、山东烟台和陕西咸阳三地苹果中的消解半衰期在两年实验中均呈现依次减少的特点,由于三地苹果品种相同,生长期基本一致,所以这种消解速率上的差异就同三地气候和环境差异有直接关系,如表1所示,三地中陕西省咸阳市具有更长的日照、更高的气温和更大的降水量,这些因素都有利于农药的消解;而天津市的日照时间最短、气温最低、降水量最小,所以其二氰蒽醌的消解速度最慢。
表5 二氰蒽醌在苹果和土壤中消解动态实验结果
Table 5 Kinetic equations for dithianon degradation in apple and soil
2.3.2 最终残留实验结果
二氰蒽醌在苹果和土壤中的最终残留数据见表6,70%二氰蒽醌水分散粒剂分别以推荐剂量和1.5倍推荐剂量各施药3~4 次,两次施药间隔10 d,在距最后1次施药14、21 d和28 d时二氰蒽醌在土壤中的最终残留量分别低于0.020~0.36、0.020~1.1 mg/kg和0.020~0.63 mg/kg,在苹果中的最终残留量分别为低于0.020~2.2、0.020~1.1 mg/kg和0.020~1.4 mg/kg,在苹果中的残留量均远低于我国规定的最大残留限量5 mg/kg[27]。
表6 2013和2014年苹果和土壤中二氰蒽醌的最终残留量
Table 6 Final residual levels of dithianon in apple and soil in 2013 and 2014

本实验利用HPLC-可变波长检测器并通过对QuEChERS法进行适当简化建立了一套苹果和土壤中二氰蒽醌的提取、净化和检测方法,该方法前处理时间较短且简便易行、成本较低,目标物与杂质峰分离较好,方法的灵敏度、精确度和稳定性均符合农药残留检测的相关要求,适合常规实验室大规模样品检测。
二氰蒽醌在苹果和土壤中半衰期分别为3.8~12.6 d和1.0~8.3 d,其在苹果中的消解速率由快到慢依次为陕西、山东和天津,说明其在苹果中的消解情况受地域和环境的影响较为明显。目前国内外关于二氰蒽醌在农作物中的残留行为报道较少,仅有兰丰等[19]报道了其在枣中的半衰期为1.5~2.5 d,消解速率快于本实验的其在苹果中的半衰期。总的来看,二氰蒽醌在这两种水果中均属于易降解农药。有研究表明,另几种常见的保护性杀菌剂如代森锰锌、丙森锌和异菌脲在苹果中的消解半衰期分别为9.4~10.2[28]、6.0~6.8 d[29]和12.9~17.1 d[30],二氰蒽醌与上述3 种农药相比,在苹果中的消解速率大体一致,但略快于异菌脲。
最终残留实验结果表明,在距最后1次施药14、21 d和28 d时,二氰蒽醌在苹果中的最高残留量分别为2.2、1.1 mg/kg和1.4 mg/kg,均低于我国规定的最大残留限量值5 mg/kg。说明分别以推荐剂量800 倍稀释液和1.5 倍推荐剂量533 倍稀释液施用70%二氰蒽醌水分散粒剂,各施药3 次和4 次,在苹果生长至1/3大小时开始第1次施药,两次施药间隔10 d,在距最后1次施药14、21 d和28 d时二氰蒽醌在苹果中的残留是安全的,并建议其在苹果上的采收安全间隔期为14 d。
参考文献:
[1] 于晓丽, 王培松, 王英姿. 22.7%二氰蒽醌悬浮剂对苹果主要真菌病害防治效果评价[J]. 烟台果树, 2015(2)∶ 20-21. DOI∶10.3969/j.issn.1005-9938.2015.02.008.
[2] 王培松, 王英姿, 栾炳辉, 等. 二氰蒽醌悬浮剂防治苹果轮纹病、褐斑病田间试验[J]. 烟台果树, 2011(1)∶ 19-20. DOI∶10.3969/j.issn.1005-9938.2011.01.013.
[3] 张敏恒. 新编农药商品手册[M]. 北京∶ 化学工业出版社, 2006∶ 675.
[4] RALF U, MICHAEL M B. Effects of fungicide and insecticide mixtures on apple tree canopy photosynthesis. dark respiration and carbon economy[J]. Crop Protection, 2004, 23(10)∶ 1001-1006.DOI:10.1016/j.cropro.2004.02.012.
[5] POZZETTIA L, PAOLINIA M, BARILLARI J, et al. Induction and suppression of murine CYP-mediated biotransformation by dithianon∶organ- and sex-related differences[J]. Cancer Letters, 1999, 141(1/2)∶47-56. DOI:10.1016/j.cropro.2004.02.012.
[6] 李彩霞, 王雅东. 分散固相萃取-高效液相色谱法测定水果中的二氰蒽醌残留[J]. 广东农业科学, 2012, 39(3)∶ 110-111. DOI∶10.3969/j.issn.1004-874X.2012.03.037.
[7] 王晓菁, 吴燕, 牛艳, 等. 苹果及土壤中二氰蒽醌残留量的高效液相色谱分析[J]. 安徽农业科学, 2014, 42(31)∶ 10936-10937.DOI∶10.3969/j.issn.0517-6611.2014.31.039.
[8] BAKER P G, CLARKE P G. Determination of residues of dithianon in apples by high-performance liquid chromatography[J]. Analyst, 1984,109(1)∶ 81-83. DOI:10.1039/an9840900081.
[9] 赵艳芹, 吴绪金, 谢桂英, 等. 山药及土壤中二氰蒽醌残留量的高效液相色谱分析[J]. 农药, 2015, 54(5)∶ 360-362.
[10] 吴燕, 姜瑞, 牛艳, 等. 辣椒及土壤中二氰蒽醌残留量的高效液相色谱分析[J]. 湖北农业科学, 2015, 54(6)∶ 1469-1471. DOI∶10.14088/j.cnki.issn0439-8114.2015.06.048.
[11] 赫秀萍, 毕瑞锋. 液相色谱-串联质谱法测定草莓中二噻农残留[J]. 化学分析计量, 2014, 23(4)∶ 48-50. DOI∶10.3969/j.issn.1008-6145.2014.04.014.
[12] 马婧玮, 李萌, 张军锋, 等. 液相色谱法测定葡萄及柑橘中二氰蒽醌的残留量[J]. 现代农药, 2014, 13(3)∶ 43-45. DOI∶10.3969/j.issn.1671-5284.2014.03.013.
[13] VERMA B C, THAKUR H K, SINGH J, et al. A new spectrophotometric method for the determination of dithianon in commercial formulations and its residues in foodstuffs[J]. Journal of AOAC International, 1999, 82(6)∶ 1298-1302.
[14] UEOKA M, ALLINSON G, KELSALL Y, et al. Environmental fate of pesticides used in Australian viticulture∶ behaviour of dithianon and vinclozolin in the soils of the South Australian Riverland[J].Chemosphere, 1997, 35(12)∶ 2915-2924. DOI:10.1016/S0045-6535(97)00279-8.
[15] 焦少俊, 石利利, 单正军, 等. 二氰蒽醌在几种典型土壤中的降解吸附和移动特性[J]. 农药科学与管理, 2012, 33(11)∶ 23-28.DOI∶10.13526/j.issn.1006-6144.2015.03.003.
[16] 陈漾, 李攻科, 胡玉玲. 表面增强拉曼光谱法快速定量分析食品中福美双、二氰蒽醌和灭蝇胺的残留[J]. 分析科学学报, 2015, 31(3)∶307-312. DOI∶10.13526/j.issn.1006-6144.2015.03.003.
[17] WANNER U, BURAUEL P, FÜHR F. Characterisation of soilbound residue fractions of the fungicide dithianon by gel permeation chromatography and polyacrylamide gel electrophoresis[J].Environmental Pollution, 2000, 108(1)∶ 53-59. DOI:10.1016/S0269-7491(99)00201-8.
[18] WANNER U, BURAUEL P, DEGRAAF A A, et al. Characterization of non-extractable residues of the fungicide dithianon in soil using13C/14C-labelling techniques[J]. Environmental Pollution, 2005, 133(1)∶35-41. DOI:10.1016/j.envpol.2004.04.017.
[19] 兰丰, 刘传德, 周先学, 等. 二氰蒽醌和吡唑醚菌酯在枣中的残留行为及膳食摄入风险评估[J]. 农药学学报, 2015, 17(6)∶ 706-714.DOI∶10.3969/j.issn.1008-7303.2015.06.010.
[20] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2)∶ 412-431.
[21] 张中印, 赵柳微, 曹葳蕤, 等. QuEChERS前处理方法结合高效液相色谱-串联质谱测定蜂蜜和蜂王浆中14 种喹诺酮类药物残留[J]. 食品科学, 2016, 37(16)∶ 242-248. DOI∶10.7506/spkx1002-6630-201616039.
[22] 王玉健, 纪少凡, 陈文慧, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定饮料中13 种饱和内酯类合成香料[J]. 食品科学,2016, 37(12)∶ 197-202. DOI∶10.7506/spkx1002-6630-201612035.
[23] 农业部. 农药残留试验准则∶ NY/T 788—2004[S]. 北京∶ 中国农业出版社, 2004.
[24] 农业部. 土壤pH的测定∶ NY/T 1377—2007[S]. 北京∶ 中国农业出版社, 2007.
[25] 农业部. 土壤检测 第6部分∶ 土壤有机质的测定∶ NY/T 1121.6—2006[S]. 北京∶ 中国农业出版社, 2006.
[26] 农业部农药检定所. 农药登记残留田间试验标准操作规程[M].北京∶ 中国标准出版社, 2007∶ 128-132; 395-400.
[27] 国家卫生和计划生育委员会, 农业部. 食品中农药最大残留限量∶GB 2763—2014[S]. 北京∶ 中国标准出版社, 2014.
[28] 冯秀琼, 李琥, 赵秋霞, 等. 代森锰锌及其代谢物乙撑硫脲在苹果及土壤中的残留研究[J]. 农药, 1997, 36(5)∶ 31-33.
[29] 刘智卓, 秦旭, 徐应明, 等. 苹果和土壤中丙森锌的消解动态及残留规律[J]. 环境化学, 2012, 31(7)∶ 1094-1100.
[30] 宋国春, 于建垒, 张君亭, 等. 异菌脲在苹果和土壤中的残留消解动态研究[J]. 农药, 2004, 43(4)∶ 184-185; 180. DOI∶10.3969/j.issn.1006-0413.2004.04.014.
Determination and Dissipation Kinetics of Dithianon Residue in Apple and Soil by Modifi ed QuEChERS Coupled with HPLC
QIN Xu, XU Yingming*, ZHAO Lijie, HUANG Qingqing, WANG Lin, SUN Yuebing, LIANG Xuefeng
(Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China)
中图分类号:S432.4;O656.3
文献标志码:A
文章编号:1002-6630(2017)20-0273-06
引文格式:
秦旭, 徐应明, 赵立杰, 等. QuEChERS法前处理结合HPLC法测定苹果和土壤中二氰蒽醌的残留[J]. 食品科学, 2017,38(20)∶ 273-278. DOI∶10.7506/spkx1002-6630-201720040. http∶//www.spkx.net.cn
QIN Xu, XU Yingming, ZHAO Lijie, et al. Determination and dissipation kinetics of dithianon residue in apple and soil by modifi ed QuEChERS coupled with HPLC[J]. Food Science, 2017, 38(20)∶ 273-278. (in Chinese with English abstract)DOI∶10.7506/spkx1002-6630-201720040. http∶//www.spkx.net.cn
收稿日期:2016-09-21
基金项目:天津市农业科技成果转化与推广项目(201502290)
作者简介:秦旭(1982—),男,高级工程师,博士研究生,研究方向为农药在农田中的污染监测与安全评价。
E-mail:qinxu621@163.com
*通信作者:徐应明(1964—),男,研究员,博士,研究方向为农田重金属与农药污染修复。E-mail:ymxu1999@126.com