表1 30 批藜麦样品的产地
Table 1 Geographical origins of 30 batches of buckheat samples

曹亚楠1,2,白 雪2,赵 钢2,邹 亮2,3,胡一晨2,*
(1.西华大学食品与生物工程学院,四川 成都 610039;2.成都大学 农业部杂粮加工重点实验室,四川 成都 610106;3.成都大学医学院,四川 成都 610106)
摘 要:采用超高效液相色谱(ultra performance liquid chromatography,UPLC)对来自世界范围多地区的30 批次藜麦进行质量控制研究,通过方法学考察建立不同产地藜麦样品UPLC指纹图谱,并分析其相似度。借助聚类分析、主成分分析、偏最小二乘判别分析等化学计量学方法对其产地和质量的相关性进行分析。结果表明,30 批藜麦对照图谱存在12 个共有峰,样品相似度大于0.7;通过化学计量法,藜麦样品按产地被很好地分为4 类,主成分分析和模式识别分析结果提示其质量差异主要与3 个化合物相关。UPLC指纹图谱的构建和化学模式的识别为藜麦质量控制提供更全面的参考,为有效控制藜麦质量提供参考依据。
关键词:藜麦;超高效液相色谱法;指纹图谱
Abstract: In this research, a method for the quality control of 30 batches of quinoa from many different areas of the world was established by ultra-performance liquid chromatography (UPLC). UPLC fi ngerprints were established after evaluation of fi gures of merit. The similarity was analyzed by similarity evaluation software. The relationship between geographical origin and quality was analyzed by cluster analysis, principal component analysis (PCA), partial least squares-discriminant analysis (PLS-DA) and other chemometric methods. The results showed that there were 12 peaks common to 30 batches of quinoa, and the similarity among samples was greater than 0.7. Using the chemometric methods, the quinoa samples were classifi ed into four categories according to their geographical orgins. The PCA and pattern recognition analysis indicated that the quality difference was mainly related to three compounds. Therefore, UPLC fi ngerprinting and chemical pattern recognition can provide detailed references for the quality control of quinoa.
Key words: quinoa; ultra performance liquid chromatography (UPLC); fi ngerprinting
DOI∶10.7506/spkx1002-6630-201720042
藜麦属于藜科藜属双子叶植物,原产于安第斯山区,主要分布在秘鲁、玻利维亚和厄瓜多尔等国家,古代印加人称之为“mother of all grains”[1]。联合国粮农组织认为藜麦是唯一的可满足人体基本营养需求的单一植物性食物,和一般谷物相比,藜麦均衡营养,其籽粒中蛋白质、维生素、矿物质等营养物质含量都较高,其种类和含量与人类生命活动的基本物质需求匹配度相当高[2-4]。值得关注的是,藜麦还含有丰富的多酚类、黄酮类、皂苷等活性成分,对于维持人类的身体健康具有十分重要的作用,具有增强机体功能、修复体质、调节免疫和内分泌系统、提高机体应激能力、预防疾病、抗癌和减肥等功效,具有显著抗氧化、抗炎、降血糖、减肥等多种生物活性[5-12],适宜于“三高”疾病和心脏病等慢性病的保健和辅助治疗。因此,藜麦对未来农业和医药研究开发具有十分重要的意义。
鉴于藜麦高营养和经济价值,目前全世界多地区对藜麦进行了广泛引种,中国的藜麦种植面积在2012年已成为非原产地国家第2位[13-14]。目前研究者们重点关注藜麦优良品种选育和栽培技术优化等方面,然而作物的品质与其生长的地域和环境密切相关,如同中药材讲究“道地性”,自然条件或栽培条件改变,植物生产发育及其形态结构常常出现变异。生态地理因子是影响药材道地性的重要因素,其中水分状况、温度、光照、土壤成分是直接影响因子,而地形、成土是间接影响因子。如土壤中的微量元素直接影响植物中微量元素的富集,进而影响其品质。所以不同地区种植的藜麦可能存在质量差异[15-18]。因此,对比研究不同产地藜麦化学组分,揭示产地来源对藜麦质量的影响,对藜麦质量控制具有重要意义。指纹图谱技术是全面、整体地控制中药或农作物质量最有效的方法之一,是其化学组成整体性的化学表征,能够反映研究对象尽量多的组分,对药材或粮食质量控制具有整体性,现已成为中药(食物)质量控制和评价的热点之一[19-24]。目前鲜见藜麦化学组分指纹图谱方面的文献报道,本研究建立了6 个国家30 批藜麦样品的超高效液相色谱(ultra performance liquid chromatography,UPLC)指纹图谱,并结合相似度评价、系统聚类分析、主成分分析(principal component analysis,PCA)等方法对数据进行了深入挖掘和分析,进行藜麦多产地质量分析和评价,以期为全面控制藜麦质量提供实验依据。
1.1 材料与试剂
藜麦原产于玻利维亚、智利和秘鲁等南美国家,随后在中国、日本、韩国等亚洲国家大量引种种植,而中国种植藜麦的区域分布广泛,主要有山西、四川、云南、甘肃、内蒙古等地区。因此,本实验根据其主要原产地和引种地区,收集藜麦样品进行测定,藜麦样品的产地或收集地具体情况见表1。
表1 30 批藜麦样品的产地
Table 1 Geographical origins of 30 batches of buckheat samples

芦丁(批号:150622,纯度≥98%)、槲皮素(批号:150419,纯度≥98%)、阿魏酸(批号:150526,纯度≥98%)、对香豆酸(批号:150927,纯度≥98%)、齐墩果酸(批号:151008,纯度≥98%) 四川省维克生物技术有限公司;咖啡酸(批号:K-003-140730,纯度≥98%)、异荭草素(批号:Y-132-140801,纯度≥98%)、牡荆素(批号:M-023-140730,纯度≥98%) 成都瑞芬思生物技术有限公司;乙腈(色谱纯,生产批号:AS1122-001)、甲醇(色谱纯,生产批号:MS1992-001) 安徽天地高纯溶剂有限公司;水为超纯水;其余实验试剂均为分析纯。
1.2 仪器与设备
ACQUITY UPLC H-Class UPLC仪(四元溶剂管理器、恒温进样样品管理器、柱温箱、二极管阵列检测器) 沃特世上海科技有限公 司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;CP224C十万分之一分析天平 上海奥豪斯仪器有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱为ACQUITY UPLC®BEH C18(50 mm×2.1 mm,1.7 μm),流动相为甲醇(A)-0.2%冰乙酸溶液(B),梯度洗脱(表2);检测波长247 nm;柱温35 ℃;流速0.2 mL/min;进样量1 μL。
表2 梯度洗脱程序
Table 2 Gradient elution program

1.3.2 供试品溶液的制备
将干燥后的藜麦粉碎过60 目筛,精密称定藜麦粉末1.000 g,置10 mL容量瓶中,加90%甲醇溶液至刻度,摇匀,称定质量,超声处理30 min,取出,冷却至室温,用90%甲醇溶液补足质量,摇匀,12 000 r/min离心10 min,取上清液,0.22 μm微孔滤膜滤过,取续滤液,即得。
1.3.3 混合标准品溶液的制备
取对照品芦丁、槲皮素、异荭草素、牡荆素、阿魏酸、咖啡酸、对香豆酸、齐墩果酸适量分别置于棕色量瓶中,精密称定,加甲醇溶液溶解并定容,制成对照品储备液。分别取对照品储备液适 量置于同一棕色量瓶,加甲醇定容至刻度,制成质量浓度芦丁1.2 μg/mL、槲皮素3.0 μg/mL、异荭草素8.9 μg/mL、牡荆素8.8 μg/mL、阿魏酸1.5 μg/mL、咖啡酸1.2 μg/mL、对香豆酸1.5 μg/mL、齐墩果酸8.5 μg/mL的混合标准品溶液,摇匀即得。
1.3.4 方法学考察
1.3.4.1 精密度考察
取同一份藜麦供试品溶液,按1.3.1节色谱条件,连续进样6 针,记录色谱图,以色谱图中6.8、7.2、8.0、10.3 min共有色谱峰保留时间和峰面积为指标计算相对标准偏差(relative standard deviation,RSD)。
1.3.4.2 重复性考察
取6 份藜麦粉末,按1.3.2节供试品溶液制备方法制备供试品,以色谱图中6.8、7.2、8.0、10.3min共有色谱峰保留时间和峰面积为指标计算RSD。
1.3.4.3 稳定性考察
取同一份藜麦供试品溶液,分别于0、2、4、8、16、24 h进样,按1.3.1节色谱条件测定。以色谱图中6.8、7.2、8.0、10.3 min共有色谱峰保留时间和峰面积为指标计算RSD。
1.3.5 样品测定及UPLC指纹图谱建立
取30 份藜麦样品,按1.3.2节方法制备供试品溶液,按1.3.1节色谱条件依次进样测定,记录色谱图,选择分离度良好、峰位居中、峰面积较大的色谱峰作为参比峰。将所得的30 批藜麦UPLC图谱依次导入国家药典委员会编写的“中药色谱指纹图谱相似度评价系统2012版”软件,以S1批样品作为相似度计算时的校正参照图谱,时间窗宽度设定为0.10,采用多点校正法对参照谱进行指纹匹配,并进行相似度计算,得到对照图谱。同时根据8 种对照品对对照图谱中化学色谱峰进行指认。
1.3.6 化学计量学数据分析
聚类分析是一种自动聚类技术,目的是建立样簇的层次结构,密切相似的样品可以归类为相同的集群,相聚较远的可以归类为不同的集群[25]。本实验运用SPSS软件(18.0版本)对30批藜麦样品进行聚类分析,根据所得树状图对样品来源和质量进行分类;PCA是一种常见的无监督模式识别方法,在尽量保留原信息的基础上,以降维的方式将多个原始变量,综合为少数几个变量,并找出对于模型鉴别影响大的重要变量[26-27]。偏最小二乘法判别分析(partial least squares-discriminate analysis,PLS-DA)技术是PCA的回归延伸,它利用类的信息优势,试图最大限度地观测组之间的分离,进一步提升方法的可靠性和有效性[28-29]。本实验运用SIMCA-P软件对30 批藜麦样品的化学成分信息进行PCA和PLS-DA模式识别,筛选出对藜麦质量影响大的化学成分信息,为藜麦质量控制提供依据。
2.1 UPLC指纹图谱方法学考察结果
表3 基于4 个共有峰的方法学考察结果(RSD)
Table 3 Evaluation of fi gures of merit based on four common chromatogram peeaakkss%

由表3可知,重复进样6 次,藜麦样品UPLC图谱中4 个共有峰的保留时间和峰面积的RSD均小于3%,仪器的精密度良好,符合UPLC指纹图谱的分析要求;6 份藜麦样品采用同一方法处理,4 个共有峰的保留时间和峰面积的RSD均小于3%,表明该方法重复性良好;24 h内不同时间进样,4 个共有峰的保留时间和峰面积的RSD均小于3%,表明藜麦样品在24 h内稳定性良好。
2.2 藜麦UPLC指纹图谱的建立
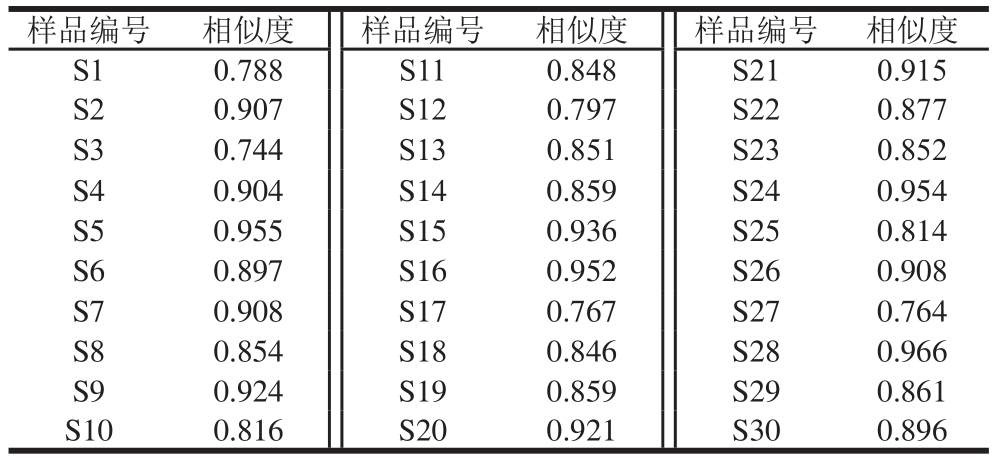
取1.1节30 批不同产地的藜麦供试品,参照1.3.2节方法分别制备供试品溶液,采用1.3.1节色谱条件进样测定,记录30 批次藜麦UPLC指纹色谱叠加图[24](图1)。将30 批藜麦的指纹图谱数据导入“中药色谱指纹图谱相似度评价系统”(2012版)软件,以中位数法生成藜麦对照指纹图谱,确定了12 个共有峰。将该对照指纹图谱与其他批次药材图谱进行对比,30 批不同产地和来源的藜麦样品化学成分相似度在0.744~0.966之间,见表4。其中,大部分样品和对照谱图的相似度在0.85以上,导致不同样本之间差异性的原因可能是产地、种属和采收季节的不同。因为不同产地的温度、光照、土壤成分、水分状况不同,导致植物出现一定的品质差异;生态地理环境也会对植物的遗传物质产生一定的影响,进而导致植物初生及次生代谢物的累积差异。

图1 30 批次藜麦样品的UPLC叠加图
Fig. 1 Overlapping UPLC chromatograms for 30 batches of quinoa samples
表4 不同产地藜麦的相似度
Table 4 Similarity between quinoa samples
2.3 指纹图谱中主要色谱峰的指认

图2 混合标准品溶液(A)和对照品(B)色谱图
Fig. 2 UPLC fi ngerprints of mixed standard solution (A) and control sample (B)
在1.3.1节色谱条件下,将咖啡酸、对香豆酸、阿魏酸、异荭草素、牡荆素、芦丁、槲皮素、齐墩果酸及其混合标准品依次进样,根据保留时间将混合标准品溶液与对照指纹图谱进行对比,完成对其中部分共有峰的指认,结果如图2所示。
2.4 模式识别分析结果
2.4.1 聚类分析结果
聚类分析是根据样本的相似程度进行归类,目前在中药真伪鉴别、质量评价、品种分类等应用较多[30]。本实验对不同产地的30 批次藜麦样品作指纹图谱分析,获得12 个共有峰,将各个共有峰相对于参比峰的峰面积量化,得到30×12阶原始数据矩阵,导入SPSS软件,采用组间连接法,选用欧氏距离对30 批样品进行系统聚类分析,结果如图3所示。

图3 30 批藜麦样品聚类分析树状图
Fig. 3 Dendrogram from hierarchical cluster analysis for the 30 tested batches of quinoa
由图3可以明显看出,聚类分析将指纹图谱大致分成了4 类,第Ⅰ类:S13、S23、S7、S8、S29、S15、S28、S5、S4、S9、S2、S21、S6、S16、S14、S26、S19、S24、S30、S20、S22。第Ⅱ类:S3、S10、S27、S18、S25、S11、S17。第Ⅲ类:S1。第Ⅳ类:S12。
由图3还可以看出,Ⅰ、Ⅱ、Ⅲ、Ⅳ类之间的距离为25,Ⅲ、Ⅳ类之间的距离为16,Ⅰ、Ⅱ类之间的距离为10,由此说明Ⅲ、Ⅳ类之间很相似,Ⅰ、Ⅱ类之间很相似,Ⅰ、Ⅱ类和Ⅲ、Ⅳ类相差较大。根据表1中藜麦样品产地(或收集地)信息可知,Ⅲ和Ⅳ类样品分别来自于藜麦的原产地南美秘鲁和玻利维亚,Ⅱ类样品大多来源于日本、韩国等亚洲国家或地区,Ⅰ类样品基本来源于中国的多个产地。由此说明,藜麦的产地对其质量影响较大,可能与其种植气候、品种等因素相关。藜麦的原产地秘鲁、玻利维亚属于高原地区,与中国、韩国等亚洲国家及地区的气候相差较大,作物的生长 状况就会出现一定的差异;土壤中微量元素与水分含量也有一定的差异,导致植物吸收的营养成分也大不相同,所以不同产地的藜麦其质量有一定差异。
2.4.2 PCA结果
选取共有色谱峰的相对峰面积值作为变量,对30 批藜麦样品进行PCA,经计算,前3 个主成分因子对总方差的累计贡献率达78.53%(图4),故仅用前3 个主成分就可表示藜麦UPLC数据的主要信息。
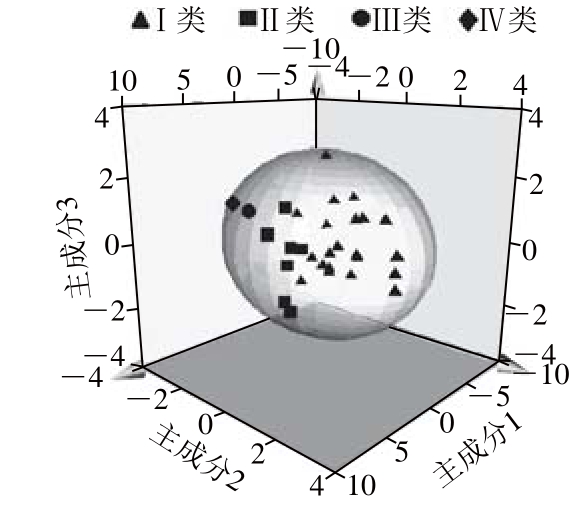
图4 基于PCA提取的3 个主成分对样品来源进行判别的PCA
Fig. 4 Distribution of quinoa samples based on the fi rst three principal components extracted in PCA
2.4.3 PLS-DA结果

图5 基于PLS-DA提取的3 个主成分对样品来源进行判别的PLS-DA
Fig. 5 Distribution of quinoa samples based on the first three principal components extracted in PLS-DA
运用PLS-DA技术获得一个高水平的组间分离结果。基于30 批藜麦样品中共有峰峰面积所得到的三维的PLS-DA散点图(图5)表明,所有测试样品可以根据其起源分为4组,并且根据每个变量对样品辨别的贡献率得出峰1(咖啡酸)、峰7(槲皮素)和峰8(齐墩果酸)可能是区分藜麦来源的最重要的变量。然后,用7 倍交叉分析估计所建立的判别模型的预测能力,R2Y和Q2Y的值分别为0.822和0.486,由此得出所建立的判别模型稳定性良好,预测能力也较好。运用统计推断方法分析是为了进一步验证鉴别模型,图6为PLS-DA模型置换验证图,图中Q2为累计交叉有效性,Q2值越大表示模型的预测能力越好;R2为累计方差值,表示有多少原始数据被用于建立新的PLS-DA判别模型,R2值越大则表示模型的解释能力越强。由图6可知,R2和Q2截距值分别为0.711和-0.245,所有位于左边的R2和Q2(Y轴数据)均低于最右边的R2和Q2值,且Q2回归线的截距均为负值,说明所建立的PLS-DA判别模型没有出现过拟合现象,具有较好的预测能力。上述结果表明,根据样品的起源对样品进行分类,进而进行质量控制,PLS-DA技术会比PCA更适合。
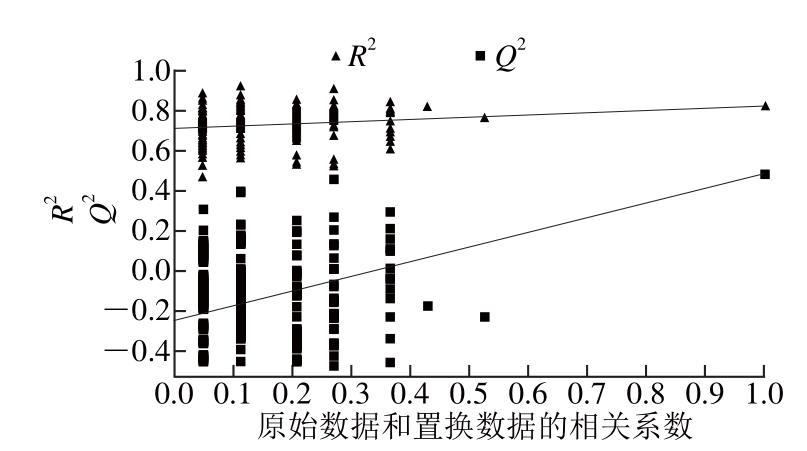
图6 基于PLS-DA 的 R2和Q2的截距
Fig. 6 R2and Q2intercept values from 200 permutations in PLS-DA
藜麦中含有多种天然化学成分,测定一个或几个指标成分不能全面地反映其质量,因此全面系统地建立其特征性指纹图谱,是质量评价和控制的有效方法。全世界范围内藜麦产地较多,由于生长环境、土壤性质等原因,不仅易导致其营养组成不同,化学成分之间也有所不同,因而表现在UPLC色谱图中峰位的差异。本实验首先对样品处理方法、流动相系统、柱温、流速等实验条件进行考察,得到最佳分析条件,建立了多产地藜麦的指纹图谱,并通过相似度分析、聚类分析、PCA、PLSDA模式识别等方法相互印证,根据其化学组成对不同产地或来源的藜麦进行分类,筛选出共有的特征成分和决定其质量的关键色谱峰,将各产地藜麦质量较清晰地区别和分类,为藜麦质量控制提供依据。
参考文献:
[1] FERREIRA D S, PALLONE J A L, POPPI R J. Direct analysis of the main chemical constituents in Chenopodium quinoa, grain using Fourier transform near-infrared spectroscopy[J]. Food Control, 2015,48(48)∶ 91-95. DOI∶10.1016/j.foodcont.2014.04.016.
[2] 王黎明, 马宁, 李颂, 等. 藜麦的营养价值及其应用前景[J]. 食品工业科技, 2014, 35(1): 381-384. DOI:10.13386/j.issn1002-0306.2014.01.007.
[3] FAO. An ancient crop to contribute to world food security[D]. Italy∶Food and Agriculture Organization, 2011.
[4] 申瑞玲, 张文杰, 董吉林, 等. 藜麦的营养成分、健康促进作用及其在食品工业中的应用[J]. 中国粮油学报, 2016, 31(9): 150-155.
[5] 肖正春, 张广伦. 藜麦及其资源开发利用[J]. 中国野生植物资源,2014, 33(2): 62-66. DOI:10.3969/j.issn.1006-9690.2014.02.015.
[6] YAO T, LI X H, BING Z, et al. Characterisation of phenolics,betanins and antioxidant activities in seeds of three Chenopodium quinoa, Willd. genotypes[J]. Food Chemistry, 2015, 166: 380-388.DOI:10.1016/j.foodchem.2014.06.18.
[7] GRAF B L, CHENG D M, ESPOSITO D, et al. Compounds leached from quinoa seeds inhibit matrix metalloproteinase activity and intracellular reactive oxygenspecies[J]. International Journal of Cosmetic Science, 2014, 37(2): 212-221. DOI:10.1111/ics.12185.
[8] LAUS M N, GAGLIARDI A, SOCCIO M, et al. Antioxidant activity of free and bound compounds in quinoa (Chenopodium quinoa,Willd.) seeds in comparison with durum wheat and emmer[J]. Journal of Food Science, 2012, 77(11): 1150-1155. DOI:10.1111/j.1750-3841.2012.02923.x.
[9] ZEVALLOS V F, HERENCIA L I, CHANG F, et al. Gastrointestinal effects of eating quinoa (Chenopodium quinoa Willd.) in celiac patients[J]. American Journal of Gastroenterology, 2014, 109(2): 270-278. DOI:10.1038/ajg.2013.431.
[10] YAO Y, SHI Z X, REN G X. Antioxidant and immunoregulatory activity of polysaccharides from quinoa (Chenopodium quinoa Willd.)[J].International Journal of Molecular Sciences, 2014, 15(10): 19307-19318. DOI:10.3390/ijms151019307.
[11] GRAF B L, POULEV A, KUHN P, et al. Quinoa seeds leach phytoecdysteroids and other compounds with anti-diabetic properties[J]. Food Chemistry, 2014, 163(3): 178-185. DOI:10.1016/j.foodchem.2014.04.088.
[12] 阙淼琳, 蒋玉蓉, 曹美丽, 等. 响应面试验优化藜麦种子多酚提取工艺及其品种差异[J]. 食品科学, 2016, 37(4): 7-12. DOI:10.7506/spkx1002-6630-201604002.
[13] 魏爱春, 杨修仕, 么杨, 等. 藜麦营养功能成分及生物活性研究进展[J]. 食品科学, 2015, 36(15): 272-276. DOI:10.7506/spkx1002-6630-201515050.
[14] BAZILE D, JACOBSEN S, VERNIAU A. The global expansion of quinoa: trends and limits[J]. Frontiers in Plant Science, 2016, 622(7):1-6. DOI:10.3389/fpls.2016.00622/full.
[15] 任贵兴, 杨修仕, 么杨. 中国藜麦产业现状[J]. 作物杂志, 2015(5):1-5. DOI:10.16035/j.issn.1001-7283.2015.05.001.
[16] 顾娴, 黄杰, 魏玉明, 等. 藜麦研究进展及发展前景[J]. 中国农学通报, 2015, 31(30): 201-204.
[17] 倪瑞军, 张永清, 庞春花, 等. 藜麦幼苗对水氮耦合变化的可塑性响应[J]. 作物杂志, 2015(6): 91-98. DOI:10.16035/j.issn.1001-7283.2015.06.016.
[18] HIROSE Y, FUJITA T, ISHII T, et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa, seeds cultivated in Japan[J]. Food Chemistry, 2010, 119(4): 1300-1306. DOI:10.1016/j.foodchem.2009.09.008.
[19] 杨燕梅, 黄得栋, 卢有媛, 等. 黄管秦艽UPLC指纹图谱研究[J]. 中药材, 2016, 39(8): 1734-1737. DOI:10.13863/j.issn1001-4454.2016.08.012.
[20] 陈林伟, 秦昆明, 徐雪松, 等. 中药指纹图谱数据库的研究现状及展望[J]. 中草药, 2014, 45(21): 3041-3047. DOI:10.7501/j.issn.0253-2670.2014.21.001.
[21] 李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22): 3095-3104. DOI:10.7501/j.issn.0253-2670.2013.22.001.
[22] 侯湘梅, 岳洪水, 张磊, 等. 中药质量一致性评价探讨[J]. 药物评价研究, 2016, 39(1): 38-45. DOI:10.7501/j.issn.1674-6376.2016.01.006.
[23] 祝明, 陈碧莲, 石上梅. 中药指纹图谱技术在中国药典2015年版一部中的应用[J]. 中国现代应用药学, 2016, 33(5): 611-614.DOI:10.13748/j.cnki.issn1007-7693.2016.05.022.
[24] 李宝丽, 朱宇轩, 邓建玲, 等. 基于GC-MS指纹图谱和化学计量分析鉴别预包装纯葡萄汁及葡萄汁制品[J]. 食品科学, 2015, 36(8):156-161. DOI:10.7506/spkx1002-6630-201508028.
[25] 陈念贻, 钦佩, 陈瑞亮, 等. 模式识别方法在化学化工中的应用[M].北京: 科学出版社, 2000: 121-133.
[26] 杨天伟, 张霁, 李涛, 等. 基于主成分分析和聚类分析的不同产地绒柄牛肝菌红外光谱鉴别研究[J]. 光谱学与光谱分析, 2016, 36(6):1726-1730. DOI:10.3964/j.issn.1000-0593(2016)06-1726-05.
[27] 刘莉敏, 郭军, 米智慧, 等. 蜂胶样品乙醇提取物的UPLC-Q-TOFMS指纹特征[J]. 食品科学, 2014, 35(18): 96-99. DOI:10.7506/spkx1002-6630-201418019.
[28] 杨忠, 任海青, 江泽慧. PLS-DA法判别分析木材生物腐朽的研究[J].光谱学与光谱分析, 2008, 28(4): 793-796.
[29] 孙灵霞, 陈锦屏, 赵改名, 等. 化学计量学在食品分析中的应用研究进展[J]. 食品工业科技, 2012, 33(7): 444-448. DOI:10.13386/j.issn1002-0306.2012.07.106.
[30] 王景富, 王静霞, 左旭, 等. 基于黄酮类成分聚类分析的苦荞粉掺兑检测方法研究[J]. 食品工业科技, 2016, 37(13): 309-313.DOI:10.13386/j.issn1002-0306.2016.13.055.
Application of UPLC Fingerprint Coupled with Chemometry for Quality Control of Quinoa from Different Geographical Origins
CAO Yanan1,2, BAI Xue2, ZHAO Gang2, ZOU Liang2,3, HU Yichen2,*
(1. College of Food and Bioengineering, Xihua University, Chengdu 610039, China;2. Key Laboratory of Coarse Cereal Processing, Ministry of Agriculture, Chengdu University, Chengdu 610106, China;3. College of Medicine, Chengdu University, Chengdu 610106, China)
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)20-0286-06
引文格式:
曹亚楠, 白雪, 赵钢, 等. UPLC指纹图谱结合化学计量学的多产地藜麦质量控制[J]. 食品科学, 2017, 38(20): 286-291.DOI:10.7506/spkx1002-6630-201720042. http://www.spkx.net.cn
CAO Yanan, BAI Xue, ZHAO Gang, et al. Application of UPLC fi ngerprint coupled with chemometry for quality control of quinoa from different geographical origins[J]. Food Science, 2017, 38(20)∶ 286-291. (in Chinese with English abstract)DOI∶10.7506/spkx1002-6630-201720042. http∶//www.spkx.net.cn
收稿日期:2016-10-24
基金项目:四川省教育厅项目(17ZB0113);成都大学校青年基金项目(2080516032)
作者简介:曹亚楠(1993—),女,硕士研究生,研究方向为食品科学。E-mail:1015880420@qq.com
*通信作者:胡一晨(1987—),女,讲师,博士,研究方向为中药质量控制及活性成分。E-mail:huyichen0323@126.com