
图1 电膜萃取五价砷的装置
Fig. 1 Schematic of the device used for electromembrane extraction(EME) of As (Ⅴ)
吴 航1,姜效军1,*,吕琳琳1,2,艾 天1
(1.辽宁科技大学化学工程学院,辽宁 鞍山 114051;2.鞍山师范学院化学与生命科学学院,辽宁 鞍山 114007)
摘 要:应用电膜萃取-紫外-可见分光光度法测定食品中砷。对影响实验的参数进行优化:有机溶剂为邻苯二甲酸二异壬酯在正辛醇溶液中体积分数2.5%、电压70 V、萃取时间15 min、接受相溶液pH 13、搅拌速率700 r/min。砷的检出限为1.5 μg/L,回收率为96%~104%,相对标准偏差(n=5)为0.1%~3.6%。本方法具有选择性好、操作简单、成本低等特点,可用于食品中总砷的分析。
关键词:电膜萃取;紫外-可见分光光度法;钼蓝络合物;食品;砷
Abstract: In this study, electro-membrane extraction was used as a highly effi cient sample pre-treatment method for the UV-VIS spectrophotometric determination of arsenic (As) in food samples. The infl uences of experimental parameters were investigated and optimized as follows∶ organic solvent, 1-octanol containing 2.5% (V/V) disononyl phthalate; applied voltage,70 V; extraction time, 15 min; pH of acceptor, 13, and stirring rate, 700 r/min. The limit of detection (LOD) of this method was 1.5 μg/L. Average recovery rates for different matrices spiked with As were 96%–104%. The precision, expressed as relative standard deviation (RSD), was 0.1%–3.6%. The method presented in this study exhibited a good selectivity, low cost and simplicity and was applicable to total As in food samples.
Key words: electromembrane extraction; UV-VIS spectrophotometric; molybdenum blue complex; food; arsenic
DOI∶10.7506/spkx1002-6630-201720048
目前大量的工业活动加剧了环境的污染,重金属的累积导致了生态系统的恶化[1]。过去的几十年里,重金属污染对生态环境的潜在风险已经引起广泛的关注,这些金属元素通过食物链在生物体中累积,造成严重的健康危害[2-4]。砷是一种广泛存在于自然环境中的类金属元素,主要散布于空气、食物和水中[5],大气沉降、杀虫剂的使用、化肥污染和水污染能够导致果蔬中砷的积聚[6-8]。砷可引发呼吸系统疾病、胃肠疾病、肝疾病、心血管疾病、神经系统疾病、肾脏功能紊乱和肝硬化等健康问题[9-10]。因此,能否快速、准确地检测食品中砷含量具有非常现实的重要意义。
目前,文献中总砷的测定有氢化物原子荧光光谱法[11-12]、电感耦合等离子体质谱法[13-14]、电感耦合等离子体发射光谱法[15-16]、拉曼光谱法[17]和分光光度法[18-20]等。除分光光度法之外,多数的砷测定方法通常需要专业培训的人员、昂贵的实验设备和运行成本。因此,许多的分光光度法已被开发作为一种替代传统测定砷的方法。钼蓝法是一种最常用测定砷的分光光度法,该方法基于五价砷与钼酸铵作用生成黄色的砷钼酸络合物被还原后可以强烈吸收蓝色,颜色的深度与砷含量呈正比,可在840 nm波长处用分光光度法测定[21]。三价砷与钼酸铵作用不显色,只有在酸性溶液中将其氧化成五价才能显色,所以该方法通过测定酸性溶液中的五价砷含量最终得出样品中的总砷含量。由于其他金属离子如铜、镍、钴、锌离子存在很强的干扰,钼蓝法的选择性较差。
电膜萃取是一种新的微萃取方法,通过施加电场使带电的分析物离子穿过中空纤维膜进行富集[22]。起初电膜萃取主要应用于带电的有机样品中如药物,2008年第一次在金属离子方面的实现了富集[23],近几年其他一些无机阴离子和重金属离子富集也被陆续报道[24-29]。本实验对经典的总砷测定方法进行改进,采用了新的样品前处理方法对食品中的总砷含量测定进行分析研究。通过利用电膜萃取方法来改善常规钼蓝法选择性差的问题,成功地测定不同食品中的砷含量。
1.1 材料与试剂
实验中检测的花生(n=1)、水果和蔬菜(n=7)、肉制品(n=8)、香料(n=16)和面粉(n=1)等样品购买于辽宁鞍山地区市场。将有壳的样品去壳,用超纯水将花生、蔬菜、水果和草本植物等清洗干净,研磨备用。然后,肉制品在110 ℃条件下干燥48 h,其他食品在70 ℃条件下干燥24 h。
五价砷标准溶液(CFGG-060033-26-01,1 000 mg/L)中国计量科学研究院;正辛醇、钼酸铵、焦亚硫酸钠、碘化钾、碘、碳酸氢钠、硫酸肼和硫酸 国药集团化学试剂有限公司;邻苯二甲酸二异壬酯(diisononyl phthalate,DINP) 美国Sigma-Aldrich公司;实验用水均为超纯水(电阻率18.2 MΩ,25 ℃);浓硝酸、双氧水等(均为优级纯) 上海阿拉丁生化科技股份有限公司;所有的化学试剂均为分析纯及以上级别,未经进一步纯化。
标准使用液现用现配;碘试剂(2.5 g/L):称取0.25 g碘溶于4 g/L碘化钾溶液中定容至100 mL;焦亚硫酸钠溶液:50 g/L;碳酸氢钠溶液:42 g/L;钼酸铵溶液(100 g/L):称取1.0 g钼酸铵加10 mL水,再加90 mL 3.0 mol/L硫酸;硫酸肼溶液:1.5 g/L;钼试剂:实验前,量取相同体积的钼酸铵溶液和硫酸肼溶液混匀备用。
实验过程中使用的聚四氟乙烯容器、玻璃容器均在1∶3硝酸中浸泡48 h以上,然后用超纯水冲洗3 次备用。
1.2 仪器与设备
UV-2550紫外-可见分光光度计 日本Shimadzu公司;MARS微波消解仪 美国CEM公司;Milli-Q Academic超纯水机 苏州赛恩斯仪器有限公司;Orionstar A211台式PH/ORP测量仪 美国Thermo Electron公司。

图1 电膜萃取五价砷的装置
Fig. 1 Schematic of the device used for electromembrane extraction(EME) of As (Ⅴ)
测定食品中砷含量的装置如图1所示。萃取容器为10 mL的玻璃瓶,内径2 cm,高4.5 cm。厚度为200 μm的PP Q3/2聚丙烯膜 德国Membrana公司;铂电极(0.25 mm直径) 挪威K.A. Rasmussen公司;hy-30002E直流稳压电源(电压范围0~300 V,电流范围0~2A) 杭州华谊电子实业有限公司;RH basic 1磁力加热搅拌器德国IKA公司。
1.3 方法
1.3.1 样品的制备
称取样品0.300 0 g左右(精确至0.000 1 g)于聚四氟乙烯消解管中,加4 mL浓HNO3浸泡过夜,次日加3 mL H2O2程序升温进行消解,同时做空白实验。消解完全后,样液澄清透明,150 ℃条件下赶酸至近干,用超纯水定容至25 mL。样品经微波密闭消解后,在硝酸介质中,砷以五价形式存在。
1.3.2 电膜萃取
取5 mL样品溶液加入10 mL玻璃瓶中,将聚丙烯膜浸在含2.5% DINP的正辛醇中10 s。将10.0 μL 100 mmol/L的NaOH溶液作为接受相,注入到腔的中空纤维中插入阳电极,中空纤维下端用小块铝箔密封。阴极直接插在样品溶液中。将电极连接到电源上,将萃取容器放在磁力搅拌器上。电压控制在70 V,萃取时间为15 min,在外加电场的作用下,五价砷从样品溶液中通过组成支撑液膜(supported liquid membrane,SLM)进入接受相溶液中。萃取完成后,立即收集接受相溶液,并用紫外-可见分光光度法进行分析。
1.3.3 分光光度法
接受相溶液先加入10.0 μL 100 mmol/L的HCl溶液中和,然后分别加入10.0 μL碘试剂、5.0 μL碳酸氢钠溶液、5.0 μL钼试剂、10.0 μL焦亚硫酸钠溶液。95 ℃加热10 min,冷却至室温。最后,以空白溶液为参比,在840 nm波长处测定溶液的吸光度,该方法基于五价砷与钼酸铵作用生成黄色的砷钼酸络合物被还原后可以强烈吸收蓝色,颜色的深度与砷含量呈正比,可在840 nm波长处用分光光度法进行测定,通过测定被测物质的吸光度大小,对该物质进行定性和定量的分析。
2.1 电膜萃取优化
影响电膜萃取回收率的参数有萃取时间、有机溶剂类型、样品溶液的pH值、给出相和接受相溶液的pH值、搅拌速率以及外加电压等。条件:DINP在正辛醇溶液中体积分数2.5%、搅拌速率750 r/min、电压70 V、接受相100 mmol/L NaOH溶液、给出相250 ng/mL五价砷溶液、萃取时间10 min(n=3),固定其他条件,考察单一因素对萃取效果的影响。
2.1.1 有机溶剂类型的选择
电膜萃取金属离子时,醇类是最好的有机溶剂[24],添加离子对试剂如DINP对电膜萃取效率有显著影响。阳离子分析物的转移机理是基于质子/分析物在载体和给出相溶液间的离子交换,随后在载体与接受相溶液间的离子/质子交换。阴离子化合物再添加DINP后,液体膜的电阻减小,转移能力将增强,吸光度就提高了[27],然而在膜电阻减小的过程中,膜电流逐渐增大,当膜电流增加到限定值时会导致膜破损,降低膜效率从而吸光度降低。因此,在本研究中使用正辛醇和DINP的混合物SLM。用含有250 ng/mL五价砷溶液考察DINP在正辛醇溶液中的体积分数对电膜萃取的影响。
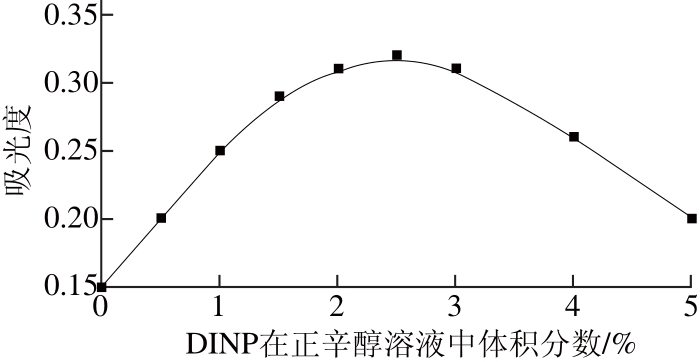
图2 DINP在正辛醇溶液中体积分数对电膜萃取五价砷的影响
Fig. 2 Effect of DINP concentration on the extraction effi ciency of As (Ⅴ)
由图2可知,当DINP在正辛醇溶液中体积分数为2.5%时,吸光度达到最大。因此,选择2.5% DINP为SLM的优化结果并用于后面实验测定,外加电压控制在70 V。
2.1.2 萃取时间的选择

图3 萃取时间对吸光度的影响
Fig. 3 Effect of extraction time on the extraction effi ciency of As (Ⅴ)
选择萃取时间5~20 min进行优化实验,如图3所示,当萃取时间为15 min时吸光度达到最大,再延长萃取时间吸光度逐渐降低,这是因为萃取后期接受相中分析物浓度过高,在浓度梯度的作用下会向样品溶液中扩散的影响。因此,萃取时间优化为15 min。
2.1.3 外加电压的选择
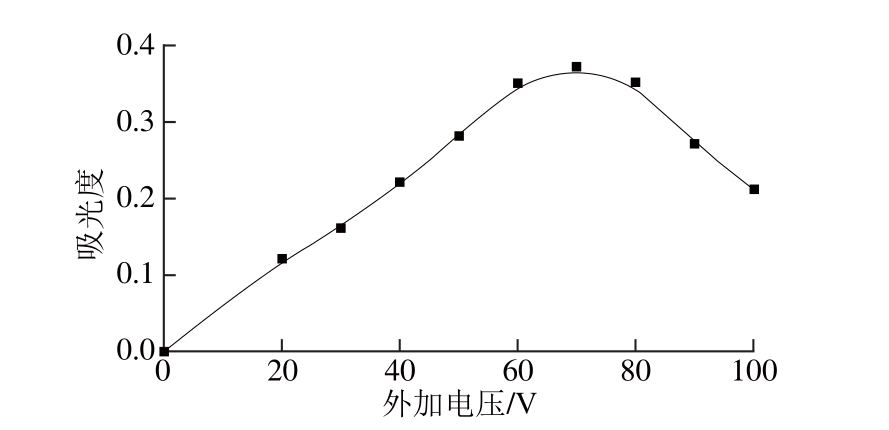
图4 外加电压对吸光度的影响
Fig. 4 Effect of applied voltage on the extraction effi ciency of As (Ⅴ)
外加电压选择在20~100 V之间考察吸光度确定最佳电压。如图4所示,当外加电压增大到70 V时吸光度达到最大,然后开始下降。因为电压过大时,易产生水解现象,生成气泡,阻碍传质过程的进行。此外,当外加电压是0 V时,没有吸光度,因此最佳的外加电压选为70 V。
2.1.4 接受相溶液pH值的选择
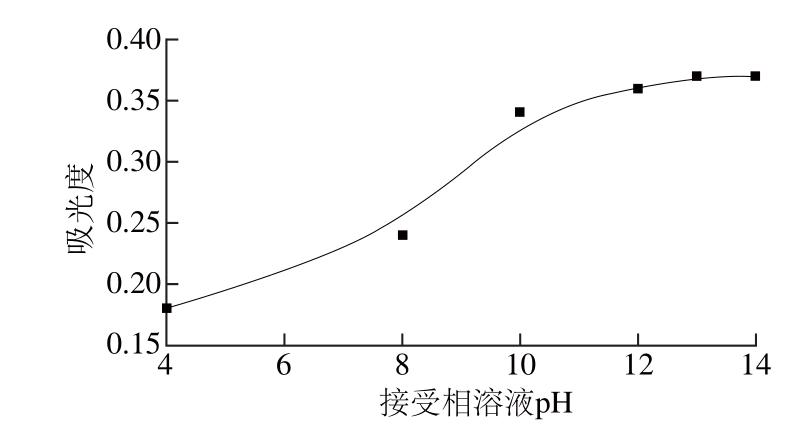
图5 接受相溶液pH值对吸光度的影响
Fig. 5 Effect of pH of acceptor on the extraction effi ciency of As (Ⅴ)
给出相溶液的pH值决定着溶液中砷的存在形式。因此,给出相溶液的pH值对于电膜萃取过程起着决定性的作用。砷酸的pKa值分别为2.19、6.94、11.5。因此,在强酸性溶液中,它的存在形式为砷酸H3AsO4,在弱酸性的条件存在砷酸二氢离子(H2AsO4-),在弱碱条件下存在形式为砷酸氢离子(HAsO42-),在强碱性条件下存在形式为砷酸根离子(AsO43-),砷离子均为阴离子,前处理溶液稀释后可直接做为给出相溶液使用。
考察接受相溶液pH值对电膜萃取效率的影响,用100 mmol/L的NaOH溶液作为接受相溶液,用1 mol/L HNO3溶液调节pH值。如图5所示,吸光度随溶液pH值的升高而增加,当pH 13~14之间时吸收强度趋于稳定。因此,100 mmol/L pH值为13的NaOH溶液作为最佳接受相溶液。
2.1.5 搅拌速率的选择
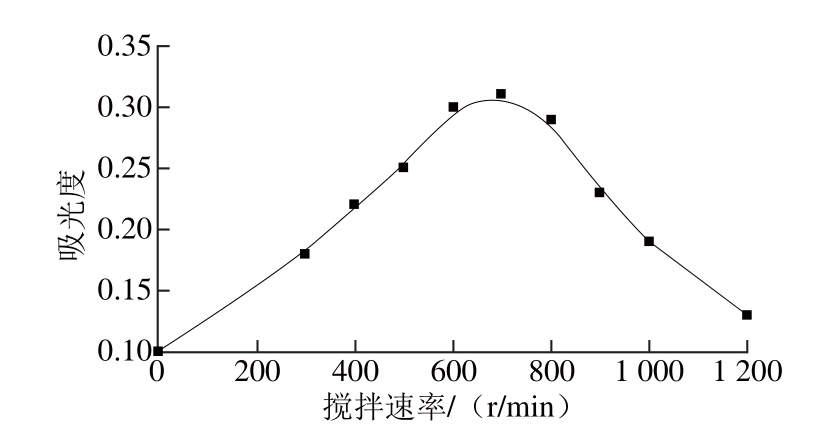
图6 搅拌速率对吸光度的影响
Fig. 6 Effect of stirring rate on the extraction effi ciency of As (Ⅴ)
搅拌的主要作用是降低样品溶液和SLM之间边界层的厚度。如图6所示,搅拌速率由300 r/min增加到700 r/min时,吸光度最高,但是在继续增加转速吸收强度下降。当搅拌速率大于700 r/min增加时吸收强度减少,可能是由于形成的气泡抑制了分析物从溶液到SLM的被动扩散[30]。因此,700 r/min的搅拌速率被定为实验的最佳速率。
2.1.6 干扰离子的影响
考察金属离子对电膜萃取砷的影响,常见的离子有Mg2+、Ca2+,还有对砷钼蓝法有强烈干扰的离子如Cu2+、Ni2+、Zn2+和Co2+,分别添加浓度比为1∶1、1∶10、1∶100的五价砷到相同的溶液进行研究。以相对标准偏差大于10%为标准作为判定是否存在干扰的依据,没有发现Mg2+、Ca2+、Cu2+、Co2+、Zn2+、Ni2+存在显著的干扰。这可能是因为金属离子的阳离子特性,在外加电场中向相反的方向进行迁移。
2.2 检出限及精密度和富集因子
在优化的实验条件下,五价砷的线性方程为y=0.001 68x-0.005 04,线性范围为0.15~300.0 μg/L,相关系数为0.998 9。连续测定空白溶液7 次,通过计算3 倍空白溶液的标准偏差除以标准曲线的斜率得砷检出限为1.5 μg/L,连续测定10 μg/L五价砷溶液5 次,得相对标准偏差为3.6%。对不同体积的样品溶液进行富集分析考察其回收率。如表1所示,当样品体积为1 000 mL时,回收率保持不变,计算得五价砷富集因子为200,可以看出在优化的实验时间内,随着样品溶液体积的不断增加,扩散效率逐渐降低从而导致回收率降低。
表1 样品体积对分析物回收率的影响(x±s,n = 3)
Table 1 Effect of sample volume on the recovery of the analyte ion(x ± s, n =3)
2.3 方法的验证与应用
表2 样品检测的准确性(x±s,n=3)
Table 2 Accuracy of the proposed method for determining Chinese cabbage and celery (x ± s, n =3)
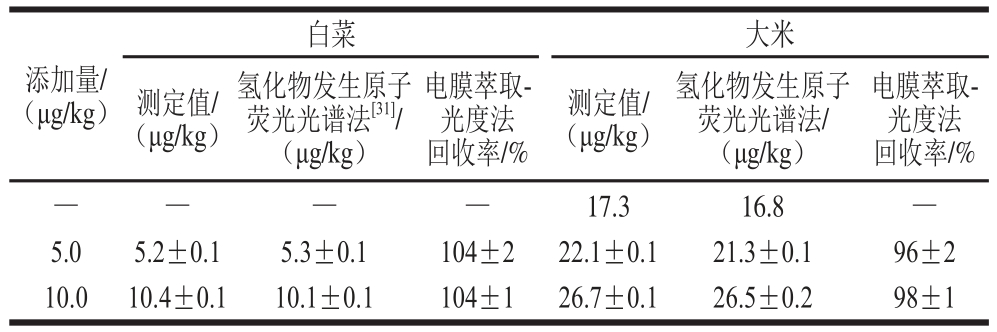
注:—.低于检出限。下同。
在优化的条件下,对白菜、大米进行加标测定砷含量并使用氢化物发生原子荧光光谱法同时进行测定。白菜中砷含量小于方法检出限,大米中砷含量为17.3 μg/L。从表2可知,添加量和实际测定值可以达到很好的吻合,回收率均高于95%,并与国标方法进行对比验证结果满意,从而可以确认该方法的准确性。将所提出的方法应用到食品样品中砷元素的测定。

根据GB 2762—2012《食品中污染物限量》,粮食中砷不高于0.5 mg/kg,蔬菜不高于0.5 mg/kg,水果不高于0.5 mg/kg,肉类不高于0.5 mg/kg。如表3所示,砷含量最高的是鱼肉为335.6 μg/kg,然后是猪肉和肉桂分别为22.7 μg/kg和19.6 μg/kg,均低于国家标准可安全食用。
本实验通过电膜萃取结合钼蓝法测定食品和水中砷,该方法已成功地应用于食品和水样中砷的测定。对于可能存在的干扰元素进行考察,没有发现存在显著的干扰。本方法具有选择性好、操作简单、成本低等优点。将所提出的方法应用到食品样品中砷元素含量的分析,均低于国家标准可安全食用。
参考文献:
[1] BAYTAK S, KENDUZLER E, TURKER A R, et al. Penicillium digitatum immobilized on pumice stone as a new solid phase extractor for preconcentration and/or separation of trace metals in environmental samples[J]. Journal Hazardous Materials, 2008, 153∶ 975-983.DOI∶10.1016/j.jhazmat.2007.09.049.
[2] ILLUMINATI S, ANNIBALDI A, TRUZZI C, et al. Recent temporal variations of trace metal content in an Italian white wine[J]. Food Chemistry, 2014, 159∶ 493-497. DOI∶10.1016/j.foodchem.2014.03.058.
[3] SRIJARANAI S, AUTSAWAPUTTANAKUL W,SANTALADCHAIYAKIT Y, et al. Use of 1-(2-pyridylazo)-2-naphthol as the post column reagent for ion exchange chromatography of heavy metals in environmental samples[J]. Microchemical Journal,2011, 99∶ 152-158. DOI∶10.1016/j.microc.2011.04.015.
[4] ZOUBOULIS A I, LOUKIDOU M X, MATIS K A. Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils[J]. Process Biochemistry, 2004, 39∶ 909-916.DOI∶10.1016/S0032-9592(03)00200-0.
[5] SMEDLEY P, KINNIBURGH D. A review of the source, behavior and distribution of arsenic in natural waters[J]. Applied Geochemistry,2002, 17∶ 517-568.
[6] CHOJNACKA K, CHOJNACKI A, GORECKA H, et al.Bioavailability of heavy metals from polluted soils to plants[J]. Science of the Total Environment, 2005, 337(1/3)∶ 175-182. DOI∶10.1016/j.scitotenv.2004.06.009.
[7] MANTOVI P, BONAZZI G, MAESTRI E, et al. Accumulation of copper and zinc from liquid manure in agricultural soils and crop plants[J]. Plant Soil, 2003, 250(2)∶ 249-257. DOI∶10.1023/A∶1022848131043.
[8] RAGHUNATH R, TRIPATHI R M, SUSEELA B, et al. Dietary intake of metals by mumbai adult population[J]. Science of the Total Environment, 2006, 356(1/3)∶ 62-68. DOI∶10.1016/j.scitotenv.2005.04.035.
[9] BHATTACHARYACH S K. Human health effects from chronic arsenic poisoning∶ a review[J]. Journal of Environmental Science and Health Part A∶ Toxic/Hazardous Substanc, 2006, 41(10)∶ 2399-2428.DOI∶10.1080/10934520600873571.
[10] GUHA-MAZUMDER D N. Chronic arsenic toxicity & human health[J]. Indian Journal of Medical Research, 2008, 128: 436-447.
[11] LI Z X, YANG X M, GUO Y A, et al. Simultaneous determination of arsenic, antimony, bismuth and mercury in geological materials by vapor generation-four-channel non-dispersive atomic fluorescence spectrometry[J]. Talanta, 2008, 74(4): 915-921. DOI:10.1016/j.talanta.2007.07.028.
[12] CAVA-MONTESINOS P, CERVERA M L, PASTOR A, et al.Determination of As, Sb, Se, Te and Bi in milk by slurry sampling hydride generation atomic fl uorescence spectrometry[J]. Talanta, 2004,62: 175-184. DOI:10.1016/S0039-9140(03)00411-9.
[13] 解楠, 葛宇, 徐红斌, 等. 微波消解-电感耦合等离子体质谱测定香辛料中铅砷镉铬铜锰锌和镍[J]. 食品科学, 2011, 32(2): 195-197.
[14] 陈国友. 微波消解ICP-MS法同时测定蔬菜中14 种元素[J]. 分析测试学报, 2007, 26(5): 742-745.
[15] 景立新, 曹利力, 邱洪久, 等. ICP -AES法测定黄芪成分F3新制剂中微量元素[J]. 大连大学学报, 2004, 25(2): 99-101.
[16] 张胜帮, 郭玉生, 夏碧琪. ICP-AES同时测定黄连上清片中多种微量元素的研究[J]. 温州大学学报, 2004, 17(15): 66-68.
[17] MULVIHILL M, TAO A, BENJAUTHRIT K, et al. Surface-enhanced Raman spectroscopy for trace arsenic detection in contaminated water[J]. Angewandte Chemie, 2008, 47: 6456-6460. DOI:10.1002/ange.200800776.
[18] HU S, LU J, JING C. A novel colorimetric method for fi eld arsenic speciation analysis[J]. Journal of Environmental Sciences, 2012, 24(7):1341-1346. DOI:10.1016/S1001-0742(11)60922-4.
[19] MORITA K, KANEKO E. Spectrophotometric determination of arsenic in water samples based on micro particle formation of ethyl violetmolybdoarsenate[J]. Analytical Sciences, 2006, 22(8): 1085-1089. DOI:10.2116/analsci.22.1085.
[20] REVANASIDDAPPA H, DAYANANDA B, KUMAR T. A sensitive spectrophotometric method for the determination of arsenic in environmental samples[J]. Environmental Chemistry Letters, 2007,5(3): 151-155. DOI:10.1007/s10311-007-0097-y.
[21] DESASA M, ROGERS L. Spectrophotometric determination of arsenic, phosphorus, and silicon in presence of each other[J].Analytical Chemistry, 1954, 26(8): 1381-1383. DOI:10.1021/ac60092a040.
[22] PEDERSEN B S, RASMUSSEN K E. Electrokinetic migration across artifi cial liquid membranes: new concept for rapid sample preparation of biological fl uids[J]. Journal of Chromatography A, 2006, 1109(2):183-190. DOI:10.1016/j.chroma.2006.01.025.
[23] BASHEER C, TAN S H, LEE H K. Extraction of lead ions by electromembrane isolation[J]. Journal of Chromatography A, 2008,1213(1): 14-18. DOI:10.1016/j.chroma.2008.10.041.
[24] CHANTHASAKDA N, NITIYANONTAKIT S, VARANUSUPAKUL P.Electro-enhanced hollow fi ber membrane liquid phase microextraction of Cr (Ⅵ) oxoanions in drinking water samples[J]. Talanta, 2016, 148:680-685. DOI:10.1016/j.talanta.2015.04.080.
[25] DAVARANI S H, MOAZEMI H R, KESHTKAR A R, et al. A selective electromembrane extraction of uranium (Ⅵ) prior to its fl uorometric determination in water[J]. Analytica Chimica Acta, 2013,783: 74-79. DOI:10.1016/j.aca.2013.04.045.
[26] KHAJEH M, PEDERSEN B S, BARKHORDAR A, et al. Application of hollow cylindrical wheat stem for electromembrane extraction of thorium in water samples[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 137: 328-332. DOI:10.1016/j.saa.2014.08.103.
[27] KUBAN P, STRIEGLEROVA L, GEBAUER P, et al.Electromembrane extraction of heavy metal cations followed by capillary electrophoresis with capacitively coupled contactless conductivity detection[J]. Electrophoresis, 2011, 32(9): 1025-1032.DOI:10.1002/elps.201000462.
[28] SAFARI M, NOJAVAN S, DAVARANI S H, et al. Speciation of chromium in environmental samples by dual electromembrane extraction system followed by high performance liquid chromatography[J]. Analytica Chimica Acta, 2013, 789: 58-64.DOI:10.1016/j.aca.2013.06.023.
[29] TAN T Y, BASHEER C, NG K P, et al. Electro membrane extraction of biological anions with ion chromatographic analysis[J]. Analytica Chimica Acta, 2012, 739: 31-36. DOI:10.1016/j.aca.2012.06.007.
[30] PEDERSEN B S, RASMUSSEN K E. Liquid-phase microextraction with porous hollow fi bers, a miniaturized and highly fl exible format for liquid-liquid extraction[J]. Journal of Chromatography A, 2008,1184(1): 132-142. DOI:10.1016/j.chroma.2007.08.088.
[31] 国家卫生和计划生育委员会. 食品中总砷及无机砷的测定: GB 5009.11—2014[S]. 北京: 中国标准出版社, 2014: 4-6.
Electromembrane Extraction and Spectrophotometric Determination of Arsenic in Food Samples
WU Hang1, JIANG Xiaojun1,*, LÜ Linlin1,2, AI Tian1
(1. School of Chemical Engineering, University of Science and Technology Liaoning, Anshan 114051, China;2. School of Chemistry and Life Science, Anshan Normal University, Anshan 114007, China)
中图分类号:TS207.5
文献标志码:A
文章编号:1002-6630(2017)20-0322-05
引文格式:
吴航, 姜效军, 吕琳琳, 等. 电膜萃取-光度法测定食品中的砷[J]. 食品科学, 2017, 38(20): 322-326. DOI:10.7506/spkx1002-6630-201720048. http://www.spkx.net.cn
WU Hang, JIANG Xiaojun, LÜ Linlin, et al. Electromembrane extraction and spectrophotometric determination of arsenic in food samples[J]. Food Science, 2017, 38(20)∶ 322-326. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720048. http∶//www.spkx.net.cn
收稿日期:2016-10-09
基金项目:辽宁鞍山市高端人才培养计划项目(20153743)
作者简介:吴航(1982—),男,博士研究生,研究方向为食品中重金属。E-mail:aswuhang@sina.com
*通信作者:姜效军(1961—),男,教授,博士,研究方向为食品中重金属、电化学。E-mail:anshanjiangxj@163.com