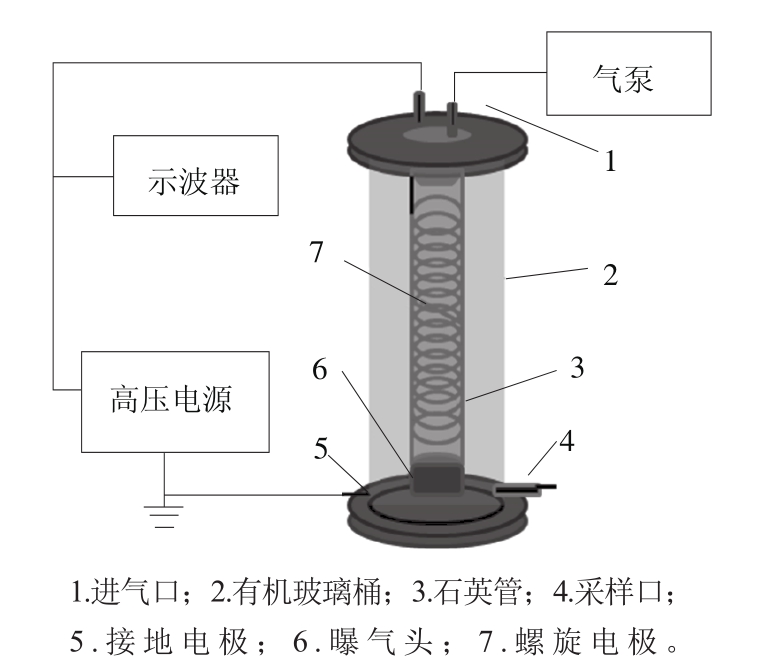
图1 放电等离子体反应系统示意图
Fig. 1 Schematic diagram of discharge plasma reaction system
潘春青1,岳田利1,王铁成2,王 媛1,袁亚宏1,*,李雨娟2
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学资源环境学院,陕西 杨凌 712100)
摘 要:目的:研究气体沿面放电低温等离子体对扩展青霉孢子的杀菌效果。方法:以扩展青霉标准菌株CICC 40658和扩展青霉分离菌株F-LPH10-06为目标菌株,探讨2 株菌在马铃薯葡萄糖液体培养基中的生长和产毒特性;应用自制的气体沿面放电低温等离子体杀菌设备,探讨处理时间、电源电压及孢子不同初始浓度对杀菌效果的影响;并应用扫描电子显微镜对孢子形态变化进行观察。结果:扩展青霉CICC 40658和F-LPH10-06培养14 d后的菌体干质量分别为28.6 mg和128.7 mg,展青霉素含量分别为912.40 μg/L和147.97 mg/L,F-LPH10-06产毒量几乎是CICC 40658产毒量的162 倍。气体沿面放电低温等离子体21 min能全部杀死样品中CICC 40658孢子(初始浓度为3.4×106个/mL);处理30 min,能使样品中F-LPH10-06孢子(初始浓度为1.5×106个/mL)减少4.58 lg(个/mL)。在相同的处理时间下,随着电源电压升高和初始孢子浓度降低,杀菌效果逐渐提高。扫描电子显微镜结果表明,孢子表面形态经过放电处理后被改变,这可能与放电过程中产生的高能电子和活性氧有关。结论:气体沿面放电低温等离子体对扩展青霉孢子有一定杀灭作用,这为低温杀菌技术的发展和应用提供了理论依据。
关键词:低温等离子体;气体沿面放电;扩展青霉;杀菌效果;展青霉素
展青霉(毒)素(patulin)又称棒曲霉(毒)素、珊瑚青霉素,是由曲霉属(Aspergillus)、青霉属(Penicillium)和丝衣霉属(Byssochlamys)等多种真菌代谢产生的一种具有神经毒性的次级代谢产物[1-2]。展青霉素对动物组织和细胞具有很强的毒性,小鼠经皮下注射展青霉素会引起肾淤血、肺水肿、呼吸困难、腹腔和胸腔积液、组织坏死等症状。人体摄入过量的展青霉素会引发肠炎、痉挛、溃疡、抽搐、呼吸困难、癌变等一系列的急性和慢性病症[3]。
在食品生产中普遍存在展青霉素污染的问题。大量研究表明,苹果、梨、猕猴桃等水果在收获、贮藏及加工过程中均有可能受到展青霉素产生菌的污染[4-7]。Zhu Yan等[8]在草酸对猕猴桃贮藏过程中对扩展青霉抑制作用的研究中表明,猕猴桃在贮藏过程中易感染霉菌而患贮积病,尤其是表面有破损的果实极易被青霉菌污染[9-10]。在所有水果中,苹果及其制品受展青霉素的污染最为严重。病原微生物主要通过破损的组织或伤口进入果实内部,在适宜的条件下,病原微生物迅速繁殖,引起水果腐烂和病变。有研究表明,在干酪和谷物产品[11]如小麦、大麦、谷物根部、饲料[12]中也可检测出展青霉素。鉴于展青霉素对人体的危害,世界各国相继制定了食品中展青霉素的限量标准。GB 14974—2003《苹果和山楂制品中展青霉素限量》中明确规定了苹果、山楂制品中展青霉素的最大容许量不得超过50 μg/L[13],欧盟第455/2004指令规定,果汁、果酒及其果肉发酵制品中展青霉素质量浓度小于50 μg/L,可使用苹果及固体产品中展青霉素限量为25 μg/L,儿童食用苹果汁和婴幼儿食品中展青霉素限量则更低,毒素质量浓度要小于10 μg/L[14-15]。目前,对食品中展青霉素的控制主要集中在两个方面,一方面是在加工过程中通过原料挑选、清洗、吸附、辐射、过滤、微波及紫外处理去除食品中的展青霉素[16-19];另一方面是通过各种物理、化学、生物方法杀灭各种展青霉素产生菌,从源头上控制展青霉素的产生。化学灭菌法主要是利用有机化学试剂进行杀菌,杀菌效果好、使用方便、设备投资少,但是长期使用会增加微生物的抗药性,同时毒性大、有腐蚀性,会对环境造成污染。生物灭菌法由于成本较高、技术掌握困难,目前处于理论研究阶段[20]。常用的灭菌方法是物理灭菌法,包括加热灭菌法和低温灭菌法。加热灭菌法是比较传统的灭菌方法,但杀菌的同时也会对食品的品质和营养价值造成一定的破坏。低温等离子体灭菌法作为一种新型的低温灭菌方法,具有很高的研究价值。
低温等离子体是气体介质在高压放电条件下所激发出的离子,是区别于液态、固态、气态所存在的物质的第4种状态[20]。低温等离子体灭菌技术作为一种新型的低温灭菌方法在污水治理[21]、空气净化[22]、医疗器械消毒[23]、材料表面改性等方面有广泛的应用,但在食品领域应用较少。低温等离子体的灭菌机理主要是利用在放电过程中产生的带电粒子的物理破坏作用[24-25]、活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的氧化作用[26]以及紫外光的辐射作用[27-28]。低温等离子体技术作为一种安全、快速、低温、环保的灭菌方法具有广阔的应用前景。
本研究以2 株扩展青霉CICC 40658和F-LPH10-06作为目标菌株,探讨了2 株菌产生展青霉素的产毒特性,以气体沿面放电低温等离子体对其进行处理,初步研究了处理时间、电源电压及孢子不同初始浓度对灭菌效果的影响,并通过扫描电子显微镜初探气体沿面放电低温等离子体的灭菌机理。
1.1 材料与试剂
菌株:扩展青霉(Penicillium expansum)CICC 40658购自中国工业微生物菌种保藏管理中心;扩展青霉(P. expansum)F-LPH10-06由西北农林科技大学食品科学与工程学院发酵动力学实验室提供。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯汁1 000 mL、葡萄糖20.0 g、琼脂20 g,pH值自然,121 ℃灭菌20 min。其中马铃薯汁的制备方法为马铃薯去皮,挖芽眼,洗净,切片,称取200 g放入1 000 mL蒸馏水中用文火煮沸10~20 min,双层纱布过滤,滤液加水补至1 000 mL。马铃薯葡萄糖液体培养基(potato dextrose broth,PDB):PDA培养基不加琼脂。
葡萄糖 西陇化工股份有限公司;琼脂粉 北京索莱宝科技有限公司。
1.2 仪器与设备
TDS2012示波器 美国Tektronix公司;LC-2010A高效液相色谱仪 日本岛津公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;CX31显微镜 日本奥林巴斯公司;BCN-1360B生物洁净工作台哈尔滨东联电子技术开发公司;ES-315高压蒸汽灭菌器日本Tomy公司;MP-160B霉菌培养箱 上海福玛实验设备有限公司;S-4800场发射扫描电子显微镜 日本日立公司。

图1 放电等离子体反应系统示意图
Fig. 1 Schematic diagram of discharge plasma reaction system
气体沿面放电低温等离子体杀菌设备(图1),与Wang Tiecheng等[29]用气相沿面放电等离子体降解腐殖酸实验中所用设备相似。放电电源采用交流高压电源发生器(频率50 Hz,电源电压0~40 kV,可调,由大连理工大学环境等离子体研究室提供);反应器是一个内径5 cm、高35 cm的有机玻璃圆桶;高压电极由一个内径12 mm、厚1.5 mm的石英玻璃管组成,内部连接有一根直径1 mm的螺旋状不锈钢丝,放电长度为17 cm;被处理的样品作为接地电极,气体沿石英管放电,放电气体介质为干燥的空气。
1.3 方法
1.3.1 菌种活化
将1.1节菌株接种到PDB培养基,25~28 ℃培养5 d后,划线转接至PDA培养基,25~28 ℃培养5 d后,转接至PDA试管,25~28 ℃培养7 d后,用无菌水将孢子洗下,接种于装有100 mL PDA培养基的250 mL三角瓶中,25~28 ℃培养10 d后,4 ℃冰箱保存,备用。
1.3.2 孢子悬液的制备
用无菌水洗下三角瓶中PDA表面的孢子,漩涡振荡器振荡后,无菌脱脂棉过滤,制备孢子悬浮液。
1.3.3 菌株生长特性研究
用血球计数板计数后,取适量孢子悬液加到灭过菌的PDB培养基中,使培养基中孢子浓度为5×105个/mL,混匀后,将菌液分装到50 mL离心管中,每管20 mL,25 ℃静置培养,每2 d取一次样,每个样品3 个平行,滤纸过滤,恒质量法(80 ℃烘干)测菌体干质量,共测14 d。
1.3.4 菌种产毒特性研究
滤纸过滤后的滤液,用于培养液中展青霉素含量的检测。采用滤纸过滤法除去培养液中的菌体和杂质成分,依照SN/T 1859—2007《饮料中棒曲霉素和5-羟甲基糠醛的液相色谱-质谱测定方法》处理和检测滤液中展青霉素的含量[30]。色谱条件为:Eclipse Plus C18色谱柱(4.6 mm×250 mm)、柱温30 ℃、流动相为乙腈-水(10∶90,V/V)、流速1.0 mL/min、进样量20 μL、检测波长276 nm。
1.3.5 低温等离子体处理
孢子悬液用血球计数板计数后,加入到350 mL无菌水中,使稀释后的样品中孢子浓度为104~106个/mL。低温等离子体处理条件为工作频率50 Hz、气体流量160 L/h,放电介质为干燥的空气,在室温、常压条件下进行处理。
1.3.6 灭菌效果检测
灭菌效果用处理后存活菌数的对数值表示。孢子存活数采用平板计数法进行统计,分别取不同处理时间下1 mL样品进行10 倍梯度稀释,选择合适的稀释度,取100 μL菌悬液涂布于PDA平板上,每个稀释度3 个平行,25~28 ℃培养48 h后进行菌落计数。
1.3.7 扫描电子显微镜观察
将处理前和经等离子体处理3 min的样品经4 ℃、2 820×g离心10 min,弃去上清液,加入1 mL 4%戊二醛固定液常温条件下固定2 h。然后用0.1 mol/L pH 6.8的磷酸盐缓冲液进行漂洗,5、10、15、20、25、30 min时各冲洗一次。再用1%锇酸常温固定2 h,再用0.1 mol/L pH 6.8的磷酸盐缓冲液进行漂洗,5、10、15、20、25、30 min,各冲洗一次。之后用乙醇进行梯度脱水,分别用30%、50%、70%、80%、90%乙醇各脱水一次,每次15 min,最后用100%乙醇脱水2 次,每次30 min。制片、自然晾干、喷金,在5 kV、5 000 倍扫描电子显微镜视野下观察、拍照。
1.4 数据统计分析
在扩展青霉生长特性和产毒特性的测定实验中,每次取3 个样品进行检测,检测结果取其平均值。在不同因素对扩展青霉杀灭效果的影响实验中,每个时间点取样1 mL进行梯度稀释,选择3 个合适的梯度进行平板涂布,每个梯度做3 个平行。采用Origin 9.0软件作图,用SPSS 22.0软件对实验数据进行多重比较,分析显著性。
2.1 不同菌株生长特性
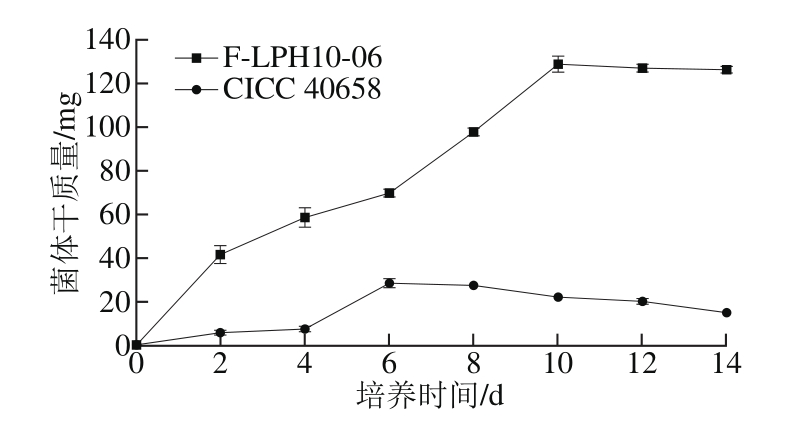
图2 2 株扩展青霉在不同培养时间的菌体干质量
Fig. 2 Dry weight biomass of P. expansum after different culture time
如图2所示,前4 d为P. expansum CICC 40658的生长适应期,在此期间,菌体生长迟缓,菌体干质量增加缓慢;从第4天开始进入快速生长时期,菌体干质量迅速增加,在第6天时达到最大值(28.6 mg),之后逐渐进入稳定期,菌体干质量达到稳定并稍有下降。P. expansum F-LPH10-06经过短暂的延滞期后迅速进入快速生长时期,从第2天到第10天均为快速生长时期,在第10天菌体干质量达到最大值(128.7 mg),之后达到稳定状态。Taniwaki等[31]对不同体积分数CO2环境下毛霉的生长特性的研究结果也表现出相似的生长规律。从2 株菌的生长情况来看,F-LPH10-06的菌体干质量是CICC 40658菌体干质量的4.5 倍,这可能与2 株菌的种间差异有关。
2.2 不同菌株产毒特性
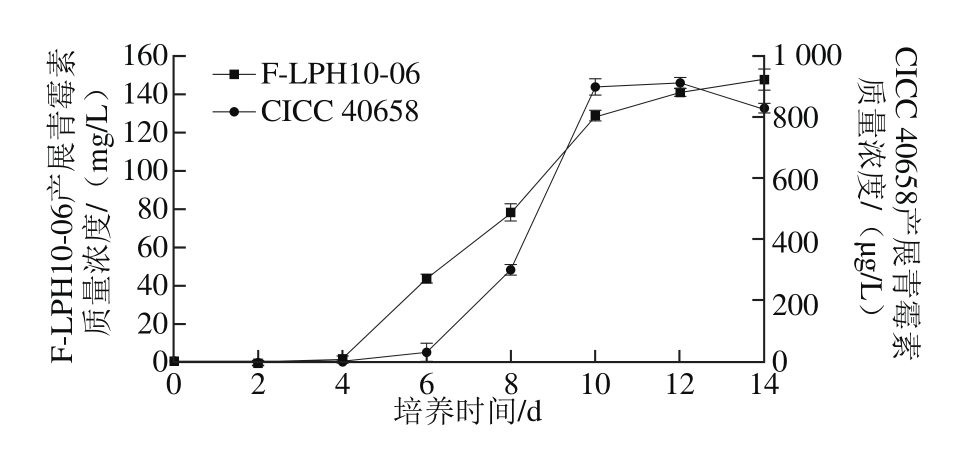
图3 2 株扩展青霉在不同培养时间的展青霉素质量浓度
Fig. 3 Concentrations of patulin produced by two strains of P. expansum after different culture times
由图3可知,2 株扩展青霉菌株均为展青霉素产生菌。从产毒曲线上可以看出,2 株扩展青霉产毒量均呈递增趋势。不同的是,P. expansum F-LPH10-06 从第4天开始产生展青霉素,随着培养时间的延长,产毒量逐渐增加,在第14天时达到147.97 mg/L;而CICC 40658从第6天才有展青霉素检出,且产毒量只有33.5 μg/L,随着培养时间的延长,CICC 40658的毒素含量有一定的积累,在第12天达到最大值(912.40 μg/L),之后略微降低。Dombrink-Kurtzman等[32]对扩展青霉在几种不同培养基上产毒情况的研究结果也表现出相同的产毒规律。从产毒速率上看,第4~10天是F-LPH10-06的快速产毒时期,之后,产毒速率有所下降,产毒量增加缓慢,逐步趋于稳定;而CICC 40658的快速产毒时期为第6~10天,之后产毒速率下降,产毒量趋于稳定。
把同一菌株的生长特性和产毒特性进行比较发现,前6 d主要是CICC 40658菌体的适应和快速生长时期,在此期间并没有展青霉素的检出;之后菌体的生长逐渐趋于稳定,开始代谢产生展青霉素,随着时间的延长,展青霉素含量逐渐增加。对于F-LPH10-06,其适应期较短,之后迅速进入快速生长期,展青霉素的代谢从第4天逐渐开始;第4天之后,菌体生物量和展青霉素含量开始同步增加,在第10天同时达到稳定。
2.3 处理时间对杀菌效果的影响
实验中选取放电电压20.3 kV、频率50 Hz、气体流量160 L/h,对已制好的样品进行处理,样品中2 株菌的孢子浓度分别为3.4×106、1.5×106个/mL。处理过的样品用平板计数法统计存活孢子数,以样品处理时间为横坐标,存活孢子数对数值为纵坐标,绘制2 株扩展青霉的杀菌动力学曲线(图4)。
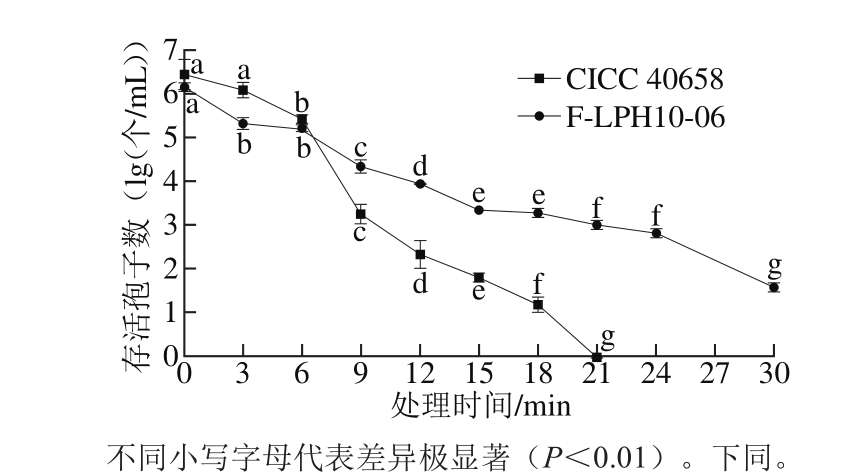
图4 气体沿面放电低温等离子体对2 株扩展青霉孢子的杀菌动力学曲线
Fig. 4 Kinetic curves of low-temperature plasma generated by gas phase surface discharge for killing spores of two strains of P. expansum
由图4可知,随着作用时间的延长,样品中的孢子数逐渐减少,处理6 min时,CICC 40658孢子数降低1.0 lg(个/mL),样品中存活孢子数对数值开始极显著下降(P<0.01),处理18 min时,孢子数对数值下降5.2 lg(个/mL),大多数孢子被杀死,进一步延长时间到21 min时,检出限范围内未检出活孢子(检出限为10 个)。随着处理时间的延长F-LPH10-06样品中孢子数也呈现递减的趋势,9 min时,孢子数减少1.8 lg(个/mL),样品中孢子数对数值极显著降低(P<0.01),21 min时减少3.1 lg(个/mL),30 min时,1 mL样品中仅剩余40 个孢子。由此可见,气体沿面放电低温等离子体对扩展青霉孢子有很好的杀灭效果[24]。
2.4 孢子不同初始浓度对杀菌效果的影响
由图5、6可知,在不同的孢子初始浓度条件下,气体沿面放电低温等离子体对扩展青霉孢子都有明显的杀菌效果(P<0.01)。样品中CICC 40658初始浓度分别为3.4×106、1.2×105、1.4×104个/mL,当孢子初始浓度为104个/mL时,经过6 min的低温等离子体处理后,在检出限范围内未有活孢子检出;当孢子初始浓度为105个/mL时,杀死样品中全部孢子需要12 min;当孢子初始浓度为106个/mL时,杀死全部孢子所需时间延长到21 min(图5)。
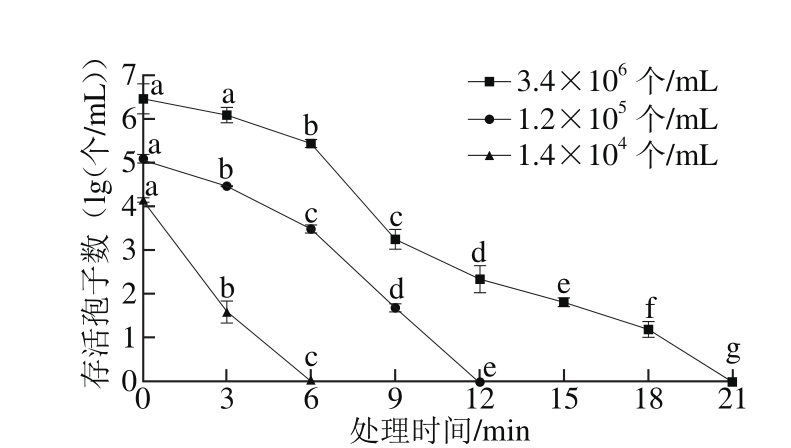
图5 不同孢子浓度的扩展青霉CICC 40658对低温等离子体灭菌效果的影响
Fig. 5 Effect of initial spore concentration on fungicidal effect of low-temperature plasma against spores of P. expansum CICC 40658
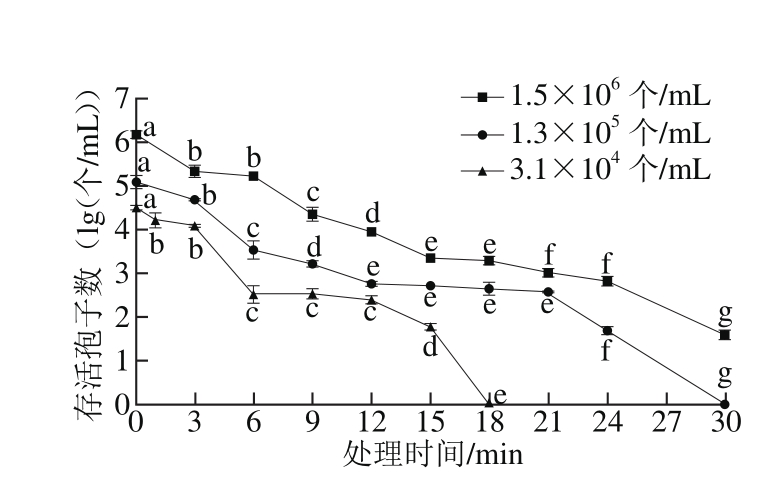
图6 不同孢子浓度的扩展青霉F-LPH10-06对低温等离子体灭菌效果的影响
Fig. 6 Effect of initial spore concentration on fungicidal effect of low-temperature plasma against spores of P. expansum F-LPH10-06
F-LPH10-06初始浓度分别为1.5×106、1.3×105、1.4×104个/mL。当F-LPH10-06孢子初始浓度为104个/mL时,经过18 min的低温等离子体处理能将孢子全部杀死;当孢子浓度为105个/mL时,低温等离子体处理30 min,可以将孢子全部杀死;当孢子浓度为106个/mL时,低温等离子体处理30 min,样品中孢子数下降了4.58 lg(个/mL)(图6)。从图5、6可知,降低样品中孢子浓度,可以明显缩短杀菌时间。郑超[33]用脉冲放电低温等离子体处理不同浓度的大肠杆菌菌悬液,发现当细胞初始浓度为7×104CFU/mL时,放电处理0.5 min后细菌即被全部杀死,这对低温等离子体杀菌技术在实际生活中的应用具有重要意义。从图5、6也可以看出,在相同的放电处理条件下,F-LPH10-06较CICC 40658更难杀死,这可能是因为F-LPH10-06孢子比CICC 40658孢子细胞壁或细胞膜较厚[24],在处理的过程中更难被破坏,需对其进一步研究探讨。
2.5 电压对杀菌效果的影响
通过调节电源控制面板调节反应器上的电压分别为10.3、12.8、15.3、17.8、20.3 kV,考察气体沿面放电低温等离子体反应体系中放电电压对低温等离子体灭菌效果的影响,得到两株扩展青霉孢子在处理时间内的存活曲线,如图7、8所示。2 株扩展青霉初始孢子浓度分别为2.9×105个/mL(CICC 40658)和1.4×106个/mL(F-LPH10-06),从存活曲线可以看出,放电电压越高,灭菌效率越高。放电电压为10.3 kV时,什么低温等离子体处理21 min后,CICC 40658孢子浓度只能下降3 lg(个/mL);当电压分别提高到12.8 kV和15.3 kV时,杀死样品中全部孢子需要的时间分别为18 min和15 min;继续升高电压到17.8 kV,杀死全部孢子的时间缩短到12 min;进一步升高电压到20.3 kV时,杀死全部孢子所需的时间并没有进一步缩短(图7)。对15.3、17.8、20.3 kV 3 个电压条件下不同时间点的孢子存活数进行分析,发现当电压为15.3、17.8 kV时,在9 min以内各时间点的杀菌效果并无明显差异,仅在12 min时才表现出明显的杀菌效果;当处理电压为17.8、20.3 kV时,2 个电压条件下的杀菌效果也只在6 min时有明显差异,其他时间点差异均不明显。究其原因,可能是因为当电压升高到一定程度时继续提高电压,电压达到了一定的饱和状态,此时的杀菌效率不会继续提高。
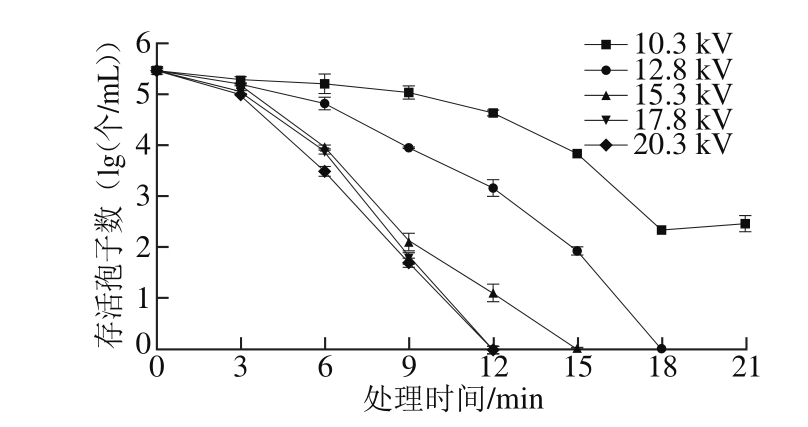
图7 不同放电电压对扩展青霉CICC 40658孢子杀菌效果的影响
Fig. 7 Effect of discharge voltage on fungicidal effect of plasma against spores of P. expansum CICC 40658
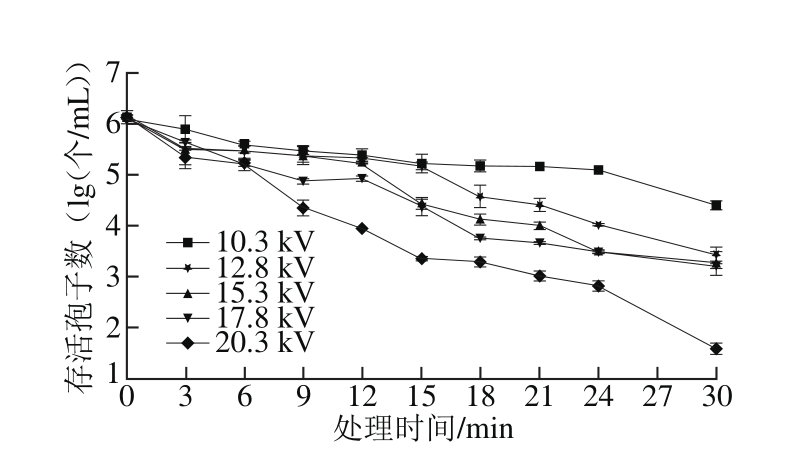
图8 不同放电电压对扩展青霉F-LPH10-06孢子杀菌效果的影响
Fig. 8 Effect of discharge voltage on fungicidal effect of plasma against spores of P. expansum F-LPH10-06
从图8也可以看出,在相同的放电电压条件下,孢子浓度随处理时间的延长而减少;在相同的处理时间下,随电源电压逐渐升高,F-LPH10-06孢子存活率也越来越低。当放电电压为10.3 kV时,低温等离子体处理30 min,F-LPH10-06孢子浓度下降1.70 lg(个/mL),升高电压到12.8 kV时,样品中孢子数对数值明显降低,进一步升高电压到15.3、17.8 kV时,存活孢子对数值与12.8 kV时杀菌效果相比无明显差异,继续提高电压为20.3 kV时,样品中孢子数对数值下降,绝大多数的孢子能被杀死。对于不同放电方式杀菌,电源电压都是影响杀菌效果的一个重要因素,张铮等[34]在常压介质阻挡放电杀灭金黄色葡萄球菌的研究中也表明,随着电源电压升高,杀菌效果逐渐提高并最终趋于稳定。
2.6 扫描电子显微镜结果
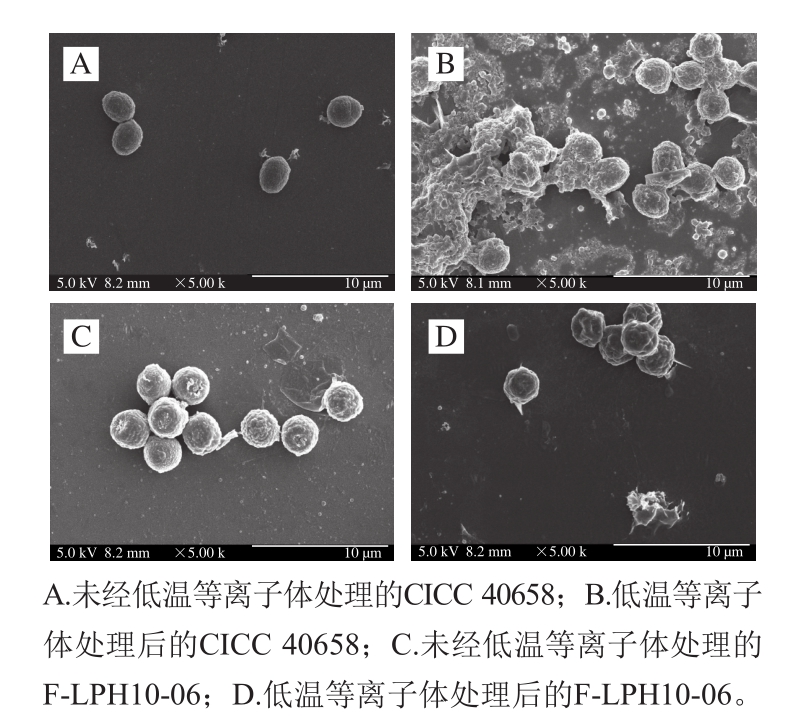
图9 低温等离子体处理前后2 株扩展青霉孢子的扫描电子显微镜图
Fig. 9 Scanning electron micrographs of spores of P. expansum (CICC 40658 and F-LPH10-06) before and after low-temperature plasma exposure
由图9可知,正常的P. expansum CICC 40658孢子形态为规则的椭球形,表面粗糙,周边完整,形态饱满,拥有完整的细胞结构(图9A);P. expansum F-LPH10-06孢子形态与CICC 40658孢子形态相比较圆,为规则的球形,同样表面粗糙,形态饱满,细胞结构完整(图9C)。Ye Shengying等[35]在连续直流电晕放电对扩展青霉孢子的杀灭研究中也表明,正常的扩展青霉孢子形状为椭圆形,表面完整光滑;而经电晕放电处理的孢子,细胞膜被破坏,孢子表面出现很多深孔,孢子形状变得不规则。Luo Ying等[36]用扫描电子显微镜对吸附展青霉素的酵母细胞进行观察,结果表明正常的酵母细胞在扫描电子显微镜下表现为完整的圆形或椭圆形。经沿面放电低温等离子体处理3 min后,可明显观察到部分霉菌孢子细胞壁和细胞膜破裂,胞内细胞质外溢,细胞表面皱缩、凹陷[37],失去原有形态,还有部分细胞破碎后仅残存一些细胞碎片[24](图9B、D),这与Ye Shengying等[35]用电晕放电处理扩展青霉孢子效果一致。
实验中采用的是一种新型的介质阻挡放电方式——气体沿面放电。在电源电压20.3 kV、频率50 Hz、气体流量160 L/h、处理时间30 min的条件下,气体沿面放电对液体样品中扩展青霉CICC 40658和F-LPH10-06孢子有很好的杀菌效果。电源电压、处理时间、孢子的不同初始浓度都是气体沿面放电低温等离子体杀菌效果的有效影响因素。在其他条件不变的情况下,延长作用时间或是增大放电电压都能使更多的能量[33-34]、ROS、RNS、带电粒子注入到反应器中,从而增大与孢子细胞的作用几率,导致样品中孢子杀灭效果增强。实验结果显示,降低样品中的孢子浓度,可以明显缩短杀菌时间,主要是因为当孢子浓度降低后,平均作用于单个孢子的能量会相应提高,从而使得孢子能更快地被杀死。除此之外,反应器的规格(如螺旋电极的长度[38-40]、低压电极结构[38]、曝气孔的大小[39]、气体流速[40])也是影响反应体系杀菌效果的重要因素。本实验中采用的是固定参数的放电电极,在未来的研究中可以通过改变电极参数来检测杀菌效果。
低温等离子体所包含的成分复杂,其灭菌的机理包括放电过程中产生的带电粒子和高能电子对细胞壁和细胞膜产生的蚀刻作用[33];羟自由基、原子氧、O3、H2O2等ROS的氧化作用[26]、紫外光的物理辐射作用[27-28]以及RNS和其在水中副产物(NO2-、NO3-)的酸化作用[41]。Moisan等[42]认为活性粒子和紫外辐射在放电的过程中破坏了微生物的细胞膜化学成分及遗传物质结构,起了主要的杀菌作用。放电气体和放电方式不同,在放电过程中发挥主要作用的物质也不相同。所以究竟是哪种物质在灭菌过程中起主要作用,目前还没有明确的结论。扫描电子显微镜的结果显示,经低温等离子体处理过的孢子表面出现了明显的皱缩、凹陷,也有部分孢子在高压放电后细胞壁和细胞膜破裂成碎片,表明了沿面放电主要是通过破坏正常的菌体细胞结构实现杀菌的。李兆杰等[24]在辉光放电低温等离子体技术对微生物的杀菌动力学及杀菌机制研究中指出,由于放电气体为氩气,不存在ROS的氧化作用,引起细菌细胞壁和细胞膜破裂的主要原因是带电粒子和高能电子的蚀刻作用。张铮等[34]通过介质阻挡放电空气等离子体对金黄色葡萄球菌杀灭效果及机理的研究,也得出了相同的结论。至于是蚀刻作用、氧化作用还是紫外辐射作用,还需在今后的实验中进一步证明。
与传统的加热杀菌和化学消毒方法相比,沿面放电低温等离子体杀菌技术具有安全、快速、低温、环保等优点[38],拥有较大的研究价值和应用前景。目前,低温等离子体灭菌技术作为一种新型的低温灭菌方法在皮肤组织的消毒[33]及有害染料的降解[29]等方面得到了广泛的应用并取得了良好的效果,在未来的研究中应该扩大低温等离子灭菌技术在食品行业的应用范围;在已有报道中,大多学者专家的研究对象主要集中在细菌和酵母,对霉菌的研究较少,因此要进一步扩大菌种的研究范围。同时,为了探究低温等离子体引起细胞死亡的原因,也要对等离子体的灭菌机理进行进一步研究。
参考文献:
[1] MOAKE M M, PADILLA-ZAKOUR O L, WOROBO R W.Comprehensive review of patulin control methods in foods[J].Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1):8-21. DOI:10.1111/j.1541-4337.2005.tb00068.x.
[2] SHARMA R P, SALUNKHE D K. Mycotoxins and phytoalexins[M].Boca Raton: CRC Press, 1991: 191-236.
[3] SCHUMACHER D M, METZLER M, LEHMANN L. Mutagenicity of the mycotoxin patulin in cultured Chinese hamster V79 cells, and its modulation by intracellular glutathione[J]. Archives of Toxicology,2005, 79(2): 110-121. DOI:10.1007/s00204-004-0612-x.
[4] DEMIRCI M, ARICI M, GÜMÜS T. Presence of patulin in fruit and fruit juices produced in Turkey[J]. Ernäehrungs-Umschau, 2003, 50(7):262-263.
[5] JIMÉNEZ M, MATEO R, QUEROL A, et al. Mycotoxins and mycotoxigenic moulds in nuts and sunflower seeds for human consumption[J]. Mycopathologia, 1991, 115(2): 121-127.DOI:10.1007/BF00436800.
[6] NERI F, DONATI I, VERONESI F, et al. Evaluation of Penicillium expansum isolates for aggressiveness, growth and patulin accumulation in usual and less common fruit hosts[J]. International Journal of Food Microbiology, 2010, 143(3): 109-117. DOI:10.1016/j.ijfoodmicro.2010.08.002.
[7] 张小平, 李元瑞, 师俊玲, 等. 苹果汁中棒曲霉素控制技术研究进展[J].中国农业科学, 2004, 37(11): 1672-1676.
[8] ZHU Yan, KOUTCHMA T, WARRINER K, et al. Kinetics of patulin degradation in model solution, apple cider and apple juice by ultraviolet radiation[J]. Food Science and Technology International,2013, 19(4): 291-303. DOI:10.1177/1082013212452414.
[9] 吴永宁. 现代食品安全科学[M]. 北京: 化学工业出版社, 2003: 27.
[10] 贺玉梅, 贾珍珍, 董葵, 等. 展青霉素产生菌产毒性能研究[J]. 中国卫生检验杂志, 2001, 11(3): 302-303.
[11] 林春国, 周元忻, 李兰, 等. 果蔬汁中棒曲霉素的来源及检测[J]. 中外葡萄与葡萄酒, 1999(1): 43-47. DOI:10.13414/j.cnki.zwpp.1999.01.016.
[12] 贾珍珍, 贺玉梅, 董葵, 等. 北京居民食用粮食中曲霉属菌种产毒能力分析[J]. 中国食品卫生杂志, 1989, 1(4): 46-49. DOI:10.13590/j.cjfh.1989.04.036.
[13] 卫生部. 苹果和山楂制品中展青霉素限量: GB 14974—2003[S].北京: 中国标准出版社, 2003: 1-3.
[14] 新华网. 欧盟抬高果汁准入标准[N]. [2016-07-12]. http://www.cnexp.net/waimao_xinxi/waimao_shichang/4967.html,2004,9,25.
[15] STOLOFF L, VAN EGMOND H P, PARK D L. Rationales for the establishment of limits and regulations for mycotoxins[J].Food Additives & Contaminants, 1991, 8(2): 251-257.DOI:10.1080/02652039109373971.
[16] 张小平, 李元瑞, 师俊玲, 等. 微波处理对苹果汁中展青霉素的破坏作用[J]. 农业机械学报, 2006, 37(3): 65-67.
[17] ZONG Y Y, LI B Q, QIN G Z, et al. Toxicity of patulin on fruit quality and its research progress[J]. Journal of Agricultural Science and Technology,2013, 15(4): 36-41. DOI:10.3969/j.issn.1008-0864.2013.04.07.
[18] DONG Q F, MANNS D C, FENG G P, et al. Reduction of patulin in apple cider by UV radiation[J]. Journal of Food Protection, 2010,73(1): 69-74. DOI:10.4315/0362-028X-73.1.69.
[19] ZHANG H L. Sterilization effects and mechanism of low temperature RF plasma on penicillium and botrytis[D]. 青岛: 青岛农业大学,2012: 10-44.
[20] 任兆杏, 丁振峰. 低温等离子体技术[J]. 自然杂志, 1996, 18(4): 201-207.
[21] LOCKE B R, SATO M, SUNKA P, et al. Electrohydraulic discharge and non-thermal plasma for water treatment[J]. Industrial & Engineering Chemical Research, 2006, 45(3): 882-905. DOI:10.1021/ie050981u.
[22] TERRIER O, ESSERE B, YVER M, et a1. Cold oxygen plasma technology efficiency against different airborne respiratory viruses[J].Journal of Clinical Virology, 2009, 45(2): 119-124. DOI:10.1016/j.jcv.2009.03.017.
[23] 孔磊, 黄志灵. 腹腔镜手术器械采用低温等离子体灭菌机灭菌的效果观察[J]. 中华医院感染学杂志, 2010, 20(22): 3519-3520.
[24] 李兆杰, 杨丽君, 刘小菁, 等. 辉光放电低温等离子体技术对微生物的杀菌动力学及杀菌机制[J]. 食品科学, 2015, 36(11): 167-171.DOI:10.7506/spkx1002-6630-201511032.
[25] DOBRYNIN D, FRIDMAN G, FRIEDMAN G, et al. Physical and biological mechanisms of direct plasma interaction with living tissue[J]. New Journal of Physics, 2009, 11(11): 115020. DOI:10.1109/PLASMA.2009.5227720.
[26] LAROUSSI M, TENDERO C, LU X, et al. Inactivation ofbacteria by the plasma pencil[J]. Plasma Processes and Polymers, 2006, 3(6/7):470-473. DOI:10.1002/ppap.200600005.
[27] CHING W K, COLUSSI A J, HOFFMANN M R, et al. Soluble sunscreens fully protect E colifrom disinfection by electrohydraulic discharges[J]. Environmental Science & Technology, 2003, 37(21):4901-4904. DOI:10.1021/es034182j.
[28] WALSH J L, LIU D X, IZA F, et al. Contrasting characteristics of submicrosecond pulsed atmospheric air and atmospheric pressure heliumoxygen glow discharges[J]. Journal of Physics D Applied Physics,2010, 43(3): 32001-32007. DOI:10.1088/0022-3727/43/3/032001.
[29] WANG Tiecheng, QU Guangzhou, REN Jingyu, et al. Evaluation of the potentials of humic acid removal in water by gas phase surface discharge plasma[J]. Water Research, 2016, 89: 28-38. DOI:10.1016/j.watres.2015.11.039.
[30] 王云凤, 常春艳, 葛宝坤, 等. 饮料中棒曲霉素和5-羟甲基糠醛的液相色谱-质谱测定方法[J]. 中国卫生检验杂志, 2007, 17(5): 841-842.
[31] TANIWAKI M H, HOCKING A D, PITT J I, et al. Growth and mycotoxin production by food spoilage fungi under high carbon dioxide and low oxygen atmospheres[J]. International Journal of Food Microbiology, 2009,132: 100-108. DOI:10.1016/j.ijfoodmicro.2009.04.005.
[32] DOBINK-KURTZMAN M A, BLACKBURN J A. Evaluation of several culture media for production of patulin by Penicillium species[J]. International Journal of Food Microbiology, 2005, 98(3):241-248. DOI:10.1 016/j.ijfoodmicro.2004.07.006.
[33] 郑超. 低温等离子体和脉冲电场灭菌技术[D]. 杭州: 浙江大学, 2013:19-153.
[34] 张铮, 岳永杰. 常压介质阻挡放电空气等离子体对金黄色葡萄球菌杀灭效果及机理研究[J]. 中国消毒学杂志, 2015, 32(9): 853-856.
[35] YE Shengying, SONG Xianliang, LIANG Jialiang, et al.Disinfection of airborne spores of Penicillium expansum in cold storage using continuous direct current corona discharge[J].Biosystems Engineering, 2012, 113: 112-119. DOI:10.1016/j.biosystemseng.2012.06.013.
[36] LUO Ying, WANG Jianguo, LIU Bin, et al. Effect of yeast cell morphology, cell wall physical structure and chemical composition on patulin adsorption[J]. PLoS ONE, 2015, 10(8): e0136045.DOI:10.1371/journal.pone.0136045.
[37] 石兴民, 张冠军, 袁育康, 等. 低温等离子体对白色念珠菌影响的电镜观察[J]. 西安交通大学学报(医学版), 2009, 30(6): 775-776.
[38] 李杰, 王昭博, 姜楠, 等. 沿面介质阻挡放电的低压电极配置方法[J].高电压技术, 2015, 41(9): 2844-2849. DOI:10.13336/j.1003-6520.hve.2015.09.003.
[39] 商克峰, 石峰, 韩长民, 等. 气体参数对沿面放电活性氧物质注入氧化亚硫酸铵的影响[J]. 高电压技术, 2015, 41(2): 529-533.DOI:10.13336/j.1003-6520.hve.2015.02.026.
[40] 李杰, 赵先军, 商克峰, 等. 沿面放电生成臭氧的传输损耗研究[J].高电压技术, 2016, 42(2): 349-353. DOI:10.13336/j.1003-6520.hve.2016.02.002.
[41] LUKES P, DOLEZALOVA E, SISROVA I, et al. Aqueous-phase chemistry and bactericidal effects from an air discharge plasma in contact with water: evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2and HNO2[J].Plasma Sources Science and Technology, 2014, 23(1): 184-195.DOI:10.1088/0963-0252/23/1/015019.
[42] MOISAN M, BARBEAU J, MOREAU S, et al. Low-temperature sterilization using gas plasmas: a review of the experiments and an analysis of the inactivation mechanisms[J]. International Journal of Pharmaceutics, 2001, 226(1/2): 1-21. DOI:10.1016/S0378-5173(01)00752-9.
Killing Effect of Low-Temperature Plasma Generated by Gas Phase Surface Discharge on Penicillium expansum Spores
PAN Chunqing1, YUE Tianli1, WANG Tiecheng2, WANG Yuan1, YUAN Yahong1,*, LI Yujuan2
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;2. College of Natural Resources and Environment, Northwest A & F University, Yangling 712100, China)
Abstract:Objective: This study was conducted to evaluate the fungicidal effect of low-temperature plasma generated by gas phase surface discharge on the spores of Penicillium expansum. Methods: Two strains (CICC 40658 and F-LPH10-06)of P. expansum were used to investigate their growth and patulin-producing characteristics in potato dextrose broth medium. Low-temperature plasma generated by gas phase surface discharge sterilizer was developed and used to study the effect of treatment time, power supply voltage and initial spore concentration on its fungicidal effect against P. expansum.Furthermore, the morphological changes of P. expansum spores were characterized using scanning electron microscopy(SEM). Results: The biomass (dry weight) of P. expansum CICC 40658 and F-LPH10-06 were 28.6 and 128.7 mg after 14 days of culture, respectively. The concentration of patulin produced by P. expansum F-LPH10-06 was 147.97 mg/L at the end of incubation, which was nearly 162 times higher than that produced by CICC 40658 (912.40 μg/L). CICC 40658 at an initial concentration of 3.4 × 106spores/mL could be completely killed after 21 min treatment by low-temperature plasma generated by gas phase surface discharge. For F-LPH10-06 (1.5 × 106spores/mL), a reduction of 4.58 lg(spores/mL) was observed after treatment for 30 min. In addition, the fungicidal effect was enhanced with the increase in discharge voltage or decrease in initial spore concentration after the same treatment time. SEM observation showed that the morphology of spores changed after treatment, which may be related to the charged particles with high energy and reactive oxygen species produced during high voltage discharge. Conclusion: Low-temperature plasma generated by gas phase surface discharge has strong fungicidal effect against P. expansum, which may provide an important theoretical basis for the development and application of low-temperature sterilization technology.
Key words:low-temperature plasma; gas phase surface discharge; Penicillium expansum; fungicidal effect; patulin
收稿日期:2016-08-14
基金项目:国家自然科学基金面上项目(31371814);国家科技基础性研究专项(2013FY113400)
作者简介:潘春青(1990—),女,硕士研究生,研究方向为食品安全控制技术。E-mail:pancq326@163.com
*通信作者:袁亚宏(1971—),女,教授,博士,研究方向为食品工程高新技术、食品发酵工程及食品安全控制技术。E-mail:yuanyh@nwsuaf.edu.cn
DOI:10.7506/spkx1002-6630-201721001
中图分类号:TS201.3;TS255.44
文献标志码:A
文章编号:1002-6630(2017)21-0001-07
引文格式:潘春青, 岳田利, 王铁成, 等. 气体沿面放电低温等离子体对扩展青霉孢子杀灭效果[J]. 食品科学, 2017, 38(21): 1-7.
DOI:10.7506/spkx1002-6630-201721001. http://www.spkx.net.cn
PAN Chunqing, YUE Tianli, WANG Tiecheng, et al. Killing effect of low-temperature plasma generated by gas phase surface discharge on Penicillium expansum spores[J]. Food Science, 2017, 38(21): 1-7. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201721001. http://www.spkx.net.cn