袁江兰,常 静,李传雯,康 旭
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
摘 要:为探究强碱处理大米谷蛋白结构和性质的变化规律,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、差示扫描量热法、表面疏水性分析、扫描电子显微镜观察、脱酰胺分析等方法表征碱处理大米谷蛋白的结构变化,以溶解性、乳化性、起泡性为指标表征其性质变化。SDS-PAGE和差示扫描量热分析结果表明,当NaOH溶液浓度大于等于0.08 mol/L时,谷蛋白发生完全变性,亚基明显降解,并且形成大分子聚集物;当pH≥12.0时,谷蛋白溶解度显著提高,pH值为13.0时溶解度达到80%;NaOH溶液浓度大于等于0.1mol/L时造成大米谷蛋白脱酰胺,分子中谷氨酸含量明显增加,并且溶解性、表面疏水性和脱酰胺度具有相关性;扫描电子显微镜观察结果表明碱处理导致大米谷蛋白解聚,结构变松散;碱处理改善了大米谷蛋白乳化性和起泡性,以0.5 mol/L NaOH溶液处理120 min为最佳,过度碱处理会破坏谷蛋白乳化能力和起泡能力。碱处理改变了谷蛋白结构,从而改善了谷蛋白溶解性、乳化性和起泡性,使其有望在食品或相关领域中得到有效利用。
关键词:大米;谷蛋白;碱处理;结构;性质
大米中蛋白质含量为6.7%~8.3%,仅次于淀粉含量。大米蛋白主要包括清蛋白、球蛋白、醇溶蛋白、谷蛋白,其中谷蛋白含量超过80%。大米蛋白是一种优质的植物蛋白,具有氨基酸组成合理、必需氨基酸含量高、过敏性低、消化率高等优点。大米蛋白中含量最高的谷蛋白是碱溶性蛋白质,只能溶解于浓度较高的碱溶液中,而不溶于水。另外,在大米的加工或存放过程中,其谷蛋白高级结构会发生进一步变化,导致难溶性增加[1]。因此使得大米蛋白的研究和应用受限。
食品加工中常用碱处理蛋白质,例如鸡蛋蛋白质受碱作用形成皮蛋风味;大豆蛋白用pH 12.0的碱液热处理,蛋白的溶解性、乳化性和弹性模量均显著提高[2-3];蛋白质碱热处理降解产生的氨基酸之间会形成赖丙复合物[4]。蛋白质分子中的谷氨酰胺、天冬酰胺也可以在较强碱性条件下发生脱酰胺而变为谷氨酸和天冬氨酸,从而使蛋白质肽链趋于舒展[5]。碱处理大麦谷蛋白发生脱酰胺反应,蛋白结构展开并水解,同时由于二硫键交联和疏水作用引起蛋白质发生可溶性聚集,而且乳化稳定性比较好[6]。所以合理利用碱处理蛋白质,可以使蛋白质的结构和性质发生改变,功能特性也发生相应改变。
大米谷蛋白由3 种亚基组成,分子质量分别约为20、34、43 kD[7]。其分子中谷氨酰胺、天冬酰胺含量较高,易通过氢键、疏水作用等形成致密的大分子蛋白聚合体,因此谷蛋白结构相当稳定[8]。实践中常用较强的碱性条件溶解和处理大米谷蛋白,但关于强碱性条件下大米谷蛋白结构、性质和功能特性方面的变化却鲜有报道。本实验系统研究了碱处理对大米谷蛋白结构、性质和功能特性的影响,为谷蛋白的进一步研究和应用提供参考。
1.1 材料与试剂
粳米(Oryza sativa L.) 市售。
8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、三羟甲基氨基甲烷(tris(hydroxymethyl)metyl aminomethane,Tris)、考马斯亮蓝(G-250,R-250)、β-巯基乙醇 美国Sigma公司;N,N-甲叉双丙烯酰胺(N,N’-methylenebisacrylamide,Bis)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 武汉市盖云天生物技术有限公司;标准蛋白Marker、甘氨酸 日本Takara公司;氨基酸标准品(纯度≥98%) 北京博伦凯鑫科技有限公司;茚三酮 上海三爱思试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;FD-1真空冷冻干燥机 杭州汇尔仪器设备有限公司;K9860全自动凯氏定氮仪 济南海能仪器股份有限公司;L8900氨基酸自动分析仪、F-7000荧光分光光度计、S-5500扫描电子显微镜 日本日立高新技术公司;Mini-PROTEAN电泳仪 美国伯乐公司;DSC1差示扫描量热(differential scanning calorimetry,DSC)仪瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 大米谷蛋白提取
采用碱溶酸沉法[9-10]。将大米粉和一定浓度的NaOH溶液按料液比1∶10(m/V)混合,搅拌4 h,然后5 000 r/min离心30 min,取上清液,再用0.05 mol/L的盐酸调等电点至4.8,静置12 h后将样品调至pH 7.0。同样条件离心取沉淀,再用去离子水洗沉淀3 次除去可溶性的物质。在将沉淀用质量浓度为5 g/100 mL的NaCl溶液按料液比1∶8(m/V)提取3.5 h后,除去少量的清蛋白和球蛋白,再以同样条件离心取沉淀,沉淀采用75%乙醇按料液比1∶8(m/V)提取3.5 h后同样条件离心除去醇溶蛋白。最后冷冻干燥得到谷蛋白冻干粉。
1.3.2 大米谷蛋白纯度测定
通过凯氏定氮仪测定各谷蛋白冻干粉样品中蛋白质含量,并通过式(1)计算大米谷蛋白纯度。
1.3.3 大米谷蛋白电泳分析
参考Laemmli的方法[11],采用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析各谷蛋白冻干粉亚基组成及分子质量。将不同浓度碱液提取的大米谷蛋白冻干粉样品和样品缓冲液按1∶1(m/V)混合,然后加热3 min,10 000r/min离心5min,取10 µL上样。其中分离胶为12%,浓缩胶为4%。
1.3.4 DSC分析
称取2 mg谷蛋白冻干粉置于密封的铝制坩埚中,用DSC仪测定谷蛋白热特性曲线,温度扫描范围为20~120 ℃,扫描速率为10 ℃/min,Al2O3石英管作参比。
1.3.5 蛋白脱酰胺度测定
大米谷蛋白冻干样品分散于NaOH溶液中,制得5 g/100 mL谷蛋白分散液,室温条件下搅拌30 min后于70 ℃恒温水浴锅中搅拌60 min使其发生脱酰胺反应。然后快速冷却至室温,用0.5 mol/L HCl溶液调整溶液至中性pH值,透析除盐,冻干。然后称取0.1 g冻干样品,加入3 mol/L HCl溶液5 mL,密封于消化管中,120 ℃恒温水解3 h。冷却后用自动凯氏定氮仪测定水解后样品的含氮量,按式(2)计算脱酰胺度。
式中:C0为未处理大米谷蛋白含氮量/%;CN为碱处理后大米谷蛋白含氮量/%。
1.3.6 大米谷蛋白溶解度测定
采用Bradford法[12]。称取脱酰胺谷蛋白冻干粉7 mg,分散于10 mL蒸馏水中,室温条件下搅拌30 min后10 000 r/min离心10 min取上清液,测定上清液蛋白质含量,以牛血清白蛋白为标准蛋白制作标准曲线。所有数据均为3 次测定的平均值。并按式(3)计算溶解度。
式中:m0为上清液中谷蛋白的总质量/mg;m1为冻干样品中谷蛋白的总质量/mg。
1.3.7 大米谷蛋白表面疏水性测定
表面疏水性采用ANS荧光探针法[13]。称取一定量大米谷蛋白分散于0.5 mol/L NaOH溶液中制成5 g/100 mL的蛋白分散液,室温条件下搅拌30 min后于70 ℃恒温搅拌不同时间(40、80、120、160、240 min)取样,然后快速冷却至室温,用0.5 mol/L HCl溶液调整pH值至中性,透析除盐,冻干。
将上述不同时间取样的冻干样品溶于pH 7.0的磷酸盐缓冲液中,分别制成0.02、0.04、0.06、0.08、0.10 mg/mL的溶液,取4 mL,加入8 mmol/L ANS储备液20 μL,振荡均匀后用荧光分光光度计测定其荧光强度。激发和发射波长分别为390 nm和470 nm,激发和发射狭缝宽均为5 nm。以荧光强度对蛋白质量浓度做标准曲线,标准曲线的斜率作为蛋白质的表面疏水性指数。
1.3.8 大米谷蛋白谷氨酸含量测定
将1.3.7节制得的不同时间取样的冻干样品加入6 mol/L HCl溶液中,然后置于110 ℃马弗炉中水解24 h,再用0.02 mol/L盐酸稀释至204 µg/mL,通过0.22 µm滤膜过滤后用氨基酸自动分析仪测定谷氨酸含量。分离柱为离子交换柱(4.6 mm×60 mm),进样量10 μL。泵1流速为0.40 mL/min;泵2流速为0.35 mL/min。分离柱温57 ℃,反应柱温135 ℃。通道一检测波长570 nm;通道二检测波长440 nm。最后用外标峰面积法计算样品谷氨酸含量。
1.3.9 大米谷蛋白乳化性测定
采用分光光度法。将色拉油与1.3.7节搅拌不同时间制得的大米谷蛋白冻干样品溶液按照体积比1∶3混合后,经过均质机10 000 r/min处理后制成乳浊液。然后再将100 µL的乳浊液置于50 mL的烧杯中,用0.1% SDS稀释到10 mL,测定500 nm波长处吸光度(A1),表征乳化能力;10 min后再次测定记为(A2),按公式(4)计算乳化稳定性。
1.3.10 大米谷蛋白起泡性测定
将1.3.7节搅拌不同时间制得的大米谷蛋白冻干样品制成2 g/100 mL的分散液,置于500 mL的量筒中,10 000 r/min、40 s均质3 次。记下此时液面的体积V1/mL,静置30 min后再次读取液面的体积V2/mL。起泡能力及起泡稳定性按式(5)、(6)计算。
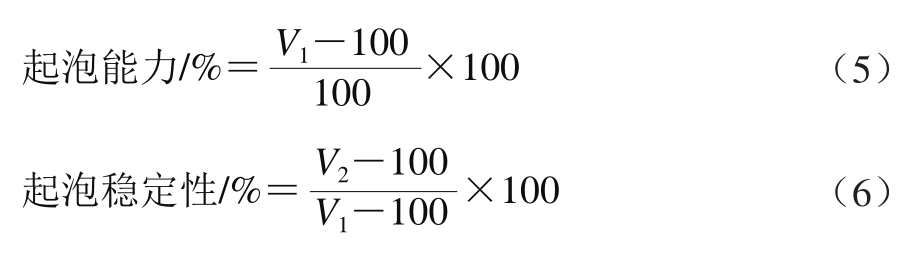
1.3.11 扫描电子显微镜观察
将1.3.7节搅拌不同时间制得的大米谷蛋白冻干样品进行喷金处理,然后采用扫描电子显微镜观察其微观结构。
1.4 数据统计分析
每个样品均做3 个平行,每个平行测定重复3 次,取平均值,结果用 表示。采用Origin 8.0软件处理和分析数据。
表示。采用Origin 8.0软件处理和分析数据。
2.1 碱法提取大米谷蛋白的纯度
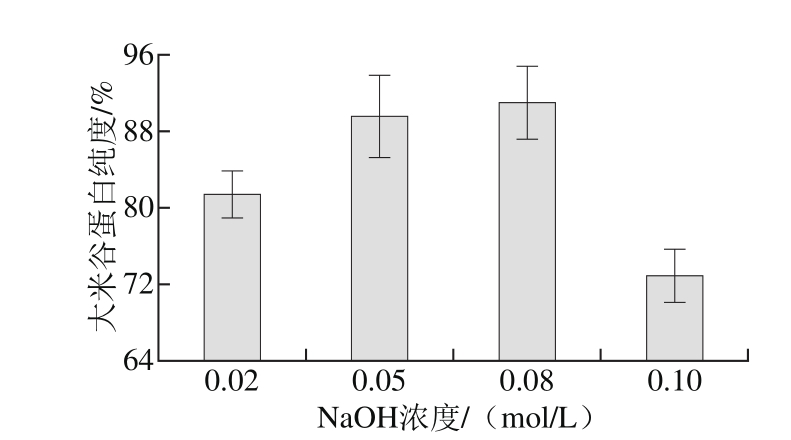
图1 碱法提取的大米谷蛋白纯度
Fig. 1 Purity of alkali extractable rice glutelin
由图1可知,NaOH浓度为0.02~0.08 mol/L时,提取物中谷蛋白纯度随NaOH浓度增加而增加,当NaOH浓度为0.10 mol/L时,提取物谷蛋白纯度明显下降,可能是因为NaOH浓度过高导致大米淀粉糊化[14],同时部分淀粉及其他成分也溶于强碱溶液,杂质增加,从而使谷蛋白纯度明显下降。0.05、0.08 mol/L NaOH溶液提取物的谷蛋白纯度差别不明显,同时考虑到较高浓度碱对谷蛋白结构产生的影响,综合分析,采用0.05 mol/L NaOH溶液提取大米谷蛋白较为宜。
2.2 碱法提取大米谷蛋白亚基和分子质量
天然的大米谷蛋白由亚基聚合而形成,每一个亚基又由一条α肽链和一条β肽链通过一个二硫键共价连接组成[15],由图2可知,不同浓度碱液提取的大米谷蛋白3 条亚基有明显区别,在NaOH浓度为0.02、0.05 mol/L时,3 条亚基条带较清晰,当NaOH浓度增大到0.08 mol/L时,大米谷蛋白亚基条带颜色变浅,各亚基均有弥散,特别是分子质量约为44.3 kD的亚基基本消失,同时在分离胶的顶部有1 条较清晰的沉积带,很可能与谷蛋白的变性聚集有关。大米谷蛋白经过多次酸碱处理会使蛋白质部分分子发生变性聚集[16],稀碱处理使鸡蛋蛋清蛋白也产生了同样的聚集结构[17]。当NaOH浓度增大到0.10 mol/L时,3 条亚基条带进一步变浅,分子质量约为44.3 kD的亚基消失,同时在分离胶的顶部有一条更加清晰的沉积带。经过强碱作用的大米谷蛋白,很可能变性聚集和降解同时存在,碱性越强,聚集程度越高,同时降解也越明显。显然,低于0.05 mol/L的NaOH溶液对谷蛋白结构和性质影响较小,碱液浓度升高则谷蛋白结构发生明显变化,大麦谷蛋白也具有相似情况,当用0.1、0.5mol/L NaOH溶液处理大麦谷蛋白时,起始阶段即发生迅速而广泛的水解作用,并且随碱浓度增大水解程度加深,但是随着处理时间延长,水解产物浓度降低同时出现了新的聚集物,说明水解物有聚集成大分子的趋势[6]。
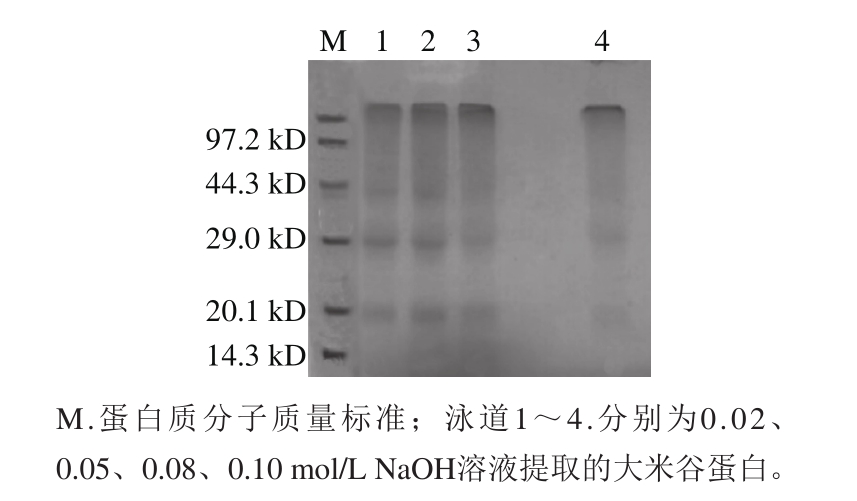
图2 大米谷蛋白亚基和分子质量
Fig. 2 Subunit composition and molecular mass of rice glutelin
2.3 碱法提取大米谷蛋白DSC的变化
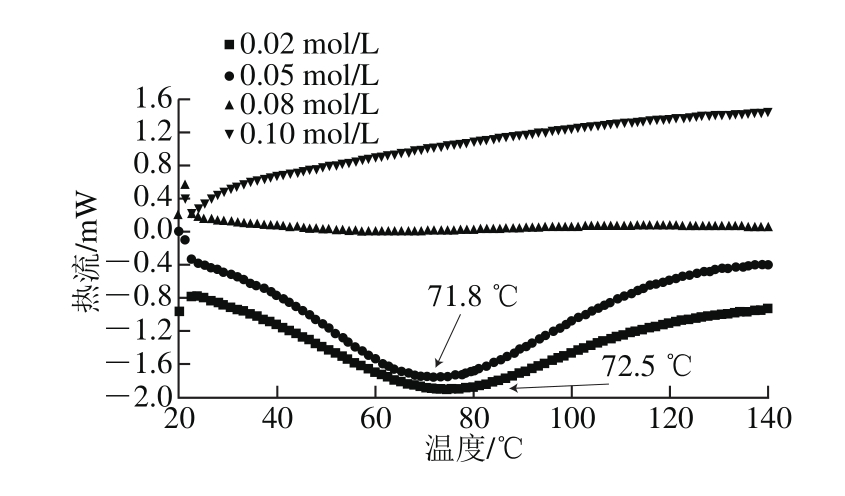
图3 碱液提取的大米谷蛋白DSC变化
Fig. 3 DSC curves of alkali extractable rice glutelin
当蛋白质发生变性时,其结构一般表现为从有序到无序,从折叠到展开,高级结构展开时会吸收热量,通过DSC测定可以反应大米谷蛋白是否发生变性。由图3可知,0.02 mol/L NaOH溶液提取的大米谷蛋白有明显的变性峰,变性温度为72.5 ℃,而0.05 mol/L NaOH溶液提取的大米谷蛋白也有明显的变性峰,但变性温度降低至71.8 ℃,变性温度逐渐降低,这是因为随着碱浓度的增大,碱导致的变性作用越来越明显,结构逐渐展开,因此变性温度随之降低[18]。当NaOH浓度大于等于0.08 mol/L时,变性峰消失,几乎呈一条直线,说明大米谷蛋白已经在碱的作用下完全变性。当碱液浓度低于0.05 mol/L时,随着NaOH浓度的升高,维系高级结构的作用力趋向于被部分打破,谷蛋白分子逐渐趋于变性,但高级结构尚能维系。当NaOH浓度达到0.08 mol/L时,谷蛋白分子内原有的非化学键作用力被破坏,谷蛋白去折叠,发生变性,也因此可能导致聚集和降解的发生[19]。DSC结果与SDS-PAGE结果一致。
2.4 碱法提取大米谷蛋白对溶解度和脱酰胺度的影响

图4 碱浓度对大米谷蛋白脱酰胺度和溶解度的影响
Fig. 4 Effect of alkali concentration on deamidation degree and solubility of rice glutelin
由图4可知,当NaOH浓度低于0.1 mol/L时,谷蛋白未发生明显的脱酰胺,当NaOH浓度超过0.1 mol/L时,脱酰胺度和溶解度均随着NaOH浓度的增加而增加。NaOH浓度为0.0~0.5 mol/L时,溶解性增加趋势明显,但是当NaOH浓度大于0.5 mol/mL时,溶解度增加趋势变缓。溶解度的变化和脱酰胺度的变化并未呈现明显的正比关系,说明脱酰胺只是影响谷蛋白溶解度的因素之一。较高浓度碱液导致谷蛋白不可逆变性,当pH值恢复至中性时,变性谷蛋白发生聚集,反而会降低谷蛋白溶解度[20]。在实验浓度范围内,谷蛋白去折叠并进一步水解,这种结构上的改变会导致更多电荷和极性基团暴露于水中,从而促进了蛋白质-水相互作用,使溶解度增加[21]。因此谷蛋白溶解度的变化是多因素综合作用的结果。
2.5 碱法提取对大米谷蛋白表面疏水性的影响
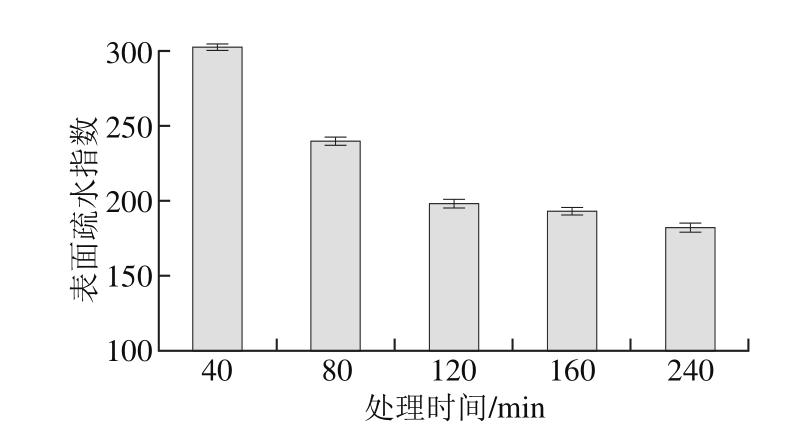
图5 碱热处理对大米谷蛋白的表面疏水性影响
Fig. 5 Effect of heating time on surface hydrohobicity of rice glutelin
由于脯氨酸、亮氨酸、丙氨酸、缬氨酸、酪氨酸、苯丙氨酸等非极性氨基酸含量较高,谷蛋白具有很强的疏水性[22],与其他分子相互作用的主要驱动力也是疏水作用力[23]。谷蛋白中谷氨酰胺和天冬酰胺含量较高,使其极性进一步降低,因而溶解性很差。碱处理导致谷蛋白脱酰胺,极性增加,疏水性降低,溶解度随之增加,结果如图5所示。0.5 mol/L NaOH溶液处理的大米谷蛋白,随着碱热处理时间的延长,表面疏水性呈现下降趋势。当处理时间超过120 min时,表面疏水性指数趋于稳定。大麦谷蛋白用0.1 mol/L NaOH溶液处理时,80 min内表面疏水性显著上升,脱酰胺度也增加至5.6%,用0.5 mol/L NaOH溶液处理超过90 min,脱酰胺度持续增加,但表面疏水性趋于稳定,同时还发现水解度持续增加[6]。说明碱处理时蛋白质的疏水性变化与脱酰胺、水解具有相关性。实验浓度处理的谷蛋白分子发生3 种主要的变化:一是分子变性,空间结构趋于舒展,部分内部基团暴露;二是脱酰胺;三是分子部分降解。这3 种变化均会导致谷蛋白表面疏水性发生变化。
2.6 碱法提取对大米谷蛋白谷氨酸含量的影响
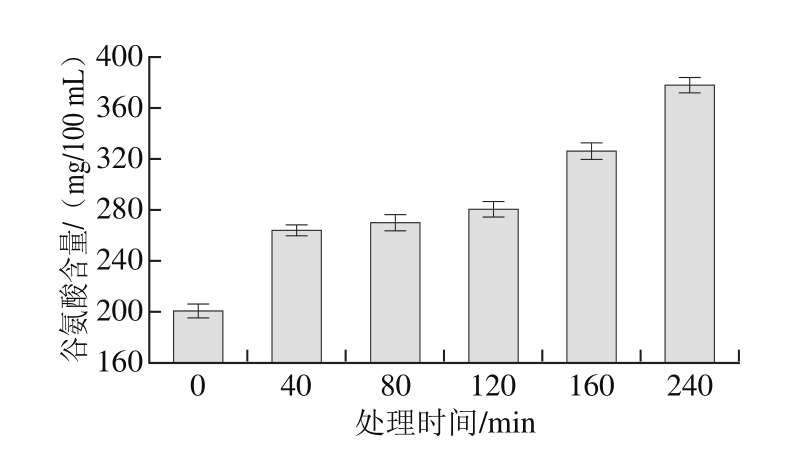
图6 碱处理大米谷蛋白谷氨酸含量
Fig. 6 Glutamic acid content of rice glutelin after different heating times
由图6可知,0.5 mol/L NaOH溶液处理的大米谷蛋白随着处理时间的延长,谷氨酸含量逐渐增加。这一变化与脱酰胺度随时间增加有关。谷氨酸含量增加使大米谷蛋白极性增大,疏水性降低。蛋白质脱酰胺使谷氨酰胺和天冬酰胺中的酰胺基转变为羧基,最终成为谷氨酸和天冬氨酸[24]。因此在对大米谷蛋白碱热处理的过程中,谷氨酸含量的增加也说明谷蛋白发生了脱酰胺。
2.7 碱法提取对大米谷蛋白乳化性和起泡性的影响
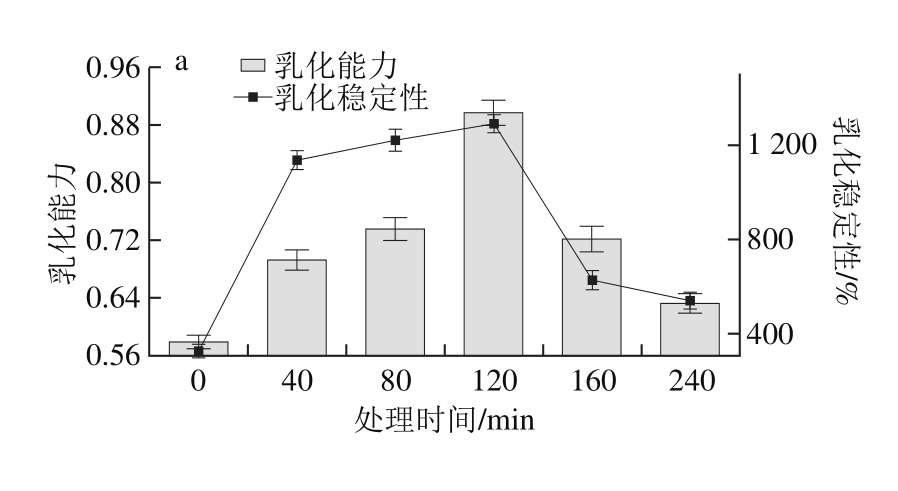

图7 碱热处理对大米谷蛋白乳化性(a)和起泡性(b)的影响
Fig. 7 Effect of alkali and heating treatment on emulsifying properties (a)and foamability (b) of rice glutelin
如图7a所示,与未处理的大米谷蛋白相比,经碱处理后乳化性总体上有提高的趋势,当热碱处理时间为0~120 min时,乳化能力明显增加,由0.578增大到0.896。随后乳化能力又逐渐降低,乳化稳定性的变化趋势与乳化能力变化趋势保持一致,但乳化能力变化规律与大麦谷蛋白有很大区别,而与很多其他蛋白如大豆蛋白、玉米蛋白等规律一致,即适度的脱酰胺改善了蛋白质的乳化能力,而过度脱酰胺则破坏了蛋白质的乳化能力,从而减少蛋白质的可利用性[25]。溶解性可以作为决定蛋白质功能特性的重要因素,溶解性良好的蛋白一般都具有良好的功能性质[26]。溶解性的改善有利于功能特性的改善,从而拓宽蛋白质的应用范围[5]。所以经过碱处理的大米谷蛋白乳化性提高可归因于溶解性增加,可溶性蛋白具有表面活性,易于吸附于油-水界面,但是乳化性也受溶解蛋白结构影响[27],碱处理时间延长导致蛋白结构持续变化,一定程度的降解和高级结构的展开等结构变化均会直接影响大米谷蛋白的乳化性[28]。适度降解导致难溶蛋白乳化性显著提高[29]。
如图7b所示,在0~120 min期间,起泡性逐渐增大,这与大米谷蛋白的溶解性存在相关性,在强碱溶液中,随着处理时间的延长,谷蛋白溶解性逐渐增加,从而更易在空气泡表面形成刚性膜状结构并且产生更多空气泡,增加了起泡性[30]。当处理时间超过120 min后,起泡性又呈明显下降趋势,说明起泡性还与蛋白质结构具有相关性,长时间碱性条件下加热使谷蛋白降解,空间结构也发生明显改变,对起泡能力影响显著。起泡稳定性和起泡性的变化趋势基本一致。


图8 大米谷蛋白超微结构(×2 500)
Fig. 8 Ultrastructure of rice glutelin (× 2 500)
由图8可知,未经碱处理的大米谷蛋白聚集成团,结构十分紧凑,没有明显孔隙。碱处理40 min时,结构变得松散,大米谷蛋白聚集体开始解体。碱处理超过120 min,聚集体进一步解体,形成细小状碎片,且随着处理时间延长,形成的碎片越来越小。说明经过碱处理,大米谷蛋白逐渐解聚,结构变松散,蛋白质发生明显降解。
大米谷蛋白是碱溶性蛋白质,在强碱条件下溶解性较好,并且相对稳定,但是其溶解性、稳定性和结构等和强碱溶液的浓度相关。当强碱液浓度低于0.05 mol/L时,大米谷蛋白结构和性质未发生明显变化,而溶解度大幅度提高。更高浓度的碱液导致大米谷蛋白明显变性和降解,谷蛋白发生明显的脱酰胺反应,谷氨酸含量增加,表面疏水性逐渐减弱,起泡性和乳化性也发生变化,但起泡性和乳化性的变化与水解程度非正相关,适度的水解有利于提高其起泡性和乳化性。关于强碱性条件下大米谷蛋白结构变化尚有待进一步深入研究。
参考文献:
[1] GUO Y B, CAI W R, TU K, et al. Infrared and Raman spectroscopic characterization of structural changes in albumin, globulin, glutelin,and prolamin during rice aging[J]. Journal of Agricultural and Food Chemistry, 2013, 61(1): 185-192. DOI:10.1021/jf303345r.
[2] WU W, HETTIARACHCHY N S, KALAPATHY U, et al. Funcrional properties and nutritional quality of alkali and heat-treated soy protein isolate[J]. Journal of Food Quality, 1999, 22(2): 119-133.DOI:10.1111/j.1745-4557.1999.tb00545.x.
[3] 简华君, 张海瑞, 黄小林, 等. 碱溶热处理对大豆分离蛋白溶解度、热聚集和流变性质的影响[J]. 食品工业科技, 2014, 35(16): 101-104.DOI:10.13386/j.issn1002-0306.2014.16.013.
[4] CHANG H M, TSAI C F, LI C F. Changes of amino acid composition and lysinoalanine formation in alkali-pickled duck eggs[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1495-1500.
[5] 廖兰. 湿热有机酸脱酰胺改性小麦面筋蛋白及作用机理的研究[D].广州: 华南理工大学, 2012: 12-15.
[6] ZHAO J, TIAN Z, CHEN L. Effects of deamidation on aggregation and emulsifying properties of barley glutelin[J]. Food Chemistry,2011, 128(4): 1029-1036. DOI:10.1016/j.foodchem.2011.04.009.
[7] SAWAI H, NIKAIDO H, MORITA Y. Studies on rice glutelin[J].Agricultural and Biological Chemistry, 1970, 34(7): 1039-1046.DOI:10.1080/00021369.1970.10859729.
[8] 葛娜, 易翠平, 姚惠源. 碱性蛋白酶提取大米水解蛋白的研究[J]. 粮食与饲料工业, 2006(4): 25-27. DOI:10.3969/j.issn.1003-6202.2006.04.010.
[9] 李亦蔚. 大米蛋白提取与分离纯化技术的研究[D]. 长沙: 长沙理工大学, 2012: 5-6.
[10] AGBOOLA S, NG D, MILLS D. Characterisation and functional properties of Australian rice protein isolates[J]. Journal of Cereal Science, 2005, 41(3): 283-290. DOI:10.1016/j.jcs.2004.10.007.
[11] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0. 5432063.
[12] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.DOI:10.1016/0003-2697(76)90527-3.
[13] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1):13-20. DOI:10.1016/0005-2795(80)90220-2.
[14] 王士磊. 大米蛋白提取工艺优化及功能特性的研究[D]. 哈尔滨: 哈尔滨工业大学, 2010: 11-13.
[15] KATSUBE-TANAKA T. Capillary electrophoresis of seed storage proteins: the separation and identification of microheterogeneous rice glutelin subunits[J]. Methods in Molecular Biology, 2013, 984:253-261. DOI:10.1007/978-1-62703-296-4_18.
[16] 李娜, 李向红, 刘永乐, 等. 提取方法对米谷蛋白分子理化性质的影响[J].食品科学, 2014, 35(3): 43-46. DOI:10.7506/spkx1002-6630-201403009.
[17] MINE Y. Effect of dry heat and mild alkaline treatment on functional properties of egg white proteins[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 2924-2928. DOI:10.1021/jf970158b.
[18] 汪立君, 李里特, 张晓峰, 等. 利用DSC对大豆蛋白质热变性的研究[J]. 中国农业大学学报, 2001(6): 93-96. DOI:10.3321/j.issn:1007-4333.2001.06.020.
[19] LIU Y L, LI X H, ZHOU X L, et al. Effects of glutaminase deamidation on the structure and solubility of rice glutelin[J]. LWT-Food Science and Technology, 2011, 44(10): 2205-2210. DOI:10.1016/j.lwt.2011.05.011.
[20] 廖兰, 韩雪跃, 李章发, 等. 小麦面筋蛋白分子聚集态对脱酰胺程度的影响[J]. 现代食品科技, 2015, 31(10): 62; 80-85. DOI:10.13982/j.mfst.1673-9078.2015.10.014.
[21] CHAN W M, MA C Y. Acid modification of proteins from soymilk residue (Okara)[J]. Food Research International, 1999, 32(2):119-127. DOI:10.1016/S0963-9969(99)00064-2.
[22] LIAO L, ZHAO M M, REN J Y, et al. Effect of acetic acid deamidationinduced modification on functional and nutritional properties and conformation of wheat gluten[J]. Journal of the Science of Food and Agriculture, 2010, 90(3): 409-417. DOI:10.1002/jsfa.3830.
[23] XU X F, LIU W, ZHONG J Z, et al. Binding interaction between rice glutelin and amylose: hydrophobic interaction and conformational changes[J]. International Journal of Biological Macromolecules, 2015,81(11): 942-950. DOI:10.1016/j.ijbiomac.2015.09.041.
[24] MATSUDOMI N, SASAKI T, KATO A, et al. Conformational changes and functional properties of acid-modified soy protein[J].Agricultural and Biological Chemistry, 1985, 49(5): 1251-1256.DOI:10.1080/00021369.1985.10866906.
[25] MARTINEZ K D, SÁNCHEZ C C, RUÍZ-HENESTROSA V P, et al.Effect of limited hydrolysis of soy protein on the interactions with polysaccharides at the air-water interface[J]. Food Hydrocolloids,2007, 21(5/6): 813-822. DOI:10.1016/j.foodhyd.2006.09.008.
[26] 聂小华, 龚燕丹, 许丹, 等. 酸法脱酰胺处理对大米蛋白功能特性的影响[J]. 食品与发酵工业, 2015, 41(5): 85-88. DOI:10.13995/j.cnki.11-1802/ts.201505015.
[27] AHMEDNA M, PRINYAWIWATKUL W, RAO R M. Solubilized wheat protein isolate: functional properties and potential food applications[J]. Journal of Agricultural and Food Chemistry, 1999,47(4): 1340-1345. DOI:10.1021/jf981098s.
[28] 周小玲, 米谷蛋白的酶法脱酰胺及其功能性质的研究[D]. 长沙: 长沙理工大学, 2011: 13-14.
[29] XU X F, ZHONG J Z, CHEN J, et al. Effectiveness of partially hydrolyzed rice glutelin as a food emulsifier: comparison to whey protein[J]. Food Chemistry, 2016, 213(12):700-707. DOI:10.1016/j.foodchem.2016.07.047.
[30] MAKRI E A, DOXASTAKIS G I. Emulsifying and foaming properties of Phaseolus vulgaris and coccineus proteins[J]. Food Chemistry,2006, 98(3): 558-568. DOI:10.1016/j.foodchem.2005.06.027.
Alkali Denaturation and Structural Characterizations of Rice Glutelin
YUAN Jianglan, CHANG Jing, LI Chuanwen, KANG Xu
(School of Food and Biological Engineering, Hubei University of Technology, Wuhan 430068, China)
Abstract:The changes in the structure and properties of rice glutelin after alkali treatment were explored. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), automatic amino acid analyzer, differential scanning calorimetry(DSC), surface hydrophobicity analysis, scanning electron microscopy (SEM) and deamidization analysis were applied to elucidate the structure of rice glutelin, and solubility, emulsifying properties and foamability were determined to clarify the change of its properties. The results from SDS-PAGE and DSC showed that rice glutelin was denaturated completely,when the concentration of sodium hydride was 0.08 mol/L or higher, causing considerable degradation of subunits and the formation of macromolecular aggregates. When pH was 12.0 or higher, glutelin solubility increased significantly and reached 80% at pH 13.0. Alkali at high concentration above 0.1 mol/L caused deamidization, leading to a significant increase of glutamate content in the glutelin molecule, and the degree of deamidization was correlated with solubility and surface hydrophobicity. Results from SEM showed that alkali treatment led to the degradation and more loose structure of rice glutelin. Appropriate alkali treatment improved the emulsifying properties and foamability of rice glutelin, and the optimum condition was treatment of rice glutelin for 120 min with 0.5 mol/L NaOH solution, but excessive alkali treatment could destroy its emulsification properties and foamability. Proper alkali treatment changed the structure of rice glutelin and accordingly improved its solubility, emulsifying properties and foamability, which is expected to be effectively utilized in food or related fields.
Key words:rice; glutelin; alkali treatment; structure; properties
DOI:10.7506/spkx1002-6630-201721007
中图分类号:Q518.4
文献标志码:A
文章编号:1002-6630(2017)21-0043-06
引文格式:袁江兰, 常静, 李传雯, 等. 大米谷蛋白的碱致变性和结构表征[J]. 食品科学, 2017, 38(21): 43-48.
DOI:10.7506/spkx1002-6630-201721007. http://www.spkx.net.cn
YUAN Jianglan, CHANG Jing, LI Chuanwen, et al. Alkali denaturation and structural characterizations of rice glutelin[J].Food Science, 2017, 38(21): 43-48. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721007.http://www.spkx.net.cn
收稿日期:2016-07-10
基金项目:国家自然科学基金面上项目(31371741)
作者简介:袁江兰(1970—),女,副教授,博士,研究方向为食品蛋白质。E-mail:jlyuan1229@163.com