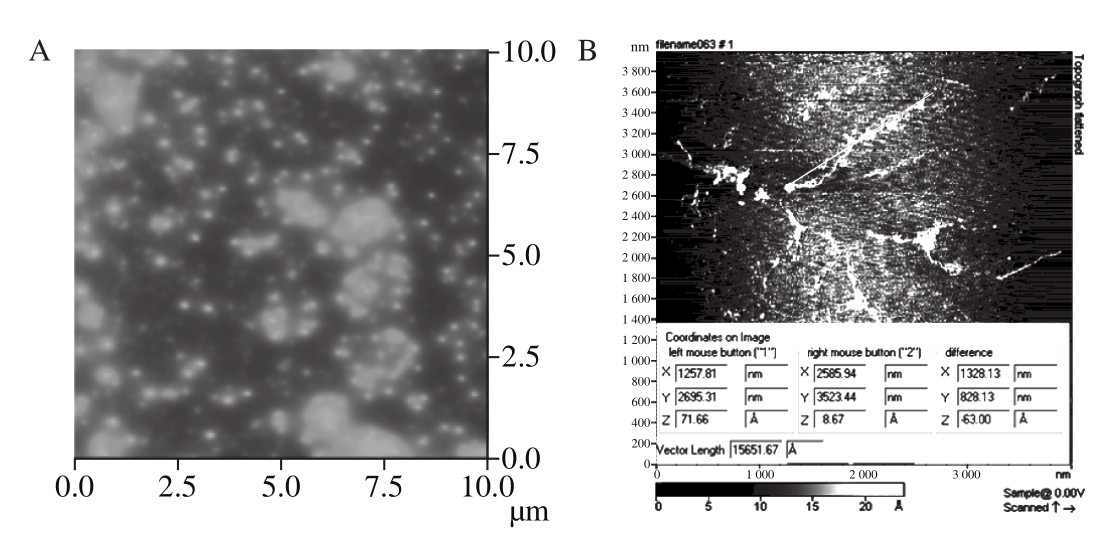
图1 1.0 μg/mL(A)和0.05 μg/mL(B)葛仙米多糖的AFM图
Fig. 1 AFM images of N. sphaeroides Kütz. polysaccharide at different concentrations
莫开菊1,2,程 超1,庄 洋1,陈美林1,赵 娜1
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
摘 要:通过原子力显微镜观察葛仙米多糖的单分子形态,发现葛仙米多糖包括柔性分支链和刚性分支链,主要以带分支的柔性长链、无分支或分支较少的刚性分支链、3 条链缠绕而成的发散结构等形态存在,同时观察到部分分支链的单螺旋结构。葛仙米多糖主要以丰富分支的状态存在,可见螺旋结构,分支长度一般在200~600 nm,单分子直径在1.0 nm以内,在多链缠绕处高度为1.3~2.3 nm左右。流变学特性分析表明,葛仙米多糖能形成弱凝胶体系,说明多糖分子间能够交联,但交联度不高,证实葛仙米多糖具有柔性的多分支结构。
关键词:原子力显微镜;葛仙米;多糖;流变学;链构象
葛仙米(Nostoc sphaeroides Kütz.)是一种药食同源的单细胞蓝藻,含有丰富的多糖[1-2]。大量研究表明,许多植物多糖具有多种抗肿瘤、抗癌、抗氧化、提高机体免疫力的功能[3-5]。葛仙米多糖也具有生物活性,莫开菊等[2]研究了葛仙米多糖的抗肿瘤效果,发现葛仙米多糖具有明显的抑瘤作用;彭常安等[1]研究证实葛仙米多糖对人体结肠直肠癌细胞有突出的抑制作用;常向东等[6]对葛仙米多糖的抗菌性进行了分析,结果表明葛仙米多糖对金黄色葡萄球菌、大肠杆菌、霉菌、绿脓杆菌等均有抑制作用。
多糖的生物活性与其化学结构关系密切,尤其是多糖的高级结构对多糖活性有更大的影响[7]。多糖的螺旋构型是最具生物活性的空间结构[8-9]。Surenjav等[10]研究了香菇多糖的构效关系,发现香菇多糖中的三股螺旋结构与抗肿瘤活性相关;Bao Xingfeng等[11]研究证明多糖的生物活性与单螺旋结构相关,单螺旋结构能促进T细胞增殖,提高机体免疫力;Yang Yi等[12]研究发现龙眼果肉多糖的单螺旋结构有助于激活淋巴细胞和自然杀伤细胞,提高机体免疫能力。吕金顺[13]从多糖构型中提炼出凹形结构的概念,指出多糖的凹形结构机制影响多糖的抗肿瘤及免疫活性,螺旋构象是一种典型的凹形结构。由此可见,探求多糖的生物活性机理须明确多糖的高级结构,尤其是链构象。
多糖的空间结构因其组成和构象的复杂性而难以完全解析,而原子力显微镜(atomic force microscopy,AFM)为观察多糖表面结构形貌提供了一种新的手段,具有制样简单、测定环境要求低、分辨率高、适用面广等优点[14]。通过AFM,可以对多糖样品在纳米尺度上高分辨成像,在观察多糖分子表面形貌的同时,还能获取链的长度、直径等量化信息,进而分析多糖分子的表面链构象。孙润广等[15]利用AFM观察到了甘草多糖链多股紧密的螺旋结构;Yang Hongshun等[16]对桃子中的果胶进行AFM观察,发现果胶分支链由长度为11.719、15.625、19.531、35.156 nm的4种链长结构单元组成,随着贮存时间的延长,果胶分子的聚集程度逐步加深。Gunning等[17]利用AFM研究了结冷胶等微生物多糖,观察到结冷胶呈纤维网状结构。
多糖的流变学特性是多糖溶液宏观动力特征,是体系结构的表征,能间接反映多糖在溶液中的链构象和构象转变[18]。多糖分子的链结构、多重构象对多糖溶液的黏弹性有重要影响[19],Rief等[20]利用AFM研究了多糖分子中葡聚糖,结果表明,改变分子构型,分子弹性明显增加。此外,有报道部分多糖如车前子多糖的生理活性与其流变学(高黏度或成胶性)特性相关[21]。因此,多糖的流变学特性有助于辅助证明多糖的结构及生理活性。
本实验以葛仙米多糖为研究对象,利用AFM对葛仙米多糖分子的表面形貌进行观察分析,并以葛仙米多糖分子的流变学特性来验证AFM观察结果的准确性,拟初步探寻葛仙米多糖分子构型与生物活性的关系,以期为葛仙米多糖分子结构的深入研究、生物活性的进一步开发提供理论支持。
1.1 材料与试剂
葛仙米 鹤峰县走马乡;葛仙米多糖:采用热水提取,Sevag法反复多次除蛋白质,乙醇沉淀,冷冻干燥,纯度达到80%,凝胶渗透色谱法分析结果表明,其是分子质量分布很宽、不含氮和硫元素的酸性多糖,其重均分子质量为9.564×106D、数均分子质量为5.634×106D、多分子分散系数d为1.698。
柠檬酸(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
AutoProbc CP Research型AFM 美国Thermo仪器公司;5500 ILM型AFM 美国安捷伦科技公司;AR2000ex型动态流变仪 美国TA仪器公司。
1.3 方法
1.3.1 葛仙米多糖的分离纯化
葛仙米多糖提取:称取一定量的葛仙米,清洗、脱色、粉碎、脱脂后,按料水比为1∶90(m/V),于90 ℃水浴锅中提取6 h[22],旋蒸去掉水分后,采用Sevag法脱蛋白,先用60%乙醇沉淀冷冻干燥得到葛仙米多糖样品S1。S1复溶后再用32%乙醇进一步醇沉纯化后,再冷冻干燥得到样品S2[2]。
1.3.2 AFM观察
用质量分数0.05%的柠檬酸水溶液配制成1.00、0.05 μg/mL的葛仙米多糖溶液,充分溶解后,移取葛仙米多糖溶液滴在新鲜剥离的云母表面。
AFM参数:100 pm扫描器,硅探针,针尖曲率半径10 nm,力常数约为2.8 N/m,轻敲模式。室温测试,空气湿度60%。
1.3.3 流变学特性测定
用纯水配制质量浓度为10、15、20、30 mg/mL的S1溶液,pH 6.0。
测定条件:振荡模式,strain=2%,平板Ф=40 mm,高度1 000 μm,温度为25 ℃。进行温度扫描时在平板周围涂上轻质硅油,防止样品水分挥发,扫描温度范围为0~90 ℃,升温程序为5 ℃/min。
1.4 数据统计分析
采用了Origin 8.0软件对数据进行了作图,并用Nanoscope V530R3SR3和Picoscan软件处理AFM图。
2.1 葛仙米多糖的AFM分析
2.1.1 不同质量浓度对葛仙米多糖微观结构的影响
糖链的密度与葛仙米多糖溶液的初始质量浓度相关。当1.0 μg/mL时,单位区域分支链密度高(图1A中高亮区域),这是由于在氢键和范德华力的作用下,链间作用点增多、作用力增强,使多糖分子形成聚集体。当0.05 μg/mL时,糖链密度降低,分支链间缠绕聚集减少,获得了分支链较分散的单分子图谱(图1B)。由此可见,样品质量浓度对单分子的微观结构影响较大,当降低到合适的状态才易于获得分散的分支链。

图1 1.0 μg/mL(A)和0.05 μg/mL(B)葛仙米多糖的AFM图
Fig. 1 AFM images of N. sphaeroides Kütz. polysaccharide at different concentrations
2.1.2 葛仙米多糖S1分支链的AFM分析

图2 葛仙米多糖S1的分支链
Fig. 2 Branched chains of N. sphaeroides Kütz. polysaccharide S1
从图2可以看出,葛仙米多糖分子得到很好的分散,没有大的聚集体,可以看出整体呈多分支的树枝状,既包括刚性的线性分支链,又包括带分支结构的柔性分支链,还有部分聚集体;葛仙米多糖带多分支的略微卷曲的柔性分支链,如a、c、d、e链,链长分别为1 565.1、440.9、188.9、342.4 nm,其最长链a上有长短不一的分支,其中b链分支长约122.0 nm;刚性分支链,呈棒状结构,最长的一条刚性分支链f长约657.6 nm。此外,分支链a存在多个分支,其中一个分支处呈现环状,这既可能是分支链未完全分散聚集而成,也有可能是链内氢键连接卷曲而成;3 条分支链(c、d、e)的一端缠绕而成的发散型的分支结构,其缠绕部分链长约245.3 nm。
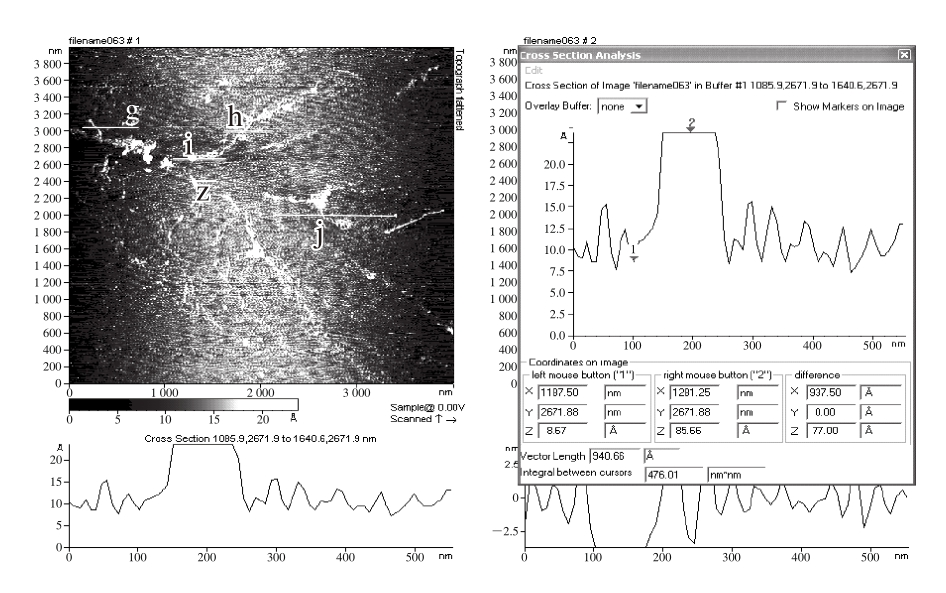
图3 葛仙米多糖S1的分支链直径
Fig. 3 Molecular diameter of branched chain of N. sphaeroides Kütz.polysaccharide S1
图3显示了葛仙米多糖S1的分支链直径。在AFM图中,分支链直径通常以分支链高度表示,而不是以分支链宽度表示,这是由于AFM针尖的尺寸偏大容易导致“增宽效应”,使测定的宽度值偏大,而分支链高度不受“增宽效应”的影响。一般多糖分支链直径为0.5~1.2 nm[23-25]。图3中g、h、j处的高度分别为0.97、0.73、0.90 nm,而z处高度为1.5 nm,i处高度为7.7 nm。结合图中各处形态,判断g、h、j所处链呈单分支状态,推测z处可能是2 条分支链缠绕,i处是未分散开的聚集态,由多条分支链通过分子间氢键或范德华力缠绕而成。
综合AFM观察,葛仙米多糖S1分子是呈树枝状的多分支结构,并发现了以下几种构型:带分支的柔性分支链、由3 条柔性分支链组成的分散结构、呈棒状的刚性分支链、分支链未分散的小聚集体,其部分结构呈单螺旋构象。
2.1.3 葛仙米多糖S2及其分支链的AFM分析
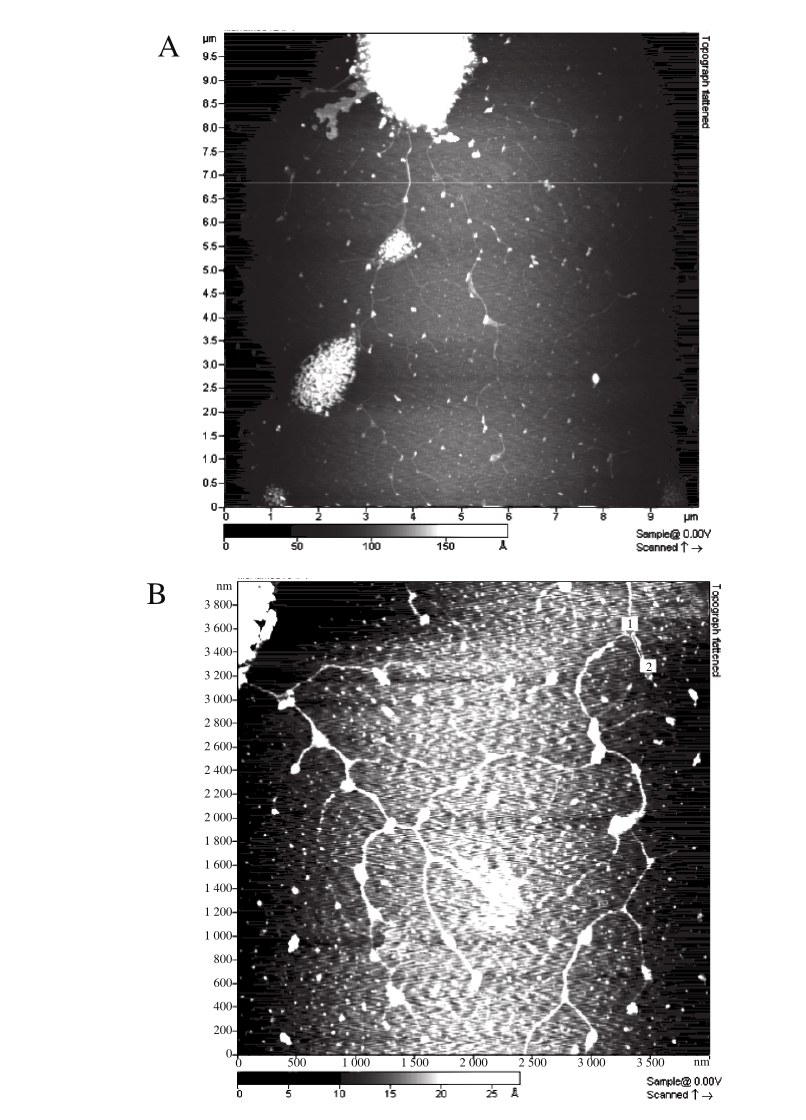

图4 葛仙米多糖S2的AFM图
Fig. 4 AFM images of N. sphaeroides Kütz. polysaccharide S2
A.扫描范围10 μm×10 μm;B.扫描范围4 μm×4 μm;C.螺旋结构。
利用AFM观察S2如图4所示。图4A中,葛仙米多糖分支链得到较好的分散,均匀分布在视野中,呈分支状,但在分支处可见许多凸起的小结点;将图4A中分散较好的部分放大得到图4B,其中以柔性分支链为主,分支较多,大多以2 条或3 条分支链以发散形态缠绕并以此种结构不断延伸;将图4B中链段放大得到图4C,依稀可见螺旋结构。
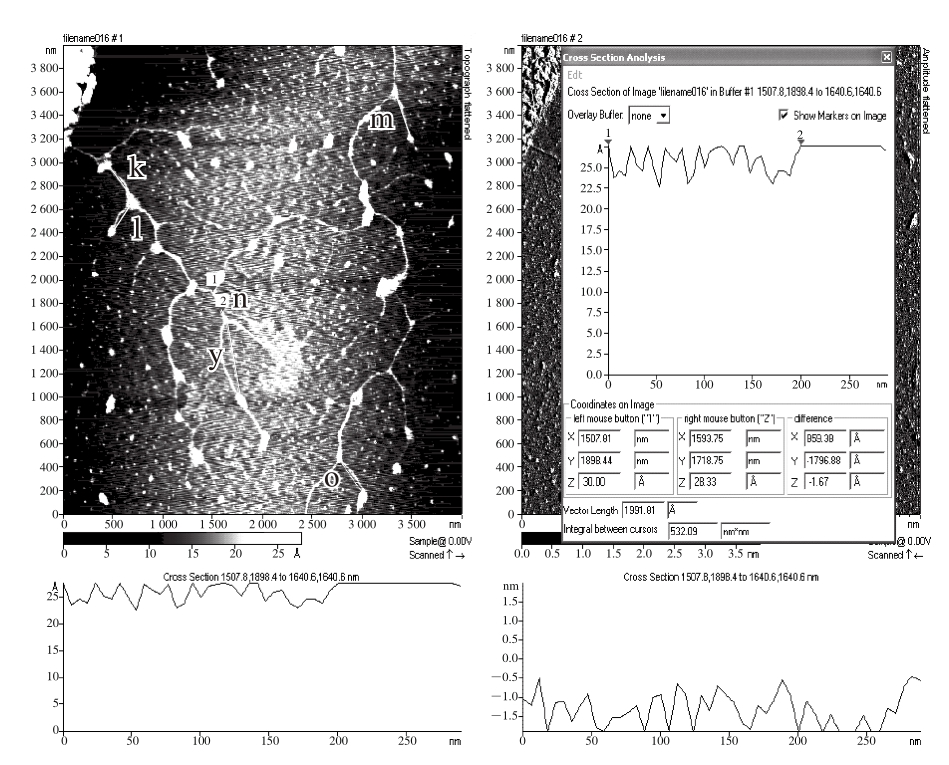
图5 葛仙米多糖S2的分支链的AFM图
Fig. 5 Branched chains of N. sphaeroides Kütz. polysaccharide S2
S2的分支链长度见图5。分支链n、k、l、m、o、y长度分别为199、337、331、392、321、645 nm,可见葛仙米多糖S2分支链长度基本均匀,链间通常由结点连接为更长的分子链,其最长的链跨越整个扫描区域,大于4 μm。
S2的分支链直径见图6。v点、p点、s点、t点的高度分别为1.2、0.9、1.0、0.8 nm,均在多糖单分子直径的范围内,而u点、q点、r点的高度分别为1.3、2.2、2.27 nm,均为结点高度,可以认为是2 条或者3 条分支链连接点。
将图3、图4~6进行比较分析发现,S1含有分支链大小、结构不同的多种组分,S2分支链多,彼此交联度高,在整个视野中看不到分离开的、独立的链。但是S1和S2两者中多糖分子的结构是极其相似的,分支长度一般在200~600 nm左右,单分支链高度大多在1.0 nm以内,在多链缠绕处高度为1.3~2.3 nm左右。这说明S2就是S1组分中分支链较大的部分,说明采用不同体积分数乙醇沉淀能达到纯化效果。
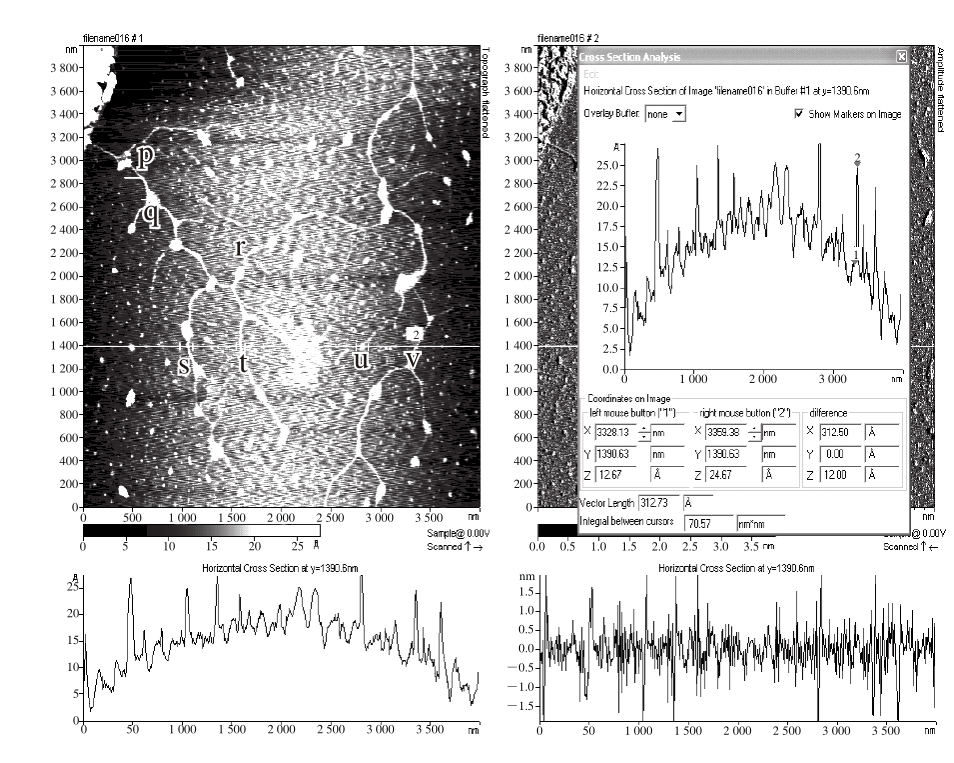
图6 葛仙米多糖S2的分支链直径
Fig. 6 Molecular diameter of N. sphaeroides Kütz. polysaccharide S2
2.2 葛仙米多糖的动态流变学特性
多糖的流变学特性与其分子结构密切相关,小幅振荡实验通过测定弹性模量(G’)、黏性模量(G’’)和损耗角(δ)来评价样品的黏弹性,微观上主要测量分子链的柔顺性,进而获得样品的内部信息。其中,G’代表弹性部分,G’’代表黏性部分,当G’’>G’时,多糖溶液表现出流体性质,被认为是溶胶特性;当G’>G’’时,多糖溶液表现出固体性质,被认为是凝胶特性。此外,损耗角δ是由G’、G’’计算出来的,其关系式为tan δ=G’/G’’。一般认为0°<δ<90°为黏弹性体,δ>45°表现为溶胶特性,δ<45°表现为凝胶特性。
2.2.1 不同质量浓度葛仙米多糖溶液的动态黏弹性
分别对质量浓度为10、15、20、30 mg/mL的葛仙米多糖水溶液在角频率0.5~50.0 rad/s的范围内进行扫描。如图7A所示,随着角频率的升高,溶液弹性模量缓慢增大;多糖质量浓度越高,溶液弹性模量越大。当葛仙米多糖质量浓度为10 mg/mL时,溶液的G’和G’’最低,当为30 mg/mL时,溶液的G’和G’’最高。这是由于随着多糖质量浓度的增加,单位区域的多糖分子增加,链段密度增大,分子间氢键、范德华力增强,对流动产生阻力,从而表现出黏性增强,同时分子间的相互作用力导致网络结构增强,相应地表现出弹性增加。
由图7可知,当葛仙米多糖质量浓度为10 mg/mL时,G’’>G’,δ>45°,体系主要表现为溶胶特性,但从15~30 mg/mL时,G’>G’’,δ<45°表现为凝胶特性。通常当δ<6°时,才能形成真凝胶,因此葛仙米多糖在15~30 mg/mL的水溶液体系中,可形成弱凝胶,表现出弹性增加。

图7 不同质量浓度的葛仙米多糖溶液的流变学特性
Fig. 7 Viscoelasticity of N. sphaeroides Kütz. polysaccharides at different concentrations
2.2.2 不同温度葛仙米多糖胶的动态黏弹性
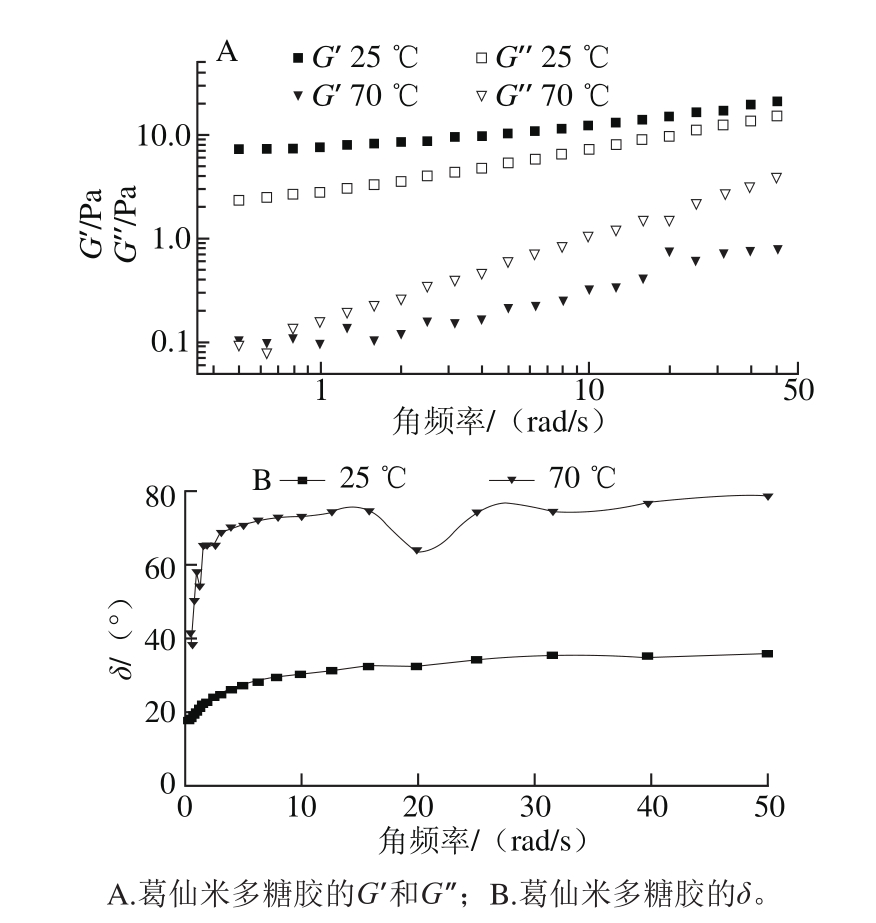
图8 不同温度条件下葛仙米多糖胶的流变学特性
Fig. 8 Viscoelasticity of N. sphaeroides Kütz. polysaccharides at different temperatures
温度会影响多糖在形变和流动过程中的黏弹性。从图8A可见,在25 ℃条件下葛仙米多糖胶的弹性模量明显大于70 ℃时的多糖胶,而且25 ℃时,G’>G’’,多糖胶表现出弹性,分支链形成稳定的网络结构,具备凝胶特征;但70℃时,G’’>G’,多糖胶表现出黏性,呈溶胶状态。图8B中,在70 ℃时,δ>45°,表现溶胶的黏性;在25 ℃时,δ<45°,表现为凝胶的弹性。这是由于随着温度的升高,分子运动活化能增加,分子间氢键被削弱,链间的联结点减少,流动性增强,体系黏度降低,分支链间稳定的网络结构难以维持。
本研究利用AFM观察发现葛仙米多糖呈树枝分散状,由刚性分支链和柔性分支链以及小的聚集体组成;大部分以柔性分支链组成,分支链间相互联结并不断延伸,可见螺旋结构。S1是采用60%乙醇沉淀提取的葛仙米多糖,经柱层析和凝胶色谱分析,被认为是性质相似的纯度较高的多糖,但是在进行AFM观察时,看到了2 种结构。因此将S1再次经水溶解,采用逐步增加乙醇体积分数,逐级分离多糖,当乙醇体积分数到达32%后,获得大量的长絮状沉淀物S2,剩余物再用更高体积分数的乙醇沉淀,当体积分数达到60%后,得到极少量短絮状物。由于后者量太少,因此第二次AFM观察时只用了32%乙醇沉淀物。两次观察结果说明,S1中含有的大量成分即S2,对S2的观察只发现了具有多分支的柔性链状分支,说明通过不同体积分数乙醇分级沉淀,能将葛仙米多糖适度分级纯化。
本研究中还观察到了葛仙米多糖的螺旋结构。螺旋结构对多糖生物活性表达非常重要,从而间接证明了葛仙米多糖抗肿瘤的生物活性[2]。此外还有些链构型可能与多糖的生物活性相关,有研究表明多糖线性分支链上的侧链能调节多糖结构与活性的不平衡[26],对多糖的生物活性有一定影响,同时,这种带多分支的分支链也符合吕金顺[13]的凹形结构学说,该分支链的支链均较短,短的支链可能对多糖活性也有贡献[27]。葛仙米多糖分子同样具有这样的结构特征,这也从侧面反映了葛仙米多糖可能具有良好的生物活性。葛仙米多糖中葡萄糖醛酸的物质的量比例高达13.5%[28],有报道称含糖醛酸的酸性多糖具有较强的免疫促进作用[29]。以上结构研究均从不同角度揭示了葛仙米多糖具有一定的生物活性。因此深入研究葛仙米多糖结构与生物活性的构效关系,将成为另一有意义的研究方向。
通过对不同质量浓度葛仙米多糖胶的流变学特性分析表明,葛仙米多糖溶液质量浓度为10 mg/mL时主要以溶胶形式存在,15~30 mg/mL时能形成弱凝胶体系,说明葛仙米多糖分子间能够交联,但交联度不高。这间接证实葛仙米多糖具有柔性的多分支结构,多分支的存在既能增强溶胶体系的黏度,又会降低凝胶体系的强度。这表现在当葛仙米多糖质量浓度较高时,分支链密度增大,链间联结点多、相互作用力强,形成稳定的网络结构,使体系呈现凝胶特性,但是,由于多分支结构的存在,又妨碍了分支链间氢键的形成及交联的紧密性,从而影响凝胶强度;当质量浓度较低时,分子间作用力减弱,分支链充分伸展,稳定的网络结构难以维系,体系呈现出溶胶特性,但是由于有较多分支,使多糖分子质量巨大,溶胶的黏度增加。此外,较低的温度有助于稳定多糖的网络结构,形成凝胶;而较高温度时,多糖分支链间氢键作用减弱,网络结构松弛,分支链伸展,流动性增强,使体系表现出溶胶特性。因此,通过流变学特性研究,证实了葛仙米多糖分子具有多分支结构。
葛仙米多糖的分子结构及流变学特性与黄原胶的十分相似。Liang Hao等[30]采用AFM技术观察到黄原胶在固态或水溶液中呈现半柔顺的双螺旋结构;有资料表明黄原胶只有在大于1 g/100 g的水溶液中才能形成弱凝胶,在较低支链浓度条件下以溶胶状态存在[31],而且在0.1 g/100 g的低质量浓度条件下,葛仙米多糖和黄原胶溶液的黏度非常接近[32]。众所周知,黄原胶作为增稠剂、稳定剂、乳化剂、抗冰晶融化剂、抗淀粉老化剂等被广泛用于食品。因此葛仙米多糖的食品功能性质值得广泛而深入的研究,为其作为食品添加剂和食品功能因子提供理论依据。
参考文献:
[1] 彭常安, 宋玉华, 李春雨. 微波提取葛仙米多糖及其抑癌作用研究[J]. 安徽农业科学, 2012, 40(20): 10606-10608. DOI:10.13989/j.cnki.0517-6611.2012.20.122.
[2] 莫开菊, 谢笔钧, 龚晨睿, 等. 葛仙米多糖体内抑瘤及对免疫的影响[J].食品科学, 2008, 29(4): 392-396.
[3] JOSEPH M M, ARAVIND S R, VARGHESE S, et al. Evaluation of antioxidant, antitumor and immunomodulatory properties of polysaccharide isolated from fruit rind of Punica granatum[J].Molecular Medicine Reports, 2011, 5(2): 489-496. DOI:10.3892/mmr.2011.638.
[4] LI Ning, LI Le, FANG Jincen, et al. Isolation and identification of a novel polysaccharide-peptide complex with antioxidant,anti-proliferative and hypoglycaemic activities from the abalone mushroom[J]. Bioscience Reports, 2012, 32(3): 221-228. DOI:10.1042/BSR20110012.
[5] 高尚龙. 三种姬松茸多糖的抗氧化、抗衰老活性与结构研究[D]. 泰安: 山东农业大学, 2014: 12-15.
[6] 常向东, 李冰冰, 邓伊苓, 等. 葛仙米水溶性多糖的抗菌性实验研究[J].医学理论与实践, 2009, 22(9): 1032-1034.
[7] LI Yan, WANG Zhaomei, GUO Siyuan. Review on the advanced structure of bioactive polysaccharides[J]. Guangdong Chemical Industry, 2005, 32(8): 78-81.
[8] 杨海龙, 吴天祥, 章克昌. (1→3)-β-D-葡聚糖构象的理论分析[J]. 无锡轻工大学学报, 2002, 21(5): 487-491.
[9] BERIT H F, TERJE, E, LIV R, et al. The cytokine stimulatingactivity of (1→3)-β-D-glucans is dependent on the triple helix conformation[J].Carbohydrate Research, 2000, 329(3): 587-596. DOI:10.1016/S0008-6215(00)00222-6.
[10] SURENJAV U, ZHANG Lina, XU Xiaojuan, et al. Effects of molecularstructure on antitumor activities of (1→3)-β-D-glucans from different Lentinusedodes[J]. Carbohydrate Polymers, 2006, 63(1): 97-104.DOI:10.1016/j.carbpol.2005.08.011.
[11] BAO Xingfeng, DONG Quan, FANG Jinian. Structure and conformation behavior of a glucan from spores of Ganoderma lucidum (Fr.)Karst.[J]. Acta Biochimica et BiophysicaSincia, 2000, 32(6): 557-561.
[12] YANG Yi, ZHANG Mingwei, LIAO Sentai, et al. Effects of alkali dissociation on the molecular conformation and immunomodulatory activity of longan pulp polysaccharide[J]. Carbohydrate Polymers,2012, 87(2): 1311-1317. DOI:10.1016/j.carbpol.2011.09.014.
[13] 吕金顺. 植物多糖的凹形结构与生物活性关系[J]. 天然产物研究与开发, 2002, 15(4): 79-82. DOI:10.16333/j.1001-6880.2002.04.017.
[14] KIRBY A R, GUNNING A P, MORRIS V J. Atomic force microscopy in food research: a new technique comes of age[J]. Trendsin Food Science & Technology, 1995, 6(11): 359-365.
[15] 孙润广, 张静. 甘草多糖螺旋结构的原子力显微镜研究[J]. 化学学报, 2006, 64(24): 2467-2472.
[16] YANG Hongshun, AN Hongjie, FENG Guoping, et al. Atomic force microscopy of the water-soluble pectin of peaches during storage[J].European Food Research and Technology, 2005, 220(5/6): 587-591.DOI:10.1007/s00217-004-1102-3.
[17] GUNNING A P, KIRBY A R, MORRIS V J, et al. Imaging bacterial polysaccharides by AFM[J]. Polymer Bulletin, 1995, 34(5/6): 615-619.DOI:10.1007/BF00423359.
[18] PELLETIER E, VIEBKE C, MEADOWS J, et al. Solution rheology of κ-carrageenan in the ordered and disordered conformations[J].Biomacromolecules, 2001, 2(3): 946-951. DOI:10.1021/bm010060c.
[19] 栾途. 透明质酸粘多糖的分子表征、流变学性质及其物理凝胶的研究[D]. 上海: 上海交通大学, 2011: 139-142.
[20] RIEF M, OESTERHELT F, HRYMANN B, et al. Single molecule force spectroscopy on polysaccharides by atomic force microscopy[J].Science, 1997, 275: 1295-1297. DOI:10.1126/science.275.5304.1295.
[21] MARLETT J A, FISCHER M H. A poorly fermented gel from psyllium seed husk increases excretamoisture and bile acid excretion in rats[J]. The Journal of Nutrition, 2002, 132(9): 2638-2643.
[22] 莫开菊, 谢笔均, 汪兴平, 等. 葛仙米多糖的提取、分离与纯化技术研究[J]. 食品科学, 2004, 25(10): 103-108.
[23] GUNNING A P, GIARDINA T P, FAULDS C B, et al. Surfactantmediated solubilisation of amylose and visualisation by atomic force microscopy[J]. Carbohydrate Polymers, 2003, 51(2): 177-182.DOI:10.1016/S0144-8617(02)00126-1.
[24] GUNNING A P, KIRBY A R, MACKIE A R, et al. Watching molecular processes with the atomic force microscope: dynamics of polymer adsorption and desorption at the single molecule level[J].Journal of Microscopy, 2004, 216(1): 52-56. DOI:10.1111/j.0022-2720.2004.01391.x.
[25] MCINTIRE T M, BRANT D A. Observations of the (1-3)-β-D-glucan linear triple helix to macrocycle interconversion using noncontact atomic force microscopy[J]. Journal of the American Chemical Society, 1998, 120(28): 6909-6919. DOI:10.1021/ja981203e.
[26] 王小梅. 超声对麦冬多糖结构、溶液行为及生物活性影响的研究[D].西安: 陕西师范大学, 2013: 5-6.
[27] 肖朱洋. 多糖的结构分析与构效关系[J]. 海峡药学, 2007, 19(3): 98-100.
[28] 莫开菊, 赵娜, 朱照武, 等. 葛仙米多糖的单糖组成分析[J]. 食品科学, 2015, 36(18): 89-92. DOI:10.7506/spkx1002-6630-201518016.
[29] 陈海霞. 高活性茶多糖的一级结构表征、空间构象及生物活性的研究[D]. 武汉: 华中农业大学, 2002: 103-107.
[30] LIANG Hao, ZENG Guanghong, LI Yinli, et al. Exploring the complex mechanical properties of xanthan scaffolds by AFM-based force spectroscopy[J]. Beilstein Joural of Nanotechnol, 2014, 5:365-373. DOI:10.3762/bjnano.5.42.
[31] 周盛华, 黄龙, 张洪斌. 黄原胶结构、性能及其应用的研究[J]. 食品科技, 2008, 33(7): 156-160. DOI:10.13684/j.cnki.spkj.2008.07.043.
[32] 莫开菊, 程超, 彭浩. 葛仙米多糖溶解性和流变特性的研究[J]. 中国酿造, 2009, 28(3): 39-42.
Conformational Analysis of Polysaccharide from Nostoc sphaeroides Kütz. Based on Atomic Force Microscope and Rheological Properties
MO Kaiju1,2, CHENG Chao1, ZHUANG Yang1, CHEN Meilin1, ZHAO Na1
(1. School of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China; 2. Hubei Key Laboratory of Biological Resource Conservation and Utilization, Hubei University for Nationalities, Enshi 445000, China)
Abstract:In this paper, the single-molecule morphology of polysaccharides extracted from Nostoc sphaeroides Kütz. was studied by atomic force microscopy. As a result, the polysaccharides were found to consist of flexible and rigid molecular chains and mainly exist in the form of flexible long chain with multi-branches, rigid chains with less or without branches and a divergent structure composed of three intertwined chains. Besides, a single helix for some of the branch chains was also found. The polysaccharides mainly existed in the conformation with abundant branches whose length was generally about 200-600 nm, the diameter of single molecules was within 1.0 nm, and the height of intertwined chains was about 1.3-2.3 nm.The rheological properties showed that the polysaccharides could form a weak gel, indicating that the polysaccharide molecules could be only slightly crosslinked. All rheological properties confirmed that the polysaccharides had multiple flexible branches.
Key words:atomic force microscopy; Nostoc sphaeroides Kütz.; polysaccharide; rheological properties; chain conformation
DOI:10.7506/spkx1002-6630-201721008
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)21-0049-06
引文格式:莫开菊, 程超, 庄洋, 等. 基于原子力显微镜和流变学特性的葛仙米多糖构象分析[J]. 食品科学, 2017, 38(21): 49-54.
DOI:10.7506/spkx1002-6630-201721008. http://www.spkx.net.cn
MO Kaiju, CHENG Chao, ZHUANG Yang, et al. Conformational analysis of polysaccharide from Nostoc sphaeroides Kütz. based on atomic force microscope and rheological properties[J]. Food Science, 2017, 38(21): 49-54. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721008. http://www.spkx.net.cn
收稿日期:2017-05-05
基金项目:国家自然科学基金面上项目(31171670)
作者简介:莫开菊(1965—),女,教授,博士,研究方向为食品加工及食品化学。E-mail:hbmymkj@163.com