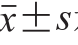 示,采用t检验进行显著性分析,P<0.05表示具有显著差异。
示,采用t检验进行显著性分析,P<0.05表示具有显著差异。张正雨,李傲婷,王凤林,李委昆,唐 越,于翠平,孙 娜,吴海涛*
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
摘 要:本实验对刺参体壁酶促溶性胶原蛋白(pepsin soluble collagen from Stichopus japonicus,sjPSC)和罗非鱼皮酶促溶性胶原蛋白(pepsin soluble collagen from Oreochromis niloticus,onPSC)的理化特性进行对比研究。结果表明,两种胶原蛋白的紫外与傅里叶变换红外光谱分析结果都较为相似。由十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图谱可知,两种胶原蛋白均以α-和β-链为主,在非还原和还原条件下,二者的电泳图谱非常相似,这表明蛋白中没有二硫键被还原。甘氨酸是sjPSC和onPSC中主要氨基酸,其中每1 000 个氨基酸残基中分别含有(344.57±2.16)、(353.00±4.84) 个甘氨酸残基。相比较而言,sjPSC中谷氨酸、天冬氨酸、丝氨酸、缬氨酸、异亮氨酸、酪氨酸含量较高,onPSC中L-羟脯氨酸、L-脯氨酸、亮氨酸、苯丙氨酸、组氨酸、赖氨酸含量较高。在V8酶和α-糜蛋白酶作用下,sjPSC和onPSC的肽谱分析表明二者的结构有一定区别,尤其是谷氨酸、天冬氨酸及羟脯氨酸残基。
关键词:酶溶性胶原蛋白;刺参;罗非鱼;氨基酸;结构
刺参作为重要的海珍品,兼具营养价值和保健功能。而刺参体壁是其主要可食部位,胶原蛋白含量尤为丰富[1]。近年来,鱼皮已成为工业生产中胶原蛋白的主要来源,常用于制作胶卷底片、香肠肠衣等,也常被用作食品添加剂[2]。罗非鱼是仅次于草鱼的养殖鱼类,鱼皮常被当作渔业加工生产中的副产物,是胶原蛋白的潜在来源,其胶原蛋白水解产物具有抗氧化、抗衰老的功效[3-4]。Matsumura[5]指出海参胶原蛋白与脊椎动物胶原蛋白相比,具有显著的难溶性,但对其理化性质和亚基组成研究较少。刺参体壁经尿素及十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液处理,SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析得到其溶出的蛋白质组分主要为非胶原蛋白质;而以相同的溶液提取罗非鱼皮蛋白质组分,经电泳分析可获得清晰的胶原蛋白条带[6]。因此,与罗非鱼皮胶原蛋白相比,刺参体壁中的胶原蛋白具有极端的不溶解性,对其胶原蛋白分子的特性进行系统研究十分必要,可为实际生产应用提供理论支撑。
目前,关于水产动物胶原蛋白的理化特性研究报道较多,其中郝淑贤等[7]研究了热水法、酸法及超声波辅助酶法提取对罗非鱼皮胶原蛋白理化特性的影响,3 种提取方法对羟脯氨酸和脯氨酸含量影响差异不显著,对变性温度影响差异也不显著,但热水提取可显著提高鱼皮胶原蛋白的凝胶强度,酸法提取可显著提高鱼皮胶原蛋白的特性黏度。Zhu Beiwei等[8]研究了刺参体壁酶促溶性胶原蛋白理化性质及其自由基清除能力,胃蛋白酶提取的胶原蛋白具有完整的三螺旋结构,并且具有很强的自由基清除能力。侯虎等[9]分析刺参体壁胶原纤维,并采用胃蛋白酶促溶法提取海参胶原蛋白,发现刺参体壁主要为红色的胶原纤维,呈网状排列,少见肌原纤维,提取的胶原蛋白符合水产胶原蛋白特征。虽然国内外对罗非鱼皮胶原蛋白及刺参体壁胶原蛋白的研究较多,但对它们分子特性的比较研究较少。因此,本实验通过紫外光谱、傅里叶变换红外光谱、SDS-PAGE、肽谱及氨基酸组成分析,从分子结构上对刺参体壁和鱼皮胶原蛋白进行全面的分析与比较,为开发利用刺参胶原制备生物材料和胶原肽提供理论依据。
1.1 材料与试剂
新鲜刺参(Stichopus japonicus)购于大连乾日海洋食品有限公司,放置于冰盒内运输1 h抵达实验室。罗非鱼购于大连百洋食代食品有限公司。
SDS、N,N,N’,N’-四甲基乙二胺、考马斯亮蓝R-250、牛血清白蛋白 上海生工生物工程有限公司;V8酶、赖氨酰基肽链内切酶、胰蛋白酶、α-糜蛋白酶 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
EMS-4B型磁力搅拌器 汕头市粤威事业有限公司;BS224S电子天平 赛多利斯科学仪器(北京)有限公司;Scientz-Ⅲ型数控层析冷柜 宁波新芝生物科技股份有限公司;UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;PHS-3C精密pH计 上海雷磁电子仪器厂;2KBTES-55型真空冷冻干燥机 美国Virtis公司;低温保存箱 海尔集团;超低温冰箱(-80 ℃)日本三洋公司;TS.B-108往复式脱色摇床 江苏海门市其林贝尔仪器制造有限公司;MF-ChemiBIS 2.0凝胶成像仪 以色列DNR成像系统有限公司;LAMBDA 35紫外-可见光谱仪、傅里叶变换红外光谱仪 美国珀金埃尔默公司;AE-6450垂直电泳仪 日本ATTO株式会社;CF 16XⅡ冷冻离心机 日本日立公司;HH- 4数显恒温水浴锅 江苏金坛荣华仪器制造有限公司;P1201高效液相色谱仪 大连依利特分析仪器有限公司。
1.3 方法
1.3.1 胶原蛋白的提取
1.3.1.1 刺参体壁酶促溶性胶原蛋白的提取
参照Zhu Beiwei等[8]的方法对刺参体壁酶促溶性胶原蛋白(pepsin soluble collagen from Stichopus japonicus,sjPSC)进行提取。以下操作除特殊注明外,均在4 ℃条件下进行。先将冷冻刺参体壁打碎,通过13 600×g离心水洗10 min,向所得沉淀中加入0.1 mol/L的Tris-HCl(pH 8.0,含5 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、0.5 mol/L NaCl)缓冲液搅拌过夜;再将13 680×g离心10 min后所得沉淀水洗2~3 次至中性,加去离子水搅拌提取72 h,经9 500×g离心5 min,得到的上层清液中含有粗胶原纤维;向下层沉淀中加入去离子水重复提取一次,并将两次提取的上清液合并;经0.1 mol/L NaOH洗涤72 h(溶液每12 h换一次)后再反复水洗至中性,经17 300×g离心30 min,取沉淀经冷冻干燥得到胶原粗纤维。将所得胶原纤维溶于500 倍体积(m/V)0.5 mol/L乙酸溶液中,并加入胃蛋白酶,搅拌72 h;17 300×g离心20 min,向上清液中加入NaCl静置过夜;经13 500 r/min离心5 min所得沉淀溶于少量0.5 mol/L乙酸中,分别采用0.02 mol/L Na2HPO4-NaH2PO4(pH 8.0)和0.1 mol/L乙酸透析液透析48 h(透析液每24 h换一次),最后将13 500 r/min离心20 min所得沉淀经冷冻干燥得到sjPSC。
1.3.1.2 鱼皮酶促溶性胶原蛋白的提取
参照Kittiphattanabawon等[10]的方法提取鱼皮酶促溶性胶原蛋白(pepsin soluble collagen from Oreochromis niloticus,onPSC)。新鲜罗非鱼皮用冷水清洗干净,于-80 ℃冷冻备用。以下所有提取操作除特殊注明外,均在4 ℃条件下进行。取预处理后的鱼皮加入0.1 mol/L NaOH搅拌24 h(溶液每8 h换一次),过滤所得沉淀用去离子水反复清洗至中性后,加入0.5mol/L乙酸溶液搅拌溶胀,搅拌24 h(溶液每12 h换一次),过滤所得沉淀加入4 倍体积(m/V)0.5 mol/L乙酸溶液,并加入胃蛋白酶搅拌48 h,过滤,向上清液中加入胃蛋白酶,过滤,向上清液中加入Tris至终浓度为0.05 mol/L、NaCl 2.5 mol/L(缓冲液体系pH值为3.7),搅拌20 min后静置过夜盐析。将过滤所得沉淀溶于少量0.5 mol/L乙酸中,采用0.1 mol/L乙酸透析72 h后,再采用蒸馏水透析,直到AgNO3检测无白色沉淀时为止,冻干即为onPSC。
1.3.2 SDS-PAGE分析
参考文献[11]的方法,将胶原蛋白溶于250 mmol/L Tris-HCl(pH 7.5、8 mol/L尿素、5% SDS、5% β-巯基乙醇)中,配制质量浓度为2 mg/mL,煮沸3 min。SDS-PAGE条件为:5%浓缩胶、8%分离胶,电泳时浓缩胶电流8 mA,分离胶电流15 mA,SDS-PAGE缓冲液采用SDS-Tris-甘氨酸体系。非还原条件下,上样缓冲液中不含强还原剂β-巯基乙醇。样品电泳完毕后,进行考马斯亮蓝R-250染色,脱色后采用凝胶成像仪进行成像。
1.3.3 紫外光谱分析
在室温条件下,将胶原蛋白样品溶于0.5 mol/L HAc溶液中配成1.0 mg/mL的胶原蛋白溶液,以0.5 mol/L HAc溶液作为空白对照,使用紫外-可见光谱仪测定其紫外吸光度,波长范围为200~800 nm。
1.3.4 傅里叶变换红外光谱分析
称取一定量样品,经过KBr压片,使用傅里叶变换红外光谱仪对样品进行扫描,范围为400~4 000 cm-1。扫描信号累加32 次,仪器分辨率为0.5 cm-1。
1.3.5 氨基酸组成分析
采用高效液相色谱进行氨基酸分析,准确称取25 mg样品于安瓿瓶当中,准确加入3 mL盐酸(6 mol/L)。利用酒精喷灯封口后,放入110 ℃烘箱中恒温水解24 h。将水解液在80 ℃条件下水浴蒸干,加衍生缓冲液定容,过滤取5 mL进行衍生化反应。加平衡缓冲液稀释至试剂瓶刻度,静置。取10 μL进样,利用氨基酸分析柱进行高效液相色谱分析。
1.3.6 肽谱分析
肽谱分析参照Saito[1]、Liu Wentao[12]等的方法进行修改。取胶原蛋白样品2 mg溶于1mL 0.1 mol/L磷酸盐缓冲液(pH 7.2,含0.5 g/100 mL SDS)。取100 μL溶液转移到1.5 mL离心管中备用,为启动反应,取10 μL含5 μg V8酶或0.1 mg赖氨酰基肽链内切酶的酶液(溶于0.1 mol/L磷酸盐缓冲液,pH 7.2),或10 μL含5 μg胰蛋白酶或α-糜蛋白酶的酶液(溶于1 mol/L HCl、20 mmol/L CaCl2溶液,pH3.0),混合液分别于37 ℃孵育5、25、60、120 min。添加5×电泳上样缓冲液(250 mmol/L Tris-HCl、8 mol/L尿素、5% SDS、体积分数5% β-巯基乙醇,pH 7.5),沸水浴3 min终止反应。采用SDS-PAGE分析所得到的样品。
1.4 数据统计分析
数据以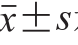 示,采用t检验进行显著性分析,P<0.05表示具有显著差异。
示,采用t检验进行显著性分析,P<0.05表示具有显著差异。
2.1 sjPSC和onPSC的SDS-PAGE对比分析

图1 非还原及还原条件下sjPSC和onPSC的电泳图谱分析
Fig. 1 SDS-PAGE patterns of sjPSC and onPSC under non-reducing and reducing conditions
HM.标准分子质量Marker(高);LM.标准分子质量Marker(低);图4同。泳道1~4.分别为非还原sjPSC、非还原onPSC、还原sjPSC、还原onPSC。
由图1可知,本研究所提取的sjPSC和onPSC纯度较高,不含杂蛋白,主要含有β-链及α-链及少量γ-链,onPSC中各组分在SDS-PAGE中的迁移速率均大于sjPSC。在还原条件下,β-巯基乙醇会还原蛋白分子中的二硫键,从图谱中可以看出,在非还原及还原条件下的两种胶原蛋白条带非常相似,并没有二硫键遭到破坏,这表明了两种胶原蛋白中不含二硫键,从而说明其氨基酸组成中不含与二硫键密切相关的半胱氨酸[13-16]。本研究结果与前期报道的其他鱼皮胶原蛋白特性相一致,如大眼鲷[17]、红鲷鱼[18]、斑点叉尾鮰[19]、多须石首鱼和羊头鲷[20],都具有胶原蛋白的典型特征。
2.2 sjPSC和onPSC的紫外光谱对比分析
一般具有共轭双键的物质都具有紫外吸收功能,因此蛋白分子在溶液中能够吸收一定波长范围的紫外光,产生紫外吸收光谱[21]。由图2可知,sjPSC和onPSC具有相似的紫外吸收谱,其特征吸收波长均位于233 nm左右,这是胶原蛋白三螺旋结构的特征吸收峰,主要是由肽键—C=O的n→π*跃迁所贡献,符合酶促溶性胶原蛋白的特征吸收,与其他鱼类胶原蛋白的研究结果一致[21-22]。色氨酸在280 nm波长处的紫外吸收最强,所以大多数蛋白质在280 nm波长处都有很强的紫外吸收,但所提胶原蛋白中几乎不含色氨酸,所以在280 nm波长处没有强吸收峰的出现,这可以表明所提取的胶原蛋白具有较高的纯度[23]。
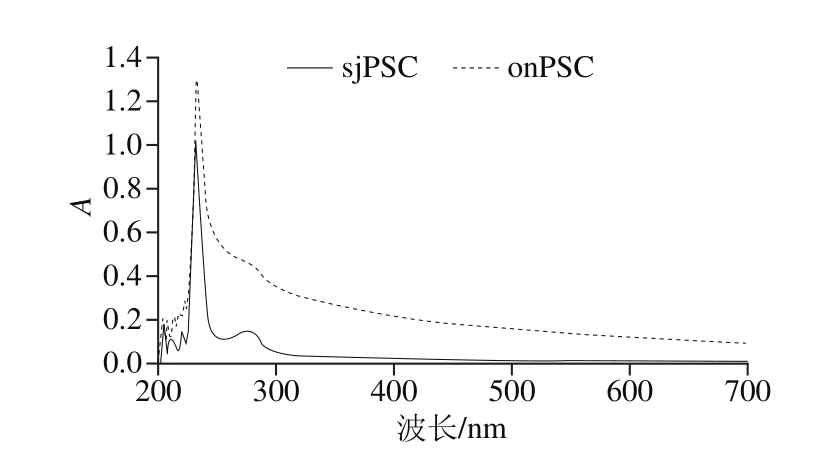
图2 sjPSC和onPSC的紫外光谱
Fig. 2 Ultraviolet spectra of sjPSC and onPSC
2.3 sjPSC和onPSC的傅里叶变换红外光谱分析
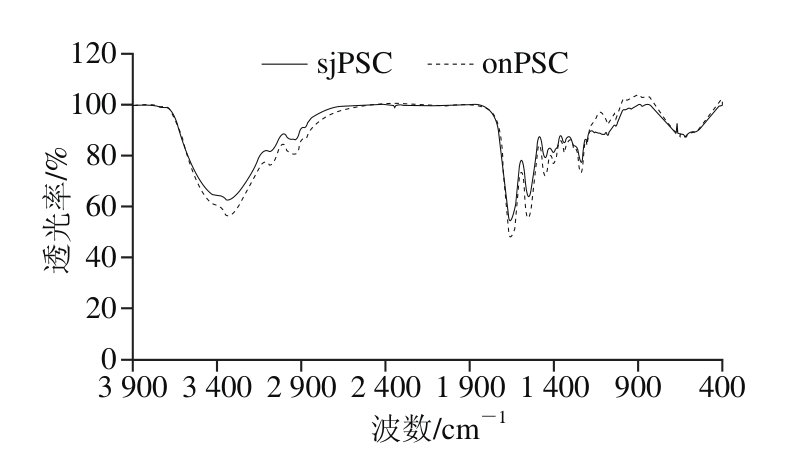
图3 sjPSC和onPSC的傅里叶变换红外光谱分析
Fig. 3 FT-IR spectra of sjPSC and onPSC
由图3可知,sjPSC和onPSC的傅里叶变换红外谱图极为相似,均具有PSC的特征吸收峰,包括酰胺A带、酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带。其中,酰胺A带与PSC的N—H伸缩振动有关,酰胺A带的吸收峰在3 400~3 440 cm-1处,而当含N—H基团的肽段参与氢键形成时,N—H基团的伸缩振动产生的吸收峰会降低100 cm-1左右,由图3可知,两种胶原蛋白均在3 330 cm-1左右有吸收峰出现,说明两种胶原蛋白分子均有氢键存在[17]。在蛋白质分子中,氨基酸之间含有大量肽键,由于羰基键的伸缩振动,会出现酰胺Ⅰ带(1 600~1 700 cm-1)吸收峰,常被用来鉴定和分析蛋白质的二级结构[8]。如图3所示,两种胶原蛋白均在1 660 cm-1附近出现的吸收峰,与酰胺Ⅰ带的出峰位置一致,证明胶原蛋白分子处于交联状态。在已知的胶原蛋白分子中,胶原蛋白酰胺Ⅱ带的吸收峰通常位于1 500~1 600 cm-1范围内,两种胶原蛋白均在1 550 cm-1附近出现吸收峰,这说明该吸收区为酰胺Ⅱ带,同酰胺Ⅰ带一样,酰胺Ⅱ带也是由α-螺旋、β-折叠、β-转角和无规卷曲叠加共同作用所产生的[24]。酰胺Ⅲ带的吸收峰通常位于1 200~1 300 cm-1,两种胶原蛋白在酰胺Ⅲ带均出现吸收峰,这表明sjPSC和onPSC均保持完整的三螺旋结构[25]。
2.4 sjPSC和onPSC的氨基酸组成对比分析
表1 sjPSC和onPSC的氨基酸组成及含量
Table 1 Amino acid compositions of sjPSC and onPSC

注:氨基酸含量为氨基酸残基数占1 000 个氨基酸残基的比例;同行肩标字母不同表示差异显著(P<0.05)。
由表1可知,胶原蛋白的特征氨基酸Gly含量在sjPSC和onPSC均最多,分别为(344.57±2.16)‰、(353.00±4.84)‰,大约占总氨基酸含量的1/3。sjPSC和onPSC的Arg((49.65±3.46)‰、(53.05±0.69)‰)、Thr((30.99±4.72)‰、(25.07±0.38)‰)、Ala((93.33±8.88)‰、(111.18±15.91)‰)含量以及少量的Met((6.46±1.10)‰、(7.02±3.59)‰)含量较为相近(P>0.05)。相比较而言,sjPSC中Glu、Asp、Ser、Val、Ile以及Tyr含量较高,而onPSC中Hyp、Pro、Leu、Phe、His及Lys含量较高。其中sjPSC中的酸性氨基酸Glu、Asp含量较多,而碱性氨基酸His、Lys及Arg含量较少,这与文献[7-8]中报道sjPSC的等电点为4.14,onPSC的等电点为6.8相符。sjPSC中Hyp及Pro的总含量为167‰,这与Saito[1]及Cui Fengxia[26]等的报道相似。onPSC中Hyp及Pro的总含量高于sjPSC,为198‰,这与大部分鱼类胶原蛋白相似[27]。有相关报道指出,onPSC的热变性温度为31 ℃,而sjPSC的热变性温度为22.3 ℃[7,9],这可能与两种胶原蛋白的Hyp及Pro的总含量有关。
2.5 sjPSC和onPSC的肽谱对比分析
由图4A可知,在V8酶作用下,sjPSC和onPSC随着酶解时间的延长呈现逐渐降解的趋势。V8酶作用于sjPSC达到5 min时,γ-和β-链消失,α-链逐渐降解成了小分子片段,分子质量依次为90.5、76.3、47.9 kD。V8酶作用于onPSC达到25 min时,β-和α-链仅有部分降解为小分子片段,分子质量依次为97.7、68.1、66.4、59.1、46.1、42.8、39.9 kD。这与Mizuta等[28]的报道相一致,不同来源和种属的胶原蛋白,其肽指纹图谱是不同的。由此推断,与onPSC相比,sjPSC对V8酶更为敏感,这与其含有更多的谷氨酸和天冬氨酸有关,V8酶为丝氨酸蛋白酶,其催化作用位点恰为含有谷氨酸和天冬氨酸的残基[29]。
由图4B、C可知,在赖氨酰基肽链内切酶及胰蛋白酶作用下,随着酶解时间的延长,sjPSC和onPSC都有一定程度的降解。当赖氨酰基肽链内切酶及胰蛋白酶作用时间分别达到60、5 min时,β-链消失,α-链降解成了分子质量小于116 kD的小分子片段。在胰蛋白酶的作用下,onPSC比sjPSC出现了更多的小分子片段,这表明onPSC对胰蛋白酶更为敏感。胰蛋白酶主要水解C末端含有赖氨酸和精氨酸的氨基酸残基[26],这也说明onPSC中含有更多的赖氨酸和精氨酸。
由图4D可见,当α-糜蛋白酶作用于sjPSC和onPSC达到5 min时,γ-和β-链消失,α-链降解成了小分子片段,在sjPSC中分子质量依次为116.7、98.0、69.8 kD,在onPSC中分子质量依次为113.0、106.8、94.7、77.2、69.7、63.8、57.8、47.6、36.6 kD。onPSC中有更多的小分子片段,表明onPSC对α-糜蛋白酶更为敏感,这与其含有较多的疏水性氨基酸残基有关,因为α-糜蛋白酶特异水解C端含有疏水性氨基酸的残基,如苯丙氨酸、酪氨酸、色氨酸和亮氨酸残基[30],所以α-糜蛋白酶可以用于sjPSC和onPSC的鉴别。


图4 sjPSC和onPSC肽谱分析
Fig. 4 Peptide maps of sjPSC and onPSC
A. V8酶;B.赖氨酰基肽链内切酶;C.胰蛋白酶;D. α-糜蛋白酶。a. sjPSC;b. onPSC;1~5.酶解时间分别为0、5、25、60、120 min。
对sjPSC和onPSC进行对比研究表明,二者具有相似的紫外、傅里叶变换红外光谱,SDS-PAGE显示二者均以α-链和β-链为主要成分且不含二硫键,氨基酸分析结果也表明二者均具有胶原蛋白的典型特征。对刺参体壁及鱼皮酶促溶性胶原蛋白的肽谱分析表明,采用V8酶和α-糜蛋白酶进行酶解,二者呈现完全不同的图谱,可以有效区分二者,尤其是谷氨酸、精氨酸和羟脯氨酸残基的含量不同。
参考文献:
[1] SAITO M, KUNISAKI N, URANO N, et al. Collagen as the major edible component of sea cucumber (Stichopus japonicus)[J]. Journal of Food Science, 2002, 67(4): 1319-1322. DOI:10.1111/j.1365-2621.2002.tb10281.x.
[2] ZHANG Junjie, DUAN Rui, TIAN Yuanyong, et al. Characterisation of acid-soluble collagen from skin of silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2009, 116(1): 318-322. DOI:10.1016/j.foodchem.2009.02.053.
[3] ZENG Shaokui, ZHANG Chaohua, LIN Hong, et al. Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia (Oreochromis niloticus)[J]. Food Chemistry, 2009, 116(4):879-883. DOI:10.1016/j.foodchem.2009.03.047.
[4] 周先艳, 樊建, 唐远龙, 等. 罗非鱼皮胶原蛋白水解产物的体外抗氧化活性和体内抗衰老作用[J]. 食品科学, 2016, 37(15): 221-226.DOI:10.7506/spkx1002-6630-201615037.
[5] MATSUMURA T. Collagen fibrils of the sea cucumber, Sticliopus japonicus: purification and morphological study[J]. Connective Tissue Research, 1974, 2(2): 117-125. DOI:10.3109/03008207409152097.
[6] WU Haitao, LI Dongmei, ZHU Beiwei, et al. Proteolysis of noncollagenous proteins in sea cucumber, Stichopus japonicus,body wall: characterisation and the effects of cysteine protease inhibitors[J]. Food Chemistry, 2013, 141(2): 1287-1294. DOI:10.1016/j.foodchem.2013.03.088.
[7] 郝淑贤, 林婉玲, 李来好, 等. 不同提取方法对罗非鱼皮胶原蛋白理化特性的影响[J]. 食品科学, 2014, 35(15): 59-62. DOI:10.7506/spkx1002-6630-201415012.
[8] ZHU Beiwei, DONG Xiuping, ZHOU Dayong, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicus[J].Food Hydrocolloids, 2012, 28(1): 182-188. DOI:10.1016/j.foodhyd.2011.12.010.
[9] 侯虎, 孙江, 毛家楠, 等. 海参胶原纤维形态及胶原蛋白理化性质研究[J]. 现代食品科技, 2013, 29(7): 1491-1495.
[10] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W,et al. Isolation and characterisation of collagen from the skin of brownbanded bamboo shark (Chiloscyllium punctatum)[J].Food Chemistry, 2010, 119(4): 1519-1526. DOI:10.1016/j.foodchem.2009.09.037.
[11] 吴海霞, 曹雨舟. 丝瓜多酚氧化酶的分离纯化及酶学性质[J]. 食品科学, 2014, 35(7): 187-191. DOI:10.7506/spkx1002-6630-201407037.
[12] LIU Wentao, LI Guoying, MIAO Yuqing, et al. Preparation and characterization of pepsin-solubilized typeⅠcollagen from the scales of snakehead (Ophiocephalus argus)[J]. Journal of Food Biochemistry,2009, 33(1): 20-37. DOI:10.1111/j.1745-4514.2008.00207.x.
[13] 董方霆, 邱丰和, 廖杰, 等. 用电喷雾质谱法监测重组人肿瘤坏死因子中二硫键的还原过程[J]. 分析测试学报, 1999, 18(3): 56-59.DOI:10.3969/j.issn.1004-4957.1999.03.017.
[14] 陶毅明, 金荣仲, 朱华, 等. 菠萝蜜过氧化物酶活性部位的研究[J].食品科学, 2016, 37(11): 103-107. DOI:10.7506/spkx1002-6630-201611018.
[15] 王慧, 张英起, 颜真. 碘乙酰胺在SDS-聚丙烯酰胺凝胶电泳中的应用[J]. 药物生物技术, 2003(6): 384-387.
[16] 赵听友, 曹瑛, 代先东, 等. 新型桶形芋螺毒素BtⅢB的分离纯化、氨基酸序列测定及二硫键定位研究[J]. 化学学报, 2005(2): 96; 163-168.
[17] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper(Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601.DOI:10.1016/j.foodchem.2006.12.035.
[18] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W,et al. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of brownstripe red snapper (Lutjanus vitta)[J]. Food Chemistry, 2005, 93(3): 475-484. DOI:10.1016/j.foodchem.2004.10.026.
[19] LIU Haiying, LI Ding, GUO Shidong. Studies on collagen from the skin of channel catfish (Ictalurus punctaus)[J]. Food Chemistry, 2007,101(2): 621-625. DOI:10.1016/j.foodchem.2006.01.059.
[20] OGAWA M, MOODY M W, PORTIER R J, et al. Biochemical properties of black drum and sheepshead seabream skin collagen[J].Journal of Agricultural and Food Chemistry, 2003, 51(27): 8088-8092.DOI:10.1021/jf034350r.
[21] 温慧芳, 陈丽丽, 白春清, 等. 基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J]. 食品科学, 2016, 37(1): 74-81.DOI:10.7506/spkx1002-6630-201601014.
[22] NALINANON S, BENJAKUL S, KISHIMURA H, et al.TypeⅠcollagen from the skin of ornate threadfin bream (Nemipterus hexodon): characteristics and effect of pepsin hydrolysis[J].Food Chemistry, 2011, 125(2): 500-507. DOI:10.1016/j.foodchem.2010.09.040.
[23] 杨玲, 赵燕, 鲁亮, 等. 鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J]. 食品科学, 2014, 34(23): 41-46. DOI:10.7506/spkx1002-6630-201323010.
[24] AHMAD M, BENJAKUL S. Extraction and characterization of pepsin-solubilised collagen from the skin of unicorn leatherjacket(Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824.DOI:10.1016/j.foodchem.2009.11.019.
[25] LIU Dasong, LIANG Li, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales,skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448. DOI:10.1016/j.foodchem.2012.02.032.
[26] CUI Fengxia, XUE Changhu, LI Zhaojie, et al. Characterization and subunit composition of collagen from the body wall of sea cucumber(Stichopus japonicus)[J]. Food Chemistry, 2007, 100(3): 1120-1125.DOI:10.1016/j.foodchem.2005.11.019.
[27] ZHANG Yan, LIU Wentao, LI Guoying, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(3): 906-912.DOI:10.1016/j.foodchem.2006.09.053.
[28] MIZUTA S, YAMASA Y, MIYAGI T, et al. Histological changes in collagen related to textural development of prawn meat during heat processing[J]. Journal of Food Science, 1999, 64(6): 991-995.DOI:10.1111/j.1365-2621.1999.tb12266.x.
[29] VERCAIGNE-MARKO D, KOSCIARZ E, NEDJAR-ARROUME N,et al. Improvement of Staphylococcus aureus-V8-protease hydrolysis of bovine haemoglobin by its adsorption on to a solid phase in the presence of SDS: peptide mapping and obtention of two haemopoietic peptides[J]. Biotechnology and Applied Biochemistry, 2000, 31(2):127-134. DOI:10.1042/BA19990114.
[30] KENNEDY J F, TURAN N. Seafood enzymes: utilization and influence on postharvest seafood quality[J]. Carbohydrate Polymers,2001, 44(3): 273. DOI:10.1016/S0144-8617(00)00228-9.
Comparative Studies on Characteristics of Pepsin-Soluble Collagen from Sea Cucumber (Stichopus japonicas)Body Wall and Tilapia (Oreochromis niloticus) Skin
ZHANG Zhengyu, LI Aoting, WANG Fenglin, LI Weikun, TANG Yue, YU Cuiping, SUN Na, WU Haitao*
(National Engineering Research Center of Seafood, School of Food Science and Technology,Dalian Polytechnic University, Dalian 116034, China)
Abstract:In this paper, the characteristics of pepsin-soluble collagen from the body wall of Stichopus japonicus (sjPSC)and the skin of Oreochromis niloticus (onPSC) were comparatively studied. The results showed that ultraviolet and Fourier transform-infrared spectroscopic measurements of onPSC and sjPSC were quite similar. Both PSCs contained mainly α- and β-chains as indicated by sodium dodecyl sulfate-polyacrylamide gel electrophoresis. The electrophoretic patterns of these two collagens under non-reducing and reducing conditions were quite similar, suggesting that reduction of disulfide bonds did not occur in these two collagens. Glycine was the dominant amino acid in both sjPSC and onPSC, accounting for approximately (344.57 ± 2.16)‰ and (353.00 ± 4.84)‰ of the total amino acid residues, respectively. More glutamic acid, aspartic acid, serine, valine, isoleucine and tyrosine were observed in sjPSC when compared with onPSC (P 〈 0.05).However, more L-hydroxy proline, L-proline, leucine, phenylalanine, histidine and lysine were observed in onPSC (P 〈 0.05).Peptide maps of both PSCs digested by V8 and α-chymotrypsin were completely different, suggesting some differences in their structure, especially in terms of glutamic acid, aspartic acid and hydroxyproline residues.
Key words:pepsin-soluble collagen; Stichopus japonicus; Oreochromis niloticus; amino acid; structure
DOI:10.7506/spkx1002-6630-201721009
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)21-0055-06
引文格式:张正雨, 李傲婷, 王凤林, 等. 刺参体壁及罗非鱼皮酶促溶性胶原蛋白特性的对比研究[J]. 食品科学, 2017, 38(21):55-60.
DOI:10.7506/spkx1002-6630-201721009. http://www.spkx.net.cn
ZHANG Zhengyu, LI Aoting, WANG Fenglin, et al. Comparative studies on characteristics of pepsin-soluble collagen from sea cucumber (Stichopus japonicas) body wall and tilapia (Oreochromis niloticus) skin[J]. Food Science, 2017, 38(21):55-60. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721009. http://www.spkx.net.cn
收稿日期:2016-07-15
基金项目:国家自然科学基金面上项目(31370037);辽宁省教育厅科学研究一般项目(L2015050)
作者简介:张正雨(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:540773720@qq.com
*通信作者:吴海涛(1980—),女,副教授,博士,研究方向为食品生物技术。E-mail:wht205@163.com