韩苗苗1,姚 娟1,易 阳1,*,黄 菲2,王丽梅3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东 广州 510610;3.武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
摘 要:探析龙眼果肉热风干燥过程中多糖的理化特性和生物活性变化规律。分离不同干燥阶段果肉中的多糖,通过对基本组成、傅里叶变换红外光谱图特征和相对分子质量分布的分析,比较其理化特征差异,结合体外抗氧化、抗肿瘤和免疫刺激效果评价比较其生物活性。随着干燥的进行,多糖中中性糖与蛋白质的质量分数比、葡萄糖和甘露糖物质的量比、游离氨基含量均呈逐渐降低的趋势,傅里叶变换红外光谱图的酰胺区特征吸收峰明显改变,高效分子排阻色谱的新高分子组分在干燥后期生成。而体外抗氧化活性评价发现,果肉干燥12~60 h,其多糖对1,1-二苯基-2-三硝基苯肼自由基清除能力、对羟自由基清除能力、总抗氧化能力得到明显增强(P<0.05);干燥12~24 h,对SGC7901和HepG2肿瘤细胞的生长抑制能力、刺激巨噬细胞一氧化氮和肿瘤坏死因子α生成的综合能力得到明显增强(P<0.05),但干燥60 h后有所减弱。不同干燥阶段多糖的生物活性差异可能与美拉德反应关联的多糖-蛋白质相互作用有关,结果可为龙眼干肉的高品质加工提供参考。
关键词:龙眼果肉;多糖;理化特性;生物活性;美拉德反应
龙眼(Dimocarpus longan Lour.)属于药食两用水果,营养及风味俱佳,而且具有补益心脾和养血安神的功能[1]。龙眼鲜果上市时间较为集中,贮运过程中代谢旺盛,极易褐变腐烂,产业发展高度依赖干制加工,仅肉干加工量已占其总产量的15.50%[2]。故而,龙眼果肉干制加工技术研究,尤其是产品的品质影响与调控引起广泛关注[3-7]。龙眼干制产品的品质控制大体涉及2 个方面,其一为传统的感官变化和营养成分损失[3-4,6],其二为特异的主要活性成分变化[7-8]。而在“药食同源”这一资源特色背景下,后者相关研究更具意义,但却更为薄弱。
多糖是龙眼果肉中的主要活性大分子,具有良好的体内外抗氧化、抗肿瘤和免疫调节活性,其理化表征、活性评价与作用机制研究均取得一定进展[9-12]。然而,龙眼果肉干制过程中的多糖变化规律研究尚鲜见报道。课题组前期比较龙眼鲜肉多糖(flesh longan pulp polysaccharide,LPF)和干肉多糖(dried longan pulp polysaccharide,LPD)的理化特征及免疫调节活性发现[13-14]:LPD中结合蛋白含量较高且结合作用力较强,采用450 W超声处理15 min难以破坏;LPF的平均相对分子质量较LPD低,其结合蛋白经150 W超声处理15 min便解离;在50~400 µg/mL剂量范围内,LPD的脾淋巴细胞和巨噬细胞刺激活性明显强于LPF,而两者结合蛋白解离均伴随刺激活性的减弱。由此说明,干制可能导致龙眼果肉中多糖组成与结构的变化,并进一步影响其生物活性。为此,本实验研究龙眼果肉热风干制过程中多糖的理化特征及活性变化规律,旨为龙眼干肉制品功能品质的研究提供科学依据。
1.1 材料与试剂
新鲜龙眼 市售。
人胃癌细胞SGC7901、人肝癌细胞HepG2、小鼠腹腔巨噬细胞RAW264.7 湖北百奥斯生物科技有限公司;磷酸盐缓冲液(phosphate buffer solution,PBS)、改良杜氏伊格尔培养基(Dulbecco’s modified Eagle medium,DMEM) 美国Hyclone公司;胰酶 杭州吉诺生物医药技术有限公司;胎牛血清 杭州四季青生物工程材料有限公司;细胞活力检测试剂盒(cell counting kit-8,CCK-8) 南京恩晶生物科技有限公司;脂多糖(lipopolysaccharide,LPS) 北京博奥拓达科技有限公司;小鼠肿瘤坏死因子α(tumor necrosis factoralpha,TNF-α)酶联免疫吸附测定试剂盒 武汉基因美科技有限公司;邻苯二甲醛(O-phthalaldehyde,OPA) 上海阿拉丁生化科技股份有限公司;L-赖氨酸 上海如吉生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrythydrazyl,DPPH)、2,4,6-三吡啶基三嗪 东京化成工业株式会社;色谱纯单糖标准品(D-甘露糖、D(+)-无水葡萄糖、D-果糖、D-阿拉伯糖、D-半乳糖、D-半乳糖醛酸、D-(+)-木糖、D-核糖、D-葡萄糖醛酸和鼠李糖) 上海源叶生物科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
SUNRISE酶标定量测定仪 西化仪(北京)科技有限公司;NEXUS-670 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国尼高力仪器公司;高效液相色谱系统(包括示差折光(differential refractive index,RI)检测器2414、二极管矩阵(photodiode array,PDA)检测器2998和二元泵1525),分子排阻色谱柱Ultrahydrogel 250(7.8 mm×300 mm)美国Warters公司;Extend-C18色谱柱(4.6 nm×250 mm,5 μm) 美国Agilent公司。
1.3 方法
1.3.1 LP的提取
参考文献[8]的方法,采用60 ℃热风干燥龙眼果实,干燥过程中间隔12 h或24 h取样。取龙眼果肉约100 g(干质量),加入1 L蒸馏水,12 000 r/min匀浆5 min。匀浆置于80 ℃的水浴锅中搅拌浸提3 h后,4 500 r/min离心10 min后过滤分离上清液。上清液经真空浓缩至原体积的1/4后加入3 倍体积无水乙醇,于4 ℃条件下静置12 h,4 500 r/min离心10 min,去除上清液,沉淀即为多糖。沉淀以体积分数75%的乙醇洗涤3 次,加少量蒸馏水复溶后冷冻干燥,得到LP。将龙眼果肉干燥0、12、24、36、60、84h后分离制备所得粗多糖,分别命名为LP-0、LP-12、LP-24、LP-36、LP-60、LP-84。
1.3.2 基本成分分析
中性多糖含量采用苯酚-硫酸法测定[15],以葡萄糖当量计算;蛋白质含量采用考马斯亮蓝试剂盒测定;糖醛酸含量采用间羟基联苯法测定[16],以葡萄糖醛酸当量计算。
游离氨基含量测定参照Nielsen等[17]的方法,采用OPA试剂测定:4 mL OPA试剂和200 μL多糖溶液(5 mg/mL)在35 ℃的水浴中反应2 min后,立即测定340 nm波长处的吸光度。以系列浓度的L-赖氨酸标准溶液建立标准曲线方程,计算多糖中的游离氨基含量。
单糖组成参照莫开菊等[18]的方法测定,采用反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法。
1.3.3 FTIR分析
取1 mg多糖和100 mg干燥的KBr粉末置于玛瑙研钵中研磨均匀,压片后在400~4 000 cm-1波数范围进行FTIR检测[19]。
1.3.4 相对分子质量分布分析
采用高效分子排阻色谱(high perfomance size exclusion chromatography,HPSEC)检测LP的相对分子质量分布。色谱分析条件为:PDA检测器(280 nm)和RI检测器串联使用;色谱柱Ultrahydrogel 250(7.8 mm×300 mm),柱温45 ℃;流动相0.1 mol/L硝酸钠;洗脱流速0.5 mL/min;进样体积15 μL。采用0.1 mol/L硝酸钠配制2.5 mg/mL的LP样液,经0.45 μm滤膜过滤后进样分析。采用低相对分子质量凝胶过滤校准试剂盒测定不同相对分子质量标准品对应的保留时间建立lg Mr-t曲线方程。
1.3.5 体外抗氧化活性评价
LP的DPPH自由基清除能力参照Wu Hao等[20]的方法测定,以对DPPH自由基清除率为50%时的样品质量浓度(半抑制浓度(half maximal inhibitory concentration,IC50)/(mg/mL))表征其清除能力。
LP的羟自由基清除能力参照Smirnoff等[21]的方法测定,以羟自由基清除率为25%时的样品质量浓度(IC25/(mg/mL))表征其清除能力。
LP的总抗氧化能力采用铁离子还原能力(ferric reducing antioxidant power,FRAP)表征[22],以每克样品还原Fe3+物质的量表示。
1.3.6 体外抗肿瘤活性评价
采用CCK-8方法检测LP的肿瘤细胞抑制率。取对数生长期的SGC7901细胞或HepG2细胞,用DMEM培养基(含10%体积分数的胎牛血清)调整细胞密度为4×104个/mL,以100 μL/孔加入96 孔板中,于37 ℃、5% CO2的培养箱中贴壁培养24 h后,加入100 μL由培养基溶液配制的LP溶液,LP终质量浓度为200、400、800 μg/mL,各质量浓度均设5 个复孔作为实验组。以培养基代替样品溶液作为对照组。另设5 个孔只加入200 μL培养基作为空白组。培养板孵育24 h后,弃去培养液,用37 ℃预温PBS洗涤2 次以除去未贴壁细胞。各孔加入200 μL培养基和10 μL CCK-8试剂,继续孵育3 h后,用酶标仪在450 nm波长处测定OD值。根据下式计算肿瘤细胞抑制率。
式中:OD实验组为实验组在450 nm波长处OD值;OD对照组为对照组在450 nm波长处的OD值;OD空白组为空白组在450 nm波长处的OD值。
1.3.7 体外巨噬细胞刺激活性评价
LP的体外免疫刺激活性结合巨噬细胞一氧化氮(nitric oxide,NO)生成量和TNF-α表达量评价。RAW264.7细胞经DMEM培养基(含10%体积分数的胎牛血清)调整细胞密度为5×105个/mL,以400 μL/孔加入24 孔培养板中,于37 ℃、5% CO2的培养箱中贴壁培养3 h后,吸除培养液。每孔加入由培养基溶液配制的LP溶液400 μL,LP终质量浓度为100、200、400 μg/mL,LPS终质量浓度为5 μg/mL。每个质量浓度设4 个复孔。另设4 个孔各加入400 μL培养基作为空白对照。培养板于培养箱中孵育48 h后,吸取细胞上清液于1.5 mL离心管中,加入300 g/L的ZnSO4溶液沉淀蛋白,经12 000 r/min离心4 min后,取100 μL上清液于96 孔培养板中,并加入100 μL的格里斯氏试剂,室温条件下轻轻摇振10 min后,用酶标仪在492 nm波长处测定OD值,每个实验孔重复测定3 次。以NaNO2建立标准曲线计算巨噬细胞NO生成量。采用相同流程刺激培养巨噬细胞48 h,取上清液于12 000 r/min离心4 min后,采用试剂盒测定TNF-α表达水平,每孔重复测定3 次。
1.4 数据处理
实验数据采用SPSS 19.0软件统计分析,组间数据在0.05水平上的显著性差异采用S-N-K检验,组间数据相关性采用Pearson双侧检验。
2.1 不同干燥阶段LP的基本组成
不同干燥阶段LP的基本组成如表1所示,LP中中性糖质量分数随干燥时间的延长逐渐降低,但干燥60 h后,变化显著(P<0.05);干燥12 h后,LP中糖醛酸质量分数显著增加(P<0.05),但随干燥时间进一步延长,未发生显著变化(P>0.05);干燥的前24 h,LP中蛋白质质量分数未发生显著变化(P>0.05),但随后显著增加(P<0.05);LP中游离氨基含量在热风干燥24 h后显著降低(P<0.05),至84 h有所回升;折算LP中蛋白质组分的游离氨基含量,发现其含量在干燥36 h明显减少。
表1 不同干燥阶段龙眼果肉中多糖的基本组成
Table 1 Proximate composition of polysaccharides from longan pulp at different drying stages

注:同列小写字母不同表示差异显著(P<0.05)。下同。
干热和湿热体系中的多糖-蛋白质相互作用一直备受关注,该大分子间相互作用由蛋白质游离氨基与多糖羰基的美拉德共价结合引发,并产生Amadori重排、分子裂解、脱水、Strecker降解、氧化、环化等一系列后续反应[23]。而这一反应亦有可能发生在龙眼果肉干燥过程中,因为LP中蛋白质质量分数逐渐增大,且蛋白质中游离氨基含量逐渐减少,糖醛酸质量分数增加的原因不明,而低聚木糖与甘氨酸的美拉德反应亦发生糖醛酸含量的增加,同时伴随还原糖含量的降低[24]。

图1 不同干燥阶段龙眼果肉中多糖的单糖组成RP-HPLC分析图谱
Fig. 1RP-HPLC chromatograms of polysaccharides from longan pulp at different drying stages
10 种单糖混合标准品的RP-HPLC色谱图如图1所示,出峰顺序依次为D-甘露糖(10.073 min)、D-核糖(11.695 min)、鼠李糖(14.536 min)、D-葡萄糖醛酸(15.361 min)、D-半乳糖醛酸(16.414 min)、D-果糖(19.395 min)、D(+)-无水葡萄糖(24.549 min)、D-半乳糖(28.082 min)、木糖(29.665 min)、D-阿拉伯糖(29.895 min)。通过与标准品比对,确定LP主要由D-甘露糖和D(+)-无水葡萄糖组成。
由表2可知,不同干燥阶段LP的单糖组成存在差异,特别地,D(+)-无水葡萄糖与D-甘露糖的物质的量比值随干燥时间的延长而逐渐降低,可能与多糖-蛋白质美拉德反应产物的裂解和Strecker降解有关。
表2 不同干燥阶段龙眼果肉中多糖的单糖组成
Table 2 Monosaccharide composition of polysaccharides from longan pulp at different drying stages
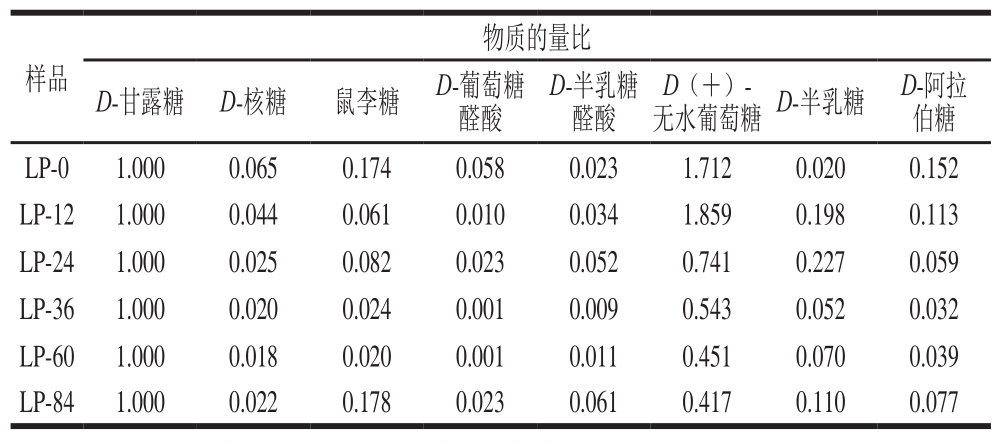
注:以D-甘露糖的物质的量计算各单糖的物质的量比。
2.2 不同干燥阶段LP的FTIR分析

图2 不同干燥阶段龙眼果肉中多糖的FTIR特征图
Fig. 2 FTIR of polysaccharides from longan pulp at different drying stages
由图2可知,不同干燥阶段LP的FTIR均呈现多糖和蛋白质的特征吸收。3 420 cm-1附近的吸收峰是由糖类分子间或分子内的O—H键伸缩振动产生,2 924 cm-1附近的吸收峰为烷基的C—H键伸缩振动产生,这两组峰均属于多糖的特征吸收峰[25]。另有3 组蛋白质的特征吸收谱带,分别为1 700~1 600 cm-1酰胺Ⅰ区(C=O伸缩振动)、1 480~1 575 cm-1酰胺Ⅱ区(N—H弯曲振动和C—N伸缩振动)和1 260~1 330 cm-1酰胺Ⅲ区(O—H弯曲振动)[26]。1 180~953 cm-1范围内的吸收谱带被称为“糖带”,是由C—C和C—O的伸缩振动以及C—H的弯曲振动引起的,蛋白质在此谱带的吸收较弱[27]。随着热风干燥时间的延长,LP在1 150 cm-1范围的吸收减弱可能与多糖和蛋白质的结合有关。
2.3 不同干燥阶段LP的相对分子质量分布
采用双检测器串联的HPSEC检测LP的相对分子质量分布,其中示差折光信号反映以多糖为主的整体相对分子质量分布情况(图3A),280 nm紫外吸收信号反映含蛋白组分的相对分子质量分布情况(图3B)。不同干燥阶段LP在保留时间18.18 min和18.52 min处出现两个主要的HPSEC-RI色谱峰,对应相对分子质量分别为4.50×103和4.37×103。此外,LP-84和LP-60均在10.89 min和12.55 min出现2 个弱峰,对应相对分子质量分别为9.18×104和2.48×104。HPSEC-PDA色谱图中,保留时间13.88 min附近的主要色谱峰应属游离蛋白质,而LP-60和LP-84在10.26、12.74 min时的新生色谱峰应属于结合蛋白(与HPSEC-RI图谱吻合)。由此可知,干燥60 h后,龙眼果肉中大分子组分发生相互作用,生成相对分子质量更高的复合物。
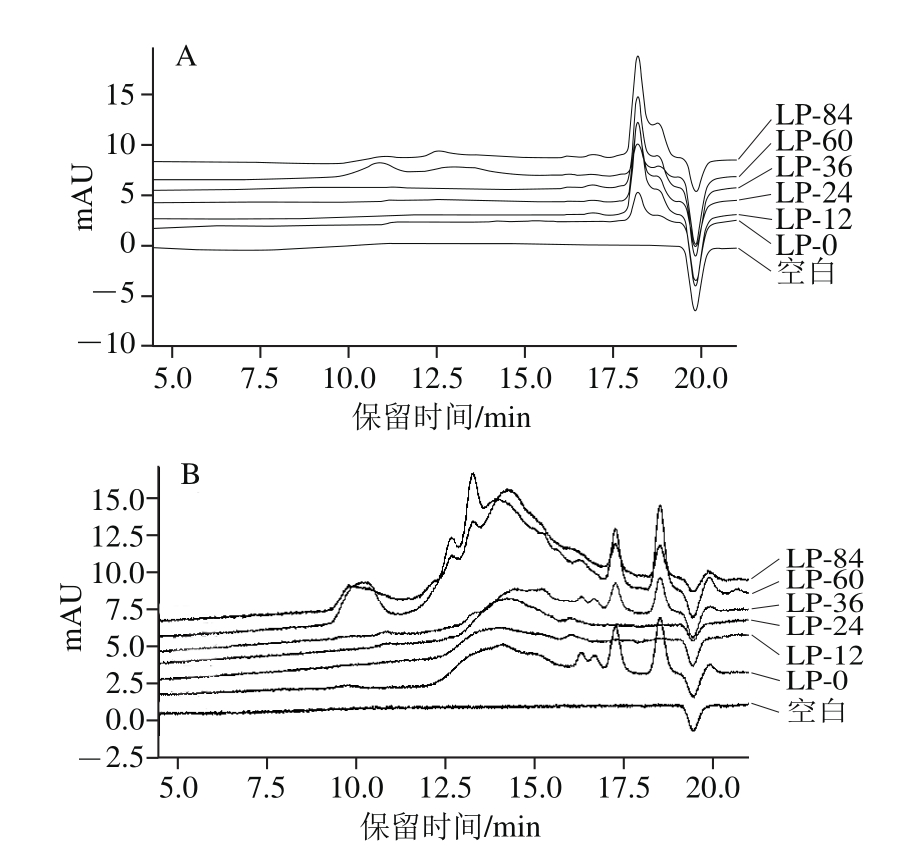
图3 不同干燥阶段龙眼果肉中多糖的HPSEC图谱
Fig. 3 HPSEC chromatograms of polysaccharides from longan pulp at different drying stages
A. HPSEC-RI图谱;B. HPSEC-PDA图谱。
综合LP的基本组成、FTIR和相对分子质量分布变化规律分析,发现干燥过程中的多糖和蛋白质发生美拉德反应,且反应主要在干燥36 h后发生。目前,多糖和蛋白质的美拉德反应研究主要依托于湿热和干热反应体系,且侧重于蛋白质的糖基化改性,食品加热体系中的大分子美拉德反应尚鲜见报道。
2.4 不同干燥阶段LP的体外抗氧化活性
表3 不同干燥阶段LP的体外抗氧化活性
Table 3 Antioxidant activities in vitro of polysaccharides from longan pulp at different drying stages
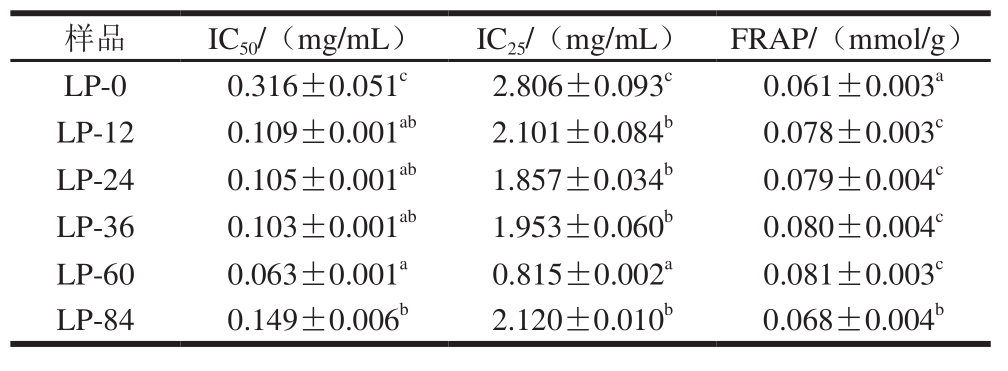
自由基清除能力以及还原能力是多糖抗氧化的重要机制[28],以此评价不同干燥阶段LP体外抗氧化活性。由表3可知,LP的抗氧化活性随热风干燥时间的延长先增大后减小,其中LP-60的自由基清除能力及还原能力较强。采用Pearson双侧检验分析LP不同抗氧化活性之间的相关性发现,IC25和FRAP之间无显著相关性(P>0.05),但分别与IC50之间存在显著(P<0.05)和极显著(P<0.01)的相关性。
多糖可作为电子供体,其提供的电子不仅能使Fe3+还原成Fe2+,同时能与自由基反应,使自由基转变为稳定的物质,从而中断自由基连锁反应[29]。在热风干燥前60 h,LP抗氧化活性的增强可能与干热环境下的多糖-蛋白质美拉德反应有关:多糖和蛋白质通过美拉德反应生成噻吩、噻唑、吡咯等杂环化合物,其电子非定域分布在环上,使碳原子上电子过剩,有利于自由基的亲电加成,从而增强自由基的清除效果[30];反应产物具有疏水性,由它提供的氢原子易与DPPH自由基结合形成稳定的DPPH-H顺磁分子,有助于对DPPH自由基的清除;反应生成吡咯酮、还原酮类、脱氧果糖嗪等大分子中间产物,可为还原性物质提供电子,增强Fe3+还原能力[31]。但热风干燥60 h后,具有抗氧化作用的美拉德反应产物发生降解和分子重排,使体系的抗氧化活性降低[32-33]。
2.5 不同干燥阶段LP的体外抗肿瘤活性
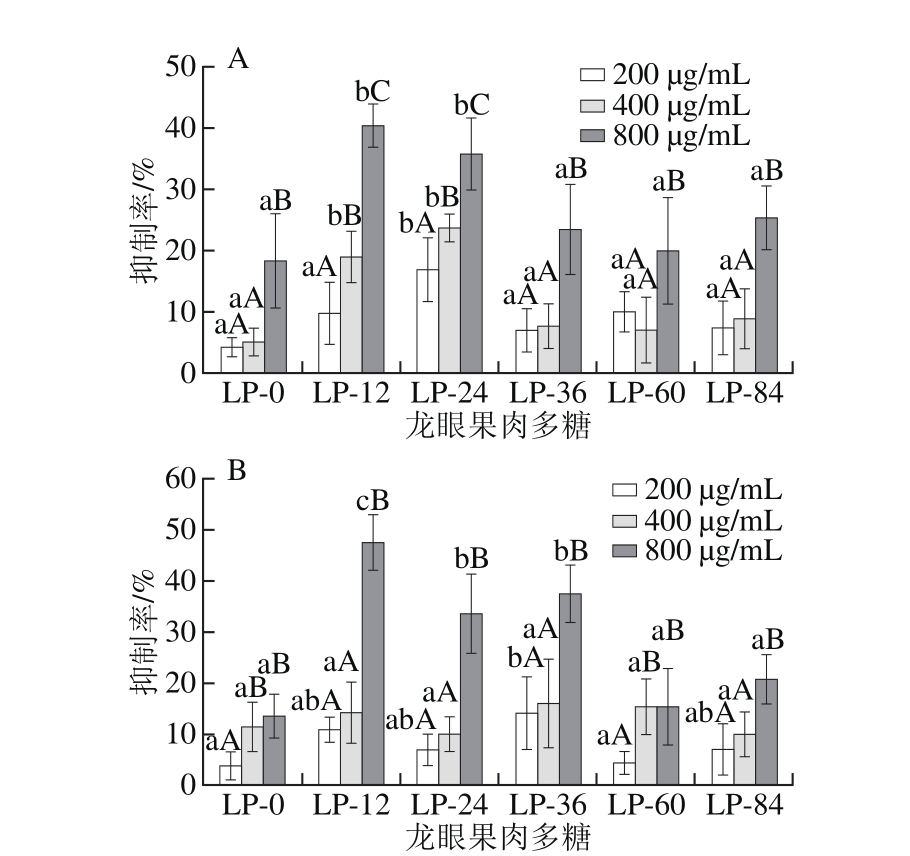
图4 不同干燥阶段龙眼果肉中多糖的抗肿瘤活性
Fig. 4 Antitumor activities of polysaccharides from longan pulp at different drying stages
A. HepG2细胞抑制率;B. SGC7901细胞抑制率;小写字母不同表示在相同剂量、不同龙眼果肉多糖之间差异显著(P<0.05);大写字母不同表示同一多糖、不同剂量之间差异显著(P<0.05)。
肝癌和胃癌是常见的消化道恶性肿瘤,其发病率在我国有逐年上升趋势[34],以胃癌细胞SGC7901和肝癌细胞HepG2为对象评价不同干燥阶段LP的抗肿瘤活性,结果如图4所示。随着干燥时间的延长,LP的肿瘤细胞抑制活性大体呈现先增强后减弱的趋势,以LP-12、LP-24和LP-36的抗肿瘤活性相对较强。对于不同干燥阶段LP,其高剂量(800 μg/mL)条件下的肿瘤细胞抑制率均显著高于低剂量(200 μg/mL)(P<0.05)。在高剂量条件下,LP-12和LP-24对HepG2细胞的生长抑制率无显著差异(P>0.05),但均显著高于其他LP(P<0.05)。LP-24和LP-36在高剂量条件下对SGC7901细胞抑制率无显著差异(P>0.05),但显著弱于LP-12(P<0.05)。
Meng Xin等[35]认为,结合蛋白含量是影响多糖抗肿瘤作用的重要因素,其主要通过增加多糖分子中的正净电荷,促使与肿瘤细胞膜负电荷受体之间的静电相互作用,增强对肿瘤细胞抑制效果。然而,多糖和蛋白质的结合可能产生空间位阻,阻碍特异性配体的受体识别,使得肿瘤抑制活性减弱,这也可能是LP-60和LP-84肿瘤抑制活性较弱的原因。
2.6 不同干燥阶段LP的体外免疫刺激活性
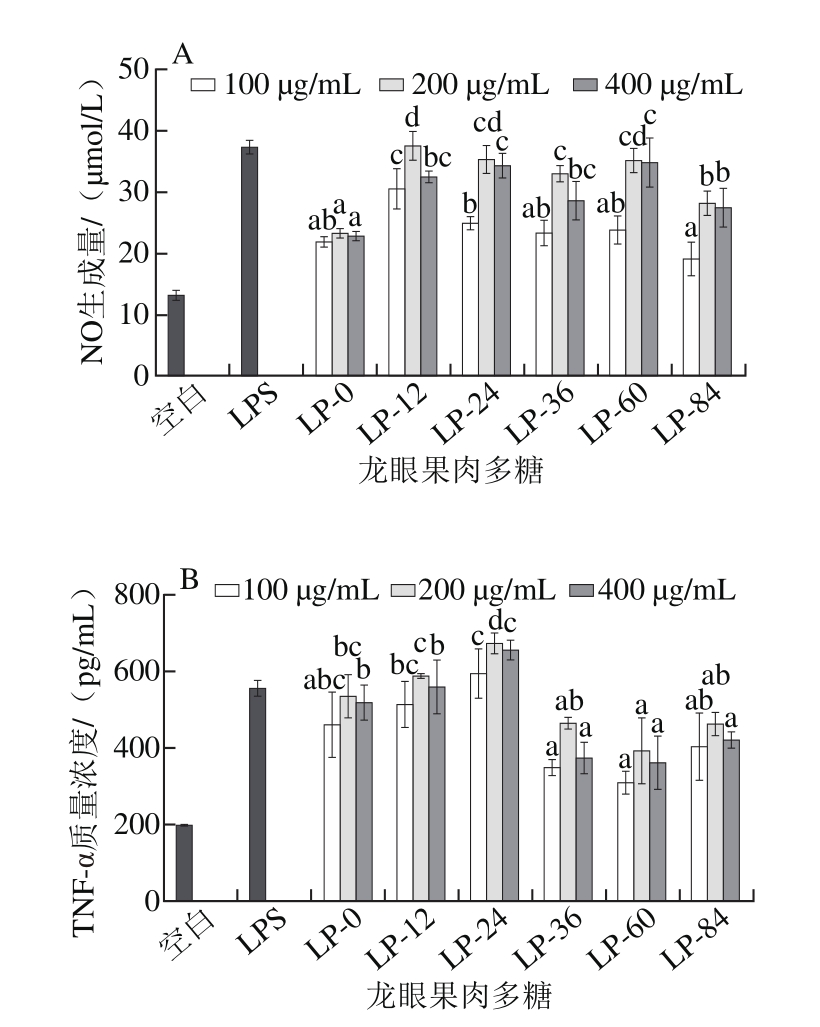
图5 不同干燥阶段龙眼果肉中多糖的巨噬细胞刺激活性
Fig. 5 Macrophage-stimulating activities of polysaccharides from longan pulp at different drying stages
A. NO生成量;B. TNF-α分泌量;小写字母不同表示相同剂量下、不同龙眼果肉多糖之间差异显著(P<0.05)。
巨噬细胞是先天免疫体系的重要组成,其NO生成和TNF-α分泌是响应多糖刺激的重要特征[36],故以此考察不同干燥阶段LP的体外免疫刺激活性,结果如图5所示。相较空白组,LP均能有效刺激巨噬细胞NO生成和TNF-α分泌(P<0.05),部分多糖的作用效果与5 μg/mL的LPS相当。龙眼果肉干燥后,LP刺激巨噬细胞NO生成作用增强。在中、高剂量条件下,LP-0的NO生成量显著低于其他LP(P<0.05),而LP-12、LP-24、LP-36和LP-60的作用较为相近,且强于LP-84。对于刺激巨噬细胞分泌TNF-α量,不同剂量条件下LP-0与LP-12并无显著差异(P>0.05),但强于LP-36、LP-60和LP-84。中、高剂量LP-24的巨噬细胞TNF-α分泌量显著高于其他LP(包括5 μg/mL的LPS)(P<0.05)。由此可见,龙眼果肉热风干燥24 h可以有效增强LP的免疫刺激活性。
Yi Yang等[10]研究发现,LP主要通过Toll样受体4和2激活巨噬细胞。而LP与免疫细胞受体的直接相互作用(立体相互作用和电荷相互作用)或间接作用,与其相对分子质量、结合蛋白、化学结构和构象密切相关[37-40]。因此干燥过程中LP的相对分子质量、结合蛋白含量及空间构象的变化是影响其免疫调节活性的主要原因。
通过对不同干燥阶段LP的基本组成、FTIR图谱特征和相对分子质量分布的研究,发现龙眼果肉在热加工过程中多糖和蛋白质相互作用,并推测主要由美拉德反应所致。同时,比较这些LP的体外抗氧化活性、抗肿瘤活性和免疫调节活性发现,果肉干制加工后的功能活性增强,但过度干制(在60 ℃条件下加热84 h)后活性减弱。12~24 h的龙眼果肉热风干制有利于提升其多糖多方面的功能活性,其潜在的构效机制尚有待于进一步研究,本研究有助于为龙眼干肉的高品质加工提供新的思路。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社,2000: 90.
[2] 韩冬梅, 杨武, 吴振先, 等. 龙眼果实贮藏品质理化指标评估体系的构建[J]. 华南农业大学学报, 2015, 36(6): 39-46. DOI:10.7671/j.issn.1001-411X.2015.06.007.
[3] NAGLE M, AZCARRAGA J C G, MAHAYOTHEE B, et al.Improved quality and energy performance of a fixed-bed longan dryer by thermodynamic modifications[J]. Journal of Food Engineering,2010, 99(3): 392-399. DOI:10.1016/j.jfoodeng.2010.03.006.
[4] NATHAKARANAKULE A, JAIBOON P, SOPONRONNARIT S.Far-infrared radiation assisted drying of longan fruit[J]. Journal of Food Engineering, 2010, 100(4): 662-668. DOI:10.1016/j.jfoodeng.2010.05.016.
[5] 田玉庭, 陈洁, 李淑婷, 等. 不同干燥方法对龙眼果肉品质特性的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(8):161-165; 170. DOI:10.13207/j.cnki.jnwafu.2012.08.004.
[6] 温靖, 徐玉娟, 肖更生, 等. 热泵和热风干燥对龙眼干营养品质和褐变反应的影响[J]. 热带作物学报, 2015, 36(4): 779-785.DOI:10.3969/j.issn.1000-2561.2015.04.024.
[7] 石骏, 廖森泰, 张名位, 等. 干制加工对龙眼果肉多酚组成及抗氧化活性的影响[J]. 华南师范大学学报(自然科学版), 2011(4): 111-115.DOI:10.6054/j.jscnun.2011.02.022.
[8] 徐玉娟, 邓彩玲, 林羡, 等. 龙眼高温热泵干制过程中主要活性成分变化研究[J]. 热带作物学报, 2014, 35(6): 1215-1220. DOI:10.3969/j.issn.1000-2561.2014.06.030.
[9] YANG B, JIANG Y M, SHI J, et al. Extraction and pharmacological properties of bioactive compounds from longan (Dimocarpus longan Lour.) fruit: a review[J]. Food Research International, 2011, 44(7):1837-1842. DOI:10.1016/j.foodres.2010.10.019.
[10] YI Yang, WANG Hongxun, ZHANG Ruifen, et al. Characterization of polysaccharide from longan pulp as the macrophage stimulator[J]. RSC Advances, 2015, 5(118): 97163-97170. DOI:10.1039/c5ra16044h.
[11] ZHONG K, WANG Q, HE Y, et al. Evaluation of radicals scavenging, immunity-modulatory and antitumor activities of longan polysaccharides with ultrasonic extraction on in S180 tumor mice models[J]. International Journal of Biological Macromolecules, 2010,47(3): 356-360. DOI:10.1016/j.ijbiomac.2010.05.022.
[12] JIANG J, MENG F Y, ZHOU H, et al. Sulfated modification of longan,polysaccharide and its immunomodulatory and antitumor activity in vitro[J]. International Journal of Biological Macromolecules, 2014,67(6): 323-329. DOI:10.1016/j.ijbiomac.2014.03.030.
[13] 易阳, 孙杰, 王丽梅, 等. 新鲜和干制龙眼果肉中多糖的理化特征及免疫调节活性比较[J]. 现代食品科技, 2015, 31(10): 53-62.DOI:10.13982/j.mfst.1673-9078.2015.10.010.
[14] 闵婷, 孙杰, 黄菲, 等. 超声处理对龙眼果肉多糖理化特征及免疫调节活性的影响[J]. 现代食品科技, 2016, 32(5): 124-131.DOI:10.13982/j.mfst.1673-9078.2016.5.020.
[15] 王文平, 郭祀远, 李琳, 等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-279. DOI:10.3321/j.issn:1002-6630.2007.04.065.
[16] BLUMENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry,1973, 54(2): 484-489. DOI:10.1016/0003-2697(73)90377-1.
[17] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5): 642-646. DOI:10.1111/j.1365-2621.2001.tb04614.x.
[18] 莫开菊, 赵娜, 朱照武, 等. 葛仙米多糖的单糖组成分析[J]. 食品科学, 2015, 36(18): 89-92. DOI:10.7506/spkx1002-6630-201518016.
[19] GU F L, KIM J K, ABBAS S, et al. Structure and antioxidant activity of high molecular weight Maillard reaction products from caseinglucose[J]. Food Chemistry, 2010, 120(2): 505-511. DOI:10.1016/j.foodchem.2009.10.044.
[20] WU Hao, ZHU Junxiang, DIAO Wenchao, et al. Ultrasound-assisted enzymatic extraction and antioxidant activity of polysaccharides from pumpkin (Cucurbita moschata)[J]. Carbohydrate Polymers, 2014, 113:314-324. DOI:10.1016/j.carbpol.2014.07.025.
[21] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.DOI:10.1016/0031-9422(89)80182-7.
[22] 鄢嫣, 张汇, 聂少平, 等. 黑灵芝子实体水溶性多糖的理化性质及抗氧化活性的研究[J]. 食品科学, 2009, 30(19): 55-60. DOI:10.3321/j.issn:1002-6630.2009.19.010.
[23] DE OLIVEIRA F C, COIMBRA J S, DE OLIVEIRA E B, et al. Food protein-polysaccharide conjugates obtained via the Maillard reaction:a review[J]. Critical Reviews in Food Science and Nutrition, 2016,56(7): 1108-1125. DOI:10.1080/10408398.2012.755669.
[24] 张亦鸣. 低聚木糖美拉德反应及其衍生物活性[D]. 上海: 上海海洋大学, 2015: 27-28.
[25] 黄静涵, 艾斯卡尔·艾拉提, 毛健. 灵芝多糖的分离纯化及结构鉴定[J].食品科学, 2011, 32(12): 301-304.
[26] 王洪伟, 武菁菁, 阚建全. 青稞和小麦醇溶蛋白和谷蛋白结构性质的比较研究[J]. 食品科学, 2016, 37(3): 43-48. DOI:10.7506/spkx1002-6630-201603009.
[27] OLIVER C M, KHER A, MCNAUGHTON D, et al. Use of FTIR and mass spectrometry for characterization of glycated caseins[J].Journal of Dairy Research, 2009, 76(1): 105-110. DOI:10.1017/S002202990800383X.
[28] KE C L, QIAO D L, GAN D, et al. Antioxidant acitivity in vitro and in vivo of the capsule polysaccharides from Streptococcus equi subsp.zooepidemicus[J]. Carbohydrate Polymers, 2009, 75(4): 677-682.DOI:10.1016/j.carbpol.2008.09.008.
[29] 项惠丹, 许时婴, 王璋. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57. DOI:10.3321/j.issn:1002-6630.2008.07.005.
[30] 周向军, 周健, 冯进兵, 等. 4 种模式美拉德反应条件及其产物抗氧化作用[J]. 食品与发酵工业, 2014, 40(6): 27-36. DOI:10.13995/j.cnki.11-1802/ts.2014.06.019.
[31] 黄梅桂. 大豆肽美拉德反应体系中色泽抑制及其机理研究[D]. 无锡: 江南大学, 2012: 31.
[32] 邹利, 赵妍嫣, 朱坦, 等. 猪骨粉酶解液的美拉德反应产物清除DPPH·的研究[J]. 食品工业科技, 2013, 34(13): 79-82. DOI:10.13386/j.issn1002-0306.2013.13.035.
[33] CHARURIN P, AMES J M, DEL C M D. Antioxidant activity of coffee model systems[J]. Journal of Agricultural & Food Chemistry,2002, 50(13): 3751-3756. DOI:10.1021/jf011703i.
[34] 许福源, 李楠, 柴进, 等. 人胃癌组织中gp78和KAI1表达水平及其临床意义[J]. 第三军医大学学报, 2010, 32(7): 688-691. DOI:10.16016/j.1000-5404.2010.07.029.
[35] MENG Xin, LIANG Hebin, LUO Lixin. Antitumor polysaccharides from mushrooms: a review on the structural characteristics, antitumor mechanisms and immunomodulating activities[J]. Carbohydrate Research, 2016, 424: 30-41. DOI:10.1016/j.carres.2016.02.008.
[36] 易阳, 曹银, 张名位. 多糖调控巨噬细胞免疫应答机制的研究进展[J].中国细胞生物学学报, 2011, 33(11): 1267-1277.
[37] SUN L Q, WANG L, ZHOU Y. Immunomodulation and antitumor activities of different-molecular-weight polysaccharides from Porphyridium cruentum[J]. Carbohydrate Polymers, 2012, 87(2):1206-1210. DOI:10.1016/j.carbpol.2011.08.097.
[38] CHEN Z, KWONG H T B, CHAN S H. Activation of T lymphocytes by polysaccharide-protein complex from Lycium barbarum L.[J].International Immunopharmacology, 2008, 8(12): 1663-1671.DOI:10.1016/j.intimp.2008.07.019.
[39] XIE G, SCHEPETKIN I A, SIEMSEN D W, et al. Fractionation and characterization of biologically-active polysaccharides from Artemisia tripartita[J]. Phytochemistry, 2008, 69(6): 1359-1371. DOI:10.1016/j.phytochem.2008.01.009.
[40] LEE J S, KWON J S, YUN J S, et al. Structural characterization of immunostimulating polysaccharide from cultured mycelia of Cordyceps militaris[J]. Carbohydrate Polymers, 2010, 80(4): 1011-1017. DOI:10.1016/j.carbpol.2010.01.017.
Changes of Polysaccharides in Longan Pulp during Drying: Physicochemical Properties and Biological Activities
HAN Miaomiao1, YAO Juan1, YI Yang1,*, HUANG Fei2, WANG Limei3
(1. School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China;2. Key Laboratory of Functional Foods, Ministry of Agriculture, Sericultural and Agri-Food Research Institute,Guangdong Academy of Agricultural Sciences, Guangzhou 510610, China;
3. School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:This work aimed to investigate the changes of polysaccharides in terms of physicochemical properties and biological activities during the drying of longan pulp. Polysaccharides from longan pulp at different drying stages were isolated.The proximate composition, Fourier transform infrared spectroscopic characteristics and molecular weight distribution of polysaccharides were analyzed, and their antioxidant, antitumor and immunostimulatory activities were evaluated in vitro. With the increase of drying time, the physicochemical characteristics of longan pulp polysaccharides (LP) showed significant changes.The mass ratio of neutral sugar to protein, the molar ratio of glucose to mannose and free amino group content were decreased,the typical amide bands in the infrared spectrum were diverse, and new fractions with relative high molecule weight were formed at the advanced stage of drying process according to the high-performance size-exclusion chromatogram. The evaluation of in vitro biological activities indicated that various activities of LP such as 1,1-diphenyl-2-picrylhydrazyl radical scavenging,hydroxyl radical scavenging, ferric reducing antioxidant power increased after 12-60 h drying of longan pulp, inhibitory effects against tumor cells (HepG2 and SGC7901) and immunostimulating effects on nitric oxide production and tumor necrosis factor-alpha secretion in macrophages increased after 12-24 h drying of longan pulp. But the activities decreased after more than 60 h drying. These changes in activities might be related to the Maillard reaction between polysaccharides and proteins in longan pulp during drying. The results can be useful for the processing of dried longan pulp with high quality.
Key words:longan pulp; polysaccharide; physicochemical property; biological activity; Maillard reaction
收稿日期:2017-05-03
基金项目:国家自然科学基金面上项目(31771979);国家自然科学基金青年科学基金项目(31301416);武汉轻工大学科研计划项目(2016J05)
作者简介:韩苗苗(1992—),女,硕士研究生,研究方向为食品营养。E-mail:18211673915@163.com
*通信作者:易阳(1986—),男,副教授,博士,研究方向为功能食品。E-mail:yiy86@whpu.edu.cn
DOI:10.7506/spkx1002-6630-201721011
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)21-0067-07
引文格式:韩苗苗, 姚娟, 易阳, 等. 龙眼果肉干燥过程中多糖的理化特征与活性变化规律[J]. 食品科学, 2017, 38(21): 67-73.
DOI:10.7506/spkx1002-6630-201721011. http://www.spkx.net.cn
HAN Miaomiao, YAO Juan, YI Yang, et al. Changes of polysaccharides in longan pulp during drying: physicochemical properties and biological activities[J]. Food Science, 2017, 38(21): 67-73. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721011. http://www.spkx.net.cn