表1 4 个与线虫寿命相关基因的基本信息
Table 1 Information about lifespan-related genes in C. elegans

王 晋,王虹元,金玲玲,郭长禄,张治洲*
(哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264200)
摘 要:以秀丽隐杆线虫(Caenorhabditis elegans)作为模式生物,在其生长培养基中分别添加4、40、400 mmol/L的乙醇试剂,观察乙醇对线虫寿命的调控作用。通过检测对照组和喂食乙醇溶液实验组线虫体内寿命相关基因(age-1、pdk-1、akt-1、let-363)的表达差异,探究乙醇调控线虫寿命的分子机制。结果表明,喂食400 mmol/L乙醇可有效提高线虫寿命,分别将寿命中位数和平均寿命提高了11.76%和15.78%,且与对照组相比均具有显著性差异(P<0.05)。利用实时荧光定量聚合酶链式反应检测基因表达,结果表明乙醇可能通过抑制age-1基因表达,引发胰岛素信号传导通路中一系列相应下游基因表达变化从而延长线虫寿命;雷帕霉素受体信号传导通路中let-363基因也因乙醇的摄入及胰岛素信号传导通路下游基因的抑制作用而表达下降,两者联合达到显著延长线虫寿命的作用效果。
关键词:秀丽隐杆线虫;长寿;乙醇;信号传导通路
随着社会的进步和科技的迅猛发展,通过药物和食品延缓衰老在技术水平上成为可能。生物体的寿命长短如何受外来因素的影响?衰老的内在调控机制到底是什么?随着胰岛素信号(insulin/IGF signalling,IIS)和雷帕霉素受体信号(mammalian target of rapamycin,mTOR)等传导通路对衰老调控作用的机制被一一解开,衰老研究在分子生物学上取得突破性进展,并成为生物学研究领域的热点课题[1-2]。基因的突变能够使生物体寿命发生显著改变,如daf-2基因突变体线虫寿命是正常线虫寿命的2~3 倍,而daf2/clk-1双基因突变体线虫寿命可提高5~6 倍[3],Insulin/IGF-1通路相关基因突变会使实验动物衰老表征得到大幅度改善[4]。然而寿命的调控是一个复杂的过程,除了受到遗传的控制之外,也与人类的生存环境和生活习惯息息相关。由于秀丽隐杆线虫(Caenorhabditis elegans)具备生命周期短、在实验室易于培养且易于操作、繁殖快、容易获取大量同期化样本以消除个体差异等优势[5-6],因此选用秀丽隐杆线虫作为寿命研究的模式生物。
以乙醇为主要成分的酒类饮料是中国人在社交、庆典等活动中不可缺少的特殊饮品,在日常生活中也占有十分重要的地位。我国自古便有“酒乃百药之长”一说,这是古人对酒的高度评价。可以说酒在医学上的应用是祖国医药学的发明之一,酒有“通血脉、散湿气”、“行药势、杀百邪恶毒气”、“除风下气”、“开胃下食”、“温肠胃、御风寒”、“止腰膝疼痛”等功效,而且在行医的过程中将酒入药可推进药效发挥[7]。在近年来的研究中发现乙醇作为酒中的主要成分具有一定的增寿作用:2011年于笑坤[8]发现在低乙醇体积分数(1%~2%)的刺激之下,线虫寿命有所延长而且爬行速度较快。而2012年美国加州大学科学家发现L1期线虫幼虫通过摄食乙醇(体积分数0.4%)并将其转化为脂肪酸而达到增寿作用[9]。
为了进一步探究摄食乙醇可显著延长秀丽隐杆线虫寿命的分子机制,本实验以N2野生型秀丽隐杆线虫作为模式生物,通过喂食4、40、400 mmol/L 3 种不同浓度乙醇,观察乙醇对其寿命的影响,从IIS和mTOR两个经典的衰老调控信号传导通路中选择寿命相关基因(age-1、pdk-1、akt-1和let-363)(表1)。其中age-1、pdk-1、akt-1基因是IIS传导通路关键基因,其对生物体表型的作用已被报道:与个体寿命、抗逆性、生育和胚胎发育都具有明显相互关联[10-11];mTOR传导通路中的let-363基因为生物个体新陈代谢关键基因,通过调控生物个体新陈代谢速率影响个体寿命的长短[12-13]。目前尚鲜见文献报道上述4 个基因的表达是否受乙醇的影响。通过实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测第8天和第12天线虫体内age-1、pdk-1、akt-1和let-363的表达情况,进而初步判断乙醇对寿命的调控作用与IIS和mTOR两个经典信号传导通路之间的关系。
表1 4 个与线虫寿命相关基因的基本信息
Table 1 Information about lifespan-related genes in C. elegans

1.1 材料与试剂
N2野生型秀丽隐杆线虫(C. elegans,the Bristol strain N2)和大肠杆菌(Escherichia coli)OP50由天津科技大学王昌禄教授惠赠。
乙醇(100%)等试剂均购于上海生物(工程)有限公司。
1.2 仪器与设备
SPX-250B-Z等系列生化培养箱、SW-CJ-1F型单人双面垂直洁净工作台 上海博迅实业有限公司医疗设备厂;电子天平 奥豪斯仪器(上海)有限公司;XYH-2A型连续变倍体式显微镜 上海永亨光学仪器制造有限公司;TDL-60B/16B型台式离心机 上海安亨科学仪器厂;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;Stepone实时荧光定量PCR仪美国ABI生物有限公司。
1.3 方法
1.3.1 线虫培养基的配制
称量3 g NaCl、2.5 g胰蛋白胨、17 g琼脂粉,添加ddH2O至1 L,121 ℃高温高压灭菌20 min,待培养基冷却至50~60 ℃时逐一添加CaCl2(1 mol/L)1 mL、MgSO4(1 mol/L)1 mL、KPO4缓冲液(1 mol/L)25 mL、胆固醇溶液1 mL,混合均匀[22]。在普通NGM(nematode growth medium)培养基冷却至50~60 ℃后分别加入对应浓度乙醇溶液。
1.3.2 E. coli OP50的培养与涂布
将37 ℃振荡培养的E. coli OP50菌群涂布在NGM培养基上,涂好菌的平板封口倒置放在37 ℃生化培养箱中培养过夜后,放入4 ℃冰箱中保存,以备喂养线虫使用。
1.3.3 线虫的同期化培养
将线虫母液与同期化试剂(5 g/100mL NaClO溶液与5 mol/L NaOH溶液体积比为2∶1)以体积比7∶3的比例混匀,不断振荡混匀,直至线虫解体溶液由浑浊变为澄清(同期化时间控制在8~10 min),4 000 r/min离心50 s,弃上清液收集EP管底部没有被同期化试剂破坏的虫卵,将收集到的虫卵用dH2O清洗3 次,接种于涂布有E. coli OP50的NGM平板上,置于20 ℃生化培养箱中孵育[23]。
1.3.4 线虫寿命统计
从同期化3 d后的平板中选出大小一致且活跃度高的线虫,各挑取35 只线虫至添加有4(0.024%,体积分数,下同)、40(0.240%)、400 mmol/L(2.400%)乙醇的培养基中进行培养,每组设置3 组平行实验,每24 h更换一次培养基,直至培养基中的线虫全部死亡,统计线虫寿命,并与对照组平板中线虫进行对比(数据剔除由于意外在培养皿壁上干死的线虫)。将每天线虫的死亡及存活数转换成线虫寿命,进行Kaplan-Meier生存分析;同时,根据线虫存活天数排序按式(1)计算平均寿命(mean of lifespan,MLS),平均寿命标准误差(standard error,SE)按式(2)计算。
式中:j为线虫日龄;xj为该日龄线虫存活条数;dj为(xj+xj+1)期间死亡的线虫条数;n为线虫的总条数。
1.3.5 线虫寿命相关基因的表达
由于线虫生命周期较短,选取8 d成熟期线虫作为对照模板(对照组);因其于第15天左右开始出现死亡个体,故选取第12天线虫作为衰老模板。在第8、12天分别从对照组及具有显著延寿作用的400 mmol/L乙醇实验组中各挑取线虫20 只,使用Trizol进行裂解,根据乙醇提取法提取RNA,并使用对应试剂盒进行反转录实验,最终获取cDNA样本。使用实时荧光定量PCR仪检测其寿命相关基因的表达情况。实验所用所有引物均为2 μmol/L且每对引物均以浓度1∶1混合(表2)。调整各个基因引物对添加量使得各基因最终扩增效率均在1左右,最终确定12 μL实时荧光定量PCR反应体系如表3所示,循环条件为:94 ℃预变性6 min;94 ℃变性20 s,61 ℃退火32 s,72 ℃延伸40 s,反应循环数为40;72 ℃完全延伸2 min。
表2 实时荧光定量PCR引物对信息
Table 2 qPCR primers used in this study

注:GAPDH为内参基因。
表3 实时荧光定量PCR反应体系设计
Table 3 qPCR reaction systems
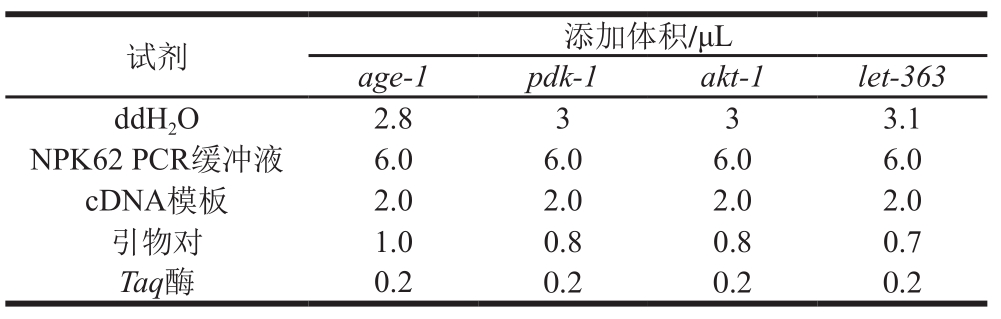
1.4 数据处理
数据均以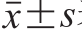 表示,以SPSS 19.0、Excel 2010等软件进行数据处理并作图,进行Kaplan-Meier生存分析、相关性检验、单因素方差分析和LSD多重比较,以P<0.05表示有显著性差异,以P<0.01表示有极显著性差异。
表示,以SPSS 19.0、Excel 2010等软件进行数据处理并作图,进行Kaplan-Meier生存分析、相关性检验、单因素方差分析和LSD多重比较,以P<0.05表示有显著性差异,以P<0.01表示有极显著性差异。
2.1 不同浓度乙醇对线虫寿命的影响
不同浓度乙醇对线虫寿命的影响情况如图1、表4所示。从生存函数可以看出400 mmol/L乙醇可有效提高线虫整个生命周期内生存率,摄食4 mmol/L和40 mmol/L乙醇线虫与对照组线虫相比不存在显著性差异。通过对数据进行单因素方差分析和LSD多重比较发现,400 mmol/L乙醇实验组线虫寿命中位数和平均寿命分别提高了11.76%和15.78%,与其他3 组相比均存在显著性差异(P<0.05)。由此可见400 mmol/L乙醇具有延寿作用。
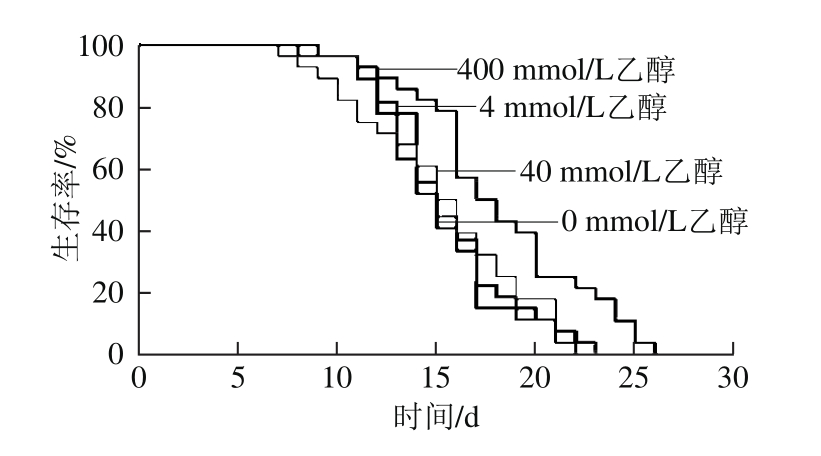
图1 不同浓度乙醇对线虫生存函数的影响
Fig. 1 Survival function of C. elegans fed with different concentrations of ethanol
表4 不同浓度乙醇对线虫寿命的影响
Table 4 Lifespan of C. elegans fed with different concentrations of ethanol
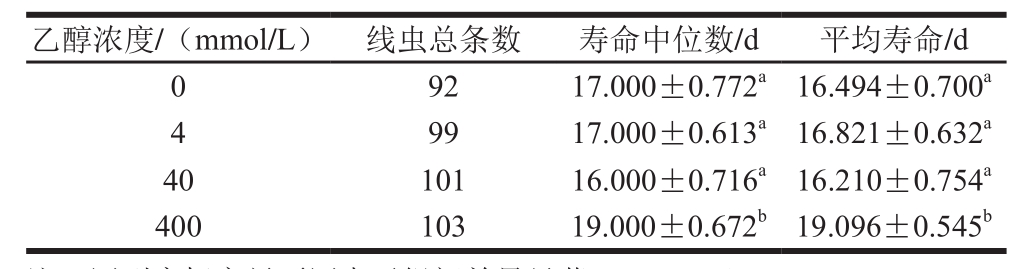
注:同列肩标字母不同表示组间差异显著(P<0.05)。
2.2 不同浓度乙醇对寿命相关基因表达水平的影响
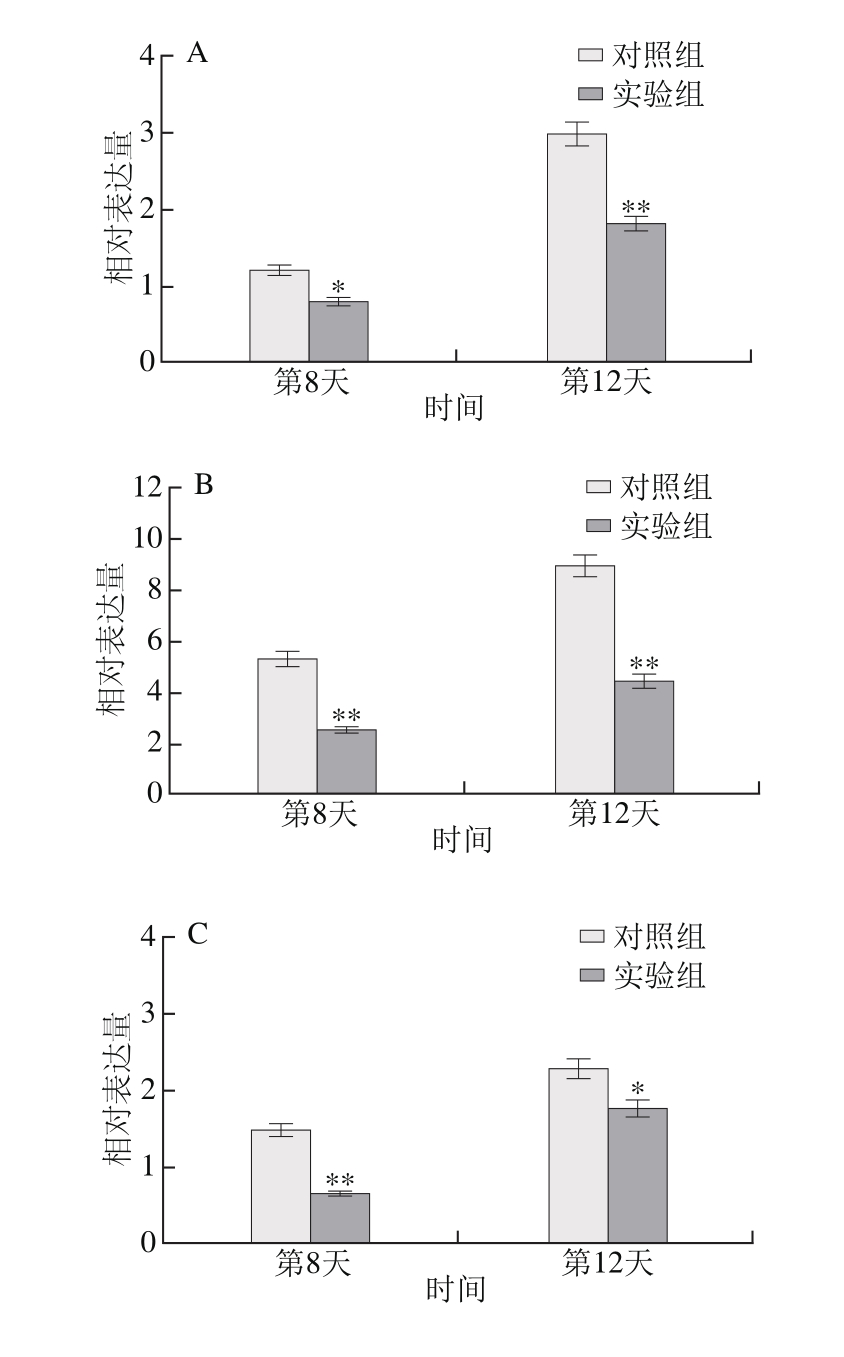
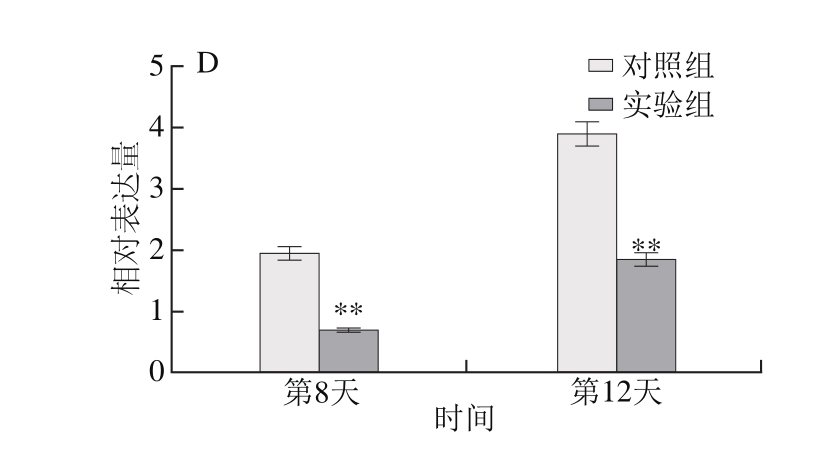
图2 线虫寿命相关基因的相对表达量
Fig. 2 Lifespan-related gene expression in C. elegans as detected by qPCR analysis
A.基因age-1;B.基因pdk-1;C.基因akt-1;D.基因let-363;*.与对照组相比差异显著(P<0.05);**.与对照组相比差异极显著(P<0.01)。相对表达量为所测基因与内参基因表达量的比值。
检测线虫成虫后第8、12天4 个基因相对表达情况,结果由图2可知,随着线虫衰老程度的增加,上述4 个基因表达量均显著性下降(P<0.05,P<0.01)。喂食400 mmol/L乙醇于线虫衰老阶段均显著抑制寿命相关基因的表达(P<0.05,P<0.01),进而有效延缓衰老进程而显著提高线虫寿命。
高剂量饮用酒精类饮品所带来的负面作用一直被人们深恶痛绝,但医学上已经证明,适量饮酒可以对人体产生真正的健康功效,比如降低胆固醇、强化智能、提高心血管机能等。本研究表明,少量、适度地补充乙醇亦存在潜在的增寿作用。通过喂食线虫4、40、400 mmol/L乙醇溶液,观察不同浓度乙醇对寿命长短的影响(乙醇剂量的选择是通过对国内外文献数据以及本研究室的前期实验结果比较总结而定[9])。结果表明,摄食400 mmol/L乙醇溶液具有延寿作用,喂食乙醇的实验组线虫无论是寿命中位数还是平均寿命均发生显著性提高(P<0.05)。
衰老调控机理研究中,IIS传导通路调控寿命的机理不仅已阐述得较为清楚,并且从酵母到小鼠都具有较高的保守性,因而成为当代衰老研究中的核心通路[24]。该通路中daf-2可与细胞外的胰岛素配体相结合而促使PI3K激活age-1的表达,进而通过一系列信号传导激活下游AKT/PKB同源物[25-27]。AKT-1,AKT-2和SGK-1组成的蛋白复合物受到因PDK-1磷酸化作用而被激活,并抑制IIS传导通路若干下游基因(如daf-16)活性,继而直接影响线虫寿命[28];而IIS传导通路下游基因还可以调控mTOR传导通路上游基因所形成的蛋白聚合体的生物学状态,继而影响寿命[29-30]。IIS传导通路下游基因(如TSC1[31]和daf-16[28])和mTOR传导通路上游基因(如RHEB[32]和AKT1S1[33])的表达情况如何受乙醇摄入的影响将在本实验基础上详细研究并另行报道。
通过实验检测第8、12天线虫体内age-1、pdk-1、akt-1和let-363的基因表达情况可知,上述基因随着衰老进程均呈现表达量上升趋势,但喂食400 mmol/L乙醇可显著抑制上述基因的表达。可以推断,一定剂量乙醇的摄入有效抑制age-1和let-363基因的表达,在IIS传导通路中age-1基因的下游基因pdk-1表达量下降,akt-1基因表达因受到pdk-1的调控作用表达同样受到抑制。与此同时,mTOR传导通路中let-363基因也因乙醇的摄入以及IIS传导通路下游基因的抑制作用而表达下降,进而调控一系列与衰老调控相关的基因导致寿命的延长。由此可见,乙醇的增寿作用是通过调控IIS和mTOR两个传导通路共同实现的(图3)。
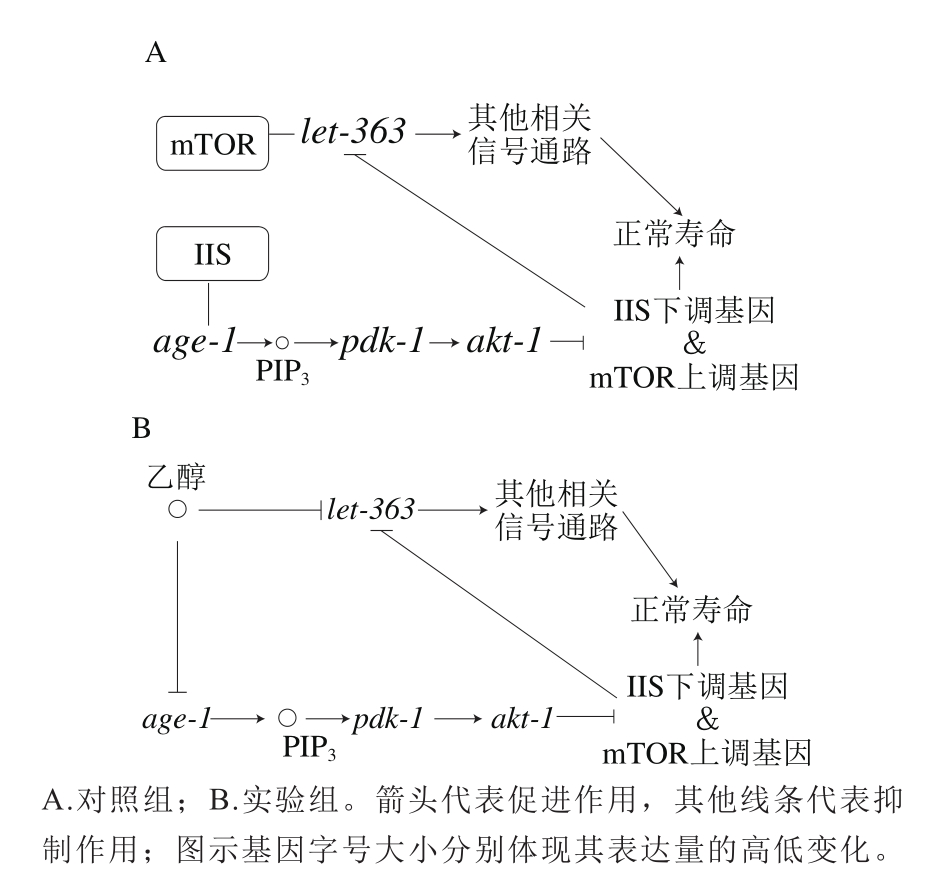
图3 乙醇对秀丽隐杆线虫延寿作用的分子机制
Fig. 3 Molecular mechanism for the effect of ethanol on lifespan extension in C. elegans
所以通过调节饮食来调节某一生物个体的寿命长短在理论上是可行的,但是任何一种生物的寿命调控的具体分子机制是非常复杂的,在本研究的基础上,乙醇摄入如何带来IIS传导通路若干下游基因和mTOR传导通路若干上游基因的表达变化,以及这些基因表达变化如何在更深入的分子水平上影响线虫的寿命,值得我们进一步研究。
参考文献:
[1] KENYON C J. The genetics of ageing[J]. Nature, 2010, 464: 504-512.DOI:10.1038/nature08980.
[2] 陈迪. 秀丽线虫胰岛素类生长因子和雷帕霉素受体信号通路对衰老的调节作用[J]. 生物化学与生物物理进展, 2014, 41(3): 305-312.DOI:10.3724/SP.J.1206.2014.00019.
[3] 吴予平. daf-2和daf-16基因的结构与功能研究进展[J]. 国外医学(分子生物学分册), 2001, 23(2): 68-70. DOI:10.3870/j.issn.1672-8009.2001.02.002.
[4] 毛玉琴, 韩三峰, 王立顺. 秀丽隐杆线虫中与衰老相关的DAF-2/IGF-1信号通路研究进展[J]. 上海交通大学学报(医学版), 2014,34(6): 929-933. DOI:10.3969 /j.issn.1674-8115.2014.06.033.
[5] 刘恩岐, 仓林让. 模型动物: 秀丽隐杆线虫研究进展[J]. 动物科学与动物医学, 2003, 20(10): 23-25.
[6] 赵晴, 蒋湉湉. 秀丽隐杆线虫研究综述[J]. 安徽农业科学, 2010,38(19): 10092-10093; 10095. DOI:10.3969/j.issn.0517-6611.2010.19.060.
[7] 刘玉平, 黄明泉, 郑福平, 等. 中国白酒中挥发性成分研究进展[J].食品科学, 2010, 31(21): 437-441.
[8] 于笑坤. 秀丽新杆线虫肌管素磷酸酶生物学功能的研究及长期酒精刺激对线虫的影响[D]. 长春: 吉林大学, 2011: 49-58.
[9] CASTRO P V, KHARE S, YOUNG B D, et al. Caenorhabditis elegans battling starvation stress: low levels of ethanol prolong lifespan in L1 larvae[J]. PLoS ONE, 2012, 7(1): 1-11. DOI:10.1371/journal.pone.0029984.
[10] MERCKEN E M, CROSBY S D, LAMMING D W, et al. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile[J]. Aging Cell, 2013, 12(4): 645-651.DOI:10.1111/acel.12088.
[11] 王敏, 高亚琴, 汪瑾. 秀丽线虫寿命的调控机制[J]. 安徽农业科学,2010, 38(20): 10514-10515. DOI:10.3969/j.issn.0517-6611.2010.20.010.
[12] KAPAHI P, CHEN D, ROGERS A N, et al. With TOR, less is more: a key role for the conserved nutrient-sensing TOR pathway in aging[J]. Cell Metabolism, 2010, 11(6): 453-465. DOI:10.1016/j.cmet.2010.05.001.
[13] JOHNSON S C, RABINOYITCH P S, KAEBERLEIN M. mTOR is a key modulator of ageing and age-related disease[J]. Nature, 2013, 493:338-345. DOI:10.1038/nature11861.
[14] ASH S C, YANG D Q, BRITT D E. Lyric/AGE-1 overexpression modulates protein levels in prostate tumor cells[J]. Biochemical and Biophysical Research Communications, 2008, 371(2): 333-338.DOI:10.1016/j.bbrc.2008.04.084.
[15] LEE S G, SU Z Z, EMDAD L, et al. Astrocyte elevated gene-1 (age-1) is a target gene of oncogenic Ha-ras requiring phosphatidylinositol 3-kinase and c-Myc[J]. Proceedings of the National Academy of Sciences, 2006,103(46): 17390-17395. DOI:10.1073/pnas.0608386103.
[16] XU J B, WU H, HE Y L, et al. Astrocyte elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J]. Medical Oncology,2011, 28(2): 455-462. DOI:10.1007/s12032-010-9475-6.
[17] RAIMONDI C, FALASCA M. Targeting PDK1 in cancer[J].Current Medicinal Chemistry, 2011, 18(18): 2763-2769.DOI:10.2174/092986711796011238.
[18] DAVIES M A, STEMKE-HALE K, LIN E, et al. Integrated molecular and clinical analysis of AKT activation in metastatic melanoma[J]. Clinical Cancer Research, 2009, 15(24): 7538-7546.DOI:10.1158/1078-0432.CCR-09-1985.
[19] 王维, 张琍. PI3K/Akt信号转导通路的研究进展[J]. 现代医药卫生,2010, 26(7): 1051-1052.
[20] 吴苗苗, 苑玉和, 陈乃宏. mTOR信号通路与神经退行性疾病研究进展[J].中国药理学通报, 2011, 27(11): 1481-1483. DOI:10.3969/j.issn.1001.
[21] SCHIEBER M, CHANDEL N S. TOR Signaling couples oxygen sensing to lifespan in C. elegans[J]. Cell Reports, 2014, 9(1): 9-15.DOI:10.1016/j.celrep.2014.08.075.
[22] THERESA S. Maintenance of C. elegans[EB/OL]. (2016-06-19)[2016-07-04]. http://www.wormbook.org:1-11.
[23] 王虹元. 氨基酸对秀丽隐杆线虫寿命的影响及分子机制的初步研究[D]. 威海: 哈尔滨工业大学(威海), 2013: 12-15.
[24] 沈露露, 王大勇. 秀丽线虫衰老调控的生理与分子机制[J]. 生理科学进展, 2009, 40(1): 75-78.
[25] GUARENTE L, KENYON C. Genetic pathways that regulate ageing in model organisms[J]. Nature, 2000, 408: 255-262.DOI:10.1038/35041700. DOI:10.1038/35041700.
[26] LOPEZ-OTIN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. DOI:10.1016/j.cell.2013.05.039.
[27] ESTEVEZ A O, MORGAN K L, SZEWCZYK N J, et al. The neurodegenerative effects of selenium are inhibited by FOXO and PINK1/PTEN regulation of insulin/insulin-like growth factor signaling in Caenorhabditis elegans[J]. Neurotoxicology, 2014, 41(6): 28-43.DOI:10.1016/j.neuro.2013.12.012.
[28] ALIC N, TULLET J M, NICCOLI T, et al. Cell-nonautonomous effects of dFOXO/DAF-16 in aging[J]. Cell Reports, 2014, 6(4): 608-616. DOI:0.1016/j.celrep.2014.01.015.
[29] VELLAI T, TAKACS-VELLAI K, ZHANG Y, et al. Genetics:influence of TOR kinase on lifespan in C. elegans[J]. Nature, 2003,426: 620-621. DOI:10.1038/426620a. DOI:10.1038/426620a.
[30] LAMMING D W, YE L, SABATINI D M, et al. Rapalogs and mTOR inhibitors as anti-aging therapeutics[J]. Journal of Clinical Investigation, 2013, 123(3): 980-989. DOI:10.1172/JCI64099.
[31] LAMB R F, ROY C, DIEFENBACH T J, et al. The TSC1 tumour suppressor hamartin regulates cell adhesion through ERM proteins and the GTPase Rho[J]. Nature Cell Biology, 2000, 2(5): 281-287.DOI:10.1038/35010550.
[32] LU Z H, SHVARTSMAN M B, LEE A Y, et al. Mammalian target of rapamycin activator RHEB is frequently overexpressed in human carcinomas and is critical and sufficient for skin epithelial carcinogenesis[J]. Cancer Research, 2010, 70(8): 3287-3298.DOI:10.1158/0008-5472.CAN-09-3467.
[33] KOVACINA K S, PARK G, BEA S S, et al. Identification of a proline-rich Akt substrate as a 14-3-3 binding partner[J]. Journal of Biological Chemistry, 2003, 278(12): 10189-10194. DOI:10.1074/jbc.M210837200.
Effect of Ethanol on Caenorhabditis elegans Lifespan and Its Potential Molecular Mechanisms
WANG Jin, WANG Hongyuan, JIN Lingling, GUO Changlu, ZHANG Zhizhou*
(School of Marine Science and Technology, Harbin Institute of Technology (Weihai), Weihai 264200, China)
Abstract:In this paper, the effect of ethanol on Caenorhabditis elegans lifespan was investigated by culturing it in a medium with different concentrations (4, 40 and 400 mmol/L) of ethanol. The results showed that 400 mmol/L ethanol could significantly extend the median lifespan by 11.76% and the mean lifespan by 15.78% (P 〈 0.05). The expression of lifespan-related genes (age-1, pdk-1, akt-1 and let-363) was detected using real-time quantitative polymerase chain reaction(qPCR) to explore the potential molecular mechanisms. Our results demonstrated that ethanol induced lifespan extension in C. elegans could be due to the suppressed expression of the above four genes and consequent regulation of the downstream genes in both the insulin/IGF signalling (IIS) and mammalian target of rapamycin (mTOR) pathways.
Key words:Caenorhabditis elegans; longevity; ethanol; signaling pathways
DOI:10.7506/spkx1002-6630-201721026
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)21-0165-05
引文格式:王晋, 王虹元, 金玲玲, 等. 乙醇对秀丽隐杆线虫寿命的影响及其分子机理[J]. 食品科学, 2017, 38(21): 165-169.
DOI:10.7506/spkx1002-6630-201721026. http://www.spkx.net.cn
WANG Jin, WANG Hongyuan, JIN Lingling, et al. Effect of ethanol on Caenorhabditis elegans lifespan and its potential molecular mechanisms[J]. Food Science, 2017, 38(21): 165-169. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721026. http://www.spkx.net.cn
收稿日期:2016-07-14
基金项目:国家自然科学基金面上项目(31071170);BIOX研究室启动资金项目(HIT0904)
作者简介:王晋(1991—),男,硕士研究生,研究方向为分子生物学。E-mail:490764656@qq.com
*通信作者:张治洲(1967—),男,教授,博士,研究方向为分子生物学、生物信息学。E-mail:15066317512@163.com