 表示。采用SPSS 20.0软件进行单因素方差分析,P<0.05表示有统计学意义。
表示。采用SPSS 20.0软件进行单因素方差分析,P<0.05表示有统计学意义。任金威,李 迪,陈启贺,刘 睿,孙靖琴,李 慧,徐 腾,李 林,李 勇*
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
摘 要:目的:探讨吉林人参低聚肽(ginseng oligopeptide,GOP)对D-半乳糖过氧化损伤大鼠抗氧化作用的影响。方法:取SD大鼠90 只,设立9 个实验组:6 个GOP剂量组(0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 g/kg mb)、1 个空白对照组、1 个乳清蛋白组(0.250 0 g/kg mb)和1 个模型对照组。除空白对照组外,其余各组每天腹腔注射D-半乳糖125 mg/kg mb,连续6 周,造成过氧化损伤模型。造模成功后继续腹腔注射D-半乳糖并连续灌胃45 d后进行血清和肝脏氧化应激指标检测。结果:GOP可以显著降低大鼠脂质氧化产物和蛋白质氧化产物水平,显著提高大鼠抗氧化酶活力和抗氧化物质含量(P<0.05),且效果优于乳清蛋白。结论:GOP对D-半乳糖所致过氧化损伤大鼠有抗氧化作用。
关键词:吉林人参低聚肽;D-半乳糖;过氧化损伤模型;抗氧化
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基和活性氮自由基产生过多,氧化程度超出氧化物的清除能力,氧化系统和抗氧化系统失衡,从而导致机体组织细胞及蛋白质和核酸等生物大分子损伤。研究证实,氧化应激可导致胰岛β细胞功能损伤及外周胰岛素抵抗,从而导致糖尿病的发生[1];并能引起内皮细胞功能障碍,导致心血管疾病[2];此外,还可引发自身免疫性疾病[3]、血液系统疾病[4]及癌症[5]等一系列疾病,给人体健康造成极大损害。因此控制氧化应激对于维持机体健康具有极其重要的作用。寻找安全有效的抗氧化物质显得尤为迫切。
目前临床应用的抗氧化药物主要有单胺氧化酶抑制剂、多巴胺受体激动剂、维生素等。这些药物均有不同程度的副作用,不宜长期服用。近年来大量研究已证实天然食物成分在抗氧化方面是安全有效的[6-7]。
生物活性肽是指对生物机体的生命活动有益或具有生理作用的肽类化合物。肽的分子结构介于氨基和蛋白质之间,是蛋白质的结构和功能片段,并使蛋白质具有数以千万计的生理功能,其本身也具有很强的生物活性[8]。低聚肽,又称为活性小分子肽,一般由10 个或10 个以下氨基酸组成。研究发现机体对低聚肽的吸收和代谢速率比对游离氨基酸快[9]。另外,生物活性肽类具有广泛的生物活性,如免疫调节、抗高血压、降胆固醇、抗氧化和清除自由基作用等。目前生物活性肽以其高效、安全的特点异军突起,逐渐显示出其在临床营养中的重要作用和广泛的应用前景[8]。
人参属名中的“Panax”来源于希腊语,意为长寿、包治百病,其应用历史可以追溯到几千年前。人参在我国药用历史悠久,由于其广泛而神奇的功效,也是人类认识和应用最早的保健佳品之一。我国现存最早的药物学专著《神农本草经》中就有记载:“人参,味甘微寒,主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智。久服,轻身延年”。《本草纲目》对人参有更为细致的记载:“补五脏血脉,益气生血,故为强壮药,能振奋精神”。2012年9月4日,我国卫生部批准人参成为新资源食品,人参的应用将由单一的中药材拓展到食品、饮料及保健产品等领域,范围大幅扩大,这为我国的人参产业发展提供了新的契机[10]。研究发现,人参可通过提高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶活性,降低丙二醛(malondialdehvde,MDA)等脂质氧化产物的含量来发挥抗氧化作用[11-14]。对人参提取物人参皂甙的研究也发现,人参皂甙Rb1[15]、Rg2[16]等具有抗氧化功能。人参低聚肽虽然作为一类重要的化合物存在于人参组织中,但其功能研究较少报道,有关其抗氧化功能的研究更是少之又少。低聚肽在人体内不需消化可直接吸收,比单个氨基酸吸收更有效,可直接参与蛋白质的合成[8],避免活性物质的浪费,提高其生理调节作用。本实验通过对过氧化损伤模型大鼠采用不同剂量的吉林人参低聚肽(ginseng oligopeptides,GOP)水溶液进行干预,观察GOP的抗氧化作用。
1.1 动物、材料与试剂
健康SPF级成年雄性SD大鼠90 只,适应期结束时,体质量(200±20)g,由北京大学医学部实验动物中心提供,动物许可证号:SCXK(京)2011-0012。分笼饲养,每笼3 只,自由饮食、饮水。动物饲养实验室符合国标清洁级,温度范围为(22±2)℃,相对湿度为50%~60%,昼夜明暗交替时间为12 h。
GOP为利用生物酶解技术从吉林人参中分离得到的小分子生物活性肽的混合物(淡黄色固体粉末),混合物主要以小分子低聚肽为主,相对分子质量小于1 000,质量分数为95.42%,由吉林肽谷生物工程有限责任公司提供。
D-半乳糖 美国Amresco公司;SOD、MDA、考马斯亮蓝、GSH-Px、8-表氢氧-异前列腺素、谷胱甘肽(glutathione,GSH)、蛋白质羰基(protein carboxyls,PCO)试剂盒 北京安迪华泰科技有限公司。
1.2 仪器与设备
高速冷冻离心机 德国艾本德股份公司;Adventurer通用型分析天平 美国奥豪斯国际贸易有限公司;电热恒温水浴锅 北京天林恒泰科技有限公司;FSH-2A可调高速电动匀浆机 金坛市金南仪器厂;722型分光光度计 上海精密科学仪器有限公司;WH-861型旋涡混合器 北京科尔德科贸有限公司。
1.3 方法
1.3.1 剂量分组及受试样品给予时间
雄性SD大鼠共分为9 个实验组,每组10 只。实验设立6 个GOP剂量组(0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 g/kg mb)、1 个空白对照组、1 个乳清蛋白组(0.250 0 g/kg mb)和1 个模型对照组。受试样品给予时间为45 d。
1.3.2 动物造模、分组及给受试物
1.3.2.1 适应期
于屏障系统下大鼠饲喂维持饲料观察7 d。
1.3.2.2 造模期
按体质量随机分成2 组,10 只大鼠作为空白对照组,其余80 只作为模型对照组。空白对照组每日腹腔注射灭菌生理盐水,注射量为0.2 mL/100 g mb,每日1 次。参照文献[17]方法制备D-半乳糖过氧化损伤大鼠模型,即模型对照组用125 mg/kg mbD-半乳糖腹腔注射造模,注射量为0.2 mL/100 g(将D-半乳糖31.25 g溶于500 mL生理盐水中配成D-半乳糖-氯化钠注射液,使用前配制,常规灭菌后使用),每日1 次,连续造模6 周,取血测MDA浓度,按MDA水平分组,随机分为1 个模型对照组、1 个乳清蛋白组和6 个GOP剂量组。
1.3.2.3 受试样品给予
分组后,6 个剂量组每天灌胃给予不同剂量GOP水溶液,空白对照组、模型对照组给予同体积蒸馏水,乳清蛋白组给予同体积乳清蛋白水溶液。在给受试样品的同时,模型对照组、乳清蛋白组和各剂量组继续给予相同剂量D-半乳糖腹腔注射,空白对照组继续给予相同剂量生理盐水腹腔注射。
实验过程中,每周各鼠称质量记录1 次,按体质量调整腹腔注射量和灌胃量。每日观察大鼠的食欲行为、状态、毛发及动物死亡情况。
1.3.3 氧化应激指标的检测
末次给灌胃及腹腔注射完毕后,大鼠禁食不禁水12 h后采血,断头处死大鼠。
1.3.3.1 血清氧化应激指标的检测
血液3 000 r/min离心10 min,取血清并按照试剂盒说明书检测8-表氢氧-异前列腺素、MDA、PCO、SOD、GSH-Px、GSH水平。
1.3.3.2 肝脏氧化应激指标的检测
冰浴剥离肝脏,除去脂肪组织,用预冷的生理盐水漂洗组织至无血色,称取相同部位组织适量,用眼科小剪刀剪碎组织块,加入相应倍数的预冷生理盐水,用匀浆机制成测试所需质量分数(10%)的组织匀浆(匀浆时间10 s/次,间隔30 s,在冰浴中进行),3 000 r/min低温离心10 min,取上清液,按照试剂盒说明书进行蛋白质、MDA、PCO、SOD、GSH-Px、GSH水平的测定。
1.4 数据统计分析
所有实验数据均以 表示。采用SPSS 20.0软件进行单因素方差分析,P<0.05表示有统计学意义。
表示。采用SPSS 20.0软件进行单因素方差分析,P<0.05表示有统计学意义。
2.1 GOP对过氧化损伤模型大鼠血清、肝组织脂质氧化产物含量的影响
由表1可知,与空白对照组相比,模型对照组大鼠血清8-表氢氧异前列腺素、MDA水平和肝脏MDA水平均有所增高,其中血清MDA水平增高极显著(P<0.01)。与模型对照组相比,乳清蛋白组大鼠血清8-表氢氧异前列腺素、MDA水平和肝脏MDA水平均无显著变化(P>0.05);GOP C、GOP D剂量组大鼠血清8-表氢氧异前列腺素水平显著降低(P<0.01,P<0.05);GOP A、D、F剂量组大鼠血清MDA水平显著降低(P<0.05);GOP A、B、D、F剂量组大鼠肝脏MDA水平显著降低(P<0.05),其中GOP A、B、F剂量组大鼠肝脏MDA水平降低极显著(P<0.01)。
表1 GOP对过氧化损伤模型大鼠血清、肝脏脂质氧化产物含量的影响(n= 10)
Table 1 Effect of GOP on lipid peroxide levels in serum and liver tissue of rats with oxidative damage (n= 10)
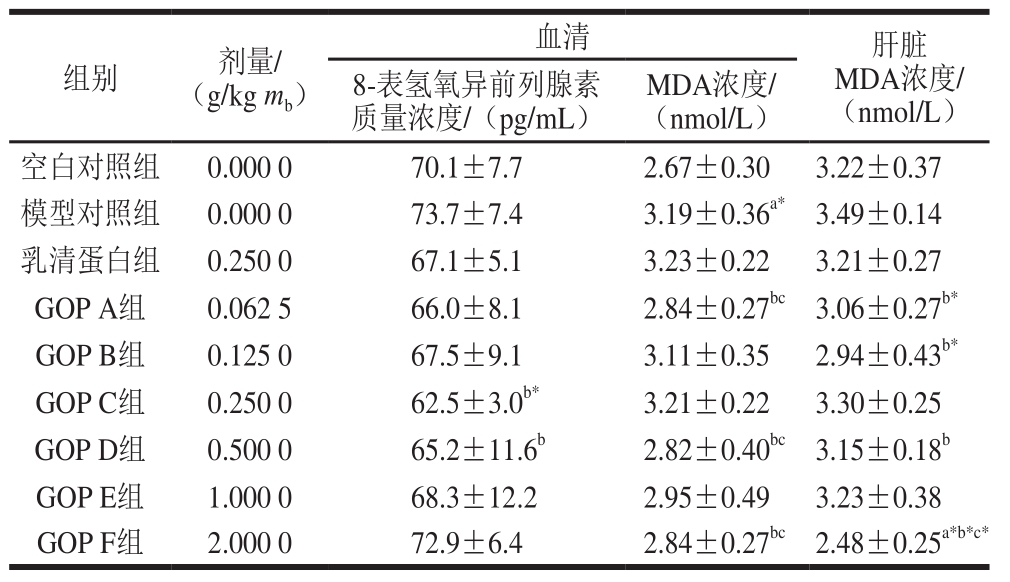
注:a.与空白对照组相比差异显著(P<0.05);a*.与空白对照组相比差异极显著(P<0.01);b.与模型对照组相比差异显著(P<0.05);b*.与模型对照组相比差异极显著(P<0.01);c.与乳清蛋白组相比差异显著(P<0.05);c*.与乳清蛋白组相比差异极显著(P<0.01)。下同。
2.2 GOP对过氧化损伤模型大鼠血清、肝组织蛋白质氧化产物含量的影响
表2 GOP对过氧化损伤模型大鼠血清、肝脏蛋白质氧化产物含量的影响(n= 10)
Table 2 Effect of GOP on protein peroxide levels in serum and liver tissue of rats with oxidative damage (n= 10)

由表2可知,与空白对照组相比,模型对照组大鼠血清PCO水平显著增高,差异有统计学意义(P<0.05)。与模型对照组相比,乳清蛋白组大鼠血清PCO水平极显著降低(P<0.01),肝脏PCO水平无显著变化(P>0.05);GOP A、C、D剂量组大鼠血清PCO水平显著降低(P<0.05),其中GOP C剂量组大鼠血清PCO水平极显著降低(P<0.01)。
2.3 GOP对过氧化损伤模型大鼠血清、肝组织抗氧化酶活力的影响
由表3可知,与空白对照组相比,模型对照组大鼠血清和肝脏SOD、GSH-Px水平均无显著变化,差异无统计学意义(P>0.05)。与模型对照组相比,乳清蛋白组大鼠血清和肝脏SOD、GSH-Px水平均无显著变化,差异无统计学意义(P>0.05);GOP E剂量组大鼠血清SOD水平极显著增高(P<0.01);GOP C、D、F剂量组大鼠肝脏SOD水平显著增高(P<0.05),其中GOP D、F剂量组大鼠肝脏SOD水平增高极显著(P<0.01);GOP D、F剂量组大鼠肝脏GSH-Px水平显著增高(P<0.05)。
表3 GOP对过氧化损伤模型大鼠血清、肝脏SOD活力、GSH-Px浓度的影响(n= 10)
Table 3 Effect of GOP on the activities of SOD and concentration of GSH-Px in serum and liver tissue of rats with oxidative damage (n= 10)

2.4 GOP对过氧化损伤模型大鼠血清、肝组织抗氧化物质含量的影响
表4 GOP对过氧化损伤模型大鼠血清、肝脏抗氧化物质含量的影响(n= 10)
Table 4 Effect of GOP on antioxidant levels in serum and liver tissue of rats with oxidative damage (n= 10)

由表4可知,与空白对照组相比,模型对照组大鼠血清和肝脏GSH水平均无显著变化,差异无统计学意义(P>0.05)。与模型对照组相比,乳清蛋白组大鼠血清和肝脏GSH水平均无显著变化,差异无统计学意义(P>0.05);GOP C剂量组大鼠血清GSH水平显著增高(P<0.05);GOP各剂量组大鼠肝脏GSH水平均无显著变化,差异无统计学意义(P>0.05)。
随着人们对自由基研究的逐步深入,许多研究证实,体内自由基含量是随着年龄的增长而积累的,但体内产生抗氧化剂和氧化酶的能力却随年龄增加而逐渐下降[18-19]。自由基的氧化可导致衰老、炎症、心脑血管疾病和肿瘤等。因此,寻找有效的抗氧化药物,减少自由基的危害,对人类的健康有着十分重要的意义。本实验通过与D-半乳糖所致过氧化损伤模型相对比,研究GOP的抗氧化作用。
单纯地增加蛋白质摄入可能会对氧化应激指标有一定的影响[20],因此本研究专门设立了乳清蛋白组作为对照,通过将GOP各剂量组与乳清蛋白组进行比较可排除因单纯提高蛋白质的摄入量而引起的假阳性结果。乳清蛋白是牛乳中酪蛋白沉淀分离时保留在上清液中的多种蛋白质组分的统称,其在消化过程中产生多种生物活性多肽,具有增强体质、提高免疫力、抗疲劳、抗氧化等多种功效[21]。但在本实验中仅观察到乳清蛋白有降低过氧化损伤模型大鼠血清PCO水平的作用,并未观察到其对脂质氧化产物、抗氧化酶活力、抗氧化物质含量的影响。
研究表明,大剂量D-半乳糖可引起多组织基因表达与调控异常、细胞增殖分化能力下降及细胞退行性改变等,其机制可能是D-半乳糖诱导活性氧产生增多,脂质过氧化亢进,产生超氧阴离子自由基[22]。同时脂质过氧化分解产物MDA能使DNA、蛋白质发生交联,影响细胞的分裂,破坏蛋白质和酶的结构、功能[23],因此,检测MDA的含量常可反映机体脂质过氧化的程度,同时也可间接地反映出细胞损伤程度。从实验结果可知,与正常对照组大鼠相比,过氧化损伤模型组大鼠的血清MDA浓度极显著升高(P<0.01),说明由D-半乳糖所致过氧化损伤模型组大鼠已经出现了一定程度的细胞损伤,同时也表明本研究的过氧化损伤模型制备成功。与模型对照组相比,乳清蛋白组大鼠血清8-表氢氧异前列腺素、MDA水平和肝脏MDA水平均无显著变化(P>0.05);GOP C、D剂量组大鼠血清8-表氢氧异前列腺素水平显著降低(P<0.01,P<0.05);GOP A、D、F剂量组大鼠血清MDA水平显著降低(P<0.05);GOP A、B、D、F剂量组大鼠肝脏MDA水平显著降低(P<0.05)。说明GOP具有抑制MDA生成,减少细胞损伤的作用。
H2O2或O2-·对蛋白质氨基酸侧链的氧化可导致羰基产物的积累。羟自由基也可直接作用于肽链,使肽链断裂,引起蛋白质一级结构的破坏,在断裂处产生羰基。羰基化蛋白极易相互交联、聚集为大分子从而降低或失去原有蛋白质的功能。PCO形成是多种氨基酸在蛋白质的氧化修饰过程中的早期标志,且化学性质稳定,并随着年龄的增长而增加[24-25]。检测PCO含量可直接反映蛋白质损伤的程度[26]。本实验结果显示,与模型对照组相比,乳清蛋白组大鼠血清PCO水平极显著降低(P<0.01),而肝脏PCO水平无显著变化(P>0.05);GOP A、C、D剂量组大鼠血清PCO水平显著降低(P<0.01,P<0.05)。提示GOP可以保护蛋白质免受氧化损伤。GSH-Px在机体内广泛存在,能够特异性地催化还原型谷胱甘肽对过氧化氢的还原反应,从而保护细胞膜结构和功能的完整性。SOD是一种能够清除超氧阴离子自由基的重要的酶,可以保护细胞免受氧化损伤[27]。从实验结果可知,与模型对照组相比,乳清蛋白组大鼠血清和肝脏SOD、GSH-Px水平均无显著变化(P>0.05);GOP E剂量组大鼠血清SOD水平极显著升高(P<0.01);GOP C、D、F剂量组大鼠肝脏SOD水平极显著升高(P<0.01);GOP D、F剂量组大鼠肝脏GSH-Px水平显著升高(P<0.05)。说明GOP能够通过提高SOD和GSH-Px的水平来减少自由基的氧化,并起到保护细胞膜的作用。
GSH是谷氨酸、甘氨酸和半胱氨酸组成的一种三肽,是组织中主要的非蛋白质的巯基化合物[28-29],能够稳定含巯基的酶,有利于酶活力的发挥。此外,GSH还是一种低分子清除剂,它可清除O2-·、H2O2、LOOH,保护DNA、蛋白质及其他辅助因子免受氧化损伤[30]。本研究结果显示,与模型对照组相比,乳清蛋白组大鼠血清和肝脏GSH水平均无显著变化(P>0.05);GOP C剂量组大鼠血清GSH水平显著增高(P<0.05)。提示GOP可以通过提高GSH的水平来减少体内氧化应激水平,保护抗氧化酶活力。总之,GOP能够增强机体的抗氧化能力,具备作为一种新型抗氧化制剂的潜力,有关其抗氧化作用的深层机制尚有待进一步的研究与探讨。
参考文献:
[1] WANG X, ZHAO L H. Calycosin ameliorates diabetes-induced cognitive impairments in rats by reducing oxidative stress via the PI3K/Akt/GSK-3beta signaling pathway[J]. Biochemical and Biophysical Research Communications, 2016, 473(2): 428-434.DOI:10.1016/j.bbrc.2016.03.024.
[2] DE PICCIOTTO N E, GANO L B, JOHNSON L C, et al.Nicotinamide mononucleotide supplementation reverses vascular dysfunction and oxidative stress with aging in mice[J]. Aging Cell,2016, 15(3): 522-530. DOI:10.1111/acel.12461.
[3] BILLER-TAKAHASHI J D, TAKAHASHI L S, MINGATTO F E, et al.The immune system is limited by oxidative stress: dietary selenium promotes optimal antioxidative status and greatest immune defense in pacu Piaractus mesopotamicus[J]. Fish and Shellfish Immunology,2015, 47(1): 360-367. DOI:10.1016/j.fsi.2015.09.022.
[4] MORET-TATAY I, IBORRA M, CERRILLO E, et al. Possible biomarkers in blood for Crohn’s disease: oxidative stress and microRNAs-current evidences and further aspects to unravel[J].Oxidative Medicine and Cellular Longevity, 2016, 2016: 1-9.DOI:10.1155/2016/2325162.
[5] MAMEDE A C, GUERRA S, LARANJO M, et al. Oxidative stress,DNA, cell cycle/cell cycle associated proteins and multidrug resistance proteins: targets of human amniotic membrane in hepatocellular carcinoma[J]. Pathology Oncology Research, 2016, 22(4): 689-697.DOI:10.1007/s12253-016-0053-x.
[6] TANG Y, LI S Y, ZHANG P, et al. Soy isoflavone protects myocardial ischemia/reperfusion injury through increasing endothelial nitric oxide synthase and decreasing oxidative stress in ovariectomized rats[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 1-14.DOI:10.1155/2016/5057405.
[7] ASEMI Z, SOLEIMANI A, SHAKERI H, et al. Effects of omega-3 fatty acid plus alpha-tocopherol supplementation on malnutritioninflammation score, biomarkers of inflammation and oxidative stress in chronic hemodialysis patients[J]. International Urology & Nephrology,2016, 48(11): 1887-1895. DOI:10.1007/s11255-016-1399-4.
[8] 李勇. 肽临床营养学[M]. 北京: 北京大学医学出版社, 2012: 2.
[9] 李勇, 蔡木易. 肽营养学[M]. 北京: 北京大学医学出版社, 2012: 1.
[10] 鲍雷, 王军波, 张远, 等. 吉林人参低聚肽对雄性小鼠性功能影响的实验研究[J]. 中国预防医学杂志, 2015(10): 757-760. DOI:10.16506/j.1009-6639.2015.10.010.
[11] DELUI M H, FATEHI H, MANAVIFAR M, et al. The effects of Panax ginseng on lipid profile, pro-oxidant: antioxidant status and high-sensitivity c reactive protein levels in hyperlipidemic patients in Iran[J]. International Journal of Preventive Medicine, 2013, 4(9):1045-1051.
[12] DONG G Z, JANG E J, KANG S H, et al. Red ginseng abrogates oxidative stress via mitochondria protection mediated by LKB1-AMPK pathway[J]. BMC Complementary and Alternative Medicine,2013, 13: 1-9. DOI:10.1186/1472-6882-13-64.
[13] LEE M R, YUN B S, SUNG C K. Comparative study of white and steamed black Panax ginseng, P. quinquefolium, and P. notoginseng on cholinesterase inhibitory and antioxidative activity[J]. Journal of Ginseng Research, 2012, 36(1): 93-101.DOI:10.5142/jgr.2012.36.1.93.
[14] KIM H G, YOO S R, PARK H J, et al. Antioxidant effects of Panax ginseng C.A. Meyer in healthy subjects: a randomized, placebocontrolled clinical trial[J]. Food and Chemical Toxicology, 2011,49(9): 2229-2235. DOI:10.1016/j.fct.2011.06.020.
[15] YE J, YAO J P, WANG X, et al. Neuroprotective effects of ginsenosides on neural progenitor cells against oxidative injury[J].Molecular Medicine Reports, 2016, 13(4): 3083-3091. DOI:10.3892/mmr.2016.4914.
[16] FU W, SUI D, YU X, et al. Protective effects of ginsenoside Rg2 against H2O2-induced injury and apoptosis in H9c2 cells[J].International Journal of Clinical and Experimental Medicine, 2015,8(11): 19938-19947.
[17] 姜国良, 于晓, 徐恺, 等. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中国老年学杂志, 2013, 33(5): 1101-1103. DOI:10.3969/j.issn.1005-9202.2013.05.051.
[18] MARTÍNEZ-CISUELO V, GÓMEZ J, GARCIÍA-JUNCEDA I,et al. Rapamycin reverses age-related increases in mitochondrial ROS production at complex Ⅰ, oxidative stress, accumulation of mtDNA fragments inside nuclear DNA, and lipofuscin level, and increases autophagy, in the liver of middle-aged mice[J]. Experimental Gerontology, 2016, 83: 130-138. DOI:10.1016/j.exger.2016.08.002.
[19] SANCHEZ-ROMAN I, GÓMEZ A, PÉREZ I, et al. Effects of aging and methionine restriction applied at old age on ROS generation and oxidative damage in rat liver mitochondria[J]. Biogerontology, 2012,13(4): 399-411. DOI:10.1007/s10522-012-9384-5.
[20] SOHRABI Z, EFTEKHARI M H, ESKANDARI M H, et al.Intradialytic oral protein supplementation and nutritional and inflammation outcomes in hemodialysis: a randomized controlled trial[J]. American Journal of Kidney Diseases, 2016, 68(1): 122-130.DOI:10.1053/j.ajkd.2016.02.050.
[21] 蒲玲玲, 郭长江. 乳清蛋白的组成及其主要保健功能[J]. 中国食物与营养, 2011, 17(6): 68-70. DOI:10.3969/j.issn.1006-9577.2011.06.018.
[22] KEMPNER E S, WHITTAKER J W, MILLER J H. Radiation inactivation of galactose oxidase, a monomeric enzyme with a stable free radical[J]. Protein Science, 2010, 19(2): 236-241. DOI:10.1002/pro.302.
[23] KAIRANE C, ROOTS K, UUSMA T, et al. Regulation of the frontocortical sodium pump by Na+in Alzheimer’s disease:difference from the age-matched control but similarity to the rat model[J]. FEBS Letters, 2002, 531(2): 241-244. DOI:10.1016/S0014-5793(02)03510-X.
[24] GRUBER J, NG L F, FONG S, et al. Mitochondrial changes in ageing Caenorhabditis elegans: what do we learn from superoxide dismutase knockouts?[J]. PLoS ONE, 2011, 6(5): 1-16. DOI:10.1371/journal.pone.0019444.
[25] PANDEY K B, MEHDI M M, MAURYA P K, et al. Plasma protein oxidation and its correlation with antioxidant potential during human aging[J]. Disease Markers, 2010, 29(1): 31-36. DOI:10.3233/DMA-2010-0723.
[26] 王志辉, 王燕一. 蛋白质羰基与衰老疾病关系的研究进展[J]. 中华老年口腔医学杂志, 2015, 13(1): 47-50. DOI:10.3969/j.issn.1672-2973.2015.01.018.
[27] DONG A L, SHEN J K, KRAUSE M, et al. Superoxide dismutase 1 protects retinal cells from oxidative damage[J]. Journal of Cellular Physiology, 2006, 208(3): 516-526. DOI:10.1002/jcp.20683.
[28] 贾贞, 王丹, 游松. 谷胱甘肽的研究进展[J]. 沈阳药科大学学报,2009(3): 238-242. DOI:10.14066/j.cnki.cn21-1349/r.2009.03.013.
[29] 王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展[J]. 中国生物工程杂志, 2014, 34(7): 89-95. DOI:10.13523/j.cb.20140714.
[30] JONES D P. Redefining oxidative stress[J]. Antioxidants & Redox Signaling, 2006, 8(9/10): 1865-1879. DOI:10.1089/ars.2006.8.1865.
Antioxidant Effect of Oligopeptide Extracted from Panax ginseng Grown in Jilin Province
REN Jinwei, LI Di, CHEN Qihe, LIU Rui, SUN Jingqin, LI Hui, XU Teng, LI Lin, LI Yong*
(Department of Nutrition and Food Hygiene, School of Public Health, Peking University, Beijing 100191, China)
Abstract:Purpose: To investigate the antioxidant effect of oligopeptide extracted from Panax ginseng grown in Jilin
province (GOP) on rats with D-galactose-induced oxidative damage. Methods: In total, 90 specific pathogen free (SPF)male SD rats were randomly divided into 9 groups: control group, model group, whey protein group, and six GOP groups with different doses. The rats in all groups except the control group were subjected to intraperitoneal injection of 125 mg/kg D-galactose for 6 weeks. Then, the rats in the six GOP groups were gavaged with 0.062 5, 0.125 0, 0.250 0, 0.500 0,1.000 0 and 2.000 0 g/kg mbGOP, respectively, while those in the control and model groups were gavaged with the same volume of distilled water. The rats in the whey protein group were gavaged with 0.250 0 g/kg mbwhey protein. The administration lasted for 45 days. At the same time, the rats in all groups except the control group were injected with D-galactose 125 mg/kg mbuninterruptedly. Thereafter, the oxidative stress parameters in serum and liver tissue were determined. Results: The levels of lipid peroxide and protein peroxide in the GOP groups were significantly lower than those in the model group. Meanwhile, the antioxidant enzyme activities and the antioxidant levels significantly increased compared with the model group (P 〈 0.05), and the antioxidant effect of GOP was better than that of whey protein. Conclusion: GOP has an antioxidant effect on rats with D-galactose-induced oxidative damage.
Key words:oligopeptide extracted from Panax ginseng grown in Jilin province (GOP); D-galactose; oxidative damage model; antioxidant
DOI:10.7506/spkx1002-6630-201721031
中图分类号:R151.2
文献标志码:A
文章编号:1002-6630(2017)21-0195-06
引文格式:任金威, 李迪, 陈启贺, 等. 吉林人参低聚肽的抗氧化作用[J]. 食品科学, 2017, 38(21): 195-200.
DOI:10.7506/spkx1002-6630-201721031. http://www.spkx.net.cn
REN Jinwei, LI Di, CHEN Qihe, et al. Antioxidant effect of oligopeptide extracted from Panax ginseng grown in Jilin province[J]. Food Science, 2017, 38(21): 195-200. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721031. http://www.spkx.net.cn
收稿日期:2016-08-28
基金项目:“十一五”国家科技支撑计划项目(2006BAD27B08)
作者简介:任金威(1988—),男,硕士研究生,研究方向为生物活性肽与健康。E-mail:ren_jinwei@126.com
*通信作者:李勇(1958—),男,教授,博士,研究方向为营养与疾病。E-mail:liyongbmu@163.com