武瑞赟1,2,刘 蕾2,张金兰2,陈贵林1,*,李平兰2,*
(1.内蒙古大学生命科学学院,内蒙古 呼和浩特 010021;2.中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:探究鲟鱼硫酸软骨素对结直肠癌细胞的生长抑制能力,并初步确定影响结直肠癌细胞生长的主要原因。选取3 株具有代表性的结直肠癌细胞Caco-2、HCT-116、SW480,采用CCK-8法测定细胞生长曲线、硫酸软骨素对癌细胞增殖的抑制能力;以其中一株结直肠癌细胞HCT-116为模型,用流式细胞仪测定其周期和凋亡情况,用细胞核染色法观察处理前后细胞形态,结合caspase-3凋亡酶活力的测定,考察鲟鱼硫酸软骨素对结直肠癌细胞的促凋亡能力,并初步确定作用途径。研究结果表明,鲟鱼硫酸软骨素对结直肠癌细胞Caco-2、HCT-116、SW480的增殖具有一定抑制作用,最高抑制率分别为70.94%、90.00%和75.00%,明显高于阳性对照处理组;处理后,细胞周期G1/G0期比例升高至88.56%,S期比例降低至4.47%,阻滞细胞G1/G0期;同时,使用鲟鱼硫酸软骨素处理细胞后,细胞形态发生变化,出现细胞核固缩以及细胞破碎等现象,细胞主要的凋亡酶活力显著升高,酶活力可达1 645 IU/µg,使细胞发生凋亡,凋亡率可达63.73%。研究结果证明,鲟鱼硫酸软骨素具有促进结直肠癌细胞凋亡、抑制细胞增殖的能力。
关键词:鲟鱼硫酸软骨素;结直肠癌;细胞增殖;凋亡
硫酸软骨素(chondroitin sulfate,CS)是存在于人和动物软骨、结缔组织中的具有特殊生物活性的酸性黏多糖[1],由于CS具有显著的亲软骨性,当其进入机体后,可优先进入软骨组织,起到保护软骨的作用;此外,CS可以通过抑制某些有害的溶酶体酶和蛋白水解酶(如N-乙酰胺基葡萄糖苷酶、弹性酶等)的活性[2],降低酶对关节组织的损伤,通过促进机体对钙的吸收和沉淀,增加机体骨骼强度,促进骨骼生长;当CS在血液中达到一定浓度时,可竞争性地与脂蛋白发生结合,降低发生动脉硬化的几率。因此,CS临床上主要用于预防和治疗关节炎、免疫调节、调脂、降脂、抗动脉粥样硬化以及神经元的保护和修复作用[3-8]。
市面上较常见的CS多提取自鲨鱼软骨[9],随着人们的过度捕捞,鲨鱼资源日趋匮乏,鲨鱼CS的取得难度增加[10]。素有“活化石”之称的鲟鱼是现在世界上最大、最原始的软骨硬磷鱼类[11]。其营养丰富,富含多种氨基酸,蛋白含量高[12],尤其是它的头、脊索、鳍中软骨占鱼体的10%左右,近年来,鲟鱼养殖业不断兴起,我国现已成为世界上第一鲟鱼养殖大国,且鲟鱼软骨中CS含量丰富[13-14],因此,鲟鱼可以作为CS的新来源。
随着经济的发展,人们生活水平的提高,生活习惯及饮食结构的改变,使得肠道紊乱、慢性肠道疾病以及肠道癌症等问题不断出现,并且影响着人们的健康[15-16]。在漫长的治疗过程中,治疗效果不理想、药物毒性的积累等问题日益突出[17],因此,寻找具有预防、治疗或辅助治疗肠道疾病的生物活性物质已成为急需解决的问题。前期的研究中,对鲟鱼CS的提取和纯化工艺进行了优化,提取工艺简单,提取后,CS得率、纯度高,为后续实验开展提供了很好的原材料。本研究选用从鲟鱼脊骨中提取纯化CS,对结直肠癌细胞增殖、周期和凋亡进行了测定,研究结果可为水生生物活性物质的开发利用提供参考。
1.1 材料与试剂
人结直肠癌细胞Caco-2、SW480、HCT-116 中国医学科学院基础医学研究所;人工养殖鲟鱼 北京怀柔区鲟鱼养殖基地。
DMEM培养基、磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Corning公司;胰蛋白酶-乙二胺四乙酸消化液(0.25%) 北京索莱宝科技有限公司;细胞增殖Cell Counting Kit-8(CCK-8)试剂盒、细胞周期检测试剂盒、Annexin V-FITC细胞凋亡试剂盒、Hoechst 33258染色液、caspase-3活力检测试剂盒 上海碧云天生物技术有限公司;碱性蛋白酶 北京奥博星生物技术有限责任公司;CS提取专用酶 诺维信中国生物技术有限公司;三氯乙酸、无水乙醇、氯化钠 北京化学试剂公司;氯化十六烷基吡啶 国药集团化学试剂有限公司;鱼CS酶联免疫试剂盒 上海酶联生物科技有限公司;5-氟脲嘧啶 武汉制药集团股份有限公司。
1.2 仪器与设备
倒置显微镜 重庆奥特光学仪器有限责任公司;流式细胞分析仪 美国BD公司;激光共聚焦显微镜德国Zeiss公司;Imark酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 鲟鱼CS制备
将鲟鱼脊柱放入锅中水煮1 h,取出冷却后剔除脊索软骨上残留的肌肉、脂肪和其他结缔组织,切碎后转移至烧杯中,加95%乙醇浸泡2 h,移出乙醇,重复浸泡一次。冷却干燥后的软骨称质量,粉碎,备用。
将制得的软骨粉按1∶25(m∶V)溶于pH 7的碳酸钠溶液中,加入75 mL的CS提取专用酶,温控60 ℃,搅拌2~3 h后煮沸使酶失活,待溶液冷却后向其中加入125 mg的碱性蛋白酶,温控60 ℃,搅拌2~3 h后煮沸使酶失活。
将上述步骤中的酶解液过滤,冷却滤液后加入6.1 mol/mL的三氯乙酸静置3 h后,10 000 r/min离心10 min去蛋白质,向所得上清液中加入75%乙醇,静置1 h后10 000r/min离心10 min收集沉淀,80 ℃烘干制得CS粗品。
将所得CS粗品溶于水后加氯化十六烷基吡啶,室温静置2 h,10 000 r/min离心10 min收集沉淀,并将沉淀溶于氯化钠溶液中,加入乙醇,10 000 r/min离心10 min收集沉淀,去离子水溶解沉淀后经透析袋透析纯化24 h后冷冻干燥,制得CS纯品。CS得率根据式(1)计算。
CS纯度的测定按照鱼CS酶联免疫试剂盒说明书进行。
1.3.2 细胞复苏培养
Caco-2、HCT-116、SW480细胞从液氮管中取出,迅速置于37 ℃水浴中,不断摇动细胞冻存管快速解冻。将解冻后的细胞快速转移至15 mL的离心管中,加入DMEM培养液重悬细胞后,转移至无菌的细胞培养瓶中,37 ℃、5% CO2条件下培养,待细胞长至80%以上,进行传代,传至3 代以上后用于实验。
1.3.3 细胞生长曲线的测定
细胞经胰蛋白酶消化后,轻轻吹打使其分散成单个细胞,进行细胞计数,稀释到5×104个/mL;将细胞悬液加入96 孔细胞培养板中,每孔100 µL,置于37 ℃、5% CO2培养箱中,每2 h取出后加入10 µL的CCK-8,于37 ℃避光反应4 h;用酶标仪测定OD450nm,绘制细胞生长曲线。
1.3.4 细胞增殖检测
细胞经胰蛋白酶消化后,轻轻吹打使其分散成单个细胞,进行细胞计数,稀释到5×104个/mL;将细胞悬液加入96 孔细胞培养板中,每孔100 µL,置于37 ℃、5% CO2培养箱中贴壁过夜培养;弃去原细胞培养液,处理组每孔加入100 µL不同质量浓度的鲟鱼CS(50、100、200、400、800、1 000 µg/mL),另设不添加任何受试物只加有细胞的对照组和不加细胞的空白组,同时设置50 µg/mL 5-氟脲嘧啶(5-fluorouracil,5-FU)为阳性对照组。每个质量浓度设6 个平行,继续培养24 h。药物处理结束,每孔添加10 µL的CCK-8试剂,于37 ℃避光反应4 h;用酶标仪于450 nm波长处测定吸光度,根据式(2)计算细胞抑制率。
1.3.5 细胞周期的测定
细胞以1×106个/mL接种于6 孔细胞培养板,置于37 ℃、5% CO2培养箱中贴壁过夜培养。吸去原细胞培养液,每孔加入1 mL不同质量浓度的鲟鱼CS(100、200、400 µg/mL),另设不添加任何受试物只加有细胞的对照组,处理24 h后,做如下处理:每孔添加0.5 mL胰蛋白酶消化贴壁细胞,并使细胞成单个细胞,收集细胞于15 mL离心管中,1 000 r/min离心5 min;加入1 mL 4 ℃预冷的PBS重悬细胞;再次1 000 r/min离心5 min后,加入1 mL 4 ℃预冷的70%乙醇固定细胞,4 ℃过夜;1 000 r/min离心5 min,弃去乙醇,加入1 mL 4 ℃预冷的PBS洗涤细胞2 次,1 000 r/min离心5 min,弃去上清液;每管中加入0.5 mL碘化丙啶染色液,37 ℃避光孵育30 min,使用激发波长为488 nm的流式细胞仪检测。
1.3.6 细胞凋亡的测定
细胞以5×105个/mL接种于6 孔细胞培养板,置于37 ℃、5% CO2培养箱中贴壁过夜。吸去原细胞培养液,每孔加入1 mL不同质量浓度的鲟鱼CS(100、200、400 µg/mL),另设不添加任何受试物,只加有细胞的对照组,处理24 h后,做如下处理:每孔添加0.5 mL胰蛋白酶消化贴壁细胞,并使细胞成单个细胞,收集细胞于15 mL离心管中,1 000 r/min离心5 min;加入1 mL 4 ℃预冷的PBS洗涤细胞2~3 次;加入195 µL Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)结合液轻轻重悬细胞,并转移至1.5 mL无菌离心管中;加入5 µL Annexin V-FITC,轻轻混匀,室温条件下孵育15 min;加入10 µL碘化丙啶染色液,轻轻混匀,室温条件下避光孵育10 min,用流式细胞仪进行检测。
1.3.7 细胞核Hoechst染色
细胞以5×105个/mL的密度接种于20 mm玻璃细胞培养皿中,37 ℃、5% CO2贴壁过夜培养。每孔加入1 mL不同质量浓度的鲟鱼CS(100、200、400 µg/mL),另设不添加任何受试物只加有细胞的对照组,处理24 h后,弃去培养液,每皿中加入1 mL预冷的70%乙醇,室温固定10 min;弃去固定液,PBS洗去残留的乙醇溶液;加入1 mL Hoechst 33258染色液,室温避光孵育20 min;弃去染色液,PBS洗涤细胞2 次;选择激发波长为350 nm,发射波长为460 nm,激光共聚焦显微镜下观察、拍照。
1.3.8 caspase-3活力测定
细胞以5×105个/mL种于6 孔培养板中,在DMEM完全培养基中培养,待细胞贴壁12 h后,加入不同质量浓度的CS,另设不加任何刺激物的对照组。培养24 h后,胰蛋白酶消化细胞,经PBS洗涤一次后,裂解细胞测定caspase-3活力。在冰浴条件下,加入细胞裂解液,冰浴裂解15 min后,4 ℃、12 000 r/min离心20 min,收集上清液。向收集好的上清液中加入底物乙酰天冬氨酸-硝基苯胺(acetyl-Asp-Glu-Val-Asp-p-nitroanilide,Ac-DEVD-pNA),37 ℃孵育2 h,用酶标仪测定A405nn。最终的caspase-3酶活力单位定义为每微克蛋白样品在37 ℃、2 h内作用于底物Ac-DEVD-pNA所产生的pNA的物质的量。
1.4 数据统计分析
所有测试重复进行平行实验3 次,用GraphPad Prism 5.0软件进行统计分析和作图。
2.1 CS的纯度
将经透析袋透析,冷冻干燥后的CS沉淀溶于DMEM培养基后,使用试剂盒测定其含量,绘制标准曲线,得回归方程y=0.014x+0.089 1,R2=0.999 3,回归性良好,说明采用此方法可以有效测定CS含量。使用酶标仪对提取CS的OD值进行检测并计算相应的CS含量及纯度,计算所得鲟鱼CS得率为19.1%、纯度为96.39%,纯度较高。
2.2 细胞生长曲线
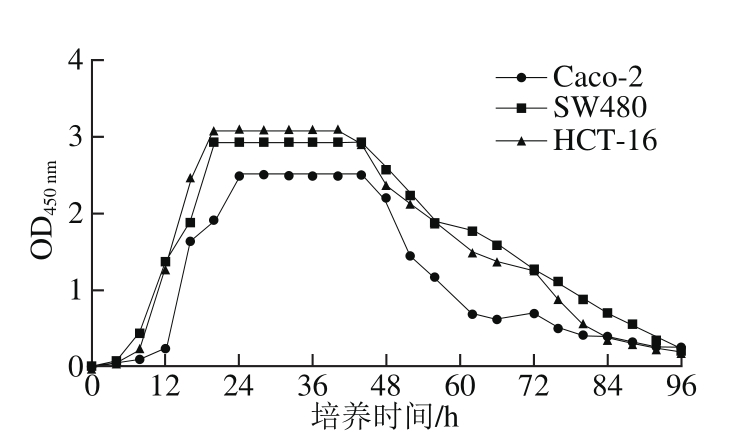
图1 3 株结直肠癌细胞生长曲线
Fig. 1 Growth curves of three colorectal cancer cells
由图1可知,细胞增生数随培养时间延长呈现先增多后减少的趋势。3 株结直肠癌细胞的增生数均在接种细胞20 h左右达到最大值,随后细胞增殖状态稳定,此后,细胞贴壁能力下降,细胞增生数开始呈下降趋势。Albrektsen等[18]研究发现,一般细胞传代之后,经过短暂的悬浮后,细胞沉降贴壁,随后经过不同时间细胞大量发生分裂,细胞生长增殖。Kariagina等[19]为了准确地描述整个过程中细胞数目的动态变化,将典型的生长曲线划分为生长缓慢的潜伏期、斜率较大的指数生长期、呈平台状的平顶期及退化衰亡4 个部分。研究结果表明细胞在0~10 h内恢复贴壁能力,10~24 h进入生长对数期,此时细胞活力最强,24~44 h为生长平稳期,之后细胞活力减弱,细胞退化死亡。这与Kariagina等[19]分析的细胞生长变化一致,该结果表明实验细胞接种密度合适,细胞自身稳定生长,适合在观察细胞生长变化等的实验中应用,同时细胞生长曲线的测定为实验给药时间点以及药物处理时间的选择提供了依据。
2.3 鲟鱼CS对结直肠癌细胞增殖的影响

图2 鲟鱼CS对结直肠癌细胞增殖的影响
Fig. 2 Inhibitory effect of sturgeon chondroitin sulfate on the growth of colorectal cancer cells
利用CCK-8试剂盒测定并计算不同质量浓度头骨、脊骨CS以及5-FU分别作用3 株结直肠癌细胞24 h后的细胞存活率,结果见图2。不同质量浓度的CS均能够在不同程度上降低结直肠癌细胞的存活率,且抑制率呈现剂量依赖效应。
鲟鱼CS对结直肠癌细胞Caco-2的最大抑制率为70.94%;对结直肠癌细胞SW480的最大抑制率为75.00%;对结直肠癌细胞HCT-116的最大抑制率可达90.00%。同时对比阳性对照5-FU的抑制效果,结果发现鲟鱼CS对结直肠癌细胞生长的抑制率均大于阳性对照5-FU的作用,阳性对照5-FU对3 种结直肠癌细胞的抑制能力分别为21.03%、18.03%和22.06%。说明鲟鱼CS具有抑制结直肠癌细胞增殖的潜力。
2.4 鲟鱼CS对结直肠癌细胞周期的影响
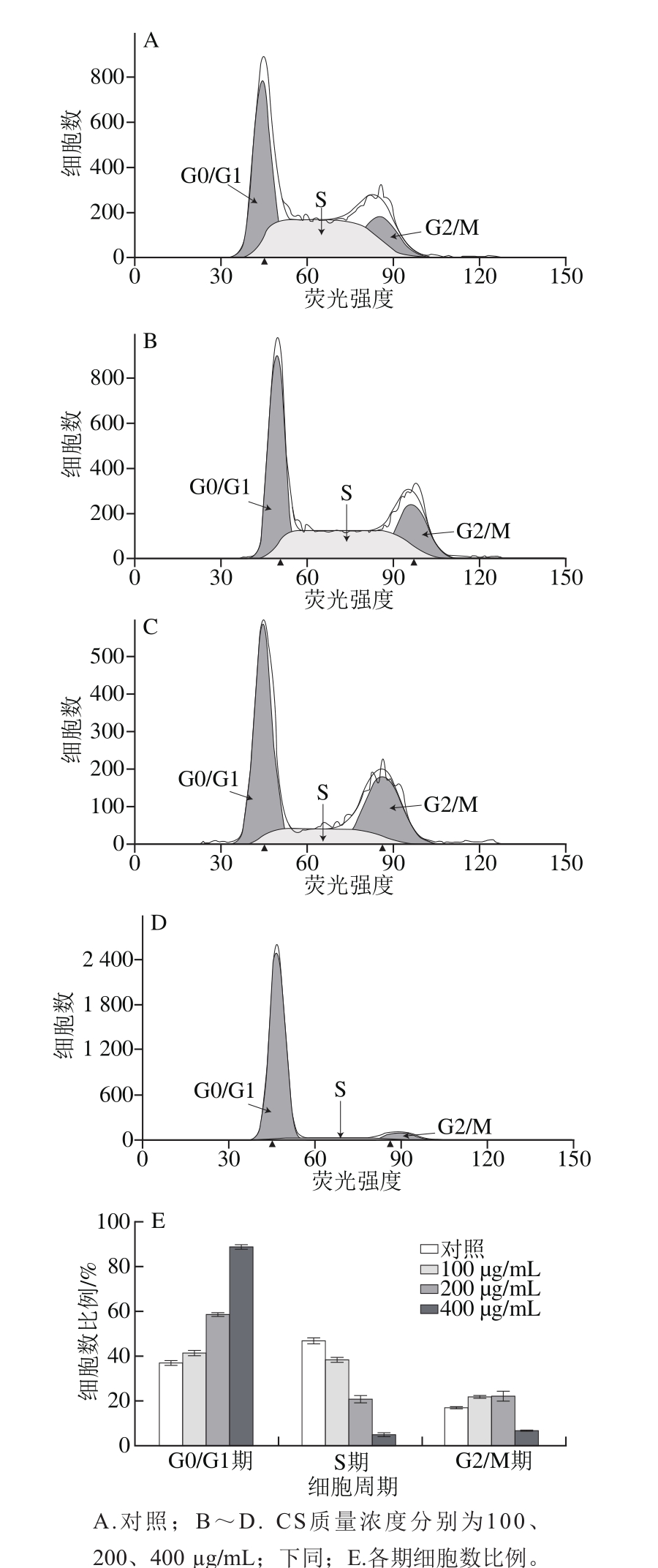
图3 鲟鱼CS对结直肠癌细胞HCT-116周期分布的影响
Fig. 3 Effect of sturgeon chondroitin sulfate on cell cycle distribution of colorectal cancer HCT-116 cells
一个完整的细胞周期包括:间隔期(G1)、DNA合成期(S)、第二时间间隔期(G2)和细胞分裂期(M)[20-21]。结合前期细胞增殖实验结果,选择了抑制效果相对最好的一株具有代表性的结直肠癌细胞HCT-116,研究不同质量浓度鲟鱼CS对结直肠癌细胞周期的影响,实验结果如图3所示。结果表明,与对照组相比,3 个质量浓度的鲟鱼脊骨CS可以提高处于G0/G1期的细胞比例,结直肠癌细胞CT-116 G0/G1期细胞比例由36.31%提高至88.56%,S期比例由47.16%下降至4.47%,说明鲟鱼CS处理细胞后,可以改变细胞周期分布,使细胞周期发生阻滞。Lee等[22]指出,G1~S期的检测是细胞周期中重要的检测,决定细胞是否可以进行DNA的合成。Mirjany等[23]研究表明,阿司匹林是通过诱导G1期阻滞来抑制细胞增殖的。因此,从实验结果可以看出,G0/G1期的细胞比例增加,说明鲟鱼CS使细胞发生G0/G1期阻滞,进而降低进入DNA合成期的细胞数量,从而抑制结直肠癌细胞增殖。
2.5 鲟鱼CS对结直肠癌细胞凋亡活性的影响
采用流失细胞仪测定鲟鱼CS(100、200、400 µg/mL)处理结直肠癌细胞HCT-116后细胞的凋亡情况,由图4结果可知,鲟鱼CS可以抑制结直肠癌细胞生长,与对照相比,3 个质量浓度的CS均可以提高结直肠癌细胞的总凋亡率,可由最初的10.01%升高到63.73%,晚期凋亡细胞增长比例大于早期凋亡细胞,说明鲟鱼CS可以引起细胞凋亡的发生,且不会引起细胞坏死的发生。
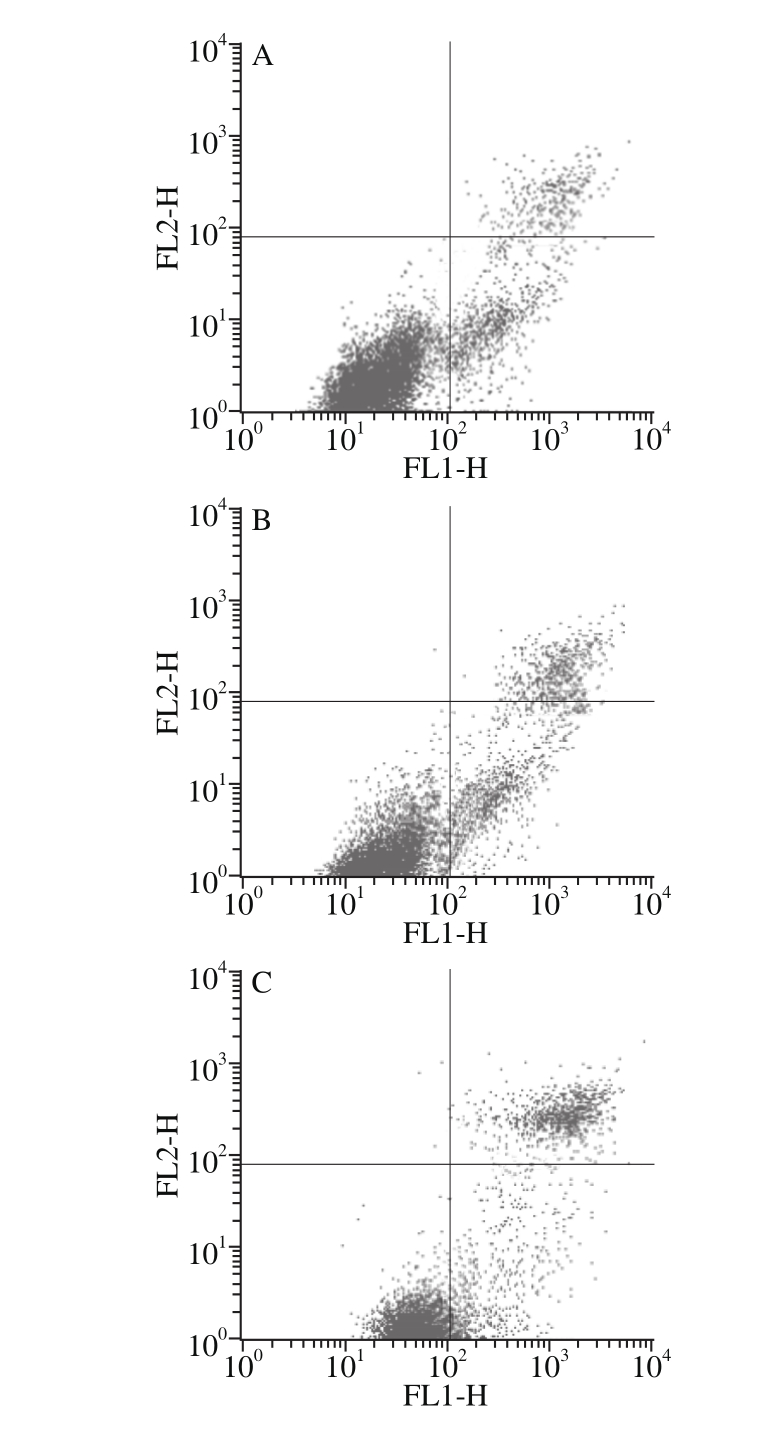

图4 鲟鱼CS对结直肠癌细胞HCT-116的促凋亡作用
Fig. 4 Sturgeon chondroitin sulfate induced apoptosis of colorectal cancer HCT-116 cells
2.6 细胞核形态
通过前面实验,发现CS作用结直肠癌细胞后,引起细胞凋亡率增加,细胞凋亡可使细胞形态发生变化,采用Hoechst进行染色后,激光共聚焦显微镜下观察细胞形态如图5所示,与对照组相比,不同质量浓度处理后,细胞膜通透性改变,膜结构被破坏[24],细胞核呈致密浓染或碎状的致密浓染,表明这些细胞已经发生了凋亡或晚期凋亡。而且,浓染细胞数目随CS质量浓度的增加而增加,贴壁细胞数目也有所减少。说明鲟鱼CS作用结直肠癌细胞后,可以引起细胞形态发生改变、染色质固缩等变化,从而引起细胞的凋亡。

图5 鲟鱼CS处理后结直肠癌细胞HCT-116的细胞核Hoechst染色
Fig. 5 Examination of chondroitin sulfate-treated HCT-116 cells by nuclear Hoechst staining
2.7 caspase-3活性
细胞内凋亡执行酶被激活,诱导细胞发生凋亡[25]。CS作用于结直肠癌细胞24 h后,测定caspase-3的活力,结果如图6所示,与空白对照组相比,CS作用结肠癌细胞后可以显著提高细胞的caspase-3活力,在鲟鱼CS质量浓度为400 µg/mL时,酶活力达到1 645 IU/μg,且存在剂量效应关系,随剂量的增加酶活力增加。细胞生长受抑制,表现为细胞凋亡的发生,细胞凋亡涉及细胞形态、生化特征、分子水平等一系列的变化[26-28]。caspase-3是caspase家族下游的关键效应分子,Holland-Nell等[29]指出,caspase-3通过剪切聚腺苷二磷酸核糖聚合酶导致细胞DNA发生裂解,促使细胞凋亡。Altonsy等[30]的研究中也有相似报道。酶活力检测结果说明,鲟鱼CS作用于结直肠癌细胞后,可以使细胞内凋亡酶caspase-3活力升高,诱导细胞凋亡的发生。

图6 鲟鱼CS对结直肠癌细胞HCT-116 caspase-3活力的影响
Fig. 6 Effect of chondroitin sulfate on caspase-3 activity in Colorectal cancer HCT-116 cells
癌症最典型的特征是异常细胞超越正常范围的增殖,抑制癌细胞的增殖是许多抗癌药物的主要作用机制。鲟鱼CS可以使结直肠癌细胞的增殖能力下降,对癌细胞生长最大抑制率可达90%。通过对鲟鱼CS处理后细胞周期、凋亡的测定发现,随鲟鱼CS质量浓度的增加,细胞周期S期变短,DNA合成期的细胞数减少,阻滞细胞周期,引起细胞内凋亡酶活力的增加,使细胞形态、结构发生改变,贴壁能力降低,从而引起了细胞凋亡现象的产生。本研究初步判定了鲟鱼CS可以引起结直肠癌细胞的凋亡,为进一步开发CS的食用、药用价值提供理论依据。
参考文献:
[1] 许永安, 陈守平, 吴靖娜, 等. 鲟鱼硫酸软骨素的制备工艺研究[J].渔业科学进展, 2011, 32(3): 121-129.
[2] 谌素华, 王维民, 刘辉, 等. 马尾藻岩藻聚糖硫酸酯纯化及降血脂功能研究[J]. 食品与发酵工业. 2010, 36(5): 28-31
[3] 宋涛. 硫酸软骨素的研究概况[J]. 食品与药品, 2006, 8(7): 31-32.
[4] CALAMIA V, LOURIDO L, FERNÁNDEZ-PUENTE P, et al.Secretome analysis of chondroitin sulfate-treated chondrocytes reveals its anti-angiogenic, anti-inflammatory and anti-catabolic properties[J].Arthritis Research and Therapy, 2012, 14(5): 1-12. DOI:10.1186/ar4040.
[5] 金艳, 崔慧斐, 曹吉超. 硫酸软骨素对鸡胚绒毛尿囊膜的血管生成抑制作用[J]. 中国生化药物杂志, 2004, 25(2): 84-85; 90.
[6] PIATIER-TONNEAU D, MACH P S, KAHAN A, et al. T suppressor lymphocytes regulation of adjuvant arthritis in two inbred strains of rats[J]. Clinical and Experimental Immunology, 1982, 49(3): 645-651.
[7] 王显伦. 动物鲜骨综合利用研究[J]. 食品工业科技, 1997, 18(6): 43-44.
[8] JULLUMSTRØ E, WIBE A, LYDERSEN S, et al. Colon cancer incidence, presentation, treatment and outcomes over 25 years[J].Colorectal Disease, 2011, 13(5): 512-518. DOI:10.1111/j.1463-1318.2010.02191.x.
[9] DE MARTEL C, FERLAY J, FRANCESCHI S, et al. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis[J]. The Lancet Oncology, 2012, 13(6): 607-615. DOI:10.1016/S1470-2045(12)70137-7.
[10] Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012,487: 330-337. DOI:10.1038/nature11252.
[11] 凌沛学, 郭学平, 荣晓花, 等. 中国生化原料药的现状和展望[J]. 中国生化药物杂志, 2001(5): 268-269.
[12] VOLPI N, MUCCI A, SCHENETTI L. Stability studies of chondroitin sulfate[J]. Carbohydrate Research, 1999, 315(3/4): 345-349.
[13] COX T R, RUMNEY R M H, SCHOOF E M, et al. The hypoxic cancer secretome induces pre-metastatic bone lesions through lysyl oxidase[J]. Nature, 2015, 522: 106-110. DOI:10.1038/nature14492.
[14] NEGRI E, LA VECCHIA C, DUFFY S W, et al. Age at first and second births and breast cancer risk in biparous women[J].International Journal of Cancer, 1990, 45(3): 428-430. DOI:10.1002/ijc.2910450308.
[15] PIKE M C, KRAILO M D, HENDERSON B E, et al. ‘Hormonal’ risk factors, ‘breast tissue age’ and the age-incidence of breast cancer[J].Nature, 1983, 303: 767-770. DOI:10.1038/303767a0.
[16] HENDERSON B E, BERNSTEIN L. The international variation in breast cancer rates: an epidemiological assessment[J]. Breast Cancer Research and Treatment, 1991, 8(Suppl 1): 11-17.
[17] LUCIANI M G, SEOK J, SAYEED A, et al. Distinctive responsiveness to stromal signaling accompanies histologic grade programming of cancer cells[J]. PLoS ONE, 2011, 6(5): e20016. DOI:10.1371/journal.pone.0020016.
[18] ALBREKTSEN G, HEUCH I, HANSEN S, et al. Breast cancer risk by age at birth, time since birth and time intervals between births:exploring interaction effects[J]. British Journal of Cancer, 2004, 92(1):167-175. DOI:10.1038/sj.bjc.6602302.
[19] KARIAGINA A, XIE J W, LANGOHR I M, et al. Progesterone stimulates proliferation and promotes cytoplasmic localization of the cell cycle inhibitor p27 in steroid receptor positive breast cancers[J].Hormones and Cancer, 2013, 4(6): 381-390. DOI:10.1007/s12672-013-0159-5.
[20] NEGRI E, LA VECCHIA C, DUFFY S W, et al. Age at first and second births and breast cancer risk in biparous women[J].International Journal of Cancer, 1990, 45(3): 428-430. DOI:10.1002/ijc.2910450308.
[21] FAOUR W H, HE Q W, MANCINI A, et al. Prostaglandin E2 stimulates p53 transactivational activity through specific serine 15 phosphorylation in human synovial fibroblasts. Role in suppression of c/EBP/NF-kappaB-mediated MEKK1-induced MMP-1 expression[J].The Journal of Biological Chemistry, 2006, 281(29): 19849-19860.DOI:10.1074/jbc.M601293200.
[22] LEE S H, AKUETE K, FULTON J, et al. An increased risk of breast cancer after delayed first parity[J]. American Journal of Surgery, 2003,186(4): 409-412. DOI:10.1016/S0002-9610(03)00272-1.
[23] MIRJANY M, HO L, PASINETTI G M. Role of cyclooxygenase-2 in neuronal cell cycle activity and glutamate-mediated excitotoxicity[J].Journal of Pharmacology and Experimental Therapeutics, 2002,301(2): 494-500. DOI:10.1124/jpet.301.2.494.
[24] KIM J, SHIM M. Prostaglandin F2αreceptor (FP) signaling regulates Bmp signaling and promotes chondrocyte differentiation[J].Biochimica et Biophysica Acta, 2015, 1853(2): 500-512. DOI:10.1016/j.bbamcr.2014.12.003.
[25] FRANCESCHI C, CAPRI M, MONTI D, et al. Inflammaging and antiinflammaging: a systemic perspective on aging and longevity emerged from studies in humans[J]. Mechanisms of Ageing and Development,2007, 128(1): 92-105. DOI:10.1016/j.mad.2006.11.016.
[26] BROWDER W, PATTERSON M D, THOMPSON J L, et al. Acute pancreatitis of unknown etiology in the elderly[J]. Annals of Surgery,1993, 217(5): 469-474. DOI:10.1097/00000658-199305010-00006.
[27] DAVID C J, HUANG Y H, CHEN M, et al. TGF-β tumor suppression through a lethal EMT[J]. Cell, 2016, 164(5): 1015-1030. DOI:10.1016/j.cell.2016.01.009.
[28] BARKAN D, EL TOUNY L H, MICHALOWSKI A M, et al.Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment[J]. Cancer Research, 2010, 70(14): 5706-5716.DOI:10.1158/0008-5472.CAN-09-2356.
[29] HOLLAND-NELL K, FERNÁNDEZ-BACHILLER M I,AHSANULLAH, et al. Chemoselective Wittig and Michael ligations of unprotected peptidyl phosphoranes in water furnish potent inhibitors of caspase-3[J]. Organic Letters, 2014, 16(17): 4428-4431.DOI:10.1021/ol501910x.
[30] ALTONSY M O, ANDREWS S C, TUOHY K M. Differential induction of apoptosis in human colonic carcinoma cells(Caco-2) by Atopobium, and commensal, probiotic and enteropathogenic bacteria: mediation by the mitochondrial pathway[J].International Journal of Food Microbiology, 2010, 137(2/3): 190-203.DOI:10.1016/j.ijfoodmicro.2009.11.015.
Inhibitory Effect of Chondroitin Sulfate from Sturgeon Bone on Colorectal Cancer Cells
WU Ruiyun1,2, LIU Lei2, ZHANG Jinlan2, CHEN Guilin1,*, LI Pinglan2,*
(1. College of Life Sciences, Inner Mongolia University, Hohhot 010021, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:Objective: This study is aimed to investigate the inhibitory effect of chondroitin sulfate from sturgeon bone on the proliferation of colorectal cancer cells and to elucidate the underlying mechanism. Methods: Three representative colorectal cancer cells (Caco-2, HCT-116, and SW480) were used in this study. Cell growth and proliferation was tested by cell counting kit-8(CCK-8) method. Colorectal cancer cell line HCT-116 was used to further investigate the pro-apoptotic ability of sturgeon chondroitin sulfate. Cell cycle and apoptosis were determined by flow cytometry. Cell morphology was observed after cell staining. Apoptosis was evaluated by caspase-3 activity. Our study indicated that sturgeon chondroitin sulfate significantly inhibit the cell proliferation of Caco-2, HCT-116 and SW480 cells with a percentage suppression of 70.94%,90.00% and 75.00%, respectively. After sturgeon chondroitin sulfate treatment, the G1/G0 phase increased to 88.56% and the S phase declined to 4.47%. Meanwhile, sturgeon chondroitin sulfate-treated cells exhibited morphological changes, nuclear pyknosis and cell fragmentation, and significantly increased apoptotic enzyme activity (1 645 IU/μg) with an apoptosis rate of 63.73%.Sturgeon chondroitin sulfate showed potential anticancer activity, which will make it a new functional food ingredient.
Key words:sturgeon chondroitin sulfate; colorectal cancer; cell proliferation; apoptosis
DOI:10.7506/spkx1002-6630-201721036
中图分类号:Q255
文献标志码:A
文章编号:1002-6630(2017)21-0223-07
引文格式:武瑞赟, 刘蕾, 张金兰, 等. 鲟鱼硫酸软骨素对结直肠癌细胞抑制作用[J]. 食品科学, 2017, 38(21): 223-229.
DOI:10.7506/spkx1002-6630-201721036. http://www.spkx.net.cn
WU Ruiyun, LIU Lei, ZHANG Jinlan, et al. Inhibitory effect of chondroitin sulfate from sturgeon bone on colorectal cancer cells[J]. Food Science, 2017, 38(21): 223-229. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721036.http://www.spkx.net.cn
收稿日期:2017-04-27
基金项目:北京市鲟鱼、鲑鳟鱼创新团队项目(SCGWZJ201711)
作者简介:武瑞赟(1990—),女,硕士研究生,研究方向为生物技术。E-mail:wuruiyun814@163.com
*通信作者:陈贵林(1961—),男,教授,博士,研究方向为药用植物化学。E-mail:guilinchen61@163.com李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn