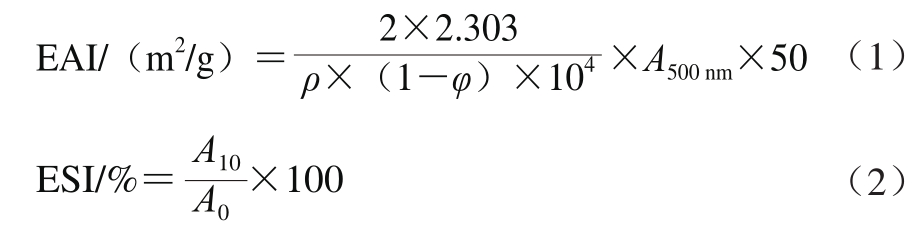
阮仕艳1,彭新颜1,*,张淑荣1,于学娟2,于海洋3,杨斌强1,张翠云1
(1.鲁东大学食品工程学院,山东 烟台 264025;2.烟台职业学院食品与生化工程系,山东 烟台 264670;3.山东商务职业学院食品工程系,山东 烟台 264670)
摘 要:研究乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白功能性及品质的影响。实验分为6组,第1组为空白对照,第2组加入质量分数20%未水解乳清蛋白,第3~5组中分别加入质量分数10%、15%、20%的乳清抗氧化肽冻干粉,第6组加入质量分数0.02%的丁基羟基茴香醚(butyl hydroxyanisd,BHA)。在肉糜4 ℃冷藏0、1、3、5、7 d时分别测定浊度、Ca2+-ATPase活力、乳化稳定性、挥发性盐基氮(totalvolatilebasicnitrogen,TVB-N)含量、蒸煮损失率、表面疏水性以及肌原纤维蛋白溶解性的变化。结果表明:添加质量分数15%的乳清抗氧化肽能有效抑制冷藏肉糜肌原纤维浊度的升高,抑制Ca2+-ATPase活力的下降,减少TVB-N的产生,抑制肌原纤维蛋白乳化稳定性和溶解性的降低。添加质量分数20%的乳清抗氧化肽则在抑制生肉糜蒸煮损失和猪肉糜肌原纤维蛋白表面疏水性增加方面效果最佳,其作用与质量分数0.02% BHA相当。上述结果表明,乳清抗氧化肽具有改善冷藏猪肉糜肌原纤维蛋白功能性及品质的作用。
关键词:冷藏猪肉糜;乳清抗氧化肽;肌原纤维蛋白;功能特性
我国是猪肉制品的生产与消费大国,其中各类肉糜调理制品因品种丰富、风味良好、携带方便等特点而备受广大消费者青睐。肌原纤维蛋白是猪肉中重要的盐溶性蛋白质,约占总蛋白质含量的50%以上,其功能性质与肉制品的色泽、表面疏水性、乳化稳定性、溶解性、产品风味等方面密切相关[1],可赋予产品重要的理化特性及感官品质。但肌原纤维蛋白在贮藏、运输及货架销售期极易受光照、温度、微生物等环境因素的影响而发生氧化劣变,导致分子交联度增加,降低其功能性和营养价值[2]。Stapornkul等[3]研究发现,脂质氧化和蛋白质氧化是肉类恶化的主要原因,其能使肉的细胞结构、黏度、乳化性质、持水能力和质地发生改变,降低产品的营养价值。因此,如何有效抑制猪肉制品氧化和改善肌原纤维蛋白功能特性是保持肉类品质的关键[4],这已成为当下肉制品行业中亟待解决的重要问题。
研究表明,在肉类和肉类制品中添加抗氧化剂是防止蛋白质氧化和改善品质的有效途径[5]。目前,人工合成的抗氧化剂因价廉易得、效果显著而被广泛用于肉制品,但其安全性一直备受质疑[6]。近年来,越来越多蛋白质水解得到的多肽被发现具有良好的抑制肉制品氧化和改善其品质的作用[7],如Wang等[8]利用铁催化氧化体系处理猪肉肌原纤维蛋白后,发现土豆水解多肽能降低氧化体系中猪肉肌原纤维蛋白的羰基含量和硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)含量,对肌原纤维蛋白和脂肪的氧化具有明显的抑制作用[9]。Niu Haili等[10]将通过高度酸性处理与温和热处理后的大豆蛋白分离物掺入肌原纤维蛋白中,发现通过温和热处理的大豆蛋白分离物能够提高肌原纤维蛋白的凝胶穿透力和保水能力,具有较好的保护肉糜凝胶品质的作用。Wang Xiaojie等[11]研究了糖基化玉米醇溶蛋白的部分性质及其对猪肉脂质氧化作用的影响,发现玉米醇溶蛋白有较高的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基清除能力,还能显著降低猪肉的过氧化值。
本课题组前期研究发现,乳清抗氧化肽能够显著抑制肉糜脂肪和肌原纤维蛋白氧化,其中质量分数20%乳清抗氧化肽处理组储能模量效果最好,15%乳清抗氧化肽在改善凝胶白度、流变学特性、保水性、质构品质方面效果最佳,接近甚至达到了丁基羟基茴香醚(butyl hydroxyanisd,BHA)处理组水平[12]。Li Yuanyuan等[13]也报道,与合成抗氧化剂不同,蛋白质水解得到的多肽往往是多功能的,不仅可以抑制蛋白质氧化,而且可以改变食物的物理性质。可见,乳清抗氧化肽已被证实具有抑制肉体系脂肪和蛋白质氧化的作用,但其对肌原纤维蛋白功能性质的影响鲜有报道。而且非肉蛋白多肽如植物多肽、乳清抗氧化肽在改善肌原纤维蛋白的功能性和品质上也显示出了一定的优越性[14]。因此,本实验将乳清抗氧化肽冻干粉添加至冷藏猪肉糜后,考察其对肉糜肌原纤维蛋白功能性质和品质的影响效果和规律,并与BHA的抗氧化效果进行对比,为乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白功能性及品质的影响提供理论依据。
1.1 材料与试剂
猪肉(新鲜猪腿肉,为屠宰后24 h的冷却排酸肉),购于烟台振华超市。
乳清蛋白(经测定蛋白质含量为95.8%) 北京MilkyWay商业公司;碱性蛋白酶(6×104U/g) 丹麦Novo公司;大豆卵磷脂、BHA 美国Sigma 公司;其余试剂为市售分析纯。
1.2 仪器与设备
TA-XT2i质构仪 英国Stable Micro Systems公司;绞肉机 山东嘉信食品机械有限公司;真空冷冻干燥机北京博医康实验仪器有限公司;AL-104精密电子天平瑞士梅特勒-托利多有限公司;FW-200高速万能粉碎机北京中兴伟业仪器有限公司;HH-42水浴锅 常州国华电器有限公司;高速冷冻离心机 湖南长沙湘仪离心机仪器有限公司;HI99163 pH计 意大利哈纳仪器公司;T25数显型均质机 德国IKA集团;TU-1800紫外-可见光分光光度计 北京普析仪器公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 乳清抗氧化肽的制备
将乳清蛋白配成质量浓度为5 g/100 mL的溶液,95℃预热5 min,转至65 ℃水浴水解,加入质量分数2%的碱性蛋白酶进行水解,反应过程中不断加入1 mol/L的NaOH,使pH值维持在8.5,经5 h水解后,沸水加热5 min灭酶,冷却,真空冷冻干燥后用于实验。
1.3.2 生肉糜肉饼的制作
在4 ℃冷库中进行肉糜的制备:去除猪肉筋膜及多余的脂肪,将瘦肉与肥肉的质量比调配至4∶1后,切成30 mm×30 mm×30 mm的小块,用绞肉机将其绞碎,按比例随机分为6 组,第1组为空白对照组,第2组加入质量分数20%的未水解乳清蛋白,向第3、4、5组中分别加质量分数10%、15%、20%的乳清抗氧化肽,剩余一组中加入质量分数0.02%的BHA作为阳性对照组。每份加入质量分数1.5%的食盐,充分混匀后,将肉糜制成50 g的肉饼(直径约7 cm,厚度约1 cm),每2个放入1个包装盒中,用保鲜膜封好,置于4 ℃冰箱冷藏,在第0、1、3、5、7天提取肌原纤维蛋白,测定各项指标。
1.3.3 肌原纤维蛋白的提取与测定
肌原纤维蛋白的提取参考彭新颜等[12]方法略加修改。用绞肉机将猪肉绞碎,取肉样加5倍体积的提取缓冲液(100 mmol/L NaCl、1 mmol/L乙二醇双(2-氨基乙基醚)四乙醚、2 mmol/L MgCl2、10 mmol/L磷酸盐缓冲溶液,pH 7.0),于4℃匀浆后,在2000×g条件下离心15 min,除去上清液,取沉淀备用。将上述步骤重复4次,并在最后1次离心前用6层纱布过滤,用0.1 mol/L盐酸调节pH值至6.2,将最终得到的蛋白膏保存于冰盒中以备实验用;以牛血清蛋白作为标准蛋白,用双缩脲法测定肌原纤维蛋白的质量浓度。
1.3.4 肌原纤维蛋白浊度的测定
猪肉肌原纤维蛋白的浊度参考Benjakul等[15]的方法测定。将肌原纤维蛋白配成1 mg/mL的蛋白质溶液,取5 mL于10 mL试管中,将试管放在50℃的水浴锅中加热30 min,取出,室温冷却,在600 nm波长处测定光密度值(OD600nm),以此表征浊度。
1.3.5 Ca2+-ATPase活力的测定
依据Xia Xiufang等[16]的方法测定肌原纤维蛋白的Ca2+-ATPase活力。将肌原纤维蛋白溶液稀释至3.0 mg/mL后,取0.2 mL加入至含有2.0 mL的Ca2+-ATPase反应体系(15 mmol/L CaCl2·2H2O、7.6 mmol/L ATP、180 mmol/L Tris-HCl、150 mmol/L的KCl,pH 7.4,25 ℃)中反应10 min,加入1.0 mL、体积分数10%三氯乙酸使反应停止,3000 r/min条件下离心5 min,去除沉淀,取1.0 mL上清液加入3.0 mL、0.66 g/100mL的钼酸铵(溶解在0.75 mol/L硫酸中),混匀后加入0.5 mL、0.1 g/mL新配制的FeSO4溶液,反应2 min,于700 nm波长处测定吸光度。Ca2+-ATPase活力以25 ℃时每毫克蛋白质在每分钟内所产生的无机磷的物质的量表示,单位为μmol/mg。
1.3.6 乳化性和乳化稳定性的测定
肌原纤维蛋白的乳化稳定性测定参考Xia Xiufang等[17]的方法并略加修改,以乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别表示肌原纤维蛋白的乳化性和乳化稳定性。
将2 mL、10 mg/mL的肌原纤维蛋白溶解在18 mL、0.1 mol/L(pH 6. 5)的磷酸缓冲溶液中,配制成为1 mg/mL的肌原纤维蛋白样品溶液,称取2.0 mL的玉米油和8.0 mL的肌原纤维蛋白样品溶液于离心管中,用匀浆机以15 000 r/min转速匀浆1 min,立即倒入30 cm×50 cm玻璃称量瓶中,分别于0、10 min时,从距离瓶底0.5 cm处吸取50 μL的匀浆液分散于5 mL、质量分数0.1%十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)溶液中,充分振荡混匀后于500 nm波长处测定吸光度,分别记作A0和A10。肌原纤维蛋白EAI和ESI的计算如公式(1)、(2)所示。
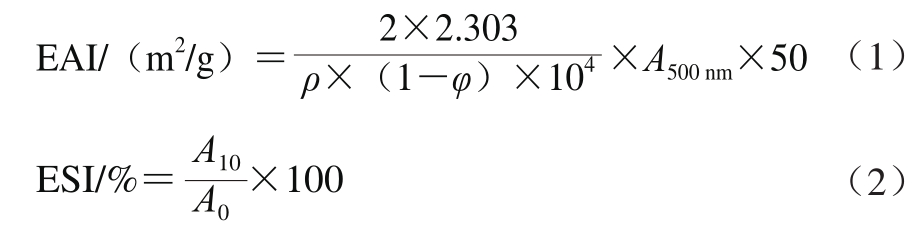
式中:A500nm为乳状液在500 nm处的吸光度(0 min时,A500nm=A0;10 min时,A500nm=A10);ρ为蛋白质量浓度/(mg/mL);φ为油相体积分数(本实验中φ=0.20%);A0、A10分别为乳状液在0 min、10 min的吸光度。
1.3.7 挥发性盐基氮含量的测定
挥发性盐基氮(total volatile basicnitrogen,TVB-N)含量测定参照Huang Xiaowei等[18]的方法,取10 g肌原纤维蛋白样品置于烧杯中,使用组织匀浆器将其与100 mL蒸馏水混合,经滤纸过滤。取5 mL滤液,加入5 mL、10 g/L氧化镁,调节pH值至9~10。使用凯氏定氮精馏装置进行蒸汽蒸馏5 min,馏出物用10 mL、20 g/L硼酸吸收,用0.01 mol/L盐酸滴定,记录消耗盐酸的体积。同时做一试剂空白实验(不加肌原纤维蛋白样品,其他操作同上)。TVB-N含量的计算如公式(3)所示。
式中:V1是测试样品所消耗盐酸的体积/mL;V2是空白组所消耗盐酸的体积/mL;c滴定所用盐酸的浓度(本实验为0.01 mol/L);m为肌原纤维蛋白样品的质量/g。
1.3.8 蒸煮损失率的测定
将肉糜置于90 ℃恒温水浴中加热凝胶化20 min,取出冷却后保存于4 ℃冰箱中,24 h后用于检测。蒸煮损失率为猪肉糜蒸煮后质量与蒸煮前质量的比值。其计算如式(4)所示。
式中:m1是猪肉糜蒸煮前的质量/g;m2是猪肉糜蒸煮后质量/g。
1.3.9 表面疏水性的测定
参照Chen Lin等[4]的方法,将肌原纤维蛋白样品溶于20 mmol/L磷酸缓冲溶液(pH 7.0),制备成5mg/mL的肌原纤维蛋白溶液,取1 mL肌原纤维蛋白溶液,加入200 μL、1 mg/mL溴酚蓝,用涡旋混合器充分混匀,在6000 r/min条件下离心15 min,将上清液转移到另一支离心管中再次离心后,取上清液稀释10倍,于595 nm波长处测定吸光度。以未加蛋白溶液的磷酸盐缓冲溶液作为对照。表面疏水性以溴酚蓝可结合的最终暴露出埋藏在蛋白质构象内部的疏水性氨基酸残基的质量来表示,计算如式(5)所示。
式中:A对照表示对照组的吸光度;A样品表示样品的吸光度。
1.3.10 肌原纤维蛋白溶解度的测定
肌原纤维蛋白溶解性的测定参照Benjakul等[19]的方法并稍作改动。准确称取肌原纤维蛋白1 g,溶解于18 mL、0.6 mol/L KCl溶液中,混合匀浆30 s后在室温条件下搅拌4 h,10 000 r/min条件下冷冻离心30 min。取10 mL离心上清液用双缩脲法测定蛋白质的质量浓度。肌原纤维蛋白溶解度用公式(6)表示。
式中:ρ1表示上清液蛋白质的质量浓度/(mg/mL);ρ2表示离心前蛋白质的质量浓度/(mg/mL)。
1.4 统计分析
每个实验重复3 次,结果表示为 。采用Sigmaplot 12.0软件作图,利用Statistix 8.1软件中的Linear Models进行数据统计分析,Turkey HSD进行差异显著性(P<0.05)分析。
。采用Sigmaplot 12.0软件作图,利用Statistix 8.1软件中的Linear Models进行数据统计分析,Turkey HSD进行差异显著性(P<0.05)分析。
2.1 乳清抗氧化肽对肌原纤维蛋白浊度的影响
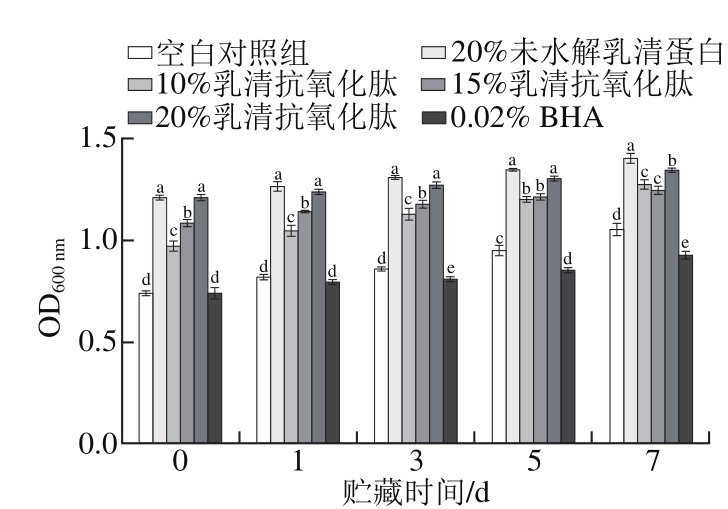
图1 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白浊度的影响
Fig. 1 Effect of whey antioxidant peptides on the turbidity of pork myofibrillar protein during refrigerated storage
相同贮藏时间条件下,不同字母表示差异显著(P<0.05)。下同。
图1表明,冷藏肉糜的浊度随贮藏时间延长而呈现上升趋势,由于未水解乳清蛋白和乳清抗氧化肽本身浊度的影响,空白对照组和质量分数0.02% BHA处理组在整个贮藏期间,与其他组相比浊度较低(P<0.05)。在贮藏前3 d,质量分数10%乳清抗氧化肽处理组与高剂量(15%和20%)抗氧化肽处理组的浊度差异显著(P<0.05),5 d后,质量分数10%和15%乳清抗氧化肽处理组与20%乳清抗氧化肽处理组相比,浊度差异显著(P<0.05)。
2.2 乳清抗氧化肽对肌原纤维蛋白Ca2+-ATPase活力的影响
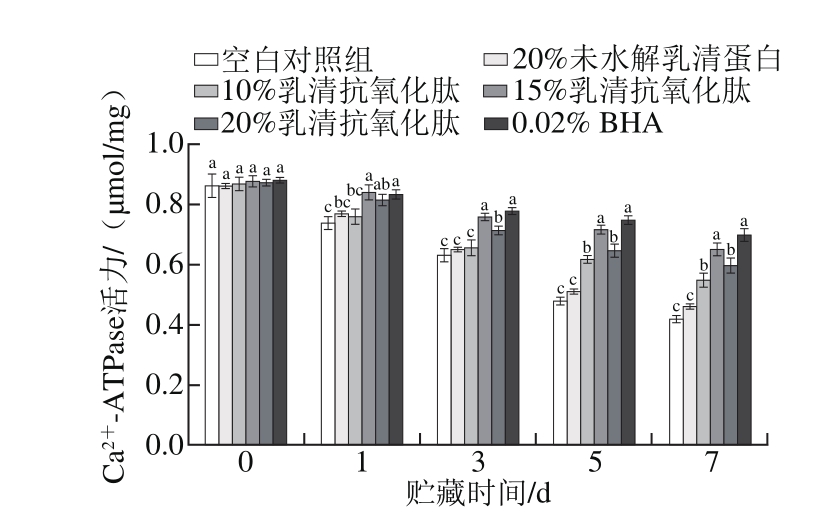
图2 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白Ca2+-ATPase活力的影响
Fig. 2 Effect of whey antioxidant peptides on the Ca2+-ATPase activity of pork myofibrillar protein during refrigerated storage
由图2可知,随着贮藏时间的延长,空白对照组与各个处理组的Ca2+-ATPase活力降低。与0 d相比,贮藏7 d时,空白对照组Ca2+-ATPase活力降低了51.2%,未水解乳清蛋白的处理组降低了46.5%,质量分数10%、15%、20%乳清抗氧化肽处理组Ca2+-ATPase活力分别降低了36.8%、26.1%、31.0%,下降幅度显著低于空白对照组(P<0.05);而质量分数0.02% BHA处理组的Ca2+-ATPase活力下降了20.5%。可见,质量分数15%乳清抗氧化肽和质量分数0.02% BHA的处理组在贮藏期间降幅相对较小,且在第3~7天贮藏期间,其Ca2+-ATPase酶活力显著高于空白对照组及质量分数20%未水解乳清蛋白组(P<0.05),因此,向猪肉糜肌原纤维蛋白中添加质量分数15%乳清抗氧化肽和质量分数0.02% BHA,对于提高Ca2+-ATPase活力的作用效果最好,且两组之间无显著差异(P>0.05)。
2.3 乳清抗氧化肽对肌原纤维蛋白乳化性和乳化稳定性的影响


图3 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白乳化性(A)和乳化稳定性(B)的影响
Fig. 3 Effect of whey antioxidant peptides on the emulsifying capacity (A) and emulsion stability (B) of pork myofibrillar protein during refrigerated storage
由图3可以看出,整个贮藏期间乳化稳定性、乳化性变化趋势相似,在贮藏0 d时,空白对照组与其他各处理组的乳化稳定性和乳化性即呈现明显差异。在第7天时,质量分数15%乳清抗氧化肽对维持乳化性及乳化稳定性的作用显著优于其他处理组(P<0.05),且质量分数15%乳清抗氧化肽处理组的乳化性及乳化稳定性显著高于质量分数0.02% BHA处理组(P<0.05),可见,添加质量分数15%乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白维持乳化性及乳化稳定性效果相对最好,且优于质量分数0.02% BHA的效果(P<0.05)。说明添加适当质量分数的乳清抗氧化肽在一定范围对维持肌原纤维蛋白的乳化性及乳化稳定性具有较好的作用。
2.4 乳清抗氧化肽对TVB-N含量的影响

图4 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白TVB-N含量的影响
Fig. 4 Effect of whey antioxidant peptides on the TVB-N content of pork myofibrillar protein during refrigerated storage
由图4所示,在贮藏过程中,所有处理组的肌原纤维蛋白TVB-N含量不断增加。从第3天开始,各处理组的TVB-N含量呈现显著差异,质量分数15%乳清抗氧化肽处理组增加幅度最小,而空白对照组和未水解乳清蛋白组的TVB-N含量分别在第3天和第5天超过临界值(15 mg/100 g),在第7天时,水解组及BHA处理组都在临界值以下,其中与对照组相比,质量分数15%乳清抗氧化肽的TVB-N含量降低了31.7%,质量分数0.02% BHA组降低了31.5%,两组之间无显著性差异(P>0.05)。说明添加质量分数15%乳清抗氧化肽能够有效抑制猪肉肌原纤维蛋白的氧化,更好地抑制肌原纤维蛋白TVB-N含量上升。
2.5 乳清抗氧化肽对肌原纤维蛋白蒸煮损失率的影响

图5 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白蒸煮损失率的影响
Fig. 5 Effect of whey antioxidant peptides on the cooking loss rate of pork myofibrillar protein during refrigerated storage
由图5可知,随着贮藏时间的延长,所有样品猪肉糜的蒸煮损失率呈上升趋势。在贮藏的第1天,各处理组的蒸煮损失率已显著低于空白对照组(P<0.05),说明所选处理均有效降低了猪肉糜的蒸煮损失,质量分数20%乳清抗氧化肽处理组蒸煮损失率最低,但与质量分数15%乳清抗氧化肽处理组和质量分数0.02%的BHA处理组无显著差异(P>0.05)。在贮藏1~7 d范围内,所有处理组的蒸煮损失率均显著低于对照组(P<0.05),其中质量分数20%乳清抗氧化肽处理组与质量分数0.02% BHA处理组无显著差异(P>0.05)。以上结果说明,质量分数20%的乳清抗氧化肽能有效减少猪肉糜在保存过程中的蒸煮损失,这可能是因为适宜质量分数的乳清抗氧化肽对肌原纤维蛋白的结构具有一定的保护作用,使得肌原纤维蛋白在空间结构上对水分子的保留能力增强。
2.6 乳清抗氧化肽对肌原纤维蛋白表面疏水性的影响
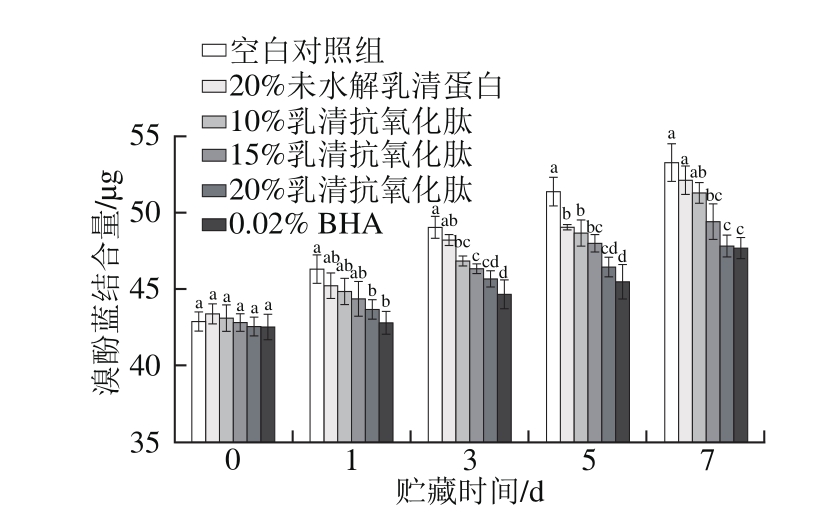
图6 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白表面疏水性的影响
Fig. 6 Effect of whey antioxidant peptides on the surface hydrophobicity of pork myofibrillar protein during refrigerated storage
由图6可得,随贮藏时间的延长,各组的表面疏水性呈上升趋势,第0天时,各组表面疏水性无显著差异(P>0.05),第1天时,质量分数20%乳清抗氧化肽处理组和质量分数0.02%的BHA处理组的表面疏水性显著低于空白对照组(P<0.05),到第7天时,与空白对照组相比,质量分数20%乳清抗氧化肽的表面疏水性与质量分数0.02% BHA处理组无显著差异(P>0.05),说明添加质量分数20%乳清抗氧化肽可有效抑制蛋白质变性,从而延缓表面疏水性的增加。
2.7 乳清抗氧化肽对肌原纤维蛋白溶解度的影响
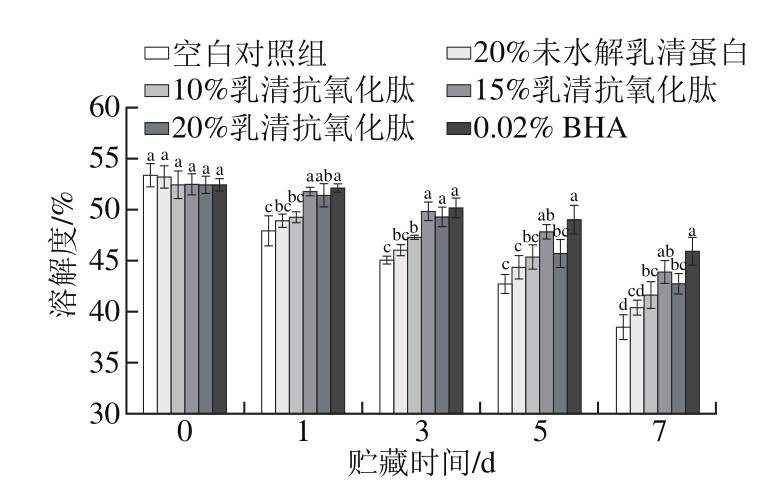
图7 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白溶解度的影响
Fig. 7 Effect of whey antioxidant peptides on the solubility of pork myofibrillar protein during refrigerated storage
图7反映了不同处理后所得到的肌原纤维蛋白在贮藏期内的溶解度变化,随贮藏时间延长,各组肌原纤维蛋白的溶解度呈下降趋势(P<0.05),各组之间溶解度在第0天时差异不显著(P>0.05),但1d以后,质量分数15%、20%乳清抗氧化肽处理组与质量分数0.02% BHA处理组的溶解度显著大于空白对照组(P<0.05)。第7天时,质量分数15%、20%乳清抗氧化肽处理组以及质量分数0.02% BHA处理组的溶解度分别比空白对照组高14.2%、11.1%和19.4%,其中质量分数15%乳清抗氧化肽处理组与其他剂量组相比溶解度最大,与质量分数0.02% BHA处理组无显著差异(P>0.05)。可见,乳清抗氧化肽通过清除氧化自由基,抑制肌原纤维蛋白氧化,从而阻止了氧化导致的蛋白质分子之间的相互聚集和交联,一定程度上抑制了在猪肉糜冷藏过程中蛋白质溶解度的下降。
乳化稳定性、Ca2+-ATPase活性、溶解性、表面疏水性、浊度、蒸煮损失率、TVB-N含量是反映肌原纤维蛋白理化性质和功能性质的常用指标,对于肉制品的加工有重要的现实意义[11,20]。肌原纤维蛋白分子是两性分子,既有亲水基团又有疏水基团,本实验中乳化稳定性、Ca2+-ATPase活力、溶解度均随贮藏时间的延长呈降低趋势,这是由于肌原蛋白在贮存期间发生氧化,改变了蛋白质分子间的氢键及蛋白质表面电荷,引起蛋白质天然构象降解或聚集[21],使埋藏于蛋白质内部的疏水基团暴露,从而导致肌原纤维蛋白乳化稳定性、Ca2+-ATPase活力、溶解度降低。此外,肉糜的弹性和黏度于冷藏第2天已发生明显质变,表现为肌原纤维蛋白浊度、表面疏水性、蒸煮损失率、TVB-N含量均呈明显的上升趋势。肌原纤维蛋白浊度升高是蛋白分子相互作用而形成聚集物的结果[22]。肌原纤维蛋白过度氧化导致粗、细肌丝之间出现相对运动即滑行现象,表现为肌细胞收缩,而大部分水分只能贮存于细胞间隙中,肌细胞收缩减弱了细胞对水分的束缚作用,这是蒸煮损失增加的主要原因[23];TVB-N含量在冷藏猪肉糜冷藏过程中增加,这是由于微生物分解蛋白质,产生了盐基氮类物质,如伯胺、仲胺、叔胺等[22]。本实验研究结果表明,质量分数10%、15%、20%乳清抗氧化肽处理组和质量分数0.02% BHA组效果明显优于未水解乳清蛋白组,这可能是由于水解过程中暴露出更多的抗氧化氨基酸残基,使抗氧化活性增强,从而延缓了冷藏过程中蛋白质的氧化,改善了肌原纤维蛋白的功能性和品质。乳清抗氧化肽的添加为冷藏生鲜肉糜保鲜防腐、改善功能性提供了一种天然安全、效果显著的新方法。
生鲜肉糜在加工贮藏过程中,容易受到环境因素影响而发生氧化劣变,致使其主要组分——肌原纤维蛋白的结构、理化性质、功能性质、营养价值降低甚至丧失[24]。有研究表明,乳清抗氧化肽具有很强的抗氧化活性[25],能够清除自由基或作为保护膜阻断自由基链式反应,同时又具有较好的成膜性和黏性,在蛋白质分子表面能形成一层致密的膜,可以很好地减缓肌原纤维蛋白氧化的速率[26]。乳清抗氧化肽具有抗氧化、维持或改善食品感官特性、提高营养价值的作用,已被广泛用于肉制品(如熟食切片火腿、法兰克福香肠和新鲜香肠等[27])中防止蛋白质氧化,从而提高产品质量。肉糜制品中添加乳清粉,不仅可以抑制肉制品发生蛋白质氧化,还能减少营养成分的损失[28]。乳清蛋白质水解物——乳清抗氧化多肽不仅能提高肉制品功能性和营养价值,还能用于改善香肠的质地[29]。Coronado等[30]研究发现,添加乳清粉对提高香肠的保水性具有较好的效果,并使香肠具有更紧凑的微观结构,这可能是因为添加的乳清粉与猪肉肌原纤维蛋白间形成了致密的网状结构,束缚住了肌原纤维蛋白中的水分。Wójciak等[31]将酸乳清蛋白添加到猪肉糜中,并于4℃冷藏一段时间后,发现猪肉糜保水效果较好,没有腐败和变味等不良现象。乳清蛋白的重要功能特性是其在适当条件下具有固定大量水和其他食品成分的能力,较高的乳清蛋白含量可能会增加肉制品的紧实度[32]。可见,乳清抗氧化肽冻干粉作为一种天然抗氧化剂,不仅可以降低脂质和蛋白氧化,维持或改善感官特性,还能有效抑制肌原纤维蛋白氧化劣变,因此添加一定质量分数的乳清抗氧化肽可为解决肉制品加工贮藏过程发生的品质劣变提供新的思路。
本研究发现乳清抗氧化肽对肌原纤维蛋白功能特性及品质有明显的影响,其中质量分数20%乳清抗氧化肽在抑制肉糜蒸煮损失和抑制肌原纤维蛋白表面疏水性方面起到较好的作用,而在减缓肌原纤维蛋白浊度升高、抑制Ca2+-ATPase活力降低、抑制乳化稳定性和溶解性的降低、减少TVB-N含量等方面,以质量分数15%的乳清抗氧化肽处理组效果更显著。可见,添加适量的乳清抗氧化肽,对猪肉糜肌原纤维蛋白功能性及品质有较好的改善作用。
参考文献:
[1] LESIOW T, RENTFROW G K, XIONG Youling L.. Polyphosphate and myofibrillar protein extract promote transglutaminase-mediated enhancements of rheological and textural properties of PSE pork meat batters[J]. Meat Science, 2017, 128: 40-46. DOI:10.1016/j.meatsci.2017.02.002.
[2] XIA Xiufang, KONG Baohua, LIU Qian, et al. Physicochemical change and protein oxidation in porcine longissimusdorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245.DOI:10.1016/j.meatsci.2009.05.003.
[3] STAPORNKUL N, PRYTKOVA T, WERE L. Effect of green tea on interaction of lipid oxidation products with sarcoplasmic and myofibrillar protein homogenates extracted from bovine top round muscle[J]. Food Research International, 2016, 89: 1038-1045.DOI:10.1016/j.foodres.2016.01.016.
[4] CHEN Lin, LI Chenyi, ULLAH N, et al. Different physicochemical,structural and digestibility characteristics of myofibrillar protein from PSE and normal pork before and after oxidation[J]. Meat Science,2016, 121: 228-237. DOI:10.1016/j.meatsci.2016.06.010.
[5] JIA Na, WANG Letian, SHAO Junhua, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science, 2017, 127: 45-50. DOI:10.1016/j.meatsci.2017.01.004.
[6] PENG Xinyan, KONG Baohua, YU Haiyang, et al. Protective effect of whey protein hydrolysates against oxidative stress in D-galactose-induced aging rats[J]. International Dairy Journal, 2014, 34: 80-85.DOI:10.1016/j.idairyj.2013.08.004.
[7] MULCAHY E M, PARK C W, DRAKE M A, et al. Improvement of the functional properties of whey protein hydrolysate by conjugation with maltodextrin[J]. International Dairy Journal, 2016, 60: 47-54.DOI:10.1016/j.idairyj.2016.02.049.
[8] WANG L L, XIONG Youling L.. Inhibition of oxidant-induced biochemical changes of pork myofibrillar protein by hydrolyzed potato protein[J]. Journal of Food Science, 2008, 73(6): 482-487.DOI:10.1111/j.1750-3841.2008.00802.x.
[9] CHENG Y, XIONG Youling L., CHEN J. Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions[J]. Food Chemistry, 2010, 120(1): 101-108. DOI:10.1016/j.foodchem.2009.09.077.
[10] NIU Haili, LI Yue, HAN Jianchun, et al. Gelation and rheological properties of myofibrillar proteins influenced by the addition of soybean protein isolates subjected to an acidic pH treatment combined with a mild heating[J]. Food Hydrocolloids, 2017, 70: 269-276.
[11] WANG Xiaojie, ZHENG Xiqun, LIU Xiaolan, et al. Preparation of glycosylated zein and retarding effect on lipid oxidation of ground pork[J]. Food Chemistry, 2017, 227: 335-341. DOI:10.1016/j.foodchem.2017.01.069.
[12] 彭新颜, 许晶, 杨阳, 等. 乳清多肽对猪肉糜氧化和凝胶特性的影响[J].食品科学, 2016, 37(21): 31-37. DOI:10.7506/spkx1002-6630-201621001.
[13] LI Yuanyuan, KONG Baohua, LIU Qian, et al. Improvement of the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions by addition of zeinhydrolysates[J]. Process Biochemistry, 2017, 53: 116-124. DOI:10.1016/j.procbio.2016.11.010.
[14] CAO Yungang, XIONG Youling L.. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillarprotein[J]. Food Chemistry,2015, 180: 235-243. DOI:10.1016/j.foodchem.2015.02.036.
[15] BENJAKUL S, BAUER F. Biochemical and physicochemical changes in catfish (Silurus glanis Linne) muscle as influenced by different freeze-thaw cycles[J]. Food Chemistry, 2001, 72(2): 207-217.DOI:10.1016/S0308-8146(00)00222-3.
[16] XIA Xiufang, KONG Baohua, LIU Jing, et al. Influence of different thawing methods on physicochemical changes and protein oxidation of porcine longissimusmuscle[J]. LWT-Food Science and Technology,2012, 46(1): 280-286. DOI:10.1016/j.lwt.2011.09.018.
[17] XIA Xiufang, KONG Baohua, XIONG Youling L., et al. Decreased dgelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[18] HUANG Xiaowei, ZOU Xiaobo, ZHAO Jiewen, et al. Sensing the quality parameters of Chinese traditional Yao-meat by using a colorimetric sensor combined with genetic algorithm partial least squares regression[J]. Meat Science, 2014, 98: 203-210. DOI:10.1016/j.meatsci.2014.05.033.
[19] BENJAKUL S, BAHER F. Physicochmical and enzymatic changes of Cod muscle proteins subjected to different freeze thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.
[20] HIGUERA-BARRAZA O A, TORRES-ARREOLA W,EZQUERRA-BRAUER J M, et al. Effect of pulsed ultrasound on the physicochemical characteristics and emulsifying properties of squid(Dosidicus gigas) mantle proteins[J]. Ultrasonics-Sonochemistry,2017, 38: 1-6. DOI:10.1016/j.ultsonch.2017.01.008.
[21] YANG Huijuan, HAN Minyi, WANG Xia, et al. Effect of high pressure on cooking losses and functional properties of reducedfat and reduced-salt pork sausage emulsions[J]. Innovative Food Science & Emerging Technologies, 2015, 29: 125-133. DOI:10.1016/j.ifset.2015.02.013.
[22] LIU Shulai, ZHAO Peicheng, ZHANG Jingjing, et al. Physicochemical and functional properties of silver carp (Hypophthalmichthys molitrix)myofibrillar protein glycated with konjacoligo-glucomannan[J].Food Hydrocolloids, 2017, 67: 216-223. DOI:10.1016/j.foodhyd.2017.01.018.
[23] SHAZLY A B, HE Z Y, EL-AZIZ M A, et al. Fractionation and identification of novel antioxidant peptides from buffalo and bovine casein hydrolysates[J]. Food Chemistry, 2017, 232: 753-762.DOI:10.1016/j.foodchem.2017.04.071.
[24] TURGUT S S, IŞIKÇI F, SOYER A. Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J]. Meat Science, 2017, 129: 111-119.DOI:10.1016/j.meatsci.2017.02.019.
[25] BRANDELLI A, DAROIT D J, CORRÊA A P F. Whey as a source of peptides with remarkable biological activities[J]. Food Research International, 2015, 73: 149-161. DOI:10.1016/j.foodres.2015.01.016.[26] POWER O, JAKEMAN P, FITZGERALD R J. Antioxidative peptides:enzymatic production, in vitro and in vivo antioxidant activity and potential applications of milk-derived antioxidativepeptides[J]. Amino Acids, 2013, 44: 797-820. DOI:10.1007/s00726-012-1393-9.
[27] WANG Bin, GONG Yandan, LI Zhongrui, et al. Isolation and characterisation of five novel antioxidant peptides from ethanol-soluble proteins hydrolysate of spotless smoothhound (Mustelusgriseus)muscle[J]. Journal of Functional Foods, 2014, 6: 176-185.DOI:10.1016/j.jff.2013.10.004.
[28] VAVRUSOVA M, PINDSTRUP H, JOHANSEN L B, et al.Characterisation of a whey protein hydrolysate as antioxidant[J].International Dairy Journal, 2015, 47: 86-93. DOI:10.1016/j.idairyj.2015.02.012.
[29] MULCAHY E M, PARK C W, DRAKE M A, et al. Improvement of the functional properties of whey protein hydrolysate by conjugation with maltodextrin[J]. International Dairy Journal, 2016, 60: 47-54.DOI:10.1016/j.idairyj.2016.02.049.
[30] CORONADO S A, TROUT G R, DUNSHEA F R, et al. Antioxidant effects of rosemary extract and whey powder on the oxidative stability of wiener sausages during 10 months frozen storage[J]. Meat Science,2002, 62(2): 217-224. DOI:10.1016/S0309-1740(01)00249-2.
[31] WÓJCIAK K M, DOLATOWSKI Z J, KOŁOZYN-KRAJEWSKA D.Use of acid whey and probiotic strains to improve microbiological quality and sensory acceptance of organic fermented sausage[J]. Journal of Food Processing and Preservation, 2015, 39: 539-547. DOI:10.1111/jfpp.12259.
[32] CHILDS J L, YATES M D, DRAKE M A. Sensory properties of meal replacement bars and beverages made from whey and soy proteins[J].Journal of Food Science, 2007, 72(6): 425-434. DOI:10.1111/j.1750-3841.2007.00429.x.
Effects of Whey Antioxidant Peptides on Functional Properties and Quality of Myofibrillar Protein from Refrigerated Pork Patties
RUAN Shiyan1, PENG Xinyan1,*, ZHANG Shurong1, YU Xuejuan2, YU Haiyang3, YANG Binqiang1, ZHANG Cuiyun1
(1. College of Food Engineering, Ludong University, Yantai 264025, China;2. Department of Food and Biochemical Engineering,Yantai Vocational College, Yantai 264670, China;3. Department of Food Engineering, Shandong Business Institute, Yantai 264670, China)
Abstract:The objective of this study was to investigate the effects of whey antioxidant peptides on the functional properties and quality of myofibrillar protein from refrigerated pork patties. The experiment was divided into 6 groups, including blank control group, 20% whey protein isolate group, 10%, 15% and 20% whey antioxidant peptide groups, and 0.02% BHA group. The changes in turbidity, Ca2+-ATPase activity, emulsion stability, total volatile basic nitrogen (TVB-N) content,cooking loss rate, surface hydrophobicity and myofibrillar protein solubility were measured after 0, 1, 3, 5, and 7 days of storage (4 ℃). The results showed that 15% whey protein hydrolysate with antioxidant activity was almost as effective as BHA in inhibiting the increase in the turbidity of pork myofibrillar protein and the decrease in Ca2+-ATPase activity,avoiding the generation of TVB-N, and suppressing the decrease in the emulsion stability and solubility of myofibrillar protein. Addition of 20% whey-derived antioxidant peptides could most effectively reduce the cooking loss of pork patties and block the increase in the surface hydrophobicity of myofibrillar protein, and its effect was similar to that of 0.02% BHA.Conclusion: Antioxidant peptides derived from whey protein have the potential for improving the functional properties and quality of myofibrillar protein from refrigerated pork.
Key words:chilled pork patties; whey protein-derived antioxidant peptides; myofibrillar protein; functional characteristic
DOI:10.7506/spkx1002-6630-201721042
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2017)21-0265-07
收稿日期:2017-05-31
基金项目:国家自然科学基金青年科学基金项目(31401491);城新创新奖学金项目;大学生创新创业训练计划项目(201610451328)
作者简介:阮仕艳(1995—),女,本科生,研究方向为功能性食品。E-mail:1351116510@qq.com
*通信作者:彭新颜(1976—),女,副教授,博士,研究方向为功能性食品。E-mail:pengxinyan2006@163.com
引文格式:阮仕艳, 彭新颜, 张淑荣, 等. 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白功能性及品质的影响[J]. 食品科学, 2017,38(21): 265-271.
DOI:10.7506/spkx1002-6630-201721042. http://www.spkx.net.cn
RUAN Shiyan, PENG Xinyan, ZHANG Shurong, et al. Effects of whey antioxidant peptides on functional properties and quality of myofibrillar protein from refrigerated pork patties[J]. Food Science, 2017, 38(21): 265-271. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721042. http://www.spkx.net.cn