农产品及其制品中交链孢酚和交链孢酚单甲醚研究进展
姜冬梅,王 瑶,姜 楠,韦迪哲,马 帅,王 蒙*
(北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097)
摘 要:交链孢菌(Alternaria spp.)是一类重要的植物病原体,能产生多种毒素,其中交链孢酚(alternariol,AOH)和交链孢酚单甲醚(alternariol monomethyl ether,AME)是目前从食物中检出的比较普遍和主要的2 种交链孢毒素,可广泛污染蔬菜、水果及谷物等农产品及其制品。本文对AOH和AME的结构及理化性质、毒性、产生影响因素、生物及化学合成和污染现状等进行了综述,并对交链孢毒素限量标准的制定、快速检测方法等进行了展望。
关键词:交链孢菌;真菌毒素;交链孢酚;交链孢酚单甲醚
交链孢菌(Alternaria spp.)是污染农产品及其制品最普遍的真菌之一,广泛分布于自然界,能寄生与腐生,具有植物致病性,可在生产前、生产中及生产后贮运过程中引起农作物霉变。由于该菌可在低温潮湿的环境下生长繁殖,因此是导致冷藏贮存或长途运输过程中水果、蔬菜、谷物等腐败变质的主要微生物。交链孢毒素是由交链孢菌产生的一系列有毒代谢产物的总称。交链孢酚(alternariol,AOH)和交链孢酚单甲醚(alternariol monomethyl ether,AME)属于二苯-α-吡喃酮类化合物,由Raistrick等[1]首次从Alternaria Tenuis中分离得到,是交链孢菌的主要毒性代谢产物,也是农产品及其制品中检出率较高的两种交链孢毒素。研究表明,AOH、AME具有诱变性和致癌性,随膳食摄入的AOH和AME对公众健康存在风险[2]。本文将对AOH和AME毒素的理化性质及其毒性、产毒影响因素、生物合成和污染现状等方面进行综述。
1 理化性质及毒性
1.1 理化性质
AOH是无色针状结晶,相对分子质量为258.23,分子式C14H10O5,熔点350 ℃;AME同样是无色针状结晶,相对分子质量为272.25,分子式C15H12O5,熔点267 ℃;紫外光照射下,这2 种毒素呈蓝紫色荧光[2]。Siegel等[3]研究了AOH和AME的化学稳定性,结果表明,在pH值为5.0的0.15 mol/L磷酸盐缓冲液中,2 种毒素均十分稳定,但在0.1 mol/L KOH中却都降解为未知的棕色产物;在pH值为7.0、浓度为0.18 mol/L的磷酸盐/柠檬酸盐缓冲液中,AOH和AME则通过水解和脱羧反应分别降解为6-甲基联苯-2,3’,4,5’-四醇和5’-甲氧基-6-甲基联苯-2,3’,4-四醇。
1.2 毒性
AOH、AME等二苯-α-吡喃酮类化合物是多种交链孢菌的主要代谢产物,目前研究表明AOH和AME对实验动物的急性毒性较低,但AOH和AME已被证明具有遗传毒性和致突变性。Pollock等[4]研究了AME的亚急性毒性作用和致畸性,将Alternaria solani产生的AME对叙利亚金色仓鼠进行腹腔注射,剂量为50 mg/kg mb与100 mg/kg mb时,不产生毒性效应,但当剂量增大到200 mg/kg mb时,AME对母鼠和胚胎的毒性效应明显,胎鼠平均体质量减少,内脏严重坏死,但AOH、AME和交链孢烯(altenuene,ALT)对鸡胚、雏鸡和大鼠却没有毒性[5],因此,AOH、AME和ALT的毒性作用可能具有动物种属特异性;Davis等[6]发现AME对鼠伤寒沙门氏菌TA98的诱变性较弱,AOH则无诱变性,也未观察到两者的协同作用;而An Yuhui等[7]的研究结果表明,AME对E. coli ND-160有很强的诱变性,因此,AME可能对不同的基因位点或DNA序列有选择性的诱变作用;大鼠和小鼠的动物实验表明AME对食管下段及前胃有较高的亲和力,说明其致癌作用存在器官特异性[8]。Pero等[9]发现AOH和AME存在协同效应,单独的AOH或AME对HeLa细胞的毒性作用之和比它们混合物的毒性作用要弱,AME可以增强AOH的胚胎毒性,反之亦然,且AME与其他交链孢毒素也存在协同效应[10],因此交链孢菌培养物粗提液的毒性较单一毒素的毒性强。体外细胞实验结果表明[11],AOH和AME的毒性作用机制是可抑制DNA拓扑异构酶的活性而引起细胞DNA损伤,DNA拓扑异构酶与DNA的超螺旋调节有关,并参与细胞的复制、转录和修复等。
此外,AOH和AME可能与某些癌症相关。Liu Guiting[12-13]、Dong Zigang[14]等用AOH处理人胚食管组织细胞,然后将其移植至小鼠中,可引发小鼠鳞状细胞瘤;AOH和AME可导致2BS细胞DNA的断裂,还可与人胚胎食管上皮细胞的DNA结合,诱导人胚胎食管上皮细胞的增生,经AOH和AME处理的人胚胎食管上皮细胞中可检出活化的癌基因;且研究发现食品中交链孢毒素污染率高的地区食管癌发病率也较高,因此,认为我国一些地区食管癌高发可能与交链孢毒素污染有关。利用人工培养的哺乳动物细胞对AOH的毒性进行研究的结果表明,AOH能够引起人工培养的哺乳动物细胞雌激素分泌异常,抑制细胞增殖从而引发遗传毒性效应,这可能与AOH具有致癌性相关[15-16]。AOH的致癌机理与癌基因的激活和抑癌基因的变异有密切关系,特别是能导致DNA聚合酶β的基因发生突变,并可能导致蛋白结构的变化而使DNA聚合酶β的基因修复功能异常[15,17-18]。同时,研究还发现AOH的致癌机制与其浓度水平有关,低浓度的AOH不引起细胞的DNA聚合酶β基因发生突变,较高浓度的AOH才会引起突变,因此较高浓度的AOH存在于食物中,可能造成细胞内基因突变而引发肿瘤[19-21]。
2 影响AOH和AME毒素产生的因素
2.1 产毒菌株
研究表明,多种交链孢菌可产生AOH和AME,如A. alternata是最常见的交链孢菌种类,也是最重要的交链孢毒素产生菌,它能产生包括AOH和AME在内的多种交链孢毒素[22];其他种类的交链孢菌如A. tenuissima、A. arborescens、A. brassicae、A. capsici-annui、A. citri、A. cucumerina、A. dauci、A. kikuchiana、A. longipes、A. porri、A. solani和A. tomato也能产生AOH和AME[23-26]。
2.2 环境因素
AOH和AME毒素产生不仅与产毒菌株有关,还与培养基质、培养状态、温度、pH值、水活度等环境条件息息相关[22]。
Maas等[27]对A. alternata在不同培养基基质上的产毒情况进行了分析,结果表明,A. alternata在复杂的液态基质及固态大米培养基上主要产生AOH和AME,虽然产毒菌株分离物不同,但AOH和AME均在固态大米培养基上达到最高产量;在合成和半合成培养基上,A. alternata在生长后期产生AOH、AME,且在半合成培养基上的产量较高,这是因为在半合成培养基中存在酵母膏提取物等利于交链孢菌产毒的物质,能够为其新陈代谢提供多种营养成分及生长因子[28]。
Brzonkalik等[29]首次研究了不同形态碳源、氮源及培养状态(振摇培养和静止培养)对交链孢毒素产生的影响,结果表明:碳源方面,在互隔交链孢中,相比于葡萄糖、果糖、蔗糖、乙酸盐和碳源的混合物,乙酸钠更有利于AOH的产生,但却抑制AME的产生;互隔交链孢的产毒性能也受氮源的调控,总体来看,有机氮源比无机氮源更有利于AOH和AME的产生,如苯丙氨酸的存在能极大地促进AOH、AME的产生,还有一些氮源如硝酸钾或硝酸钠则抑制上述2 种毒素的产生,仅当硝酸盐被消耗完后,才产生AOH,因此,氮源对于通过聚酮合酶途径产生毒素的生物合成途径的影响要比碳源的影响更大一些;另外,在振摇状态下培养,所有真菌毒素的产生量低于静止状态培养,因此,静置培养可能更有利于毒素的产生。总之,交链孢毒素的产生不仅受不同形态碳氮来源的影响,还受培养状态的影响。
Brzonkalik等[30]还研究了不同pH值(3.5~8.0)和C/N比(24~96)对A. alternata DSM 12633菌株产AOH、AME毒素的影响,结果表明,pH值为4.0~4.5时,DSM 12633菌株的产毒量最高,pH值高于5.5时产毒量下降,甚至不产毒;随着C/N比值增高,菌株产毒量不断增加,当C/N比值为72时,菌株产毒量最高,C/N比值高于72时,菌株产毒量并不随着C/N比值的增高而增加。
Vaquera等[31]在合成番茄培养基上研究了水分活度和温度对A. arborescens产毒素情况的影响,结果表明,温度为30 ℃,水分活度为0.975时,AOH和AME的含量达到最高;温度为6 ℃,水分活度为0.95时,没有检测到明显的AOH和AME,因此,较高的温度和水分活度有利于A. arborescens产生毒素。
温度是影响交链孢菌生长和产毒水平的重要因素,如A. alternata在番茄果实上的生长温度范围为4~25 ℃,虽然菌株生长量和产毒量在25 ℃时比较低温度时高,但AOH和AME的产量在15 ℃贮存4 周时达到峰值;长期贮存时,AOH和AME的含量会有所下降[32]。A. alternata在苹果中的产毒水平受温度影响也较大,25 ℃贮存时,分别有47%和41%的交链孢菌在苹果上产生AOH和AME毒素,同时产生以上3 种毒素的交链孢菌占38%;2 ℃贮存时,产生AOH和AME毒素的菌株比例有所减少:分别产生AOH和AME的菌株比例为17%和5.9%,同时产生2 种毒素的菌株比例为5.9%[33]。
综上所述,交链孢菌的产毒素性能受产毒真菌的种类、温度和培养条件等多种因素的影响,由于目前交链孢毒素的生物合成途径尚不完全清楚,各影响因素的作用机制尚不明确,对产毒影响因素的进一步研究以及交链孢毒素生物合成途径的进一步解析,将有助于揭示交链孢菌产毒影响因素的作用机制。
3 生物及化学合成
AOH和AME属于聚酮化合物,其生物合成过程产生含有多个酮基的中间产物,聚酮合酶(polyketide synthase,PKS)是催化这种中间产物合成的关键酶[34]。Koch等[35]以苔黑素(1,3-二羟基-5-甲苯)为原料,通过甲基化等7 个步骤合成了AOH和AME。目前大家所接受的AOH形成途径是1 个乙酰辅酶A和6 个丙二酰辅酶A在酮基合成酶及酰基转移酶的作用下通过头尾醛醇缩合反应(这个缩合过程没有氧原子及其他原子的丢失),使聚酮得以延长,最终在硫酯酶作用下,碳链释放,通过醇醛缩合芳构化和内酯化形成AOH。AOH是大多数二苯并吡喃酮衍生物的形成前体,AOH与S-腺苷甲氨硫酸反应生成AME,AME在一定条件下发生蒽醌重排,降解产物就是其他二苯并吡喃酮衍生物[36]。
AOH和AME合成相关聚酮合酶的作用机理尚不明确,但目前已克隆获得多个与AOH及AME合成相关的A. alternata聚酮合酶编码基因,其功能尚未完全清楚,其中pksJ是合成交链孢酚的关键基因,而PksH下调会影响pksJ表达;另外AME为AOH甲基化产物,可能受转录因子altR调控;随后的研究证明SnPKS19是Parastagonopora nodorum合成AOH的关键基因[36-37]。随着科学技术的进步及研究的深入,越来越多的毒素合成基因及其作用机理将被揭示。
4 污染现状
AOH和AME是污染水果、蔬菜和谷物等农产品的主要交链孢毒素,由于AOH和AME在农产品的加工过程中稳定存在,因此,很多农产品的加工制品中也存在AOH和AME[38]。近年来,随着检测技术的进步,色谱质谱联用等快速、准确、灵敏的检测方法相继应用于包括交链孢毒素在内的真菌毒素的检测[39],农产品及其制品中AOH和AME的检测准确度和精度越来越高。2000年以来,德国、瑞士、荷兰等欧洲国家、美国、加拿大、阿根廷以及中国已经报道的AOH和AME污染的农产品及其制品包括番茄、苹果、蓝莓、葡萄、柑橘等果蔬(表1),也包括小麦、大麦、燕麦、玉米等谷物及部分油料作物(表2)。如Scott等[40-41]利用高效液相色谱串联质谱(high-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术对来自加拿大的17 份当地红葡萄酒和7 份进口红葡萄酒中的AME和AOH进行了测定,结果显示,13 份当地红葡萄酒及7 份进口红葡萄酒中均检出AOH,且样品中常伴有痕量的AME;白葡萄酒中AOH和AME含量较少(≤1.5 ng/mL),而且这两种毒素在酒中比较稳定。Lau等[42]利用电喷雾液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术测定加拿大市售苹果汁和其他水果饮料中的交链孢毒素,结果表明,AOH存在于苹果汁、葡萄汁、覆盆子果汁、蔓越莓花蜜、西梅汁、红葡萄酒等水果制品中,质量浓度最高达6 ng/mL;且除覆盆子果汁之外的其他样品中还检测到了AME,质量浓度为0.2~1.4 ng/mL。Azcarate等[43]对阿根廷2004年和2005年收获的64 个小麦样本进行检测,结果发现:23%的样本中含有AME,其是小麦样品中的主要交链孢毒素,6%的小麦中含有AOH;Wagacha等[44]用HPLC-MS/MS方法对从肯尼亚采集的26 份小麦样品中的AOH和AME进行了测定,结果发现27%的样品污染了AOH和AME。Noser等[45]利用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)快速检测方法,对85 份瑞士市售番茄制品进行了检测,结果发现,新鲜番茄中未检测到交链孢毒素,但瑞士市售26 份番茄制品中含有AOH,26份番茄制品中含有AME,含量分别为4~33 μg/kg和1~9 μg/kg。López等[46]利用UPLC-MS和LC-MS/MS技术对荷兰地区包括番茄酱、谷物制品等在内的95 份样品进行了检测,结果发现,14 份谷物样品中,1 份样品呈AOH和AME阳性,含量分别为3.0 μg/kg和5.2 μg/kg;8 份番茄酱中有4 份检出AOH和AME,检出率均为50%,含量分别为小于1.0~7.8 μg/kg和小于2.0~25 μg/kg;11 份新鲜苹果样品中有1 份检测出AOH,含量为29 μg/kg;5 份红酒样品中1 份呈AOH阳性,含量为11 μg/kg;Hickert等[47]利用HPLC-MS/MS技术对德国市售番茄制品、果汁及烘焙制品等96 个样品进行了检测,发现番茄制品、果汁等食品中AOH和AME的检出率较高:34 份番茄制品中,AOH和AME的检出率分别为70.59%和79.41%,含量分别为6.1~25 μg/kg和1.2~7.4 μg/kg;23 份果汁中AOH和AME的检出率分别为56.52%和43.48%,含量分别为0.65~16 μg/kg和0.14~4.9 μg/kg;9 个烘焙制品中8 个呈AME阳性,毒素平均含量为3.2 μg/kg;19 份蔬菜油中AOH和AME的检出率分别为47.37%和84.21%,含量分别为6.0 μg/kg和2.8~14 μg/kg;11 份葵花籽油中AOH和AME的检出率分别为54.55%和63.64%,含量分别为16~39 μg/kg和0.64~21 μg/kg。何强等[48]利用UPLC-MS/MS检测浓缩苹果汁中AOH、AME等在内的交链孢毒素,结果表明,15 份我国市售浓缩苹果汁样品中,1 份检出AOH和AME,含量分别为1.9 μg/kg和0.8 μg/kg。近年来,我国的小麦及其制品中也不断检测出AOH和AME[49-50]。
表1 2000年以来果蔬及其制品中交链孢毒素污染情况
Table 1 Contamination of AOH and AME in fruits, vegetables and their products since 2000
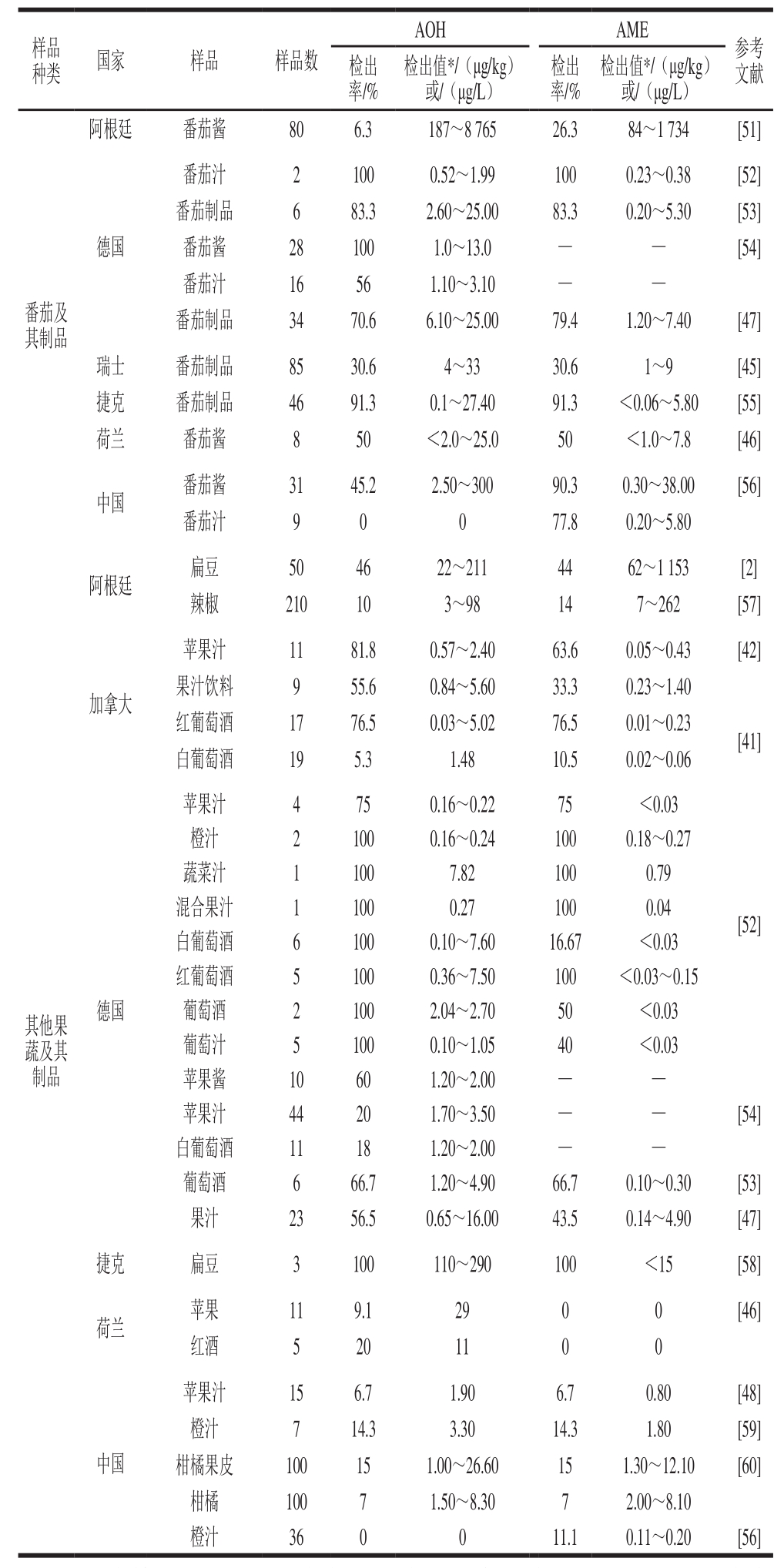
注:-. 未检出;*.固体类农产品及其制品单位采用μg/kg,液体类农产品及其制品单位采用μg/L。下同。
样品种类 国家 样品 样品数AOH AME参考文献检出率/%检出值*/(μg/kg)或/(μg/L)检出率/%检出值*/(μg/kg)或/(μg/L)番茄及其制品阿根廷 番茄酱 80 6.3 187~8 765 26.3 84~1 734 [51]德国番茄汁 2 100 0.52~1.99 100 0.23~0.38 [52]番茄制品 6 83.3 2.60~25.00 83.3 0.20~5.30 [53]番茄酱 28 100 1.0~13.0 — — [54]番茄汁 16 56 1.10~3.10 — —番茄制品 34 70.6 6.10~25.00 79.4 1.20~7.40 [47]瑞士 番茄制品 85 30.6 4~33 30.6 1~9 [45]捷克 番茄制品 46 91.3 0.1~27.40 91.3 <0.06~5.80 [55]荷兰 番茄酱 8 50 <2.0~25.0 50 <1.0~7.8 [46]中国 番茄酱 31 45.2 2.50~300 90.3 0.30~38.00 [56]番茄汁 9 0 0 77.8 0.20~5.80其他果蔬及其制品阿根廷 扁豆 50 46 22~211 44 62~1 153 [2]辣椒 210 10 3~98 14 7~262 [57]加拿大苹果汁 11 81.8 0.57~2.40 63.6 0.05~0.43 [42]果汁饮料 9 55.6 0.84~5.60 33.3 0.23~1.40红葡萄酒 17 76.5 0.03~5.02 76.5 0.01~0.23 [41]白葡萄酒 19 5.3 1.48 10.5 0.02~0.06德国苹果汁 4 75 0.16~0.22 75 <0.03[52]橙汁 2 100 0.16~0.24 100 0.18~0.27蔬菜汁 1 100 7.82 100 0.79混合果汁 1 100 0.27 100 0.04白葡萄酒 6 100 0.10~7.60 16.67 <0.03红葡萄酒 5 100 0.36~7.50 100 <0.03~0.15葡萄酒 2 100 2.04~2.70 50 <0.03葡萄汁 5 100 0.10~1.05 40 <0.03苹果酱 10 60 1.20~2.00 — —[54]苹果汁 44 20 1.70~3.50 — —白葡萄酒 11 18 1.20~2.00 — —葡萄酒 6 66.7 1.20~4.90 66.7 0.10~0.30 [53]果汁 23 56.5 0.65~16.00 43.5 0.14~4.90 [47]捷克 扁豆 3 100 110~290 100 <15 [58]荷兰 苹果 11 9.1 29 0 0 [46]红酒 5 20 11 0 0中国苹果汁 15 6.7 1.90 6.7 0.80 [48]橙汁 7 14.3 3.30 14.3 1.80 [59]柑橘果皮 100 15 1.00~26.60 15 1.30~12.10 [60]柑橘 100 7 1.50~8.30 7 2.00~8.10橙汁 36 0 0 11.1 0.11~0.20 [56]
交链孢毒素的污染水平和稳定性受贮存方式、温度、压力和不同食品基质的影响。Combina等[61]将含有AOH和AME的葵花籽粉在不同温度、压力条件下经一定时间处理后,测定其处理前后毒素含量的变化,结果发现AOH、AME经100 ℃处理90 min含量无明显变化,121 ℃条件下处理60 min可有效降低AOH、AME含量;Scott等[40]对不同条件下果汁和果酒中的AOH和AME含量进行研究,将果汁在室温条件下存放20 d,其中的AOH、AME含量基本不变,2 种毒素在果酒中也具有相似的稳定性,因此,AOH和AME可能在室温条件下能长期保持稳定,但高温条件下易降解。另外,交链孢毒素在果实不同部位的含量也不相同,对柑橘全果、果皮、果肉等不同部位取样后的检测结果表明:交链孢毒素主要产生在果皮上,而后通过果皮残留于果实[60,62-63]。
表2 2000年以来其他农产品及制品中交链孢毒素污染情况
Table 2 Contamination of AOH and AME in other agro-products since 2000

样品种类 国家 样品 样品数AOH AME 参考文献检出率/% 检出值*/(μg/kg)或/(μg/L) 检出率/% 检出值*/(μg/kg)或/(μg/L)谷物及其制品阿根廷 小麦 64 9.4 645~1 388 23 566~7 451 [43]比利时 玉米 14 7.1 17 7.1 19 [64]爱沙尼亚 小麦 4 75 210~340 — — [65]大麦 4 25 130 — —瑞典 大麦/小麦/燕麦 18 88.9 9~335 38.9 1~184 [66]德国谷物制品 13 7.7 0.00~4.10 13 0 [53]燕麦粉(动物) 6 83.3 13~250 100 3~100小麦 1 064 8.1 0~832 3.1 0~905 [67]烘焙制品 9 88.9 — 88.9 3.20 [47]捷克 小麦 129 46.5 6.30~44.40 0 0 [2]玉米 8 25 19~25 0 0 [64]荷兰 谷物制品 14 7.1 3.0 7.1 5.20 [46]俄罗斯小麦 28 14.3 76~192 — —[68]大麦 76 28.9 20~126 — —玉米 52 9.6 38~169 — —麦麸 10 4 20~63 — —玉米麸质 20 80 20~190 — —肯尼亚 小麦 26 27 37~71 27 5~174 [44]中国小麦 22 90.9 116~731 95.5 52~1 426 [69]小麦粉 181 6.1 16.00~98.70 91.2 0.30~61.80 [49]干面条 52 5.8 9.59~11.80 61.5 0.18~4.10面包 50 2.0 9.98 44 0.18~6.49 [50]馒头 40 0 0 72.5 0.21~1 041小麦 192 51.9 1.30~74.40 14.9 0.30~54.80其他食品德国 蔬菜油 19 47.4 6.0 84.2 2.8~14.00 [47]葵花籽油 11 54.6 16~39 63.6 0.64~21.00捷克 亚麻籽 122 3.3 <104 16.4 <30 [70]俄罗斯 豆饼 7 14.3 23 — — [68]葵花粕油饼 21 81 25~388 — —
5 结 语
交链孢毒素在全球范围内广泛分布,对人类和动物健康存在一定的风险。欧洲食品安全局提出了一种可采用毒理学关注阈值(threshold of toxicological concern,TTC)方法来评估食品中交链孢毒素对人类健康的潜在风险[2],由于AOH和AME具有诱变性,估算的慢性膳食暴露上限与第95个百分位膳食暴露均值超过了TTC值(2.5 ng/(kg·d)mb),说明随膳食摄入的AOH和AME对公众健康可能存在潜在风险。长期以来,由于鲜食的果蔬在食用过程中会去除腐烂部位,果蔬中的真菌毒素污染未引起足够的重视,而且到目前为止,国内外现行有效的农产品及其制品相关的真菌毒素限量标准中尚不包括交链孢毒素,因此制定各种标准和法规来控制交链孢毒素在谷物、水果及其制品中的污染乃是当务之急,目前欧盟已开始着手制定交链孢毒素的最大残留限量标准[71],我国也应尽快从安全角度考虑,建立既符合国际通行规则又符合本国国情的风险评估技术和限量标准。
随着国家对农产品质量安全的日益重视,精准快速检测技术已成为检测方法中的热点问题,HPLC-MS等常规检测方法是交链孢毒素传统的检测方法,但是这些大型的检测设备只能满足实验室中检测的需求,不能满足实时、快速、便携式检测的需求,而免疫检测技术具有反应快速、灵敏度高、特异性强、成本较低且可开发成便携式快速检测试剂盒等优点,但需要针对不同的毒素筛选到专一、亲和性高的抗体,因此还没有在交链孢毒素检测中得到广泛应用。目前用于交链孢毒素的免疫学检测方法只有酶联免疫吸附测定技术,且仅应用于细交链格孢酮酸[72-73]和AOH[54]。交链孢毒素快速检测试剂盒的开发和快速检测方法的建立不仅可以省时省力,同时还能减少样品的消耗量,对农产品中交链孢毒素的检测具有重大意义。
参考文献:
[1] RAISTRICK H, STICKINGS C E, THOMAS R. Studies in the biochemistry of micro-organisms. alternariol and alternariol monomethyl ether, metabolic products of Alternaria tenuis[J].Biochemical Journal, 1953, 55(3): 421-433. DOI:10.1042/bj0550421.
[2] EFSA (European Food Safety Authority) Panel on Contaminants in the Food Chain. Scientific opinion on the risks for animal and public health related to the presence of Alternaria toxins in feed and food[J].EFSA Journal, 2011, 9(10): 2407. DOI:10.2903/j.efsa.2011.2407.
[3] SIEGEL D, FEIST M, PROSKE M, et al. Degradation of the Alternaria mycotoxins alternariol, alternariol monomethyl ether, and altenuene upon bread baking[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9622-9630. DOI:10.1021/jf102156w.
[4] POLLOCK G A, DISABATINO C E, HEIMSCH R C, et al. The subchronic toxicity and teratogenicity of alternariol monomethyl ether produced by Alternaria solani[J]. Food and Chemical Toxicology,1982, 20(6): 899-902. DOI:10.1016/S0015-6264(82)80225-3.
[5] GRIFFIN G F, CHU F S. Toxicity of the Alternaria metabolites alternariol, alternariol methyl ether, altenuene, and tenuazonic acid in the chicken embryo assay[J]. Applied and Environmental Microbiology, 1983, 46(6): 1420-1422.
[6] DAVIS V M, STACK M E. Evaluation of alternariol and alternariol methyl ether for mutagenic activity in salmonella typhimurium[J].Applied and Environmental Microbiology, 1994, 60(10): 3901-3902.
[7] AN Yuhui, ZHAO Tianzheng, MIAO Jian, et al. Isolation,identification, and mutagenicity of alternariol monomethyl ether[J].Journal of Agricultural and Food Chemistry, 1989, 37(5): 1341-1343.DOI:10.1021/jf00089a029.
[8] 石智勇, 刘桂亭, 钱玉珍, 等. 交链孢酚单甲醚在大鼠小鼠体内的分布[J]. 河南医科大学学报, 1990, 25(2): 136-140. DOI:10.13705/j.issn.1671-6825.1990.02.006.
[9] PERO R W, POSNER H, BLOIS M, et al. Toxicity of metabolites produced by the “Alternaria”[J]. Environmental Health Perspectives,1973, 4: 87-94. DOI:10.1289/ehp.730487.
[10] 安玉会, 卢荣华, 冯文舟, 等. 林县交链孢霉毒素: 交链孢醇单甲醚和交链孢烯的协同毒性和致畸作用研究[J]. 癌症, 1988, 7(1): 54-55.
[11] FEHR M, PAHLKE G, FRITZ J, et al. Alternariol acts as 42a topoisomerase poison, preferentially affecting the IIα isoform[J].Molecular Nutrition & Food Research, 2009, 53(4): 441-451.DOI:10.1002/mnfr.200700379.
[12] LIU Guiting, QIAN Yuzhen, ZHANG Peng, et al. Etiological role of Alternaria alternata in human esophageal cancer[J]. Chinese Medical Journal, 1992, 105(5): 394-400.
[13] LIU Guiting, QIAN Yuzhen, ZHANG Peng, et al. Relationships between Alternaria alternate and oesophageal cancer[J]. Iarc Scientific Publications, 1991(105): 258-262.
[14] DONG Zigang, LIU Guiting, DONG Ziming, et al. Induction of mutagenesis and transformation by the extract of Alternaria alternata isolated from grains in Linxian, China[J]. Carcinogenesis, 1987, 8(7):989-991. DOI:10.1093/carcin/8.7.989.
[15] BRUGGER E M, WAGNER J, SCHUMACHER D M, et al.Mutagenicity of the mycotoxin alternariol in cultured mammalian cells[J]. Toxicology Letters, 2006, 164(3): 221-230. DOI:10.1016/j.toxlet.2006.01.001.
[16] LEHMANN L, WAGNER J, METZLER M. Estrogenic and clastogenic potential of the mycotoxin alternariol in cultured mammalian cells[J]. Food and Chemical Toxicology, 2006, 44(3):398-408. DOI:10.1016/j.fct.2005.08.013.
[17] SCHRADER T J, CHERRY W, SOPER K, et al. Examination of Alternaria alternate mutagenicity and effects of nitrosylation using the Ames Salmonella test[J]. Teratogen Carcinogen Mutagen, 2001, 21(4):261-274. DOI:10.1002/tcm.1014.
[18] PFEIFFER E, ESCHBACH S, METZLER M. Alternaria toxins: DNA strand-breaking activity in mammalian cells in vitro[J]. Mycotoxin Research, 2007, 23(3): 152-157. DOI:10.1007/BF02951512.
[19] 朱涵, 樊红琨, 章茜. 互隔交链孢酚对NIH/3T3细胞中DNA聚合酶β的致突变作用[J]. 中国组织工程研究, 2012, 16(15): 2831-2834.DOI:10.3969/j.issn.1673-8225.2012.15.038.
[20] 朱涵, 杨春, 赵伟达, 等. 交链孢酚对成纤维细胞中DNA聚合酶β的影响[J]. 现代预防医学, 2012, 39(19): 5071-5073.
[21] 杨胜利, 董子明, 裴留成, 等. 河南林县居民粮食中互隔交链孢霉及其毒素污染和人群暴露状况研究[J]. 癌变·畸变·突变, 2007, 19(1):44-46. DOI:10.3969/j.issn.1004-616X.2007.01.013.
[22] PASTER N, BARKAI-GOLAN R. Mouldy fruits and vegetables as a source of mycotoxins: part 1[J]. World Mycotoxin Journal, 2008, 1(2): 147-159.
[23] BOTTALICO A, LOGRIECO A. Toxigenic Alternaria species of economic importance[M]// DOWD P F. Mycotoxins in agriculture and food safety. New York: Marcel Dekker, 1998: 65-108.
[24] ANDERSEN B, FRISVAD J C. Natural occurrence of fungi and fungal metabolites in moldy tomatoes[J]. Journal of Agricultural and Food Chemistry, 2004, 52(25): 7507-7513. DOI:10.1021/jf048727k.
[25] POSE G, LUDEMANN V, SEGURA J, et al. Mycotoxin production by Alternaria strains isolated from tomatoes affected by Blackmold in Argentina[J]. Mycotoxin Research, 2004, 20(2): 80-85. DOI:10.1007/BF02946738.
[26] NTASIOU P, MYRESIOTIS C, KONSTANTINOU S, et al.Identification, characterization and mycotoxigenic ability of Alternaria spp. causing core rot of apple fruit in Greece[J]. International Journal of Food Microbiology, 2015, 197: 22-29. DOI:10.1016/j.ijfoodmicro.2014.12.008.
[27] MAAS M R, WOODY M A, CHU F S. Production of alternariol and alternariol methyl ether by Alternaria spp.[J]. Journal of Food Safety,1980, 3(1): 39-47. DOI:10.1111/j.1745-4565.1980.tb00407.x.
[28] WEI C I, SWARTZ D D. Growth and production of mycotoxins by Alternaria alternata in synthetic, semi-synthetic and rice media[J].Journal of Food Protection, 1985, 48(4): 306-311. DOI:10.4315/0362-028X-48.4.306.
[29] BRZONKALIK K, HERRLING T, SYLDATK C, et al. The influence of different nitrogen and carbon sources on mycotoxin production in Alternaria alternata[J]. International Journal of Food Microbiology,2011, 147(2): 120-126. DOI:10.1016/j.ijfoodmicro.2011.03.016.
[30] BRZONKALIK K, HÜMMER D, SYLDATK C, et al. Influence of pH and carbon to nitrogen ratio onmycotoxin production by Alternaria alternata insubmerged cultivation[J]. AMB Express, 2012, 2(1): 1-8.DOI:10.1186/2191-0855-2-28.
[31] VAQUERA S, PATRIARCA A, FERNÁNDEZ P V. Water activity and temperature effects on growth of Alternaria arborescens on tomato medium[J]. International Journal of Food Microbiology, 2014,185(1): 136-139. DOI:10.1016/j.ijfoodmicro.2014.06.007.
[32] OZCELIK S, OZCELIK N, BEUCHAT L R. Toxin production by Alternaria alternata in tomatoes and apples stored under various conditions and quantitation of the toxins by high-performance liquid chromatography[J]. International Journal of Food Microbiology, 1990,11(3/4): 187-194. DOI:10.1016/0168-1605(90)90011-S.
[33] VIÑAS I, BONET J, SANCHIS V. Incidence and mycotoxin production by Alternaria tenuis in decayed apples[J]. Letters in Applied Microbiology, 1992, 14(6): 284-287. DOI:10.1111/j.1472-765X.1992.tb00706.x.
[34] COX R J. Polyketides, proteins and genes in fungi: programmed nanomachines begin to reveal their secrets[J]. Organic & Biomolecular Chemistry, 2007, 5(13): 2010-2026. DOI:10.1002/chin.200740268.
[35] KOCH K, PODLECH J, PFEIFFER E, et al. Total synthesis of alternariol[J]. Journal of Organic Chemistry, 2005, 70(8): 3275-3276.DOI:10.1021/jo050075r.
[36] SAHA D, FETZNER R, BURKHARDT B, et al. Identification of a polyketide synthase required for alternariol (AOH) and alternariol-9-methyl ether (AME) formation in Alternaria alternata[J]. PLoS ONE,2012, 7(7): 1-14. DOI:10.1371/journal.pone.0040564.
[37] CHOOI Y H, MURIA-GONZALEZ M J, MEAD O L, et al. SnpkS19 encodes the polyketide synthase for alternariol mycotoxin biosynthesis in the wheat pathogen Parastagonospora nodorum[J]. Applied and Environmental Microbiology, 2015, 81(16): 5309-5317. DOI:10.1128/AEM.00278-15.
[38] SCOTT P M. Analysis of agricultural commodities and foods for Alternaria mycotoxins[J]. Journal of AOAC International, 2001, 84(6): 1809-1817.
[39] 满燕, 梁刚, 李安, 等. 链格孢霉毒素检测方法研究进展[J]. 食品安全质量检测学报, 2016, 7(2): 453-458.
[40] SCOTT P M, KANHERE S R. Stability of Alternaria toxins in fruit juices and wine[J]. Mycotoxin Research, 2001, 17(1): 9-14.DOI:10.1007/BF02946112.
[41] SCOTT P M, LAWRENCE G A, LAU B P Y. Analysis of wines,grape juices and cranberry juices for Alternaria toxins[J]. Mycotoxin Research, 2006, 22(2): 142-147. DOI:10.1007/BF02956778.
[42] LAU B P-Y, SCOTT P M, LEWIS D A, et al. Liquid chromatographymass spectrometry and liquid chromatography-tandem mass spectrometry of the Alternaria mycotoxins alternariol and alternariol monomethyl ether in fruit juices and beverages[J]. Journal of Chromatography A, 2003, 998(1/2): 119-131. DOI:10.1016/S0021-9673(03)00606-X.
[43] AZCARATE P M, PATRIARCA A, TERMINIELLO L, et al.Alternaria toxins in wheat during the 2004 to 2005 argentinean harvest[J]. Journal of Food Protection, 2008, 71(6): 1262-1265.
[44] WAGACHA J M, STEINER U, DEHNE H W, et al. Diversity in mycotoxins and fungal species infecting wheat in Nakuru District,Kenya[J]. Journal of Phytopathology, 2010, 158(7/8): 527-535.DOI:10.1111/j.1439-0434.2009.01653.x.
[45] NOSER J, SCHNEIDER P, ROTHER M, et al. Determination of six Alternaria, toxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market[J]. Mycotoxin Research, 2011, 27(4): 265-271. DOI:10.1007/s12550-011-0103-x.
[46] LÓPEZ P, VENEMA D, DE RIJK T, et al. Occurrence of Alternaria toxins in food products in the Netherlands[J]. Food Control, 2016, 60:196-204. DOI:10.1016/j.foodcont.2015.07.032.
[47] HICKERT S, BERGMANN M, ERSEN S, et al. Survey of Alternaria,toxin contamination in food from the German market, using a rapid HPLC-MS/MS approach[J]. Mycotoxin Research, 2016, 32(1): 7-18.DOI:10.1007/s12550-015-0233-7.
[48] 何强, 李建华, 孔祥虹, 等. 超高效液相色谱-串联质谱法同时测定浓缩苹果汁中的4 种链格孢霉毒素[J]. 色谱, 2010, 28(12): 1128-1131.DOI:10.3724/SP.J.1123.2010.01128.
[49] ZHAO K, SHAO B, YANG D J, et al. Natural occurrence of Alternaria toxins in wheat-based products and their dietary exposure in China[J]. PLoS ONE, 2015, 10(6): 1-11. DOI:10.1371/journal.pone.0132019.
[50] XU W J, HAN X M, LI F Q, et al. Natural occurrence of Alternaria toxins in the 2015 wheat from Anhui province, China[J]. Toxins, 2016,8(11): 1-11. DOI:10.3390/toxins8110308.
[51] TERMINIELLO L, PATRIARCA A, POSE G, et al. Occurrence of alternariol, alternariol monomethyl ether and tenuazonic acid in Argentinean tomato puree[J]. Mycotoxin Research, 2006, 22(4): 236-240. DOI:10.1007/BF02946748.
[52] ASAM S, KONITZER K, SCHIEBERLE P, et al. Stable isotope dilution assays of alternariol and alternariol monomethyl ether in beverages[J]. Journal of Agricultural and Food Chemistry, 2009,57(12): 5152-5160. DOI:10.1021/jf900450w.
[53] ASAM S, KONITZER K, RYCHLIK M. Precise determination of the Alternaria mycotoxins alternariol and alternariol monomethyl ether in cereal, fruit and vegetable products using stable isotope dilution assays[J]. Mycotoxin Research, 2011, 27(1): 23-28. DOI:10.1007/s12550-010-0071-6.
[54] ACKERMANN Y, CURTUI V, DIETRICH R, et al. Widespread occurrence of low levels of alternariol in apple and tomato products,as determined by comparative immunochemical assessment using monoclonal and polyclonal antibodies[J]. Journal of Agricultural and Food Chemistry, 2011, 59(12): 6360-6368. DOI:10.1021/jf201516f.
[55] OSTRY V. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs[J/OL]. World Mycotoxin Journal, 2008, 1(2): 175-188.DOI:10.3920/WMJ2008.x013.
[56] ZHAO K, SHAO B, YANG D J, et al. Natural occurrence of four Alternaria mycotoxins in tomato- and citrus-based foods in China[J].Journal of Agricultural and Food Chemistry, 2015, 63(1): 343-348.DOI:10.1021/jf5052738.
[57] DA CRUZ CABRAL L, TERMINIELLO L, PINTO F V, et al. Natural occurrence of mycotoxins and toxigenic capacity of Alternaria strains from mouldy peppers[J]. International Journal of Food Microbiology,2016, 236: 155-160. DOI:10.1016/j.ijfoodmicro.2016.08.005.
[58] OSTRY V, SKARKOVA J, RUPRICH J. Occurrence of Alternaria mycotoxins and Alternaria spp. in lentils and human health[C]// 26thHerrsching: MycotoxinWorkshop, 2004.
[59] 李建华, 何强, 孔祥虹, 等. 凝胶渗透净化-超高效液相色谱-串联质谱法测定橙汁中链格孢霉毒素[J]. 化学分析计量, 2012, 21(3): 20-23. DOI:10.3969/j.issn.1008-6145.2012.03.006.
[60] 史文景, 赵其阳, 焦必宁. UPLC-ESI-MS-MS结合QuEChERS同时测定柑橘中的4 种真菌毒素[J]. 食品科学, 2014, 35(20): 170-174.DOI:10.7506/spkx1002-6630-201420034.
[61] COMBINA M, DALCERO A, VARSAVSKY E, et al. Effect of heat treatments on stability of altemariol, alternariol monomethyl ether and tenuazonic acid in sunflower flour[J]. Mycotoxin Research, 1999,15(1): 33-38. DOI:10.1007/BF02945212.
[62] MAGNANI R F, DE SOUZA G D, RODRIGUES-FILHO E. Analysis of alternariol and alternariol monomethyl ether on flavedo and albedo tissues of tangerines (Citrus reticulata) with symptoms of altenaria brown spot[J]. Journal of Agricultural and Food Chemistry, 2007,55(13): 4980-4986. DOI:10.1021/jf0704256.
[63] 蒋黎艳, 赵其阳, 龚蕾, 等. 超高效液相色谱串联质谱法快速检测柑橘中的5 种链格孢霉毒素[J]. 分析化学, 2015, 43(12): 1851-1858.DOI:10.11895/j.issn.0253-3820.150370.
[64] MONBALIU S, VAN POUCKE C, DETAVERNIER C, et al.Occurrence of mycotoxins in feed as analyzed by a multi-mycotoxin LC-MS/MS method[J]. Journal of Agricultural and Food Chemistry,2010, 58(1): 66-71. DOI:10.1021/jf903859z.
[65] KÜTT M L, LÕIVEKE H, TANNER R. Detection of alternariol in Estonian grain samples[J]. Agronomy Research, 2010, 8(Special Issue II): 317-322.
[66] HÄGGBLOM P, STEPINSKA A, SOLYAKOV A. Alternaria mycotoxins in Swedish feed grain[C]// Proceedings of the 29th Stuttgart-Fellbach, Germany: Mycotoxin Workshop, 2007: 35.
[67] MÜLLER M E H, KORN U. Alternaria mycotoxins in wheat: a 10 years survey in the northeast of Germany[J/OL]. Food Control, 2013,34(1): 191-197. DOI:10.1016/j.foodcont.2013.04.018.
[68] BURKIN A A, KONONENKO G P. Enzyme immunoassay of alternariol for the assessment of risk of agricultural products contamination[J]. Applied Biochemistry and Microbiology, 2011,47(1): 72-76. DOI:10.1134/S0003683811010030.
[69] LI F Q, YOSHIZAWA T. Alternaria mycotoxins in weathered wheat from China[J]. Journal of Agricultural and Food Chemistry, 2000,48(7): 2920-2924. DOI:10.1021/jf0000171.
[70] KRÁLOVÁ J, HAJŠLOVÁ J, POUSTKA J, et al. Occurrence of Alternaria toxins in fibre flax, linseed, and peas grown in organic and conventional farms: monitoring pilot study[J]. Czech Journal of Food Sciences, 2006, 24(6): 288-296.
[71] PRELLE A, SPADARO D, GARIBALDI A, et al. A new method for detection of five Alternaria toxins in food matrices based on LCAPCI-MS[J]. Food Chemistry, 2013, 140(1/2): 161-167. DOI:10.1016/j.foodchem.2012.12.065.
[72] GROSS M, CURTUI V, ACKERMANN Y, et al. Enzyme immunoassay for tenuazonic acid in apple and tomato products[J].Journal of Agricultural and Food Chemistry, 2011, 59(23): 12317-12322. DOI:10.1021/jf203540y.
[73] 杨星星, 刘细霞, 王弘, 等. 细交链孢菌酮酸酶联免疫吸附分析方法研究[J]. 分析化学, 2012, 40(9): 1347-1352. DOI:10.3724/SP.J.1096.2012.11253.
Review on Alternariol and Alternariol Monomethyl Ether in Agro-Products
JIANG Dongmei, WANG Yao, JIANG Nan, WEI Dizhe, MA Shuai, WANG Meng*
(Risk Assessment Laboratory for Agro-Products (Beijing), Ministry of Agriculture, Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China)
Abstract:Fungi of the genus Alternaria spp. are one of the important plant pathogens that can produce a variety of mycotoxins. Alternariol (AOH) and alternariol monomethyl ether (AME) are two important Alternaria spp. toxins that can contaminate various agro-products including vegetables, fruits, grains and their processed products. In this paper, the structure, physicochemical characteristics and toxicity of AOH and AME, the factors affecting their formation, their chemical and biological synthesis pathways, and the current status of their contamination levels are reviewed. Future prospects for the formulation of maximum residue limit standards and for the rapid detection of AOH and AME are discussed.
Key words:Alternaria spp.; mycotoxin; alternariol; alternariol monomethyl ether
DOI:10.7506/spkx1002-6630-201721045
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)21-0287-07
引文格式:姜冬梅, 王瑶, 姜楠, 等. 农产品及其制品中交链孢酚和交链孢酚单甲醚研究进展[J]. 食品科学, 2017, 38(21): 287-293.
DOI:10.7506/spkx1002-6630-201721045. http://www.spkx.net.cn
JIANG Dongmei, WANG Yao, JIANG Nan, et al. Review on alternariol and alternariol monomethyl ether in agroproducts[J]. Food Science, 2017, 38(21): 287-293. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721045. http://www.spkx.net.cn
收稿日期:2017-02-21
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0400902);国家农产品质量安全风险评估重大专项(GJFP2017013);北京市农林科学院青年基金项目(QNJJ2015018)
作者简介:姜冬梅(1984—),女,助理研究员,博士,研究方向为农产品质量安全与标准。E-mail:mei.315@163.com
*通信作者:王蒙(1980—),女,副研究员,博士,研究方向为农产品质量安全与标准。E-mail:ameng-001@163.com

