表1 冻干保护剂配方优化正交试验因素与水平
Table 1 Coded level and corresponding actual levels of independent variables used in orthogonal array design
李 军1,张丽末1,桂 萌2,刘 蕾1,郭秀锋1,李平兰1,*
(1.北京食品营养与人类高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083;2.北京市水产科学研究所,北京 100071)
摘 要:采用耐胃酸、耐胆盐、模拟胃液和模拟肠液的独立影响实验和连续模拟消化道实验考察动物双歧杆菌对消化道环境的耐受性,结果表明:动物双歧杆菌RH经各独立实验后活菌数仍保持在107CFU/m L,经连续模拟消化道实验后活菌数为106CFU/m L。采用单因素试验和正交试验对动物双歧杆菌RH微胶囊壁材进行优化,结果表明:动物双歧杆菌RH最佳冻干保护剂各组成质量分数分别为甘油10%、海藻酸钠0.5%、乳清蛋白1.5%、阿拉伯胶1.25%和大豆卵磷脂1.25%,该条件下制备的冻干微胶囊活菌数为1.80×1012CFU/g,平均包埋效率为96.04%。结论:动物双歧杆菌RH对人工模拟消化道具有较好的耐受性,经壁材优化后制备的冻干微胶囊有较高的活菌数和较好的肠溶性。本研究为动物双歧杆菌RH益生菌产品的开发提供理论基础和技术支撑。
关键词:动物双歧杆菌RH;消化道逆环境;冻干微胶囊
随着生活水平的提高,人们对营养、健康的需求也日益增长。双歧杆菌具有调节肠道菌群平衡、增强人体免疫系统、抗肿瘤等作用,已被广泛应用于各类食品中[1-5]。
动物双歧杆菌RH为本实验室从广西巴马百岁长寿老人粪便中分离获得的一株优良菌株。刘丽莎等[6]通过形态学、生理生化和分子鉴定,确定双歧杆菌RH为动物双歧杆菌乳亚种,进一步通过PCR扩增得到RH菌的12个与胞外多糖(exopolysaccharides,EPS)生物合成有关的基因,说明该菌自身能够产生EPS[7-8]。刘蕾等[9]对该菌进行了全基因组测序,基因组信息(GenBank登录号:CP007755.1)也表明该菌株具有EPS的生物合成特性。尚楠等[10-11]采用动物实验研究RH菌株调节肠道菌群平衡能力,结果表明双歧杆菌RH的活菌、将菌体破碎后所得胞内物及发酵后上清液都可以增加小鼠肠道内双歧杆菌和乳酸菌的数量,降低产气荚膜梭菌和肠球菌的数量,并使肠杆菌和拟杆菌恢复至正常水平,从而改善小鼠肠道菌群组成。李辉等[12]利用细胞模型研究EPS的免疫激活作用及其对结肠癌细胞的生长抑制效果,结果表明双歧杆菌RH合成的EPS能够增强巨噬细胞的吞噬活性且不影响巨噬细胞增殖;通过激活宿主免疫进一步发挥抗肿瘤活性。郭秀锋[13]用该菌发酵南瓜、胡萝卜复合果蔬汁,研究结果显示该发酵果蔬汁营养丰富,酸甜适宜,口感良好,且具有较高的活菌数。以上研究结果显示动物双歧杆菌RH具有益生作用,具有开发成活性益生菌产品的巨大潜力。
严格厌氧的双歧杆菌对环境极为敏感,环境中许多不利因素如氧气、酸环境等均会导致双歧杆菌存活率的降低,从而丧失生理活性[14-16]。通过将双歧杆菌进行包埋制成微胶囊,能够较好地提高双歧杆菌在各种不利外界环境中的存活率,可实现其在机体肠道较好的释放效果。双歧杆菌微胶囊常用的壁材有3 类:海藻酸钠、壳聚糖和阿拉伯胶等具有成膜性的碳水化合物;乳清蛋白和酪蛋白等具有乳化性和成膜性的蛋白质;吐温80和卵磷脂等形成W/O乳浊液从而隔绝氧气的脂类。目前工业上常用海藻酸钠为壁材生产双歧杆菌微胶囊[17-19]。
本研究采用人工模拟消化道环境的方法考察了动物双歧杆菌RH对消化道逆环境的耐受性,并采用挤压法制备了动物双歧杆菌微胶囊,探究不同壁材制备的微胶囊对动物双歧杆菌RH的保护作用,提高动物双歧杆菌RH能够有效抵御食品体系中的有害成分对菌体的破坏,为动物双歧杆菌RH在食品工业中的应用提供技术支撑。
1.1 材料与试剂
1.1.1 菌种与细胞
动物双歧杆菌RH(Bifidobacterium animalis subsp.lactis RH)分离自中国广西巴马百岁老人的粪便。动物双歧杆菌BB-12(Bifidobacterium animalis subsp. lactis BB-12)为本实验室保存菌种。
1.1.2 培养基
M RS肉汤培养基:蛋白胨1 0 g/L,酵母提取物5 g/L,柠檬酸二铵2 g/L,葡萄糖20 g/L,MgSO4·7H2O 0.58 g/L,肉浸膏10 g/L,K2HPO42 g/L,乙酸钠5 g/L,吐温80 1 m L/L,M nSO4·4H2O 0.25 g/L。MRS琼脂培养基:在MRS肉汤培养基的基础上添加质量分数1.5%~1.8%琼脂。
1.1.3 主要溶液
0.05 mol/L pH 2.2甘氨酸-盐酸缓冲液的配制:分别配制50 m L 0.2 mol/L的甘氨酸溶液和44 m L 0.2 mol/L的盐酸,混合后加水稀释至200 m L;1/15 mol/L pH 6.98磷酸缓冲液的配制:将1/15 m o l/L的Na2HPO4溶液与1/15 mol/L的KH2PO4溶液按体积比3∶2的进行混合,摇匀即可;pH 7.4磷酸盐缓冲液的配制:称取NaCl 8.5 g,Na2HPO42.2 g,NaH2PO40.2 g,溶于1 000 m L去离子水中,混匀,用浓盐酸将pH值调节至7.4。
食管到胃连续过程的模拟液:向MRS肉汤培养基中加入质量分数0.5%的胃蛋白酶,分别调pH值至5.5、4.6、3.8、2.8、2.3、2.0,用0.22 μm的微孔滤膜过滤备用。十二指肠模拟液:向MRS肉汤培养基中加入质量分数1.0%胰蛋白酶和0.3%的胆盐,调节pH值至5.0,用0.22 μm的微孔滤膜过滤备用。回肠模拟液:用0.1 mol/L NaHCO3溶液将十二指肠模拟液pH值调至6.5,用0.22 μm的微孔滤膜过滤备用。固化液的配制:质量分数3%氯化钙溶液,用1 mol/L盐酸调节pH值至6.5,灭菌备用。解囊液的配制:十二水合磷酸氢二钠溶液35.8 g/L,柠檬酸溶液10.5 g/L,灭菌备用。
1.2 仪器与设备
FA 10 0 4电子分析天平 上海天平仪器厂;SPX-250B-Z恒温水浴锅、YXQ-LS-SⅡ压力蒸汽灭菌锅上海博讯实业有限公司;TGL-20M台式高速离心机长沙平凡仪器仪表有限公司;SCL-1300超净工作台北京赛伯乐仪器有限公司;S23C型pH计 上海雷磁仪器厂;DNP-9102恒温恒湿培养箱 上海精宏实验设备有限公司;LGJ-12真空冷冻干燥 北京松源科技发展有限公司。
1.3 方法
1.3.1 消化道环境对动物双歧杆菌RH的影响
1.3.1.1 独立影响实验
耐胃酸实验:以MRS培养基为基础,用浓盐酸将其pH值分别调至2.0和3.0,以正常MRS培养基pH值为对照,充氮气,121 ℃灭菌15 m in。按10%接种量接入活化后的动物双歧杆菌RH菌种,37 ℃厌氧条件下分别作用0、1 h和2 h后取样测定活菌数。以动物双歧杆菌BB-12为对照。
耐胆盐实验:以MRS液体培养基为基础,向培养基中加入质量分数0.3%的胆盐,按照每管10 m L分装,充氮气,121 ℃灭菌15 m in,备用。将动物双歧杆菌RH按最终体系菌体浓度109CFU/m L接种量接入上述含胆盐的培养基中,37 ℃厌氧培养10 h,测定初始接种量和培养10 h后的活菌数,进行比较。以动物双歧杆菌BB-12为对照。
模拟胃液实验:以0.05 mol/L pH 2.2甘氨酸-盐酸缓冲液为基础,分装到试管,充氮气,121 ℃灭菌15 m in,再按0.5%添加量加入胃蛋白酶作为模拟胃液,按最终体系菌体浓度为109CFU/m L接种量接入已活化的动物双歧杆菌RH液体菌种,37 ℃厌氧条件下分别作用0、1 h和2 h后取样测定活菌数。以动物双歧杆菌BB-12为对照。
模拟肠液实验:以1/15 mol/L pH 6.98磷酸盐缓冲液为基础,分装到试管,充氮气,121 ℃灭菌15 m in,再按1.0%添加量加入胰蛋白酶作为模拟肠液,按10%的接种量接入已活化的动物双歧杆菌RH液体菌种,37 ℃厌氧条件下分别作用0 h和10 h后取样测定活菌数。以动物双歧杆菌BB-12为对照。
1.3.1.2 模拟消化道体系的影响
将活力正常的动物双歧杆菌RH按最终体系菌体浓度为109CFU/m L的量接入食管到胃的模拟液中。在pH 5.5模拟液中作用10 m in,离心收集菌体,接入pH 4.6模拟液中处理10 m in,收集菌体,接入pH 3.8模拟液中处理10 m in,收集菌体,接入pH 2.8模拟液中处理20 m in,接入pH 2.3模拟液中处理20 m in,收集菌体,接入pH 2.0模拟液中处理20 m in,收集菌体,测定活菌数。
将所收集菌体接入十二指肠模拟液,作用1.5 h,收集菌体,取样测定活菌数。
将所收集菌体接入回肠模拟液,作用2.5 h,收集菌体,取样测定活菌数。以相同条件处理的动物双歧杆菌BB-12作为对照[20]。
1.3.2 动物双歧杆菌RH微胶囊的制备
1.3.2.1 菌株的活化与培养
将动物双歧杆菌RH菌种活化至2~3 代。按4%的接种量接种于MRS肉汤培养基中,37 ℃厌氧培养至15 h,之后4 500 r/m in离心10 m in,弃去上清液,用无菌生理盐水洗涤2 次,4 500 r/m in离心10 m in,收集菌体,获得动物双歧杆菌RH菌泥,备用。
1.3.2.2 壁材的配制
甘油是公认的应用较多的冻干保护剂,将其添加至微胶囊壁材中,可提高双歧杆菌的冻干存活率。刘云[21]研究发现质量分数20%甘油、3%乳清蛋白和2%海藻酸钠制备的长双歧杆菌BBMN68冻干微胶囊包埋效果和成型效果好,且具有较高的包埋率。本实验在壁材溶液中添加质量分数20%甘油时,溶液黏度过大,严重影响了微胶囊的成型和包埋,因此本研究将质量分数10%甘油作为冻干保护剂添加至壁材溶液中。
配制质量分数分别为0.25%、0.50%、1.00%、1.50%和2.00%海藻酸钠溶液,室温下磁力搅拌至均匀分散,4 ℃静置过夜,确保完全溶解,备用。
在海藻酸钠最适添加量的基础上,分别向溶液中添加乳清蛋白、阿拉伯胶和大豆卵磷脂,使乳清蛋白质量分数分别为0.50%、1.00%、1.50%和2.00%,阿拉伯胶质量分数分别为0.50%、1.00%和1.50%,大豆卵磷脂质量分数分别为0.50%、1.00%、1.50%和2.00%,室温下磁力搅拌至均匀分散,4 ℃静置过夜,确保完全溶解,备用。
1.3.2.3 冻干微胶囊的制备
将400 m L培养基培养的菌体离心后加入到160 g壁材中,使每克湿胶囊含菌量约109~1010CFU[21],磁力搅拌混合均匀,用5 m L注射器将混合液垂直滴入磁力搅拌的质量分数3% CaCl2溶液中,固化30 m in[21],用无菌生理盐水洗涤3 次得到双歧杆菌湿微胶囊。
将制备好的湿微胶囊均匀铺满培养皿,约1 cm厚,培养皿上覆盖8 层纱布并扎紧,放入-20 ℃预冻12 h,然后进行真空冷冻干燥,冻干时间约48 h[13,21]。将所得冻干微胶囊装于压盖瓶中密封,贮藏于-20℃,备用。
1.3.2.4 微胶囊活菌数的确定
称取0.1 g冻干微胶囊,溶于9.9 m L解囊液中,于37 ℃条件下进行解囊,待完全崩解后采用亨盖特厌氧滚管技术[22]测定解囊液中双歧杆菌的活菌数。
1.3.3 正交试验优化微胶囊壁材
根据单因素试验结果,选择乳清蛋白(A)、阿拉伯胶(B)、大豆卵磷脂(C)为影响因素,设计L9(34)正交试验,见表1。研究各因素对微胶囊活菌数的影响,从而得到最优冻干保护剂复配配方。
表1 冻干保护剂配方优化正交试验因素与水平
Table 1 Coded level and corresponding actual levels of independent variables used in orthogonal array design

1.3.4 冻干微胶囊包埋效率[23-24]的测定
称取0.1 g优化后制备的冻干微胶囊样品2 份,分别置于9.9 m L的磷酸盐缓冲液(pH 4.0)和模拟肠溶液(pH 6.8)中, 37 ℃恒温培养箱振荡处理45 m in,活菌计数。包埋效率计算公式[25]如下:
式中:EE为包埋效率/%;Ct为包埋于微胶囊中的双歧杆菌活菌总数;C0为起始添加的双歧杆菌活菌总数。
1.3.5 肠溶性实验
称取0.1 g优化后制备的冻干微胶囊样品置于含有9.9 m L模拟肠液(pH 6.8)的厌氧管中,充氮气,在37 ℃恒温培养箱中振荡培养,分别于0、1、2、3、4 h 和5 h取1 m L肠液进行稀释,活菌计数。
1.4 数据分析
所有实验均为3 组重复,以 ±s表示,采用SPSS 20.0软件进行显著性分析。
2.1 消化道环境对动物双歧杆菌RH的影响
2.1.1 独立影响实验
2.1.1.1 耐胃酸实验

图1 对照菌株动物双歧杆菌BB-12对胃酸的耐受性
Fig. 1 Tolerability of the control strain to gastric acid
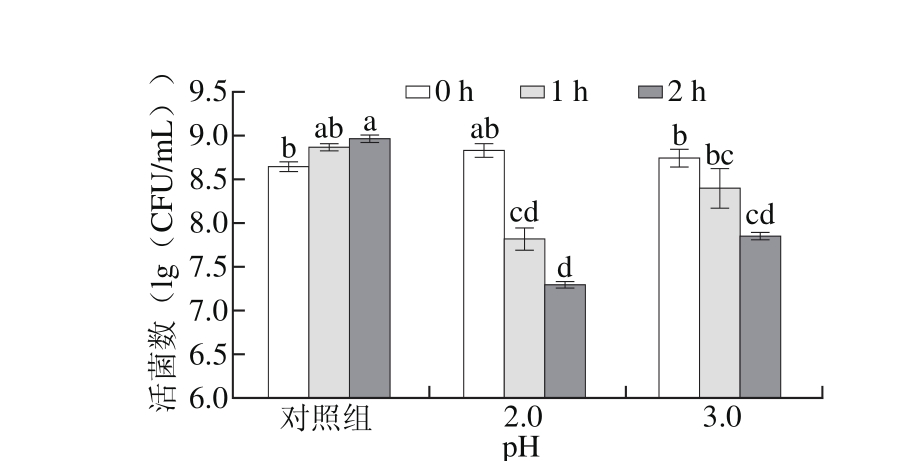
图2 实验菌株动物双歧杆菌RH对胃酸的耐受性
Fig. 2 Tolerability of Bifidobacterium RH to gastric acid
由图1和图2可知,正常条件下培养动物双歧杆菌RH活菌数不断增加,在pH 2.0条件下,培养1 h后,RH的活菌数对数值由原来的(8.82±0.09)(lg(CFU/m L))降至(7.82±0.11)(lg(CFU/m L)),培养2 h后降至(7.30±0.03)(lg(CFU/m L))。RH菌株在此条件下1 h后降低一个数量级,随着时间的延长,活菌数逐渐降低,但降低幅度相对较慢。RH菌株在pH 3.0条件下作用2 h后,活菌数降低程度较小。
动物双歧杆菌RH菌株的耐酸性与BB-12相当。通常胃酸的pH值为3.0左右,流体食物在胃内停留的时间一般为1~12 h,相对较短,在此条件下,动物双歧杆菌RH的活菌数能保持在较高水平,具有较强的耐胃酸能力。
2.1.1.2 耐胆盐实验

图3 动物双歧杆菌RH对胆盐的耐受性
Fig. 3 Tolerability of Bifidobacterium RH to bile salt
由图3可知,动物双歧杆菌RH和对照菌株相比,在质量分数0.3%的胆盐环境下,RH菌株有一定程度的生长,而对照菌株却受胆盐环境的影响较大,活菌数大幅降低,培养10 h后活菌数约比培养0 h时降低一个数量级。培养0 h时的活菌数是按照对照菌与实验菌等量接入培养基后,迅速进行活菌计数的结果,而0 h时RH活菌数显著高于对照组,说明对照菌株在胆盐环境处理瞬间即造成严重损失。对于大多数食物来讲,10 h足以通过肠道,尤其是流体食物。研究表明,动物双歧杆菌RH对人体正常的胆盐环境具有较好的耐受作用。
2.1.1.3 模拟胃液和模拟肠液实验
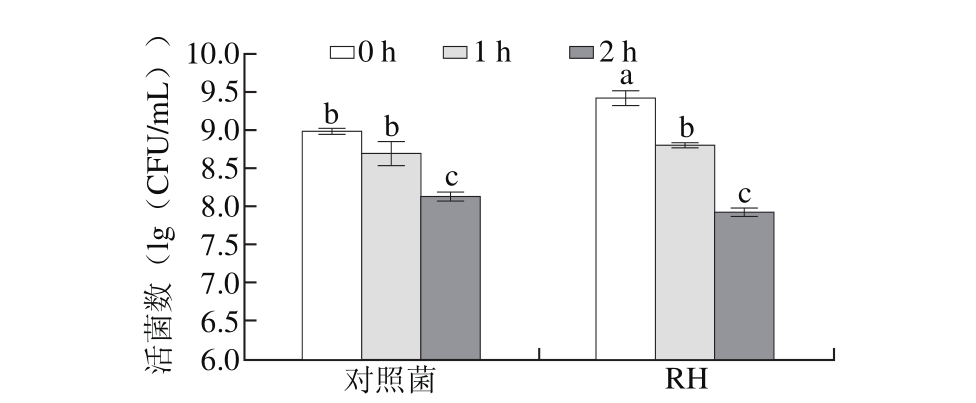
图4 人工模拟胃液对动物双歧杆菌RH存活的影响
Fig. 4 Effect of simulated gastric fluid on the survival of Bifidobacterium RH

图5 人工模拟肠液对动物双歧杆菌RH存活的影响
Fig. 5 Effect of simu lated intestinal environment on the survival of Bifidobacterium RH
由图4可以看出,R H的活菌数初始值为(9.42±0.09)(lg(CFU/m L)),在经过模拟胃液处理1 h后,活菌数降至(8.82±0.03)(lg(CFU/m L)),处理2 h后活菌数降为(7.93±0.05)(lg(CFU/m L))。动物双歧杆菌RH在模拟胃液处理时,随着时间延长,活菌数逐渐降低,且降低幅度基本保持一致,最后依然能够保持在较高的数量级,与对照组相当。
由图5可以看出,将动物双歧杆菌RH在人工模拟肠液中培养10 h后,活菌数由初始的(8.83±0.11)(lg(CFU/mL))降为(8.23±0.05)(lg(CFU/m L)),仍保持在较高活菌数水平,明显优于对照组在模拟肠液环境下的存活率。孟祥晨[26]研究了模拟胃液环境对几种双歧杆菌的影响,不同菌株耐受能力不同,并且多数菌体在胃液处理前期活菌数降低幅度大,后期降低幅度小,对于导致菌株对胃肠液耐受能力差异的机制尚不明确。
2.1.2 连续模拟消化道体系实验结果
人体消化道系统是一个连续的体系,消化管是一条起自口腔,延续为咽、食管、胃、小肠(包括十二指肠和空肠和回肠)、大肠终于肛门的肌性管道,外界食物进入人体后,需经过一系列过程到达小肠。研究动物双歧杆菌RH对人体消化道逆环境的耐受性,需要模拟连续消化道体系来展开。双歧杆菌活菌制剂食用时多为流体形式,在口腔及咽喉停留时间极短,据此本实验通过配制食管到胃模拟液、十二指肠模拟液、系膜小肠(主要包括空肠和回肠)模拟液对动物双歧杆菌RH菌株进行连续处理,观察双歧杆菌RH对整个消化道逆环境的耐受性。
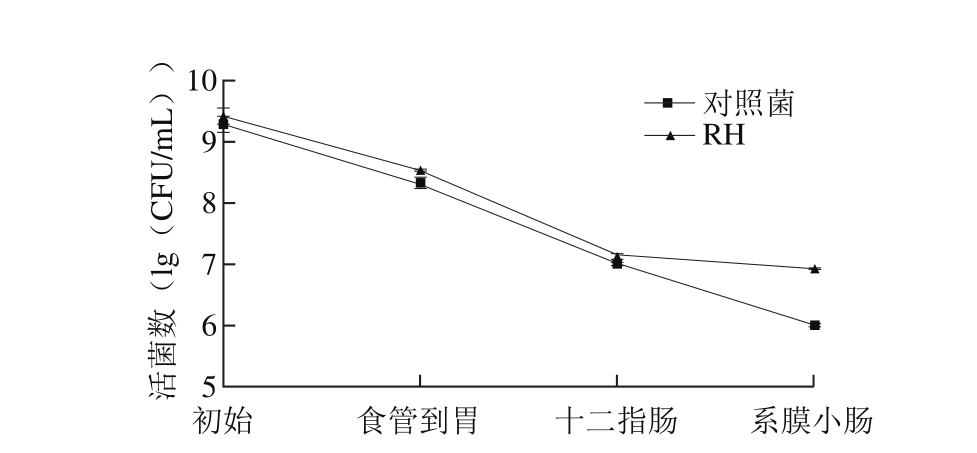
图6 连续模拟消化道体系对动物双歧杆菌RH存活的影响
Fig. 6 Effects of continuous simu lated gastrointestinal digestion on the survival of Bifidobacterium RH
由图6可知,将初始量为(9.41±0.17)(lg(CFU/mL))的动物双歧杆菌RH经过食管到胃连续过程后,活菌数降至(8.54±0.08)(lg(CFU/m L)),通过十二指肠模拟液后,活菌数降至(7.16±0.01)(lg(CFU/m L)),通过系膜小肠模拟液后,活菌数最终降至(6.94±0.06)(lg(CFU/m L)),经过连续肠道模拟环境后,动物双歧杆菌RH的活菌数仍接近107CFU/m L,对照菌株在前两个阶段与RH菌株无显著性差异,最后一阶段降低幅度较大,最终活菌数降至(6.00±0.03)(lg(CFU/m L)),显著低于动物双歧杆菌RH。这说明动物双歧杆菌RH对连续的消化道逆环境具有较好的耐受性。
关于益生菌对消化道逆环境的耐受性,国内外研究大都分别考虑菌株对胃酸的耐受性和对胆盐的耐受性。Ranadheera等[27]研究了嗜酸乳杆菌LA-5及丙酸菌702对消化道的耐受性,分别用pH 2.0的胃酸溶液和0.3%的胆盐溶液对实验菌株进行处理,处理2~3 h后,活菌数有显著降低。Pan Xiaodong等[28]通过研究不同pH值及胆盐浓度下嗜酸乳杆菌LNT的存活率来研究该菌株对消化道环境的耐受性。消化道是一个完整的体系,有必要通过连续模拟消化道环境来分析菌株对消化道的耐受性,M adureira等[29]通过四步连续过程,分析了干酪乳杆菌LAFTI-L26和嗜酸乳杆菌LAFTI-10分别经过口腔、食管到胃、十二指肠和回肠过程后活菌数的变化,这种连续模拟方式与实际情况更接近。本实验除单独消化道因素对菌体的影响之外,采用完整消化道连续模拟了消化道逆环境对RH菌体的影响,更能反映真实情况。
2.2 动物双歧杆菌RH微胶囊的制备
2.2.1 微胶囊壁材单因素试验结果与分析
不同壁材对动物双歧杆菌RH的生长影响如图7所示。各因素对活菌数的影响结果表明,所选因素对活菌数的影响均为随着添加量的增大冻干微胶囊活菌数先增长后下降。
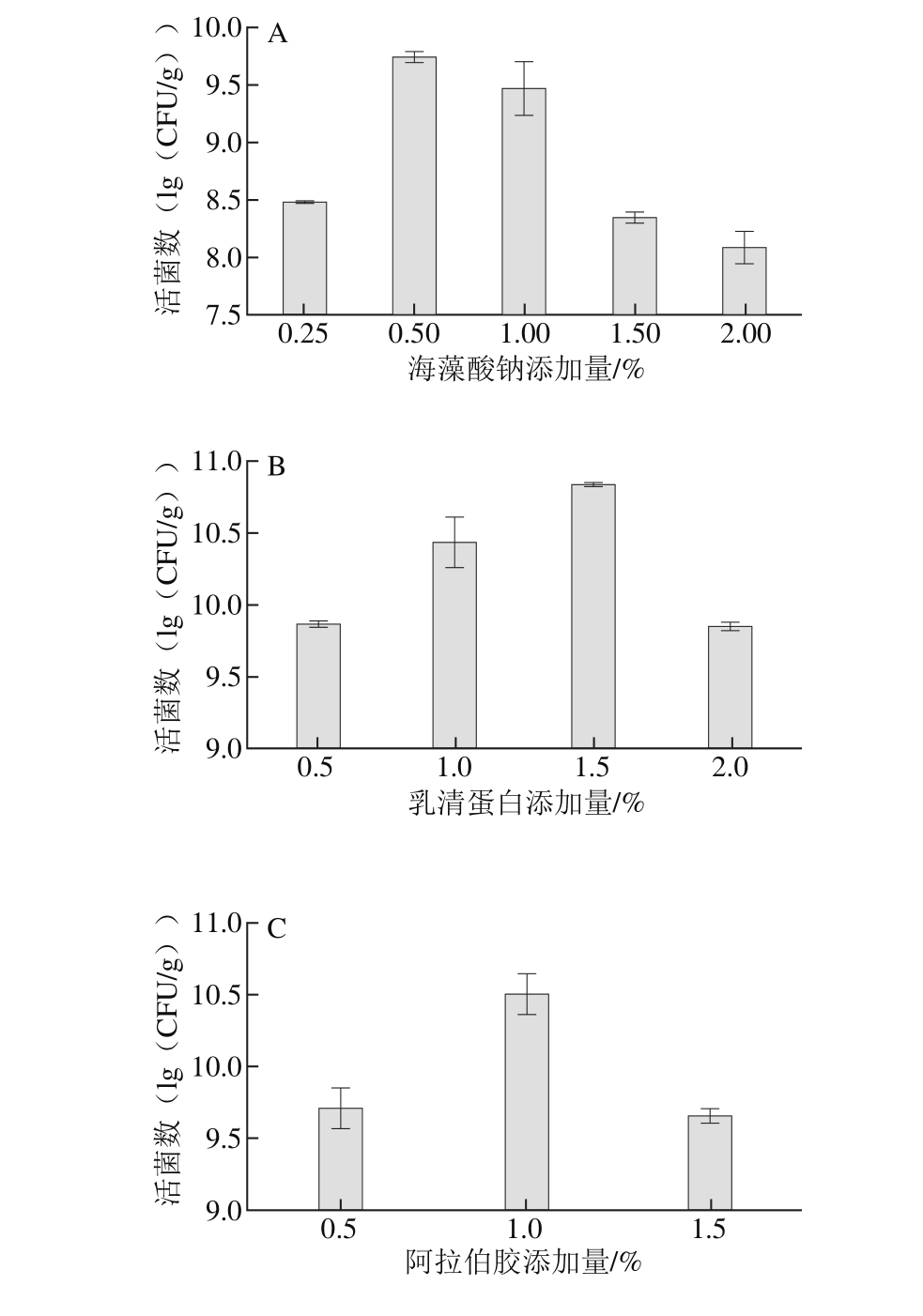
如图7A所示,当海藻酸钠的添加量为0.50%时,冻干微胶囊的活菌数达到最大值,为5.50×109CFU/g,高于其他添加量(P<0.05)。海藻酸盐是一种从海藻中提取的带负电荷天然大分子多糖,当与Ca2+接触时,海藻酸钠结构中的羧酸根阴离子与钙离子之间交联,结合成“蛋盒”式结构的海藻酸钙,最终形成三维网络状的凝胶,将双歧杆菌细胞截留在微胶囊中[30]。而且海藻酸盐胶凝条件相对较温和、安全无毒、生物相容性好且成本较低,在微生物包埋处理方面发挥着重要作用。
如图7B所示,当乳清蛋白添加量为1.50%时,微胶囊中活菌数达到最大(6.95×1010CFU/g),比不添加乳清蛋白活菌数高出1 个数量级(5.50×109CFU/g)。在双歧杆菌壁材体系中添加乳清蛋白可以在双歧杆菌体外形成蛋白膜,该膜可以保护菌体细胞,同时乳清蛋白还可以为体系提供缓冲溶质,保持溶液的pH值相对稳定,并固定细胞中冻干的酶类[31];此外,乳清蛋白变性,蛋白结构展开,经过相互作用形成聚集体,弥补了海藻酸钠形成的多孔结构,增加了微胶囊的强度,使芯材较多的截留在微胶囊中。
由图7C可知,当阿拉伯胶添加量为1.00%时,活菌数为3.23×1010CFU/g。阿拉伯胶为大分子多糖,含有特殊的结构,具有成膜性。
由图7D可知,当大豆卵磷脂的添加量为1.00%时,活菌数达到9.20×1010CFU/g,此时微胶囊所含活菌数最大。体系中添加一定量的大豆卵磷脂时,有助于形成W/O的乳浊液体系,为双歧杆菌提供厌氧的环境[23],提高了微胶囊所含活菌数。
2.2.2 微胶囊壁材正交试验结果与分析
设计L9(34)正交试验优化壁材从而增大冻干微胶囊所含的活菌数,正交试验结果如表2所示,冻干保护剂中乳清蛋白和大豆卵磷脂对冻干微胶囊活菌数具有显著影响,阿拉伯胶的影响相对较小。
根据SPSS软件分析各因素检验得到正交试验的最优组合为A2B3C3,即乳清蛋白添加量为1.50%,阿拉伯胶添加量为1.25%,大豆卵磷脂添加量为1.25%。因此冻干保护剂中含质量分数分别为10%甘油,0.5%海藻酸钠,1.5%乳清蛋白,1.25%阿拉伯胶和1.25%大豆卵磷脂。该条件下冻干微胶囊活菌数为1.80×1012CFU/g。刘云[21]以海藻酸钠、乳清蛋白和甘油为壁材,利用挤压法包埋长双歧杆菌BBMN68,冻干后每克胶囊活菌数分别为9.66和10.6 个数量级。
图7 海藻酸钠(A)、乳清蛋白(B)、阿拉伯胶(C)和大豆卵磷脂(D)添加量对微胶囊所含活菌数的影响
Fig. 7 Effects of sodium alginate (A), whey protein (B), Arabic gum (C) and soybean lecithin (D) concentration on the survival of m icroencapsuled Bifidobacterium RH
表2 壁材配方正交试验设计及结果
Tab le 2 Orthogonal array design w ith experimental resu lts
2.3 动物双歧杆菌湿微胶囊的形态描述
微胶囊的外观和大小是重要的物理因素,若将其添加至食品中,会对整体的风味、质地和外观有显著的影响。经壁材优化后制备的动物双歧杆菌RH湿微胶囊形态如图8所示,可以看出,微胶囊大小均一,表面光滑,乳白色,有光泽,呈规则球形,无拖尾现象,成型效果较好。对微胶囊粒径进行测定,粒径大约为1~2 mm。

图8 动物双歧RH湿态微胶囊形态
Fig. 8 M orphology of wet m icrocapsules containing Bifidobacterium RH
2.4 包埋效率
根据1.2.4节方法得出冻干微胶囊包埋效率为96.04%,高于Holkem等[19]制备的双歧杆菌BB-12冻干微胶囊的包埋效率(89.71%)。
2.5 肠溶性实验结果
含有双歧杆菌的制品必须能够在人体肠道的碱性环境中完全快速的释放出来,才能有效发挥其重要功效。双歧杆菌微胶囊的肠溶性是评价冻干微胶囊的重要指标[32],因此本研究对壁材优化后的冻干微胶囊进行了肠溶性实验。
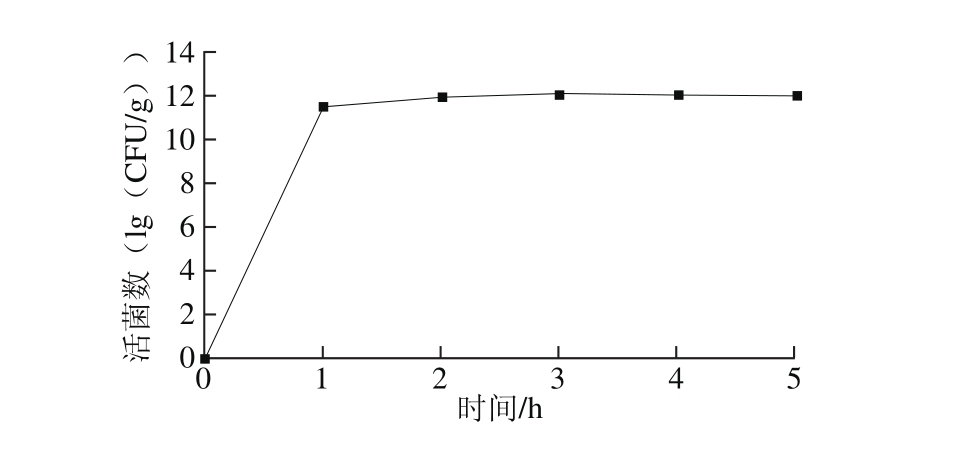
图9 冻干微胶囊在模拟肠液中活菌数的变化
Fig. 9 Change in survival rate of freeze-dried m icrocapsules in simulated intestinal fluid
由图9可知,经模拟肠液处理1 h后,微胶囊形态发生变化,开始溶胀变大,溶液中活菌数迅速增加,达到1011CFU/g,2 h后肠液中活菌数约为1012CFU/g,此时微胶囊基本完全溶于肠液中,无明显颗粒存在,之后双歧杆菌活菌数趋于稳定。说明双歧杆菌冻干微胶囊在肠道中2 h左右基本完全释放。长双歧杆菌BBMN68冻干微胶囊在模拟肠液中2 h内完成崩解[21]。动物双歧杆菌RH微胶囊具有较好的肠溶性,能够及时地溶解将包裹的动物双歧杆菌RH释放出来。
动物双歧杆菌RH及其代谢产物胞外多糖具有抗肿瘤、免疫调节等多种生理活性,具有开发成益生菌产品的潜力。本研究考察了动物双歧杆菌RH对消化道逆环境的耐受性,结果显示经各独立实验后活菌数仍保持在107CFU/m L,经连续模拟消化道实验后活菌数为106CFU/m L,符合规定的双歧杆菌活菌体最低摄入量106CFU/m L的要求。这说明动物双歧杆菌RH具有较好的消化道耐受性。动物双歧杆菌RH具有多重益生作用,将其开发成益生菌产品是趋势,而食品体系中有害成分会对菌体产生破坏作用,微囊化能够有效地保护菌体抵御外界不利因素。本研究对RH微胶囊壁材进行优化,经壁材优化后制备的冻干微胶囊含有较高活菌数和较好的肠溶性。
参考文献:
[1] NOMOTO K. Prevention of infections by probiotics[J]. Journal of B ioscience and Bioengineering, 2005, 100(6): 583-592. DOI:10.1263/jbb.100.583.
[2] SHAH N P. Func tional cu ltu res and health benefits[J].International Dairy Journal, 2007, 17(1): 1262-1277. DOI:10.1016/j.idairyj.2007.01.014.
[3] GOM I A, IINO T, NONAKA C, et al. Health benefits of fermented m ilk containing Bifidobacterium bifidum YIT 10347 on gastric symptoms in adults[J]. Journal of Dairy Science, 2015, 98(4): 2277-2283. DOI:10.3168/jds.2014-9158.
[4] VERRUCK S, PRUDENCIO E S, MULLER C M O, et al. Influence of Bifidobacterium Bb-12 on the physicochem ical and rheological properties of buffalo M inas Frescal cheese during cold storage[J].Journal of Food Engineering, 2015, 151: 34-42. DOI:10.1016/j.jfoodeng.2014.11.021
[5] VERRUCK S, PRUDENCIO E S, VIEIRA C R W, et al. The buff alo M inas Frescal cheese as a protective matrix of Bifidobacterium,BB-12 under in vitro, simulated gastrointestinal conditions[J]. LWTFood Science and Technology, 2015, 63(2): 1179-1183.
[6] 刘丽莎, 范熠, 旭日花, 等. 动物双歧杆菌RH胞外多糖基因簇的克隆及分析[J]. 食品科学, 2013, 34(15): 136-142. DOI:10.7506/spkx1002-6630-201315028.
[7] FANNING S, HALL L J, CRONIN M, et al. Bifidobacterial surfaceexopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection[J]. Proceedings of the National Academy of Sciences, 2012, 109(6): 2108-2113.DOI:10.1073/pnas.1115621109.
[8] PRASANNA P H P, GRANDISON A S, CHARALAMPOPULOS D. Screening human intestinal Bifidobacterium strains for grow th,acidification, EPS production and viscosity potential in low-fat m ilk[J]. International Dairy Journal, 2012, 23(1): 36-44. DOI:10.1016/j.idairyj.2011.09.008.
[9] LIU L, QIN Y X, WANG Y, et al. Complete genome sequence of Bifidobacterium animalis RH, a probiotic bacterium producing exopolysaccharides[J]. Journal of B iotechnology, 2014, 189(10): 86-87. DOI:10.1016/j.jbiotec.2014.08.041.
[10] SHANG N, XU R, LI P L. Struc tu re charac terization o f exopolysaccharide produced by Bifidobacterium animalis RH[J].Carbohyd rate P o lymers, 2013, 91(1): 128-134. DOI:10.1016/j.carbpol.2012.08.012.
[11] 尚楠, 刘丽莎, 旭日花, 等. 双歧杆菌RH菌株不同处理物修复肠道菌群平衡失调的研究[J]. 食品科学, 2010, 31(23): 300-304.
[12] 李辉, 宋居易, 刘蕾, 等. 双歧杆菌RH胞外多糖提取纯化及体外抗凝血活性评价[J]. 食品科学, 2014, 35(23): 129-132. DOI:10.7506/spkx1002-6630-201423026.
[13] 郭秀锋. 动物双歧杆菌生理特性研究及发酵果蔬复合饮品的研制[D].北京: 中国农业大学, 2015: 24-41.
[14] WANG J, KORBER D R, LOW N H, et al. Entrapment, survival and release of Bifidobacterium adolescentis w ithin chickpea proteinbased microcapsules[J]. Food Research International, 2014, 55: 20-27.DOI:10.1016/j.foodres.2013.09.018.
[15] ANAL A K, SINGH H. Recent advances in m icroencapsulation of probiotics for industrial applications and targeted delivery[J]. Trends in Food Science & Technology, 2007, 18(5): 240-251. DOI:10.1016/j.tifs.2007.01.004.
[16] RANADHEERA R D C S, BAINES S K, ADAMS M C. Importance of food in probiotic efficacy[J]. Food Research International, 2010,43(1): 1-7. DOI:10.1016/j.foodres.2009.09.009.
[17] COOK M T, TZORTZIS G, CHARALAMPOPOULO D, et al.M icroencapsulation of probiotics for gastrointestinal delivery[J].Journal of Controlled Release, 2012, 162(1): 56-67. DOI:10.1016/j.jconrel.2012.06.003.
[18] CHAN E S, WONG S L, LEE P P, et al. Effects of starch filler on the physical properties of lyophilized calcium-alginate beads and the viability of encapsulated cells[J]. Carbohydrate Polymers, 2011, 83(1):225-232.
[19] HOLKEM A T, RADDATZ G C, NUNES G L, et al. Development and characterization of alginate microcapsules containing Bifidobacterium,BB-12 produced by emulsification/internal gelation followed by freeze drying[J]. LWT-Food Science and Technology, 2016, 71: 302-308.DOI:10.1016/j.lw t.2016.04.012.
[20] SENUMA Y, LOWE C, ZWEIFEL Y, et al. A lginate hydrogel m icrospheres and m ic rocapsu les p repared by spinning disk atom ization[J]. Biotechnology and Bioengineering, 2000, 67(5): 616-622. DOI:10.1002/(SICI)1097-0290(20000305)67:5%3C616::AIDBIT12%3E3.0.CO;2-Z.
[21] 刘云. 长双歧杆菌BBMN68冻干微胶囊的制备及其稳定性的研究[D].北京: 中国农业大学, 2014: 24-41.
[22] CHANDRAMOULI V, KA ILASAPATHY K, PEIRIS P, et al.An improved method of m icroencapsulation and its evaluation to protect Lactobacillus spp. in simulated gastric conditions[J]. Journal of M icrobiological M ethods, 2004, 56(1): 27-35. DOI:10.1016/j.m imet.2003.09.002.
[23] 刘茜, 张娟, 陈坚, 等. 喷雾冷凝法制备高性能乳酸菌微胶囊[J].应用与环境生物学报, 2012, 18(5): 824-830.
[24] SU R, ZHU X L, FAN D, et al. Encapsu lation o f p robiotic Bifidobacterium longum BIOMA 5920 w ith alginate-human-like collagen and evaluation of survival in simulated gastrointestinal conditions[J]. International Journal of Biological M acromolecules,2011, 49(5): 979-984. DOI:10.1016/j.ijbiomac.2011.08.018.
[25] DOHERTY S B, GEE V L, ROSS R P, et al. Development and characterization of whey protein m icro-beads as potential matrices for probiotic protection[J]. Food Hydrocolloids, 2011, 25(6): 1604-1617.DOI:10.1016/j.foodhyd.2010.12.012.
[26] 孟祥晨. 双歧杆菌生理功能特性及其应用的研究[D]. 哈尔滨: 东北农业大学, 2002: 24-35.
[27] RANADHEERA C S, EVANS C A, ADAMS M C, et al. Effect of dairy probiotic combinations on in vitro, gastrointestinal tolerance,intestinal epithelial cell adhesion and cytokine secretion[J]. Journal of Functional Foods, 2014, 8(1): 18-25. DOI:10.1016/j.jff.2014.02.022.
[28] PAN X, CHEN F, WU T, et al. The acid, bile tolerance and antim icrobial property of Lactobacillus acidophilus, NIT[J]. Food Control, 2009, 20(6): 598-602. DOI:10.1016/j.foodcont.2008.08.019.
[29] MADUREIRA A R, AMORIM M, GOMES A M, et al. Protective eff ect of whey cheese matrix on probiotic strains exposed to simulated gastrointestinal conditions[J]. Food Research International, 2011,44(1): 465-470. DOI:10.1016/j.foodres.2010.09.010.
[30] 刘袖洞, 于炜婷, 王为, 等. 海藻酸钠和壳聚糖聚电解质微胶囊及其生物医学应用[J]. 化学进展, 2008, 20(1): 126-139.
[31] 熊涛, 田微, 黄寅. 鼠李糖乳杆菌冻干保护剂的研究[J]. 食品科技,2011, 36(5): 8-12.
[32] DOHERTY S B, AUTY M A, STANTON C. Survival of entrapped Lactobacillus rhamnosus GG in w hey protein m icro-beads during simulated ex vivo gastro-intestinal transit[J]. International Dairy Journal , 2012, 22(1): 31-43. DOI:10.1016/j.idairyj.2011.06.009.
Resistance of Bifidobacterium RH to Simulated Gastrointestinal Conditions and Preparation of M icrocapsules Containing This Strain
LI Jun1, ZHANG Limo1, GUI Meng2, LIU Lei1, GUO Xiufeng1, LI Pinglan1,*
(1. Beijng Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China; 2. Beijing Fisheries Research Institute, Beijing 100071, China)
Abstract:The aim of this study was to evaluate the potential of Bifidobacterium RH to be used as a probiotic product. We examined the viability of the probiotic under simulated gastrointestinal conditions and we investigated the production of probiotic m icrocapsules w ith resistance to various negative factors. The bacterial counts were 107CFU/m L and 106CFU/m L,respectively, under simulated gastrointestinal conditions separately and sequentially. The optim ized wall material of m icrocasuples contained l0% glycerol, 0.50% sodium alginate, 1.50% whey protein, 1.25% Arabic gum and 1.25% soybean lecithin as determ ined by one-factor-at-a-time and orthogonal array designs. The count of viable Bifidobacterial cells in the m icrocapsules was 1.80 × 1012CFU/g, and w ith respect to encapsulation efficiency, the results showed a mean value of 96.04%. Thus, the study demonstrated that m icroencapsulated Bifidobacterium RH could be resistant to simulated gastrointestinal conditions. The m icroencapsulation process was shown to efficiently increase the viability of probiotic cultures, and the microorganism was released from the microcapsules. This study may provide a theoretical and technical support for the development of probiotic products containing Bifidobacterium RH.
Key words:Bifidobacterium RH; simulated gastrointestinal conditions; m icrocapsules
DOI:10.7506/spkx1002-6630-201722003
中图分类号:Q939.99
文献标志码:A
文章编号:1002-6630(2017)22-0014-08
引文格式:
李军, 张丽末, 桂萌, 等. 动物双歧杆菌RH对消化道的耐受性及其微胶囊制备的研究[J]. 食品科学, 2017, 38(22): 14-21.
DOI:10.7506/spkx1002-6630-201722003. http://www.spkx.net.cn
LI Jun, ZHANG Limo, GUI Meng, et al. Resistance of Bifidobacterium RH to simulated gastrointestinal conditions and preparation of microcapsules containing this strain[J]. Food Science, 2017, 38(22): 14-21. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722003. http://www.spkx.net.cn
收稿日期:2017-02-28
基金项目:国家自然科学基金面上项目(31271827;31671831)
作者简介:李军(1989—),女,硕士研究生,研究方向为食品微生物。E-mail:lijun900330@126.com
*通信作者:李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn