王大慧,聂 敏,卫功元*
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
摘 要:为提高产朊假丝酵母(Candida utilis SZU 07-01)发酵生产谷胱甘肽(glutathione,GSH)的产量,分别考察L-蛋氨酸和L-半胱氨酸在GSH分批发酵和流加发酵中的作用,结果发现L-蛋氨酸提升了酵母细胞在生长期的GSH合成能力,而L-半胱氨酸显著提高了细胞生长结束后的GSH产量。在此基础上,提出了两阶段氨基酸添加策略,即在分批发酵初始时(0 h)添加60 mmol/L L-蛋氨酸,在流加发酵过程中细胞干质量达到最大值时(第27小时)一次性添加30 mmol/L L-半胱氨酸。最终,GSH产量和胞内GSH含量进一步提高,分别达到1 247.1 mg/L和24.1 mg/g。该两阶段氨基酸添加策略在GSH发酵高产中的成功应用,对其他类似化合物的高效生产具有一定的借鉴意义。
关键词:产朊假丝酵母;谷胱甘肽;L-蛋氨酸;L-半胱氨酸;流加发酵
谷胱甘肽(glutathione,GSH)是由L-谷氨酸、L-半胱氨酸和甘氨酸在ATP的存在下,经γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶催化得到的一种三肽化合物[1-3]。GSH具有消除自由基和抗氧化作用,因此对机体正常代谢起着强有力的保护作用[4]。在20世纪50年代,日本就开始将GSH作为生物活性添加剂并积极开发应用在保健食品的生产中[5]。在食品加工领域,由于GSH在强化食品风味的同时对人体有保健作用,因此被称为抗衰老因子和长寿因子,它的应用前景要明显优于其他类型的防腐剂或抗氧化剂[6]。
微生物发酵法被认为是GSH生物合成最有效的方法之一[5]。一直以来,研究者们采用菌种遗传改造、发酵条件优化以及前体物质添加等方法来提高GSH的产量和合成效率[2],但仍然存在许多技术瓶颈,以至于GSH的国产化还没能完全实现。在GSH生物合成过程中,L-半胱氨酸的水平是能否实现GSH高效合成的关键因素,因此添加L-半胱氨酸可以显著提高GSH的发酵产量[6-8]。然而,当L-半胱氨酸超过一定浓度时将抑制细胞的生长,所以在发酵过程中L-半胱氨酸主要在细胞生长结束时添加或者采用流加方式[9-10]。此外,在胞内腺苷甲硫氨酸合成酶的催化下,L-蛋氨酸能与ATP反应生成S-腺苷甲硫氨酸,它是大多数酵母细胞内唯一的甲基供体。而细胞在生长旺盛时甲基化反应非常频繁,因此在培养基中添加L-蛋氨酸可以促进这一过程的发生[11-12]。与此同时,L-蛋氨酸在代谢过程中生成的S-腺苷同型半胱氨酸会经过多步反应形成L-半胱氨酸,最终可能有利于GSH的合成[13]。
GSH是胞内产物,通常从提高细胞密度和或胞内GSH含量两个方面入手来提高GSH的发酵产量[14-15]。在前期针对产朊假丝酵母(Candida utilis SZU 07-01)高密度培养的研究中,发现采用多项式流加策略可以获得较高的细胞密度,但是胞内GSH含量却并没有明显提高[16]。因此,有必要采取有效措施实现细胞高密度和GSH高产的统一。本研究在前期工作的基础上,分别考察L-蛋氨酸和L-半胱氨酸在酵母细胞生长过程中以及生长结束后对GSH生物合成的作用,结合高密度培养技术,提出基于两阶段氨基酸添加的GSH发酵方法,最终实现GSH的高产发酵,为实现GSH产业化生产提供了理论依据。
1.1 菌株与培养基
C. utilis SZU 07-01由苏州大学微生物生理与代谢调控研究室保藏。
斜面培养基:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨10 g/L,琼脂20 g/L,pH 6.0。
种子培养基:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨10 g/L,pH 6.0。
发酵培养基:葡萄糖30 g/L,KH2PO43 g/L,M gSO40.25 g/L,M nSO40.01 g/L,FeSO40.01 g/L,CuSO40.001 g/L,ZnSO40.003 g/L,pH 5.5。L-蛋氨酸和L-半胱氨酸浓度和添加时间根据实验要求确定。
流加培养基:葡萄糖600 g/L,(NH4)2SO480 g/L,KH2PO430 g/L,MgSO42.5 g/L。葡萄糖单独灭菌后再与其他成分混合。
1.2 仪器与设备
SW-CJ-2A超净工作台 吴江市龙宏净化设备有限公司;LDZX-50KBS高压蒸气灭菌锅 上海申安医疗器械厂;HZ-2010K恒温摇瓶柜 太仓市华利达实验仪器设备公司;BIOTECH-5BGZ搅拌式发酵罐 上海保兴生物设备工程有限公司;LD4-2A离心机 北京医用离心机厂。
1.3 方法
1.3.1 种子培养
将斜面保藏菌种活化4 h后接入种子培养基中,30 ℃、200 r/m in摇床培养20 h。
1.3.2 摇瓶培养
按照体积分数10%的接种量将种子接入到装有50 m L发酵培养基的500 m L三角瓶中,于30 ℃、200 r/m in条件下摇床培养30 h。
1.3.3 分批培养
全自动5 L搅拌式发酵罐中装3 L发酵培养基,将培养好的种子按照10%的接种量接入发酵罐中。在温度30℃,通气量3.0 L/m in,搅拌转速300 r/m in条件下培养时间30 h。pH值采用梅特勒电极在位监测,并通过自动流加3 mol/L H2SO4或3 mol/L NaOH溶液进行调节以维持pH值在5.5±0.02以内。
1.3.4 高密度培养
在总糖质量浓度为150 g/L的前提下,以多项式流加方式实现细胞高密度培养,具体方法见文献[16]。在培养的第27小时向体系中加入L-半胱氨酸,之后温度和pH值保持不变,前3 h内溶氧控制在5%,随后的12 h溶氧控制在20%,之后溶氧不控制[17]。
1.3.5 酵母生物量的测定
以细胞干质量表示酵母生物量。取25 m L发酵液,3 500 r/m in离心10 m in,用蒸馏水将离心后的沉淀洗涤3 次,收集菌体后于70 ℃烘干至质量恒定,计算出细胞干质量。
1.3.6 指标测定
葡萄糖的测定采用3,5-二硝基水杨酸法[18];GSH的测定采用5,5’-二硫代双(2-硝基苯甲酸)-谷胱甘肽还原酶循环法[19]。
1.3.7 指标计算
1.3.7.1 胞内GSH含量的计算
胞内GSH含量定义为单位质量干细胞在胞内合成GSH产量,计算如下式所示:
1.3.7.2 动力学参数的计算
细胞得率、GSH得率、细胞生产强度、GSH生产强度的计算方法同文献[19-20]。
1.4 数据统计分析
所有摇瓶实验数据均为3 组独立实验样品的平均值,所有分批发酵实验数据均为3 次检测结果的平均值。Excel 2010软件作图。
2.1 L-蛋氨酸对酵母细胞生长和GSH合成的影响
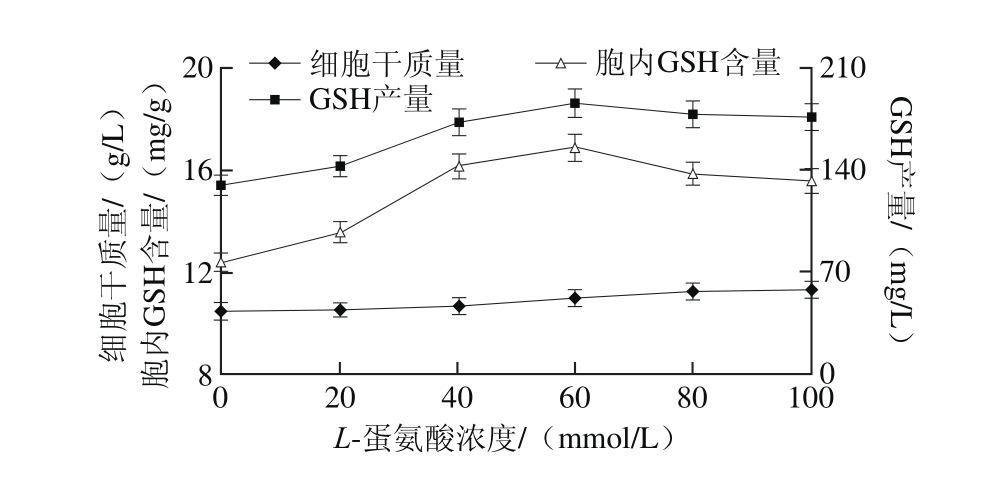
图1 不同L-蛋氨酸添加浓度条件下的细胞生长和GSH合成情况
Fig. 1 Cell grow th and GSH production at different concentrations of L-methionine in fl ask culture
首先,在摇瓶培养的0 h,向发酵培养基中添加L-蛋氨酸,考察其对C. utilis SZU 07-01细胞生长和GSH合成的影响(图1)。结果发现,在考察的浓度范围内,添加L-蛋氨酸虽然对酵母细胞生长的影响不大,但明显促进了GSH的生物合成,因此GSH产量和胞内GSH含量均有显著提升。当添加L-蛋氨酸浓度为60 mmol/L时,胞内GSH含量和GSH产量均达到最大值16.9 mg/g和185.6 mg/L,比对照(不添加L-蛋氨酸)分别提高了36.7%和43.2%。由此可见,L-蛋氨酸在参与胞内含硫化合物代谢的同时,明显有助于酵母细胞内GSH合成能力的提高。
2.2 L-蛋氨酸在GSH分批发酵中的作用


图2 添加L-蛋氨酸对GSH分批发酵过程的影响
Fig. 2 Effect of L-methionine addition on glutathione p roduction during batch fermentation
在分批培养的0 h,向发酵培养基中添加60 mmol/L L-蛋氨酸,考察L-蛋氨酸在GSH分批发酵中的作用,结果如图2所示。与对照(不添加L-蛋氨酸)相比,L-蛋氨酸的添加对酵母细胞生长几乎没有影响,细胞干质量的变化趋势也基本一致。然而,在L-蛋氨酸添加的条件下,葡萄糖的消耗速率却有所下降,但也能在第15小时时基本耗完。对于GSH的合成来说,自第3小时开始,GSH的合成速率比对照明显提高,GSH产量和胞内GSH含量在第24小时达到最大值272.2 mg/L和21.5 mg/g,比对照分别提高了36.4%和40.4%。以上结果表明,作为含硫氨基酸,L-蛋氨酸在分批发酵过程中的添加同样可以促进GSH的生物合成与积累。
2.3 高密度培养条件下添加L-半胱氨酸的作用
L-半胱氨酸是GSH生物合成的前体氨基酸之一,向培养基中添加L-半胱氨酸可以提高GSH产量和胞内GSH含量[9-10]。然而,L-半胱氨酸在一定程度上会抑制细胞的生长,因此通常选择在细胞生长结束时添加L-半胱氨酸为佳[14]。前期研究表明,采用多项式流加方法可以很好地实现C. utilis SZU 07-01细胞高密度培养,酵母细胞快速生长,细胞干质量在27 h达到最大值[16]。为此,本研究在多项式流加培养的基础上,考察L-半胱氨酸在高密度培养条件下对GSH生物合成的影响。
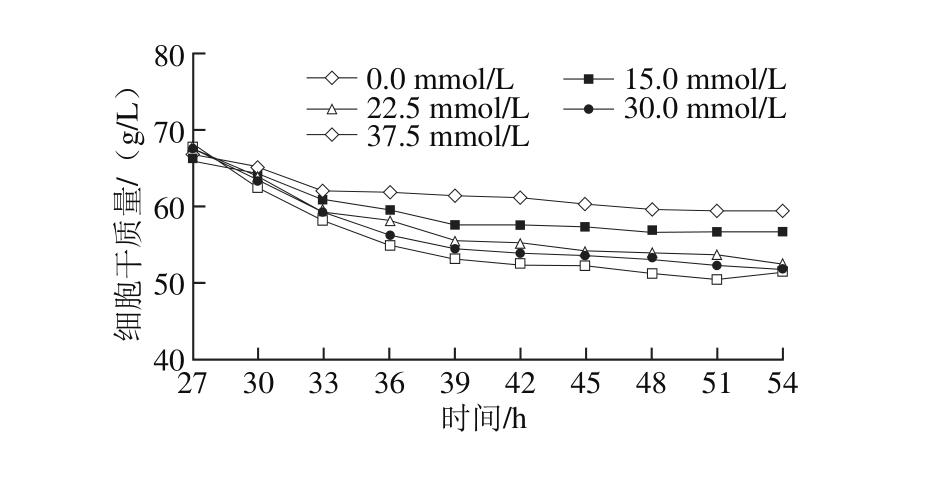
在总葡萄糖质量浓度为150 g/L前提下实现酵母细胞的高密度培养,在第27小时一次性向发酵培养基中添加不同浓度的L-半胱氨酸,GSH合成与细胞干质量随培养时间的变化情况见图3。不同批次高密度培养结果具有很好的一致性,第27小时的细胞干质量、GSH产量和胞内GSH含量分别为(67.27±0.75)g/L、(435.4±5.4)mg/L和(6.5±0.1)mg/g。添加L-半胱氨酸后,酵母细胞干质量逐渐下降,且L-半胱氨酸浓度越高,其对细胞干质量的不利影响越大。然而,GSH在添加L-半胱氨酸之后快速合成,其产量及胞内GSH含量均在第48小时达到最大值。其中,当L-半胱氨酸添加浓度为30 mmol/L时,GSH产量与胞内GSH含量分别为1 104.3 mg/L和21.0 mg/g,比对照分别提高了59.7%和85.4%。由此可见,L-半胱氨酸在细胞生长结束后可以明显地促进GSH的生物合成,特别地,在提高胞内GSH含量上的作用非常显著。
2.4 两阶段氨基酸添加策略的提出及在GSH高产中的应用
以上实验结果表明,在细胞生长阶段添加L-蛋氨酸或在细胞生长停止之后添加L-半胱氨酸均有利于GSH产量和胞内GSH含量的提高。因此,本研究提出了两阶段氨基酸添加的策略,即在高密度培养的起始(0 h)添加60 mmol/L L-蛋氨酸,然后在细胞干质量达到最大值时(第27小时)一次性添加30 mmol/L L-半胱氨酸,考察该策略对C. utilis SZU 07-01生物合成GSH的影响,结果见图4。
由图4可以看出,L-蛋氨酸的添加并没有影响高密度培养过程中细胞的生长,在第27小时细胞干质量达到最大值67.44 g/L。同时,胞内GSH含量为7.5 mg/g,GSH产量为506.8 mg/L,比图3中不添加L-蛋氨酸时的结果分别增加了24.1%和21.6%。这表明L-蛋氨酸在高密度培养过程中对于维持胞内GSH含量起到了一定的积极作用。

图3 添加L-半胱氨酸对高密度培养条件下GSH合成的影响
Fig. 3 Effect of L-cysteine addition on glutathione p roduction under high cell density cu lture
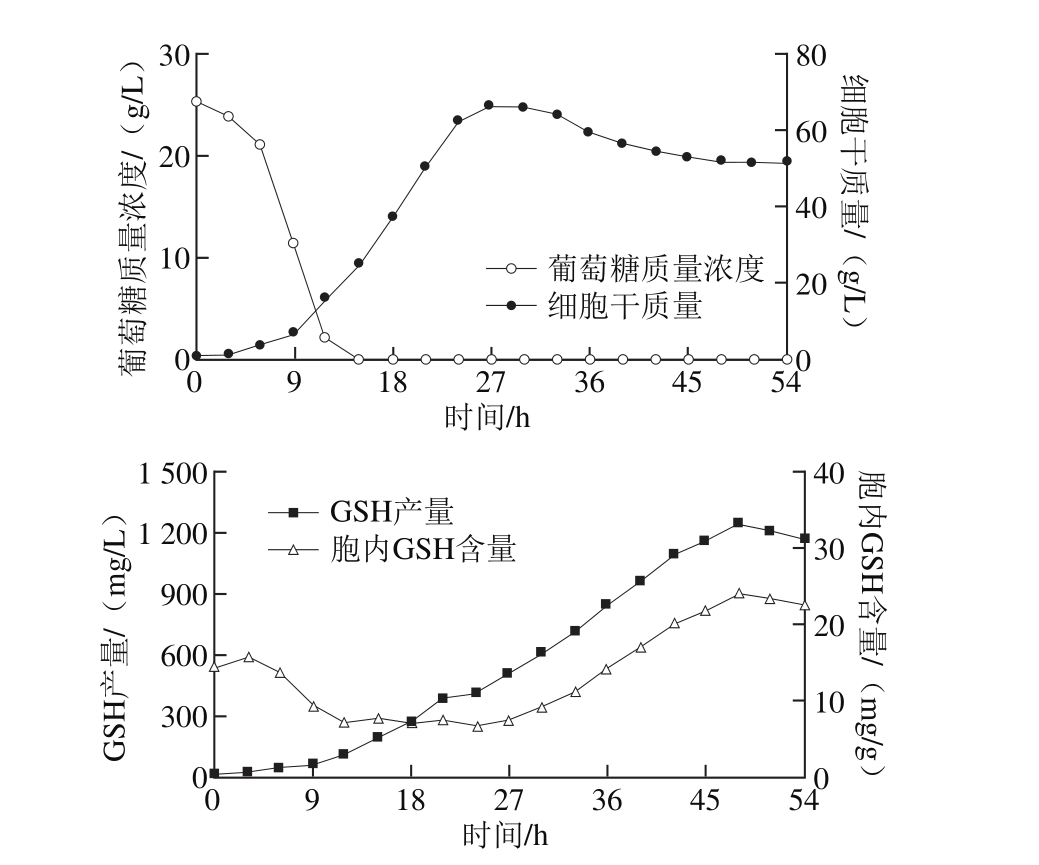
图4 联合添加L-半胱氨酸和L-蛋氨酸时的GSH高密度发酵过程
Fig. 4 High-cell-density culture of C. utilis for GSH p roduction w ith the addition of L-cysteine at 27 h and L-methionine at 0 h
在两阶段氨基酸添加策略下进行GSH高密度发酵,GSH产量和胞内GSH含量比L-半胱氨酸单独添加时的结果有了进一步提高,在第48小时二者分别达到1 247.1 mg/L和24.1 mg/g。高密度发酵模式下,采取不同氨基酸添加方式的发酵过程参数如表1所示。经过比较分析可以看出,两阶段氨基酸添加策略不但有利于提高胞内GSH含量与GSH产量,而且显著地提高了GSH生产强度。因此,基于两阶段氨基酸添加的GSH发酵高产方法是可行的,也具有一定的实际应用价值。
表1 氨基酸不同添加方式下的GSH高密度发酵过程主要参数比较
Tab le 1 Com parison of parameters involved in GSH p roduction by high cell density cultivation under different am ino acid addition modes

注:a. L-半胱氨酸添加时间发酵第27小时;b. 0 h添加60 mmol/L L-蛋氨酸,发酵第27小时添加30 mmol/L L-半胱氨酸。
GSH分子中既含有氨基和羧基,又含有巯基和γ-谷氨酰基,正是这种化学结构上的特殊性,使GSH在医药和食品等行业中具有广泛的应用前景[1]。为此,研究者们利用基因工程手段构建了一系列GSH高产菌株[21-22],并围绕GSH生物合成酶[23-24]、代谢调控[25-26]和胞外分泌[27]等展开了深入研究。尽管如此,针对GSH发酵过程进行优化仍然一直是提高GSH生产效率的有效方法[3]。本研究利用C. utilis SZU 07-01发酵生产GSH,分别从前体氨基酸添加和高密度培养等角度探索提高GSH产量的措施。
研究表明,作为GSH前体氨基酸之一的L-半胱氨酸,当在酵母细胞培养的合适阶段适量添加,可以明显地提高GSH产量[10,14]。由于L-半胱氨酸对细胞生长的抑制作用,GSH的过量合成都是在细胞量不变或略微下降的基础上发生的。因此,添加L-半胱氨酸可以显著提高胞内GSH含量,即提升了酵母细胞合成GSH的能力。另外一种含硫氨基酸L-蛋氨酸,它在代谢过程中是L-半胱氨酸生物合成的前体物质[13],所以L-蛋氨酸的添加将有利于在细胞生长期提高胞内用于GSH合成的L-半胱氨酸的供给,进而有效地提高GSH产量。值得注意的是,L-蛋氨酸的适量添加,可以在不影响细胞生长的前提下促进细胞在生长过程中合成GSH(图2)。因此,采用两阶段氨基酸添加策略,可以同时促进生长期和稳定期的细胞过量合成GSH,最终提高整个发酵过程中的GSH合成总量(图4)。
GSH属于胞内产物,在发酵生产时提高酵母细胞合成GSH的能力对于提高GSH产量非常有效[2]。与此同时,采用合适的培养方法提高细胞密度也有助于GSH的高效合成。用于GSH生产菌株高密度培养的方法有很多,包括恒速流加、指数流加、底物浓度反馈控制流加等[8,10,14],这些方法均取得了一定的成效。为解决底物葡萄糖的流加速率和浓度不断提高与细胞消耗葡萄糖速率之间的平衡,将多项式流加策略[16]应用于C. utilis SZU 07-01的高密度培养中,GSH产量与分批发酵比较有了很大提高(图3)。由于C. utilis SZU 07-01在流加发酵过程中不产生或只产生少量的乙醇,因此,细胞和GSH对底物的得率要高于酿酒酵母的结果[14]。多项式流加策略在酵母细胞高密度培养中的成功应用,为GSH高产提供了理论支持。
表2 近20年国内外流加发酵法生产GSH主要参数比较
Table 2 Com parison of main parameters for GSH p roduction by fed-batch fermentation in recent 20 years

注:—.数据未给出。
为进一步提高微生物合成GSH的能力和效率,研究者们纷纷构建了许多基因工程菌株,在高密度培养的基础上,采用生物转化方法实现GSH的过量合成[28-31]。近20年来,国内外采用流加发酵法生产GSH的主要文献列于表2。可以看出,与其他传统发酵法特别是与生物转化法相比,本研究中的GSH产量还有不小的差距。但是,采用两阶段氨基酸添加策略,酵母胞内GSH含量相对较高。若综合考虑所采用的流加发酵方法和原料成本等因素,本研究的结果仍然具有一定的竞争力。
综上,本研究在分别考察了L-蛋氨酸和L-半胱氨酸在GSH分批发酵和高密度发酵中的作用的基础上,以GSH高产为目标,提出了两阶段氨基酸添加策略,即在分批培养初始(0 h)时添加60 mmol/L L-蛋氨酸,然后在高密度培养过程中当细胞干质量达到最大值(第27小时)时一次性添加30 mmol/L L-半胱氨酸。将该两阶段策略应用到GSH的高密度发酵中,GSH产量最高为1 247.1 mg/L,胞内GSH含量和GSH生产强度也显著提升。本研究结果为GSH的高效生产提供了一种方法,同时也对其他类似化合物的高产发酵具有一定的借鉴意义。
参考文献:
[1] MEISTR A, ANDERSON M E. G lutathione[J]. Annual Review o f Biochem istry, 1983, 52: 711-760. DOI:10.1146/annurev.bi.52.070183.003431.
[2] LI Y, WEI G Y, CHEN J. Glutathione: a review on biotechnological production[J]. Applied M icrobiology and Biotechnology, 2004, 66:233-242. DOI:10.1007/s00253-004-1751-y.
[3] 王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展[J]. 中国生物工程杂志, 2014, 34(7): 89-95. DOI:10.13523/j.cb.20140714.
[4] SEO Y J, LEE J W, LEE E H, et al. Role of glutathione in the adaptive tolerance to H2O2[J]. Free Radical Biology and Medicine, 2004, 37:1272-1281. DOI:10.1016/j.freeradbiomed.2004.07.012.
[5] 陈坚, 卫功元, 李寅, 等. 微生物发酵法生产谷胱甘肽[J]. 无锡轻工大学学报, 2004, 23(5): 104-110. DOI:1009-038X(2004)05-0104-07.
[6] SEN C K. Nutritional biochem istry of cellular glutathione[J]. The Journal of Nutritional Biochemistry, 1997, 8: 660-672. DOI:10.1016/S0955-2863(97)00113-7.
[7] WEN S H, ZHANG T, TAN T W. Utilization of am ino acids to enhance glutathione production in Saccharomyces cerevisiae[J].Enzyme and M icrobial Technology, 2004, 35: 501-507. DOI:10.1016/j.enzm ictec.2004.08.003.
[8] WANG Z, TAN T W, SONG J. Effect of am ino acids addition and feedback control strategies on the high-cell-density cultivation of Saccharomyces cerevisiae for glutathione production[J]. Process Biochem istry, 2007, 42: 108-111. DOI:10.1016/j.procbio.2006.07.008.
[9] LORENZ E, SCHM ACHT M, STAHL U, et al. Enhanced incorporation yield o f cysteine for g lutathione overproduction by fed-batch fermentation of Saccharomyces cerevisiae[J].Journal of Biotechnology, 2015, 216: 131-139. DOI:10.1016/j.jbiotec.2015.10.016.
[10] ALFAFARA C G, M IURA K, SH IM IZU H, et al. Cysteine addition strategy for maximum glutathione production in fed-batch culture of Saccharomyces cerevisiae[J]. App lied M icrobiology and Biotechnology, 1992, 37: 141-146. DOI:10.1007/BF00178160.
[11] LU S C. S-adenosy lmethionine[J]. The International Journal of Biochem istry & Cell Biology, 2000, 32: 391-395. DOI:10.1016/S1357-2725(99)00139-9.
[12] 聂敏. 发酵法生产谷胱甘肽及其高产策略研究[D]. 苏州: 苏州大学,2010: 33-39.
[13] BRONSNAN J T, BRONSNAN M E, BERTOLO R F P, et al.M ethionine: a metabolically unique am ino acid[J]. Life Sciences,2007, 112: 2-7. DOI:10.1016/j.livsci.2007.07.005.
[14] WEI G Y, WANG D H, CHEN J. Overproduction of glutathione by L-cysteine addition and a temperature-shift strategy[J]. Biotechnology and Bioprocess Engineering, 2008, 13(3): 347-353. DOI:10.1007/s12257-007-0191-9.
[15] 贾建萍, 裘娟萍, 周彦钢. 谷胱甘肽分批补料发酵动力学模型的建立[J]. 现代食品科技, 2012, 28(4): 391-395. DOI:1673-9078(2012)4-391-395.
[16] NIE M, WEI G Y, SHAO N, et al. A novel strategy on the high-celldensity cultivation of Candida utilis for the enhanced production of glutathione[J]. Korean Journal of Chemical Engineering, 2010, 27(4):1246-1251. DOI:10.1007/s11814-010-0190-y.
[17] WANG D H, YANG B, WEI G Y, et al. Efficient preparation of selenium/glutathione-enriched Candida utilis and its biological eff ects on rats[J]. Biological Trace Element Research, 2012, 150: 249-257.DOI:10.1007/s12011-012-9459-9.
[18] WANG Y, WANG D, WEI G, et al. Enhanced co-production of S-adenosylmethionine and glutathione by an ATP-oriented am ino acid addition strategy[J]. Bioresource Technology, 2012, 107: 19-24.DOI:10.1016/j.biortech.2011.12.030.
[19] WANG Y L, WANG D H, WEI G Y, et al. Improved co-production of S-adenosylmethionine and glutathione using citrate as an auxiliary energy substrate[J]. Bioresource Technology, 2013, 131: 28-32.DOI:10.1016/j.biortech.2012.10.168.
[20] 郑丽雪, 王立梅, 梅艳珍, 等. 酿酒酵母生产谷胱甘肽分批发酵动力学研究[J]. 食品科学, 2011, 32(1): 158-161.
[21] WANG D Z, WANG C, WU H, et al. Glutathione production by recombinant Escherichia coli expressing bifunctional glutathione synthetase[J]. Journal of Industrial M icrobiology and Biotechnology,2016, 43: 45-53. DOI:10.1007/s10295-015-1707-5.
[22] SASAK I K, HARA K Y, KAWAGUCHI H, et al. Nanofiltration concentration of extracellular glutathione produced by engineered Saccharom yces cerevisiae[J]. Jou rna l o f B iosc ience and Bioengineering, 2016, 121: 96-100. DOI:10.1016/j.jbiosc.2015.05.013.[23] YANG J H, LI W, WANG D Z, et al. Characterization of bifunctional L-glutathione synthetases from Actinobacillus pleuropneumoniae and Actinobacillus succinogenes for effi cient glutathione biosynthesis[J].Applied M icrobiology and Biotechnology, 2016, 100: 6279-6289.DOI:10.1007/s00253-016-7437-4.
[24] TANG L, WANG W, ZHOU W, et al. Three-pathway combination for glutathione biosynthesis in Saccharomyces cerevisiae[J]. M icrobial Cell Factories, 2015, 14: 139. DOI:10.1186/s12934-015-0327-0.
[25] ZHANG J, QUAN C, WANG C, et al. Systematic manipulation of glutathione metabolism in Escherichia coli for improved glutathione production[J]. M icrobial Cell Factories, 2016, 15: 38. DOI:10.1186/s12934-016-0439-1.
[26] CHEN J L, XIE L, CAI J J. Enzymatic synthesis of glutathione using engineered Saccharomyces cerevisiae[J]. Biotechnology Letters, 2013,35: 1259-1264. DOI:10.1007/s10529-013-1191-9.
[27] KIRIYAMA K, HARA K Y, KONDO A. Extracellular glutathione fermentation using engineered Saccharomyces cerevisiae expressing a novel glutathione exporter[J]. Applied M icrobiology and Biotechnology,2012, 96: 1021-1027. DOI:10.1007/s00253-012-4075-3.
[28] LI Y, CHEN J, MAO Y Y, et al. Effect of additives and fed-batch culture strategies on the production of glutathione by recombinant Escherichia co li[J]. Process Biochem istry, 1998, 33: 709-714.DOI:10.1016/S0032-9592(98)00038-7.
[29] WANG C, ZHANG J, WU H, et al. Hetero logous gshF gene expression in various vector systems in Escherichia coli for enhanced glutathione production[J]. Journal of Biotechnology, 2015, 214: 63-68.DOI:10.1016/j.jbiotec.2015.09.004.
[30] UBIYVOVK V M, ANAN IN V M, MALYSHEV A Y, et al.Optim ization of glutathione production in batch and fed-batch cultures by the w ild-type and recombinant strains of the methylotrophic yeast Hansenula polymorpha DL-1[J]. BMC Biotechnology, 2011, 11: 8.DOI:10.1186/1472-6750-11-8.
[31] FEI L, WANG Y, CHEN S. Im proved glutathione production by gene expression in Pichia pastoris[J]. Bioprocess and Biosystems Engineering, 2009, 32(6): 729-735. DOI:10.1007/s00449-009-0297-x.
[32] NIE W, WEI G Y, DU G C, et al. Enhanced intracellular glutathione synthesis and excretion capability of Candida utilis by using a low pH-stress strategy[J]. Letters in Applied M icrobiology, 2005, 40(5): 378-384. DOI:10.1111/j.1472-765X.2005.01687.x.
[33] LIANG G B, LIAO X Y, DU G C, et al. Elevated glutathione production by adding precursor am ino acids coup led w ith ATP in high cell density cultivation of Candida utilis[J]. Journal of Applied M icrobiology, 2008, 105(5): 1432-1440. DOI:10.1111/j.1365-2672.2008.03892.x.
[34] WANG M, SUN J, XUE F, et al. The eff ect of intracellular am ino acids on GSH production by high-cell-density cultivation of Saccharomyces cerevisiae[J]. Applied Biochemistry and Biotechnology, 2012, 168(1):198-205. DOI:10.1007/s12010-011-9435-4.
[35] WEN S H, ZHANG T, TAN T W. M axim izing p roduction o f glutathione by am ino acid modulation and hih-cell-densit fed-batch culture of Saccharomyces cerevisiae[J]. Process Biochemistry, 2006,41(12): 2424-2428. DOI:10.1016/j.procbio.2006.06.030.
[36] X IONG Z Q, GUO M J, GUO Y X, et al. RQ feedback control for simultaneous improvement of GSH yield and GSH content in Saccharomyces cerevisiae T65[J]. Enzyme and Microbial Technology,2010, 46(7): 598-602. DOI:10.1016/j.enzm ictec.2010.03.003.
Improved Glutathione Production in Candida utilis by Two-Stage Am ino Acid Addition
WANG Dahui, NIE M in, WEI Gongyuan*
(School of Biology and Basic Medical Sciences, Soochow University, Suzhou 215123, China)
Abstract:In order to improve glutathione production by Candida utilis SZU 07-01, the eff ects of addition of L-methionine and L-cysteine on glutathione biosynthesis during batch and fed-batch fermentation, respectively, were investigated. The results indicated that addition of L-methionine improved the glutathione biosynthesis ability of yeast during cell grow th phase while addition of L-cysteine significantly enhanced the production of glutathione after cell grow th. Based on this finding, a two-stage strategy for amino acid addition was proposed for high glutathione production, that is, 60 mmol/L of L-methionine was added into the medium at the beginning of fermentation (0 h), and 30 mmol/L of L-cysteine was then added when the biomass achieved the maximum level (27 h) during fed-batch culture. The two-stage strategy ultimately resulted in further improvements in glutathione production and intracellular glutathione content, which were 1 247.1 mg/L and 24.1 mg/g at 48 h, respectively. The successful application of the two-stage am ino acid addition strategy for improved glutathione production also provides a feasible approach for the effi cient production of other similar compounds.
Key words:Candida utilis; glutathione; L-methionine; L-cysteine; fed-batch fermentation
DOI:10.7506/spkx1002-6630-201722004
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2017)22-0022-06
引文格式:
王大慧, 聂敏, 卫功元. 基于两阶段氨基酸添加的谷胱甘肽发酵高产方法[J]. 食品科学, 2017, 38(22): 22-27.
DOI:10.7506/spkx1002-6630-201722004. http://www.spkx.net.cn
WANG Dahui, NIE M in, WEI Gongyuan. Improved glutathione production in Candida utilis by two-stage am ino acid addition[J]. Food Science, 2017, 38(22): 22-27. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722004.http://www.spkx.net.cn
收稿日期:2016-12-28
基金项目:国家自然科学基金面上项目(21376155);国家自然科学基金青年科学基金项目(21506136);苏州市农业应用基础研究项目(SNG201606)
作者简介:王大慧(1975—),女,副教授,博士,研究方向为食品微生物与生物技术。E-mail:wangdh@suda.edu.cn
*通信作者:卫功元(1975—),男,教授,博士,研究方向为发酵工程。E-mail:weigy@suda.edu.cn