颜龙杰1,沈建东2,张凌晶1,2,翁 凌1,2,胡莉苹1,曹敏杰1,2,3,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3.福建省海洋生物资源开发利用协调创新中心,福建 厦门 361102)
摘 要:本研究从凡纳滨对虾肝胰腺中纯化获得一种组织蛋白酶L,其分子质量约为31 kD,肽质量指纹图谱分析得到8 个片段共112 个氨基酸残基,与报道的凡纳滨对虾组织蛋白酶L序列完全一致。该酶的最适温度和最适pH值分别为35 ℃和5.5,且在0~40 ℃以及pH 5.5~6.5之间酶活力稳定。该酶仅对底物Z-Phe-Arg-MCA特异分解。半胱氨酸蛋白酶抑制剂E-64和Leupeptin对其有明显的抑制作用,而金属蛋白酶抑制剂乙二胺四乙酸和乙二醇二乙醚二胺四乙酸对其有少量的激活作用。扫描电子显微镜观察结果显示,随着低温贮藏时间的延长,对虾肌肉纤维的断裂程度不断增加。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析显示,组织蛋白酶L可使肌肉蛋白发生分解,推测其可能参与对虾低温贮藏过程中肌肉的降解。
关键词:凡纳滨对虾;组织蛋白酶L;纯化;肌原纤维;扫描电子显微镜;降解
凡纳滨对虾(Litopenaeus vannamei)是世界三大养殖虾品种之一[1]。2014年,我国凡纳滨对虾养殖产量达157.6万 t[2]。凡纳滨对虾因味道鲜美、营养丰富,深受人们喜爱。对虾在流通过程中的贮藏通常采用0~4 ℃短期冷藏、-18 ℃长期冻藏等方式。虽然0~4 ℃低温贮藏可以延长其货架期,但黑变、肌肉弹性下降等问题难以避免[3-5]。此外,-18 ℃冻藏的对虾在解冻过程中虾肉会出现自溶现象。
国内外研究发现,肌肉蛋白的降解是虾肉贮藏过程中组织软化、自溶的主要原因[6],而内源性蛋白酶是造成肌肉蛋白降解的关键因素[3,7-9]。在多种内源性蛋白酶中,组织蛋白酶L是一类容易使肌原纤维蛋白降解的蛋白酶[10-12]。研究发现[13],该酶基因在虾的肝胰腺、血细胞、腮、肌肉、肠、胃及卵巢等组织均有表达,而在肝胰腺中的表达水平最高。虽然有研究[14-15]尝试通过添加不同类型抑制剂判断组织蛋白酶L在贮藏过程中的作用,但是其相关的酶学性质以及对肌肉蛋白降解作用的研究鲜有报道。本研究以凡纳滨对虾为研究对象,运用生化分离技术获得高纯度组织蛋白酶L,分析酶学性质,进一步采用扫描电镜观察贮藏过程中虾肉的微观变化情况,探索组织蛋白酶L对肌肉蛋白的降解作用。
1.1 材料与试剂
鲜活凡纳滨对虾(平均个体质量10 g) 厦门集美农贸市场;SP-Sepharose阳离子层析柱 美国GE Healthcare公司;Z-Phe-A rg-MCA、Z-A rg-A rg-M CA、Boc-G ln-A rg-A rg-M CA等荧光底物 日本Peptide Institute公司;反式琥珀酸-亮氨酰胺-胍基丁酮(E-64) 美国Am resco公司;胃蛋白酶抑制剂Pepstatin 瑞士Roche公司;乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、苯甲基 磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、苯甲脒、亮肽素 美国Sigma公司;蛋白标准品 美国Thermo Fisher Scientific公司。
1.2 仪器与设备
Pro高分辨率扫描电镜 荷兰Phenom公司;PT2500E高速组织捣碎机 瑞士Kinematica公司;Cary Eclipse荧光分光光度计 美国Agilent公司;Avanti J-265xp高速冷冻离心机、手持式500型pH计 美国Beckman公司;WB-10L1型恒温水浴锅 德国Memmert公司;YP6001N电子天平 中国上海精科天平厂;M ini Protean Cell垂直电泳槽 美国Bio-Rad公司。
1.3 方法
1.3.1 样品处理
鲜活凡纳滨对虾采用冰水混合致死(1∶2(g/m L)冰水中浸泡20 m in)[3],无菌水洗净,沥干,分3 组,装入无菌真空包装袋,置于4 ℃冷藏,用于实验。
1.3.2 组织扫描电镜分析
平行于凡纳滨对虾肌肉纹理进行切片,获得片状组织(1 cm×1 cm×2 mm),体积分数2.5%戊二醛溶液4 ℃固定24 h,用0.2 mol/L磷酸盐缓冲液(pH 7.2)漂洗2 次,再用质量分数1%四氧化锇溶液25 ℃浸泡1 h,之后采用不同体积分数(50%、60%、70%、80%、90%)的乙醇梯度脱水,20 m in/次,再用100%乙醇脱水3 次,15 m in/次,处理后,再用乙酸异戊酯置换乙醇。乙醇置换后,用溅射仪在样品表面溅射镀金,最后用扫描电镜进行观察,记录结果。
1.3.3 组织蛋白酶L酶活力的测定
参考Barrett等[16]的方法稍作修改,操作如下:在900 μL 100 mmol/L乙酸钠缓冲液(pH 5.5)中,加入50 μL酶液和50 μL荧光底物Z-Phe-Arg-MCA(10 μmol/L)混匀,37 ℃孵育10 m in,加入1.5 m L终止液(水-甲醇-异丙醇体积比为35∶35∶30),混匀终止反应。采用荧光分光光度计检测混合液的荧光值,测定时激发波长和发射波长分别为380 nm和450 nm,对照组用缓冲液代替荧光底物。酶活力单位(U)定义为每分钟释放1 nmol 7-氨基-4-甲基香豆素(7-am ino-4-methylcoumarin,AMC)所需酶量。
1.3.4 组织蛋白酶L的分离纯化
分离纯化过程均在4 ℃条件下进行,具体步骤如下:取新鲜对虾肝胰腺,加入4 倍体积50 mm o l/L乙酸钠缓冲液(pH 4.5,含1 mmo l/L PMSF、1 mmol/L EDTA),进行组织捣碎,于0 ℃,12 000×g离心20 m in,绢布过滤,上清液即为粗酶液。粗酶液进行饱和度为40%~80%硫酸铵溶液分级沉淀,所得沉淀采用少量缓冲液溶解,4 ℃条件下充分透析。透析后的样品上样于S P-Sepharose阳离子交换层析柱(1.5 cm×12 cm),并淋洗至280 nm波长处检测值到基线。接着用含0~0.5 mol/L NaCl的缓冲液线性洗脱。收集酶活性峰透析,再次上样于SP-Sepharose预装柱(体积1 m L),用含0.2~0.5 mol/L NaCl缓冲液线性洗脱,获得纯化的蛋白酶,并用于性质分析。
1.3.5 组织蛋白酶L的质谱鉴定
将纯化的蛋白酶上样于质量分数12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecy l sulfatepolyacrylam ide gel electrophoresis,SDS-PAGE),经质谱银染后,切下目的条带,送至上海中科新生命生物科技有限公司进行肽质量指纹图谱鉴定。
1.3.6 酶学性质分析
1.3.6.1 最适温度和热稳定性
蛋白酶最适温度测定按照1.2.3节方法,其中孵育条件为不同温度(4~80 ℃)孵育10 m in。热稳定性的测定,首先将酶液置于不同温度(0~70 ℃)孵育30 m in,立即冰浴冷却至室温,在37 ℃条件下测定其剩余酶活力。
1.3.6.2 最适pH值和pH稳定性
蛋白酶最适pH值测定时,孵育液为0.1 mol/L不同pH值的缓冲液(pH 2.0~8.0)。pH稳定性测定方法为:将酶液加到不同pH值的缓冲液(pH 2.0~8.0)中,4 ℃孵育30 m in,取出少量酶液于100 mmol/L乙酸钠缓冲液(pH 5.5),测定其剩余酶活力。
1.3.6.3 底物特异性
底物特异性是将酶液与不同类型的荧光底物孵育反应,按1.2.3节方法测定其对不同类型底物的水解程度,以水解Z-Phe-A rg-MCA荧光底物为对照。不同类型荧光底物包括Boc-Gln-Arg-A rg-MCA、Boc-Phe-Ser-Arg-MCA、Suc-Leu-Leu-Val-Tyr-MCA、Z-Phe-A rg-MCA、Z-Arg-Arg-MCA。
1.3.6.4 蛋白酶抑制剂的作用
将酶液与不同类型的抑制剂混匀,在4 ℃孵育1 h后,用1.2.3节方法测定酶液剩余酶活力。对照样品的反应条件一致,但不加任何抑制剂。所用抑制剂包括半胱氨酸蛋白酶抑制剂(E-64和Leupeptin)、金属蛋白酶抑制剂(EDTA、EGTA)、丝氨酸蛋白酶抑制剂(PMSF、苯甲脒)。
1.3.7 组织蛋白酶L与肌肉蛋白降解的关系
1.3.7.1 肌肉蛋白的制备
新鲜凡纳滨对虾去壳取肉,加入4 倍体积的50 mmol/L磷酸盐缓冲液(pH 6.5,含0.15 moL/L NaCl溶液)组织捣碎,捣碎后的混合液即为肌肉总蛋白。
1.3.7.2 酶在不同时间下对肌肉蛋白的降解
在50 mmol/L磷酸盐缓冲液(pH 6.5)中,将2.5 mg肌肉全蛋白(含约0.01 U酶活力的组织蛋白酶L)与0.4 U酶活力的组织蛋白酶L充分混合,在35 ℃分别反应0、5、15、30、60、90、120、180 min后,进行SDS-PAGE分析,观察肌肉蛋白的降解情况。对照样品的反应条件为35 ℃,180 min,不添加组织蛋白酶L,其他条件相同。
1.4 数据分析
本研究有关相对酶活力数据处理中,以同一组内3个重复样品的平均变异系数(coefficient of variation,CV)为组内误差进行分析。
2.1 组织蛋白酶L的分离纯化
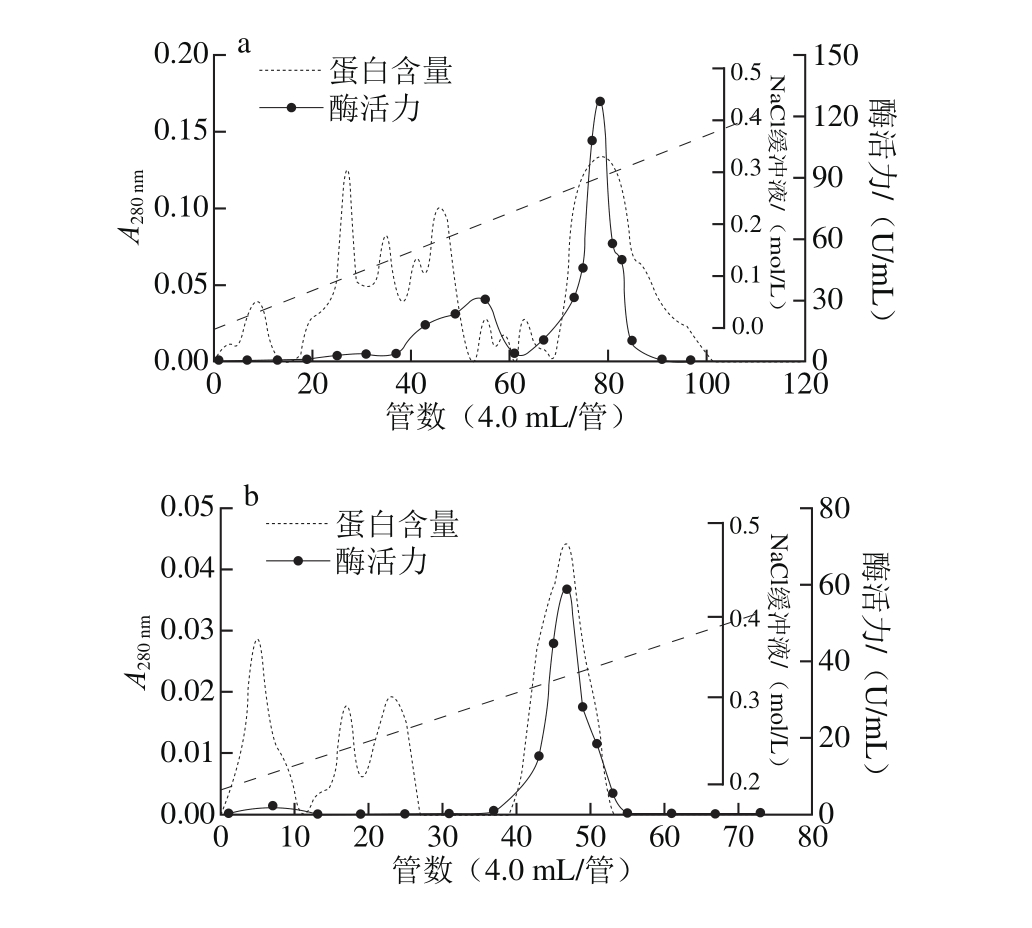
粗酶液经过预处理和硫酸铵盐析后,上样于预先平衡的SP-Sepharose阳离子交换层析柱。结果如图1a所示,目的蛋白吸附于SP-Sepharose层析柱,而大量的杂蛋白未被吸附,因此该层析柱能有效地将杂蛋白与目的蛋白分开。吸附部分的蛋白采用含0~0.5 mol/L NaCl缓冲液线性洗脱,目的蛋白被洗脱下来。由图1b所示,经SP-Sepharose阳离子交换预装柱进一步纯化。由图1c可知,组织蛋白酶L在SDS-PAGE显示单一条带,分子质量约为31 kD。该结果与来源于蓝圆鲹、鲑鱼肌肉以及海参内脏的组织蛋白酶L分子质量(30 kD左右)接近[12,17-18],但略高于鲍鱼(28.5 kD和28 kD)[11]、鲤鱼(28 kD)[19]等的分子质量。组织蛋白酶L是一种酸性蛋白酶,其等电点在5.0左右。因此,其在pH 4.5的缓冲液中带正电荷,通过2 次阳离子交换层析柱分离纯化,获得了高度纯化的组织蛋白酶L,如表1所示,酶活力、纯化倍数和得率分别为666.7 U/mg、349.4 倍和9.6%。

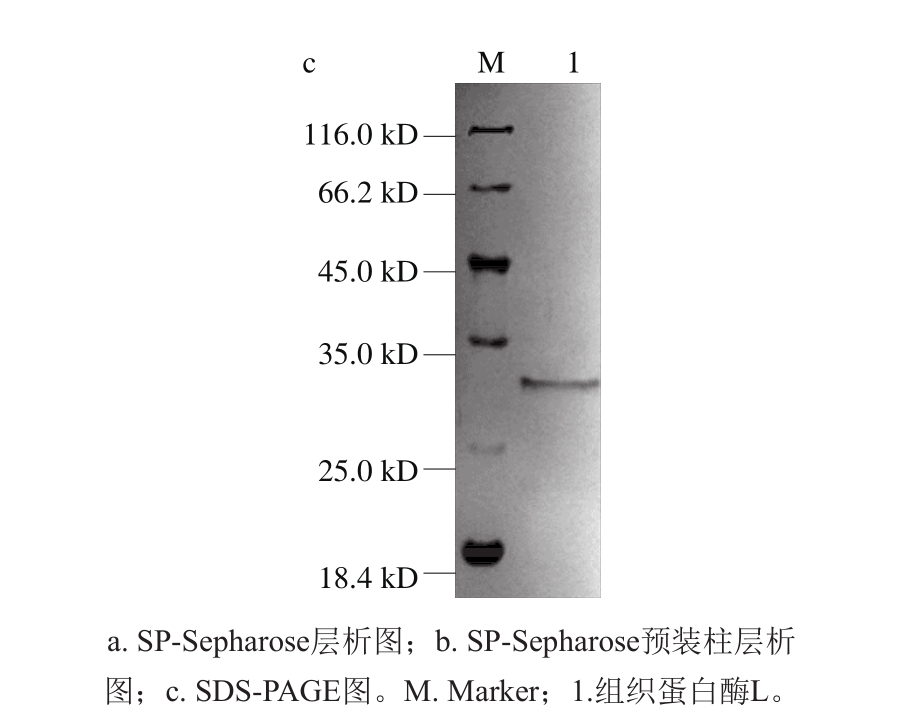
图1 组织蛋白酶L分离纯化层析图
Fig. 1 Column chromatographic purification of cathepsin L
表1 凡纳滨对虾组织蛋白酶L的纯化
Table 1 Summary of the purification of cathepsin L from shrim p
2.2 肽质量指纹图谱分析
表2 纯化蛋白质谱分析获得的肽段
Table 2 Peptide sequences of purified protein obtained by peptide mass fingerprinting
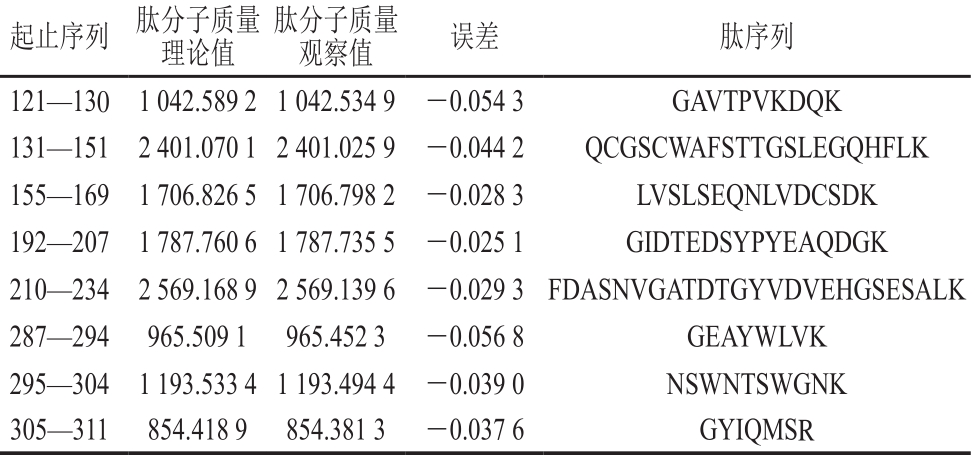
由表2可知,利用肽质量指纹图谱技术对纯化蛋白进行鉴定,获得8 个氨基酸片段包含112 个氨基酸残基。由图2可知,经过序列比对,发现所得片段与通过分子克隆获得的凡纳滨对虾(L.vannamei)组织蛋白酶L(GenBank:CAA68066.1)的氨基酸序列完全一致,证明纯化的酶为组织蛋白酶L。作为溶酶体中重要的半胱氨酸蛋白酶之一,组织蛋白酶L在多种动物中被发现存有潜在的糖基化位点[11,19-20]。鲍鱼的组织蛋白酶L由于糖基化而出现2 个分子质量不同的条带[11]。凡纳滨对虾组织蛋白酶L的序列中同样有一个潜在的糖基化位点(Asn298)[20],但是在蛋白水平上并没有出现糖基化修饰现象。利用空间预测软件SW ISS-MODEL,以人的组织蛋白酶L(SMTL ID:1cs8.1)为模板,对凡纳滨对虾组织蛋白酶L进行同源建模,如图3所示,推测是由于潜在糖基化位点(Asn298)在空间结构上处于蛋白内部,被蛋白质折叠所掩盖而未发生糖基化。

图2 纯化蛋白的质谱片段与报道的凡纳滨对虾(L. vannamei)组织蛋白酶L的序列比较
Fig. 2 Sequence alignment of the peptide of purified p rotein w ith cathepsin L from Litopenaeus vannamei
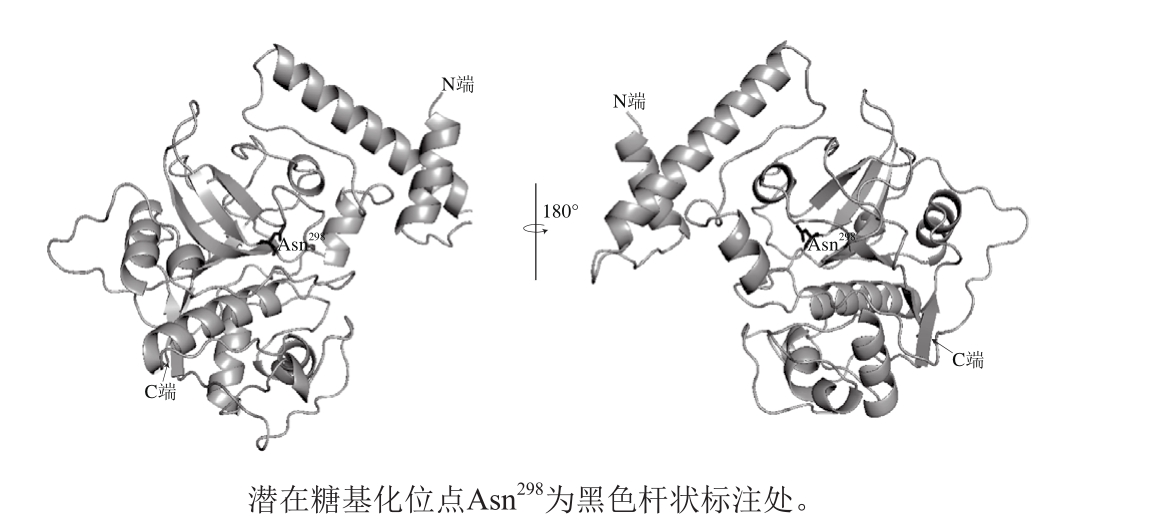
图3 凡纳滨对虾(L. vannamei)组织蛋白酶L中潜在N糖基化位点在三级结构中位置
Fig. 3 Potential N-glycosylated site of cathepsin L from Litopenaeus vannamei in the three-dimensional structure
2.3 组织蛋白酶L的性质分析
2.3.1 最适温度和热稳定性
如图4所示,组织蛋白酶L在35 ℃时对Z-Phe-A rg-M CA荧光底物的分解能力最强,与鲍鱼来源的组织蛋白酶L(35 ℃)相近[11],低于蓝圆鲹(55 ℃)[12]、海参(50 ℃)[18]等水产动物的组织蛋白酶L。当温度为4 ℃时,组织蛋白酶L保持40%的相对酶活力,表明该酶在低温条件下仍表现出较高的酶活力;当温度为60 ℃时,由于高温引起蛋白变性,组织蛋白酶L出现了失活状态。另外,组织蛋白酶L的热稳定性结果显示,当温度低于40 ℃时,酶的稳定性良好,相对酶活力保持在60%以上。当温度高于40 ℃时,组织蛋白酶L酶活力下降明显。在50 ℃孵育30 min后,组织蛋白酶L的相对酶活力仅为20%。
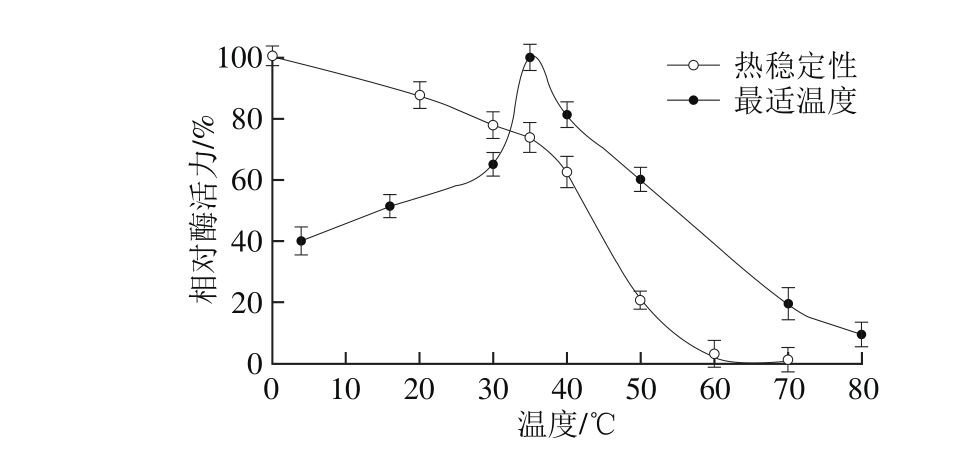
图4 组织蛋白酶L的最适温度和热稳定性
Fig. 4 Op timal tem perature and thermal stability of cathepsin L
2.3.2 最适pH值和pH稳定性
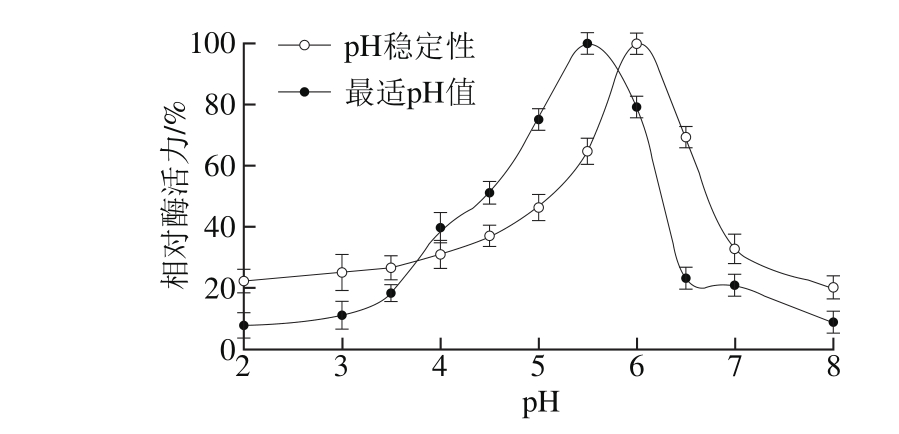
图5 组织蛋白酶L的最适pH值和pH稳定性
Fig. 5 Optimal pH and pH stability of cathepsin L
如图5所示,凡纳滨对虾组织蛋白酶L的最适pH值为5.5,这个特性与多数水产动物中组织蛋白酶L的性质相似[11-12,17-18]。当pH值为4.0时,酶活力较低,仅有40%的相对酶活力;当pH值为8.0时,几乎不表现酶活性。可见组织蛋白酶L是一种在酸性条件下表现酶活力并发挥其功能的蛋白酶。当pH值大于6.5,酶活力下降明显,到pH 8.0时,酶活力几乎丧失。当pH值小于5.5时,酶活力也呈下降趋势,表明组织蛋白酶L在pH 5.5~6.5区域,其稳定性良好,这与本实验室先前报道的来源于鲍鱼[11]、蓝圆鲹[12]的组织蛋白酶L性质相似。
2.3.3 底物特异性研究
表3 组织蛋白酶L的底物特异性
Tab le 3 Substrate specificity of cathepsin L

本实验选用不同类型的荧光底物对凡纳滨对虾组织蛋白酶L的底物特异性进行研究,结果如表3所示。组织蛋白酶L对荧光底物的分解十分专一,仅对P1位(切割位点N端第一个氨基酸残基)为碱性氨基酸[21],P2位为疏水性氨基酸的底物的组织蛋白酶底物Z-Phe-A rg-MCA进行强烈分解[22],而对其他类型的荧光底物分解程度较低。Brömme等[23]通过合成一系列底物进行分析,指出组织蛋白酶L更偏向于切割P2为芳香族氨基酸残基的底物,这一性质与组织蛋白酶B和S不同。可见,组织蛋白酶L、B、S虽均属于半胱氨酸蛋白酶中的木瓜蛋白酶超家族,但底物特异性仍存在差异。
2.3.4 蛋白酶抑制剂的影响
不同蛋白酶抑制剂对组织蛋白酶L分解Z-Phe-A rg-MCA的影响如表4所示。丝氨酸蛋白酶抑制剂苯甲脒有一定的抑制,但PMSF对其抑制作用不明显。蛋白酶抑制剂亮肽素和E-64对该酶活力有强烈的抑制效果。Leupeptin既属于半胱氨酸蛋白酶抑制剂,也是丝氨酸蛋白酶抑制剂,其抑制类型并不专一,而E-64是一种专一抑制剂半胱氨酸蛋白酶的抑制剂,这2 种抑制剂可以有效抑制该酶活性,也证明了纯化的酶属于半胱氨酸蛋白酶类。金属蛋白酶抑制剂EDTA、EGTA对该酶有轻微的激活作用,推测是由于某种(或某几种)金属离子对该酶的活性存在抑制作用,而EDTA、EGTA螯合金属离子,进而激活了酶活性。类似的结果在鲍鱼组织蛋白酶L也被观察到[9]。
表4 不同蛋白酶抑制剂对组织蛋白酶L的影响
Table 4 Effect of different p roteinase inhibitors on the activity of cathepsin L

2.4 凡纳滨对虾冷藏过程中肌肉微观结构的变化
对虾在4 ℃冷藏过程中,肌肉结构由紧密逐渐变为松散是导致质构不断下降的原因。扫描电镜图分析结果显示,新鲜对虾的肌肉结构完整,成束状平行规则排列,纤维结构紧密(图6a1、6a2)。冷藏3 d后,肌肉束状纤维出现断裂(箭头所指向处),纤维之间变得疏松(图6b1、6b2)。5 d后,肌肉束状结构断裂加剧,出现片状化现象(箭头所指向处),肌肉结构更加松散、肉质软化(图6c1、6c2)。Pornrat等[24]运用超微结构分析了罗氏沼虾在5 ℃贮藏3 d后肌原纤维蛋白的变化情况,发现Z线发生断裂,4~6 d后,Z线、I线和M线均发生断裂。有研究发现对虾在冷藏过程中,蛋白酶会造成肌肉弹性下降,是造成纤维不断产生断裂、片状化的原因之一[25]。

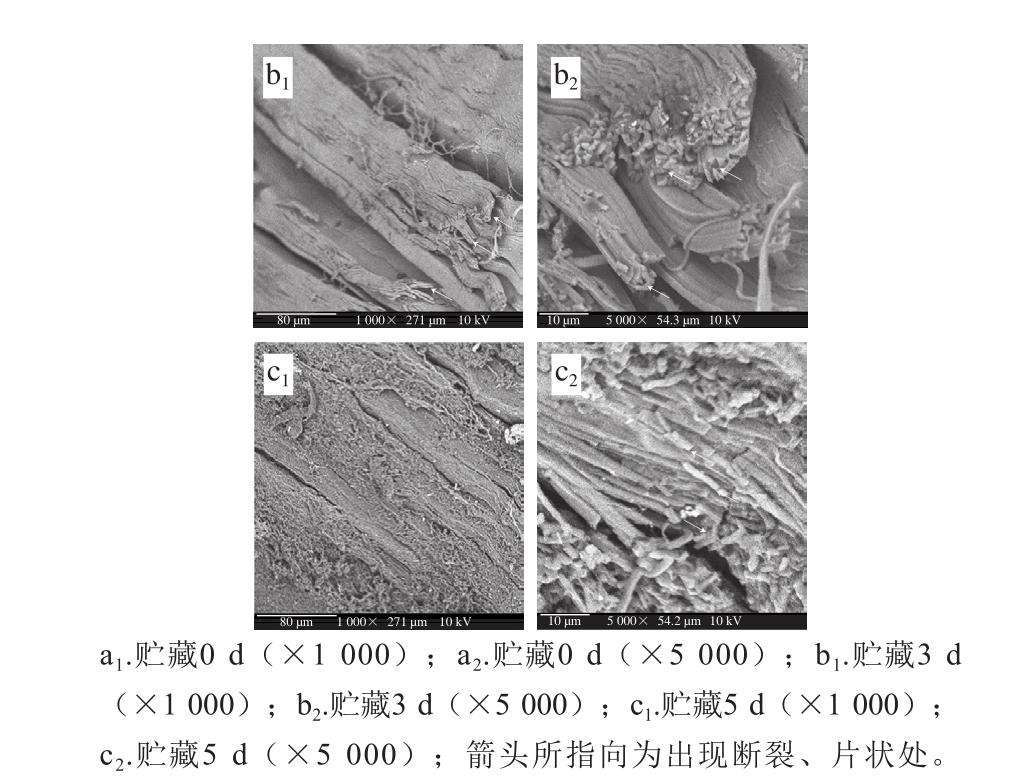
图6 凡纳滨对虾肌肉在4 ℃贮藏不同时间的扫描电镜图
Fig. 6 EM photom icrographs of shrim p muscle stored at 4 ℃ for different time intervals
2.5 组织蛋白酶L与肌肉总蛋白降解的关系
为了探究组织蛋白酶L是否能够导致虾肌肉软化,研究了组织蛋白酶L对虾肌肉蛋白的降解作用,结果如图7所示。在磷酸盐缓冲液(pH 6.5)中,组织蛋白酶L与肌肉总蛋白在35 ℃共同孵育5 m in,肌球蛋白重链(myosin heavy chain,MHC)迅速发生降解。随着时间的延长,虾肌肉中分子质量大于60 kD的蛋白均出现降解现象。反应180 min后,MHC几乎被完全降解,同时,肌动蛋白和原肌球蛋白,以及其他蛋白(条带1~5)等也发生降解。在4 ℃条件下,随着作用时间延长,也可观察到同样的结果。
活虾肌肉pH值约为7.0,虾死后初期由于体内糖原的降解,三磷酸腺苷分解导致酸类物质的产生,pH值下降至6.5左右。随着贮藏时间延长,虾体内的蛋白质、氨基酸及含氮类物质在自身蛋白酶和微生物的共同作用下分解产生胺类、吲哚等碱性物质,使虾肉pH值逐渐上升至8.0左右[24-25]。组织蛋白酶L的酶学性质显示,当pH值大于6.5时,酶活力下降十分明显,因此其可能参与虾死后初期和中期肌肉蛋白质的降解。
尽管本研究的组织蛋白酶L是从肝胰腺中分离获得,但该酶广泛存在于虾肌肉中[28],是肌肉中活性较高的内源性蛋白酶之一[29]。同时,对虾肝胰腺中存在高活力的丝氨酸蛋白酶[4,29-30]。随着对虾新鲜度的下降,肝胰腺中的蛋白酶可以逐渐向肌肉扩散,并使肌肉蛋白发生降解。本研究也发现,在4 ℃贮藏过程中,虾肉的第一腹节处最先出现肌肉断裂现象,蛋白降解最剧烈,可能是虾头部丰富的蛋白酶逐渐向肌肉中扩散并发挥作用。
同时,本研究对4 ℃贮藏过程中虾肌肉中组织蛋白酶L相对活力进行检测,由图8所示,随时间延长,该酶活力有一定程度降低,但即便贮藏5 d,其相对活性仍保持在80%以上。因此,组织蛋白酶L在虾贮藏过程中持续参与肌肉蛋白的分解,尤其对组成肌肉的主要蛋白MHC的降解最为显著。
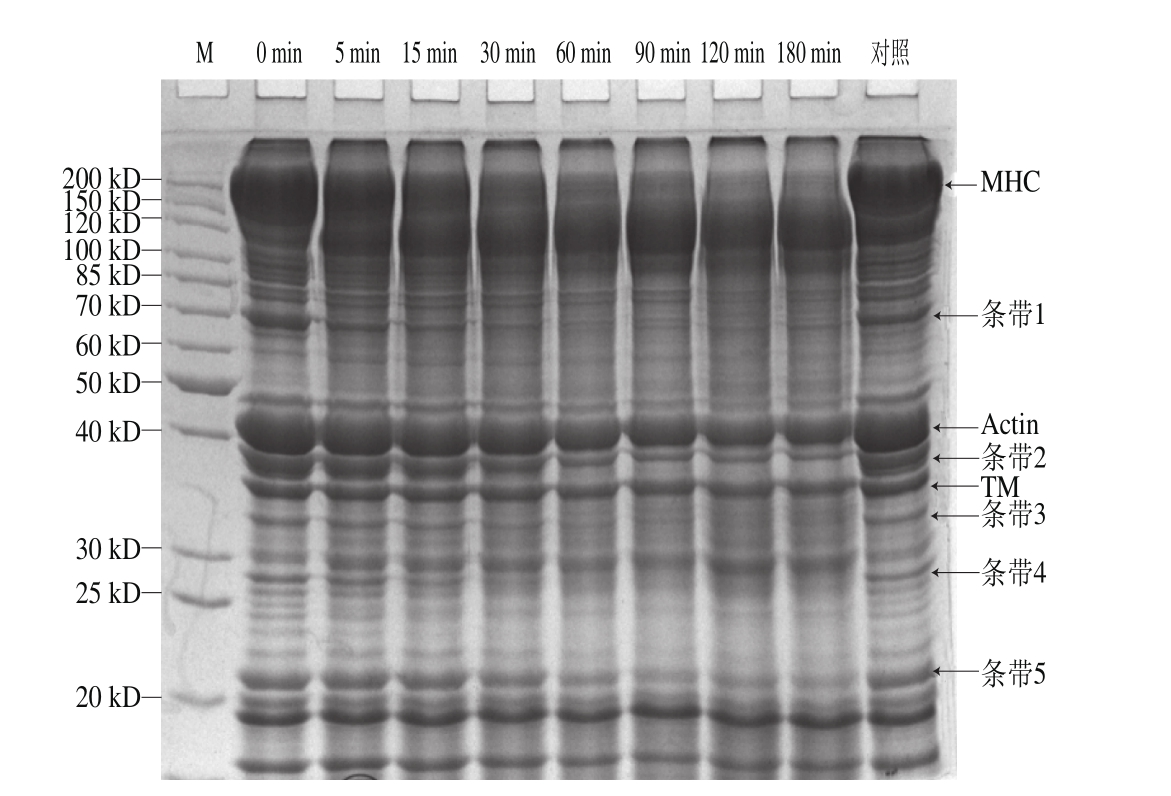
图7 组织蛋白酶L对虾肌肉蛋白的降解作用
Fig. 7 SDS-PAGE profi les show ing degradation of shrim p muscular proteins by cathepsin L
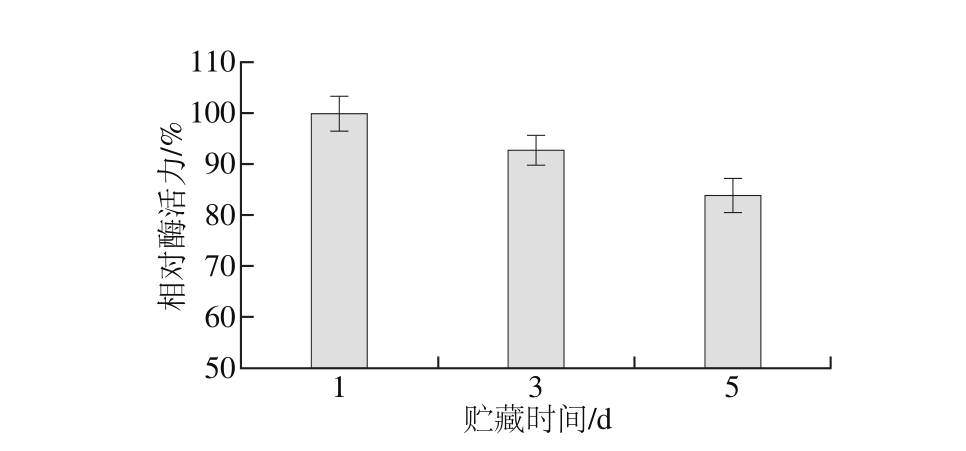
图8 4 ℃贮藏不同时间肌肉中组织蛋白酶L相对活力的变化
Fig. 8 Relative activities of cathepsin L in shrimp muscle at different time intervals during storage at 4 ℃
本研究运用生化分离技术从凡纳滨对虾中纯化获得一种组织蛋白酶L,结果显示该酶分子质量为31 kD,最适温度和pH值分别为35 ℃和5.5,在0~40 ℃以及pH 5.5~6.5之间酶活力稳定。肽质量指纹图谱进一步确定该酶为组织蛋白酶L。该酶对组织蛋白酶底物Z-Phe-A rg-MCA分解作用显著,半胱氨酸蛋白酶抑制剂E-64和Leupeptin对该酶活力有强烈的抑制效果。扫描电镜结果显示,虾肌肉在冷藏解冻过程中,肌肉纤维出现断裂、片状化现象。纯化的组织蛋白酶L能够使虾肉蛋白产生降解,推测其与虾类贮藏过程中肌肉蛋白品质下降直接相关。
参考文献:
[1] 边涛, 赵艳, 张虹, 等. 凡纳滨对虾在不同冷藏条件下的品质变化研究[J]. 水产科学, 2009, 28(9): 493-497. DOI:10.3969/j.issn.1003-1111.2009.09.002.
[2] 农业部渔业局. 中国渔业年鉴[Z]. 北京: 中国农业出版社, 2015:217-219.
[3] 李学鹏. 中国对虾冷藏过程中品质评价及新鲜度指示蛋白研究[D].杭州: 浙江工商大学, 2012: 8-17.
[4] 陈诗妍. 凡纳滨对虾死后胰蛋白酶的迁移及其对肌肉蛋白的降解作用[D]. 湛江: 广东海洋大学, 2015: 2-6.
[5] 梁美艳, 陈庆森, 阎亚丽, 等. 气调保藏技术用于虾类保鲜的初步研究[J]. 食品科学, 2009, 30(14): 296-299. DOI:10.3321/j.issn:1002-6630.2009.14.066.
[6] 李姣, 李学鹏, 励建荣, 等. 冷藏条件下中国对虾肌肉蛋白质的生化特性[J]. 食品科学, 2011, 32(5): 16-21.
[7] 冯家敏, 张宾, 蒋林珍, 等. 流化冰结合防黑剂、抑菌剂对南美白对虾的保鲜效果[J]. 食品科学, 2016, 37(2): 244-249. DOI:10.7506/spkx1002-6630-201602043.
[8] KONG B, XIONG Y L, CHEN G, et al. Influence of gender and spawning on thermal stability and proteolytic degradation of proteins in Australian red claw crayfish (Cherax quadricarinatus) muscle stored at 2 ℃[J]. International Journal of Food Science and Technology,2007, 42(42): 1073-1079. DOI:10.1111/j.1365-2621.2006.01350.x.
[9] GORNIK S G, ALBALAT A, ATKINSON R J A, et al. Biochemical investigations into the absence of rigor mortis in the Norway lobster Nephrops norvegicus[J]. Journal of Experimental Marine Biology and Ecology, 2009, 373(1): 58-65. DOI:10.1016/j.jembe.2009.03.004.
[10] 李来好, 孙蕾蕾, 黄卉, 等. 冰藏奥尼罗非鱼片组织蛋白酶与品质变化的相关性分析[J]. 水产学报, 2015, 39(4): 589-597. DOI:10.11964/jfc.20141109558.
[11] SHEN J D, CAI Q F, YAN L J, et al. Cathepsin L is an immune-related protein in Pacific abalone (Haliotis discus hannai): purification and characterization[J]. Fish and Shellfish Immunology, 2015, 47: 986-995. DOI:10.1016/j.fsi.2015.11.004.
[12] ZHONG C, CAI Q, LIU G, et al. Purification and characterisation of cathepsin L from the skeletal muscle of blue scad (Decapterus M aruadsi) and com parison o f its ro le w ith m yo fibril-bound serine proteinase in the degradation of myofibrillar proteins[J].Food Chem istry, 2012, 133(4): 1560-1568. DO I:10.1016/j.foodchem.2012.02.050.
[13] 段亚飞, 刘萍, 李吉涛, 等. 脊尾白虾组织蛋白酶L基因的克隆及其表达分析[J]. 动物学研究, 2013, 34(1): 39-46. DOI:10.3724/SP.J.1141.2013.01039.
[14] EAKPETCH P, BENJAKUL S, VISESSANGUAN W, et al. Autolysis of Pacifi c white shrimp (Litopenaeus vannamei) meat: characterization and the eff ects of protein additives[J]. Journal of Food Science, 2008,73(2): 95-103. DOI:10.1111/j.1750-3841.2007.00630.x.
[15] MARTINEZ I, FRIIS T J, MERCEDES C. Post mortem muscle protein degradation during ice-storage of Arctic (Pandalus borealis)and tropical (Penaeus japonicus and Penaeus monodon) shrimps:a comparative electrophoretic and immunological study[J]. Journal of the Science of Food and Agriculture, 2001, 81(12): 1199-1208.DOI:10.1002/jsfa.931.
[16] BARRETT A J, RAW LINGS N D. Evolutionary lines of cysteine pep tidases[J]. Bio logical Chem istry, 2001, 382(5): 727-733.DOI:10.1515/BC.2001.088.
[17] YAMASHITA M, KONAGAYA S. Purifi cation and characterization of cathepsin L from the white muscle of chum salmon, Oncorhynchus keta[J]. Com parative Biochem istry and Physio logy Part B:Biochem istry and M o lecu lar Biology, 1990, 96(2): 247-252.DOI:10.1016/0305-0491(90)90371-Y.
[18] ZHOU D, CHANG X, BAO S, et al. Purification and partial charac terisation o f a cathepsin L-like p roteinase from sea cucumber (Stichopus japonicus) and its tissue distribution in body w all[J]. Food Chem istry, 2014, 158: 192-199. DOI:10.1016/j.foodchem.2014.02.105.
[19] TSUNEMOTO K, OSATOM I K, NOZAK I Y, et al. M olecu lar characterization of cathepsin L from hepatopancreas of the carp Cyprinus carpio[J]. Comparative Biochem istry and Physiology Part B: Biochem istry and Molecular Biology, 2004, 137(1): 107-114.DOI:10.1016/j.cbpc.2003.10.012.
[20] BOULAY C L, WORMHOUDT A V, SELLOS D. Cloning and expression of cathepsin L-like proteinases in the hepatopancreas of the shrimp Penaeus vannamei during the intermolt cycle[J]. Journal of Comparative Physiology B, 1996, 166(5): 310-318. DOI:10.1007/BF02439917.
[21] LEE J J, CHEN H C, JIANG S T. Comparison of the kinetics of cathepsins B, L, L-like, and X from the dorsal muscle of mackerel on the hydrolysis of methylcoumary lam ide substrates[J]. Journal of Agricultural and Food Chem istry, 1996, 44(3): 774-778. DOI:10.1021/jf9502515.
[22] TOWATARI T, KATANUMA N. Selective cleavage of peptide bonds by cathepsins L and B from rat liver[J]. Journal of Biochem istry, 1983,93: 1119-1128.
[23] BRÖMME D, BONNEAU P R, LACHANCE P, et al. Engineering the S2subsite specifi city of human cathepsin S to a cathepsin L and cathepsin B-like specificity[J]. Journal of Biological Chem istry, 1994,269(48): 30238-30242.
[24] PORNRAT S, SUMATE T, ROMMANEE S, et al. Changes in the ultrastructure and texture of prawn muscle (Macrobrachuim rosenbergii)during cold storage[J]. LWT-Food Science and Technology, 2007, 40(10):1747-1754. DOI:10.1016/j.lw t.2007.01.006.
[25] 吉宏武, 刘书成. 对虾加工与利用[M]. 北京: 中国轻工业出版社,2015: 45-57.
[26] 常耀光, 李兆杰, 薛长湖, 等. 超高压处理对南美白对虾在冷藏过程中贮藏特性的影响[J]. 农业工程学报, 2008, 24(12): 230-237.DOI:10.3321/j.issn:1002-6819.2008.12.048.
[27] 王亮, 曾名湧, 董士远, 等. 海带多酚制备及其对南美白对虾保鲜效果的研究[J]. 食品工业科技, 2009, 30(10): 187-191.
[28] SRIKET C, BENJAKUL S, VISESSANGUAN W. Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn (Macrobrachium rosenbergii)[J]. Journal of the Science of Food and Agriculture, 2011, 91(1): 52-59. DOI:10.1002/jsfa.4145.
[29] 陈诗妍, 吉宏武, 李承勇, 等. 凡纳滨对虾内源蛋白酶对肌原纤维蛋白的降解作用[J]. 食品工业科技, 2015, 36(5): 149-155.DOI:10.13386/j.issn1002-0306.2015.05.023.
[30] 翁凌, 李腾, 阴利华, 等. 南美白对虾丝氨酸蛋白酶的分离纯化及性质研究[J]. 集美大学学报(自然科学版), 2010, 15(4): 272-278.DOI:10.3969/j.issn.1007-7405.2010.04.007.
Characterization of Cathepsin L from Litopenaeus vannamei and Its Effect on Muscular Protein Degradation
YAN Longjie1, SHEN Jiandong2, ZHANG Lingjing1,2, WENG Ling1,2, HU Liping1, CAO M injie1,2,3,*
(1. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China;2. National and Local Joint Engineering Research Center of Processing Technology for Aquatic Products, Xiamen 361021, China;3. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361102, China)
Abstract:This study aimed to investigate the enzyme that m ight be involved in this process. Cathepsin L was purified to homogeneity from the hepatopancreas of Litopenaeus vannamei, and its molecular mass was approximately 31 kD as analyzed by sodium dodecyl sulfate- polyacrylam ide gel electrophoresis (SDS-PAGE). Peptide mass fingerprinting revealed that 8 peptide fragments w ith a total of 112 amino acid residues were completely identical to the cathepsin L gene of L. vannamei. Using Z-Phe-Arg-MCA as substrate, the proteinase revealed optimal activity at 35 ℃ and pH 5.5,respectively. Purified cathepsin L was stable at temperature up to 40 ℃ and in the pH range from 5.5 to 6.5. It exhibited high specificity towards the substrate Z-Phe-Arg-MCA. Its enzymatic activity was significantly suppressed by the cysteine proteinase inhibitors E-64 and leupeptin, while it could be slightly activated by the metalloproteinase inhibitors ethylene diam ine tetraacetic acid (EDTA) and ethylene glycol tetraacetic acid (EGTA). In addition, the fibrous structure of shrimp meat was increasingly destroyed w ith the prolongation of cold storage time as observed by scanning electron m icroscope(SEM). Purified cathepsin L eff ectively hydrolyzed muscular proteins as detected by SDS-PAGE, suggesting its potential involvement in the degradation of shrimp muscular proteins during cold storage.
Key words:Litopenaeus vannamei; cathepsin L; purification; myofibillar protein; degradation; scanning electron m icroscope (SEM)
DOI:10.7506/spkx1002-6630-201722006
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)22-0034-07
收稿日期:2016-10-13
基金项目:国家自然科学基金面上项目(31271838);厦门南方海洋研究中心项目(14CZP030HJ04)
作者简介:颜龙杰(1988—),男,博士研究生,研究方向为水产加工。E-mail:yanlongjieg@163.com
*通信作者:曹敏杰(1964—),男,教授,博士,研究方向为水产品深加工与蛋白质化学。E-mail:m jcao@jmu.edu.cn
引文格式:
颜龙杰, 沈建东, 张凌晶, 等. 凡纳滨对虾组织蛋白酶L性质分析及其对肌肉蛋白的降解[J]. 食品科学, 2017, 38(22):34-40. DOI:10.7506/spkx1002-6630-201722006. http://www.spkx.net.cn
YAN Longjie, SHEN Jiandong, ZHANG Lingj ing, et al. Characterization of cathepsin L from Litopenaeus vannamei and its effect on muscular protein degradation[J]. Food Science, 2017, 38(22): 34-40. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722006. http://www.spkx.net.cn