刘 蕾1,武瑞赟2,李 军1,李平兰1,*
(1.北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083;2.内蒙古大学生命科学学院,内蒙古 呼和浩特 010021)
摘 要:采用平板活菌计数法比较被膜态及浮游态的类植物乳杆菌L-ZS9经热处理、酸处理、胆盐处理后的存活率,结果表明被膜态菌体具有更强的抗胁迫能力;通过实时荧光定量聚合酶链式反应的方法比较被膜态及浮游态菌株L-ZS9的胁迫相关基因atpβ、atpε、clp、pspC、ccpA及群体感应信号分子自诱导物(autoinducer 2,AI-2)合成关键基因luxS的转录水平,结果表明被膜态菌体的基因转录水平显著高于浮游态;通过报告菌株发光检测法比较被膜态及浮游态菌株上清液中AI-2的活性,结果表明被膜态菌体上清液中AI-2的活性显著高于浮游态;且外源信号分子AI-2可以调控基因atpβ、atpε、clp、ccpA、luxS的转录水平。结果说明生物被膜不仅可以提供物理防御作用,而且其细胞个体的基因转录水平与浮游态也有所不同,且群体感应系统在被膜的形成与调控中发挥着重要作用。本研究为开发高活力益生菌功能食品提供了新的思路和理论基础。
关键词:类植物乳杆菌;生物被膜;抗胁迫能力;信号分子AI-2;转录水平
近年来,肠道菌群因其在营养物质代谢、人体自身发育及免疫疾病等方面发挥的重要作用引起了科研人员的广泛关注。肠道菌群依据其数量多少可分为主要(优势)菌群和次要菌群,其中乳杆菌因其具有重要生理功能而归为优势菌群。根据世界卫生组织对益生菌的定义,益生菌是指当以足够数量存在时可对机体健康产生有益作用的活性微生物,其中研究最深入、应用最广泛的是乳酸菌。许多研究结果表明,乳酸菌对皮肤炎、哮喘、节段性回肠炎、肝源性脑病、鼻炎、结肠直肠癌、胃肠道感染、肥胖乃至抑郁症等精神疾病均具有显著的治疗作用[1-3]。目前,益生菌不仅是一种食品补充剂,其营养保健及治疗作用也得到了越来越多的认可。因此,如何有效发挥益生菌的益生作用已成为近年来的研究热点。
益生菌通常被直接制备成菌粉或以食物(如酸奶、果汁、发酵乳酪等)为载体通过口服进入人体,黏附定植于胃肠道黏膜表面,通过拮抗病原菌、分泌活性物质、调节人体免疫系统等途径发挥益生作用[4]。值得注意的是,益生菌在生产制备过程中会经受各种不良环境的胁迫,如喷雾干燥制备菌粉时菌体需耐受80 ℃以上的高温[5]。当菌体摄食入口,在到达发挥益生功效的生态位点前,需经受pH 2.0~3.0的胃酸环境,以及质量浓度约为0.05~2 g/100 m L的胆盐环境[6-7]。以上胁迫环境都会对益生菌的生理活性产生严重影响。因此,如何提高益生菌的抗胁迫能力意义重大。
细菌为了抵抗外界不良环境常以生物被膜的状态存在。生物被膜是大多数细菌在自然状态下的一种生长方式,且被膜的形成和发展与多种生理行为相关,如毒力、发光、耐药性等。关于有害微生物生物被膜的研究已取得了很大的进展[8-9]。生物被膜不是细菌个体的简单堆积,而是细菌菌体及胞外分泌物如多糖、纤维蛋白、脂蛋白等相互作用而形成的具有复杂结构的膜样物质。多数细菌在自然环境中之所以选择以被膜状态生存,主要是由于被膜态菌体具有浮游态时不可比拟的优势[10]。研究发现,将被膜态的鼠李糖乳杆菌(Lactobacillus rhamnosus)制成微制剂,不仅能更好地控制其释放,还可增强其耐热耐酸的能力。如将形成高密度生物被膜的益生菌包裹在壳聚糖包被的藻酸盐微胶囊中,可显著提高菌体抗冷冻干燥的能力和耐热能力,且生物被膜态的益生菌与浮游态相比具有更显著的免疫调节作用[11]。
本研究选择1株类植物乳杆菌(L. paraplantarum)L-ZS9为研究对象,该菌株可产生多种细菌素,可有效抑制肠杆菌科微生物的生长[12-13],具有开发成优良益生菌制剂和益生菌添加剂的潜力。且前期研究发现L. paraplantarum L-ZS9具有较强的生物被膜形成能力,且群体感应信号分子自诱导物(autoinducer-2,A I-2)可影响其被膜形成[14]。本实验通过比较L. paraplantarum L-ZS9生物被膜及浮游态细胞的耐热、耐酸、耐胆盐能力及相关基因的转录水平,明确了被膜态菌体具有更强的抗胁迫能力;进一步对2 种状态菌体上清液中的信号分子AI-2进行了检测,分析了不同菌体状态与信号分子AI-2的关系。该研究为开发高活力益生菌功能食品提供了新的思路和理论基础。
1.1 材料与试剂
1.1.1 菌种
类植物乳杆菌(L. paraplantarum)L-ZS9从比利时发酵肉Saucisson sec pur中分离,现保藏于中国普通微生物菌种保藏管理中心(China General M icrobiological Culture Collection Center,CGMCC),保藏编号为CGMCC No. 11669。
哈维氏弧菌(Vibrio harveyi)BB170及BB152从中国农业科学院上海兽医研究所获得。
大肠杆菌(Escherichia coli)DH5α购于宝生物工程(大连)有限公司。
1.1.2 试剂
反转录试剂盒TUREscript 1st Strand cDNA Synthesis Kit和TRIpure 北京艾德莱生物科技有限公司;DNaseⅠ(RNase-free)及RNase抑制剂 Thermo Fisher科技(中国)有限公司;SYBG reen染料 美国K apa Biosystems公司。
1.1.3 培养基
乳酸菌培养用培养基:M RS培养基,包括蛋白胨10 g/L、酵母提取物5 g/L、柠檬酸二铵2 g/L、葡萄糖20 g/L、M gSO4·7H2O 0.58 g/L、牛肉浸膏10 g/L、K2HPO42 g/L、乙酸钠5 g/L、Tween 80 1 m L/L、MnSO4·4H2O 0.25 g/L。
大肠杆菌培养用培养基:LB培养基,包括胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L,调节pH值至7.4,121 ℃灭菌15 m in后备用。
哈维氏弧菌培养用培养基:海生菌肉汤,取37.4 g培养基粉末,使溶质完全溶解,定容至1 L,121 ℃灭菌15 m in后备用。
乳酸菌上清液制备培养基:质量分数12%脱脂乳培养基,115 ℃灭菌10 m in后置于4 ℃冰箱备用,在2 d内用完。
信号分子检测用培养基:AB培养基,每升培养基中加入0.05 mol MgSO4、0.3 mol NaCl、质量分数为0.2%无维生素酪蛋白氨基酸(vitam in-free casam ino acids),用KOH溶液调节pH值至7.5,121 ℃灭菌15 m in后添加10 m L 1 mo l/L磷酸氢二钾(0.22 μm滤器过滤)、10 m L 0.1 mol/L L-精氨酸(0.22 μm滤器过滤)、20 m L质量分数50%甘油(0.22 μm滤器过滤),现配现用。
1.2 方法
1.2.1 浮游态及生物被膜态细菌制备
将活化的L. paraplantarum L-ZS9接种于MRS液体培养基中,在37 ℃、200 r/m in条件下振荡培养36 h后,5 000×g离心10 m in收集菌体,50 mmol/L磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.0)重悬菌体至终浓度1×108CFU/m L,此为浮游态细胞。
细菌可附着在聚苯乙烯材料表面形成生物被膜[15]。生物被膜态L. paraplantarum L-ZS9的培养条件及方法参照参考文献[14]。将活化的菌株L-ZS9接种于MRS液体培养基中,置于由聚苯乙烯材料制成的细胞培养板,37 ℃ 静置培养36 h,用移液枪吹散并重悬细胞,收集于1.5 m L离心管中,5 000×g离心10 m in收集菌体,并重悬至终浓度1×108CFU/m L,此为被膜态细胞。
1.2.2 浮游态及被膜态菌体耐热能力测定
分别制备浮游态和被膜态菌株L-ZS9。将收集到的菌体置于80 ℃水浴锅中,处理3 m in。处理结束后通过平板活菌计数法计算活菌数,并计算存活率。实验每组设置3 个平行,且进行3 次生物学重复实验,测定浮游态及被膜态菌体的耐热能力。
1.2.3 浮游态及被膜态菌体耐酸能力测定
分别制备浮游态和被膜态菌株L-ZS9。将收集到的菌体分别重悬于pH值为2.8的MRS培养基中,处理1 h。处理结束后通过平板计数法计算活菌数。实验每组设3 个平行,且进行3 次生物学重复实验,测定浮游态及被膜态菌体的耐酸能力。
1.2.4 浮游态及被膜态菌体耐胆盐能力测定
分别制备浮游态和被膜态菌株L-ZS9。将收集到的菌体分别重悬于胆盐质量浓度为0.2 g/100 m L的MRS培养基中,处理0.5 h。处理结束后通过平板计数法计算活菌数。实验每组设3 个平行,且进行3 次生物学重复实验。以此确定最适处理胆盐浓度及处理时间,测定浮游态及被膜态菌体的耐胆盐能力。
1.2.5 浮游态及被膜态菌体基因转录水平测定
收集浮游态和生物被膜态细菌,按照北京艾德莱生物科技有限公司的TRIpure提取总RNA步骤分别提取两者总RNA。cDNA的合成参照该公司TUREscript 1st Strand cDNA Synthesis K it说明书进行,方法如下:总RNA 50 ng~5 μg,Random Primer 1 μL,5×RT Reaction M ix 4 μL,TUREscript H-RTase 1 μL,之后用RNase free H2O定容至20 μL。25 ℃孵育10 m in,42 ℃孵育30~50 m in,65 ℃加热15 m in失活TUREscript H-RTase。合成的cDNA经DNaseⅠ处理后置于-80 ℃条件下待用。
参照L. paraplantarum L-ZS9全基因组序列,选取抗胁迫相关基因atpβ、atpε、clp、pspC、ccpA以及群体感应信号分子AI-2合成关键基因luxS为检测目标,以16S RNA为内参基因,运用Primer 3 Input(version0.4.0)设计引物,用于进行实时荧光定量聚合酶链式反应,引物序列见表1。
表1 引物设计
Table 1 Primers used in this study

实时荧光定量聚合酶链式反应体系(20 μL)如下:1 μL cDNA,10 μL 2×Sybgreen,上游引物和下游引物各1 μL(10 μmol/L),加7 μL无RNase水。反应体系如下:95 ℃预变性10 m in;95 ℃变性15 s,60 ℃退火30 s,40 个循环。数据分析采用Livak法[16]。
1.2.6 细菌上清液制备
将L. paraplantarum L-ZS9接种于脱脂乳培养基中,置于试管中振荡培养以形成浮游态菌体,分别于2、4、6、8、10、12、14、16、18、20、22、24 h收集菌液,4 ℃、12 000×g离心15 min,吸取上清液,用0.22 μm滤器过滤,为浮游态菌体上清液,置于-80 ℃条件下冷冻保存。
将L. paraplantarum L-ZS9接种于脱脂乳培养基中,置于6 孔细胞培养板中静置培养以形成被膜游态菌体,分别于2、4、6、8、10、12、14、16、18、20、22、24 h重悬菌体,4 ℃、12 000×g离心15 m in,吸取上清液,用0.22 μm滤器过滤,为被膜态菌体上清液,置于-80 ℃条件下冷冻保存。
将V. harvey i BB 152接种于M B培养基中,在28 ℃ 200 r/m in条件下振荡培养至对数生长期。4 ℃、12 000×g离心15 m in,吸取上清液,用0.22 μm滤器过滤,为阳性对照上清液,置于-80 ℃条件下冷冻保存。
将E. co li DH 5α接种于LB培养基中,在37 ℃、200 r/min条件下振荡培养至对数生长期。4 ℃、12 000×g离心15 m in,吸取上清液,用0.22 μm滤器过滤,为阴性对照上清液,置于-80 ℃条件下冷冻保存。
1.2.7 信号分子检测
将报告菌株V. harveyi BB170接种于MB培养基中,在28 ℃、200 r/m in条件下振荡培养,至暗室中可见黄绿色荧光。将其按照体积比为1∶5 000转接入新鲜配制的AB培养基中,以体积分数10%的比例加入1.2.6节中制备好的上清液中,在28 ℃、200 r/m in条件下振荡培养5 h,从中量取100 μL于白色酶标板,用多功能酶标仪生物发光模式检测发光强度,重复5 孔。进行3 次生物学重复实验。
1.2.8 添加信号分子AI-2后菌体胁迫相关基因转录水平的测定
将类植物乳杆菌L-ZS9接种于MRS培养基中,不添加AI-2的为对照组,外源添加至终质量浓度为3.84 g/m L的信号分子AI-2的为处理组[14],培养24 h后,收集菌体,液氮研磨。按照北京艾德莱生物科技有限公司的TRIpure提取总RNA步骤分别提取两者总RNA。提取过程、实时荧光定量聚合酶链式反应方法与程序设置同1.2.5节。
1.3 数据分析
所有测试重复进行平行实验3 次,用GraphPad Prism 5.0软件进行统计分析及作图。
2.1 浮游态及被膜态菌体耐热能力比较

图1 浮游态和被膜态L-ZS9耐热能力比较
Fig. 1 Survival rates of p lank tonic and biofi lm cells of L-ZS9 under heat treatment
由图1可知,浮游态菌体在80 ℃条件下处理3 m in后存活率平均值为0.15%,被膜态菌体存活率平均值为0.25%,提高了0.1%。以初始菌数为108CFU/m L计算,经热处理后被膜态将比浮游态多存活105CFU/m L。在实际制备益生菌制剂或发酵菌剂过程中,由于培养体积的扩大,被膜态活菌数将显著高于浮游态,这对于实际生产具有重大意义。
从生物学上来说,温度对生物存活影响最大,特别是高温。高温能破坏微生物的细胞膜、细胞壁、蛋白质和核酸,从而导致其死亡。研究发现[17]通过差示扫描量热仪分析保加利亚乳酸菌在62、64、65、66 ℃的耐热能力,确定加热处理过程中的损伤部位:64 ℃以下引起细胞膜的损伤,65 ℃以上引起细胞壁和蛋白质的损伤,细胞核糖体的不可逆反应也是在65 ℃。生物被膜中菌体间的黏液层可以起到很好的保护作用,减缓热传导作用,增强被膜态菌体的存活率。
2.2 浮游态及被膜态菌体耐酸能力比较
胃壁黏膜中含有大量腺体,可以分泌胃液,胃液呈酸性,pH值通常在2.0~3.0之间波动,有时甚至可以达到1.0。本研究发现pH 2.8处理1 h后,被膜态菌株L-ZS9的存活率略高于浮游态,具有统计学差异,见图2所示。
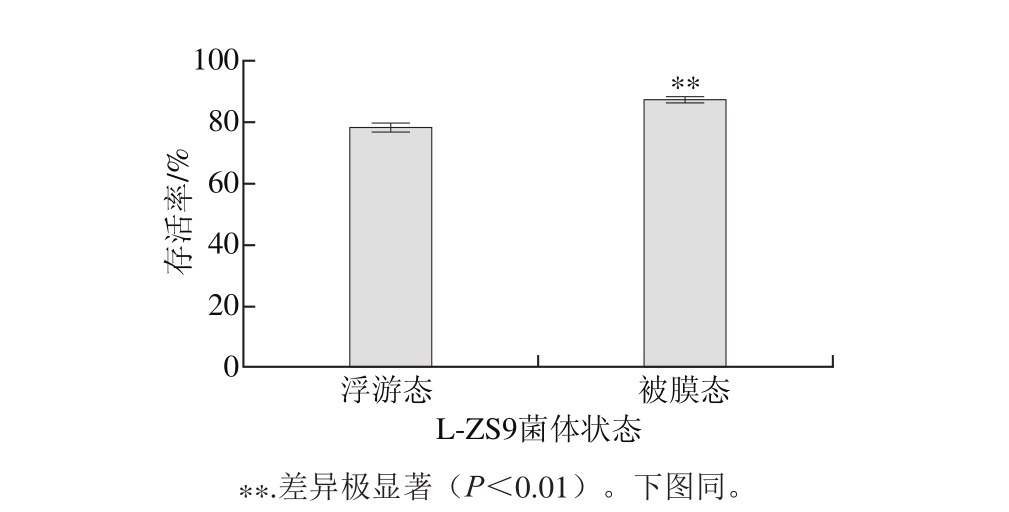
图2 浮游态和被膜态L-ZS9耐酸能力比较
Fig. 2 Survival rates of p lanktonic and biofi lm cells of L-ZS9 under acid treatment
低pH值对菌体生长和代谢产生诸多不利影响称为酸胁迫。酸胁迫引起胞内pH值下降,导致碳水化合物代谢途径中一些酸敏感的酶活性丧失,严重影响能量供给。同时,酸胁迫会对细胞膜、大分子物质(如DNA和蛋白质)的结构产生损伤[18]。生物被膜中的胞外多聚物将菌体包裹其中,使菌体生存环境与低pH值胁迫环境隔离开来,大大削弱酸胁迫对菌体细胞膜的直接破坏作用。此外,生物被膜中菌体形成立体的三维结构,其中的营养物质、渗透压及pH值可形成梯度,这也对低pH值环境起到了缓冲作用,削弱了低pH值对菌体的杀伤作用,提高菌体存活率。
2.3 浮游态及被膜态菌体耐胆盐能力比较
本研究采用0.2 g/100 m L胆盐处理菌株L-ZS9 0.5 h,结果如图3所示,浮游态菌体经处理后存活率约为28%,被膜态菌体经处理后存活率约为54%,比浮游态菌体上升约一倍。
胆盐胁迫对细菌最直接的危害是破坏细胞膜。低浓度的胆盐能够改变细胞膜的通透性和流动性,引起一些膜镶嵌酶类的失活和跨膜转运子的功能紊乱[19],此外还能改变细胞表面疏水性和电势等表面特性。高浓度的胆盐可以迅速解离细胞质膜和膜蛋白,造成细胞质组分外泄,导致菌体死亡。胆盐侵入菌体后,能造成DNA损伤、引发RNA形成异常二级结构、诱使蛋白质错误折叠变性等。胞内的胆盐解离会同时引起低pH值酸胁迫和渗透压失衡的产生[20]。由此可见,生物被膜的结构可以抵御胆盐对细胞膜的破坏作用,从而提高其存活率。与此同时,研究发现胆盐可以促进细菌生物被膜的形成[21-24]。
胆盐胁迫可以促进被膜形成,被膜态可以提高菌体存活率,由此推测,菌体可能通过形成被膜态来抵抗胆盐胁迫。其具体的调控应答机制有待进一步研究。

图3 浮游态和被膜态L-ZS9耐胆盐能力比较
Fig. 3 Survival rates of p lanktonic and biofi lm cells of L-ZS9 under bile salt treatment
2.4 浮游态及被膜态菌体基因转录水平比较

图4 浮游态和被膜态L-ZS9基因转录水平比较
Fig. 4 Comparison of genes transcription in planktonic and biofi lm cells of L-ZS9
菌株L-ZS9浮游态及被膜态的胁迫相关基因转录水平结果如图4所示,被膜态基因atpβ、atpε、clp、pspC、ccpA的mRNA转录水平均高于浮游态。其中,atpβ、atpε是atp操纵子中亚基的编码基因。乳酸菌抵御酸胁迫的一个重要机制为依靠三磷酸腺苷(adenosine triphosphate,ATP)输出质子从而维持胞内外pH值平衡。F1F0-ATPase在细菌中普遍存在,既能够通过利用质子来合成ATP,又能利用ATP水解提供的能量将质子运送出细胞。乳酸菌在低pH值环境中,F1F0-ATPase水解ATP运送质子的活性升高,这对于维持胞内外pH值梯度非常重要[25-26]。本研究表明在酸胁迫环境下,被膜态的F1F0-ATPase可能具有更高的活性,从而更好地维持pH值梯度,有利于菌体的存活。clp为分子伴侣蛋白编码基因,参与菌体胁迫环境下多种蛋白质的组装与折叠。CcpA为一般代谢调控蛋白,PspC为一般压力蛋白,在菌体抵抗外界环境压力过程中发挥作用。luxS基因为群体感应系统信号分子AI-2的关键合成基因[27],其表达量与AI-2的合成量密切相关。AI-2参与调节细菌生物被膜的形成,同时参与其他诸多生理行为[28-32]。菌株L-ZS9被膜态的基因转录水平均高于浮游态,可推测生物被膜不仅可以为菌体提供结构上的物理保护作用,其细胞个体也通过调控多种基因的表达从而激活抗胁迫机制,其具体分子机制有待进一步研究。
2.5 浮游态及被膜态菌体上清液AI-2活性比较

图5 L-ZS9浮游态与被膜态上清液中AI-2的活性比较
Fig. 5 Com parison of AI-2 activity in supernatants of p lanktonic and biofi lm cells of L-ZS9
由图5可知,菌株L-ZS9被膜态上清液中的A I-2活性显著高于浮游态。有研究发现在细胞数量相同的前提下,聚集态细菌比非聚集态细菌表现出更强的群体感应,这可能是由于聚集态菌体的细胞与细胞间交流的距离更短[33]。微生物作为简单细胞,无法从复杂的环境中分辨出清楚特定的信息,只能通过它们周围的信号分子来识别环境的改变。但是,它们也有自己的防御机制。微生物细胞通过形成生物被膜来抵御外界环境的胁迫。因此,菌体细胞倾向于聚集地生长,形成细胞聚集体,从而比单细胞状态时更好地抵御环境的变化[33]。
前期研究表明,外源AI-2可以促进菌株L-ZS9生物被膜的形成[14]。本研究发现被膜态的L-ZS9上清液中具有更强的AI-2活性。根据以上结果可推测,菌株L-ZS9的信号分子AI-2与生物被膜两者之间存在互相促进的正反馈调控关系,具体的调控机制有待进一步研究。
2.6 信号分子AI-2对类植物乳杆菌L-ZS9胁迫相关基因的影响
上述研究发现被膜态菌株L-ZS9比浮游态具有更强的耐热、耐酸和耐胆盐能力,且被膜态菌体细胞中胁迫相关基因atpβ、atpε、clp、pspC、ccpA及群体感应关键基因luxS的转录水平均高于浮游态菌体。而被膜态菌体上清液中的信号分子A I-2浓度更高。结合前期研究AI-2可促进菌株L-ZS9生物被膜的形成。本研究就外源AI-2对胁迫相关基因及luxS转录水平进行了测定。结果如图6所示,外源信号分子AI-2可以上调基因atpε、clp、ccpA、luxS的转录水平,其中atpε上调高达约140 倍,clp上调高达约145 倍,ccpA、luxS则分别上调约3.8 倍和4.4 倍。AI-2下调基因atpβ的表达约至0.07。而外源AI-2对pspC基因的转录水平没有显著影响。以上结果表明,信号分子AI-2可以直接调节胁迫相关基因atpβ、atpε、clp、ccpA的转录水平,从而影响菌株L-ZS9的抗胁迫能力。而AI-2作为自诱导物,可以促进luxS基因的表达,进一步正反馈促进AI-2合成和分泌,从而增强抗胁迫和生物被膜形成能力。关于信号分子AI-2对益生乳杆菌抗胁迫能力及被膜形成能力的调控机制有待进一步深入研究。

图6 信号分子AI-2对L-ZS9胁迫相关基因转录水平的影响
Fig. 6 Effect of AI-2 on the transcriptional levels of stress resistancerelated genes
细菌有2 种生存状态:自由漂浮的悬浮态和形成克隆的被膜态。随着对生物被膜的深入研究,其重要性渐渐被认识到[34]。生物被膜可保护细菌免受外界环境的胁迫。关于在病原微生物和有害微生物的相关研究非常多,大多集中在如何清除其生物被膜。虽然关于益生菌生物被膜的相关研究起步较晚,但已有研究表明一些益生菌的生物被膜具有重要的研究意义和应用价值。例如,Lactobacillus spp.的被膜形成能力可以促进菌株在宿主黏膜表面的黏附,以及延长其存留时间,避免病原微生物的定植[35]。在过去数年中,科研人员对乳杆菌在非生物材料(玻璃或聚苯乙烯)表面形成生物被膜的能力进行了研究。但研究表明只有部分菌株具备这种能力[35-40]。本实验室前期研究表明类植物乳杆菌L-ZS9可以在聚苯乙烯材料表面形成生物,且其被膜态菌体的黏附能力更强[14]。有研究表明L. plantarum subsp. plantarum JCM 1149可以在玻璃表面上形成生物被膜,与其浮游态菌体相比,被膜态菌体可以更好地耐受乙酸和乙醇[11]。还有研究发现L. reuteri的被膜形成能力与免疫激活作用有关[13]。本研究首次报道类植物乳杆菌的被膜态也具有浮游态不具有的优势,丰富了相关研究数据。
自益生菌的益生功效被发现以来,其开发和应用发展迅速,主要经过4 个阶段[41]。第1代益生菌产品主要应用于乳制品领域,包括酸奶或牛奶等。它们为不经包被处理的菌株,以浮游态或冷冻干燥状态存在。第2代益生菌产品为药用胶囊包被的冷冻干燥菌体,膜衣材料常为聚合材料、合成、半合成或天然制药赋形剂[42-43]。第3代益生菌产品为荚膜包被或微胶囊制备的菌剂[44-45]。就在近几年时间内,第4代益生菌产品研发正在兴起,其主要创新就在于被膜态益生菌的制备和微胶囊技术的升级[41]。在此大背景下,本研究就类植物乳杆菌被膜态与浮游态的抗逆性进行了研究,并初步发现群体感应信号分子AI-2与被膜形成有关,为后续研究的开展提供了基础。
本研究发现,类植物乳杆菌L-ZS9的被膜态比浮游态细胞具有更强的耐热、耐酸和耐胆盐的抗胁迫能力。被膜态菌体抗胁迫相关基因atpβ、atpε、clp、pspC、ccpA以及群体感应信号分子AI-2合成关键基因luxS的转录水平均显著高于浮游态细胞,表明生物被膜除了结构上的物理保护作用外,其个体细胞的转录水平也发生了改变。群体感应信号分子AI-2活性检测实验发现,被膜态上清液中的AI-2比浮游态上清液中具有更强的活性,表明群体感应系统在菌株L-ZS9生物被膜的形成与调控中发挥重要作用。以上研究为开发高活力益生菌制剂提供了新思路,并为进一步研究益生菌生物被膜的功能与调控提供了重要信息。
参考文献:
[1] KOBYLIAK N, CONTE C, CAMMAROTA G, et al. Probiotics in prevention and treatment of obesity: a critical view[J]. Nutrition and Metabolism (Lond), 2016, 13(1): 1-13. DOI:10.1186/ s12986-016-0067-0.
[2] DISTRUTTI E, MONALDI L, RICCI P, et al. Gut m icrobiota role in irritable bowel syndrome: new therapeutic strategies[J]. World Journal of Gastroenterology, 2016, 22(7): 2219-2241. DOI:10.3748/w jg.v22.i7.2219.
[3] SANDERS M E, GUARNER F, GUERRANT R, et al. An update on the use and investigation of probiotics in health and disease[J]. Gut,2013, 62(5): 787-796. DOI:10.1136/gutjnl-2012-302504.
[4] MADUREIRA A R, AMORIM M, GOMES A M, et al. Protective effect of whey cheese matrix on probiotic strains exposed to simulated gastrointestinal conditions[J]. Food Research International, 2011,44(1): 465-470. DOI:10.1016/j.foodres.2010.09.010.
[5] 曲微, 范俊华, 霍贵成. 益生菌喷雾干燥技术的研究进展[J]. 中国乳业,2008(4): 36-28.
[6] CONWAY P L, GORBACH S L, GOLDIN B R. Survival of lactic acid bacteria in the human stomach and adhesion to intestinal cells[J].Journal of Dairy Science, 1987, 70(1): 1-12. DOI:10.3168/jds.S0022-0302(87)79974-3.
[7] RUIZ L, MARGOLLES A, SÁNCHEZ B. Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J]. Frontiers in M icrobiology,2013, 4: 396. DOI:10.3389/fm icb.2013.00396.
[8] DAS T, KUTTY S K, TAVALLAIE R, et al. Phenazine virulence factor binding to extracellular DNA is important for Pseudomonas aeruginosa biofilm formation[J]. Scientific Reports, 2015, 5: 8398.DOI:10.1038/srep08398.
[9] MARGUERETTAZ M, DIEPPOIS G, QUE Y A, et al. Sputum containing zinc enhances carbapenem resistance, biofilm formation and virulence of Pseudomonas aeruginosa[J]. M icrobial Pathogenesis,2014, 77: 36-41. DOI:10.1016/j.m icpath.2014.10.011.
[10] BLACKLEDGE M S, WORTHINGTON R J, MELANDER C.Biologically inspired strategies for combating bacterial biofilms[J].Curren t Op inion in Pharm aco logy, 2013, 13(5): 699-706.DOI:10.1016/j.coph.2013.07.004.
[11] CHEOW W S, K IEW T Y, HADINOTO K. Controlled release of Lactobacillus rhamnosus biofi lm probiotics from alginate-locust bean gum m icrocapsules[J]. Carbohydrate Polymers, 2014, 103: 587-595.DOI:10.1016/j.carbpol.2014.01.036.
[12] WANG Y, SUN Y, ZHANG X, et al. Bacteriocin-producing probiotics enhance the safety and functionality of sturgeon sausage[J]. Food Control, 2015, 50: 725-735. DOI:10.1016/j.foodcont.2014.09.045.
[13] ZHANG X, WANG Y, LIU L, et al. Two-peptide bacteriocin PlnEF causes cell membrane damage to Lactobacillus plantarum[J].Biochim ica et Biophysica Acta, 2016, 1858(2): 274-280. DOI:10.1016/j.bbamem.2015.11.018.
[14] 刘蕾, 武瑞赟, 李军, 等. 类植物乳杆菌L-ZS9生物被膜态的黏附能力及形成影响因素[J]. 食品科学, 2016, 27(15): 136-143.DOI:10.7506/spkx1002-6630-201615023.
[15] CHRISTENSEN G D, SIMPSON W A, YOUNGER J J, et al.Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices[J]. Journal of Clinical M icrobiology, 1985, 22(6):996-1006.
[16] LIVAK K J, SCHM ITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001, 25(4): 402-408.
[17] TEIXEIRA P, CASTRO H, MOHÁCSI-FARKAS C, et al.Identification of sites of injury in Lactobacillus bulgaricus during heat stress[J]. Journal of Applied M icrobiol ogy, 1997, 83(2): 219-226.
[18] COTTER P D, HILL C. Surviving the acid test: responses of grampositive bacteria to low pH[J]. M icrobiology and Molecular Biology Rev iews, 2003, 67(3): 429-453.
[19] NOH D O, GILLILAND S E. Influence of bile on cellular integrity and beta-galactosidase activity of Lactobacillus acidophilus[J]. Journal of Dairy Sci ence, 1993, 76(5): 1253-1259. DOI:10.3168/jds.S0022-0302(93)77454-8.
[20] 安浩然. 长双歧杆菌BBMN68抗胆盐胁迫反应机制及双组分系统在胆盐胁迫应答中的作用[D]. 北京: 中国农业大学, 2014: 17.
[21] AMBALAM P, KONDEPUDI K K, NILSSON I, et al. Bile enhances cell surface hydrophobicity and biofi lm formation of bifidobacteria[J].Applied Biochem istry and Biotechnol ogy, 2014, 172(4): 1970-1981.DOI:10.1007/s12010-013-0596-1.
[22] AMBALAM P, KONDEPUDI K K, NILSSON I, et al. Bile stimulates cell surface hydrophobicity, Congo red binding and biofi lm formation of Lactobacillus strains[J]. FEMS M icrobiology Letters, 2012, 333(1):10-19. DOI:10.1111/j.1574-6968.2012.02590.x.
[23] PUMBWE L, SK ILBECK C A, NAKANO V, et al. Bile salts enhance bacterial co-aggregation, bacterial-intestinal epithelial cell adhesion, biofilm formation and antim icrobial resistance of Bacteroides fragilis[J]. M icrobial Pathogogenesis, 2007, 43(2/3): 78-87. DOI:10.1016/j.m icpath.2007.04.002.
[24] HUNG D T, ZHU J, STURTEVANT D, et al. Bile acids stimulate biofilm formation in Vibrio cholerae[J]. M olecular M icrobiol ogy,2006, 59(1): 193-201. DOI:10.1111/j.1365-2958. 2005. 04846.x.
[25] GUCHTE M V D, SERROR P, CHERVAUX C, et al. Stress response in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002,82(1/2/3/4): 187-216.
[26] MATSUMOTO M, OHISHI H, BENNO Y. H+-ATPase activity in Bifidobacterium w ith special reference to acid tolerance[J].International Journal of Food M icrobiol ogy, 2004, 93(1): 109-113.DOI:10.1016/j.ijfoodmicro.2003.10.009.
[27] SCHAUDER S, SHOKAT K, SURETTE M G, et al. The LuxS fam ily of bacterial autoinducers: biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular M icrobiol ogy, 2001, 41(2): 463-476.
[28] DAVIES D G , PARSEK M R , PEARSON J P, et al . The involvement of cell-to-cell signals in the development of a bacterial biofi lm[J]. Science,1998, 280: 295-298. DOI:10.1126/ science.280.5361.295.
[29] DERZELLE S, DUCHAUD E, KUNST F, et al. Identification,characterization, and regulation of a cluster of genes involved in carbapenem biosynthesis in Photorhabdus luminescens[J]. Applied and Environmental M icrobiology, 2002, 68(8): 3780-3789. DOI:10.1128/AEM.68.8.3780-3789.2002.
[30] M ILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of M icrobiology, 2001, 55: 165-199. DOI:10.1146/annurev.micro.55.1.165.
[31] M ILLER M B, SKORUPSKI K, LENZ D H, et al. Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae[J].Cell, 2002, 110(3): 303-314. DOI:10.1016/S0092-867 4(02)00829-2.
[32] MORRISON D A, LEE M S. Regulation of competence for genetic transformation in Streptococcus pneumoniae: a link between quorum sensing and DNA processing genes[J]. Research in M icrobiology,2000, 151(6): 445-451. DOI:10.1016/S0923-2508(00)00171-6.
[33] GAO M, ZHENG H, REN Y, et al. A crucial role for spatial distribution in bacterial quorum sensing[J]. Scientific Reports, 2016, 6:34695. DOI:10.1038/srep34695.
[34] PROBERT H M, GIBSON G R. Bacterial biofilms in the human gastrointestinal tract[J]. Current Issues in Intestinal M icrobiology,2002, 3(2): 23-27.
[35] TERRAF M C, JUAREZ T M, NADER-MACIAS M E, et al.Screening of biofilm formation by beneficial vaginal lactobacilli and influence of culture media components[J]. Journal of App lied M icrobiology, 2012, 113(6): 1517-1529. DOI:10.1111/j.1365-2672.2012.05429.x.
[36] LEBEER S, VERHOEVEN T L, PEREA V M, et al. Im pact of environmental and genetic factors on biofi lm formation by the probiotic strain Lactobacillus rhamnosus GG[J]. Applied and Environmental M icrobiolology, 2007, 73(21): 6768-6775. DOI:10.1128/AEM.01393-07.
[37] BUJNAKOVA D, KMET V. Functional properties of Lactobacillus strains isolated from dairy products[J]. Folia M icrobiologica (Praha),2012, 57(4): 263-267. DOI:10.1007/s12223-012-0121-x.
[38] KUBOTA H, SENDA S, NOMURA N, et al. Biofilm formation by lactic acid bacteria and resistance to environmental stress[J]. Journal of Bioscience and Bioengineering, 2008, 106(4): 381-386. DOI:10.1263/jbb.106.381.
[39] KUBOTA H, SENDA S, TOKUDA H, et al. Stress resistance of biofi lm and planktonic Lactobacillus plantarum subsp. plantarum JCM 1149[J]. Food M icrobiology, 2009, 26(6): 592-597. DOI:10.1016/j.fm.2009.04.001.
[40] JONES S E, VERSALOV IC J. Probiotic Lactobacillus reuteri biofi lms produce antim icrobial and anti-inflammatory factors[J]. BMC M icrobiology, 2009, 9: 35. DOI:10.1186/1471-2180-9-35.
[41] SALAS-JARA M J, ILABACA A, VEGA M, et al. Biofilm form ing lactobacillus: new challenges for the development of probiotics[J]. M icroorganism s, 2016, 4(3): 35. DOI:10.3390/m icroorganisms4030035.
[42] ZARATE G, TOMAS M S, NADER-MACIAS M E. Effect of some pharmaceutical excipients on the survival of probiotic vaginal lactobacilli[J]. Canadian Journal of M icrobiology, 2005, 51(6): 483-489. DOI:10.1139/w05-031.
[43] KLAYRAUNG S, V IERNSTEIN H, OKONOGI S. Development o f tab lets containing p robiotics: effects o f form u lation and p rocessing parameters on bacterial viability[J]. International Journal of Pharmaceutics, 2009, 370(1/2): 54-60. DOI:10.1016/j.ijpharm.2008.11.004.
[44] DE VOS P, FASS M, SPASOJEVIC M, SIKKEMA J. Encapsulation for preservation of functionality and targeteddelivery of bioactive food components[J]. International Dairy Journal, 2010, 20: 292-302.DOI:10.1016/j.idairyj.2009.11.008.
[45] BURGA IN J, GA IANI C, LINDER M, et al. Encapsu lation of probiotic living cells: from laboratory scale toindustrial applications[J].Journal of Food Engineering, 2011, 104: 467-493. DOI:10.1016/j.jfoodeng.2010.12.031.
Stress Resistance of Biofi lm and Planktonic Cells of Lactobacillus paraplantarum L-ZS9 Regulated by Autoinducer 2
LIU Lei1, WU Ruiyun2, LI Jun1, LI Pinglan1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. College of Life Sciences, Inner Mongolia University, Hohhot 010021, China)
Abstract:The present study compared the heat, acid and bile resistance of biofi lm and planktonic cells of L-ZS9 by colony counting method. The results showed that biofilm cells had stronger stress resistance than their planktonic counterpart.The transcriptional levels of the stress resistance-related genes atpβ, atpε, clp, pspC and ccpA and the luxS gene encoding the quorum sensing signal autoinducer 2 (AI-2) synthase were investigated in biofi lm and planktonic cells through realtime PCR. The results showed that the transcriptional levels of these genes were up-regulated in biofi lm cells compared to planktonic cells. AI-2 activity were measured by its ability to induce lum inescence in the reporter strain Vibrio harveyi BB170 and the results showed that the supernatant of biofi lm cells had higher AI-2 activity than planktonic cells. Exogenous AI-2 could regulate the transcriptional levels of the atpβ, atpε, clp, ccpA and luxS genes. This study suggested that biofi lm protected the cells by physical defense and biofi lm cells differed from planktonic cells in terms of the transcriptional levels of the investigated genes. The quorum sensing system played an important role in the formation and regulation of biofi lm.This work has laid a foundation for producing functional foods based on biofi lm probiotics w ith high activity.
Key words:Lactobacillus paraplantarum L-ZS9; biofi lm; stress resistance; signal AI-2; transcription
DOI:10.7506/spkx1002-6630-201722007
中图分类号:Q939.99
文献标志码:A
文章编号:1002-6630(2017)22-0041-07
引文格式:
刘蕾, 武瑞赟, 李军, 等. 基于AI-2介导的类植物乳杆菌生物被膜态与浮游态抗胁迫能力比较与分析[J]. 食品科学,2017, 38(22): 41-47. DOI:10.7506/spkx1002-6630-201722007. http://www.spkx.net.cn
LIU Lei, WU Ruiyun, LI Jun, et al. Stress resistance of biofilm and planktonic cells of Lactobacillus paraplantarum L-ZS9 regulated by autoinducer 2[J]. Food Science, 2017, 38(22): 41-47. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722007. http://www.spkx.net.cn
收稿日期:2017-01-18
基金项目:国家自然科学基金面上项目(31671831;31471707);北京市鲟鱼、鲑鳟鱼创新团队项目(SCGWZJ201711)
作者简介:刘蕾(1988—),女,博士研究生,研究方向为食品微生物。E-mail:liulei0606@gmail.com
*通信作者:李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn