不同反应条件对勐库大叶种多酚氧化酶合成茶黄素的影响
黄莹捷,伍梦瑶,姚燕妮,黄友谊*
(园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院茶学系,湖北 武汉 430000)
摘 要:研究不同因素对勐库大叶种多酚氧化酶催化合成茶黄素的影响,结果表明在pH 4.0、37 ℃、茶多酚质量浓度为4.5 mg/m L的条件下,勐库大叶种多酚氧化酶催化1.0 h,最有利于茶黄素的合成,其总产量可达(461.12±15.01)μg/m L,转化率为(15.31±0.40)%。勐库大叶种多酚氧化酶对酯型儿茶素催化活性更强,催化合成酯型茶黄素为主,在催化过程中还伴随着表没食子儿茶素和没食子酸的生成,有利于茶黄素的合成积累,这可能与滇红优异品质形成有关。
关键词:勐库大叶种;多酚氧化酶;茶黄素;儿茶素
茶黄素类化合物(theaflavins,TFs)虽仅占红茶总固形物的1%~5%,却是红茶重要的品质成分[1]。TFs还具抗氧化[2]、抗癌[3]、抑制血糖升高[4]、延缓糖尿病[5]等多种保健功能,被誉为茶叶中的“软黄金”。因提取红茶中的TFs成本高,以多酚氧化酶(po lypheno l oxidase,PPO)体外氧化制备TFs是实现其规模化生产的有效途径。吴红梅[6]比较了茶叶、梨等不同来源PPO制取TFs的效果,龚志华[7]研究了不同茶树品种PPO对体外酶促合成TFs的效果,谷记平[8]、鲜殊[9]、周洁[10]等对苹云、安徽七号、福鼎大白的PPO粗酶体外酶促合成TFs的条件进行了优化,此外还有利用香蕉[11]、山药[12]、毛栓菌[13]以及菌菇[14]等植物或微生物的PPO粗酶制备TFs。已有研究结果表明,以茶源PPO合成TFs的效果最佳[6],而TFs产量及其各单体比例因茶树品种不同而异[7]。云南大叶种生产的滇红在国内品质最好,TFs含量高,然而却缺乏云南大叶种PPO的相关研究。为此选用云南大叶种的代表性品种勐库大叶种为材料,以成本远低于儿茶素单体的茶多酚提取物为底物,分析不同条件对其PPO合成TFs的影响,为阐明滇红品质形成机理和规模化制备TFs奠定基础。
1 材料与方法
1.1 材料与试剂
春夏季于华中农业大学茶园基地采摘勐库大叶种一芽二叶,于-80 ℃超低温冰箱保存。
聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、磷酸氢二钠、柠檬酸、邻苯二酚、乙二胺四乙酸二钠、冰醋酸等(均为分析纯) 国药集团化学试剂有限公司;甲醇、乙腈(均为色谱纯) 美国Fisher公司;反应底物茶多酚 上海源叶生物科技有限公司,其组成如表1所示。
表1 茶多酚中儿茶素组分及酚酸的含量
Tab le 1 Contents of catechins components and phenolic acids in tea polyphenols%

注:GA.没食子酸(gallic acid);GC.没食子儿茶素(gallocatechin);EGC.表没食子儿茶素(epigallocatechin);C.儿茶素(catechin);EGCG.表没食子儿茶素没食子酸酯(epigallocatechin gallate); EC.表儿茶素(epicatechin);GCG.没食子儿茶素没食子酸酯(gallocatechin gallate);ECG.表儿茶素没食子酸酯(epicatechin gallate);CG.儿茶素没食子酸酯(catechin gallate)。下同。
组分 GA GC EGC C EGCG EC GCG ECG CG 总含量质量分数 0.43±0.01 1.04±0.05 7.98±0.08 1.09±0.1740.00±0.68 4.67±0.18 1.48±0.01 10.48±0.23 0.18±0.01 67.36±0.72
1.2 仪器与设备
FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;HH-2数显恒温水浴锅 金坛市富华仪器有限公司;Synergy HT多功能酶标仪 基因科技(上海)股份有限公司;M ach 1.6R高速冷冻离心机 武汉赤诚生物技术有限公司;TS-200B恒温摇床 上海天呈实验仪器制造有限公司;1260高效液相色谱仪、TC-C18色谱柱(250 mm×4.60 mm,0.45 μm) 美国Agilent公司。
1.3 方法
1.3.1 PPO的提取与活性测定
取勐库大叶种一芽二叶20 g,按料液比1∶3(g/m L)加入预冷的柠檬酸-磷酸缓冲液(0.1 m o l/L,pH 7.2)、5 g/100 m L PVP、适量海砂,冰浴研磨,4 ℃浸提12 h后,4 ℃、9 000 r/m in离心35 m in,过滤,滤液即为勐库大叶种PPO粗酶(简称为勐库大叶种PPO)。
PPO活性的测定方法采用改进黄意欢[15]的方法:取10 μL酶液,加入50 μL柠檬酸-磷酸缓冲液(0.1 mol/L,pH 5.6)、75 μL底物混合液(V(0.1 mo l/L,pH 5.6柠檬酸-磷酸缓冲液)∶V(0.1 g/100 m L脯氨酸)∶V(1 g/100 m L邻苯二酚)=10∶2∶3,现配现用),于37 ℃水浴反应30 m in,立即加入50 μL尿素(6 m o l/L),于多功能酶标仪410 nm波长处测定吸光度。空白对照的待测样品以失活酶液代替。在本实验测定条件下,以邻苯二酚反应液的吸光度每分钟增加0.001定义为1个酶活力单位(U)。以柠檬酸-磷酸缓冲液(0.1 mol/L,pH 7.2)稀释勐库大叶种PPO至酶活力单位为1 500 U/m L(实测为(1 497.78±24.57)U/m L),用于催化合成TFs实验。
1.3.2 pH值对TFs合成的影响
配制pH值为3.6、4.0、4.4、4.8、5.2、5.6、6.0、6.4系列柠檬酸-磷酸缓冲液(0.1 m o l/L)。取30 μL酶液于5 m L加盖离心管中,加入270 μL反应液(V(0.1 mol/L柠檬酸-磷酸缓冲液)∶V(60 mg/m L茶多酚)=26∶1,现配现用),使反应终体系底物质量浓度为2 mg/m L。将Sharma等[16]TFs合成方法进行改进,具体方法如下:37 ℃、130 r/m in摇床振荡反应1 h,立即沸水浴5 m in终止反应,以2 400 r/m in离心5 m in,0.45 μm微孔滤膜过滤于2 m L进样瓶,于-80 ℃保存待测。空白对照的待测样品以失活酶液代替。
1.3.3 反应温度对TFs合成的影响
以1.3.2节获得的最适pH值配制反应液,设置反应温度为20、30、35、37、40、50 ℃,摇床预热30 m in后开始酶促反应,其他处理同1.3.2节,比较反应温度对勐库大叶种PPO合成TFs的影响。
1.3.4 底物质量浓度对TFs合成的影响
以1.3.2节获得的最适pH值分别配制不同底物质量浓度的反应液,使反应体系的茶多酚终质量浓度分别为1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/m L。在1.3.3节确定的最适反应温度条件下进行酶促反应,其他处理同1.3.2节。
1.3.5 反应时间对TFs合成的影响
根据上述实验结果,在最适pH值、最适温度以及最适底物质量浓度条件下,酶促反应时间分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h,其他处理同1.3.2节。0 h实验样品以沸水浴10 m in灭活酶样代替,其他处理相同。
1.3.6 TFs含量的测定
参照GB/T 30483—2013《茶叶中茶黄素的测定 高效液相色谱法》[17],以高效液相色谱(h igh performance liquid chromatography,HPLC)法测定TFs含量。流动相A为90 m L乙腈,20 m L冰乙酸,2 m L(10 m g/m L)乙二胺四乙酸二钠,超纯水定容至1 L。流动相B为800 m L乙腈,20 m L冰乙酸,2 m L(10 mg/m L)乙二胺四乙酸二钠,超纯水定容至1 L。使用TC-C18色谱柱进行TFs的HPLC分析,流动相A、B梯度洗脱,洗脱梯度见表2,流速0.7 m L/m in,柱温35 ℃,278 nm波长检测,进样量5 μL。
表2 茶黄素HPLC洗脱梯度
Tab le 2 HPLC elution gradients for theafl avins
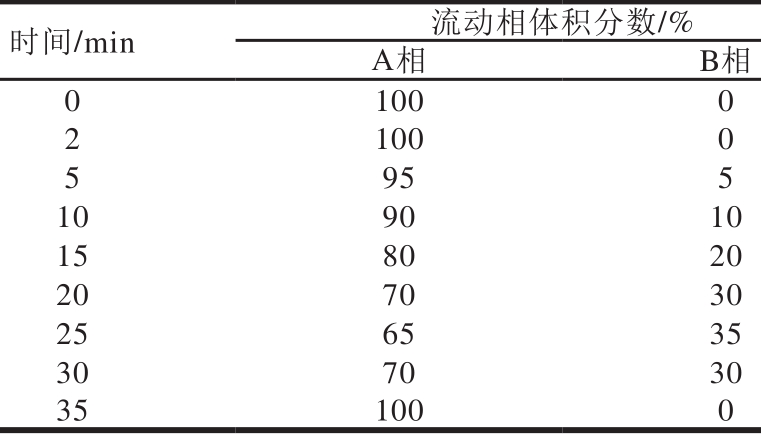
注:A相. 90 m L乙腈、20 m L冰乙酸、2 m L(10 mg/m L)乙二胺四乙酸二钠,超纯水定容至1 L;B相. 800 m L乙腈、20 m L冰乙酸、2 m L(10 mg/m L)乙二胺四乙酸二钠,超纯水定容至1 L。
时间/m in 流动相体积分数/%A相 B相0 100 0 2 100 0 5 95 5 10 90 10 15 80 20 20 70 30 25 65 35 30 70 30 35 100 0
1.3.7 儿茶素含量的测定
采用HPLC法检测儿茶素,色谱柱为TC-C18色谱柱,流动相A为0.1%甲酸溶液(溶剂为超纯水),流动相B为0.1%甲酸(溶剂为甲醇)。流动相A、B梯度洗脱,具体洗脱梯度见表3,流速1.0 m L/m in,柱温35 ℃,检测波长278 nm,进样量5 μL。
表3 儿茶素HPLC洗脱梯度
Table 3 HPLC elution gradients for catechins

注:A相. 0.1%甲酸溶液(溶剂为超纯水);B相. 0.1%甲酸(溶剂为甲醇)。
时间/m in 流动相体积分数/%A相 B相0 80 20 2 75 25 6 70 30 10 75 25 13 70 30 20 70 30 23 75 25 25 80 20 30 80 20
1.3.8 合成TFs最优条件的验证实验
对以上单因素试验中所得的最优条件进行3次验证实验,验证所得结果的稳定性和准确性,并计算TFs的转化率,公式如下:
1.4 数据处理
数据均采用Excel 2003和统计软件SAS软件包进行方差分析和显著性比较。所有数据均以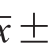 s(2 次重复)表示。
s(2 次重复)表示。
2 结果与分析
2.1 pH值对勐库大叶种PPO合成TFs的影响
由图1可知,以茶多酚为底物,在不同p H值条件下,勐库大叶种PPO催化合成的TFs以及4 种TFs单体具有相同的变化趋势,且其中以酯型茶黄素为主,茶黄素-3,3’-双没食子酸酯(theaflavin-3,3’-gallate,TFDG)的产量最高,茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)次之,茶黄素-3’-没食子酸酯(theaflavin-3’-gallate,TF-3’-G)与茶黄素(theaflavin,TF)的合成量较为接近。pH值低于或高于4.0,勐库大叶种PPO催化合成的TFs产量均较低;尤其是在pH 5.6~6.4之间,催化后的TFs含量极低甚至检测不出,表明勐库大叶种PPO的TFs合成能力在pH更为偏酸的条件下较强。由此可见,勐库大叶种PPO合成TFs的最适pH值为4.0,这与福鼎大白鲜叶匀浆悬浮发酵体系在pH 4.0条件下的TFs产量最高的结果一致[18],但低于苹云(pH 4.8)[8]、福鼎大白(pH 5.0)[10]以及政和大白(pH 5.2)[19]等茶树品种的PPO粗酶,这可能与茶树品种、提取方法、缓冲液体系等因素有关[20]。
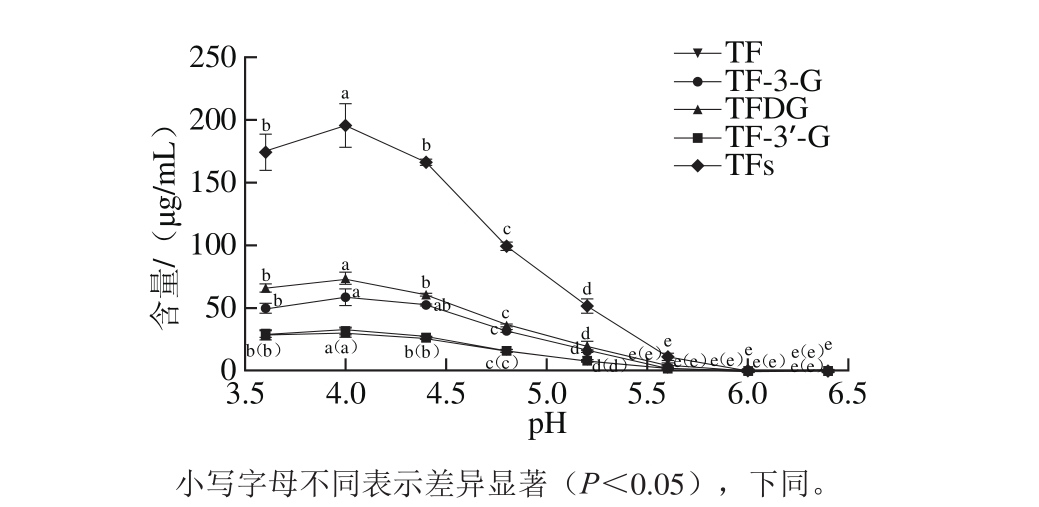
图1 pH值对勐库大叶种PPO合成茶黄素含量的影响
Fig. 1 Effect of pH on the synthesis of theafl avins
2.2 反应温度对勐库大叶种PPO合成TFs的影响
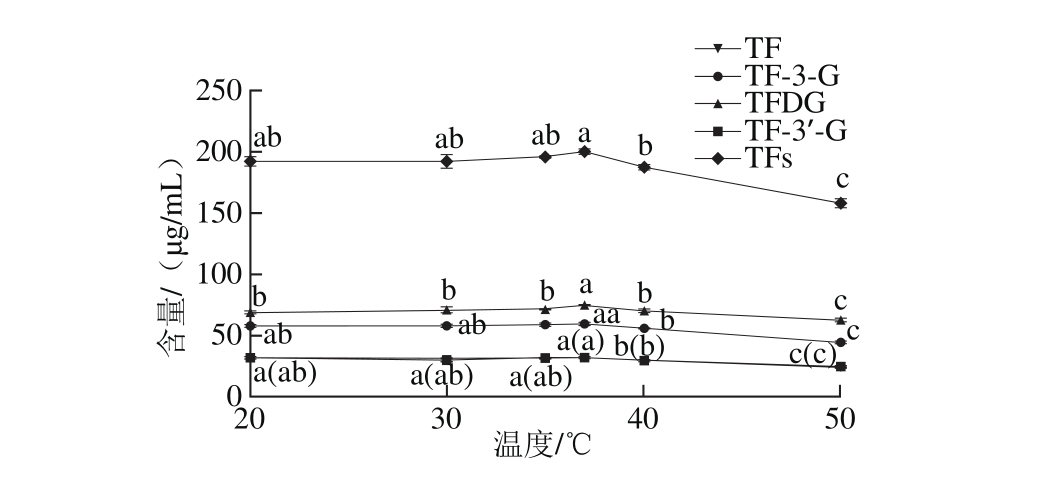
图2 反应温度对勐库大叶种PPO合成茶黄素含量的影响
Fig. 2 The theaflavins content synthesized by C. sinensis var. assamica cv. M engku crude PPO under different tem peratures
由图2可知,在20~37 ℃范围内,虽然勐库大叶种PPO合成的TFs及其各组分含量缓慢增加,但TFs以及TF、TF-3-G、TF-3’-G各自产量间没有显著差异,而TFDG在37 ℃产量最多,且与20、30、35 ℃条件下的合成量差异显著(P<0.05)。当反应温度超过37 ℃时,TFs及其各单体含量开始逐步降低。由此可见,勐库大叶种PPO在30~40 ℃之间均具有较强的TFs合成能力,与苹云(30 ℃)[8]、政和大白(35 ℃)[19]的茶树PPO粗酶液催化合成TFs的最适温度接近。但综合考虑TFs和TFDG产量,勐库大叶种PPO合成TFs的酶促反应温度以37 ℃为宜。此外,在不同温度条件下,TFs的组成均以酯型茶黄素为主体,非酯型茶黄素含量较低,且其中以TFDG的产量最高,其次为TF-3-G。
2.3 底物质量浓度对勐库大叶种PPO合成TFs的影响
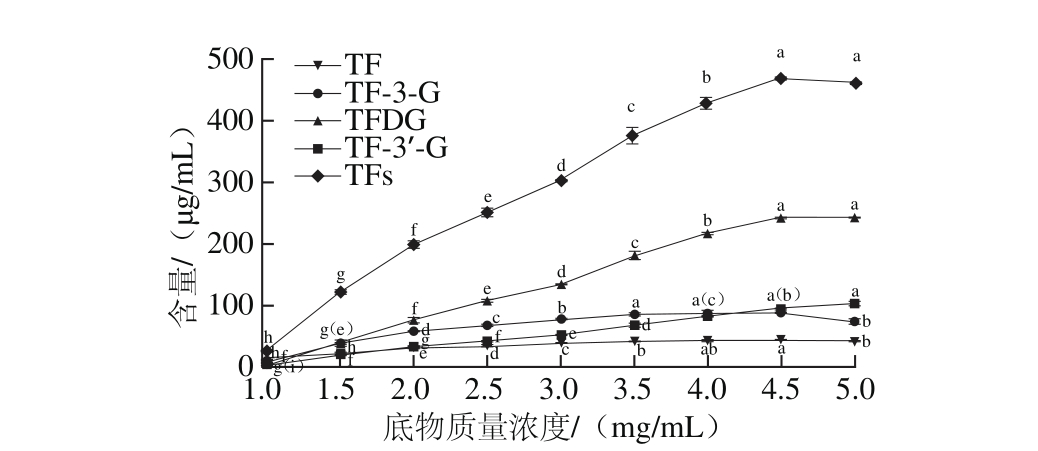
图3 底物质量浓度对勐库大叶种PPO合成茶黄素含量的影响
Fig. 3 Theaflavins content synthesized by C. sinensis var. assam ica cv.M engku crude PPO at different substrate concentrations
由图3可知,随着茶多酚底物质量浓度的提高,勐库大叶种PPO催化产生的TFs总量不断增加,且在底物质量浓度为4.5 mg/m L时达到最大值,之后略有降低。除TF-3’-G合成量随底物质量浓度的升高一直缓慢上升外,其他3 种TFs单体均表现出与TFs相同的变化趋势。但各TFs单体所对应的最适底物质量浓度不同,TF、TF-3-G、TFDG和TF-3’-G分别在底物质量浓度为4.5、3.5~4.5、4.5~5.0、5.0 mg/m L时含量最高。在4 种TFs单体中,TFDG含量最高,而TF的生成量最低,表明勐库大叶种PPO可能具有较强的酯型茶黄素合成能力,且在TFDG合成方面表现的尤为明显。
2.4 反应时间对勐库大叶种PPO合成TFs的影响

图4 反应时间对勐库大叶种PPO合成茶黄素含量的影响
Fig. 4 Theaflavins content synthesized by C. sinensis var. assam ica cv.M engku crude PPO for different periods of reaction time
如图4所示,TFs含量在反应时间1.5 h达到最大值,但与1.0、2.0 h条件下的TFs产量间无显著差异,可见勐库大叶种PPO催化合成TFs的最佳反应时间以1.0 h为宜。在反应1.0 h内是TFs合成的上升期,各单体均快速形成;在1.5~2.5 h,勐库大叶种PPO催化合成TFs进入到稳定阶段,反应混合液中TFs各单体维持较高的含量;随着反应时间延长至4.0 h,TFs及其各单体含量开始下降,且以2.5~3.0 h下降幅度最大,而后下降速度又趋于平缓。
2.5 勐库大叶种PPO催化合成TFs中儿茶素组成的变化及相关性
勐库大叶种PPO催化反应4.0 h过程中,主要儿茶素单体以及没食子酸含量的动态变化如图5所示。由图5A可知,勐库大叶种PPO对EC的催化氧化相对缓慢,反应1.0 h后仍有约75%的EC未被利用;而EGCG、ECG被大量氧化,各仅有近10%和20%的残留。可见勐库大叶种PPO对不同儿茶素单体的选择上具有偏好性,对酯型儿茶素的催化氧化能力明显强于EC,从而使得TFDG成为其合成的TFs中最重要的单体。随着反应的继续进行,EGCG、ECG以及EC仍在缓慢下降。但至2.5 h时,反应混合液中TFs及其各单体含量开始下降(图4),表明此时TFs的降解速度快于合成,向不利于TFs积累的方向推进。与EGCG、EC以及ECG不同,作为合成TFs底物之一的EGC,在反应过程中其含量不但没有因合成TF和TF-3’-G而减少,反而有所增加,且随反应时间呈现出先增加后减少再增加的复杂变化,且在反应1 h后增幅最大,达到60%左右。另外,如图5B所示,GA在勐库大叶种PPO催化反应最初的1.5 h内也大量合成积累,这可能是由于勐库大叶种PPO中含有酯型儿茶素水解酶,催化EGCG、ECG水解,从而导致EGC和GA含量的增加[21];而在PPO催化EGCG氧化过程中,脱没食子化和差向异构化也可使其脱去没食子基,这可能是造成EGC、GA含量增多的另一可能途径[22]。

图5 勐库大叶种PPO催化过程中主要儿茶素单体(A)和没食子酸含量(B)的变化
Fig. 5 Major catechins components (A) and gallic acid contents (B) against time during C. sinensis var. assamica cv. Mengku crude PPO oxidation
表4 儿茶素单体与茶黄素产量的相关性
Tab le 4 Correlation analysis between various catechin monomers and theafl avins yield
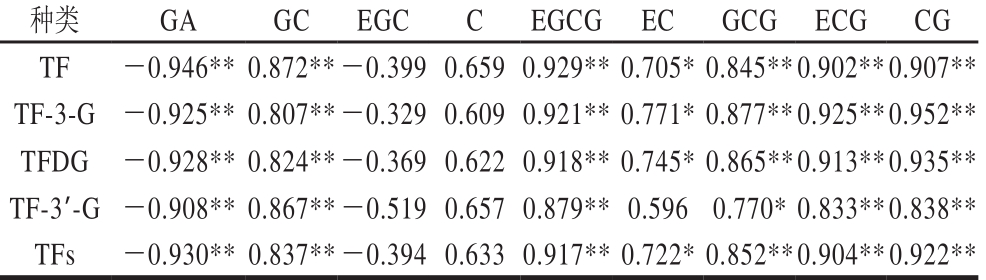
注:*.显著线性相关(P<0.05);**.极显著线性相关(P<0.01)。
种类 GA GC EGC C EGCG EC GCG ECG CG TF -0.946**0.872**-0.399 0.659 0.929**0.705*0.845**0.902**0.907**TF-3-G -0.925**0.807**-0.329 0.609 0.921**0.771*0.877**0.925**0.952**TFDG -0.928**0.824**-0.369 0.622 0.918**0.745*0.865**0.913**0.935**TF-3’-G -0.908**0.867**-0.519 0.657 0.879**0.596 0.770*0.833**0.838**TFs -0.930**0.837**-0.394 0.633 0.917**0.722*0.852**0.904**0.922**
由表4可知,GA的消耗量与TFs及其4 种主要单体产量呈极显著负相关,表明在形成TFs的同时,GA含量有所增多。而GC、EGCG、ECG以及CG的消耗量与TFs及其各单体产量呈极显著正相关。除TF-3’-G外,EC的消耗量与TFs和其他3 种主要TFs单体产量呈显著正相关。GCG的消耗量与TF-3’-G产量呈显著正相关,而与TF、TF-3-G、TFDG以及TFs产量的相关性达到极显著水平。由此可见,GC、EGCG、GCG、ECG以及CG是勐库大叶种PPO合成TFs的主要底物。
2.6 勐库大叶种PPO催化合成茶黄素最优条件的验证
通过单因素试验逐步优化勐库大叶种PPO催化合成TFs的条件,最终确定其最优催化条件为pH 4.0、37 ℃、茶多酚质量浓度为4.5 mg/m L的条件下,催化反应1.0 h。最优条件下进行3 次验证实验,TFs产量分别为468.12、443.89、471.34 μg/m L,变异系数为3.25%,平均值为(461.12±15.01)μg/m L,转化率为(15.31±0.40)%,可见在所获得的最优条件下勐库大叶种PPO催化TFs的效率高、重复性好。
3 讨 论
3.1 TFs合成条件
发酵过程中的温度、pH值、相对湿度以及时间控制在红茶品质形成中发挥至关重要作用,其中TFs的积累、消耗与反应温度密切相关,高温在加速TFs形成的同时使其降解量也随之增多[23-24]。因此,在红茶生产中,发酵温度宜控制在24~28 ℃范围内,叶温30 ℃较好[25]。尽管如此,在红茶发酵过程中由于放热反应导致的叶温升高现象在所难免,叶温会由发酵初期的25 ℃升高至结束时的35 ℃左右[26]。然而,勐库大叶种PPO在25~37 ℃之间的TFs产量间无显著差异,且具有逐渐增强的TFs合成能力,这可能是形成滇红优异品质的一个重要原因。在滇红的发酵过程中,如适当降低发酵温度和适当延长时间,有利于维持较高的TFs、茶红素转化率;另一方面如采用先高温后低温的变温发酵方式,有利于减少后期的TFs降解。然而,应该注意控制红茶总体的发酵时间,如发酵时间过长,会导致TFs降解,直接降低红茶品质。
3.2 TFs合成底物
不同茶树品种PPO在底物的选择性和亲和力方面差异明显[27]。有研究表明,同样适制红茶的秀红[7]在与本研究底物组成比例、反应条件相近时,其PPO有利于催化EC和EGC合成TF。然而,与非酯型儿茶素相比,勐库大叶种PPO可能对EGCG和ECG具有更强的亲和力,而使得其产物中TFDG的含量远高于其他TFs单体。因此,在TFs制备上,利用勐库大叶种PPO开发高纯度的TFDG单体产品具有良好的前景。另外,茶树鲜叶中酯型儿茶素含量高于非酯型儿茶素[28],云南大叶种中酯型儿茶素含量和儿茶素总量均高于一般的茶树品种,而勐库大叶种PPO对酯型儿茶素的高亲和性正好与之相适应,这可能是滇红品质优异的又一个重要原因。但TFs的合成不仅与PPO同工酶组成有关,还受儿茶素含量以及组成的影响[7,29]。由于本实验选用的底物为一种茶多酚提取物,还需对勐库大叶种鲜叶中酯型儿茶素与非酯型儿茶素的比例,滇红发酵过程中TFs单体产量及比例变化,以及其与适制红茶的中小叶种之间的差异进行深入研究。
3.3 TFs合成途径
目前,TFs的合成前体以及合成途径均已较为明确,儿茶素先经酶或非酶氧化形成醌类物质,而后儿茶素邻醌与没食子儿茶素邻醌配对,进行骈环反应从而形成TFs[30-31]。作为合成TFs重要底物的EGC,其氧化电位是各儿茶素单体中最低的,因而极其容易被PPO氧化消耗而合成TFs[32-33]。但不同于以往研究的是,在勐库大叶种PPO催化过程中,EGC含量并不随着TFs的合成而减少,反而增加。EGC不仅是合成TFs的底物,而且有研究表明EGC可有效地阻止TFs的氧化降解[34],从而在TFs积累方面发挥着重要作用。勐库大叶种可能通过这种维持高EGC含量的独特方式,促进滇红发酵过程中TFs的合成与积累,为其优良品质的形成奠定基础。然而EGC形成过程,以及在TFs合成中的作用,还需要进一步研究。
参考文献:
[1] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2011: 30-31.
[2] 陈虎, 胡英, 周睿, 等. 茶黄素的抗氧化机理的研究进展[J]. 茶叶科学, 2005, 25(4): 237-241. DOI:10.13305/j.cnki.jts.2005.04.001.
[3] 江和源, 袁新跃, 王川丕, 等. 茶黄素双没食子酸酯的抗癌活性及其作用机理研究[J]. 茶叶科学, 2007, 27(1): 33-38.DOI:10.3969/j.issn.1000-369X.2007.01.005.
[4] TAKEMOTO M, TAKEMOTO H, SAKURADA A. Synthesis of theaflavins w ith Camellia sinensis cell culture and inhibition of increase in blood sugar values in high-fat diet m ice subjected to sucrose or glucose loading[J]. Tetrahedron Letters, 2014, 55(36):5038-5040. DOI:10.1016/j.tetlet.2014.07.092.
[5] 李彩蓉, 蔡飞, 赵辛元, 等. 茶黄素对糖尿病大鼠肾小球系膜细胞p38丝裂原活化蛋白激酶及细胞外基质合成的影响[J]. 茶叶科学,2009, 29(6): 470-474. DOI:10.13305/j.cnki.jts.2009.06.010.
[6] 吴红梅. 多酚氧化酶酶源筛选及酶法制取茶色素研究[D]. 合肥:安徽农业大学, 2004: 2-32.
[7] 龚志华, 朱盛尧, 陈朵, 等. 不同茶树品种多酚氧化酶体外酶促合成茶黄素研究[C]//湖南省茶叶学会2011年学术年会论文集. 长沙:湖南省茶叶学会, 2011: 110-115.
[8] 谷记平, 刘仲华, 黄建安, 等. 酶性氧化合成茶黄素条件优化的研究[J]. 茶叶科学, 2006, 26(4): 285-290. DOI:10.3969/j.issn.1000-369X.2006.04.010.
[9] 鲜殊. 茶鲜叶匀浆悬浮发酵在高茶黄素含量茶色素制备中的应用研究[D]. 合肥: 安徽农业大学, 2012: 17-32.
[10] 周洁. 茶黄素酶促氧化合成条件的优化[D]. 重庆: 西南大学,2013: 16-25.
[11] JHOO J W, SANG S, WEI G J, et al. Enzymatic synthesis o f theaflavins and epitheaflavic acid from catechins and their antioxidant activity[J]. Journal of Food Lipids, 2004, 11: 89-103. DOI:10.1111/j.1745-4522.2004.tb00263.x.
[12] 蒋长兴, 焦云鹏, 熊清平, 等. 山药氧化酶特性及茶黄素的合成[J]. 江苏农业科学, 2013, 41(8): 277-280. DOI:10.3969/j.issn.1002-1302.2013.08.106.
[13] 李适. 微生物多酚氧化酶酶源筛选及其在茶黄素合成中的应用[D].长沙: 湖南农业大学, 2006: 37-38.
[14] 徐斌. 不同体系条件下聚酯型儿茶素的形成特性及其与茶黄素的竞争性形成[D]. 杭州: 中国农业科学院, 2015: 33-38.
[15] 黄意欢. 茶学实验技术[M]. 北京: 中国农业出版社, 1997: 142-143.
[16] SHARMA K, BARI S S, SINGH H P. Biotransformation of tea catechins into theaflavins w ith immobilized polyphenol oxidase[J]. Journal of M olecular Catalysis B: Enzymatic, 2009,56(4): 253-258. DOI:10.1016/j.molcatb.2008.05.016.
[17] 国家质量监督检验检疫总局, 国家标准化管理委员会. 茶叶中茶黄素的测定 高效液相色谱法: GB/T 30483—2013[S]. 北京: 中国标准出版社, 2013: 1-4.
[18] 夏涛. 红茶色素形成机理的研究[J]. 茶叶科学, 1999, 19(2): 139-144.DOI:10.13305/j.cnki.jts.1999.02.011.
[19] 龚志华, 李徐, 朱盛尧, 等. 茶鲜叶酶促氧化合成茶黄素研究[J]. 食品与机械, 2012, 28(6): 59-62; 73. DOI:10.3969/j.issn.1003-5788.2012.06.014.
[20] YORUK R, MARSHALL M R. Physicochem ical properties and function of p lant polyphenol oxidase: a review[J]. Journal of Food Biochem istry, 2003, 27: 361-422. DOI:10.1111/j.1745-4514.2003.tb00289.x.
[21] 夏涛, 高丽萍, 韦朝领, 等. 茶树儿茶素生物合成研究进展[C]//2009年中国茶叶科技创新与产业发展学术研讨会论文集. 杭州:中国茶叶学会, 2009: 520-525.
[22] COGGON P, MOSS G A, GRAHAM H N, et al. The biochem istry of tea fermentation: oxidative degallation and epimerization of the tea fl avanol gallates[J]. Journal of Agricultural and Food Chem istry,1973, 21(4): 727-733. DOI:10.1021/jf60190a055.
[23] CLOUGHLEY J B. The effect of fermentation temperature on the quality parameters and price evaluation of Central A frican black teas[J]. Science of Food and Agriculture, 1980, 31: 911-919.DOI:0022-5142/80/0900-0911.
[24] SAMANTA T, CHEENI V, DAS S, et al. Assessing biochem ical changes du ring standard ization o f ferm en tation tim e and tem perature for m anu facturing quality b lack tea[J]. Journal o f Food Science and Techno logy, 2015, 52(4): 2387-2393.DOI:10.1007/s13197-013-1230-5.
[25] 俞露婷, 袁海波, 王伟伟, 等. 红茶发酵过程生理生化变化及调控技术研究进展[J]. 中国农学通报, 2015, 31(22): 263-269.
[26] BARUAH A M, MAHANTA P K. Fermentation characteristics of some Assam ica clones and process optim ization of black tea manufacturing[J]. Journal of Agricultural and Food Chem istry,2003, 51(22): 6578-6588. DOI:10.1021/jf030019w.
[27] 谷记平. 茶黄素酶促氧化制备技术的研究[D]. 长沙: 湖南农业大学, 2004: 30-33.
[28] TANAKA T, MATSUO Y, KOUNO I. Chem istry of secondary polypheno ls p roduced during p rocessing o f tea and selected foods[J]. International Journal of M olecular Sciences, 2010, 11:14-40. DOI:10.3390/ijm s11010014.
[29] OWUOR P O, OBANDA M. The use of green tea (Camellia sinensis)leaf flavan-3-ol composition in predicting plain black tea quality potential[J]. Food Chem istry, 2007, 100(3): 873-884. DOI:10.1016/j.foodchem.2005.10.030.
[30] 江和源, 程启坤, 杜琪珍, 等. 红茶中的茶黄素[J]. 中国茶叶,1998, 3: 18-20.
[31] CO LL IER P D, BRYCE T, M A LLOW S R, e t a l. The theaflavins of black tea[J]. Tetrahedron, 1973, 29(1): 125-142.DOI:10.1016/S0040-4020(01)99386-X.
[32] STODT U W, BLAUTH N, NIEMANN S, et al. Investigation of processes in black tea manufacture through model fermentation(oxidation) experiments[J]. Journal of Agricultural and Food Chem istry, 2014, 62(31): 7854-7861. DOI:10.1021/jf501591j.
[33] 龚志华, 刘昆言, 刘林峰, 等. 红条茶加工过程中茶黄素组分的动态变化[J]. 茶叶通讯, 2016, 43(2): 19-23. DOI:10.3969/j.issn.1009-525X.2016.02.005.
[34] BA JA J K L, ANAN T, TSUSH IDA T, et a l. E f fec ts o f(-)-epicatechin on oxidation o f theaflavins by po lypheno l oxidase from tea leaves[J]. Agricultural and Biological Chem istry,1987, 51(7): 1767-1772. DOI:10.1080/00021369.1987.10868292.
Effects of Different Conditions on Theaflavins Synthesis by Polyphenol Oxidase of Camellia sinensis var. assamica cv. Mengku
HUANG Yingjie, WU Mengyao, YAO Yanni, HUANG Youyi*
(Key Laboratory of Horticultural Plant Biology, M inistry of Education, Department of Tea Science,College of Horticulture and Forestry Science, Huazhong Agricultural University, Wuhan 430000, China)
Abstract:The effects of different factors on the synthesis of theaflavins from tea polyphenols by crude polyphenol oxidase (PPO) from the leaves of Camellia sinensis var. assamica cv. Mengku were analyzed. The results show ed that pH 4.0, temperature of 37 ℃, a substrate concentration of 4.5 mg/m L and a reaction time of 1 h were found to be optimum for the synthesis of theaflavins. Under these conditions, the product yield reached (461.12 ± 15.01) μg/m L and the conversion of substrate was (15.31 ± 0.40)%. Additionally, ester theaflavins were the major products of the crude PPO and EGC and GA were also generated during PPO oxidation, which benefited the synthesis and accumulation of theaflavins. These results may be related to the high quality of Dianhong black tea.
Key words:Camellia sinensis var. assamica cv. Mengku; polyphenol oxidase; theaflavins; catechins
DOI:10.7506/spkx1002-6630-201722009
中图分类号:S571.1
文献标志码:A
文章编号:1002-6630(2017)22-0054-06
引文格式:
黄莹捷, 伍梦瑶, 姚燕妮, 等. 不同反应条件对勐库大叶种多酚氧化酶合成茶黄素的影响[J]. 食品科学, 2017, 38(22):54-59. DOI:10.7506/spkx1002-6630-201722009. http://www.spkx.net.cn
HUANG Yingjie, WU Mengyao, YAO Yanni, et al. Effects of different conditions on theaflavins synthesis by polyphenol oxidase of Camellia sinensis var. assamica cv. Mengku[J]. Food Science, 2017, 38(22): 54-59. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722009. http://www.spkx.net.cn
收稿日期:2016-10-08
基金项目:国家自然科学基金面上项目(31270731)
作者简介:黄莹捷(1992—),女,硕士研究生,研究方向为茶叶生物技术与加工。E-mail:hyj605791@163.com
*通信作者:黄友谊(1973—),男,教授,博士,研究方向为茶树生物技术与加工。E-mail:youyi@mail.hzau.edu.cn


 s(2 次重复)表示。
s(2 次重复)表示。




