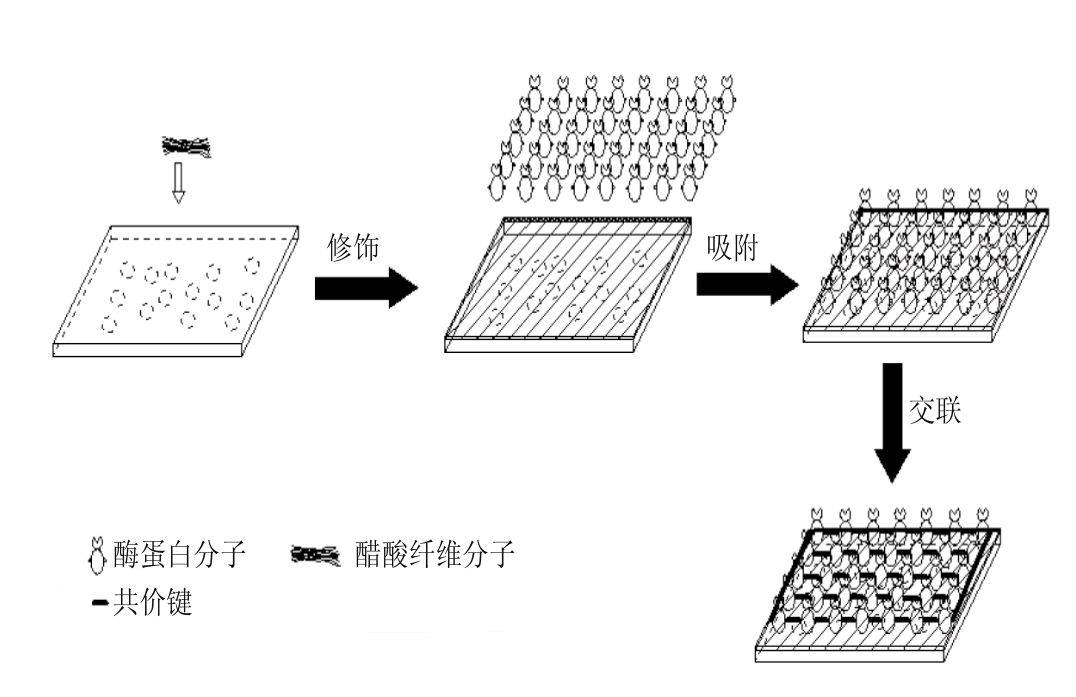
图1 酶固定化原理示意图
Fig. 1 Schematic diagram illustrating the p rincip le of enzyme immobilization
李中宾,任 悦,邹德智,王 旭,于殿宇*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:利用醋酸纤维素修饰聚丙烯微孔膜,再将纤维素酶和中性蛋白酶分别固定在醋酸纤维素/聚丙烯复合膜上,并制成固定化酶辊,以大豆胚片为原料,依次按纤维素酶辊、中性蛋白酶辊的顺序共同交替多效循环对其进行碾压酶解,以冷榨大豆胚片的出油率为指标,在单因素试验的基础上,采用响应面法优化固定化酶辊酶解大豆胚片条件。结果表明,最佳条件为酶解环境空气相对湿度86.0%、大豆料胚温度55.0 ℃、酶辊碾压时间91.0 m in,在此条件下酶解的大豆胚片经冷榨出油率为73.8%,瓦饼的蛋白变性较小,2 种固定化酶辊重复使用7 次后,其相对酶活力仍保持在80%以上。
关键词:固定化酶辊;多效酶解;冷榨法;出油率;氮溶解指数(NSI)
目前,大豆制油的工业化方法主要为溶剂萃取法、热榨法和冷榨法[1-3],其中溶剂萃取法的出油率最高,但油脂的营养价值偏低,同时豆粕中溶剂残留,使豆粕效能降低[4-5]。热榨法提取的油脂品质较好,安全健康,但出油率仅为70%左右,且高温使豆粕蛋白变性严重,利用率很低[6-7]。冷榨法是将未经过蒸炒的油料直接在80 ℃以下进行物理压榨,从而避免了热榨法的不足,并且冷榨油不需进一步常规的油脂精炼工序,最大限度地保存了油中各种脂溶性营养成分[8-10],但出油率约为热榨法的一半,致使其市场售价较高。
近年来,人们对酶法与冷榨技术相结合制油的技术展开的相关研究[11-12]表明,相较于传统冷榨制油法,酶法与冷榨技术相结合制油的技术使得出油率显著提高,同时瓦饼中蛋白质变性程度较低,但是此种方法所用的酶大多数为游离酶,在制油的过程中酶的用量大,成本较高,酶无法重复使用等问题限制了其在工业化生产上的广泛应用。将游离酶固定在载体上制成固定化酶,不仅提高了酶的稳定性,同时可使酶重复使用,从而降低了生产成本[13],固定化酶载体材料根据其形态大致可以分为微球、多孔材料和膜材料等[14-15],而将酶固定在膜表面制成酶膜,可以将酶的催化功能和膜的分离功能有机地结合起来,这一点是其他载体材料无法比拟的[16]。
醋酸纤维素/聚丙烯复合膜具有一定的吸附性、化学稳定性好、疏水性和机械性能优异等优点,根据复合膜的吸附特性固定酶,可提高酶在反应体系中的稳定性,从而有利于酶的回收和产品的生产。而将酶膜制成酶辊,并用于大豆胚片酶解反应中,不仅可以降低蛋白与油脂的结合力[17-19],保证了较高的出油率,又可以用于工业化连续生产。
本实验利用醋酸纤维素修饰聚丙烯微孔膜,再以醋酸纤维素/聚丙烯复合膜为载体,以吸附交联法分别将纤维素酶和中性蛋白酶固定在载体上,如图1所示,并将2 种固定化酶膜分别制成酶辊,依次按纤维素酶辊、中性蛋白酶辊的顺序共同交替循环酶解大豆胚片,研究酶辊的相关特性及2 种酶辊连续多效酶解过程的工艺条件,研究酶解后冷榨大豆胚片的出油率及蛋白变性情况,为工业化连续生产提供一定的理论依据。

图1 酶固定化原理示意图
Fig. 1 Schematic diagram illustrating the p rincip le of enzyme immobilization
1.1 材料与试剂
大豆胚片(从企业生产线上取样,工艺参数为大豆破碎4~6 瓣,软化温度70 ℃,时间约15 m in,胚片厚度0.3 mm左右;水分质量分数10.6%,蛋白质质量分数41.6%,脂肪质量分数20.8%,灰分质量分数4.3%)黑龙江九三康诺有机农产品科技有限公司;纤维素酶(25 U/mg)、中性蛋白酶(200 U/mg) 诺维信(中国)有限公司;聚丙烯微孔膜 北京塑料研究所;醋酸纤维素 中国医药集团上海化学试剂公司;其他试剂均为分析纯。
1.2 仪器与设备
SG30-2B型家用螺旋榨油机 北京永恒鑫盛科技发展中心;JF-976G分体式加热平台 东莞市长安金峰电子工具厂;SM-03B型电子雾化加湿器 江苏湿美电气制造有限公司;N24120型电子天平 梅特勒-托利多仪器有限公司;DHG-9075A型电热恒温鼓风干燥箱 上海凯朗仪器设备厂;PHS-3C精密酸度计 上海雷韵试验仪器制造有限公司;THZ-82数显水浴恒温振荡器江苏省金坛市友联仪器研究所;PP-2000型扫描电子显微镜 英国Quorum公司;2300自动定氮仪 杭州福斯特卡托公司。
1.3 方法
1.3.1 聚丙烯复合膜的表面修饰
聚丙烯微孔膜内部呈纤维状,微孔较多,这种结构并不利于酶的固定化,因此需用醋酸纤维素对聚丙烯微孔膜进行表面改性,将5.0 g醋酸纤维素溶于100 m L丙酮中,待溶解完全形成均一的膜液,将聚丙烯微孔膜浸于溶有醋酸纤维素的丙酮溶液中,自然成膜,以去离子水冲洗醋酸纤维素/聚丙烯复合膜数次干燥备用[20]。
1.3.2 酶膜的制备
纤维素酶膜的制备:将7.5 m g纤维素酶溶解于45 ℃、500 m L、pH 4的磷酸盐缓冲液中配制成酶液,取2 份相同大小的醋酸纤维素/聚丙烯复合膜紧密贴合,置于上述酶液中振荡吸附5 h后,加入2.5 m L戊二醛进行交联反应4 h,确保纤维素酶固定于单张酶膜的一侧,以达到节约成本的目的。取出酶膜以去离子水冲洗数次后于室温下干燥,制得一侧有固定化纤维素酶的酶膜,对酶膜进行表征,观察其表面形貌,所得电镜图片经专业图象分析软件分析其孔径大小[21]。
中性蛋白酶膜的制备:将7.5 mg中性蛋白酶溶解于51 ℃、500 m L、pH 7的磷酸盐缓冲液中配制成酶液,将2 张紧密贴合的纤维素/聚丙烯复合膜置于酶液中,振荡吸附4 h后,加入2.5 m L戊二醛进行交联反应3 h,干燥后制得一侧有固定化中性蛋白酶的酶膜,对酶膜进行表征,观察其表面形貌,所得电镜图片经专业图象分析软件分析其孔径大小。
1.3.3 固定化酶膜载酶量的测定
用单位面积的酶膜所固定的酶蛋白含量表示载酶量,采用Bradford[22]的方法测定固定化前后的纤维素酶及中性蛋白酶的酶液含量,同时测定清洗固定化酶膜所用PBS中的酶蛋白含量,同一条件下进行平行重复实验3 次,取平均值,实验误差在5%以下。根据公式(1)计算载酶量:
式中:ρ0为固定化之前酶溶液中蛋白质量浓度/(m g/m L);ρ为酶经固定化后溶液中蛋白质量浓度/(mg/m L);ρw为清洗溶液中蛋白质量浓度/(mg/m L);V为固定化实验所用酶溶液体积/m L;Vw为清洗溶液体积/m L;S为浸入酶溶液中膜的面积/cm2。
1.3.4 固定化酶膜酶活力测定
测定固定化酶膜活力时,每次取固定化酶膜2 份,其中一份做空白实验,在样品瓶中加入另一份固定化酶膜1 cm2,其中纤维素酶活力采用QB 2583—2003《纤维素酶制剂》中的滤纸酶活力法测定;中性蛋白酶活力采用GB/T 23527—2009《蛋白酶制剂》中的福林-酚法测定,以酶活力最大值为100%,其余酶活力与其对比,即相对酶活力,见公式(2):
式中:A为固定化酶膜初始酶活力/(U/cm2);B为使用一定时间后固定化酶膜的酶活力/(U/cm2)。
1.3.5 酶辊的制备
辊的规格为直径60 mm,长400 mm,辊轴长80 mm,辊的表面材质为普通碳钢板(板厚3.0 mm),酶辊上固定2 层,第1层用牛皮纸包裹辊,将少量乳白胶均匀的涂抹在牛皮纸中间及两侧位置,第2层将制备好的固定化纤维素酶膜的空白一侧缠绕于附有乳白胶的牛皮纸上,使酶膜较好的固定在辊上,从而制得固定化纤维素酶辊;同法制得中性蛋白酶辊。
1.3.6 酶辊碾压胚片过程
将大豆胚片平铺于带有电热的600 mm×400 mm不锈钢板上,大豆胚片厚度大约5 mm,将其支撑在800 mm×450 mm×500 mm的不锈钢板制作的密封室内,酶辊的两段轴头外漏,调节电热板至一定温度,利用电子雾化加湿器向酶解室内喷雾,调节酶解室内空气相对湿度,按照纤维素酶辊在前,中性蛋白酶辊在后的顺序多次碾压电热板上的大豆胚片,人工转动辊轴使2 种酶辊连续循环往复碾压酶解胚片,期间每隔10 m in将胚片翻置1 次。
1.3.7 响应面试验设计
综合单因素试验结果,采用Box-Behnken模型,对空气相对湿度(A)、大豆料胚温度(B)、酶辊碾压时间(C)3 个因素进行优化,以出油率(Y)为响应值,进行三因素三水平的响应面分析,使用Design-Expert 8.0.6设计响应面试验以优化制油工艺参数。响应面因素与水平见表1。
表1 Box-Behnken设计试验因素与水平
Table 1 Code and level of independent variables used in Box-Behnken design

1.3.8 冷榨制油方法
取出酶解后的胚片,对其进行低温干燥处理,调节物料水分质量分数为5%,将干燥后物料投入冷榨机内,在冷榨压力3.5 MPa、冷榨温度65 ℃条件下进行冷榨制油,并计算出油率,见公式(3):
式中:mA为压榨后瓦饼含油质量/g;mB为大豆胚片总含油质量/g。
1.3.9 氮溶解指数测定
参照Mattil[23]的方法并做适当改进以测定榨油后瓦饼的氮溶解指数(nitrogen solubility index,NSI),具体方法为:准确称取100 mg样品,加入15 m L蒸馏水,室温下磁力搅拌30 m in, 4 000 r/m in离心30 m in,收集上清液。取20 m L上清液,凯氏定氮法测定上清液中的氮含量,同时测定瓦饼中的总氮含量。
1.3.10 酶辊操作稳定性分析
在响应面优化的最佳操作条件下,用2 种酶辊对大豆胚片进行碾压酶解操作,每次碾压时间为优化出酶解的最佳时间,每次碾压结束后,从酶辊上取约1 cm2的酶膜进行酶活力检测,重复上述实验过程,以初始的酶活力记为100%,计算相对酶活力,考察重复使用次数对酶膜相对酶活力的影响。
2.1 固定化酶辊的制备
2.1.1 聚丙烯微孔膜及固定化酶膜的微观结构
从图2a可知,空白聚丙烯微孔膜内部呈纤维状,错乱交叉,微孔较多,其平均孔径为0.22 μm,这种结构并不利于酶的固定化。图2b中醋酸纤维素/聚丙烯复合膜的表面平整、致密、均匀,且无明显的微孔结构,这说明经醋酸纤维素修饰后,聚丙烯膜内部微孔被醋酸纤维素交织成网状结构,从而有利于酶的固定[24]。图2c、2d中醋酸纤维素/聚丙烯复合膜的表面大部分被酶覆盖,且酶在复合膜的表面分布均匀,这表明大部分的酶被固定在醋酸纤维素/聚丙烯复合膜的界面上。

图2 微孔膜及固定化酶膜的扫描电镜图(×1 000)
Fig. 2 Scanning electron m icroscopic images of m icroporous membrane and immobilized enzyme membrane (× 1 000)
2.1.2 酶膜载酶量及酶活力由表2可知,固定化纤维素酶膜与固定化中性蛋白酶膜的酶活力分别为18.92 U/mg和142.32 U/mg,虽然酶活力有所降低,但可增加重复利用次数,避免了酶的大量流失[25-26]。
表2 2 种酶膜的载酶量及酶活力
Table 2 Enzyme loadings and activities of two immobilized enzyme membranes
2.1.3 固定化酶辊立体结构

图3 酶辊的立体实物图
Fig. 3 Pictures of immobilized enzyme rollers
如图3所示,碳钢材质具有较好的机械强度,可保证在长时间使用下酶辊不变形,牛皮纸使辊表面平整,避免在操作过程中外层固定化纤维素酶膜受到内部辊的机械损伤,同时牛皮纸具有较好的透气性,可使固定化纤维素酶膜层内外湿度保持相近,从而利于其酶膜在一定的湿度下发挥作用;固定化中性蛋白酶辊结构与固定化纤维素酶辊相同。
2.2 单因素试验结果分析
2.2.1 酶解室空气相对湿度对出油率的影响
通过控制通入水雾量调节酶解室内的空气相对湿度为75%、80%、85%、90%、95%,料胚温度为55 ℃,酶辊连续碾压大豆胚片的时间为90.0 m in,空气相对湿度对大豆胚片出油率的影响见图4。

图4 空气相对湿度对出油率的影响
Fig. 4 Effect of relative air hum idity on oil yield
由图4可知,随着酶解室内空气相对湿度的增大,大豆胚片的出油率呈先升高后平缓趋势,当空气相对湿度大于85%时,出油率趋于平稳,这主要是因为酶的催化作用只与少部分与酶结合的“结合水”有关,过高的水分含量会稀释酶和底物,使酶促反应速率下降[26],并且空气相对湿度过高,可能导致酶膜上固定化酶的脱落致使出油率增加不明显,综合考虑,空气相对湿度在85%为宜。
2.2.2 大豆料胚温度对出油率的影响
选取酶解室空气相对湿度为85%,料胚温度为35、45、55、65、75 ℃,酶辊连续碾压大豆胚片的时间为90.0 min,大豆料胚温度对大豆胚片出油率的影响见图5。

图5 大豆料胚温度对出油率的影响
Fig. 5 Effect of operating temperature on oil yield
由图5可以看出,当大豆料胚温度从35 ℃升至55 ℃时,出油率逐渐升高,温度达到55 ℃时,出油率达到最大。这说明随着温度的升高,2 种酶的催化活性部位逐渐暴露,使酶的活性逐渐增强[28]。然而,随着温度继续升高,大豆胚片出油率开始降低,这可能是因为较高温度使酶辊上的酶部分失活所导致的。因此,2 种酶辊共同作用大豆胚片的最佳大豆料胚温度为55 ℃。
2.2.3 酶辊碾压时间对出油率的影响
选取酶解室内空气相对湿度为85%,料胚温度为55 ℃,酶辊连续碾压大豆胚片的时间为75、80、85、90、95 min,酶辊碾压时间对大豆胚片出油率的影响见图6。

图6 酶辊碾压时间对出油率的影响
Fig. 6 Effect of rolling time on oil yield
由图6可以看出,开始时随着两种酶辊连续碾压大豆胚片时间延长,出油率逐渐增大,酶辊碾压超过90.0 m in时,出油率增加减缓,原因为纤维素酶辊破坏了大豆胚片细胞壁,中性蛋白酶辊降低了大豆胚片内油脂与蛋白结合力,从而使油脂易于从固体油料中释放出来[29-30],延长碾压时间,虽有利于出油率的提高,但时间过长会导致生产效率的下降,综合考虑,选取碾压时间为90.0 m in。
2.3 响应面法优化酶解工艺
2.3.1 响应面试验设计与结果
综合单因素试验的结果,以空气相对湿度(A)、大豆料胚温度(B)、酶辊碾压时间(C)3 个因素进行优化,以出油率(Y)为响应值,进行三因素三水平的响应面分析,使用Design-Expert 8.0.6设计响应面试验以优化制油工艺参数。响应面试验方案与结果见表3。
表3 Box-Behnken试验设计及结果
Table 3 Box-Behnken design w ith experimental values of oil yield
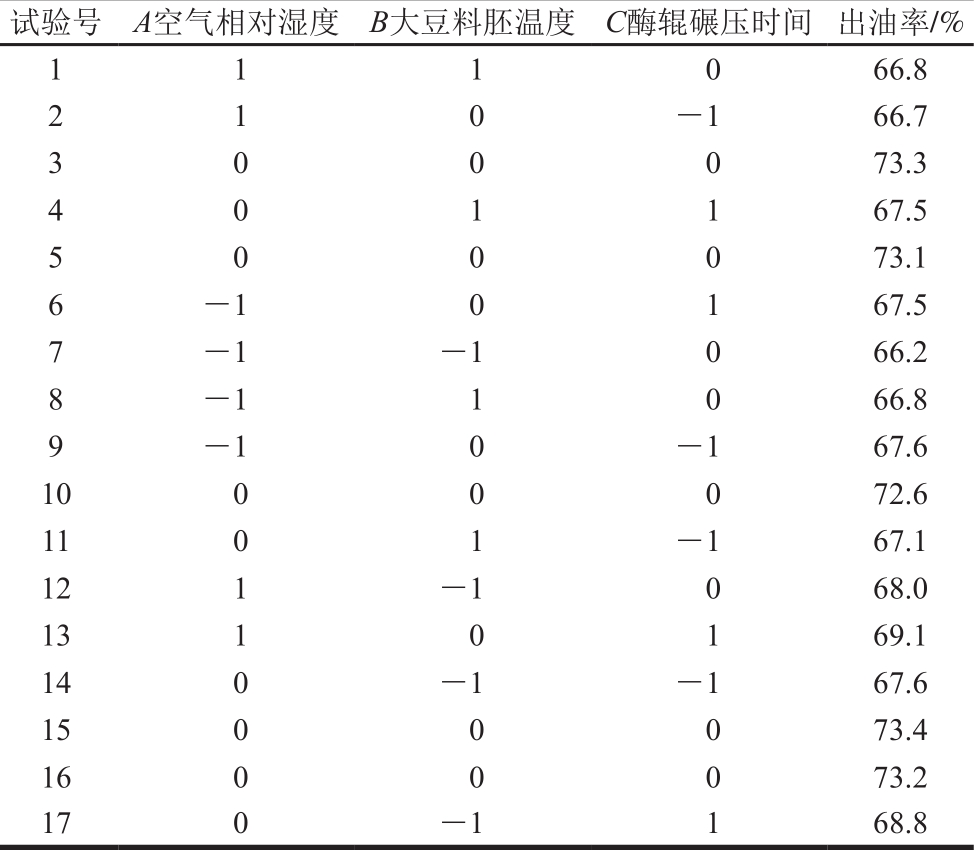
由表3可知,整个试验共进行17 次,其中析因试验为12 次,中心试验为5 次。采用Design-E xpert 8.0.6软件对表中数据进行二次多项回归拟合,得到3 个因素对响应值影响的回归方程模型如下:

2.3.2 响应面模型的显著性检验与分析
表4 回归方程的方差分析
Tab le 4 Analysis of variance of regression equation

注:***.差异极显著(P<0.000 1);**.差异高度显著(0.000 1<P<0.01);*.差异显著(0.01<P<0.05)。
表4中出油率整体模型的F值为119.64,P值小于0.000 1,模型极显著,表明回归方程描述各因素与响应值之间的关系时,因变量与所有自变量之间的线性关系显著,即这种实验方法是可靠的。失拟项是用来表示模型与实验拟合的程度,即二者差异的程度[31]。表3中失拟项F值为1.35,P值为0.377 5,失拟项不显著,表明该模型选择正确,模型中的调整系数R2Adj为0.984 5,说明98.45%的响应值变化可以通过拟合模型进行解释,相关系数R2为0.992 2,表明该模型与实际实验拟合较好,可以用此模型来分析和预测出油率。
从回归方程系数的显著性检验可以看出:一次项C对响应值的影响高度著性,A、B对响应值的影响显著。在所确定的实验水平范围内,各因素对响应值的影响程度顺序为C>A>B,即酶辊碾压时间>空气相对湿度>大豆料胚温度,3 个因素中,空气相对湿度和酶辊碾压时间之间有高度显著交互作用,空气相对湿度和大豆料胚温度之间有显著交互作用。
通过试验设计优化得到酶辊处理大豆胚片的最佳工艺参数为空气相对湿度85.3%、大豆料胚温度54.4 ℃、酶辊碾压时间90.6 m in,该条件下出油率预测值为73.2%。根据实际情况将工艺参数进行整理,得出整理值为空气相对湿度86.0%、大豆料胚温度55.0 ℃、酶辊碾压时间91.0 m in,在此条件下进行3 次平行验证实验,该条件下出油率平均值为73.8%,实测值与预测值之间具有良好的拟合性,从而证实了模型的有效性。同时本实验对最佳工艺下冷榨制油后瓦饼的NSI值进行测定,结果表明,实验冷榨瓦饼NSI为70.0%,通过比较本实验中的冷榨瓦饼与普通冷榨瓦饼可知,本实验冷榨瓦饼NSI较其上升3.4%,这说明本实验方法所得的瓦饼蛋白具有较好的溶解性,相对于普通冷榨榨制油工艺所得的瓦饼蛋白加工特性较好,具有较好的经济价值以及更广泛的应用领域。
2.4 固定酶辊的操作稳定性
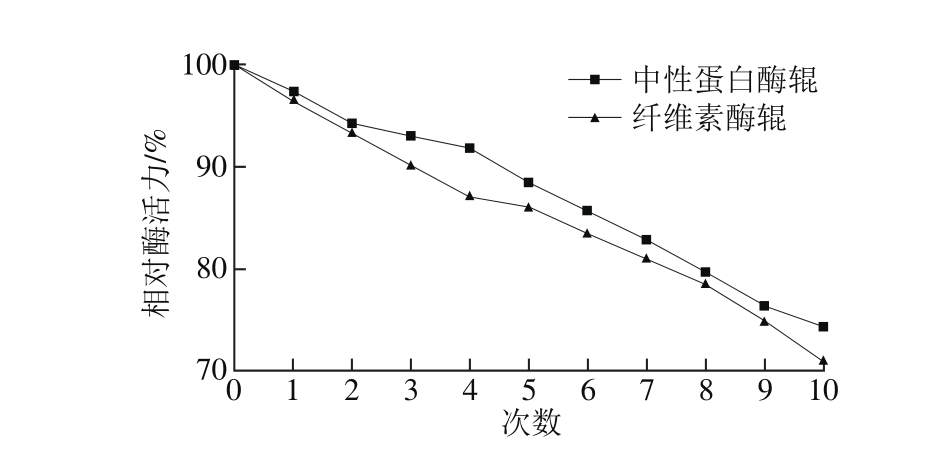
图7 2 种酶辊重复使用次数对相对酶活力的影响
Fig. 7 Repeated usability of two immobilized enzyme rollers
由图7可以看出,无论固定化纤维素酶辊还是固定化中性蛋白酶辊的相对酶活力,均随着重复使用次数的增加而降低,这可能是由于重复使用次数增加,酶膜受到一定的机械损伤,使载体破损,并可能伴有固定化酶脱落现象,或者酶本身的失活导致了固定化酶相对酶活力的降低。但2 种酶辊在重复使用7 次后,相对酶活力仍可保持80%以上,说明其具有良好的操作稳定性。
本实验研制了固定化纤维素酶辊和固定化中性蛋白酶辊,应用2 种酶辊连续循环往复对大豆胚片进行碾压酶解处理,降低了大豆胚片内油脂与蛋白结合力,以冷榨出油率为指标,通过响应面法优化了空气相对湿度、大豆料胚温度和酶辊碾压时间对酶解效果的影响,在酶解最佳条件下,冷榨出油率为73.8%。同时测得压榨后瓦饼的NSI为70.0%,相较于普通冷榨瓦饼有显著提高,提高了3.4%。2 种固定化酶辊重复使用7 次后,其相对酶活力均可保持80%以上,具有较好的操作稳定性,应用此法对大豆胚片进行酶解处理,不仅提高了冷榨法制油的出油率及冷榨后瓦饼中蛋白的利用率,酶辊的连续使用性能为工业化连续生产提供一定的理论依据。
参考文献:
[1] RUSSIN T A, BOYE J I, ARCAND Y. A lternative techniques for defatting soy: a practical review[J]. Food and Bioprocess Technology,2011, 4(2): 200-223. DOI:10.1007/s11947-010-0367-8.
[2] 刘玉兰, 陈刘杨, 汪学德, 等. 不同压榨工艺对芝麻油和芝麻饼品质的影响[J]. 农业工程学报, 2011, 27(6): 382-386. DOI:10.3969/j.issn.1002-6819.2011.06.066.
[3] YANIK D K. A lternative to traditional olive pomace oil extraction systems: m icrowave-assisted solvent extraction of oil from wet olive pomace[J]. LWT-Food Science and Technology, 2017, 77: 45-51.DOI:10.1016/j.lw t.2016.11.020.
[4] TRES M V, RACOSK I J C, LUCCIO M D, et al. Separation of soybean oil/n-hexane and soybean oil/n-butane m ixtures using ceram ic membranes[J]. Food Research International, 2014, 63: 33-41.DOI:10.1016/j.foodres.2014.02.004.
[5] 徐红华, 申德超. 改进的挤压膨化浸出工艺对大豆油脂及粕蛋白品质的改善[J]. 农业工程学报, 2007, 23(4): 249-252. DOI:10.3321/j.issn:1002-6819.2007.04.049.
[6] BARGALE P C, FORD R J, SOSULSKI F W, et al. Mechanical oil expression from extruded soybean samples[J]. Journal of the American Oil Chem ists’ Society, 1999, 76(2): 223-229.
[7] NIU Y X, LI W, ZHU J, et al. Aqueous enzymatic extraction of rapeseed oil and protein from dehulled cold-pressed double-low rapeseed cake[J]. International Journal of Food Engineering, 2012,8(3): 1-14. DOI:10.1515/1556-3758.2530.
[8] 张雪娇, 王向红, 桑亚新, 等. 响应面法优化亚麻籽油制备工艺条件[J]. 中国食品学报, 2013, 13(9): 99-107. DOI:10.16429/j.1009-7848.2013.09.020.
[9] YU L L, ZHOU K K, PARRY J. Antioxidant properties of cold-pressed black caraway, carrot, cranberry and hemp seed oils[J]. Food Chemistry,2005, 91(4): 723-729. DOI:10.1016/j.foodchem.2004.06.044.
[10] KANIA M, M ICHALAK M, GOGOLEWSKI M, et al. Antioxidative potential of substances contained in cold pressed soybean oil and after each phase of refining process[J]. Acta Scientiarum Polonorum Technologia A limentaria, 2004, 3(1): 113-121.
[11] SOTO C, CHAMY R, ZÚÑIGA M E. Enzym atic hyd ro lysis and pressing conditions effect on borage oil extraction by cold pressing[J]. Food Chem istry, 2007, 102(3): 834-840. DOI:10.1016/j.foodchem.2006.06.014.
[12] ANWAR F, ZREEN Z, SULTANA B, et al. Enzyme-aided cold pressing of fl axseed (Linum usitatissimum L.): enhancement in yield,quality and phenolics of the oil[J]. Grasas Y Aceites, 2013, 64(5): 463-471. DOI:10.3989/gya.132212.
[13] 叶丽静, 房鑫, 王浩绮, 等. 介孔TiO2晶须材料的硅烷化改性及其对载体pzc值和酶负载性能的影响[J]. 化工学报, 2013, 64(6): 2160-2168. DOI:10.3969/J.ISSN.0438-1157.2013.06.035.
[14] 邓辉, 陈晟, 陈坚, 等. 产葡萄糖异构酶细胞的固定化[J]. 食品科学,2013, 34(9): 164-169. DOI:10.7506/spkx1002-6630-201309034.
[15] 代云容, 牛军峰, 殷立峰, 等. 静电纺丝纳米纤维膜固定化酶及其应用[J]. 化学进展, 2010, 22(9): 1808-1818.
[16] 徐坚, 王玉军, 骆广生, 等. 利用醋酸纤维素/聚四氟乙烯复合膜中的微结构固定化脂肪酶[J]. 化工学报, 2006, 57(10): 2372-2377.
[17] SHARMA A, KHARE S K, GUPTA M N. Enzyme-assisted aqueous extraction of rice bran oil[J]. Journal of the American Oil Chem ists’Society, 2001, 78(9): 949-951. DOI:10.1007/s11746-001-0369-x.
[18] HANMOUNGJAI P, PYLE D L, NIRANJAN K. Enzymatic process for extracting oil and protein from rice bran[J]. Journal of the American Oil Chemists’ Society, 2001, 78(8): 817-821. DOI:10.1007/s11746-001-0348-2.
[19] SANTAMARÍA R I, SOTO C, ZÚÑIGA M E, et al. Enzymatic extraction of oil from Gevuina avellana, the Chilean hazelnut[J].Journal of the American Oil Chem ists’ Society, 2003, 80(1): 33-36.DOI:10.1007/s11746-003-0646-8.
[20] 时敏, 王雪, 马丽娜, 等. 醋酸纤维素-聚丙烯复合膜固定化转谷氨酰胺酶的研究[J]. 食品科学, 2013, 34(9): 155-158. DOI:10.7506/spkx1002-6630-201309032.
[21] MASSELIN I, DURAND-BOURLIER L, LA INE J M, et al.Membrane characterization using m icroscopic image analysis[J].Journal of Membrane Science, 2001, 186(1): 85-96.
[22] BRADFORD M M. A rapid and sensitive method for the quantitation of m icrogram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochem istry, 1976, 72(1/2): 248-254.
[23] MATTIL K F. The functional requirements of proteins for foods[J].Journal of the American Oil Chem ists’ Society, 1971, 48(9): 477-480.
[24] 梁单琼, 周晓丹, 时敏, 等. 醋酸纤维素-聚四氟乙烯复合膜固定化脂肪酶的研究[J]. 食品科学, 2011, 32(21): 171-176.
[25] 赵磊, 唐婧, 王成涛. 脂肪酶在尼龙网上的固定化及其酶学性质研究[J]. 食品科学, 2013, 34(9): 210-215. DOI:10.7506/spkx1002-6630-201309043.
[26] 陈新营, 魏荣卿, 何冰芳, 等. 梳状亲水性环氧基载体固定化Pseudomonas stutzeri LC2-8脂肪酶[J]. 高校化学工程学报, 2012,26(4): 635-639.
[27] 杨缜. 有机介质中酶催化的基本原理[J]. 化学进展, 2005, 17(5):924-930. DOI:10.3321/j.issn:1005-281X.2005.05.022.
[28] 张家明, 许多现, 李相昕, 等. 响应面试验优化超临界CO2酯交换法制备低能SLS型结构脂质工艺[J]. 食品科学, 2015, 36(20): 67-72.DOI:10.7506/spkx1002-6630-201520012.
[29] 江连洲, 李杨, 王妍, 等. 水酶法提取大豆油的研究进展[J]. 食品科学, 2013, 34(9): 346-350. DOI:10.7506/spkx1002-6630-201309069.
[30] BOCEVSKA M, KARLOVIĆ D, TURKULOV J, et al. Quality of corn germ oil obtained by aqueous enzymatic extraction[J]. Journal of the American Oil Chem ists’ Society, 1993, 70(12): 1273-1277.DOI:10.1007/BF02564241.
[31] BOHUTSKYI P, KULA T, KESSLER B A, et al. M ixed trophic state production process for m icroalgal biomass w ith high lipid content for generating biodiesel and biogas[J]. Bioenergy Research, 2014, 7(4):1174-1185. DOI:10.1007/s12155-014-9453-5.
Optim ization of Sequential Hydrolysis of Soybean Flakes by Immobilized Enzyme Rollers for Increased Cold-Presssed Oil Yield
LI Zhongbin, REN Yue, ZOU Dezhi, WANG Xu, YU Dianyu*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:An immobilized enzyme roller was developed by immobilizing cellulase and neutral protease onto polypropylene m icroporous membrane modified by cellulose acetate, respectively. Soybean flakes were rolled sequentially w ith the cellulose roller followed by the neutral protease roller and then used for the production of cold-pressed oil. Hydrolysis conditions were optim ized by one-factor-at-a-time method and response surface methodology. An air relative hum idity of 86.0%, an operating temperature of 55.0 ℃ and a rolling time of 91.0 m in were found to be the optimal conditions to obtain a higher oil yield of 73.8% and a lower degree of protein denaturation. A fter seventh repeated use, both immobilized enzyme rollers retained more than 80% of their initial activities.
Key words:immobilized enzyme roller; sequential enzymatic hydrolysis; cold pressing method; oil yield; nitrogen solubility index (NSI)
DOI:10.7506/spkx1002-6630-201722011
中图分类号:TS224.3;TQ644.1
文献标志码:A
文章编号:1002-6630(2017)22-0067-07
引文格式:
李中宾, 任悦, 邹德智, 等. 固定化酶辊多效酶解大豆胚片的工艺优化[J]. 食品科学, 2017, 38(22): 67-73. DOI:10.7506/spkx1002-6630-201722011. http://www.spkx.net.cn
LI Zhongbin, REN Yue, ZOU Dezhi, et al. Optimization of sequential hydrolysis of soybean flakes by immobilized enzyme rollers for increased cold-presssed oil yield[J]. Food Science, 2017, 38(22): 67-73. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722011. http://www.spkx.net.cn
收稿日期:2017-04-10
基金项目:“十三五”国家重点研发计划重点专项(2016YD0401402);国家自然科学基金面上项目(31571880)
作者简介:李中宾(1987—),男,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:380003840@qq.com
*通信作者:于殿宇(1964—),男,教授,博士,研究方向为粮油精深加工技术。E-mail:dyyu2000@126.com