
姚 婷,黄津津,任向峰,张 燕,何欣萌,王友升*
(北京食品营养与人类健康高精尖创新中心,食品质量与安全北京实验室,北京工商大学,北京 100048)
摘 要:从采后贮藏过程中自然发病的“拉宾斯”、“红灯”樱桃果实中分离到5 株丝状病原真菌319#、323#、367#、369#和370#。对分离得到的菌株纯化、回接、再分离纯化,并观察菌落形态和个体形态。提取5 株病原真菌DNA,PCR扩增rDNA ITS区序列后测序,分析测序结果并构建进化树。综合形态学特征和rDNA ITS区序列鉴定分析结果,得到菌株319#为匍枝根霉(Rhizopus stolonifer)、菌株323#为苹果果腐病菌(Diaporthe perniciosa)、菌株367#为黑附球菌(Epicoccum nigrum)、菌株369#为核果褐腐病菌(Monilinia laxa)和菌株370#为圆孤青霉菌(Penicillium cyclopium),其中D. perniciosa、E. nigrum和P. cyclopium为在樱桃果实上首次分离到的病原真菌。
关键词:樱桃;病原真菌;形态学观察;rDNA ITS区序列分析
樱桃(Cerasus pseudocerasus)果实富含维生素、钙、铁、磷及钾等多种元素,营养丰富,深受消费者喜爱,但由于樱桃皮薄多汁,果实在采后贮藏过程中易受微生物侵染而发生品质裂变[1-2]。据报道,导致樱桃果实采后贮藏期间腐烂损失严重的病原真菌有灰霉病菌(Botrytis cinerea Pers. ex Fr.)引起的灰霉病、匍枝根霉(Rhizopus stolonifer)引起的软腐病、链核盘菌(Monilinia sp.)引起的褐腐病、扩展青霉(Penicillium expansum)引起的青霉病和链格孢菌(A lternaria alternata)引起的交链孢霉腐病等[3-4]。目前对引起樱桃采后病害的其他病原微生物,国内外鲜有报道。
rDNA基因内转录间隔区(in ternal transc ribed spacer,ITS)存在保守序列和可变序列,利用可变区分化程度高、变异性强的特点可从分子水平上解决真菌分类鉴定及进化水平上的差异性问题[5-7]。可通过分析较短的rDNA ITS区序列信息,快速有效地对真菌进行分类鉴定,而被广泛应用,rDNA ITS区序列是真菌鉴定的有效途径[8-9]。但目前未见利用rDNA ITS区序列分析技术系统研究樱桃果实采后病原真菌的报道。
本研究从采后樱桃果实上分离得到5 株丝状真菌,结合菌落和个体形态学特征及rDNA ITS区序列分析,发现了引起甜樱桃果实采后病害的新病原微生物,以期进一步丰富樱桃果实采后病原微生物的种类的同时,为樱桃果实采后病害的生物防治供理论依据。
1.1 材料与试剂
1.1.1 菌株
从采后贮藏过程中自然发病“拉宾斯”樱桃果实中分离到2 株丝状真菌319#、323#,“红灯”樱桃果实中分离到3 株丝状真菌367#、369#和370#。
1.1.2 培养基
马铃薯琼脂(potato dex trose agar,PDA)培养基:马铃薯去皮后切片,称取200 g,加1 L无菌水煮沸30 m in后,过滤取汁液,向滤液中加入琼脂18 g、葡萄糖20 g、最后加水补足至1 L,在高温高压灭菌锅中121 ℃灭菌20 m in。
麦芽浸粉琼脂(malt extract agar,ME)培养基:麦芽浸粉20 g、琼脂18 g,调节pH值至5.5±0.2,在高温高压灭菌锅中121 ℃灭菌20 m in。
1.1.3 试剂
DNA分子质量标准2×Taq PCR Master M ix、MarkerⅦ、6×Loading Buffer(溴酚蓝) 天根生化试剂公司;通用引物ITS-4和ITS-5由Invitrogen公司负责合成。十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸钠(sodium ethylene diam ine tetracetate,EDTA) 美国Amersco公司;乙醇、盐酸均为分析纯。
1.2 仪器与设备
微量移液器 美国Effendorf公司;HQ45恒温摇床武汉中科科仪技术发展有限公司;Imager 2200凝胶成像系统 美国ALpha公司;DYY-6C型电泳仪 北京六一仪器厂;4 ℃预冷离心机 美国Sigma公司;生物安全柜美国Thermo公司;Axio Image A 1显微镜 德国Zeiss公司;PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 菌种的分离、纯化与回接[10]
分离:取发病樱桃果实的发病、健康交界处组织于PDA固体培养基平板上,25 ℃培养3 d。
纯化:取分离菌边缘菌块,分别三点转接到PDA和ME培养基平板上,于25 ℃培养14 d,观察7 d和14 d菌落形态和个体形态特征。
回接:挑选健康无损伤的樱桃果实,75%乙醇溶液表面消毒,用无菌接种针刺孔,取纯化后的菌块接种至伤口处,观察果实接种处的病症。
1.3.2 形态学观察
从分离得到生长于PDA上的菌落外沿取菌块分别三点转接到到PDA和ME培养基上,于25 ℃条件下培养14 d,分别于7 d和14 d观察菌落形态、色泽等。培养期间,若培养基上长出孢子,于洁净载玻片上,滴一滴乳酸石炭酸棉蓝染色液,将插片培养的盖玻片置染色液中,置于显微镜下观察菌落产生分生孢子及分生孢子梗的形状、色泽,分生孢子隔膜等性状[11]。
1.3.3 基因组DNA的提取及ITS区PCR扩增
基因组DNA的提取:采用改良后SDS-氯化苄法提取待鉴定菌株的基因组DNA[7]作为PCR模板。
ITS区PCR扩增:以真菌rDNA ITS区的通用引物ITS-4(5’-TCCTCCGCTTATTGATATGC-3’)和ITS-5(5’-GGAAGTAAAAGTCGTAACAAGG-3’)作为PCR扩增引物。25 μL 2×Taq PCR MasterM ix、ITS4和ITS5两条正反向引物各4 μL和5 μL基因组模板、12 μL ddH2O,将体系混匀。在PCR仪中94 ℃预变性3 m in,94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸45 s,72 ℃再延伸10 min;30 个循环。
反应结束后取5 μL PCR产物加1 μL 6×Loading Buffer(溴酚蓝)混匀,进行染色。将染色后的样品加到1.0%琼脂糖凝胶胶孔中,180 V、180 m A条件下电泳30 m in,电泳后在EB染液中染色10 m in后于紫外灯下观察电泳条带。
1.3.4 测序结果分析
PCR产物由北京六合华大基因科技股份有限公司进行脱盐、纯化和双向测序,测序结果在CExpress软件中进行序列拼接,将拼接结果在网站https://blast.ncbi.nlm.nih.gov/Blast.cgi上进行核酸比对[10],根据比对结果在GenBank数据库中找目的菌株同源序列,通过MEGA 6软件进行同源性分析,构建进化树。
2.1 菌株的分离与回接

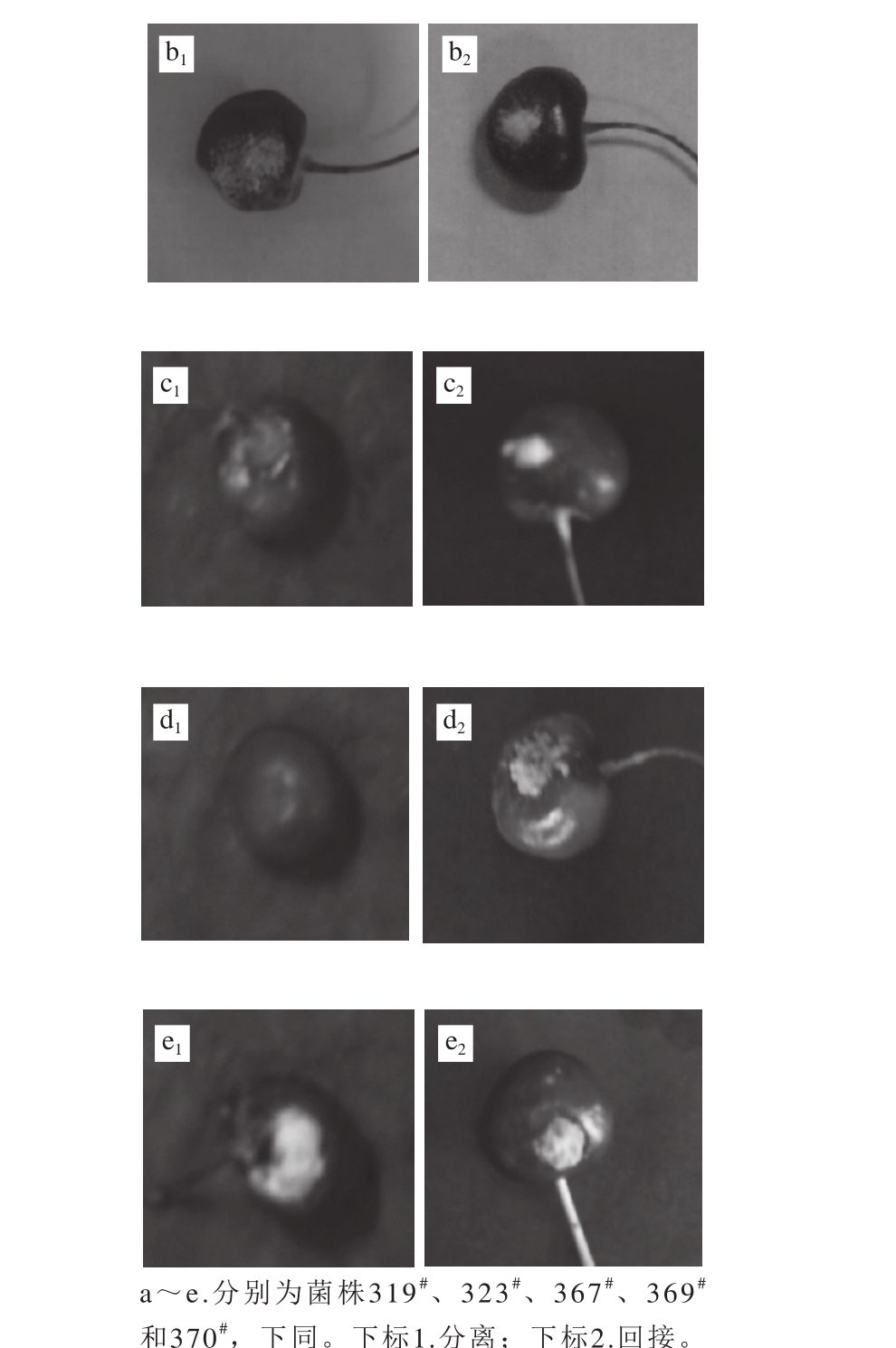
图1 5 株病原真菌分离与回接病症
Fig. 1 Naturally and artificially infected fruits
从采后自然发病的“拉宾斯”樱桃果实中分离到丝状真菌319#和323#,从“红灯”樱桃果实中分离到367#、369#和370#(图1a1~e1),纯化后回接到健康无伤的相应品种的樱桃果实上,在接种部位均出现相同的病症(图1a2~e2),并能从该病害部位再次分离得到相应病原菌,因此,可确定上述5种丝状真菌均为樱桃果实致病菌。
2.2 病原菌的形态观察
2.2.1 菌落形态

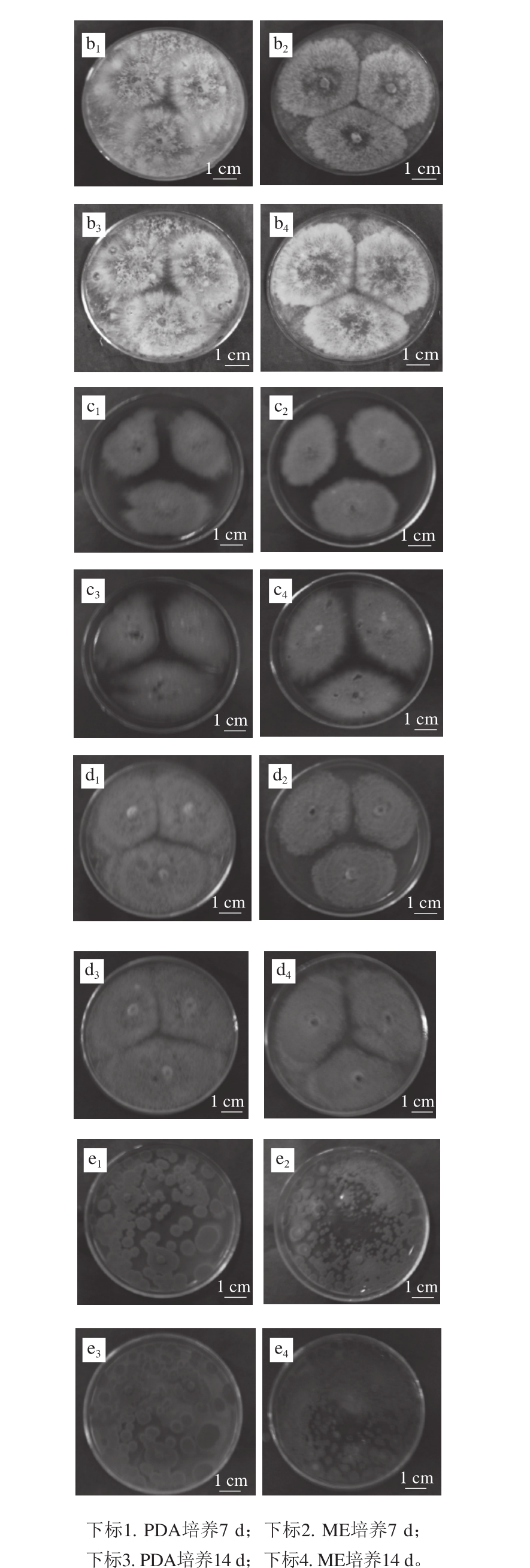
图2 5 株樱桃果实采后丝状病原真菌分别在PDA和ME培养基上25 ℃培养7、14 d的菌落特征
Fig. 2 Colony grow th of five fungal pathogens cu ltured on ME and PDA p lates at 25 ℃ for 7 and 14 days
由图2可以看出,5 株病原菌在PDA和ME培养基上25 ℃培养条件下均生长旺盛,但菌落形态差异较大。“拉宾斯”樱桃上分离的菌株319#和323#菌丝呈白色,外观干燥,不透明(图2a1、a2、b1、b2),其中菌株319#菌丝长而疏松,气生的匍匐菌丝分布在培养基表层(图2a1、a2)。而菌株323#菌丝质地紧密,呈沟纹状(图2b1、b2),但这两种菌继续培养至14 d菌落形态并无明显变化。
“红灯”樱桃上分离的菌株367#、369#和370#在PDA和ME培养基上25 ℃培养7 d后,两种培养基上菌落形态较一致,菌落质地紧密且菌丝较短。比较而言,菌株367#在PDA和ME培养基上培养7 d后,菌丝均长到2/3平板,呈橙黄色(图2c1、c2),14 d后,菌丝颜色均加深并分布在板上的面积增大(图2c3、c4)。而菌株369#在PDA上7 d后已经铺满板,而ME培养基上菌丝长到2/3平板,呈棕褐色(图2d1、d2),但14 d后,菌丝颜色均加深并分布在板上的面积增大(图2d3、d4)。菌株370#在PDA和ME培养基上菌丝零星满板,菌落呈灰绿色(图2e1、e2),14 d后,菌丝颜色均加深并分布在板上的面积增大(图2e3、e4)。
2.2.2 显微形态

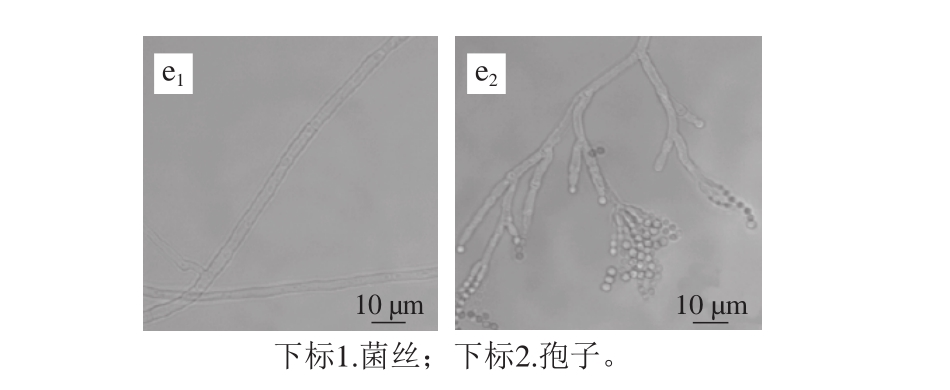
图3 5 株病原菌真菌的显微形态观察
Fig. 3 M orphological characteristics of five pathogenic fungi
图3显示了5种丝状病原真菌在PDA培养基上25 ℃培养7 d后菌丝及孢子形态观察。结果表明,5 株病原菌菌丝均多分枝且内部具有隔膜,菌丝与孢子梗有明显的区别。其中菌株319#、323#、367#和370#菌丝细且着色浅,而菌株369#菌丝较粗且着色深(图3a1~e1)。菌株319#、323#、369#和370#孢子形态各异,而菌株367#未观察到孢子(图3a2~e2)。比较而言,菌株319#分生孢子穗呈球形,黑色或黑褐色,分生孢子梗光滑顶囊膨大,分生孢子粗糙,常具黑褐色条纹(图3a2)。菌株323#菌丝上生出许多横隔,内部灰色,然后从分隔处断裂,产生梭形至椭圆形的双细胞孢子(图3b2)。菌株369#孢子梗有隔膜,顶端分枝,分生孢子单孢、串生且分枝较多,孢子球形或卵形,孢子壁光滑(图3d2)。菌株370#分生孢子梗从菌丝垂直生出,有横隔,顶端生排列成帚状分生孢子串呈不分枝的链状,单个孢子球状、卵圆形或椭圆形,绿色(图3e2)。
本研究分离到的5 株丝状真菌与《真菌鉴定手册》等文献[12-13]中的菌落、菌丝和孢子形态描述进行比较,确定319#属于藻菌纲、毛霉目、毛霉科的根霉属;323#属于子囊菌纲、鹿角菌目、腐皮壳科的腐皮壳属;367#属于壳霉目、杯霉科、黑附球菌,369#属于半知菌类从梗孢目、从梗孢科、串珠霉属的核果褐腐串珠霉;370#属于半知菌类从梗孢目、从梗孢科的青霉属。
2.3 基因组DNA的PCR扩增

图4 5 株病原真菌的ITS区rDNA琼脂糖凝胶电泳检测图谱
Fig. 4 Agarose gel electrophoresis of ITS rDNA sequence of five pathogenic fungi
5 株病原真菌ITS区产物经1%琼脂糖凝胶电泳和紫外检测结果表明,不同菌株序列长度存在差异,其中菌株369#、323#、367#和370#在500~600 bp之间,而菌株319#片段在900 bp左右(图4)。这可能由于rDNA ITS区存在长度和序列多态性[8]。
2.4 构建ITS区r DNA系统进化树分析
将5 株菌株ITS区测序结果在NCBI网站上进行比对,从GenBank数据库中搜索相似度达97%以上的同源序列,通过MEGA 6软件Bootstraps功能计算目的菌株所在进化树各分枝的置信度,发现5 株病原真菌分别属于5个不同的属。


图5 以ITS rDNA基因序列为分子标记的5 株菌株的系统进化树
Fig. 5 Phylogenetic tree for each fungal strain based on ITS rDNA sequence
菌株319#在NCBI网站上比对只出现根霉属,进化树结果表明,319#与匍枝根霉(R. stolonifer)(JQ991620.1)在同一分支上,置信度支持率可达94%(图5a)。
菌株323#序列与腐皮壳属D iaporthe、链格孢属Alternaria、拟茎点霉属Phomopsis相关菌株均具有较高相似度,但与腐皮壳属Diaporthe的一个亚种相似度最高,找相应属的同源序列,对目的序列构建进化树分析,323#与苹果果腐病菌(D. perniciosa)(HQ908492.1)在同一个分支上,通过Bootstraps的验证表明它们的置信度支持率可达75%(图5b)。
菌株367#在NCBI中的比对结果显示只与黑附球菌(E. nigrum)具有很高的相似度,进化树分析结果显示367#与黑附球菌这个种的菌株E. nigrum(GU014950.1)在同一分枝上,与该菌株在进化过程中的亲缘性最近,置信度支持率可达93%(图5c)。
菌株369#在NCB I同源性比对过程中与灰霉属Botrytis、链核盘菌属Monilinia、核盘霉属Sclerotinia相关菌株具有较高相似度,但与链核盘菌属Monilinia相似度最高,找3个属的同源序列,进化树分析结果表明,369#与M. laxa(KC515383.1)在同一分枝上,置信度支持率可达83%(图5d)。
菌株370#在NCBI网站上比对只出现青霉属,构建进化树分析,发现370#为圆孤青霉菌,与菌株P. cyclopium(KJ783269.1)在同一分枝上,且置信度支持率达100%(图5e)。
综上所述,分离得到的5 株病原真菌,rDNA ITS区序列鉴定结果为:菌株319#匍枝根霉(R. stolonifer)、菌株323#苹果果腐病菌(D. perniciosa)、菌株367#黑附球菌(E. nigrum)、菌株369#核果褐腐病菌(M. laxa)和菌株370#圆孤青霉菌(P. cyclopium)。
据报道,樱桃果实的病原菌主要有褐腐病菌[2]、灰霉病菌[4]、链格孢菌[14]、软腐病菌[15]和青霉病菌[16]等,前期的研究中也分离到了灰葡萄病菌(B. cinerea)和链格孢菌(A. a lternata)(结果待发表)。本研究从采后贮藏期间“拉宾斯”樱桃果实上分离到匍枝根霉(R. stolonifer)(菌株319#),何煜波等[15]也从甜樱桃果实上分离到R. stolonifer,且该病原菌还能够引起橘子、梨、葡萄和油桃[17-20]等果实软腐病。此外,本研究分离到的苹果果腐病菌(D. perniciosa)能够侵染采后贮藏期间的苹果果实[21-22],但鲜见该菌侵染采后贮藏期间樱桃果实的报道。
类似地,从“红灯”樱桃果实上分离到的核果链核盘菌(M. laxa)(菌株369#),据报道该病原菌与该属的美澳型核果链核盘菌(M. fructicola)均能侵染桃、杏、油桃和樱桃等核果果实而导致褐腐病[23-25],表明链核盘菌属(Monilinia)中关系较近的这两种真菌的寄主特异性并不明显。
此外,本研究从“红灯”樱桃果实上分离到圆弧青霉(P. cyclopium)(菌株370#),该菌在食品工业中主要用于生产葡萄糖酶,也可侵染苹果、番茄等果实[26-27],而引起樱桃果实青霉病的主要是扩展青霉(P. expansum)[28],但鲜见P. cyclopium侵染樱桃果实的报道。类似的,本研究分离到的黑附球菌(E. nigrum)(菌株367#)可侵染采后脱水干瘪的葡萄果实[29],也可作为拮抗菌来防治桃果实的褐腐病菌[30],但鲜见侵染樱桃果实的报道。
从樱桃上分离得到的5 株病原真菌,结合形态学特征及rDNA ITS区序列进化树分析分别鉴定为匍枝根霉(R. stolonifer)、苹果果腐病菌(D. perniciosa)、黑附球菌(E. nigrum)、核果褐腐病菌(M. laxa)和圆孤青霉(P. cyclopium)。目前鲜见D. perniciosa、E. nigrum和P. cyclopium侵染樱桃果实的报道,为樱桃果实采后贮藏期间分离到的病原真菌。
参考文献:
[1] 宋曰钦, 王建中, 吴迪, 等. 甜樱桃常温液藏保鲜的研究[J]. 食品科技, 2005, 30(11): 70-72. DOI:10.13684/j.cnki.spkj.2005.11.023.
[2] 焦中高, 刘杰超, 王思新. 甜樱桃采后生理与贮藏保鲜[J]. 果树学报,2003, 20(6): 498-502. DOI:10.13925/j.cnki.gsxb.2003.06.019.
[3] 杜小琴, 李杰, 秦文, 等. 甜樱桃果实采后病原菌的分离鉴定及其生物学特性研究[J]. 食品工业科技, 2015, 36(18): 197-202.DOI:10.13386/j.issn1002-0306.2015.18.031.
[4] 张娜, 关文强, 阎瑞香, 等. 甜樱桃果实采后致病菌的分离及定性分析[J]. 中国农学通报, 2012, 28(13): 190-194.
[5] 姚子鹏, 郭晓敏, 王友升, 等. 3 株罗伦隐球酵母的26S rDNAD1/D2区序列、代谢指纹图谱及生防效力比较分析[J]. 食品科学, 2011,32(1): 135-140.
[6] 王友升, 张燕, 何欣萌, 等. 1 株树莓果实采后病原真菌的rDNA ITS 序列及碳源代谢指纹图谱分析[J]. 中国食品学报, 2015, 15(8):224-230. DOI:10.16429/j.1009-7848.2015.08.032.
[7] 王友升, 郭晓敏, 姚子鹏, 等. 1 株桃果实采后病原真菌的鉴定以及碳源代谢指纹图谱分析[J]. 北京工商大学学报(自然科学版), 2011,29(1): 47-53.
[8] 燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志, 18(10): 1958-1961.
[9] CAPPA F, COCCONCELLI P S. Identification of fungi from dairy products by means of 18S rRNA analysis[J]. International Journal of Food M icrobiology, 2001, 69(1): 157-160.
[10] 王友升, 张燕, 陈玉娟. 5 株桃, 李果实采后褐腐病菌鉴定, rDNA ITS序列与碳源代谢指纹图谱分析[J]. 食品科学, 2012, 33(16): 246-250.[11] 王祥红, 汤志宏, 李静. 曲霉菌的分离及其形态观察[J]. 生物学通报,2013, 48(7): 54-55.
[12] 魏景超. 真菌鉴定手册[M]. 上海: 上海科技出版社, 1979: 60-501.
[13] 王宇, 郭良栋. 内生真菌EPICOCCUM N IGRUM的形态与分子鉴定[J]. 菌物学报, 2004, 23(4): 474-479. DOI:10.13346/j.mycosystema.2004.04.005
[14] 赵远征, 刘志恒, 李俞涛, 等. 大樱桃黑斑病病原鉴定及其致病性研究[J]. 园艺学报, 2013, 40(8): 1560-1566. DOI:10.16420/j.issn.0513-353x.2013.08.001.
[15] 何煜波, 王如意, 胡文忠, 等. 樱桃软腐病原菌的分离鉴定和特性分析[C]//中国食品科学技术学会年会, 2010.
[16] 杨娟侠. 二氧化氯对甜樱桃‘红灯’和‘布鲁克斯’贮藏保鲜效果研究[D].泰安: 山东农业大学, 2011.
[17] CAMELE I, DE FEO V, ALTIERI L, et al. An attempt of postharvest orange fruit rot control using essential oils from M editerranean plants[J]. Journal of Medicinal Food, 2010, 13(6): 1515-1523.DOI:10.1089=jm f.2009.0285.
[18] KWON J H, LEE C J. Rhizopus soft rot on pear (Pyrus serotina)caused by Rhizopus stolonifer in Korea[J]. Mycobiology, 2006, 34(3):151-153. DOI:10.4489/MYCO.2006.34.3.151.
[19] DOS SANTOS N S T, AGUIAR A J A A, DE OLIVERIRA C E V, et al.Efficacy of the application of a coating composed of chitosan and Origanum vulgare L. essential oil to control Rhizopus stolonifer and Aspergillus niger in grapes (Vitis labrusca L.)[J]. Food M icrobiology,2012, 32(2): 345-353. DOI:10.1016/j.fm.2012.07.014.
[20] NAVARRO D, DIAZ-MULA H M, GUILLEN F, et al. Reduction of nectarine decay caused by Rhizopus stolonifer, Botrytis cinerea and Penicillium digitatum w ith Aloe vera gel alone or w ith the addition of thymol[J]. International Journal of Food M icrobiology, 2011, 151(2):241-246. DOI:10.1016/j.ijfoodm icro.2011.09.009.
[21] AYUB A, SWINBUME T R. Observations on the infection and rotting of apples var. Bram ley’s Seedliong by Diaporthe perniciosa[J]. Annals of Applied Biology, 1970, 66(2): 245-255.
[22] 李新芳, 王卫芳, 余霞, 等. 广东佛山口岸进境水果检疫及其有害生物疫情分析与防范对策[J]. 植物检疫, 2012, 26(5): 69-75.
[23] 刘志恒, 白海涛, 杨红, 等. 大樱桃褐腐病菌生物学特性研究[J]. 果树学报, 2012, 29(3): 423-427. DOI:10.13925/j.cnki.gsxb.2012.03.002.
[24] BONATERRA A, MARI M, CASALINI L, et al. Biological control of Monilinia laxa and Rhizopus sto lonifer in postharvest of stone fruit by Pantoea agglomerans EPS125 and putative mechanisms of antagonism[J]. International Journal of Food M icrobiology, 2003,84(1): 93-104. DOI:10.1016/S0168-1605(02)00403-8.
[25] BEMAT M, SEGARRA J, XU X M, et al. Influence of temperature on decay, m ycelium development and sporodochia production caused by Monilinia fructicola and M. laxa on stone fruits[J]. Food M icrobiology, 2017, 64: 112-118. DOI:10.1016/j.fm.2016.12.016.
[26] 江彦军, 孙明清, 曹克强. 河北省红富士苹果青霉病病菌种类鉴定[J].中国植保导刊, 2013(1): 15-17.
[27] 田虎, 张继红, 孙和龙, 等. 番茄采后寄生菌的分离鉴定及(E)-2-己烯醛抑菌活性研究[J]. 激光生物学报, 2015, 24(6): 545-550.DOI:10.3969/j.issn.1007-7146.2015.06.010.
[28] DE PAIVA E, SERRADILLA M J, RUIZ-MOYANO S, et al.Combined effect of antagonistic yeast and modified atmosphere to control Penicillium expansum infection in sw eet cherries cv.Ambrunés[J]. International Journal of Food M icrobiology, 2017, 241:276-282. DOI:10.1016/j.ijfoodm icro.2016.10.033.
[29] LORENZINI M, ZAPPAROLI G. Occurrence and infection of Cladosporium, Fusarium, Epicoccum and Aureobasidium in withered rotten grapes during post-harvest dehydration[J]. Antonie van Leeuwenhoek, 2015,108(5): 1171-1180. DOI:10.1007/s10482-015-0570-8.
[30] DE CAL A, LARENA I, LINAN M, et al. Population dynam ics of Epicoccum nigrum, a biocontrol agent against brown rot in stone fruit[J]. Journal of App lied M icrobiology, 2009, 106(2): 592-605.DOI:10.1111/j.1365-2672.2008.04030.x.
Morphological Characterization and rDNA ITS Sequence Analysis of Five Pathogenic Fungi Isolated from Cherry Fruits
YAO Ting, HUANG Jinjin, REN Xiangfeng, ZHANG Yan, HE Xinmeng, WANG Yousheng*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Laboratory for Food Quality and Safety,Beijing Technology & Business University (BTBU), Beijing 100048, China)
Abstract:Five fungal strains isolated from naturally infected cherry fruit were purified, re-inoculated and identified as pathogens of cherry fruits. The results of morphological characterization and ribosomal DNA internal transcribed spacer(rDNA-ITS) analysis showed that strain 319#, 323#, 367#, 369#and 370#were identified as Rhizopus stolonifer, Diaporthe perniciosa, Epicoccum nigrum, Monilinia laxa and Penicillium cyclopium, respectively. In this study, D. perniciosa,E. nigrum and P. cyclopium were isolated from cherry fruits for the fi rst time.
Key words:cherry fruit; pathogenic fungi; morphological characterization; rDNA ITS sequence analysis
DOI:10.7506/spkx1002-6630-201722012
中图分类号:Q93-331
文献标志码:A
文章编号:1002-6630(2017)22-0074-06
引文格式:
姚婷, 黄津津, 任向峰, 等. 5 株樱桃果实采后病原真菌分离及rDNA ITS区序列分析[J]. 食品科学, 2017, 38(22): 74-79.
DOI:10.7506/spkx1002-6630-201722012. http://www.spkx.net.cn
YAO Ting, HUANG Jinjin, REN Xiangfeng, et al. Morphological characterization and rdna its sequence analysis of five pathogenic fungi isolated from cherry fruits[J]. Food Science, 2017, 38(22): 74-79. (in Chinese w ith English abstract)DOI:10.7506/spkx1002-6630-201722012. http://www.spkx.net.cn
收稿日期:2017-05-15
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B06);国家自然科学基金面上项目(31471626)
作者简介:姚婷(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:yaoting0127@163.com
*通信作者:王友升(1976—),男,教授,博士,研究方向为果蔬绿色保鲜及其高值化。E-mail:wangys@btbu.edu.cn