表1 感官评分细则
Table 1 Criteria for sensory evaluation of fermented app le juice

李维妮,张宇翔,魏建平,袁亚宏,韩晓江,岳田利*
(西北农林科技大学食品科学与工程学院,陕西 杨陵 712100)
摘 要:以红富士苹果为原料,进行乳酸菌发酵苹果汁工艺条件优化并分析发酵期间苹果汁有机酸的变化。选择Lactobacillus paracasei 20241、Bifidobacterium animalis 6165、Streptococcus thermophilus 6063和Lactobacillus acidophilus 6005混合发酵苹果汁,以活菌数和感官评分为主要指标,在单因素试验基础上进行响应面优化试验,研究不同的菌种比例、接种量、发酵时间等对苹果汁活菌数和感官评分的影响。结果表明,乳酸菌发酵苹果汁的优化工艺条件为菌种比例1∶1∶1∶1、接种量2%、发酵时间24 h、发酵温度37 ℃,在此条件下得到的活菌数为1.985×108CFU/m L,感官评分为80.23 分。采用最佳工艺条件发酵苹果汁,利用高效液相色谱法对发酵过程中苹果汁有机酸的变化情况进行分析,结果表明:经过发酵后,苹果酸和琥珀酸含量下降明显(P<0.05),而乳酸、奎宁酸、柠檬酸、酒石酸、丙酮酸和莽草酸含量均显著提高(P<0.05)。
关键词:乳酸菌;苹果汁;发酵;工艺优化;有机酸
乳酸菌是一类可发酵糖类产生乳酸的细菌的统称,在人体内可帮助机体消化,是益生菌的重要组成部分。研究表明,食品中加入益生菌有益于健康,可提高免疫力,维持肠道微生态平衡和降低患癌风险[1]。果蔬中所含糖类、无机盐、维生素等均易被人体吸收,是重要的营养物质[2]。
苹果汁富含多种营养成分,其中,苹果酸是最主要的有机酸,还有奎宁酸、莽草酸、柠檬酸和琥珀酸等[3],是良好的生理碱性食品[4]。
目前,有许多国内外学者对乳酸菌发酵果蔬汁进行研究。在工艺优化方面,崔莉等[5]利用肠膜明串珠菌和植物乳杆菌按2∶1的比例混合后发酵黄秋葵汁后活菌数可达108CFU/m L,优化工艺条件为接种量5%、发酵温度35 ℃和发酵时间72 h。张晓等[6]利用植物乳杆菌、短乳杆菌和鲁氏酵母混合发酵芹菜汁,通过优化试验得到最佳工艺条件为菌种比例2∶2∶1、接种量7%和发酵温度30 ℃,此条件下乳酸菌活菌数可达1.78×108CFU/m L。王凯旋等[7]利用乳酸菌LAB-5发酵桑葚汁,以乳酸产量为响应值,确定的最佳发酵工艺为发酵时间6.85 h、发酵温度35 ℃和接种量3.13%,有效提升了乳酸产量。刘磊等[8]采用梯度浓度驯化法将保加利亚乳杆菌和嗜热链球菌以1∶1的比例接入龙眼汁中,经响应面法得到最佳工艺条件为发酵时间12 h、发酵温度45 ℃、接种量3%和脱脂奶粉添加量5%,有效提升了龙眼汁的酸度,并且使得其挥发性风味植物发生显著变化。在有机酸方面,Herrero等[9]研究2 种不同温度下酵母菌和苹果酸乳酸菌混合发酵苹果汁,受到温度的影响,苹果酸在发酵过程中被完全代谢,且在苹果酸下降结束后乳酸也开始下降,而乙酸则大量生成。Leila等[10]将酵母菌和乳酸菌混合发酵苹果酒,当酵母衰亡后,乳酸菌活菌数达到最大,在酒精发酵阶段苹果酸被完全消耗,而乳酸发酵过程中一直有乳酸生成。
由于我国对果蔬的加工利用率低,造成了极大浪费,而果蔬发酵饮料则为果蔬资源的加工利用提供了一条有效的解决途径[11]。乳酸菌进行苹果酸-乳酸发酵,不仅赋予果蔬汁更好的发酵风味,而且使果蔬汁具有能调节人体肠道微环境的功效,并提高矿质元素的吸收利用,增强免疫力等[12-13]。相关研究表明,通过乳酸菌发酵果蔬汁可产生一些功能性物质,如与抗氧化作用密切相关的多酚类化合物[14-15]、含量极低且不可缺少的维生素[16]等。目前,各种果蔬汁和果酒不断涌现,果蔬发酵汁已由单一原料、单一发酵剂发展至现在的多种原料、多种复合发酵剂[17],多菌协同发酵能够赋予果蔬汁更优的风味和口感。但所选菌种数较少,范围较窄,多为单菌发酵或双菌发酵,且在国内外,在乳酸菌发酵过程中对有机酸进行具体分析方面的报道很少。
本实验以红富士苹果为主要原料,利用副干酪乳杆菌、动物双歧杆菌、嗜热链球菌和嗜酸乳杆菌协同发酵苹果汁,研究不同菌种比例、接种量和发酵时间对苹果汁活菌数和感官评分的影响,在单因素试验的基础上进行响应面优化试验,并对苹果汁中的有机酸进行动态监测。旨在研制出一种富含能够调节人体肠道功能的乳酸菌苹果汁,不仅拓宽了对乳酸菌的选择,还优化了发酵工艺条件并分析出有机酸的具体变化,为乳酸菌在发酵果蔬汁方面的应用提供理论依据。
1.1 材料与试剂
红富士苹果(Malus pumila M ill.)购于陕西杨凌,9月中下旬采摘,大小均一,无机械损伤,无病害或腐烂。
副干酪乳杆菌20241(Lactobacillus paracasei)、动物双歧杆菌6165(Bifidobacterium animalis)、嗜热链球菌6063(Streptococcus thermophilus)、嗜酸乳杆菌6005(Lactobacillus acidophilus),保存于西北农林科技大学食品科学与工程学院食品发酵工程与食品安全实验室。
MRS肉汤培养基 北京奥博星生物技术有限责任公司;有机酸标准品苹果酸、乳酸、柠檬酸,莽草酸、奎宁酸、丙酮酸、琥珀酸、酒石酸(纯度≥98%) 上海源叶生物科技有限公司;磷酸铵、磷酸(均为色谱纯)美国Sigma-Aldrich公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
2000JP-1型离心果汁机 南通金橙机械有限公司;YXQ-LS-70A型立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;YT-CJ-2ND型超净工作台北京亚泰科隆仪器技术有限公司;HWS-80型智能恒温恒湿箱 宁波海曙赛福实验仪器厂;超纯水机 上海优普实业有限公司;LC-15C高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 苹果汁的制备
挑选→清洗→去核→切块→榨汁→护色→酶解→抽滤→调酸→-20 ℃冷冻待用
1.3.2 苹果汁的发酵
将保存于甘油管的4 株乳酸菌分别置于MRS液体培养基中进行活化,于37 ℃无菌环境下静置培养24 h。再分别接种于100 m L苹果汁种子液中,于37 ℃静置培养18 h,活菌数约达1×107CFU/m L,将副干酪乳杆菌20241、动物双歧杆菌6165、嗜热链球菌6063和嗜酸乳杆菌6005 4株菌分别按照不同的配比方式,以不同的接种量接种于500 m L苹果汁中,于37 ℃静置发酵不同时间,发酵结束后置于-20 ℃冰箱下保存待用。
1.3.3 苹果汁活菌数测定和感官评定
活菌数按倾注平板法计数[18]。为了评价不同的发酵方式对苹果汁感官品质的影响,由20 名专业的老师和学生组成感官评定小组,从色泽、体态、香气和口感4 个方面对各个苹果汁样品进行评分。评分细则如表1所示。
表1 感官评分细则
Table 1 Criteria for sensory evaluation of fermented app le juice

1.3.4 乳酸菌发酵苹果汁工艺条件的单因素试验设计
1.3.4.1 发酵温度的确定
经处理的苹果汁,初始糖度为14.03 °Brix,pH值为5.85,将副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌按照1∶1∶1∶1的菌种比例接入苹果汁中,接种量为3%,分别在31、33、35、37、39、41 ℃发酵26 h,比较各苹果汁的活菌数和感官评分。
1.3.4.2 菌种比例的确定
经处理的苹果汁,初始糖度为14.03 °Brix,pH值为5.85,分别将副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌按照1∶2∶1∶2、2∶2∶1∶1、1∶1∶1∶1、1∶1∶2∶2、2∶1∶2∶1、1∶2∶2∶1的菌种比例接入苹果汁中,接种量为3%,37 ℃发酵26 h,比较各苹果汁的活菌数和感官评分。
1.3.4.3 接种量的确定
经处理的苹果汁,初始糖度为14.03 °Brix,pH值为5.85,将副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌按照1∶1∶1∶1的菌种比例接入苹果汁中,接种量分别为1%、2%、3%、4%、5%、6%、7%,37 ℃发酵26 h,比较各苹果汁的活菌数和感官评分。
1.3.4.4 发酵时间的确定
经处理的苹果汁,初始糖度为14.03 °Brix,pH值为5.85,将副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌按照1∶1∶1∶1的菌种比例接入苹果汁中,接种量为3%,在37 ℃分别发酵21、22、23、24、25、26、27、28、29、30 h,比较各苹果汁的活菌数和感官评分。
1.3.5 乳酸菌发酵苹果汁的响应面优化试验
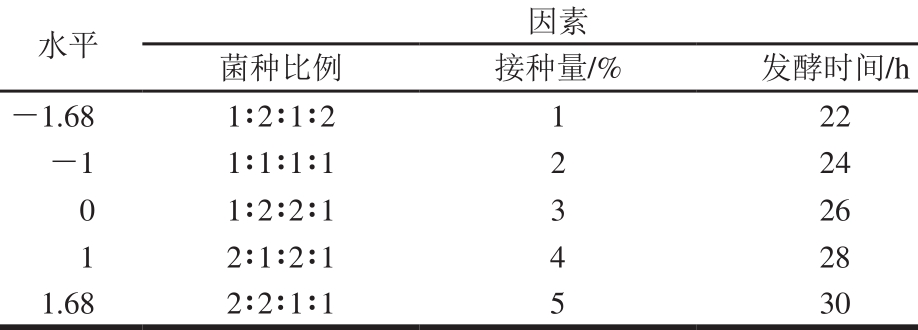
在单因素试验分析结果的基础上,采用中心组合试验(center combination design,CCD)设计方法,选择菌种比例、接种量和发酵时间这3个影响较大的因素,设计三因素五水平响应面试验,以活菌数和感官评分为响应值进行优化。两个响应值所占权重各为50%。试验设计见表2。
表2 CCD试验因素与水平
Table 2 Factors and their levels used for central com posite design
1.3.6 有机酸测定
参照Y E M engq i等[19]的方法并在此基础上改进。取1 m L发酵苹果汁,经0.45 μm滤膜过滤后进行色谱分析。色谱条件:W aters xTerra M S C18色谱柱(250 mm×4.6 mm,5 μm);流动相0.01 m o l/L(NH4)3PO4,用H3PO4调pH值至2.70;洗脱程序为等度洗脱;样品过0.45 μm有机系滤膜;流速0.7 m L/m in;检测波长210 nm;柱温30 ℃;进样量10 μL。
1.4 数据处理方法
所有实验重复3 次,采用Origin 9.0软件作图,用SPSS 22.0软件进行方差显著性分析。
2.1 苹果汁发酵条件的单因素试验
2.1.1 发酵温度对苹果汁活菌数及感官评分的影响
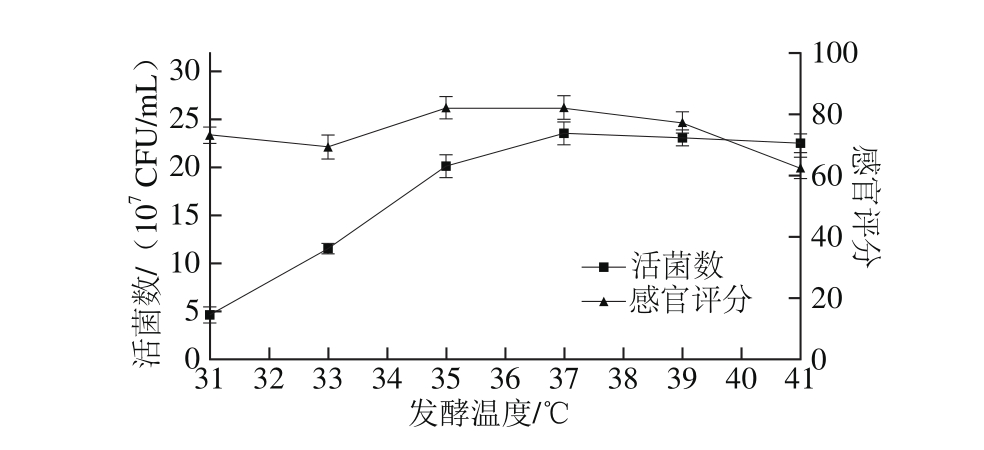
图1 发酵温度对活菌数和感官评分的影响
Fig. 1 Effect of different tem perature on viable count and sensory evaluation
如图1所示,当发酵温度较低时,乳酸菌生长和繁殖速度较慢,活菌数随着温度的升高而显著增加(P<0.05)。当温度高于37 ℃时,苹果汁的活菌数变化不明显(P>0.05)。在35~39 ℃时,感官评分差异不显著(P>0.05),而温度过高对苹果汁的风味和口感也会有所影响。当发酵温度为37 ℃时,苹果汁的活菌数为23.6×107CFU/m L,感官评分为82 分。综合考虑选择37 ℃为最佳温度。
2.1.2 菌种比例对苹果汁活菌数及感官评分的影响
如图2所示,当副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌比例为1∶2∶2∶1时苹果汁的活菌数最多,为29.9×107CFU/m L,显著高于其他组(P<0.05)。当菌种比例为1∶1∶1∶1时感官评分最高,为80 分。为进一步检验不同菌种比例对苹果汁活菌数和感官评分的影响是否显著,对试验结果进行单因素方差分析,结果P值均小于0.01,不同菌种比例下的活菌数和感官评分差异极显著。因此在该单因素试验中,综合考虑后选择副干酪乳杆菌、动物双歧杆菌、嗜热链球菌、嗜酸乳杆菌比例为1∶2∶2∶1为最佳比例,并确定1∶2∶2∶1、2∶1∶2∶1、1∶1∶1∶1、2∶2∶1∶1和1∶2∶1∶2的菌种比例作为下一步工艺优化的5 个水平。
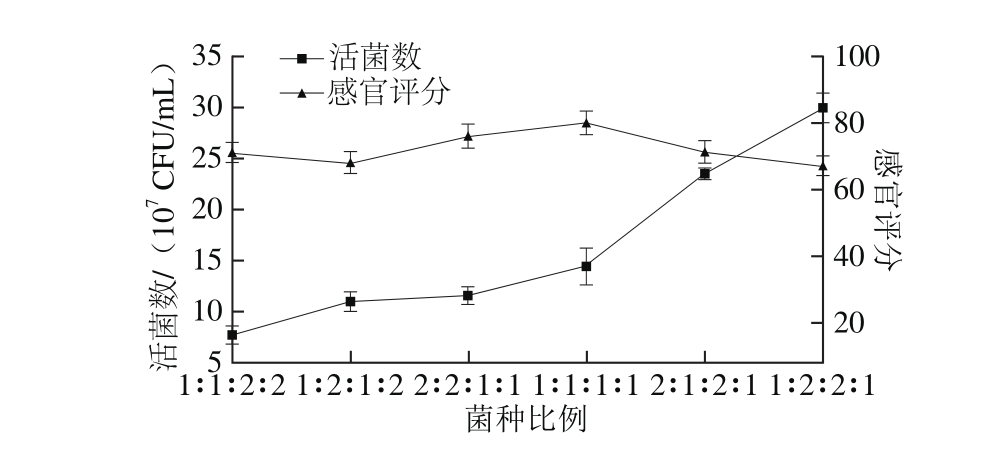
图2 菌种比例对活菌数和感官评分的影响
Fig. 2 Effect of ratio among probiotic strains on viable count and sensory evaluation
2.1.3 接种量对苹果汁活菌数及感官评分的影响
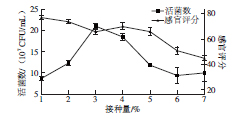
图3 接种量对活菌数和感官评分的影响
Fig. 3 Effect of inoculum size on viab le count and sensory evaluation
如图3所示,当接种量在1%~3%时,活菌数随接种量的增加呈明显上升的趋势(P<0.05)。当接种量为3%时,苹果汁的活菌数为最高,达21.0×107CFU/m L,显著高于其他组(P<0.05)。当接种量大于3%时,活菌数呈逐渐下降趋势。从整体来看,感官评分随着接种量的增大呈现出逐渐减少的趋势。采用方差分析法对苹果汁的活菌数和感官评分进行显著性分析,结果接种量对活菌数和感官评分均极显著(P<0.01)。考虑节约成本、简便操作等因素,选择接种量为3%,并且选择1%、2%、3%、4%和5%的接种量作为下一步工艺优化的5 个水平。
2.1.4 发酵时间对苹果汁活菌数及感官评分的影响
如图4所示,发酵至21~26 h时,苹果汁活菌数升高较快,并且在发酵26 h时达到最大值30.0×107CFU/m L,之后则呈下降趋势,相对应的感官评分也降低,可见发酵时间过长会对苹果汁的风味和口感有所影响。为进一步检验发酵时间对苹果汁活菌数和感官评分的影响是否显著,对试验结果进行单因素方差分析,结果表明发酵时间对两者有极显著影响(P<0.01)。综合考虑,选择26 h为最佳发酵时间,并选择22、24、26、28 h和30 h的发酵时间作为下一步工艺优化的5 个水平。
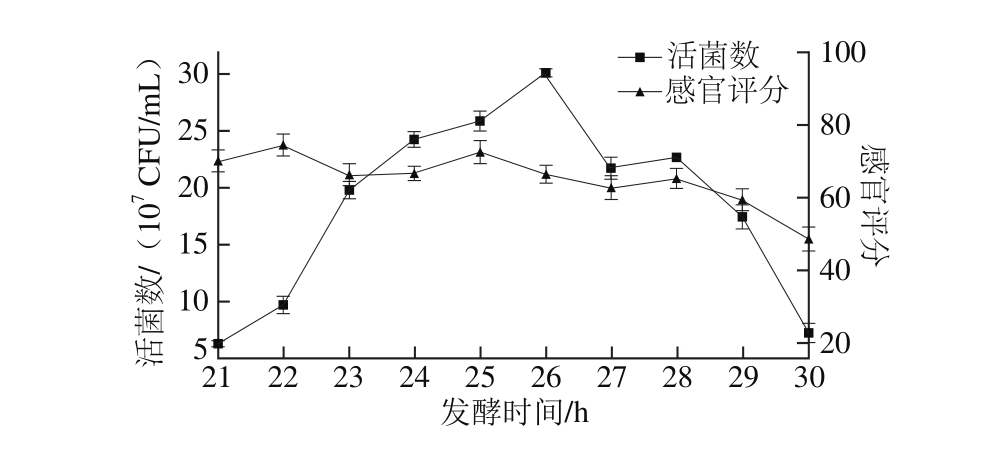
图4 发酵时间对活菌数和感官评分的影响
Fig. 4 Effect of fermentation time on viable count and sensory evaluation
2.2 CCD响应面优化
2.2.1 优化结果和方差分析
利用Design-Expert软件对表3中的试验数据进行整理分析,得到活菌数(Y1)和感官评分(Y2)对自变量菌种比例(A)、接种量(B)、发酵时间(C)的回归方程分别为:Y1=15.41-3.45A-0.62B-1.06C+2.79AB+1.87AC+2.76BC-0.77A2-3.29B2-2.46C2。Y2=73.96+0.64A-0.47B-0.52C+3.00AB+0.93AC-1.30BC+1.59A2+0.034B2-0.21C2。
表3 CCD试验设计及结果
Table 3 Central com posite design w ith experimental results

由表4和表5可知,2 个模型中P值均小于0.01,说明本试验所选用的二次多项模型差异极显著。失拟项不显著(P>0.05)。模型决定系数R2(活菌数)值为0.992 2,R2(感官评分)值为0.991 0,说明活菌数和感官评分的实测值与预测值之间具有较好的拟合度,所以该模型拟合效果较好,可以用此模型分析和预测乳酸菌发酵苹果汁的主发酵工艺。在响应值为活菌数的模型中,A(菌种比例)、B(接种量)、C(发酵时间)及AB、AC、BC的交互作用及二次项A2、B2、C2对苹果汁活菌数的影响极显著。在响应值为感官评分的模型中,A(菌种比例)、B(接种量)、C(发酵时间)及AB、AC、BC的交互作用及A2对苹果汁感官评分的影响极显著,B2和C2对其影响则不显著。
2.2.2 因素间交互作用分析
由图5可知,根据等高线的形状可以明显地反映出试验因素之间交互作用显著性的强弱,例如菌种比例、接种量、发酵时间及其交互作用对响应值的影响。当等高线的形状为椭圆形或马鞍形时,说明其交互作用显著;当等高线的形状为圆形时,说明其交互作用不显著[20]。在交互作用对苹果汁的活菌数和感官评分影响中,菌种比例、接种量和发酵时间两两因素交互项均产生了显著影响。
表4 活菌数的方差分析
Tab le 4 Analysis of variance of viable count
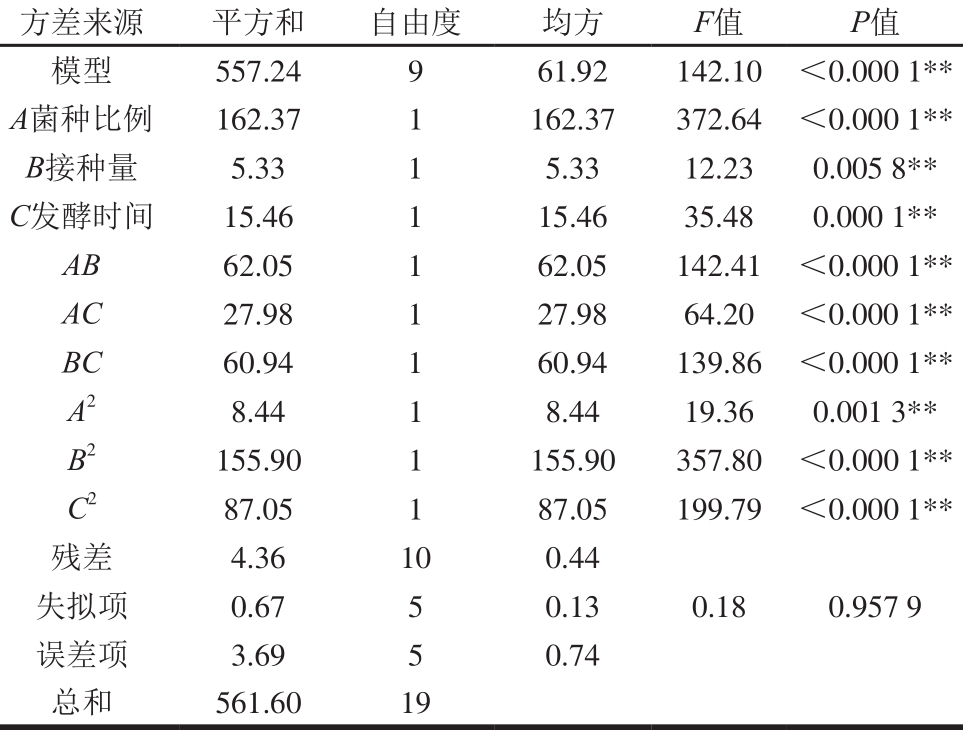
注:**. P<0.01,差异极显著。下表同。
表5 感官评分的方差分析
Table 5 Analysis of variance of sensory evaluation

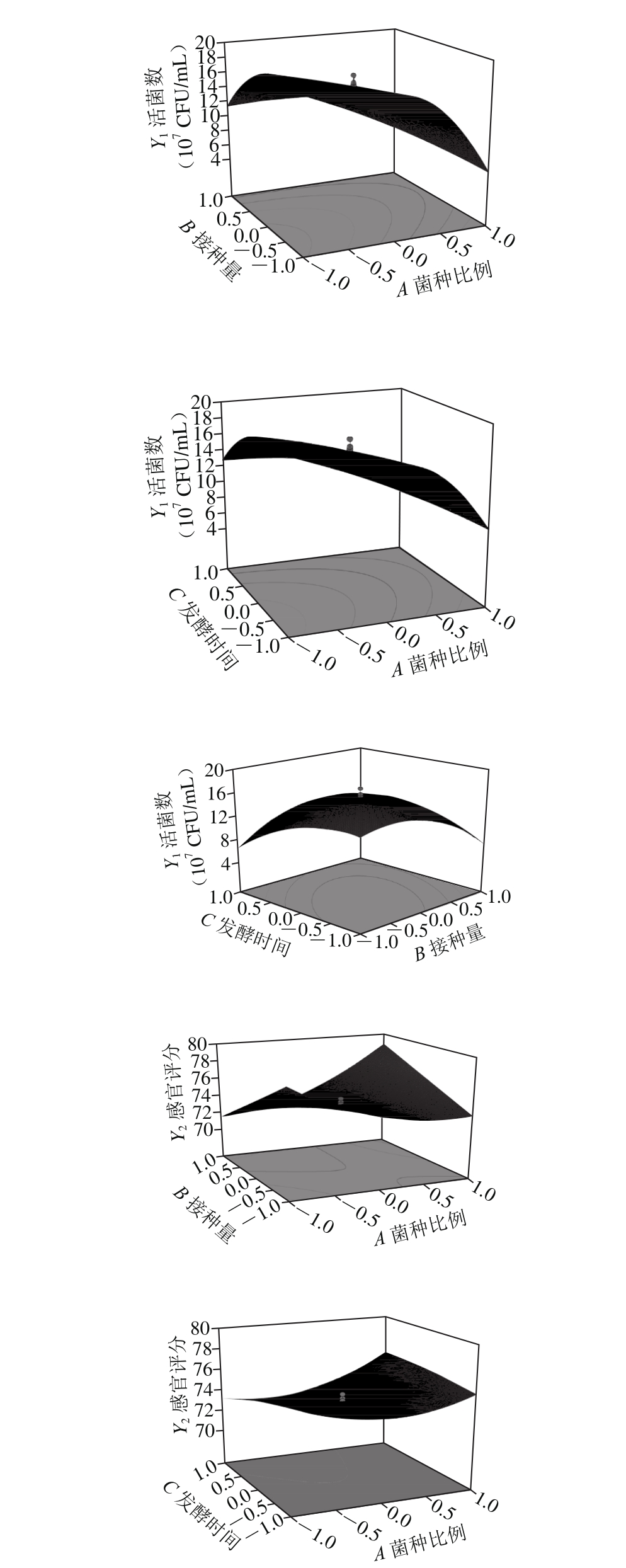
2.2.3 模型验证实验结果
通过该回归方程求得优化后的最佳工艺参数为副干酪乳杆菌∶动物双歧杆菌∶嗜热链球菌∶嗜酸乳杆菌菌种比例1∶1∶1∶1、接种量2%、发酵时间24 h,此条件下发酵得到的苹果汁活菌数预测值为21.44×107CFU/m L,感官评分为78.35分。在此条件下进行验证实验,结果显示,该条件下发酵得到的苹果汁的活菌数为19.85×107CFU/m L,与预测值相比误差为7.4%,感官评分为80.23 分,与预测值相比误差为2.4%,可见通过响应面优化方法得到的苹果汁最佳工艺条件比较可靠。
2.3 最佳发酵条件下苹果汁有机酸的动态变化
苹果汁富含多种有机酸,还可在发酵中产生,这些有机酸的种类和含量对苹果汁发酵后的感官品质有着重要的影响[21]。果汁中的有机酸不仅对果汁的感官特性、稳定性、可接受性和营养品质上有重要影响[22-23],还能避免或抑制许多引起果汁腐败的潜在有害微生物的生长[24]。采用上述所得最佳工艺条件对苹果汁进行发酵,并用高效液相色谱法监测发酵过程中苹果汁各有机酸的变化趋势。在苹果汁发酵过程中,共监测了8 种常见有机酸的变化情况。
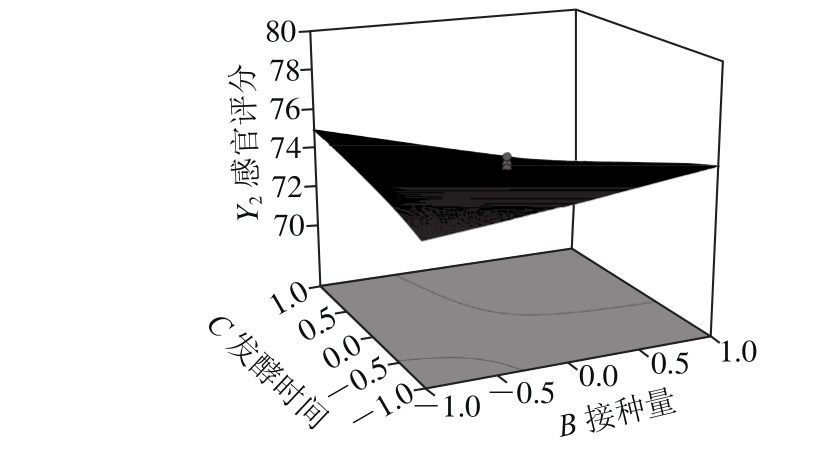
图5 不同因素交互作用对苹果汁活菌数和感官评分影响的响应面图
Fig. 5 Response surface plots showing the interactive effects of different factors on viable count and sensory evaluation of app le juice
表6 发酵过程中各有机酸含量的变化
Table 6 Changes in organic acids contents during fermentation
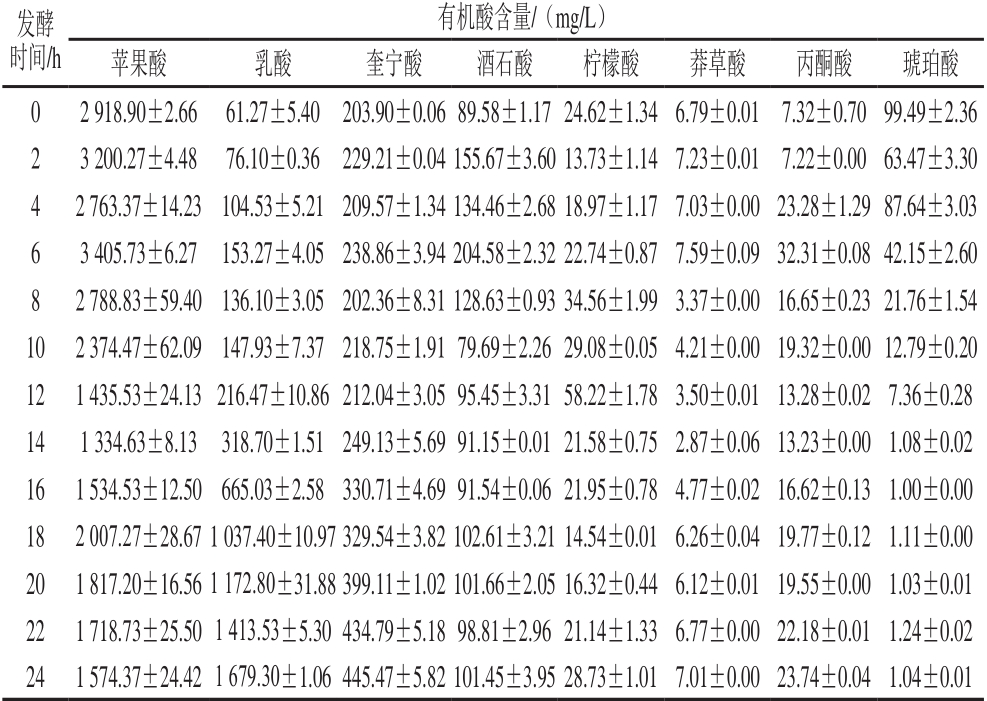
苹果酸是苹果汁中最重要且含量最高的一种有机酸,乳酸菌在发酵过程中,不但利用苹果酸合成乳酸等多种物质,而且利用其他物质合成苹果酸。如表6所示,苹果汁中苹果酸的初始质量浓度为2 918.90 mg/L,发酵6 h后含量达到最大值,之后迅速下降,这可能是由于乳酸菌在进行苹果酸-乳酸发酵时分解了苹果酸。发酵期间,乳酸菌进行三羧酸循环,作为生物体三羧酸循环的中间体,苹果酸参与多个不同的生化反应,所以其含量处在动态变化中。随着反应的进行,苹果酸被分解为其他物质而导致含量下降,发酵结束时的最终质量浓度为1 574.36 mg/L,较发酵前含量显著降低(P<0.05),这与Herrero等[9]利用乳酸菌和酵母混合发酵所得苹果汁中苹果酸含量显著下降的结果相吻合。乳酸也是苹果汁中重要的有机酸,乳酸初始质量浓度为61.26 mg/L,在发酵初期,乳酸含量变化不大,随着乳酸菌的数量增多,在乳酸菌进行苹果酸-乳酸发酵过程中,苹果酸向乳酸转变,且苹果汁中的葡萄糖经糖酵解途径降解成丙酮酸,后者在乳酸脱氢酶的作用下,直接被还原为乳酸,从而导致乳酸含量不断升高。发酵结束时,乳酸含量达到最高值1 679.3 mg/L,较发酵前显著升高(P<0.05),这与Ellendersen等[25]利用干酪乳杆菌发酵苹果汁过程中乳酸的变化趋势相似。
奎宁酸是苹果汁中含量较高的高等植物特有的脂环族有机酸,在苹果汁中的含量仅次于苹果酸。如表6所示,发酵开始时,奎宁酸的质量浓度为203.90 mg/L,发酵前12 h变化大,之后奎宁酸含量迅速上升,至发酵结束质量浓度达最大值445.47 mg/L,较发酵前含量显著升高(P<0.05)。柠檬酸是三羧酸循环的中间代谢产物,含量处于动态变化中,在苹果汁中的初始含量为24.62 mg/L,含量上升至12 h时达最大值,之后又逐渐下降,可能是由于苹果酸-乳酸发酵过程中乳酸菌将柠檬酸分解成丙酮酸和乙酸,也有转化为乳酸的现象,其代谢中间产物还能产生乙偶姻和双乙酰等风味化合物[26],这些物质对苹果汁的风味有较大影响。发酵结束时质量浓度为28.73 mg/L,较发酵前显著升高(P<0.05),而郑欣等[27]利用多种乳酸菌混合发酵荔枝汁后柠檬酸没有显著变化(P>0.05)。
莽草酸代谢存在于大量高等植物和微生物中,以莽草酸作为中间体,在生物体内合成分解,生成其他物质[28]。莽草酸在苹果汁中含量较低,如表6所示,发酵开始时其含量为6.80 mg/L,发酵过程的变化趋势较平稳,这与Herrero等[9]研究的苹果酸乳酸菌协同酵母发酵苹果汁中奎宁酸的变化趋势相似。发酵结束时含量为7.01 mg/L,较发酵前含量显著升高(P<0.05)。
琥珀酸在苹果酸-乳酸途径中,可通过部分丙酮酸氧化为乙酸和H+,H+再将延胡索酸还原得到琥珀酸。另一方面,也可通过酒石酸分解而生成,但生成量较少[26]。Dudley等[29]研究表明,乳酸菌能够利用三羧酸循环产生的柠檬酸合成琥珀酸,同时还会产生乳酸等有机酸,直接影响果汁的酸味。如表6所示,琥珀酸在苹果汁中的初始含量为99.49 mg/L,发酵14 h后一直处在较低水平,结束时质量浓度为1.04 mg/L,较发酵前含量显著降低(P<0.05)。酒石酸在苹果汁中的初始质量浓度为89.58 mg/L。发酵6 h时达最高值,之后呈下降趋势,酒石酸能够被乳酸菌降解生成乳酸和乙酸,使挥发酸含量增加[30]。发酵结束时,酒石酸含量为101.45 mg/L,较发酵前显著升高(P<0.05)。丙酮酸是糖酵解、苹果酸-乳酸发酵、三羧酸循环等生物体基本代谢途径的中间产物。如表6所示,初始质量浓度为7.32 mg/L,发酵6 h后达到最大值,之后呈下降趋势,这可能是由于在厌氧条件下,所有的乳酸菌都能代谢丙酮酸而产生乙酸、乳酸和双乙酰等产物[26]。发酵结束时质量浓度为23.74 mg/L,较发酵前含量显著升高(P<0.05)。
苹果汁发酵过程中,苹果酸、酒石酸和丙酮酸均在发酵6 h时达到最大值,柠檬酸则是在发酵12 h时达到最大值;此外,乳酸和奎宁酸均一直处于上升趋势,在发酵结束时达到最大值;而莽草酸的质量浓度波动不大,没有明显的最大值,琥珀酸则处于下降趋势,发酵结束质量浓度较低。除了苹果酸和琥珀酸经过发酵后含量显著下降(P<0.05)外,其他有机酸的含量均显著升高(P<0.05)。
利用副干酪乳杆菌20241、动物双歧杆菌6165、嗜热链球菌6063和嗜酸乳杆菌6005 4 株菌发酵红富士苹果汁,通过单因素试验,选择37 ℃为发酵温度。在苹果汁发酵过程中,菌种比例、接种量、发酵时间对苹果汁活菌数和感官评分均有显著影响。通过响应面优化所得苹果汁发酵的最佳工艺条件为副干酪乳杆菌20241、动物双歧杆菌6165、嗜热链球菌6063和嗜酸乳杆菌6005菌种比例1∶1∶1∶1、接种量2%、发酵时间24 h,在此条件下得到的活菌数为19.85×107CFU/m L,感官评分为80.23分。采用高效液相色谱法检测最佳发酵条件下苹果汁有机酸的变化情况,其中苹果酸和琥珀酸经发酵后含量下降明显(P<0.05),而乳酸、奎宁酸、柠檬酸、酒石酸、丙酮酸和莽草酸含量均显著提高(P<0.05)。
参考文献:
[1] YOON K Y, WOODAMS E E, HANG Y D. Production of probiotic cabbage juice by lactic acid bacteria[J]. Bioresource Technology,2006, 97: 1427-1430. DOI:10.1016/j.biortech.2005.06.018.
[2] 安兴娟, 张瑶, 姬阿美, 等. 植物乳杆菌发酵枸杞胡萝卜汁工艺的优化[J]. 天津科技大学学报, 2016, 31(3): 20-24. DOI:10.13364/j.issn.1672-6510.20150029.
[3] FILEKI T, PELAYO E, PALABAY R B. Carboxylic acid composition of varietal juices produced from fresh and stored apples[J]. Journal of Agricultural and Food Chem istry, 1995, 43(3): 598-607. DOI:10.1021/jf00051a009.
[4] 原德树. 液态深层发酵苹果醋及苹果醋饮料的研制[J]. 现代食品科技, 2010, 26(5): 523-526. DOI:10.3969/j.issn.1673-9078.2010.05.026.[5] 崔莉, 李大婧, 刘春泉, 等. 黄秋葵汁乳酸菌混菌发酵条件优化[J].食品科学, 2015, 36(23): 205-208. DOI:10.7506/spkx1002-6630-201523038.
[6] 张晓, 夏延斌. 乳酸菌和酵母菌复合发酵芹菜汁制备泡菜母液条件的优化[J]. 湖南农业大学学报, 2013, 39(2): 204-208.
[7] 王凯旋, 张健, 王俊, 等. 应用双响应曲面法优化乳酸菌发酵桑葚汁的生产工艺条件[J]. 蚕业科学, 2013, 39(4): 763-770.
[8] 刘磊, 汪浩, 张名位, 等. 龙眼乳酸菌发酵工艺条件优化及其挥发性风味物质变化[J]. 中国农业科学, 2015, 48(20): 4147-4158.DOI:10.3864/j.issn.0578-1752.2015.20.014.
[9] HERRERO M, GARCIA L A, DIAZ M. Organic acids in cider w ith simultaneous inoculation of yeast and malolactic bacteria: effect of fermentation temperature[J]. Journal of the Institute of Brew ing, 1999,105(4): 229-232. DOI:10.1002/j.2050-0416.1990.tb00023.x.
[10] DIERINGS L R, BRAGA C M, SILVA K M D , et al. Population dynam ics of m ixed cultures of yeast and lactic acid bacteria in cider conditions[J]. Brazilian Archives of Biology and Technology, 2013,56(5): 837-847. DOI:10.1590/s1516-89132013000500016.
[11] 赵蓓, 李锋. 发酵型复合果蔬乳饮料的制备工艺研究[J]. 食品安全导刊, 2015(6): 131-134.
[12] 牛墨, 孟祥晨. 复合发酵苹果山药果蔬汁优良乳酸菌菌株的筛选[J].食品工业科技, 2012, 33(14): 242-246.
[13] ELMADFA L, KLEIN P, MEYER A. Immune-stimulating effects of lactic acid bacteria in vivo and in vitro[J]. Proceedings of the Nutrition Society, 2010, 69(3): 416-420. DOI:10.1017/s0029665110001710.
[14] FILANNINO P, AZZI L, CAVOSKI I, et al. Exploitation of the healthpromoting and sensory properties of organic pomegranate (Punica granatum L.) juice through lactic acid fermentation[J]. International Journal of Food M icrobiology, 2013, 163(2/3): 184-192. DOI:10.1016/j.ijfoodm icro.2013.03.002.
[15] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chem istry, 2014,160(10): 346-356. DOI:10.1016/j.foodchem.2014.03.112.
[16] CAPOZZI V, MENGA V, DIGESU A M, et al. Biotechno logy p roduction o f vitam in B2-enriched bread and pasta[J]. Journal of Agricultural and Food Chem istry, 2011, 59(14): 8013-8020.DOI:10.1021/jf201519h.
[17] 尹曼, 王一侠, 魏颖, 等. 复合果蔬乳酸菌发酵产物分析及功能性评价[J]. 食品工业, 2016, 37(11): 215-219.
[18] 国家食品药品监督管理总局. 食品微生物学检验 乳酸菌检验: GB 4789.35—2016[S]. 北京: 中国标准出版社, 2016: 1-8.
[19] YE M Q, YUE T L, YUAN Y H. Evolution of polyphenols and organic acids during the fermentation of apple cider[J]. Journal of the Science of Food and Agriculture, 2014, 94(14): 2951-2957.DOI:10.1002/jsfa.6639.
[20] MURALIDHAR R V, CHIRUMAM ILA R R, MARCHANT R, et al.A response surface approach for the comparison of lipase production by Candida cylindracea using tw o different carbon sources[J].Biochem istry Engineering Journal, 2001, 9(1): 17-23. DOI:10. 1016/s1369-703x(01)00117-6.
[21] RAAMON-PORTUGAL F, SEILLER L, TAILLANDIER P, et al.K inetics of production and consumption of organic acids during alcoholic fermentation by Saccharomyces cerevisae[J]. Food Technology and Biotechnology, 1999, 37(4): 235-240.
[22] SHUI G, LEONG L P. Separation and determ ination of organic acids and phenolic compounds in fruit juices and drinks by highperformance liquid chromatography[J]. Journal of Chromatography A,2002, 977: 89-96. DOI:10.1016/s0021-9673(02)01345-6.
[23] SOYER Y, KOCA N, KARADENIZ F. Organic acid profi le of Turkish white grapes and grape juices[J]. Journal of Food Composition and Analysis, 2003, 16: 629-636. DOI:10.1016/s0889-1575(03)00065-6.
[24] ZOTOU A, LOUKOU Z, KARAVA O. M ethod development for the determ ination of seven organic acids in w ines by reversed-phase high performance liquid chromatography[J]. Chromatographia, 2004, 60:39-44. DOI:10.1365/s10337-004-0330-9.
[25] ELLENDERSEN, DANIEL G, KARLA B G, et al. Development and sensory profile of a probiotic beverage from apple fermented w ith Lactobacillus casei[J]. Engineering in Life Science, 2012, 12(4): 475-485. DOI:10. 1002/elsc.201100136.
[26] 李华. 葡萄酒化学[M]. 北京: 科学出版社, 2006: 90-108.
[27] 郑欣, 余元善, 吴继军, 等. 荔枝汁经乳酸菌发酵后营养品质的变化及贮藏稳定性研究[J]. 现代食品科技, 2013, 29(12): 2909-2914.
[28] 庞雪龙, 张戎睿, 杨磊, 等. 莽草酸研究进展[J]. 黑龙江医药, 2011,24(5): 700-702. DOI:10.3969/j.issn.1006-2882.2011.05.010.
[29] DUDLEY E G, STEELE J L. Succinate p roduction and citrate catabolism by Cheddar cheese nonstarter lactobacilli[J]. Journal of Applied M icrobiology, 2005, 98(1): 14-23. DOI:10.1111/j.1365-2672.2004.02440.X.
[30] RADIN L, PRONZATO C, CASARETO L, et al. Tartaric acid in w ines may be useful for preventing renal calculi: rapid determ ination by HPLC[J]. Journal of Liquid Chromatography, 1994, 17(10): 2231-2246. DOI:10.1080/10826079408013543.
Optimization of Fermentation of Apple Juice by Probiotics and Organic Acids Evolution during Fermentation
LI Weini, ZHANG Yuxiang, WEI Jianping, YUAN Yahong, HAN Xiaojiang, YUE Tianli*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Abstract:The fermentation of Fuji apple juice by lactic acid bacteria was optimized and changes in organic acids during
fermentation were analyzed. Lactobacillus paracasei 20241, Bifidobacterium animalis 6165, Streptococcus thermophilus 6063 and Lactobacillus acidophilus 6005 were used as mixed cultures in the fermentation of apple juice. The optimization of culture composition, inoculum size and fermentation time was performed using one-factor-at-a-time method and response surface methodology. Viable cell count and sensory score were used as response variables. The results showed that the optimal fermentation conditions were as follows: ratio of four probiotic strains, 1:1:1:1; inoculum size, 2%; fermentation time, 24 h; and temperature, 37 ℃. Under these conditions, viable cell count was 1.985 × 108CFU/m L and sensory score was 80.23 points. Malic acid and succinic acid contents decreased significantly after fermentation (P < 0.05), while lactic acid, quinic acid, citric acid, tartaric acid, pyruvic acid and shikim ic acid contents significantly increased (P < 0.05) as demonstrated by HPLC analysis.
Key words:lactic acid bacteria; apple juice; fermentation; process optim ization; organic acids
DOI:10.7506/spkx1002-6630-201722013
中图分类号:TS255.4
文献标志码:A
文章编号:1002-6630(2017)22-0080-08
引文格式:
李维妮, 张宇翔, 魏建平, 等. 益生菌发酵苹果汁工艺优化及有机酸的变化[J]. 食品科学, 2017, 38(22): 80-87.
DOI:10.7506/spkx1002-6630-201722013. http://www.spkx.net.cn
LI Weini, ZHANG Yuxiang, WEI Jianping, et al. Optimization of fermentation of apple juice by probiotics and organic acids evolution during fermentation[J]. Food Science, 2017, 38(22): 80-87. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722013. http://www.spkx.net.cn
收稿日期:2017-03-10
基金项目:“十三五”国家重点研发计划重点专项(2017YFD0400702)
作者简介:李维妮(1990—),女,硕士研究生,研究方向为食品科学。E-mail:236099531@qq.com
*通信作者:岳田利(1965—),男,教授,博士,研究方向为食品生物技术及食品安全控制。E-mail:yuetl@nwafu.edu.cn