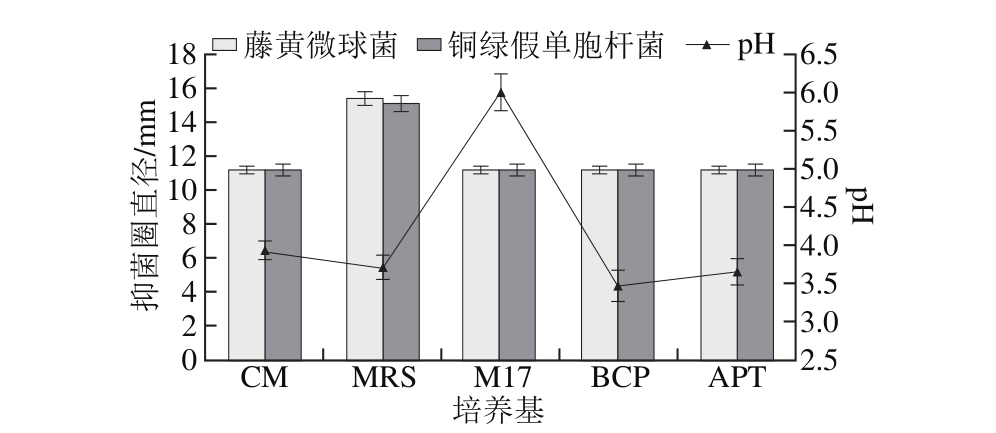
图1 培养基对菌株P158产细菌素的影响
Fig. 1 Effect of different media on production of bacteriocin by strain P158
徐珑倩1,胡凯弟1,张艾青1,周 康1,2,刘书亮1,2,*
(1.四川农业大学食品学院,四川 雅安 625014;2.四川农业大学食品加工与安全研究所,四川 雅安 625014)
摘 要:为提高乳酸菌细菌素产量,以藤黄微球菌、铜绿假单胞杆菌为指示菌,通过单因素和正交试验优化植物乳杆菌P158产细菌素的培养基和培养条件。结果表明,5 种乳酸菌培养基中MRS培养基为该菌株产细菌素的适宜培养基;最佳培养条件为种子液接种量3%(V/V)、培养基初始pH 6.0、34℃静置培养42 h;最佳培养基配方为葡萄糖添加量2 g/100 m L、酵母浸膏添加量2 g/100 mL、大豆蛋白胨添加量1.5 g/100 m L、MgSO4添加量0.058 g/100 mL、MnSO4添加量0.025 g/100 m L、FeSO4添加量0.02 g/100 m L、Tween 80添加量0.08 g/100 m L、乙酸钠添加量0.5 g/100 m L、K2HPO4添加量0.2 g/100 m L。在此条件下,细菌素效价为1 145 IU/m L,较优化前(362 IU/m L)提高了216%。
关键词:植物乳杆菌;细菌素;培养基;培养条件
乳酸菌是一类利用可发酵性糖产生大量乳酸的细菌[1-2],在食品工业中有广泛应用[3-4],而乳酸菌细菌素(乳酸菌素)是菌体在代谢过程中由核糖体产生的具有抑菌活性的多肽、蛋白质或蛋白质复合物[5-6]。该类物质可作为天然防腐剂(如乳酸链球菌素)应用于食品中[7],由于不产生抗药性,对人体无害,其应用前景广阔[8]。乳酸菌素产生于菌体对数生长中期,在对数后期或稳定前期达到最大值,其产量与细菌生长相关[9-12]。培养温度、接种量、初始pH值等培养条件[13-14],以及培养基种类、碳源、氮源等营养条件[15-16]都对乳酸菌素产量有直接或间接影响。植物乳杆菌属于我国卫生部关于“可用于食品的菌种名单”中公布的益生菌之一,能够通过代谢产生的过氧化氢、有机酸、细菌素以及其他竞争营养物质达到抑菌作用[15,17],延长食品保质期。植物乳杆菌(Lactobacillu splantarum)P158分离于四川传统发酵食品,可产生广谱植物乳杆菌素,对多数革兰氏阴性菌和革兰氏阳性菌及少数真菌有较强抑制活性,有望作为食品生物防腐剂[18-19];但较低的产量限制了其应用。因此,研究菌株P158产细菌素的影响因素,优化发酵条件,从而提高细菌素产量,为其应用提供参考依据。
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌(L. plantarum)P158[18]、藤黄微球菌(M icrococcus luteus)CICC10209、铜绿假单胞杆菌(Pseudomonas aeruginosa)ATCC27853作指示菌,由四川农业大学食品微生物实验室提供。
1.1.2 试剂
乳酸链球菌素(效价106IU/g) 浙江银象生物工程有限公司;植物蛋白胨、聚蛋白胨、胰蛋白胨、大豆蛋白胨均为生物试剂 北京奥博星生物技术有限责任公司;β-甘油磷酸二钠、抗坏血酸、蔗糖、乳糖、半乳糖、麦芽糖、木糖、纤维二糖、山梨醇、可溶性淀粉等均为分析纯试剂 成都科龙试剂厂。
1.1.3 培养基
营养肉汤培养基配方:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、水1 000 m L,调至pH 7.0~7.2。
CM培养基配方:蔗糖10 g、蛋白胨10 g、酵母浸膏10 g、K2HPO410 g、NaCl 2 g、MgSO4·7H2O 0.2 g、水1 000 m L,调至pH 6.2。
MRS培养基配方:蛋白胨10 g、牛肉膏10 g、酵母浸膏5 g、葡萄糖20 g、K2HPO42 g、柠檬酸二铵2 g、乙酸钠5 g、M gSO40.58 g、M nSO40.25 g、Tween 80 1 m L、水1 000 m L,调至pH 6.5。
M 17培养基配方:植物蛋白胨5 g、聚蛋白胨5 g、牛肉膏2.5 g、酵母浸膏5 g、β-甘油磷酸二钠19 g、抗坏血酸0.5 g、MgSO4·7H2O 0.25 g、水1 000 m L,调至pH 7.1。
BCP培养基配方:酵母浸膏2.5 g、蛋白胨5 g、葡萄糖5 g、溴甲酚紫0.04 g、水1 000 m L,调至pH 6.8~7.0。
APT培养基配方:胰蛋白胨10 g、酵母浸膏5 g、柠檬酸钠5 g、葡萄糖10 g、K2HPO45 g、Tween 80 1 m L、NaCl 5 g、MgSO4·7H2O 0.8 g、MnCl2·4H2O 0.14 g、FeSO4·7H2O 0.04 g、水1 000 m L,调至pH 6.7~7.0。
以上培养基添加20 g/L琼脂粉为相应固体培养基,均于121 ℃灭菌15 min。
1.2 仪器与设备
PHS-4C+酸度计 成都世纪方舟科技有限公司;Sorvall ST 16R冷冻离心机、1300 Series A2生物安全柜美国Thermo Fisher Scientific公司;DHP-9162电热恒温培养箱 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 指示菌活化及其菌悬液制备
分别挑取藤黄微球菌CICC10209和铜绿假单胞杆菌ATCC27853划线于营养琼脂斜面,37 ℃培养24 h进行活化;用5 m L无菌生理盐水洗下菌苔,调整细胞浓度为107CFU/m L。
1.3.2 植物乳杆菌P158活化及其种子液制备
将菌株P158划线于MRS斜面,37 ℃培养24 h进行活化;用5 m L无菌生理盐水洗下菌苔,调整细胞浓度为108CFU/m L作为种子液。
1.3.3 发酵上清液的制备
将菌株P158种子液按体积分数1%接种至10 m L发酵培养基中,30 ℃静置培养48 h后离心(10 000 r/m in,10 m in)得到发酵上清液。
1.3.4 抑菌实验
采用牛津杯双层琼脂扩散法,并稍作改进[20]。在铺有10 m L水琼脂平板上放置牛津杯,吸取200 μL指示菌悬液至20 m L 50 ℃左右的无菌营养琼脂培养基,混匀后倾注平板,放置15 min。向牛津杯内加入100 μL菌株P158发酵上清液,37 ℃正置培养16~18 h,分别测量发酵上清液对指示菌CICC10209和ATCC27853抑菌圈直径,设置添加等量无菌MRS液体培养基为对照;同时测定发酵上清液pH值。
1.3.5 细菌素效价测定
将发酵上清液用质量分数70% (NH4)2SO4溶液沉淀,4 ℃盐析过夜后离心(10 000 r/m in,20 m in),弃去上清液;利用20 mmol/L pH 4.5的柠檬酸缓冲液复溶后用于效价测定。效价测定方法:以藤黄微球菌10209为指示菌,选择100、500、1 000、1 500、2 000 IU/m L 5 个浓度,采用牛津杯双层琼脂扩散法做抑菌实验,以效价对数值为横坐标,抑菌圈直径为纵坐标,绘制效价标准曲线,然后对应标准曲线计算植物乳杆菌P158产细菌素的效价。
1.3.6 实验设计
1.3.6.1 确定植物乳杆菌P158产细菌素适宜培养条件的单因素试验
将菌株P158种子液按体积分数1%分别接种于CM、MRS、M 17、BCP和APT 5 种培养基中,30 ℃静置培养48 h,测定其发酵上清液抑菌圈直径和pH值,以添加各自使用的无菌培养基为对照,确定最适宜的培养基种类。
将菌株P158种子液按体积分数1%接入MRS培养基(pH 6.5),分别于26、30、34、38、42 ℃培养48 h,测其发酵上清液抑菌圈直径和pH值,确定适宜的培养温度;将菌株P158种子液按体积分数1%接入MRS培养基(pH 6.5),34 ℃静置培养,培养12、18、24、30、36、42、48、54、60、66、72 h,测定其发酵上清液抑菌圈直径和pH值,确定适宜的培养时间。
将菌株P158种子液分别按体积分数1%、2%、3%、4%接入MRS培养基(pH 6.5),34 ℃培养42 h后,测定其发酵上清液抑菌圈直径和pH值,确定适宜的接种量。
将菌株P158种子液按体积分数3%接入MRS培养基,培养基初始pH值分别调至4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,34 ℃静置培养42 h,测定其发酵上清液抑菌圈直径和pH值,确定适宜的初始pH值。
1.3.6.2 确定植物乳杆菌P158产细菌素适宜碳/氮源的单因素和正交试验
在1.3.6.1节获得的培养菌株P158培养基种类及最佳条件基础上,以不同碳源、氮源、碳/氮源适宜比例为因素,进行单因素试验,具体如下:以MRS培养基去除碳源为基础,分别添加2 g/100 m L的葡萄糖、麦芽糖、半乳糖、纤维二糖、蔗糖、山梨醇、乳糖、木糖和可溶性淀粉,测定菌株P158发酵液抑菌圈直径和pH值;以MRS培养基去除氮源为基础,分别添加2 g/100 m L的酵母浸膏、大豆蛋白胨、胰蛋白胨、牛肉膏、蛋白胨、氨水、硝酸钠和柠檬酸氢二铵,测定菌株P158发酵上清液抑菌圈直径和pH值。
根据上述实验结果,进行培养基碳/氮源适宜比例实验,将葡萄糖作为最适碳源,按不同质量浓度0、1、2、3、4、5、7.5、10 g/100 m L添加于MRS培养基,测菌株P158发酵上清液抑菌圈直径和pH值;将酵母浸膏按不同质量浓度0、0.5、1、1.5 g/100 m L添加于MRS培养基,测菌株P158发酵上清液抑菌圈直径及其pH值;除酵母浸膏外,将大豆蛋白胨按不同质量浓度0、0.5、1、1.5、2、2.5、3 g/100 m L添加于MRS培养基中,测菌株P158发酵上清液抑菌圈直径和pH值。
根据单因素试验结果,设计L9(34)正交试验,进一步优化培养基碳/氮源组合。
1.3.6.3 确定植物乳杆菌P158产细菌素适宜金属离子的单因素和正交试验
在1.3.6.2节基础上,分别考察Mg2+、Mn2+和Fe2+对菌株P158产细菌素的影响。将MgSO4按不同质量浓度0、0.029、0.058、0.087、0.116 g/100 m L分别添加于培养基中,在最佳培养条件下培养菌株P158,测定其发酵液上清液抑菌圈直径和pH值;将M nSO4按不同质量浓度0、0.012 5、0.025、0.037 5、0.05 g/100 m L分别添加于培养基中,在最佳培养条件下培养菌株P158,测定其发酵上清液抑菌圈直径及其pH值;将FeSO4按不同质量浓度0、0.02、0.04、0.06、0.08 g/100m L分别添加于培养基中,在最佳培养条件下培养菌株P158,测定其发酵上清液抑菌圈直径及其pH值。
根据单因素试验结果,设计L9(34)正交试验,进一步优化金属离子添加量。
1.3.6.4 确定植物乳杆菌P158产细菌素适宜Tween 80质量浓度
在上述试验结果基础上,分别添加不同质量浓度0、0.01、0.02、0.03、0.04、0.06、0.08、0.1 g/100 m L Tween 80,在最佳培养条件下培养菌株P158并进行抑菌实验,测定其发酵上清液抑菌圈直径及其pH值。
1.4 数据处理
实验重复3 次,取其平均值,数据采用SPSS V 22进行统计分析。
2.1 植物乳杆菌P158产细菌素适宜培养条件的确定

图1 培养基对菌株P158产细菌素的影响
Fig. 1 Effect of different media on production of bacteriocin by strain P158
2.1.1 乳酸菌培养基种类对植物乳杆菌P158产细菌素的影响由图1可知,5 种培养基对菌株P158产细菌素的效果依次为MRS>APT>CM>BCP>M 17。虽然使用MRS培养基时其发酵液pH值较APT和BCP略高,但是抑菌圈直径最大(P<0.05),故选择MRS培养基做后续实验。
2.1.2 培养温度对植物乳杆菌P158产细菌素的影响
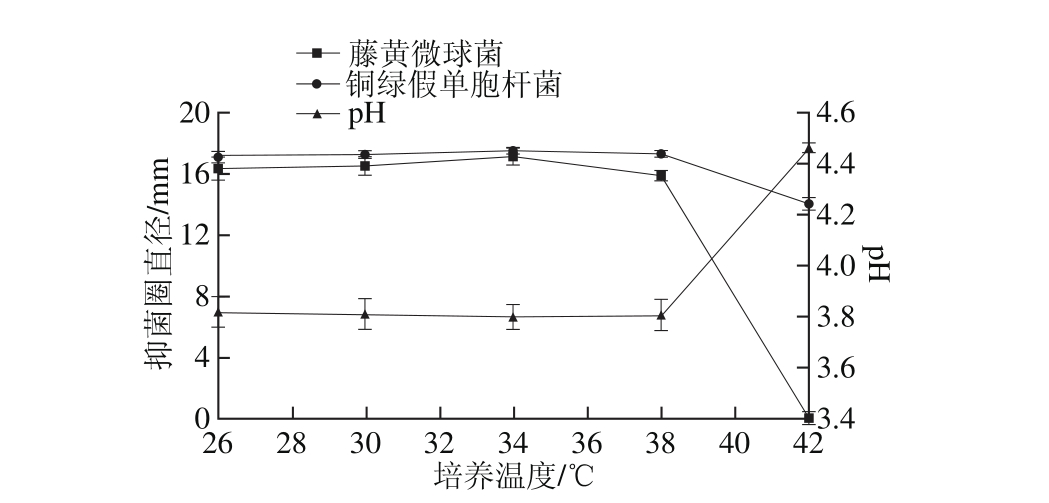
图2 培养温度对菌株P158产细菌素的影响
Fig. 2 Effect of culture temperature on production of bacteriocin by strain P158
由图2可知,抑菌圈直径随着培养温度的升高而增大,并在34 ℃时达到最大值(P<0.05);当温度继续上升,抑菌圈直径反而减小甚至为0,发酵液pH值相对较高,可见P158生长已受到影响。
2.1.3 培养时间对植物乳杆菌P158产细菌素的影响
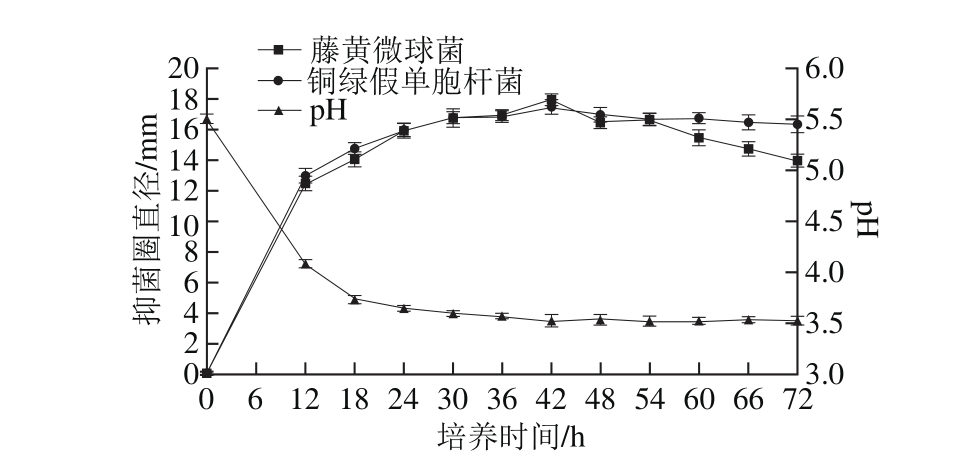
图3 培养时间对菌株P158产细菌素的影响
Fig. 3 Effect of incubation time on production of bacteriocin by strain P158
由图3可知,随着培养时间的延长,发酵液pH值持续下降并最终稳定在3.5左右,对2 种指示菌的抑制活性均显著增强(P<0.05),42 h时最强;当培养超过60 h,抑菌圈直径均开始减小;故选择42 h作为最佳培养时间。
2.1.4 接种量对植物乳杆菌P158产细菌素的影响

图4 接种量对菌株P158产细菌素的影响
Fig. 4 Effect of inoculum amount on production of bacteriocin by strain P158
由图4可知,当种子液接种量为3%时,抑菌圈直径较大。
2.1.5 初始pH值对植物乳杆菌P158产细菌素的影响

图5 初始pH值对菌株P158产细菌素的影响
Fig. 5 Effect of initial pH on p roduction of bacteriocin by strain P158
由图5可知,随着初始pH值的增大,藤黄微球菌和铜绿假单胞杆菌的抑菌圈直径均呈现先增大后缓慢降低的趋势;中性和偏碱性环境不利于乳酸菌生长故抑菌活性偏低[21](P<0.05);初始pH值为6.0时抑菌效果最好。
2.2 植物乳杆菌P158产细菌素适宜培养基成分的确定
2.2.1 碳源对植物乳杆菌P158产细菌素的影响

图6 碳源对菌株P158产细菌素的影响
Fig. 6 Effect of carbon sources on p roduction of bacteriocin by strain P158
由图6可知,以葡萄糖为碳源时,菌株发酵上清液对藤黄微球菌抑制活性与添加麦芽糖相比无明显差异(P>0.05),但显著优于半乳糖等其他处理组(P<0.05);并且铜绿假单胞杆菌抑菌圈最大(P<0.05),pH值最低;当以乳糖为碳源时,P158对藤黄微球菌没有活性;而添加木糖和可溶性淀粉时,藤黄微球菌和铜绿假单胞杆菌均未出现抑菌圈,此现象与Turgis等[22]研究结果相似。因此选择葡萄糖作为最佳碳源。
2.2.2 氮源对植物乳杆菌P158产细菌素的影响
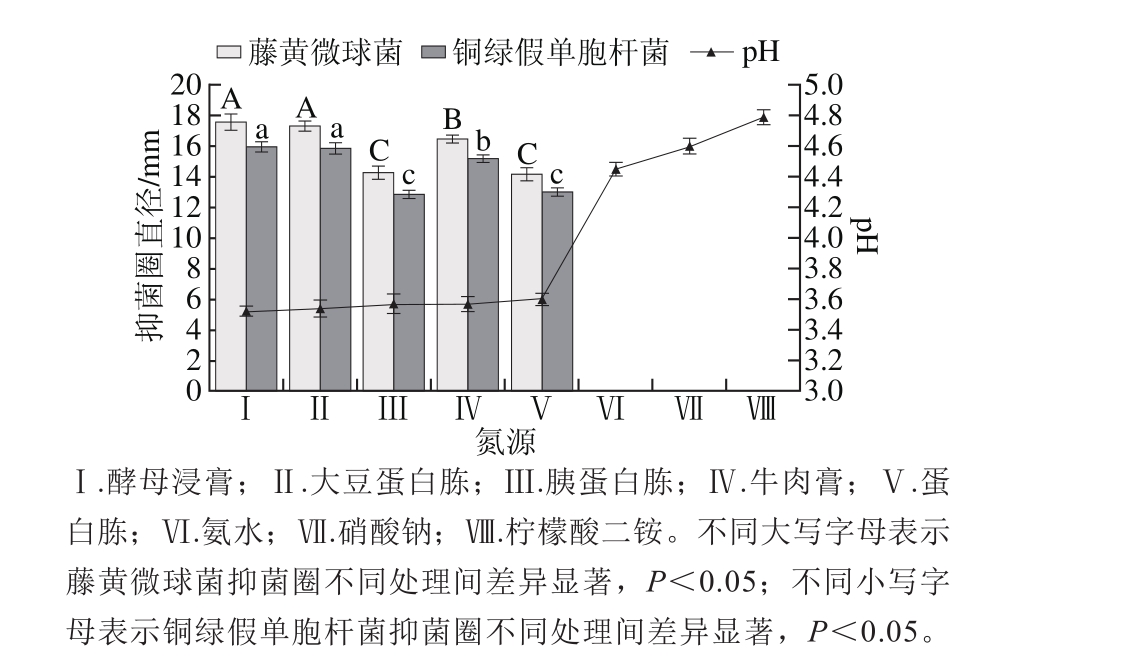
图7 氮源对菌株P158产细菌素的影响
Fig. 7 Effect of nitrogen sources on production of bacteriocin by strain P158
由图7可知,相比于无机氮源,有机氮源更有利于菌株产细菌素,且不同氮源之间差异较大。酵母浸膏和大豆蛋白胨为氮源时,菌株P158产细菌素能力远强于其他氮源(P<0.05),但二者之间并无显著性差异(P>0.05);二者发酵液pH值分别为3.54与3.52,几乎无差异。
2.2.3 培养基碳/氮源适宜比例
2.2.3.1 葡萄糖质量浓度对植物乳杆菌P158产细菌素的影响
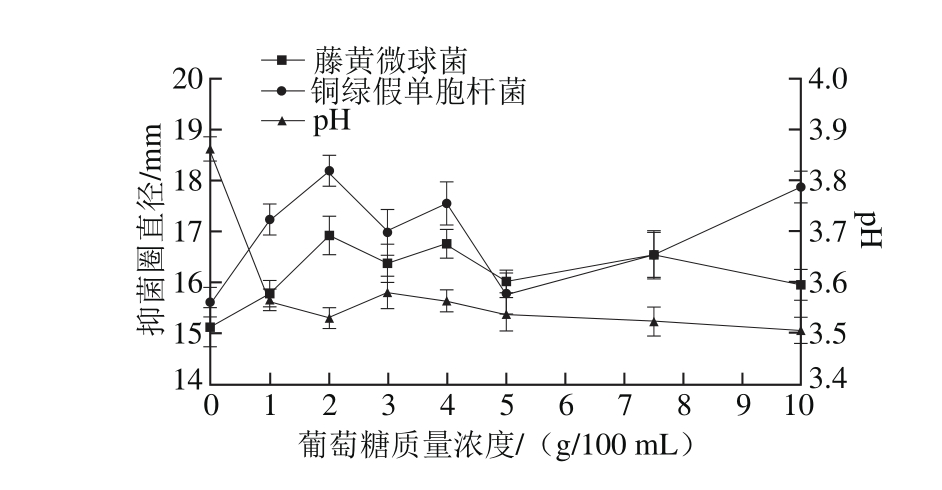
图8 葡萄糖质量浓度对菌株P158产细菌素的影响
Fig. 8 Effect of glucose concentration on production of bacteriocin by strain P158
由图8可知,当葡萄糖质量浓度维持在1~3 g/100 m L时,2 种抑菌圈直径均较大,pH值变化较小(维持pH 3.5左右);2 g/100 m L时效果显著(P<0.05)。
2.2.3.2 酵母浸膏质量浓度对植物乳杆菌P158产细菌素的影响

图9 酵母浸膏质量浓度对菌株P158产细菌素的影响
Fig. 9 Effect of yeast extract concentration on p roduction of bacteriocinby strain P158
由图9可知,质量浓度的酵母浸膏对植物乳杆菌P158产细菌素影响较大;当添加1~2 g/100 m L时,抑菌圈直径较其他实验组大(P<0.05)。
2.2.3.3 大豆蛋白胨质量浓度对植物乳杆菌P158产细菌素的影响

图10 大豆蛋白胨质量浓度对菌株P158产细菌素的影响
Fig. 10 Effects of soy peptone concentration on production of bacteriocin by strain P158
如图10所示,当大豆蛋白胨添加量在1~2 g/100 m L时,P158发酵液对2 种指示菌的抑制活性较高,且pH值保持平稳,维持pH 3.5左右。
2.2.3.4 培养基碳/氮源组分正交试验结果
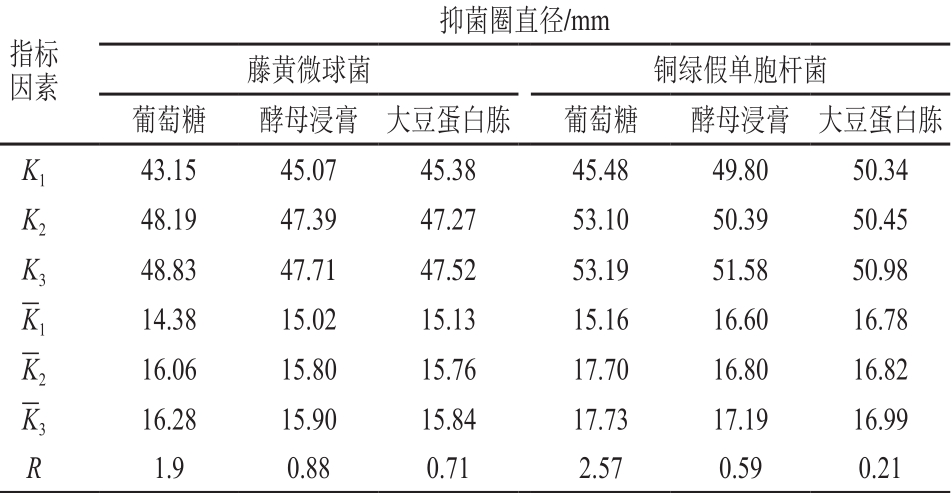
根据单因素试验结果,设计L9(34)正交试验,进一步优化培养基碳/氮源组合,试验设计与结果见表1,直观分析见表2。由表2可知,影响菌株P158对2 种指示菌抑制活性的主次因素为葡萄糖>酵母浸膏>大豆蛋白胨。根据正交试验结果,试验号5和9对藤黄微球菌抑菌圈直径显著大于其他试验组号(P<0.05);而铜绿假单胞杆菌则是试验号4~9组优于试验号1~3组,且第5和第9试验号之间无显著差异(P>0.05)。考虑到成本问题,故选择第5组作为碳/氮源最佳配比。
表1 培养基碳/氮源组分正交试验优化及结果
Table 1 O rthogonal array design w ith response values for the op tim ization of glucose, yeast extract and soy pep tone concentration in the medium
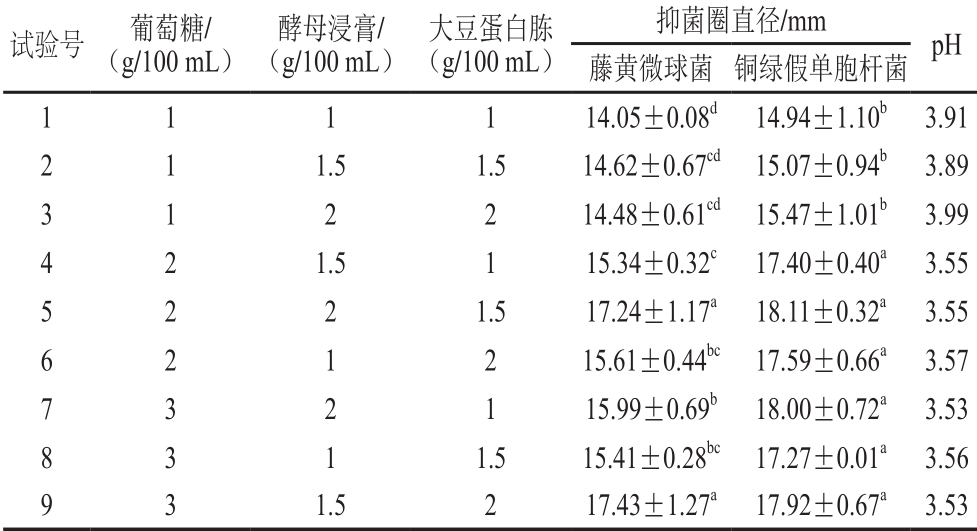
注:同列不同小写字母表示差异显著(P<0.05),表3同。
表2 培养基碳/氮源组分正交试验直观分析
Table 2 Range analysis of bacteriostatic activity
2.2.4 金属离子成分
2.2.4.1 单因素试验结果
由图11可知,随着M g2+质量浓度逐渐增大,抑菌圈直径表现为先增大后减小,其中铜绿假单胞杆菌抑菌圈在M g2+质量浓度为0.058 g/100 m L时达到最大(P<0.05)。当添加量为0.058~0.116 g/100 m L时,抑菌活性较强,故选择此范围做后续实验。

图11 M g2 质量浓度对菌株P158产细菌素的影响
质量浓度对菌株P158产细菌素的影响
Fig. 11 Effect of M g2+concentration on production of bacteriocin by strain P158
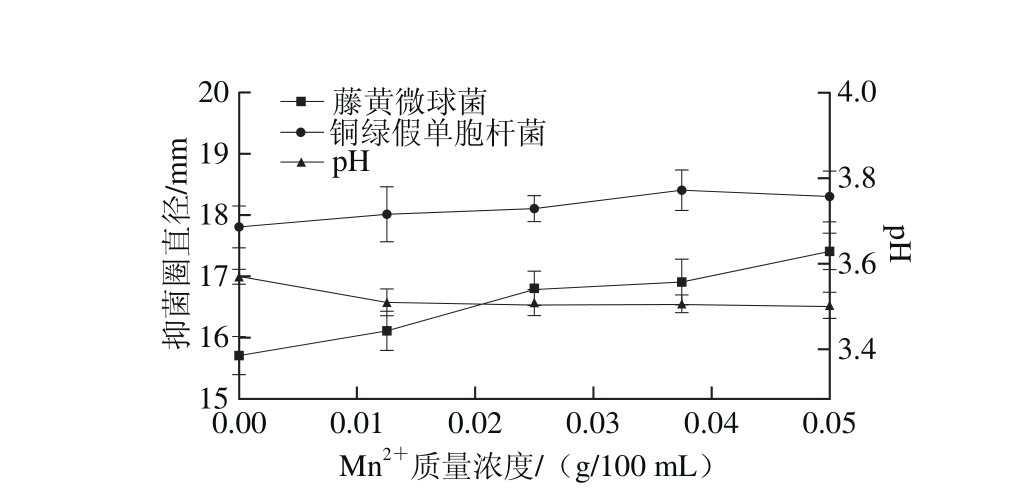
图12 M n2 质量浓度对菌株P158产细菌素的影响
质量浓度对菌株P158产细菌素的影响
Fig. 12 Effect of M n2+concentration on production of bacteriocin by strain P158
由图12可知,Mn2+质量浓度在0.025~0.05 g/100 m L之间,菌株P158发酵上清液对2 种指示菌有较大抑制活性(P<0.05)。
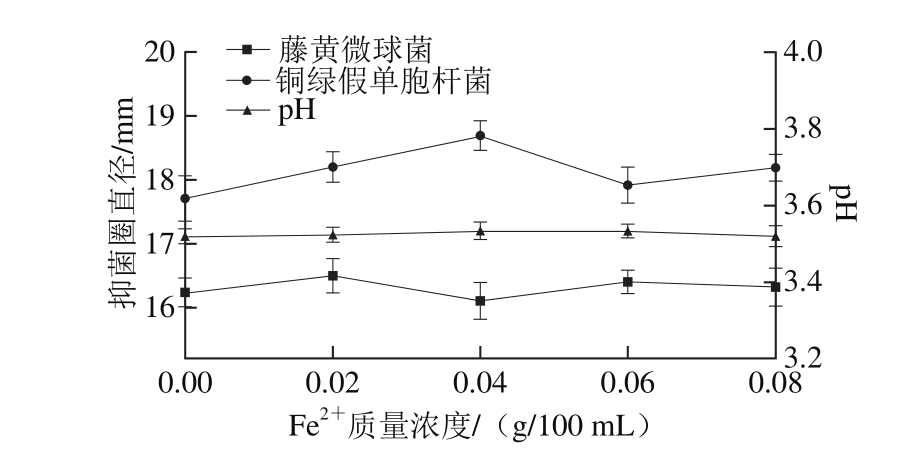
图13 Fe2 质量浓度对菌株P158产细菌素的影响
质量浓度对菌株P158产细菌素的影响
Fig. 13 Effect of Fe2+concentration on production of bacteriocin by strain P158
由图13可知,菌株P158细菌素产量在Fe2+添加量为0.02~0.06 g/100 m L时较高。
2.2.4.2 培养基金属离子正交试验结果
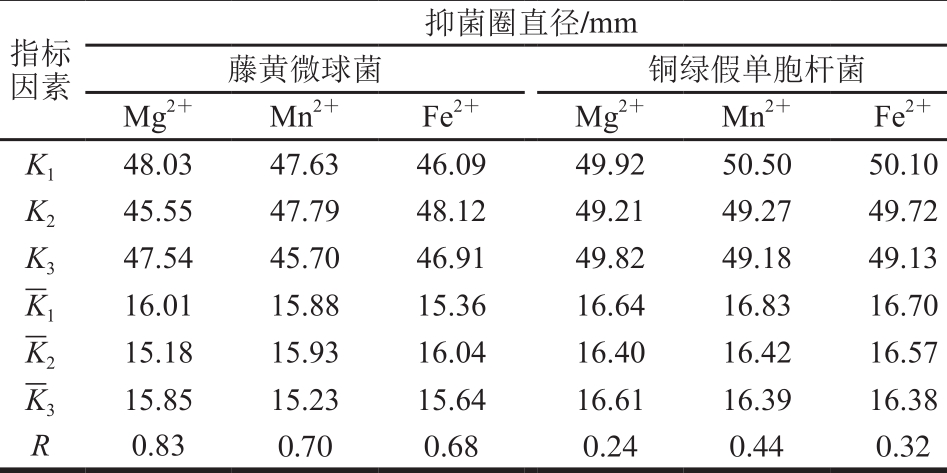
根据单因素试验结果,设计L9(33)正交试验,进一步考察金属离子比例对菌株P158产细菌的影响。试验设计及结果见表3,直观分析见表4。P158对藤黄微球菌抑制效果影响主次因素为Mg2+>Mn2+>Fe2+,最优组合为试验2;而对铜绿假单胞杆菌则是M n2+>Fe2+>M g2+,试验1效果最好;显著性分析表明,二者差异不显著。从成本角度考虑,选择试验1中各项水平作为最优组合添加于培养基中。
表3 培养基金属离子正交试验设计及结果
Table 3 Orthogonal array design w ith response values for the optim ization of m etal ion concentrations in the medium
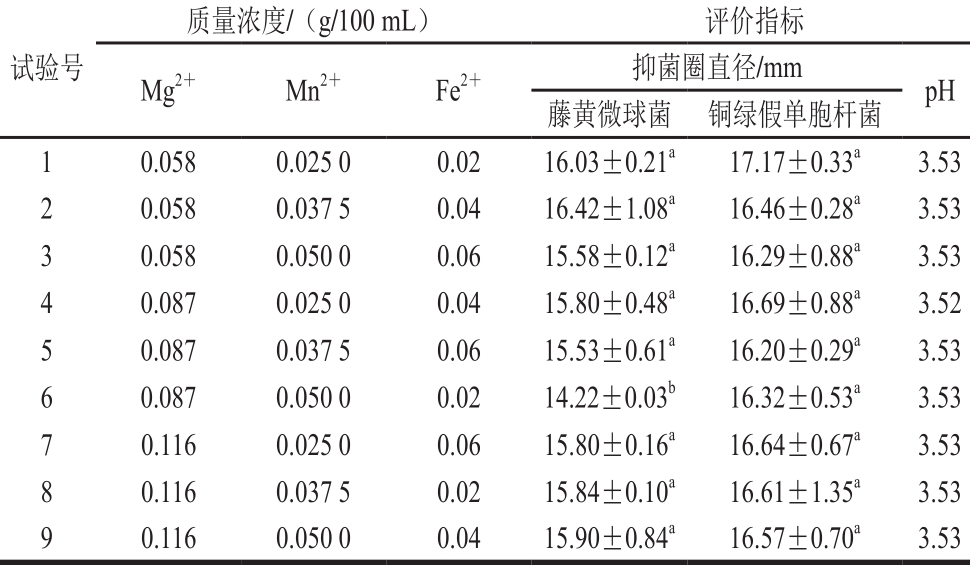
表4 培养基金属离子正交试验直观分析
Table 4 Range analysis of bacteriostatic activity
2.2.5 Tween 80质量浓度的影响

图14 Tween 80质量浓度对菌株P158产细菌素的影响
Fig. 14 Effect of Tween 80 concentration on production of bacteriocin by strain P158
由图14可知,Tween 80对菌株P158产细菌素有一定刺激作用;其质量浓度为0.08 g/100 m L时,发酵上清液抑菌活性最强(P<0.05)。
2.3 植物乳杆菌素P158的效价结果
根据实验结果,以效价对数值为自变量,抑菌圈直径为因变量进行线性拟合,得到效价线性回归方程:y=4.432 6x+3.980 7(R2=0.997 8)。分别以优化前后条件培养菌株P158,发酵液经粗提后得到细菌素粗提物,按1.3.4节分别测定其抑菌圈直径和pH值。结果表明,优化前的抑菌圈为15.32mm,优化后为17.54mm;分别代入回归方程计算得到效价依次为362 IU/m L和1 145 IU/m L,提高了216%;优化前后的pH值一致。该结果优于陈芸芸等[23]和Pal等[24]的研究。
乳酸菌素作为生物防腐剂,可提高食品安全性与品质[18]。其产量与菌体生长有关,但最佳发酵条件往往与菌体最适生长条件不一致[10-11],温度、pH值、氮源、碳源等诸多因素对乳酸菌素产量有不同程度的影响,尽管原因尚未系统阐明[25],但优化乳酸菌素产量并提高其活性显得尤为重要[26]。Tabbene等[14]从培养基成分入手,对枯草芽孢杆菌(Bacillus subtilis)B38产细菌素条件进行研究,结果表明乳糖、(NH4)2SO4和Mn2+对其产量影响显著;Anthony等[27]则发现高浓度酵母浸膏和NaCl对细菌素产量有正效应,碱性环境和较高的培养温度亦是如此;而Raza等[28]考察了不同金属离子对Paenibacillus polymyxa SQR-21产细菌素的影响,结果表明Zn2+对产量有抑制作用,而M g2+相反,Fe2+虽然影响不显著,但与Mg2+有协同作用。纵观优化乳酸菌素产量的文献,大多局限于某一方面因素;与之不同的是,本实验不仅从培养条件,也从培养基成分方面,对植物乳杆菌P158产乳酸菌素发酵条件进行了研究,系统考察了不同因素的影响效果并作优化,为菌株的应用提供了更详细的数据参考。此外,实验结果表明Tween 80对植物乳杆菌P158产细菌素有一定促进作用,这与Collado等[29]报道相一致,可能是Tween 80作为一种乳化剂,改变了菌体细胞膜通透性,从而有利于营养物质和代谢产物的运输[30]。
植物乳杆菌P158产细菌素的适宜培养基为MRS,其最佳培养条件为种子液接种量3%(V/V)、培养基初始pH 6、34℃静置培养42 h。最佳培养基配方为葡萄糖质量浓度2 g/100 m L、酵母浸膏质量浓度2 g/100 m L、大豆蛋白胨质量浓度1.5 g/100 m L、M gSO4质量浓度0.058 g/100 m L、M nSO4质量浓度0.025 g/100 m L、FeSO4质量浓度0.02 g/100 m L、Tw een 80质量浓度0.08 g/100 m L、乙酸钠质量浓度0.5 g/100 m L、K2HPO4质量浓度0.2 g/100 m L。在此条件下,细菌素产量提高了216%,效价达到1 145 IU/m L。
参考文献:
[1] KÖN IG H, FRÖHLICH J. Lactic acid bacteria[M]//Biology of M icroorganisms on Grapes, in Must and in W ine. Berlin: Springer,2009: 3-29. DOI:10.1007/978-3-540-85463-0.
[2] AXELSSON L. Lactic acid bacteria: m icrobiological and functional aspects[M]//3rd. Lactic acid bacteria: classification and physiology.New York: Marcel Dekker Inc, 2004: 1-66.
[3] CALO-MATA P, ARLINDO S, BOEHME K, et al. Current app lications and future trends o f lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food products[J]. Food and Bioprocess Technology, 2008, 1(1): 43-63. DOI:10.1007/s11947-007-0021-2.
[4] LEROY F, DE VUYST L. Lactic acid bacteria as functional starter cultures for the food fermentation industry[J]. Trends in Food Science &Technology, 2004, 15(2): 67-78. DOI:10.1016/j.tifs.2003.09.004.
[5] SAVADOGO A, OUATTARA A T C, BASSOLE H N I, et al.Bacteriocins and lactic acid bacteria: a m inireview[J]. A frican Journal of Biotechnology, 2006, 5(9): 678-683.
[6] ZACHAROF M P, LOVITT R W. Bacteriocins produced by lactic acid bacteria a review article[J]. Apcbee Procedia, 2012, 2: 50-56.DOI:10.1016/j.apcbee.2012.06.010.
[7] TWOMEY D, ROSS R P, RYAN M, et al. Lantibiotics produced by lactic acid bacteria: structure, function and applications[J]. Antonie Van Leeuw enhoek, 2002, 82(1/2/3/4): 165-185. DOI:10.1023/A:1020660321724.
[8] ROSSI F, PALLOTTA M L. Bacteriocin producing cultures: a sustainable way for food safety improvement and probiotics w ith additional health promoting eff ects[J]. International Journal of Medical and Biological Frontiers, 2016, 22(1): 59-87.
[9] AVONTS L, VAN UYTVEN E, DE VUYST L. Cell grow th and bacteriocin production of probiotic Lactobacillus strains in diff erent media[J]. International Dairy Journal, 2004, 14(11): 947-955.DOI:10.1016/j.idairyj.2004.04.003.
[10] CHEIGH C I, CHOI H J, PARK H, et al. In fluence o f grow th conditions on the p roduction o f a nisin-like bacteriocin by Lactococcus lactis subsp. lactis A 164 isolated from kim chi[J].Journal of Biotechnology, 2002, 95(3): 225-235. DOI:10.1016/S0168-1656(02)00010-X.
[11] TOMÁS J, BRU E, W IESE B, et al. Influence of pH, temperature and culture media on the grow th and bacteriocin production by vaginal Lactobacillus salivarius CRL 1328[J]. Journal of Applied M icrobio logy, 2002, 93(4): 714-724. DOI:10.1046/j.1365-2672.2002.01753.x.
[12] BHATTACHARYA S, DAS A. Study of physical and cu ltural parameters on the bacteriocins produced by lactic acid bacteria isolated from traditional Indian fermented foods[J]. American Journal of Food Technology, 2010, 5(2): 111-120. DOI:10.3923/ajft.2010.111.120.
[13] DELGADO A, BRITO D, PERES C, et al. Bacteriocin production by Lactobacillus pentosus B96 can be expressed as a function of temperature and NaCl concentration[J]. Food M icrobiology, 2005,22(6): 521-528. DOI:10.1016/j.fm.2004.11.015.
[14] TABBENE O, SLIMENE I B, DJEBALI K, et al. Optim ization of medium composition for the production of antim icrobial activity by Bacillus subtilis B38[J]. Biotechnology Progress, 2009, 25(5): 1267-1274. DOI:10.1002/btpr.202.
[15] DE VUYST L, LEROY F. Bacteriocins from lactic acid bacteria:production, purification, and food app lications[J]. Journal of Molecular M icrobiology and Biotechnology, 2007, 13(4): 194-199.DOI:10.1159/000104752.
[16] MALHEIROS P S, SANT’ANNA V, TODOROV S D, et al.Optim ization of grow th and bacteriocin production by Lactobacillus sakei subsp. sakei2a[J]. Brazilian Journal of M icrobiology, 2015,46(3): 825-834. DOI:10.1590/S1517-838246320140279.
[17] SOOMRO A H, MASUD T, ANWAAR K. Role of lactic acid bacteria(LAB) in food preservation and human health-a review[J]. Pakistan Journal of Nutrition, 2002, 1(1): 20-24.
[18] 张艾青, 刘书亮, 敖灵. 产广谱细菌素乳酸菌的筛选和鉴定[J].微生物学通报, 2007, 34(4): 753-756. DOI:10.13344/j.m icrobiol.china.2007.04.014.
[19] 刘书亮, 张艾青, 田刚. 植物乳杆菌P158的生长曲线及其细菌素的特性[J]. 核农学报, 2009, 23(6): 1021-1025; 1035.
[20] 罗佩文, 刘书亮, 朱永清, 等. 植物乳杆菌SJ35的抑菌特性及复合保鲜剂配制[J]. 食品与机械, 32(7): 112-116; 201. DOI:10.13652/j.issn.1003-5788.2016.07.027.
[21] ZHOU K, ZENG Y T, HAN X F, et al. M odelling grow th and bacteriocin production by Lactobacillus plantarum BC-25 in response to temperature and pH in batch fermentation[J]. Applied Biochem istry and Biotechnology, 2015, 176(6): 1627-1637. DOI:10.1007/s12010-015-1666-3.
[22] TURGIS M, VU K D, M ILLETTE M, et al. Influence of environmental factors on bacteriocin production by human isolates of Lactococcus lactis MM 19 and Pediococcus acidilactici MM 33[J]. Probiotics and Antim icrobial Proteins, 2016, 8(1): 53-59. DOI:10.1007/s12602-015-9204-8.
[23] 陈芸芸, 陆兆新, 卢静, 等. 植物乳杆菌fmb10产细菌素发酵条件的优化[J]. 食品科学, 2015, 36(17): 140-145. DOI:10.7506/spkx1002-6630-201517027.
[24] PAL A, RAMANA K V, BAWA A S. Simplifi cation and optim ization of deManRogosa Sharpe (MRS) medium for enhanced production of bacteriocin by Weissella paramesenteroides DFR-8[J]. Journal of Food Science and Technology, 2010, 47(3): 258-265. DOI:10.1007/s13197-010-0040-2.
[25] O’SULLIVAN L, ROSS R P, HILL C. Potential of bacteriocinproducing lactic acid bacteria for improvements in food safety and quality[J]. Biochim ie, 2002, 84(5): 593-604. DOI:10.1016/S0300-9084(02)01457-8.
[26] ABO-AMER A E. Optim ization of bacteriocin production by Lactobacillus acidophilus AA 11, a strain isolated from Egyptian cheese[J]. Annals o f M ic robio logy, 2011, 61(3): 445-452.DOI:10.1007/s13213-010-0157-6.
[27] ANTHONY T, RAJESH T, KAYALV IZHI N, et al. In fluence of medium com ponents and fermentation conditions on the production of bacteriocin(s) by Bacillus licheniformis AnBa9[J].Bioresource Technology, 2009, 100(2): 872-877. DOI:10.1016/j.biortech.2008.07.027.
[28] RAZA W, YANG X, WU H, et al. Evaluation of metal ions (Zn2+,Fe3+and M g2+) effect on the p roduc tion o f fusaricidin-type antifungal com pounds by Paenibacillus po lymyxa SQR-21[J].Bioresource Technology, 2010, 101(23): 9264-9271. DOI:10.1016/j.biortech.2010.07.052.
[29] COLLADO M C, HERNÁNDEZ M, SANZ Y. Production of bacteriocin-like inhibitory compounds by human fecal Bifidobacterium strains[J]. Journal of Food Protection, 2005, 68(5): 1034-1040.DOI:10.4315/0362-028X-68.5.1034.
[30] PARENTE E, RICCIARDI A. Production, recovery and purifi cation of bacteriocins from lactic acid bacteria[J]. Applied M icrobiology and Biotechnology, 1999, 52(5): 628-638. DOI:10.1007/s002530051570.
Optimization of Medium and Culture Conditions for Bacteriocin Production by Lactobacillus plantarum P158
XU Longqian1, HU Kaidi1, ZHANG Aiqing1, ZHOU Kang1,2, LIU Shuliang1,2,*
(1. College of Food Science, Sichuan Agricultural University,Ya’an 625014, China;2. Institute of Food Processing and Safety, Sichuan Agricultural University, Ya’an 625014, China)
Abstract:To increase the yield of bacteriocin produced by Lactobacillus plantarum P158, the medium and culture conditions for this strain were optimized using one-factor-at-a-time and orthogonal array design methods. The bacteriostatic activity of bacteriocin against Micrococcus luteus and Pseudomonas aeruginosa and pH were used as response variables.Results showed that MRS was the most suitable for bacteriocin production among five culture media for lactic acid bacteria.The optimal culture conditions were obtained as follow s: inoculum amount, 3% (V/V); initial pH, 6.0; and static culture at 34 ℃ for 42 h; the optimum medium was composed of glucose 2 g/100 m L, yeast extract 2 g/100 m L, soy peptone 1.5 g/100 m L, MgSO40.058 g/100 m L, MnSO40.025 g/100 m L, FeSO40.02 g/100 m L, Tween 80 0.08 g/100 m L, sodium acetate 0.5 g/100 m L, and K2HPO40.2 g/100 m L. Under these conditions, bacteriocin titer was 1 145 IU/m L, which was 216% higher than that (362 IU/m L) before optimization.
Key words:Lactobacillus plantarum; bacteriocin; medium; culture conditions
DOI:10.7506/spkx1002-6630-201722017
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)22-0109-08引文格式:
徐珑倩, 胡凯弟, 张艾青, 等. 植物乳杆菌P158产细菌素培养基及培养条件的优化[J]. 食品科学, 2017, 38(22): 109-116.
DOI:10.7506/spkx1002-6630-201722017. http://www.spkx.net.cn
XU Longqian, HU Kaidi, ZHANG Aiqing, et al. Optimization of medium and culture conditions for bacteriocin production by Lactobacillus plantarum P158[J]. Food Science, 2017, 38(22): 109-116. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722017. http://www.spkx.net.cn
收稿日期:2017-01-17
基金项目:四川省农业科技成果转化资金项目(14NZ0012);四川省科技支撑计划项目(2015FZ0001)
作者简介:徐珑倩(1996—),女,学士,研究方向为食品微生物。E-mail:540922828@qq.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com