
图1 样品校正集和验证集主成分二维分布图、数据统计及方差分析
Fig. 1 Two-dimension distribution p lots of the fi rst two p rincipal com ponents (PC1 and PC2) of the sam p les in the calibration (a) and validation (b) subsets
高 丽1,潘从飞1,陈 嘉1,王勇德2,*,赵国华1,3,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市中药研究院,重庆 400065;3.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:利用近红外光谱技术建立新鲜甘薯水分和还原糖含量的预测模型,实现快速检测与分析,为甘薯品质分析和种质资源筛选提供便捷。选用不同品系甘薯样品146 份,109 份作为校正样品,37 份作为验证样品。运用不同光谱预处理方法、协同区间偏最小二乘最优波长选择法以及主成分回归和偏最小二乘法建立甘薯水分和还原糖模型。结果显示,所建甘薯水分(还原糖)最优模型的决定系数、预测均方根误差和标准差比率分别为0.974(0.885),1.154(0.270)和6.334(3.148)。表明2 种模型具有较好的检测性能,近红外光谱模型的预测值与其相应的化学值有较好的相关性,适用于大批量甘薯选育时水分和还原糖含量的快速检测。
关键词:近红外光谱技术;甘薯;水分;还原糖;区间协同偏最小二乘法
甘薯(Ipomoea batatas (L.) Lam.),又名红薯、红苕、番薯、白薯、地瓜、山芋等,隶属于旋花科的甘薯属,是一年生或多年生蔓生草本植物[1-2]。我国是甘薯生产大国,生产总量居世界首位,根据世界粮农组织统计,每年种植面积约为3.4×106hm2(2010—2014),约占世界甘薯种植面积的41.0%;年生产量为7.3×107t,约占世界总产量的69.5%。甘薯稳产、高产、适应性强,繁殖和栽培简便,在我国粮食作物生产中排名第五,仅次于水稻、小麦、玉米和马铃薯,是重要的粮食、饲料、工业原料、新型能源及保健作物[3]。甘薯含有丰富的营养成分,具有多种食疗保健及药用价值,是营养均衡的保健食品,被人们称为“冠军菜”,被欧美人称为“第二面包”,被前苏联科学家称作“宇航食品”[4]。水分是其最基本的品质指标,还原糖则是其品质育种领域重点改良的化学成分[5]。随着人们对甘薯营养和保健功能认识的不断深入,甘薯品质育种多样化成为趋势。但是,目前所用的常规化学检测方法存在操作繁琐、检测速度慢、高成本、低产出等一系列缺点,不能满足甘薯品种筛选中大批量检测的需求[5]。寻求一种适用于大批量、快速、简便、精确可靠的成分检测方法,对于甘薯种质选择尤为重要。
近红外光谱技术是一种高效快速的现代分析技术,它可以同时测定样品中一种或者几种化学成分,不需要对样品进行化学处理,不会产生任何有毒有害废弃物,是一种介于可见光和中红外光谱之间(12 820~4 000 cm-1)的电磁波。其主要光谱信息来源于—CH、—NH和—OH等含氢基团的倍频和合频吸收。最早用于美国农业部测定苹果等作物的内部品质,目前已广泛应用 于 食 品[6]、 农 业[7-10]、 石 油[11]、 化 学[12]、 制 药[13]、林业[14]、纺织[15]及化妆品[16]等各个行业。目前,近红外光谱技术已经在甘薯化学成分测定中得到应用[17-18],分别构建了甘薯蛋白质[19-20]、淀粉[21-22]、糖类[22]、黄酮[23]和甘薯茎叶色素[24]、重金属[25]等定量测定模型,但这些模型均将甘薯样品进行干燥、磨粉等处理,仍费时费力,目前暂未见利用近红外光谱技术直接对新鲜甘薯进行成分分析的报道。本实验以146 份不同品系的甘薯育种材料为研究对象,选37 份作为验证样品,109 份为校正样品,利用近红外光谱结合化学计量法建立新鲜甘薯水分和还原糖含量最优预测模型,为我国甘薯品质分析和种质筛选提供新思路及参考依据。
1.1 材料
甘薯由重庆市甘薯工程技术研究中心(2015年11月)提供。选取大小一致、表面光滑、无病虫害且不同品系的甘薯,共计146 份样品。将甘薯表面的泥土清洗干净,在室温条件下自然晾干其表面水分并编号,储存于(15±2)℃备用。将甘薯从中心横向一切两半,一半用于甘薯化学成分测定,一半用于近红外光谱扫描。
1.2 仪器与设备
AntarisⅡ傅里叶近红外光谱仪 美国Thermo Fisher Scientific公司;BS-223S电子天平 北京塞多利斯仪器系统有限公司;DHG-9140电热恒温鼓风干燥箱 上海市齐欣科学仪器有限公司;培英DDHZ-300台式恒温振荡器太仓市实验设备厂。
1.3 方法
1.3.1 成分测定及光谱采集
化学法成分测定:参考GB 5497—1985《粮食、油料检验 水分测定法》和GB/T 5009.7—2008《食品中还原糖的测定》测定甘薯中水分和还原糖含量,所有样品平行测定3 次,结果取平均值。
近红外光谱采集:甘薯样品从中心横向一切两半,以切面中心为中点,选取中心到边缘中点左右两点为样品近红外光谱采集点。选用AntarisⅡ傅里叶近红外光谱仪及积分球漫反射附件采集甘薯样品近红外光谱,仪器开机预热30 m in,正式采样之前,对仪器进行测试,保证仪器稳定工作。测试通过后,进行背景扫描。仪器参数:波数范围4 000~12 000 cm-1(即光谱波长范围833~2 500 nm),扫描次数32,分辨率4 cm-1,InGaAs检测器收集信号,为消除噪音干扰,每隔5 个样品进行一次背景扫描。每个采样点平行测定3 次,取平均光谱,最终光谱为2 个采样点平均光谱的平均值。
1.3.2 样品划分
样品的合理划分和化学值的准确测定直接影响所建模型的适用性和准确度,所以校正集和验证集样品在性质变化内应该是分布均匀的。一个好的样品划分方法要能使所选校正集和验证集样品均具有代表性,并涵盖整个样品化学测定范围。随机划分应用最为广泛且操作简单,但其偶然性大,不具有代表性,且所选样品并不能很好地反映所有样品信息[26]。Kennerd-Stone(KS)算法是另一种应用较为广泛的样品划分方法,其主要思想是依照同种算法在光谱间选取欧氏距离最大的样品作为校正集,其余的作为验证集,该方法虽涵盖了所有样品光谱,但未考虑因变量影响,对于含量或浓度较低的范围,其对应样本间光谱变化很小,这样选出的样本也不具有代表性[26-27]。
为了保证划分子集样品具有代表性,减小偏差,参考Wu Zhengzong等[28]的方法,先将所有样品根据化学测定值(还原糖或水分含量)按从小到大排列,然后每4 个中选1 个作为验证样品,连续选出37 个作为验证集,剩余109 个样品作为校正集。
1.3.3 光谱预处理
为消除由仪器、样品背景等产生的高频随机噪声,基线偏移,光散射等影响因素,改善光谱特征,提高光谱信息有效性,研究对比了不同光谱预处理方法对预测模型的影响。利用The Unscrambler软件对光谱进行预处理,主要有卷积平滑(savitzky-golay,SG)、一阶导数(1st)、二阶导数(2nd)、标准正态变换(standard normal variate,SNV)、多元散射校正(multipilicative scatter correction,MSC)及其组合等。
1.3.4 有效波长选取
波长的有效选取不仅可以对近红外光谱变量起到降维作用,减少计算量,还可以提高模型准确度,目前常用的方法主要有相关系数法、方差分析法、逐步回归法、区间偏最小二乘法、连续投影算法、无信息变量消除法、CARS自适应加权算法等。本实验参考Chen Jia等[29]的研究,采用协同区间偏最小二乘法,将全光谱2 075 个变量等分为10 个区间,对应光谱范围分别为:11 998.9~11 208.3(1)、11 204.4~10 406.0(2)、10 402.2~9 607.6 (3)、9 603.8~8 805.4(4)、8 801.5~8 007.0(5)、8 003.1~7 204.8(6)、7 200.9~6 406.4(7)、6 402.5~5 604.1(8)、5 600.3~4 805.7(9)、4 801.9~3 999.6(10) cm-1,区间数从1~10不同组合,可以得到1 023 种结果。具体操作:区间数为1时,从10 个区间中选1 个区间,获得10 个模型进行比较,从中选取最优模型,对应的区间范围为最优波长;区间数为2时,从10 个区间中任选2 个区间,获得45 个模型进行比较,从中选取最优模型,对应的区间范围为最优波长;区间数为3时,从10 个区间中任选3 个区间,获得120 个模型进行比较,从中选取最优模型,对应的区间范围为最优波长;以此类推。最终为区间数分别为1~10的10 个结果。
1.3.5 模型建立、检验及数据处理
选用The Unscrambler 9.8中主成分回归(principal components regression,PCR)法和偏最小二乘(partial least square,PLS)法2 种建模方法进行研究。为确认所建模型的准确性,需要对其进行验证评价。根据模型的预测均方根误差(root mean square error of prediction,RMSEP)、相关系数(R2)、预测标准误差(standard error of prediction,SEP)、偏差及标准差比率(standard deviation ratio,SDR)最终选出最优模型[29]。
数据分析采用The Unscrambler 9.8,Matlab R2015b和SPSS 19.0软件,作图采用Origin 8.0软件。
2.1 样品划分的合理性

图1 样品校正集和验证集主成分二维分布图、数据统计及方差分析
Fig. 1 Two-dimension distribution p lots of the fi rst two p rincipal com ponents (PC1 and PC2) of the sam p les in the calibration (a) and validation (b) subsets
表1 甘薯水分和还原糖含量校正集和验证集数据统计及方差分析
Table 1 Statistical com parison and analysis of variance (ANOVA) of moisture and reducing sugar contents of sweet potato between calibration and validation subsets

注:同一指标不同小写字母表示差异显著(P<0.05)。平均值以 ±s表示。
建立校正模型之前,需先对样品划分的合理性进行评估。利用二维主成分分析图,可以很直观的观察样品划分情况。如图1所示,发现甘薯水分和还原糖的校正集和验证集样品间均没有明显地聚集趋势,且同一指标的2 个子集间平均值和范围基本一致。进一步通过方差分析(t-检验),如表1所示,同一指标条件下2 个子集的样品间没有显著性差异,说明本研究样品划分结果理想,可用于后期建模。
2.2 光谱预处理对模型的影响
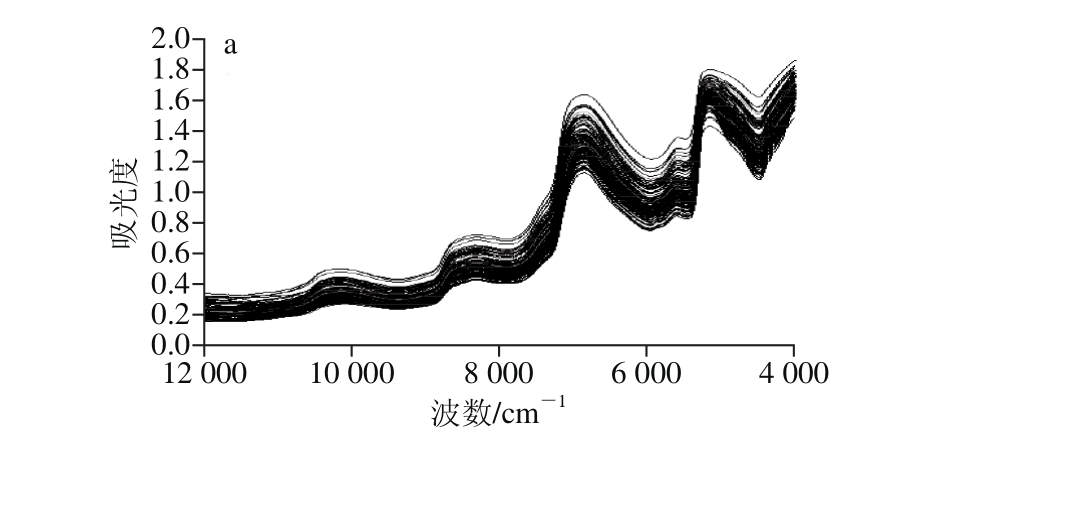
图2a为按照1.3节方法及参数采集的新鲜甘薯近红外原始光谱图,如若不考虑甘薯来源和测量时样品状态,与唐忠厚等[22]报道的光谱趋势图类似。由图2a可见,146 份新鲜甘薯块根样品在近红外光谱区域的吸收光谱特征基本一致,表明样品中所含成分类别相似;同时,由于样品中各组分含量高低的差异,导致样品吸收光谱强度不同,样品吸收光谱不完全重合,这为后续预测样品中不同组分含量提供了可能。但红外光谱的吸收谱带相对较宽,而且重叠严重,因此,很难找到某个特定的光谱带,其吸收强度变化与水分或还原糖含量呈线性关系,所以直接在原始光谱图基础上测定甘薯水分和还原糖含量还比较困难。
通常在建立校正模型之前,为消除原始光谱中基线漂移,减少噪声等其他不必要的干扰信号,需要先对原始光谱进行预处理,来提高模型稳定性和可靠性。本研究采用了8 种光谱预处理方法,即SNV、MSC(图2b)、1st、2nd、SNV+1st、SNV+2nd、MSC+1st(图2c)、MSC+2nd。其中,1st和2nd可以有效扣除本底吸收,消除基线偏移和漂移,分离重叠光谱[30];且对每一条光谱进行单独校正,消除基线漂移和样品散射所引起的误差[31];MSC可消除散射,改善光谱信噪比。主要参数如表2所示。
从表2可以看出,PCR/PLS在原始光谱条件下对甘薯水分建模的R2、RMSEP、SDR分别为0.940/0.940、1.763/1.759、4.146/4.156,表明该模型可被接受,甘薯水分含量与近红外光谱吸光度之间存在很好的关系。1st、2nd、SNV+1st、SNV+2nd、MSC+1st和MSC+2nd处理均提高了模型性能,其中MSC+1st处理获得的PCR/PLS模型为最优模型,其RMSEP最小,为1.498/1.474。PCR/PLS在原始光谱条件下对甘薯还原糖含量建模的R2、RMSEP、SDR分别为0.610/0.786、0.500/0.369、1.700/2.404,PCR模型R2较低,RMSEP偏大,同时没有预处理方法可以改善该模型性能,表明PCR模型建模对于甘薯还原糖而言不太理想,PLS模型可被接受。SNV和MSC处理可以提高PLS模型性能,其中MSC处理可得最优模型,其RMSEP最小,为0.328。在同一指标条件下,比较PCR和PLS两种建模方法,发现PLS所建模型的RMSEP均小于PCR(1st除外),说明PLS更适于甘薯水分和还原糖含量建模。

图2 新鲜甘薯近红外光谱图
Fig. 2 Near infrared spectra of fresh sweet potato
表2 不同光谱预处理方法对甘薯水分和还原糖含量最优模型(PCR/PLS)主要参数的影响
Table 2 Effects of spectral p reprocessing on the key parameters of optim ized calibration models (PCR/PLS) for moisture and reducing sugar contents of sweet potato

2.3 协同区间矩阵对模型性能的影响
为了进一步提高模型性能,本研究在上述甘薯水分((MSC+1st)/PLS)和还原糖(MSC/PLS)最优模型的基础上,利用协同区间矩阵将近红外光谱全波长划分为10个区间,区间数从1~10构成不同组合的模型,具体操作参考方法1.3.5节。其中,以RMSEP最小为衡量标准,选取每个区间数中的最优模型,模型结果见表3。
从表3可以看出,协同区间矩阵明显改善了模型性能,全波长时,甘薯水分和还原糖PCR/PLS模型的R2、RMSEP分别为0.957/0.958和0.610/0.831、1.498/1.474和0.500/0.328,随着区间的划分和不同组合,模型R2增高,RMSEP降低;比较同一指标条件下PCR和PLS,发现PLS更适于甘薯水分和还原糖建模。甘薯水分和还原糖最优模型的光谱范围、R2和RMSEP分别为[2 3 5]和[8]、0.974和0.885,1.154和0.270。
表3 区间数(1~10)对甘薯水分和还原糖含量最优模型(siPCR/siPLS)主要参数的影响
Tab le 3 Effects of the number of subinterval (varying from one to ten)on the key parameters of optim ized models (siPCR/siPLS) for moisture and reducing sugar contents of sweet potato

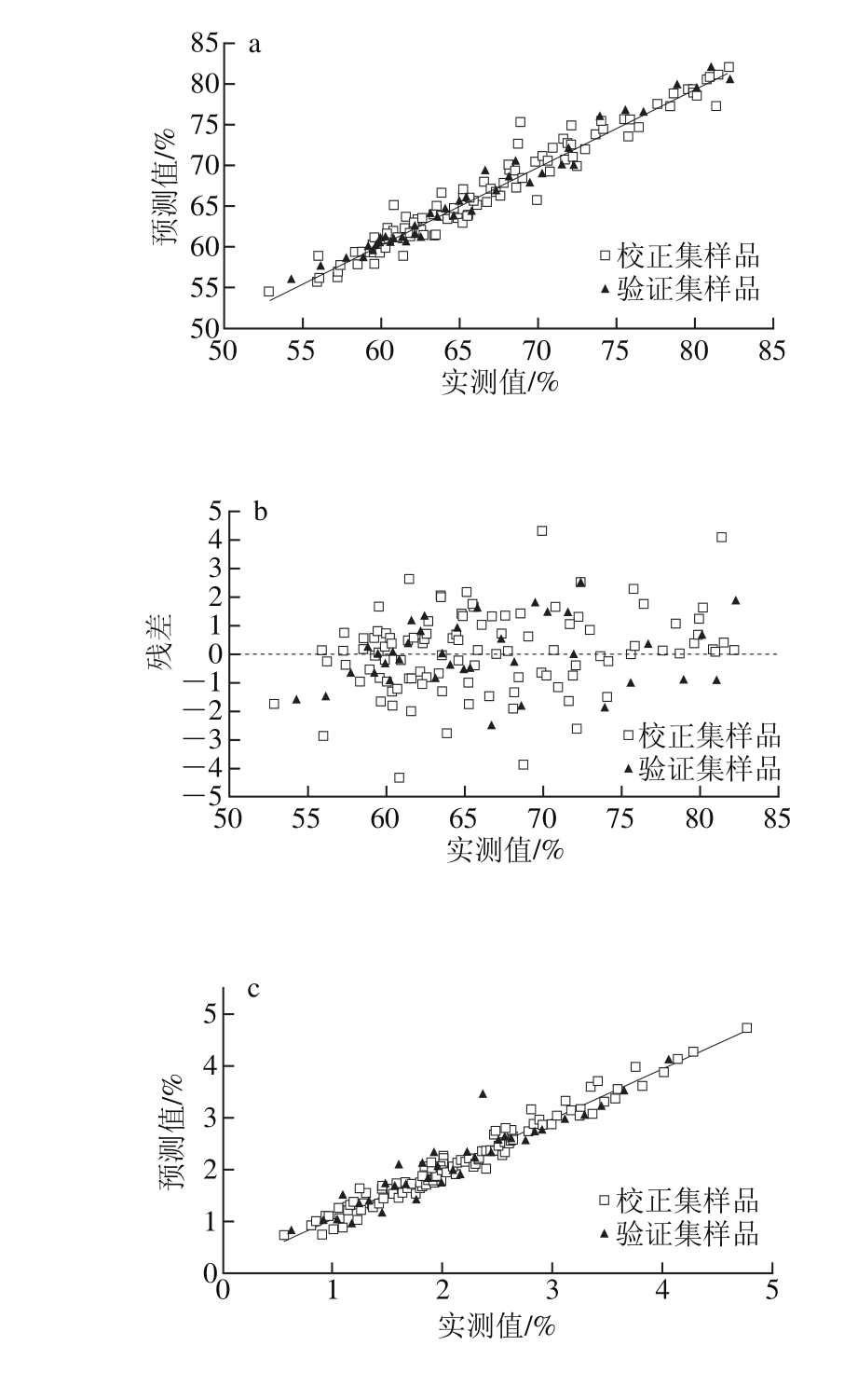

图3 甘薯实测值与预测值的相关性及残差
Fig. 3 Correlation and regression residuals between measured and predicted values for sweet potato
由图3可见,样品比较集中的分布在拟合线周围,残差分布在可接受范围内,表明该模型可用于对新鲜甘薯水分和还原糖含量的预测,且结果可靠。
近红外光谱分析技术结合化学计量学方法、光谱预处理方法和最优特征波长提取方法,成功获得了新鲜甘薯水分和还原糖含量的最优模型,分别为MSC+1st/siPLS和MSC/siPLS。以最高R2、SDR和最低RMSEP为衡量参数,评价模型性能,所得最优模型MSC+1st/siPLS和MSC/siPLS的R2、SDR、RMSEP分别为0.974和0.885、6.334和3.148、1.154和0.270。与原始光谱相比,运用适当的光谱预处理技术可以有效改善模型性能,这主要与测试目标样品和所选化学计量学方法相关。通过利用协同区间矩阵算法,从不同区间数1 023 种组合中选择最优特征波长范围,进一步提高了模型性能。无论是利用全波长还是协同区间最优特征波长,所建甘薯水分含量模型精度均优于还原糖含量模型。本研究的创新点是:1)采用新鲜未处理的甘薯块根作为研究对象;2)比较PCR和PLS两种建模方法,表明在甘薯水分和还原糖含量预测中PLS优于PCR;3)证实了协同区间矩阵算法能够有效改善模型性能。总之,所建最优模型均可被接受,对甘薯品质分析和种质材料筛选有很好的参考价值,能够有效解决传统方法分析速度慢、成本高、操作繁琐、存在污染及浪费等问题,是未来甘薯产业及育种中一种快速、简便、绿色、可靠,有望替代传统化学分析法的潜在方法。
参考文献:
[1] 刘鲁林, 木泰华, 孙艳丽. 不同品种甘薯块根营养成分及相关性分析[J]. 中国粮油学报, 2008, 23(1): 39-43.
[2] 刘水英, 李新生, 江海, 等. 彩色甘薯不同品种中基本物质及功能成分分析[J]. 江苏农业科学, 2015, 43(1): 303-305. DOI:10.15889/j.issn.1002-1302.2015.01.101.
[3] 朱旭霞, 刘莉莎, 何素兰, 等. 保健甘薯的功能及产品开发研究[J]. 中国食物与营养, 2014, 20(11): 34-36. DOI:10.3969/j.issn.1006-9577.2014.11.008.
[4] 赵秀玲. 甘薯的营养成分与保健作用[J]. 中国食物与营养, 2008,29(10): 58-60. DOI:10.3969/j.issn.1006-9577.2008.10.019.
[5] 陆国权, 盛家廉. 近红外反射光谱法(N IRS)在甘薯品质育种上的应用[J]. 中国农业科学, 1990, 23(1): 76-81. DOI:10.3321/j.issn:0578-1752.1990.01.009.
[6] POREP J U, KAMMERER D R, CARLE R. On-line application of near infrared (NIR) spectroscopy in food production[J]. Trends in Food Science & Technology, 2015, 46(2): 211-230. DOI:10.1016/j.tifs.2015.10.002.
[7] BAGCHI T B, SHARMA S, CHATTOPADHYAY K. Development of NIRS models to predict protein and amylose content of brown rice and proximate compositions of rice bran[J]. Food Chem istry, 2016,191: 21-27. DOI:10.1016/j.foodchem.2015.05.038.
[8] BERNHARD T, TRUBERY B, FEIEDT W, et al. Development of near-infrared refl ection spectroscopy calibrations for crude protein and dry matter content in fresh and dried potato tuber samples[J]. Potato Research, 2016, 59(2): 149-165. DOI:10.1007/s11540-016-9318-8.
[9] REDAELLI R, ALFIERI M, CABASSI G. Development of a NIRS calibration for total antioxidant capacity in maize germ plasm[J].Talanta, 2016, 154: 164-168. DOI:10.1016/j.talanta.2016.03.048.
[10] SU W H, HE H J, SUN D W. Non-destructive and rapid evaluation of staple foods quality by using spectroscopic techniques: a review[J].Food Science and Nutrition, 2017, 57(5): 1039-1051. DOI:10.1080/10 408398.2015.1082966.
[11] NG W, MALONE B P, M INASNY B. Rapid assessment of petroleumcontam inated soils w ith infrared spectroscopy[J]. Geoderma, 2017,289: 150-160. DOI:10.1016/j.geoderma.2016.11.030.
[12] BOTHRA S, UPADHYAY Y, KUMAR R, et al. Chem ically modified cellulose strips w ith pyridoxal conjugated red fluorescent gold nanoclusters for nanomolar detection o f mercuric ions[J].Biosensors and Bioelectronics, 2017, 90: 329-335. DOI:10.1016/j.bios.2016.11.066.
[13] PAWAR P, WANG Y, KEYVAN G, et al. Enabling real time release testing by NIR prediction of dissolution of tablets made by continuous direct compression (CDC)[J]. International Journal of Pharmaceutics,2016, 512(1): 96-107. DOI:10.1016/j.ijpharm.2016.08.033.
[14] 于仕兴, 李学春, 黄安民, 等. 粒子群支持向量机结合NIR测定桉木木质素[J]. 东北林业大学学报, 2013, 41(2): 123-126. DOI:10.3969/j.issn.1000-5382.2013.02.029.
[15] PEREIRA H, SANTOS A, ANJOS O. Fibre m orpho logical characteristics of kraft pulps of acacia melanoxylon estimated by NIR-PLS-R models[J]. Materials, 2015, 9(1): 1-9. DOI:10.3390/ma9010008.
[16] BLANCO M, ALCALA M, PLANELLS J, et al. Quality control of cosmetic m ixtures by NIR spectroscopy[J]. Analytical and Bioanalytical Chem istry, 2007, 389(5): 1577-1583. DOI:10.1007/s00216-007-1541-3.
[17] DIAZ J T, VEAL M W, CHINN M S. Development of NIRS models to predict composition of enzymatically processed sweet potato[J].Industrial Crops and Products, 2014, 59: 119-124. DOI:10.1016/j.indcrop.2014.05.012.
[18] LEBOT V, NDIAYE A, MALAPA R. Phenotypic characterization of sweet potato [Ipomoea batatas (L.) Lam.] genotypes in relation to prediction of chem ical quality constituents by NIRS equations[J].Plant Breeding, 2011, 130(4): 457-463. DOI:10.1111/j.1439-0523.2010.01840.x.
[19] MAGWAZA L S, NAIDOO S L M, LAURIE S M, et al. Development o f NIRS models for rapid quantification of p rotein content in sweetpotato [Ipomoea batatas (L.) LAM][J]. LWT-Food Science and Technology, 2016, 72: 63-70. DOI:10.1016/j.lw t.2016.04.032.
[20] 唐忠厚, 李洪民, 马代夫. 甘薯蛋白质含量近红外反射光谱分析模型应用研究[J]. 中国食品学报, 2008, 8(4): 169-173. DOI:10.3969/j.issn.1009-7848.2008.04.028.
[21] 唐忠厚, 李洪民, 陆国权. 基于近红外光谱的甘薯抗性淀粉含量的快速测定方法[J]. 江苏农业学报, 2011, 27(6): 1426-1429.DOI:10.3969/j.issn.1000-4440.2011.06.050.
[22] 唐忠厚, 李洪民, 李强, 等. 基于近红外光谱技术预测甘薯块根淀粉与糖类物质含量[J]. 江苏农业学报, 2013, 29(6): 1260-1265.DOI:10.3969/j.issn.1000-4440.2013.06.013.
[23] 衣申艳, 陆国权. 甘薯黄酮含量近红外反射光谱分析模型的构建及其应用[J]. 光谱实验室, 2013, 30(2): 860-864. DOI:10.3969/j.issn.1004-8138.2013.02.082.
[24] HUANG W D, LIN K H, HSU M H, et al. Elim inating interference by an thocyanin in ch lo rophy ll estim ation o f sw eet potato(Ipomoea batatas L.) leaves[J]. Botanical Studies, 2014, 55: 11.DOI:10.1186/1999-3110-55-11.
[25] 徐庆则, 沈恒胜, 林斌. 利用近红外漫反射光谱(NIRS)技术建立甘薯茎叶重金属预测模型[J]. 福建农学报, 2011, 26(3): 440-445.DOI:10.3969/j.issn.1008-0384.2011.03.021.
[26] GALVAO R K H, ARAUJO M C U, JOSE G E, et al. A method for calibration and validation subset partitioning[J]. Talanta, 2005, 67(4):736-740. DOI:10.1016/j.talanta.2005.03.025.
[27] 刘伟, 赵众, 袁洪福, 等. 光谱多元分析校正集和验证集样本分布优选方法[J]. 光谱学与光谱分析, 2014, 34(4): 947-951. DOI:10.3964/j.issn.1000-0593(2014)04-0947-05.
[28] WU Z Z, XU E B, LONG J, et al. Com parison between ATR-IR,Raman, concatenated ATR-IR and Raman spectroscopy for the determ ination of total antioxidant capacity and total phenolic content of Chinese rice w ine[J]. Food Chem istry, 2016, 194: 671-679.DOI:10.1016/j.foodchem.2015.08.071.
[29] CHEN J, ZHU S P, ZHAO G H. Rapid determ ination of total protein and wet gluten in commercial wheat flour using siSVRNIR[J]. Food Chem istry, 2017, 221: 1939-1946. DOI:10.1016/j.foodchem.2016.11.155.
[30] AL-MBAIDEEN A, BENAISSA M. Frequency self-deconvolution in the quantitative analysis of near infrared spectra[J]. Analytica Chim ica Acta, 2011, 705(1/2): 135-147. DOI:10.1016/j.aca.2011.04.037.
[31] BI Y M, YUAN K L, XIAO W Q, et al. A local pre-processing method for near-infrared spectra, combined w ith spectral segmentation and standard normal variate transformation[J]. Analytica Chim ica Acta,2016, 909: 30-40. DOI:10.1016/j.aca.2016.01.010.
Rapid Determ ination of Moisture and Reducing Sugar in Sweet Potato by Near-Infrared Spectroscopy Coupled w ith Chemometrics
GAO Li1, PAN Congfei1, CHEN Jia1, WANG Yongde2,*, ZHAO Guohua1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Academy of Chinese Materia Medica, Chongqing 400065, China;3. Chongqing Engineering Research Center for Special Food, Chongqing 400715, China)
Abstract:A predictive model for rapid quantification of moisture and reducing sugar in fresh sweet potato was established by near-infrared (NIR) spectroscopy, which could facilitate the quality analysis and germplasm screening of sweet potato. In this study, 146 samples of diff erent lines of sweet potato were selected, out of which 109 samples were used as calibration samples while the rest were used as validation samples. A fter different spectral pretreatments and optimal wavelength selection by synergy interval partial least squares, a principal component regression model and a partial least squares model were developed for predicting the contents of moisture and reducing sugar in sweet potato, respectively. The results showed that the coefficient of determ ination, root mean square error of prediction, and standard deviation ratio of the optimal model for moisture and reducing sugar contents were 0.974 and 0.885, 1.154 and 0.270, and 6.334 and 3.148, respectively,indicating that the two models have good prediction performance, and the NIR model predicted values had a good correlation w ith the corresponding chem ical values. Therefore, the predictive model is suitable for rapid quantification of water and reducing sugar in large-scale sweet potato breeding.
Key words:near-infrared spectroscopy; sweet potato; moisture; reducing sugar; synergy interval partial least squares
DOI:10.7506/spkx1002-6630-201722031
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)22-0205-06
引文格式:
高丽, 潘从飞, 陈嘉, 等. 甘薯水分和还原糖协同向量NIR快速检测方法[J]. 食品科学, 2017, 38(22): 205-210.
DOI:10.7506/spkx1002-6630-201722031. http://www.spkx.net.cn
GAO Li, PAN Congfei, CHEN Jia, et al. Rapid determination of moisture and reducing sugar in sweet potato by nearinfrared spectroscopy coupled w ith chemometrics[J]. Food Science, 2017, 38(22): 205-210. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722031. http://www.spkx.net.cn
收稿日期:2017-03-07
基金项目:重庆市社会事业与民生保障科技创新专项(cstc2015shms-ztzx80006);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:高丽(1991—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:gl910112@163.com
*通信作者:王勇德(1972—),男,副研究员,博士,研究方向为食品加工。E-mail:84538607@qq.com赵国华(1971—),男,教授,博士,研究方向为食品化学。E-mail:zhaoguohua1971@163.com