龙晓琴,唐 杰,赵景芳,曾凡坤*
(西南大学食品科学学院,重庆 400715)
摘 要:为研究酶法-超声波辅助提取红油椿老叶总黄酮工艺参数,以总黄酮得率为指标,经单因素试验筛选出影响总黄酮得率的4 个因素:酶添加量、pH值、超声温度、料液比,并采用响应面试验优化提取工艺条件,并建立红油椿老叶中黄酮的高效液相色谱测定方法。结果表明,红油椿老叶总黄酮提取最佳工艺为纤维素酶添加量0.6%、pH 4.6、45 ℃酶解120 m in,再经60%乙醇溶液、料液比1∶25(g/m L),超声功率140 W、超声温度62 ℃条件下提取40 min,连续提取2 次,红油椿老叶总黄酮得率为14.98%。与酶法提取相比,酶法联合超声波法提取明显提高了总黄酮得率。高效液相色谱法测定结果表明,红油椿老叶总黄酮粗提物中含有芦丁、槲皮素和山柰酚,质量分数分别为0.16%、0.06%、0.03%。
关键词:红油椿叶;响应面;总黄酮;高效液相色谱法
香椿(Toona sinensis)又名椿芽树、椿、椿树,分为紫香椿和绿香椿两大类,红油椿则属于紫香椿类。香椿是我国特有树种,原产于我国中部地区,至今已有2 000多年的栽培历史。现今,广泛分布于华北至华南和西南各省[1],香椿嫩芽因其具有独特的香气和含有丰富的营养物质,备受人们青睐。因此,香椿树的栽种面积从房前屋后的一两棵,扩展到田边种植或成片规模化的香椿林。但香椿芽生产期短,仅限于春季,采收期约2 个月,而香椿老叶作为香椿产业的主要副产物,却没有得到很好地利用,大部分被遗弃成为枯叶[2]。近几年来,对香椿的活性成分研究较多,文献记载,香椿中主要活性成分为黄酮类化合物[3],是广泛存在于植物中的一类重要的天然有机化合物[4],其具有降血脂、保护心肌、抗肿瘤、抗氧化、抗病毒等多种药理作用[5-9]。目前香椿叶黄酮提取方法有超声波法、微波法、酶法、超临界二氧化碳法等,其中酶法有反应温和、工艺简单、对样品破坏小等优点[10-11];超声波法借助超声波的空化作用加快目标提取物溶出[12-13]。本实验结合酶法和超声波提取技术的优点,研究提取过程中各因素对红油椿老叶中黄酮得率的影响,采用Box-Behnken试验设计,通过响应面优化,并用高效液相色谱(high performance liquid chromatography,HPLC)法分析其黄酮单体成分含量,为香椿老叶在食品工业中的综合利用、活性成分的深入分析及黄酮类化合物的工业化提取利用提供参考。
1.1 材料、试剂与仪器
红油椿老叶,2016年9月采摘于重庆江津区永兴镇,洗净,烘房30 ℃烘干备用;芦丁、山柰酚(标准品)中国食品药品检定研究院;槲皮素(标准品) 美国Chrom adex公司;纤维素酶(40 000 U/g)、果胶酶(30 000 U/g) 上海如吉生物科技发展有限公司;乙醇、亚硝酸钠、硝酸铝、氢氧化钠、无水醋酸钠、冰醋酸(均为分析纯),磷酸、甲醇(均为色谱纯) 成都市科龙化工试剂厂。
FA2004A分析天平 上海精天电子仪器有限公司;FW 177中草药粉碎机 天津市泰斯特仪器有限公司;XH-C旋涡混合器 金坛市白塔新宝仪器厂;HWS 26电热恒温水浴锅 上海一恒科学仪器有限公司;KQ5200DE数控超声波清洗器 昆山市超声仪器有限公司;UV 1000紫外-可见分光光度计 上海天美科学仪器有限公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;LC-20A高校液相色谱仪 日本岛津公司。
1.2 方法
1.2.1 芦丁标准曲线的绘制
按照李秀信等[14]的NaNO2-A l(NO3)3法绘制芦丁标准曲线,以吸光度(Y)为纵坐标,芦丁质量浓度(X)为横坐标,制作标准曲线,得到回归方程为:Y=10.997X+0.012 8,R2=0.999 3。
1.2.2 红油椿老叶总黄酮的提取
准确称取2.0 g红油椿叶粉,于乙酸-乙酸钠缓冲溶液中与酶作用一段时间后,沸水灭酶30 s,加入乙醇,在设定的超声条件下提取,抽滤,定容100 m L,得提取液。
1.2.3 红油椿老叶总黄酮得率的计算
用相应提取溶剂适当稀释提取液,准确吸取2 m L稀释液于10 m L刻度试管,按1.2.1节方法显色,测定吸光度,按下式计算总黄酮得率。
式中:C为稀释溶液中总黄酮的质量浓度/(g/L);N为稀释倍数;V为提取液体积/L;m为红油椿叶粉质量/g;W为红油椿叶粉水分质量分数/%。
1.2.4 红油椿老叶粉碎时间的确定
将预先干燥的红油椿叶放满粉碎机容器,分别粉碎5、15、25、35、50 s,筛分法计算平均粒径的范围,取2.0 g于100 m L锥形瓶,加入料液比1∶20(g/m L)的体积分数70%乙醇溶液,60 ℃水浴提取2 h。
1.2.5 酶种类的确定
选用纤维素酶(Ⅰ)、果胶酶(Ⅱ)及3 种复合酶(Ⅰ、Ⅱ质量比分别为1∶1、1∶2、2∶1),研究不同组成的酶对红油椿老叶总黄酮得率的影响,红油椿叶粉在酶添加量0.6%、酶解时间120 m in、pH 5.0、酶解温度45 ℃、乙醇溶液体积分数60%、料液比1∶30(g/m L)条件下水浴提取1.5 h。
1.2.6 酶法-超声波提取红油椿老叶总黄酮得率的单因素试验
分别考察纤维素酶添加量:质量分数0.1%、0.3%、0.6%、1.0%、2.0%、3.0%;pH值:3.8、4.2、4.6、5.0、5.4、5.8;酶解温度:30、35、40、45、50、55 ℃;酶解时间:30、60、90、120、150、180 m in;料液比:1∶10、1∶15、1∶20、1∶25、1∶30、1∶40(g/m L);乙醇溶液体积分数:40%、50%、60%、79%、80%;超声温度:40、50、60、70、80 ℃;超声功率:100、120、140、160、180、200 W;超声时间:10、20、30、40、50 m in。按提取方法,分别进行单因素试验。
1.2.7 酶法-超声波提取红油椿老叶总黄酮得率的响应面试验
对单因素试验中的9 个因素进行方差分析,得出酶添加量、pH值、超声温度、料液比对总黄酮得率有极显著影响,其他因素无显著性影响。为了优化酶法-超声波提取红油椿老叶总黄酮提取工艺,根据Box-Behnken试验设计原理[15-16],以4 个极显著影响因素作为变量,总黄酮得率作为响应值,设计了四因素三水平响应面试验,见表1。
1.2.8 红油椿老叶黄酮的HPLC分析
准确称取芦丁、槲皮素、山柰酚各0.005 0 g,用甲醇分别定容于10 m L容量瓶中,0.45 μm滤膜过滤备用,用于确定各自的出峰时间。再准确称取各标品0.005 0 g,用甲醇定容于10 m L容量瓶中,制得混合储备液,甲醇稀释储备液制成不同质量浓度梯度,0.45 μm滤膜过滤备用,以质量浓度为横坐标,峰面积为纵坐标,制作标准曲线,得到线性回归方程。用优化后的方法提取红油椿总黄酮,得提取液,蒸发后干燥至恒质量得到粗提物,精密称取0.05 g,甲醇溶解后定容10 m L,0.45 μm滤膜过滤备用[17]。
H PLC条件:色谱柱:C h rom p lu s TM C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.2%磷酸(60∶40,V/V);柱温30 ℃;检测波长368 nm;流速1.0 m L/m in;进样量10 μL。重复3 次。
1.3 数据处理
采用Origin 8.1软件处理单因素数据和作图,SPSS 13.0统计软件进行方差分析,Design-Expert 8.0.6软件进行响应面分析。
表1 Box-Behnken响应面试验设计因素与水平
Tab le 1 Code and level of independent variables used in Box-Behnken design

2.1 红油椿老叶粉碎时间的确定
表2 粉碎时间对平均粒径范围及总黄酮得率的影响
Table 2 Effect of comm inution time on average particle size and total flavonoids yield

由表2可以看出,随着粉碎时间的延长,粉体粒径减小,黄酮得率先增加后减小,在粉碎时间为25 s时总黄酮得率最大。故选择粉碎时间为25 s。
2.2 酶种类的确定
如图1所示,经纤维素酶(Ⅰ)和果胶酶(Ⅱ)酶解后,总黄酮得率都大于无酶组,且纤维素酶效果优于果胶酶,而复合酶解总黄酮得率介于等质量的纤维素酶和果胶酶之间,表明2 种酶无明显协同作用,这与陈丛瑾[18]研究结论相同。因此,选择单一纤维素酶。

图1 酶种类对总黄酮得率的影响
Fig. 1 Effect of enzyme type on total fl avonoid yield
2.3 酶法-超声波提取红油椿老叶总黄酮的单因素试验结果
2.3.1 酶添加量对红油椿老叶总黄酮得率的影响

图2 酶添加量对总黄酮得率的影响
Fig. 2 Effect of enzyme dosage on total flavonoid yield
如图2所示,在酶添加量为1.0%时有最大得率。Acedo等[19]发现纤维素酶能破坏细胞壁,有助于总黄酮的溶出,但随着添加量的增加,酶解的同时一部分纤维附着在颗粒表面,阻碍黄酮的部分溶出通道,使得率降低,故添加1%的纤维素酶效果较好。
2.3.2 pH值对红油椿老叶总黄酮得率的影响
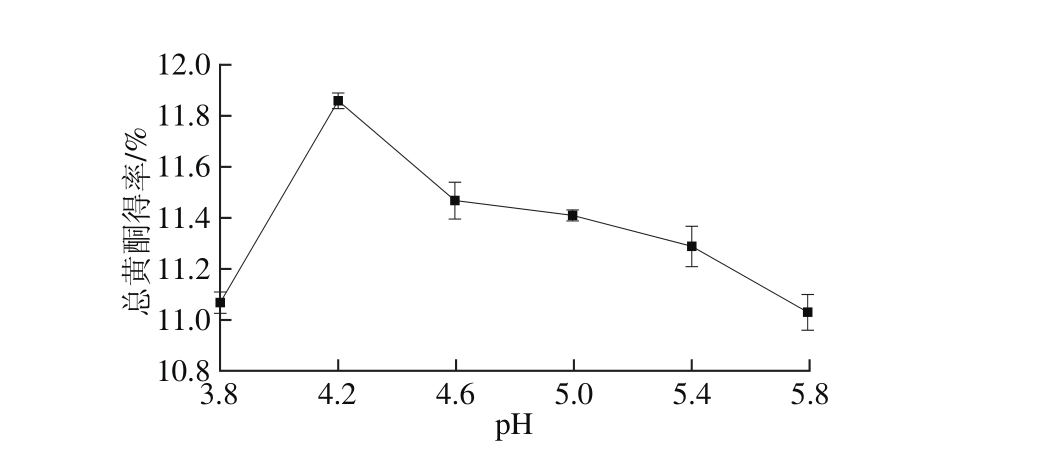
图3 pH值对总黄酮得率的影响
Fig. 3 Effect of hydrolysis pH on total flavonoid yield
如图3所示,当pH 4.2时,总黄酮得率最高,之后得率明显降低。可能由于pH值既对酶的构象有影响,也对底物的解离状态有影响,当pH 4.2时,纤维素酶活力最大,提取效率最高[20]。
2.3.3 酶解温度对红油椿老叶总黄酮得率的影响

图4 酶解温度对总黄酮得率的影响
Fig. 4 Effect of hydrolysis temperatures on total flavonoid yield
酶在合适的温度条件下,酶解底物更完全,总黄酮得率更高,由图4可以看出,总黄酮得率在酶解温度为45 ℃时最高,即45 ℃为较佳酶解温度。
2.3.4 酶解时间对红油椿老叶总黄酮得率的影响
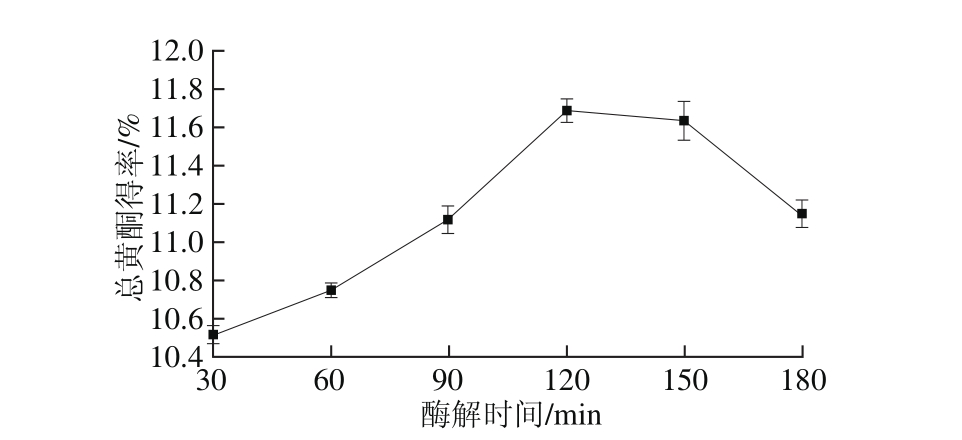
图5 酶解时间对总黄酮得率的影响
Fig. 5 Effect of hydrolysis time on total fl avonoid yield
如图5所示,随酶解时间的延长得率增加,酶解120 m in时有最大黄酮得率,再继续酶解使得率略有降低。石会军等[21]利用酶法提取银杏叶黄酮,酶解2 次,酶解时间为60 m in时有最大提取率,与本实验结论相符。
2.3.5 料液比对红油椿老叶总黄酮得率的影响

图6 料液比对总黄酮得率的影响
Fig. 6 Effect of solid to liquid ratio on total fl avonoid yield
由图6可知,并不是料液比越大得率越高,当料液比大于1∶25后得率呈显著降低的趋势。Li Chunhong等[22]用超声溶剂提取香椿嫩叶黄酮得出,料液比1∶40最佳。本实验因协同了酶法,可能使得乙醇用量在较少情况下也能获得较佳得率。
2.3.6 乙醇溶液体积分数对红油椿老叶总黄酮得率的影响

图7 乙醇溶液体积分数对总黄酮得率的影响
Fig. 7 Effect of ethanol concentration on total flavonoid yield
乙醇溶液体积分数不同,极性不同,从图7可以看出,随乙醇溶液体积分数的增加总黄酮得率先增加后减少,乙醇溶液体积分数为60%时效果较佳。
2.3.7 超声温度对红油椿老叶总黄酮得率的影响

图8 超声温度对总黄酮得率的影响
Fig. 8 Effect of extraction tem perature on total flavonoid yield
如图8所示,随着超声温度的升高,总黄酮得率增加,超声温度超过60 ℃时得率开始降低,故取60 ℃为最佳超声温度。
2.3.8 超声功率对红油椿老叶总黄酮得率的影响
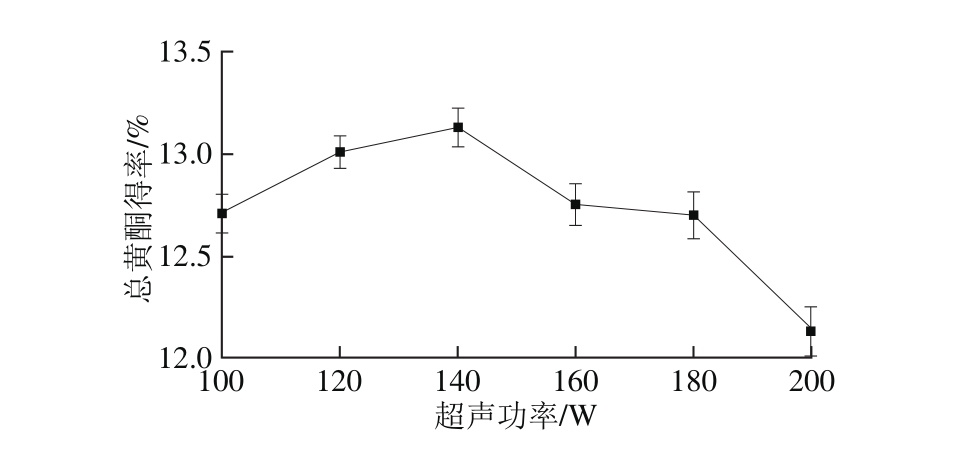
图9 超声功率对总黄酮得率的影响
Fig. 9 Effect of u ltrasonic power on total fl avonoid yield
如图9所示,随着超声功率的增加,得率呈先增加后减小的趋势,可能由于超声功率小,空化效应小;超声功率大,提取剂流动加快,超声波停留时间减小,使得率降低[23]。在140 W时得率最大。
2.3.9 超声时间对红油椿老叶总黄酮得率的影响
如图10所示,超声时间在10~40 min范围内,总黄酮得率随时间延长而增加,40 min后变化趋于平缓,再延长提取时间将增加成本,故选取超声时间40 min。

图10 超声时间对总黄酮得率的影响
Fig. 10 Effect of ultrasonication time on total fl avonoid yield
2.4 酶法-超声波提取红油椿老叶总黄酮得率的响应面试验结果
2.4.1 回归模型的建立及显著性检验
表3 Box-Behnken试验设计方案及结果
Table 3 Box-Behnken design with experimental results
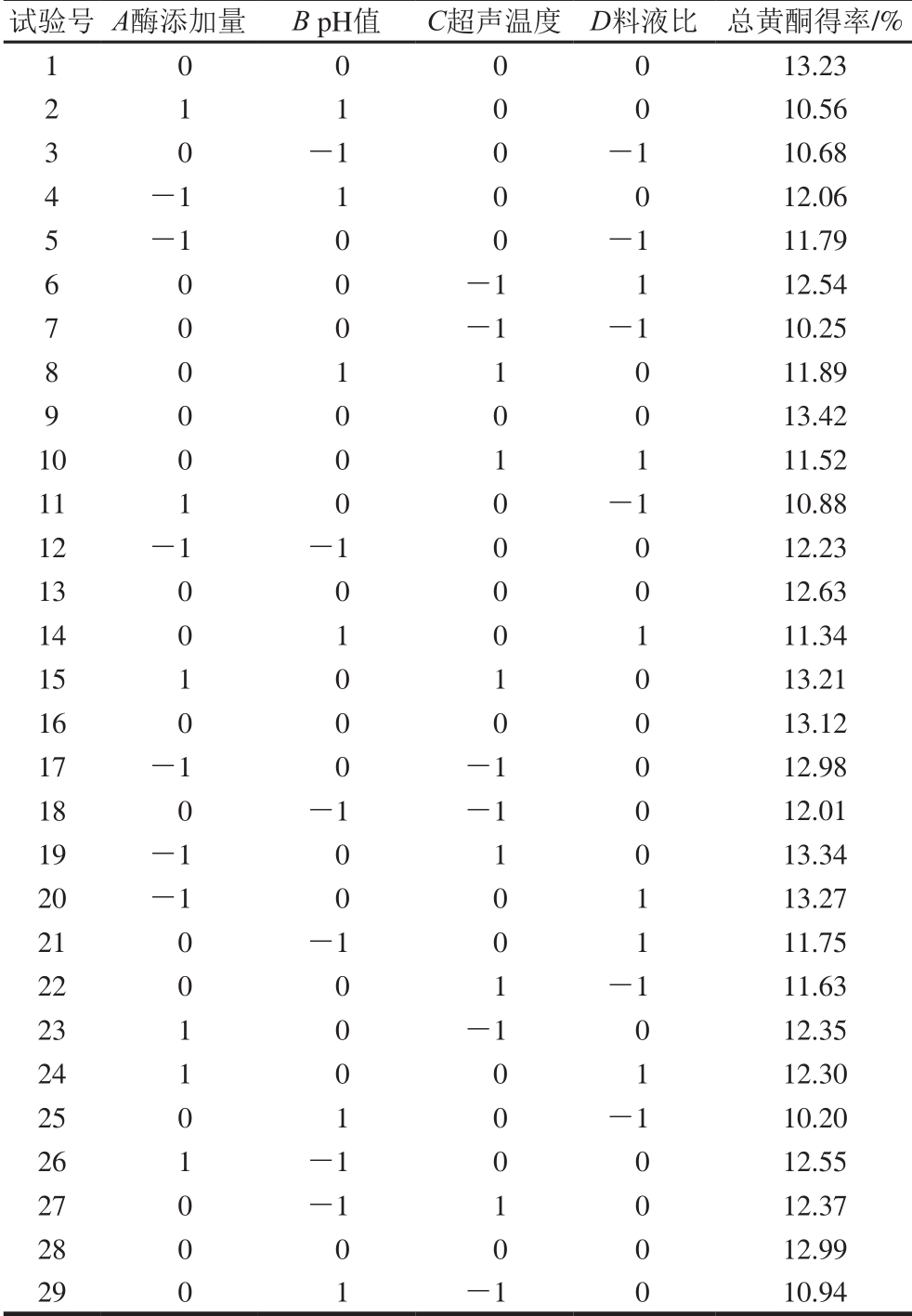
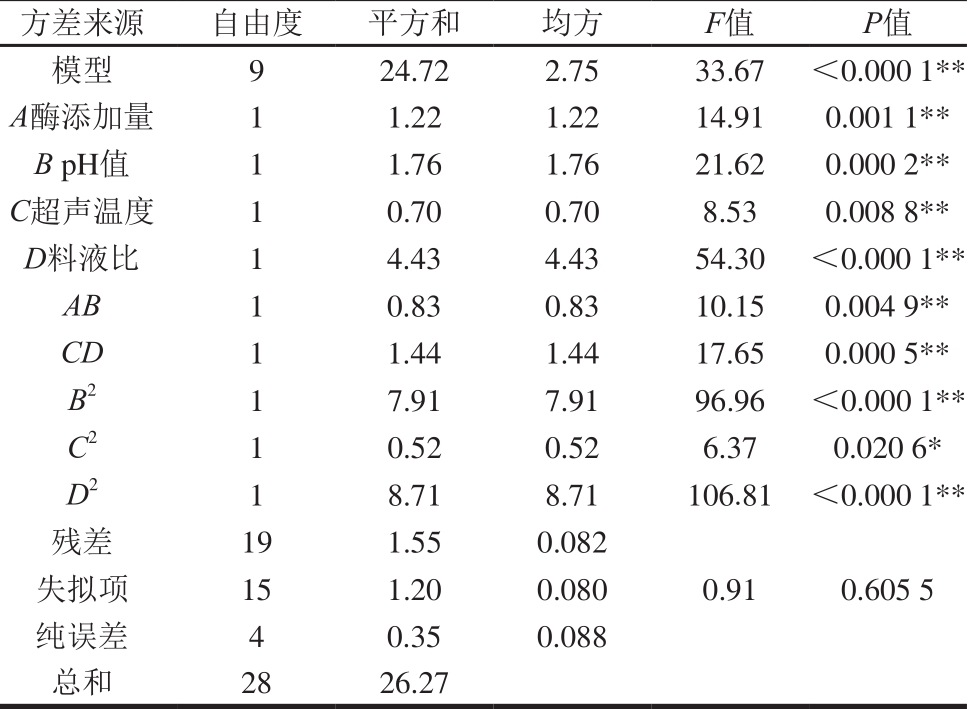
根据单因素试验结果,对影响总黄酮得率显著的因素(酶添加量、pH值、超声温度、料液比)进行四因素三水平响应面试验设计,结果见表3。以总黄酮得率为响应值,建立影响因素和红油椿老叶总黄酮得率间的数学模型[24]:Y1=13.08-0.32A-0.38B+0.24C+0.61D-0.45AB+0.13AC-0.015AD+0.15BC+0.017BD-0.60CD+0.041A2-1.08B2-0.27C2-1.13D2。经回归方程进行方差分析见表4,通过比较F值大小可知,4 个因素对总黄酮得率的影响顺序为D>B>A>C。
对不显著项进行逐步回归分析,得到优化后的回归方程为:Y2=13.10-0.32A-0.38B+0.24C+0.61D-0.46AB-0.60CD-1.08B2-0.28C2-1.14D2。通过对优化后的回归方程进行方差分析,如表5所示,发现模型是极显著的,而失拟项不显著,表明模型不存在失拟因素,回归模型各项的方差分析结果表明,一次项、二次项除A2外对总黄酮得率都有显著影响,各因素之间的交互作用AB和CD对总黄酮得率影响显著,R2为0.941 0,表明响应值的变化有94.10%来自所选变量,即试验设计所得的回归方程式拟合性好[25-26]。
表4 优化方程前的方差分析
Table 4 Analysis of variance for unop tim ized regression model

注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。表5同。
表5 优化方程后的方差分析
Table 5 Analysis of variance for optim ized regression model
2.4.2 响应面分析
从各因素方差分析结果可知,酶添加量、pH值、超声温度、料液比对总黄酮得率影响均为极显著,如图11所示,酶添加量与pH值、超声温度与料液比的等高线图均为椭圆,表示交互作用显著[27-28]。
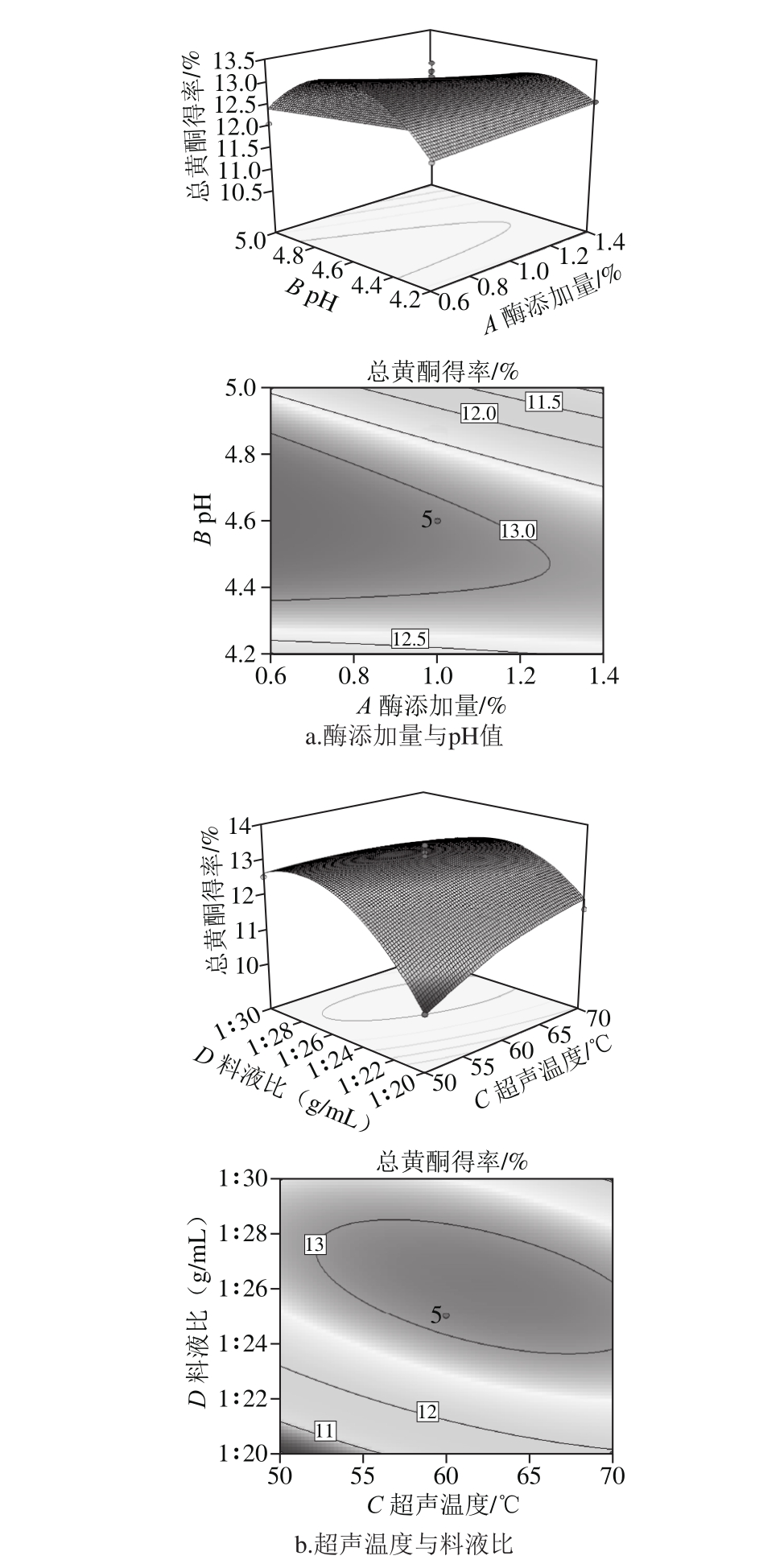
图11 交互作用对总黄酮得率影响的响应面和等高线图
Fig. 11 Response surface and contour p lots show ing the interactive effects of variab les on total flavonoids yield
2.4.3 验证实验结果
结合方程与响应面图得到4 个因素最优参数为酶添加量0.6%、pH 4.61、超声温度62.04 ℃、料液比1∶26.07(g/m L),得到的总黄酮得率预测值为13.51%,为方便实验进行,取各因素值分别为酶添加量0.6%、pH 4.6、超声温度62 ℃、料液比1∶25(g/m L),重复3 次,进行验证实验,总黄酮得率实际测得值为13.68%,相对标准偏差为0.59%,说明响应面法优化得到的参数准确可靠,具有参考价值。
2.4.4 提取次数
取0.5 g红油椿叶粉,按上述优化条件连续提取4 次,分别测定吸光度,依次是1.42、0.139、0.059、0.021,第1次提取所占百分比为87.12%,前2 次提取总和所占百分比为95.64%,说明已经提取出大部分总黄酮,故实验确定提取次数为2 次。连续提取2 次,红油椿老叶总黄酮得率为14.98%
2.4.5 与酶法提取比较
为了验证超声波联合酶法提取的有效性,分别进行酶法提取和超声波联合酶法提取,前者得率为11.56%,后者得率为12.98%,两者差异显著,说明超声波联合酶法提取红油椿老叶总黄酮的效果明显优于酶法提取。
2.5 红油椿老叶黄酮的HPLC检测
根据芦丁、槲皮素和山柰酚各自的标准溶液HPLC图可知,芦丁出峰时间4.648 m in,槲皮素出峰时间8.989 min,山柰酚出峰时间为14.160 m in,通过保留时间进行定性,如图12A所示,各峰依次为芦丁、槲皮素和山柰酚。结合图12A,对图12B分析,可推断红油椿老叶总黄酮粗提物中含有芦丁、槲皮素和山柰酚成分[29-30]。

图12 混合对照品(A)和红油椿老叶总黄酮样品液(B)的HPLC图谱
Fig. 12 HPLC chromatogram of m ixed standards (A) and total flavonoids (B) from Toon sinensis
根据标准曲线可知,芦丁质量浓度与峰面积的线性回归方程为Y=27 338X-3 576.4,R2=0.996 5,得到红油椿老叶总黄酮粗提物中芦丁的质量分数为0.16%;槲皮素质量浓度与峰面积的线性回归方程为Y=63 611X-14 361,R2=0.997 8,槲皮素的质量分数为0.06%;山柰酚质量浓度与峰面积的线性回归方程为Y=71 778X-13 648,R2=0.997 6,山柰酚的质量分数为0.03%。
本实验选用纤维素酶法联合超声波提取红油椿老叶总黄酮,经响应面优化后得到的最佳工艺为纤维素酶添加量0.6%、pH 4.6、45 ℃酶解120 m in,再经60%乙醇溶液、料液比1∶25(g/m L),超声功率140 W、62 ℃温度条件下超声波提取40 m in,连续提取2 次,红油椿老叶总黄酮得率为14.98%。与酶法提取相比,酶法联合超声波提取总黄酮效率更好,得率明显提高。
红油椿老叶总黄酮粗提物的HPLC分析结果表明,含有芦丁、槲皮素、山柰酚,质量分数分别为0.16%、0.06%、0.03%,红油椿中其他黄酮单体还有待进一步研究。
参考文献:
[1] 王玉荣, 江慎华, 陈勉华, 等. 香椿老叶粗提物抗氧化活性的研究[J].食品科技, 2011, 36(2): 186-188.
[2] 雷小华. 30 个香椿样本的性状评价与优选[D]. 武汉: 华中农业大学, 2004.
[3] 罗晓东, 吴少华, 马云保, 等. 椿叶的化学成分研究[J]. 中草药, 2001,32(5): 390-391. DOI:10.3321/j.issn:0253-2670.2001.05.003.
[4] MORIMOTO M, TAN IMOTO K, NAKANO S, et al. Insect antifeedant activity of flavones and chromones against Spodoptera litura[J]. Journal of Agricultural & Food Chem istry, 2003, 51(2):389-393. DOI:10.1021/jf025627a.
[5] 杨阳, 杨京霞, 王荣, 等. 太和香椿总黄酮的提取及含量测定[J]. 生物学杂志, 2011, 28(1): 91-93. DOI:10.3969/j.issn.1008-9632.2011.01.091.
[6] KAWAGUCHI K, KIKUCHI S R, HASUNUMA R, et al. Suppression of infection induced endotox in shock in m ice by a citrus fl avanone naringin[J]. Planta Medica, 2004, 70(1): 17-22. DOI:10.1055/s-2004-815449.
[7] LI Q N, HU B, HUANG L F, et al. Effect of low dose of hydrochloride tetracycline on bone metabolism mad uterus in ovariectonm ized rats[J]. Acta Pharmacologica Sinica, 2007, 24(6): 599-604.
[8] HSIEH T J, TSAI Y H, LIAO M C, et al. Anti-diabetic properties of nonpolar Toona sinensis Roem extract prepared by supercritical-CO2fl uid[J]. Food and Chem ical Toxicology, 2012, 50(3): 779-789.DOI:10.1016/j.fct.2011.12.023.
[9] ZHANG W, LI C, YOU L J, et al. Structural identification of compounds from Toona sinensis leaves w ith antioxidant and anticancer activities[J]. Journal of Functional Foods, 2014, 10: 427-435.DOI:10.1016/j.jff.2014.07.015.
[10] 章斌, 侯小桢. 复合酶法提取广佛手总黄酮的工艺[J]. 食品研究与开发, 2010, 31(10): 188-191. DOI:10.3969/j.issn.1005-6521.2010.10.056.
[11] 高霞, 刘聪燕, 陈彦, 等. 酶技术在中药黄酮类成分研究中的应用[J]. 中草药, 2014, 45(16): 2412-2417. DOI:10.7501/j.issn.0253-2670.2014.16.025.
[12] 丁彩梅. 超声强化超临界流体萃取香椿叶黄酮类化合物的研究[D].广州: 华南理工大学, 2004.
[13] 杨月云, 王小光, 郜蒙蒙. 超声波辅助提取香椿叶挥发成分的工艺优化[J]. 食品工业科技, 2015, 36(23): 261-265. DOI:10.13386/j.issn1002-0306.2015.23.045.
[14] 李秀信, 张院民. 香椿叶总黄酮含量测定方法研究[J]. 中国食品学报, 2010, 10(5): 243-248. DOI:10.3969/j.issn.1009-7848.2010.05.036.
[15] 张泽志, 韩春亮, 李成未. 响应面法在试验设计与优化中的应用[J]. 河南教育学院学报, 2011, 20(4): 34-37. DOI:10.3969/j.issn.1007-0834.2011.04.012.
[16] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41-45. DOI:10.3969/j.issn.1006-7167.2015.08.011.
[17] 王振伟, 申森, 胡晓冰. 刺梨中黄酮的超声提取及HPLC测定[J].湖北农业科学, 2014, 53(19): 4684-4687. DOI:10.14088/j.cnki.issn0439-8114.2014.19.046.
[18] 陈丛瑾. 香椿有效成分的提取纯化和生物活性研[D]. 长沙: 中南林业科技大学, 2010.
[19] ACEDO A J R, THANH C D, VAN L T S, et al. Tomato precooling using simp le hydrocooler and fruit quality changes during ambient and cold storage[J]. Acta Horticulturae(ISHS), 2009, 37: 135-140.DOI:10.17660/ActaHortic.2009.837.15.
[20] 吴梅林. 银杏叶中活性成分提取分离与测定研究[D]. 长沙: 中南大学, 2005.
[21] 石会军, 王文丰, 戴余军. 银杏叶黄酮酶法提取工艺的优化[J]. 食品科技, 2014, 39(10): 208-211.
[22] LI C H, MEI Z Q, ZHANG J P, et al. Optim ization of the extraction technology of total flavonoids from young leaves of Toona sinensis[J].Medicinal Plant, 2013, 4(1): 5-7.
[23] 刘智峰. 酶法-超声波辅助提取香椿叶中总黄酮及抗氧化活性研究[J]. 食品工业科技, 2015, 36(20): 314-319; 353. DOI:10.13386/j.issn1002-0306.2015.20.056.
[24] 徐向宏, 何明珠. 试验设计与Design-Expert、SPSS应用[M]. 北京:科学出版社, 2010: 146-157.
[25] 邹建国, 刘飞, 刘燕燕, 等. 响应面法优化微博辅助提取枳壳中总黄酮工艺[J]. 食品科学, 2012, 33(2): 24-28.
[26] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128. DOI:10.7506/spkx1002-6630-201306027.
[27] 彭晶, 杨颖, 牛付阁, 等. 响应曲面法优化大高良姜黄酮酶法提取工艺[J]. 食品科学, 2013, 34(14): 169-172. DOI:10.7506/spkx1002-6630-201314034. DOI:10.7506/spkx1002-6630-201314034.
[28] 李秀信, 张军华, 黄以超, 等. 响应面优化表面活性剂-微波提取香椿黄酮工艺[J]. 化学工程, 2011, 39(12): 11-16. DOI:10.3969/j.issn.1005-9954.2011.12.003.
[29] 张元梅, 周志钦, 孙玉敬, 等. 高效液相色谱法同时测定柑橘果实中18 种类黄酮的含量[J]. 中国农业科学, 2012, 45(17): 3558-3565.DOI:10.3864/j.issn.0578-1752.2012.17.012.
[30] 王慧, 黄聪, 刘思源, 等. HPLC测定刺梨中杨梅素和槲皮素的含量[J].中国实验方剂学杂志, 2013, 19(1): 109-111.
Ultrasonic-Assisted Enzymatic Extraction and HPLC Analysis of Flavonoids from Old Leaves of Toona sinensis
LONG Xiaoqin, TANG Jie, ZHAO Jingfang, ZENG Fankun*
(College of Food Science, Southwest University, Chongqing 400715, China)
Abstract:The present study aimed to optim ize the process parameters for the ultrasonic-assisted enzymatic extraction of total flavonoids from old leaves of Toona sinensis. Using one-factor-at-a-time method, enzyme dosage, pH, temperature, and solid to liquid ratio were identified as important factors affecting the total flavonoid yield. These factors were by response surface methodology. An HPLC method to determine total flavoids in T. sinensis was established. The results showed that the optimum conditions were as follows: hydrolysis w ith 0.6% cellulose at pH 4.6 and 45 ℃ for 120 min, followed by two cycles of 40 m in extraction at 62 ℃ w ith 60% ethanol as the extraction solvent at a solid to liquid ratio of 1:25 (g/m L) under 140 W ultrasonic irradiation. Under these conditions, the total flavonoid yield was 14.98%, which was significantly increased compared w ith traditional enzymatic extraction. The results of HPLC showed that the flavonoids extracted contained 0.16%rutin, 0.06% quercetin and 0.03% kaempferol.
Key words:leaves of Toona sinensis; response surface methodology; total flavonoids; high performance liquid chromatography (HPLC)
DOI:10.7506/spkx1002-6630-201722038
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)22-0256-07
引文格式:
龙晓琴, 唐杰, 赵景芳, 等. 红油椿老叶中黄酮的酶法-超声波提取及HPLC测定[J]. 食品科学, 2017, 38(22): 256-262.
DOI:10.7506/spkx1002-6630-201722038. http://www.spkx.net.cn
LONG Xiaoqin, TANG Jie, ZHAO Jingfang, et al. Ultrasonic-assisted enzymatic extraction and HPLC analysis of flavonoids from old leaves of Toona sinensis[J]. Food Science, 2017, 38(22): 256-262. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722038. http://www.spkx.net.cn
收稿日期:2017-01-22
基金项目:重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:龙晓琴(1993—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:1966619416@qq.com
*通信作者:曾凡坤(1963—),男,教授,硕士,研究方向为果蔬加工技术。E-mail: zengfankun@swu.edu.cn