表1 响应面试验因素与水平
Tab le 1 Code and level of independent variables used in response surface analysis

赵 超,叶海青,侯萍萍,杨 扬,周欣慧,钟姝凝,张铁华*
(吉林大学食品科学与工程学院,吉林 长春 130062)
摘 要:以林蛙卵为原料,以无水乙醇为提取剂,研究微波法对林蛙卵油提取率的影响。在单因素试验的基础上,进行响应面优化试验,研究料液比、浸泡时间、微波功率对林蛙卵油提取的影响。结果表明,提取最佳工艺条件为料液比1∶9.82(g/m L)、浸泡时间3.33 h、微波时间30 m in、微波功率600 W;林蛙卵油的提取率可达到(20±0.67)%。与其他林蛙卵油提取方法比较,微波法辅助提取林蛙卵油具有得率高的优点。对得到的林蛙卵油采用气相色谱-质谱分析检测出27 种脂肪酸,不饱和脂肪酸质量分数54.98%,其中以亚油酸、二十碳二烯酸、二十碳三烯酸、二十碳四烯酸、亚麻酸、棕榈反油酸、二十二碳五烯酸含量较高。
关键词:林蛙卵油;微波辅助;提取率;响应面分析;脂肪酸含量
中国林蛙是一种名贵的补品和滋补性中药材[1-2]。溶剂浸提法和超临界流体萃取法得到的林蛙卵油中不饱和脂肪酸含量大约占到70%,由C12~C22脂肪酸组成,主要不饱和脂肪酸是十六碳烯酸、亚油酸、油酸、二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA),其中亚麻酸质量分数为0.16%~0.21%,二十碳四烯酸质量分数为0.66%~1.02%[3]。李成义等[4]证明了林蛙卵油中含脂溶性维生素,如VA、VD、VE、VK、β-胡萝卜素。此外,林蛙卵油还有很高的药用价值,具有降血脂、抑制焦虑、保护卵巢、调节妇科内分泌、抗惊厥、中枢神经抑制作用[5-9]。综上所述,林蛙卵油将是未来新型绿色保健食品和药品。但是目前从林蛙卵中提取林蛙卵油方法有超临界流体萃取法[10]和溶剂浸提法[11],这2 种方法林蛙卵油最大的提取率为18.7%,存在提取率低、成本高等问题。
近年来,利用微波技术提取油脂得到了广泛应用[12-15]。张佰清等[16]采用微波辅助提取树莓籽油,提高了树莓籽油得率。为了提高林蛙卵油提取率,本实验将微波应用于林蛙卵油提取工艺中,采用Box-Behnken试验设计结合响应面分析方法,以料液比、浸泡时间、微波时间、微波功率为考察因素,确定微波法辅助提取林蛙卵油的最佳工艺。结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析技术对油脂的组成进行分析测定,对其营养价值进行评价。为林蛙卵油的深入研究和开发保健型食品提供理论依据,为废弃物林蛙卵的综合开发利用提供新的思路和方法。
1.1 材料与仪器
林蛙卵采自于东北长白山区林蛙;其他试剂均为国产分析纯。
M L3002型电子天平 瑞士M ettler-Toledo公司;GX-04型粉碎机 浙江高鑫工贸有限公司;MAS-II型微波萃取仪 上海新仪微波化学科技有限公司;EYELAN-1100型旋转蒸发仪 上海爱朗仪器有限公司;5975-6890N型GC-MS联用仪 美国Agilent科技有限公司。
1.2 方法
1.2.1 工艺流程
林蛙卵→粉碎→浸提→微波萃取→过滤→去除溶剂→装瓶
将含水量小于6%的林蛙卵粉用40目筛网筛分,每次准确称取林蛙卵粉质量10 g,在无水乙醇中浸提,采用微波法辅助提取,提取结束后沉降1 h,过滤,将上述操作重复进行2 次,合并上清液,备用。
1.2.2 微波法辅助提取林蛙卵油的单因素试验
以料液比(1∶7、1∶8、1∶9、1∶10、1∶11(g/m L)、浸泡时间(3、3.5、4、4.5、5 h)、微波时间(10、20、30、40、50 m in)、微波功率(400、500、600、700、800 W)为影响因素,以林蛙卵油提取率为指标进行单因素试验。
1.2.3 响应面试验设计
根据Box-Behnken试验设计原理,其因素固定条件为微波温度30 ℃,微波时间30 m in,选择料液比(A)、浸泡时间(B)、微波功率(C)为响应面试验因素,响应面试验设计见表1。
表1 响应面试验因素与水平
Tab le 1 Code and level of independent variables used in response surface analysis

1.2.4 林蛙卵油的脂肪酸组成分析
1.2.4.1 样品处理
称取0.5 g林蛙卵油,加入5 m L 0.5 m o l/L KOHCH3OH溶液,70 ℃皂化回流5 m in,冷却到室温,从冷凝管顶部加入1 m L BF3,保持20 m in,冷却后加入1 m L正己烷溶液,取上清液进行GC-MS分析[17-18]。
1.2.4.2 色谱条件
色谱柱:Agilent 19091G-133毛细管柱(30 m×0.25 mm,0.25 μm),载气为氦气。流速1 mL/min,分流比30∶1,脂肪酸甲酯分析条件:初始温度100 ℃,保持1 min;以8 ℃/min速率升至280 ℃;保持20 min。
1.2.4.3 质谱条件
分析采用电子电离源(70 eV),选取全扫描模式,扫描范围m/z 50~550。在脂肪酸的分析中,根据GC-MS中各组分保留时间以及质谱图,通过脂肪酸标准品、NIST和Varian标准谱库检索进行鉴定,采用峰面积归一化法计算各脂肪酸的相对含量[19-21]。
1.2.5 林蛙卵油提取率计算
称取1.2.1节所得上清液,倒入旋转蒸发瓶中,称量旋转蒸发瓶质量,用减压蒸馏装置除去溶剂,挥发完后,称量旋转蒸发瓶的质量,进行3 次平行实验,结果取平均值,按下式计算林蛙卵油提取率:
式中:m1为挥发前旋转蒸发瓶质量;m2为挥发后旋转蒸发瓶质量。
1.3 数据处理
每组数据重复3 次,采用Origin 8.0绘图,通过SPSS 19.0软件进行显著性分析,响应面试验设计与分析采用Design-Expert 8.0软件。
2.1 料液比对林蛙卵油提取率的影响
选用无水乙醇作为提取溶剂,操作参数为微波温度30 ℃、浸泡时间3.5 h、微波时间10 m in、微波功率500 W。如图1所示,料液比1∶10(g/m L)时,林蛙卵油提取率最高,且料液比1∶7~1∶10(g/m L)的林蛙卵油提取率有显著性提高(P<0.05)。这可能由于当林蛙卵粉质量一定时,溶液体积增大,接触面积增大,分子扩散速率增加,有利于林蛙卵油的提取。但是提取溶剂比例太大时,部分微波会被有机溶剂吸收,对林蛙卵粉内部的微波作用减少,细胞破碎能力减弱,林蛙卵油提取率降低[22-23]。从而,确定料液比为1∶10(g/m L)。
2.2 浸泡时间对林蛙卵油提取率的影响
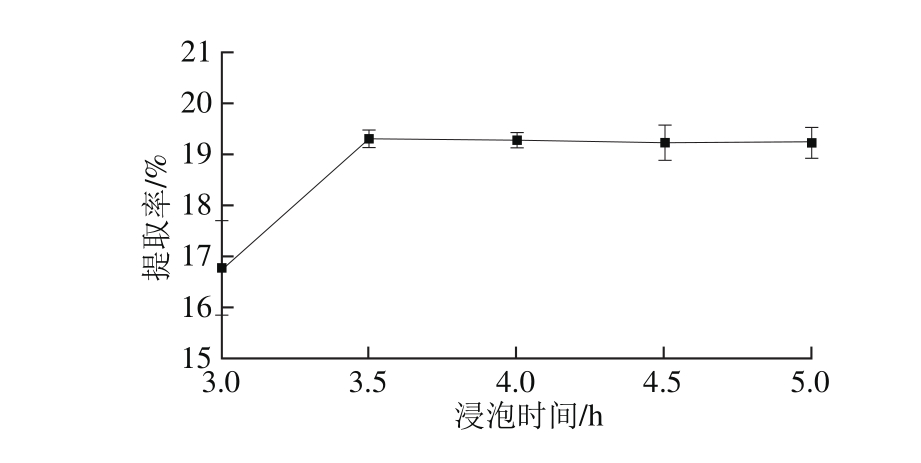
图2 浸泡时间对提取率的影响
Fig. 2 Effect of soaking time on the extraction yield of oil
选用无水乙醇作为提取溶剂,操作参数为料液比1∶10(g/m L)、微波温度30 ℃、微波时间10 m in、微波功率500 W。由图2可知,在3.5 h时,林蛙卵油提取率最高,且在浸泡时间3.0、3.5 h下林蛙卵油提取率有显著差异性(P<0.05)。随着浸泡时间的延长,林蛙卵油提取率变化不显著,从节约时间和劳动力成本考虑,确定林蛙卵油提取时间以3.5 h最佳。
2.3 微波时间对林蛙卵油提取率的影响
选用无水乙醇作为提取溶剂,操作参数为料液比1∶10(g/m L)、微波温度30 ℃、浸泡时间3 h、微波功率500 W。如图3所示,当微波时间为30 m in时,林蛙卵油提取率最大。随着时间的延长,细胞中的油脂与乙醇溶液逐渐达到了相对平衡[24-26]。大于30 m in以后,提取率变化不显著,考虑到温度升高,油会分解或挥发。从而,确定微波时间为30 m in。
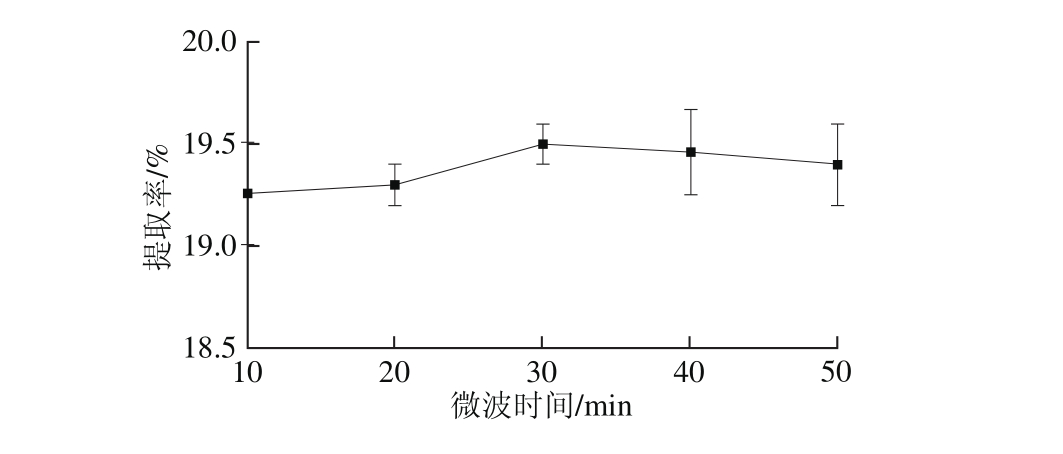
图3 微波时间对提取率的影响
Fig. 3 Effect of m icrowave irradiation time on the extraction yield of oil
2.4 微波功率对林蛙卵油提取率的影响
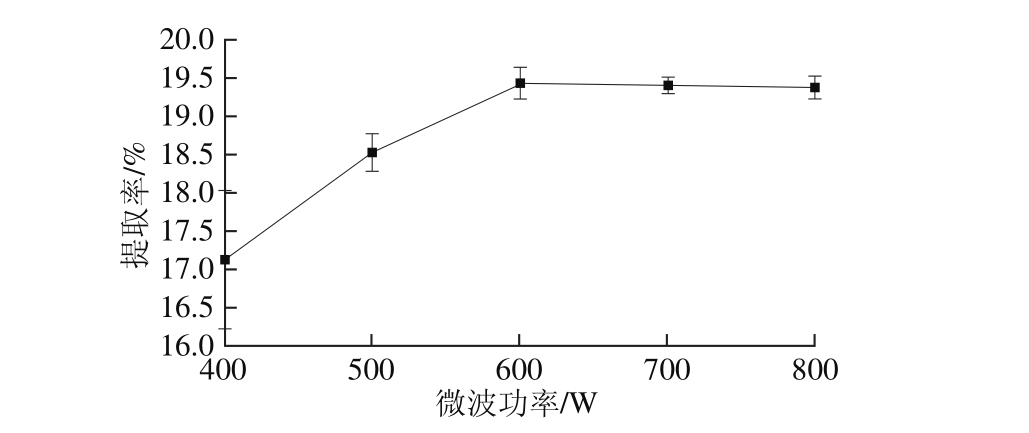
图4 微波功率对提取率的影响
Fig. 4 Effect of m icrowave power on the extraction yield of oil
选用无水乙醇作为提取溶剂,操作参数为料液比1∶10(g/m L)、微波温度30 ℃、浸泡时间3 h、微波时间20 m in。由图4可知,当微波功率为600 W时,林蛙卵油提取率最大。且400、500 W和600 W功率条件下林蛙卵油提取率具有显著差异性(P<0.05)。这是因为微波产生大量能量,经过热效应作用,萃取物的细胞结构破裂。随着功率的增加,热效应越激烈,提取物吸收的能量越多,细胞结构破裂程度越高[27-28]。当600 W以后,温度升高,部分溶剂会挥发,冷凝的效果不明显,所以林蛙卵油提取率会有所降低,从而确定微波功率为600 W。
2.5 响应面试验结果与分析
根据单因素试验结果,以料液比(A)、浸泡时间(B)、微波功率(C)为影响因素,以提取率为响应值进行试验设计,试验方案及结果如表2所示。在料液比1∶10(g/m L)、浸泡时间3.5 h、微波功率600 W时林蛙卵油提取率最高,为20.8%。
以林蛙卵油提取率为响应值,利用Design-Expert 8.0软件对林蛙卵油提取率结果进行回归分析,其回归方程为:Y=20.24-0.31A-0.33B+0.063C+0.43AB+0.45AC+0.025BC-1.27A2-0.59B2-0.7C2。
由表3可知,回归方程模型F值为3.78,P值为0.046 7,回归显著;失拟项P值为0.508 7(>0.1),说明模型失拟值不显著,因此模型可以用于林蛙卵油提取率测定。一次项、交叉项对响应值影响不显著,模型二次项A2影响显著,各因素影响按主次排位顺序为浸泡时间>料液比>微波功率。
表2 响应面试验设计及结果
Table 2 Experimental design w ith results for response surface analysis

表3 响应面二次回归模型分析结果
Table 3 Analysis of variance for response surface quadratic model
注:*. P<0.05,差异显著。
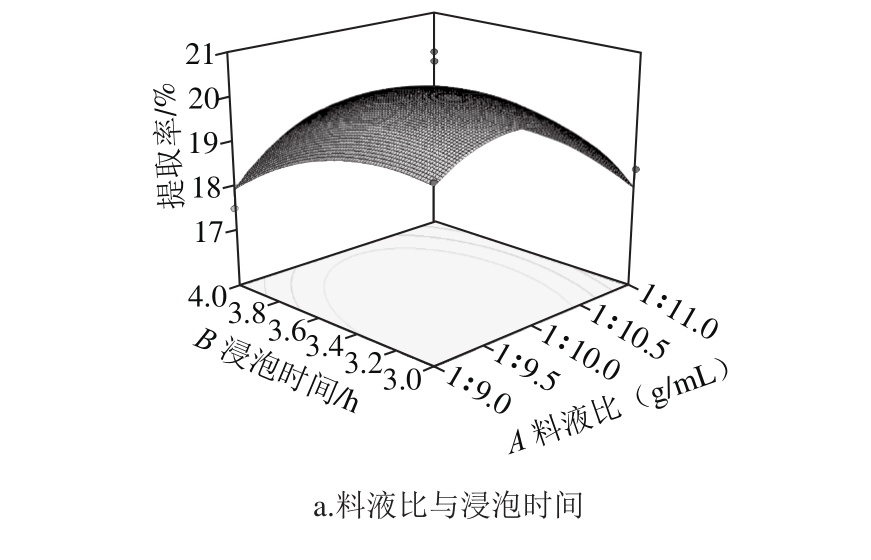
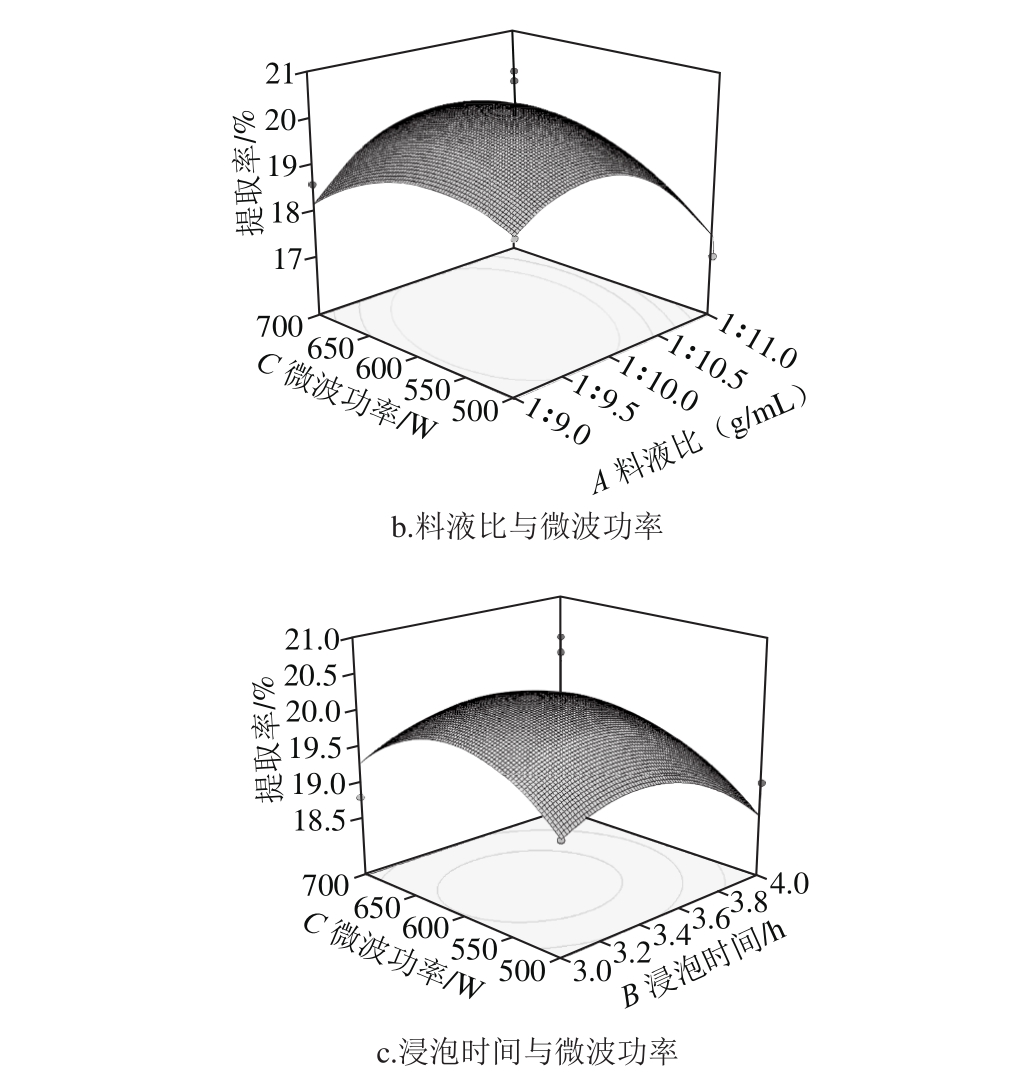
图5 交互因素对林蛙卵油提取率的影响
Fig. 5 Response surface p lots show ing the interactive effects of various factors on the extraction yield of oil
由图5a可知,料液比一定时,林蛙卵油提取率随着浸泡时间的延长成先增大后减小的趋势,浸泡时间一定时,林蛙卵油提取率随着料液比的增大呈现先增大后减小的趋势。由图5b可知,料液比一定时,林蛙卵油提取率随着微波功率的增加呈现先增大后减小的趋势,微波功率一定时,林蛙卵油提取率随着提取溶剂用量的增大呈现先增大后减小的趋势。由图5c可知,浸泡时间一定时,林蛙卵油提取率随着微波功率的延长成先增大后减小的趋势,微波功率一定时,林蛙卵油提取率随着浸泡时间的增大呈现先增大后减小的趋势。
通过对二次回归方程求一阶偏导,计算得到林蛙卵油提取率的最佳工艺为料液比1∶9.82(g/m L)、浸泡时间3.33 h、微波功率598.12 W。由于实际操作原因,得到提取林蛙卵油最佳工艺条件为料液比1∶9.82(g/m L)、浸泡时间3.33 h、微波功率600 W。2.6 林蛙卵油脂肪酸结果分析
由表4可知,GC-MS法共分离得到27 种脂肪酸,饱和脂肪酸相对含量为36.5%,其中十八碳酸相对含量为17.199%。不饱和脂肪酸占54.98%,多不饱和脂肪酸占50.02%。亚油酸含量最高,相对含量为24.41%。二十碳三烯酸相对含量为7.02%。与金莉莉等[3]检测超临界流体萃取法和溶剂浸提法得到的林蛙卵油相比,3 种方法提取的林蛙卵油脂肪酸组成基本一致,由C12-22脂肪酸组成,但主要脂肪酸及含量略微不同。在饱和脂肪酸含量上,微波法提取林蛙卵油饱和脂肪酸相对含量增加约8.83%,超临界流体萃取法和溶剂浸提法提取林蛙卵油中饱和脂肪酸十六碳酸相对含量最多,微波法中十八碳酸相对含量最多。在不饱和脂肪酸的含量上,超临界流体萃取法和溶剂浸提法得到林蛙卵油中主要不饱和脂肪酸为十六碳烯酸、亚油酸、油酸、EPA、DHA。微波法中,主要不饱和脂肪酸为亚油酸、二十碳二烯酸、二十碳三烯酸、二十碳四烯酸、亚麻酸、棕榈反油酸、二十二碳五烯酸。这是降低血脂,降低血压和血糖,预防出血性脑疾病和血栓性疾病,预防过敏性疾病,增强人体免疫力和减缓人体衰老等的主要物质基础[29-30]。
表4 林蛙卵油脂肪酸的组成及相对含量
Table 4 Fatty acid com position of Rana chensinensis egg oil

注:表中相对分子质量及分子式均为脂肪酸甲酯。
微波法辅助提取林蛙卵油各因素影响按由大到小顺序为浸泡时间>料液比>微波功率。研究得到提取林蛙卵油最佳工艺条件为微波时间30 m in、料液比1∶9.82(g/m L)、浸泡时间3.33 h、微波功率600 W。在此工艺条件下,林蛙卵油的提取率可达到(20±0.67)%。与其他方法比较,微波法辅助提取林蛙卵油具有得率高的优点,采用GC-MS法对脂肪酸成分分析,微波法中主要不饱和脂肪酸为亚油酸、二十碳二烯酸、二十碳三烯酸、二十碳四烯酸、亚麻酸、棕榈反油酸、二十二碳五烯酸。
参考文献:
[1] ZHANG X, CHENG Y Y, YANG Y, et al. Polypeptides from the skin of Rana chensinensis exert the antioxidant and antiapoptotic activities on HaCaT cells[J]. Animal Biotechnology, 2016, 28(1): 1-10. DOI:10.1080/10495398.2016.1188825.
[2] WANG Z Y, ZHAN Y Y, SU T T, et al. Characterization and antioxidant activity in vitro and in vivo of polysaccharide purified from Rana chensinensis skin[J]. Crabohydrate polymers, 2015, 126(21): 17-22. DOI:10.1016/j.Carbpol.2015.03.031.
[3] 金莉莉, 王秋雨, 娄虹, 等. 林蛙卵油脂肪酸组分的分析研究[J].食品科学, 2004, 25(10): 232-234.
[4] 李成义, 孙文伟, 姜熙罗, 等. 哈士蟆卵油化学成分的分析[J]. 中国药学杂志, 1994, 29(12): 712-713.
[5] 朱立夫. 林蛙卵油软胶囊对高脂血大鼠的降脂效果初步研究[J].黑龙江科技信息, 2013(31): 65-66.
[6] 闫清伟, 田青. 中国林蛙卵油对焦虑大鼠行为的影响[J]. 心理与行为研究, 2013, 11(5): 622-628.
[7] 苑春莉, 孙连坤, 康劲松. 林蛙卵油灌胃对于雄激素预处理大鼠妇科内分泌的影响[J]. 中国实验诊断学, 2010, 14(2): 196-198.
[8] 彭飞. 中国林蛙卵油的抗惊厥作用[D]. 沈阳: 沈阳药科大学, 2002:1-78.
[9] 彭飞, 于虹, 徐峰, 等. 中国林蛙卵油的中枢抑制作用[J]. 沈阳药科大学学报, 2002, 19(3): 204-207.
[10] 张学义. CO2超临界萃取技术提取中国林蛙卵油的研究[J]. 中国林副特产, 2006(5): 17-18. DOI:10.13268/j.cnki.fbsic.2006.05.007.
[11] 李志东, 宋旭鹭, 张洪林, 等. 影响林蛙卵油提取率工艺参数的研究[J].中国食品添加剂, 2007(1): 89-91.
[12] HU B, LI C, ZHANG Z Q, et al. M icrow ave-assisted extraction of silkworm pupal oil and evaluation of its fatty acid composition,physicochem ical properties and antioxidant activities[J]. Food Chem istry, 2017, 231: 348-355. DOI:10.1016/j.foodchem.2017.03.152.
[13] KUSUMA H S, MAHFUD M. K inetic studies on extraction of essential oil from sandalwood (Santalum album) by m icrowave airhydrodistillation method[J]. A lexandria Engineering Journal, 2017.DOI:10.1016/j.aej.2017.02.007.
[14] LUCCHESI M E, CHEMAT F, SMADJA J. Solvent-free m icrowave extraction of essential oil from aromatic herbs: comparison w ith conventional hydro-distillation[J]. Journal of Chromatography A,2004, 1043(2): 323-327. DOI:10.1016/j.chroma.2004.05.083.
[15] AZCAN N, DANISMAN A. M icrowave assisted transesterification of rapeseed oil[J]. Fuel, 2008, 87(10/11): 1787-1788. DOI:10.1016/j.fuel.2007.12.004.
[16] 张佰清, 李龙杰, 张艳艳. 响应面法优化微波辅助提取树莓籽油工艺[J]. 食品科学, 2011, 32(4): 92-96.
[17] DIAS H M A M, BERBICZ F, PEDROCHIC F, et al. Butter cholesterol removal using diff erent complexation methods w ith beta-cyclodextrin,and the contribution of photoacoustic spectroscopy to the evaluation of the complex[J]. Food Research International, 2010, 43: 1104-1110.
[18] ALONSO L, CUESTA P, FONTECHA J, et al. Use of β-cyclodextrin to decrease the level of cholesterol in m ilk fat[J]. Journal of Dairy Science, 2009, 92(3): 863-869.
[19] FADAVI A, BARZEGAR M, AZIZI M H. Determ ination of fatty acids and total lipid content in oilseed of 25 pomegranates varieties grown in Iran[J]. Journal of Food Composition and Analysis, 2006, 19: 676-680.DOI:10.1016/j.jfca.2004.09.002.
[20] BOGA M, ERTAS A, YILMAZ M A, et al. UHPLC-ESI-MS/MS and GC-MS analyses on phenolic, fatty acid and essential oil of verbascum pinetorum w ith antioxidant, anticholinesterase, antim icrobial and DNA damage protection effects[J]. Iranian Journal of Pharmaceutical Research, 2016, 15(3): 393-405.
[21] WANG J, WU W W, WANG X D, et al. An effective GC method for the determ ination of the fatty acid composition in silkworm pupae oil using a two-step methylation process[J]. Journal of the Serbian Chemical Society, 2015, 80(1): 9-20. DOI:10.2298/JSC140401073W.
[22] CHANIOTI S, TZIA C. Optim ization of ultrasound-assisted extraction of oil from olive pomace using response surface technology: oil recovery, unsaponifiable matter, total phenol content and antioxidant activity[J]. LWT-Food Science and Technology, 2017, 79: 178-179.DOI:10.1016/j.lw t.2017.01.029.
[23] HASHEM I S M B, KHANEGHAH A M, NIKMARAM N, et al.Heating, m icrowave and UV irradiation eff ects on oxidative stability of Sardasht red grape (Vitis vinifera cultiv. Sardasht) seed oil[J].International Journal of Food Science and Technology, 2017, 52(6):1341-1347. DOI:10.1111/ijfs.13421.
[24] JMASON T, CHEMAT F, VINATORU M. The extraction of natural p roducts using ultrasound or m icrow aves[J]. Current Organic Chem istry, 2011, 15(2): 237-247.
[25] 张雯雯, 张宏, 郑华, 等. 余甘子核仁油的微波辅助萃取工艺优化及脂肪酸组成分析[J]. 食品科学, 2013, 34(20): 13-18. DOI:10.7506/spkx1002-6630-201320003.
[26] LI X L, WANG B B, WU S X, et al. Optim izing the conditions for the microwave-assisted pyrolysis of cotton stalk for bio-oil production using response surface methodology[J]. Waste and Biomass Valorization, 2017,8(4): 1361-1369. DOI:10.1007/s12649-016-9692-0.
[27] DERYA KOC A K. A lternative to traditional olive pomace oil extraction systems: m icrowave-assisted solvent extraction of oil from wet olive pomace[J]. LWT-Food Science and Technology, 2017, 77:45-51. DOI:10.1016/j.lw t.2016.11.020.
[28] LUCCHESI M E, SMADJA J, BRADSHAW S, et al. Solvent free m icrowave extraction of Elletaria cardamomum L.: a multivariate study of a new technique for the extraction of essential oil[J].Journal of Food Engineering, 2007, 79(3): 1079-1086. DOI:10.1016/j.jfoodeng.2006.03.029.
[29] 张文文, 杨敬辉, 吴琴燕, 等. 西瓜籽油提取工艺优化及稳定性研究[J]. 江苏农业学报, 2013, 29(6): 1520-1522. DOI:10. 3969/j.issn.1000-4440.2013 06.057.
[30] 张媛, 王喆之. 火麻仁脂溶性成分的GC-MS分析[J]. 西北植物学报,2006, 26(9): 1955-1958.
Optimization of M icrowave-Assisted Extraction and Fatty Acid Composition of Rana chensinensis Egg Oil
ZHAO Chao, YE Haiqing, HOU Pingping, YANG Yang, ZHOU Xinhui, ZHONG Shuning, ZHANG Tiehua*
(College of Food Science and Engineering, Jilin University, Changchun 130062, China)
Abstract:The m icrowave-assisted extraction of oil from Rana chensinensis eggs using anhydrous ethanol as the extraction solvent was optimized by one-factor-at-a-time method and response surface methodology. With this aim, we investigated the eff ect of solid-to-solvent ratio, soaking time and m icrowave power on the oil yield. The results obtained from the study showed that the optim ized conditions were as follow s: solid-to-solvent ratio, 1:9.82 (g/m L); soaking time, 3.33 h; m icrowave irradiation time, 30 min; and m icrowave power, 600 W. Under these conditions, the oil yield could reach (20 ± 0.67)%,which was higher than that obtained by other extraction methods. By gas chromatography-mass spectrometry (GC-MS),27 fatty acids in the extracted oil were detected. Unsaturated fatty acids accounted for 54.98% of the total fatty acids in the oil, w ith 9-octadecadienoic acid, cis-11,14-eicosadienoic acid, 7,11,14-eicosatrienoate, 8,11,14,17-eicosatetraenoate,9,12,15-octadecatrienoic acid, 9-hexadecenoic acid and 7,10,13,16,19-docosapentaenoate being predom inant.
Key words:Rana chensinensis egg oil; microwave-assisted extraction; extraction yield; response surface methodology; fatty acid composition
DOI:10.7506/spkx1002-6630-201722039
中图分类号:TS225.2
文献标志码:A
文章编号:1002-6630(2017)22-0263-06
引文格式:
赵超, 叶海青, 侯萍萍, 等. 微波辅助提取林蛙卵油的工艺优化及脂肪酸组成分析[J]. 食品科学, 2017, 38(22): 263-268.
DOI:10.7506/spkx1002-6630-201722039. http://www.spkx.net.cn
ZHAO Chao, YE Haiqing, HOU Pingping, et al. Optimization of microwave-assisted extraction and fatty acid composition of Rana chensinensis egg oil[J]. Food Science, 2017, 38(22): 263-268. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722039. http://www.spkx.net.cn
收稿日期:2017-05-27
基金项目:吉林省科技学技术厅成果转化项目(20130727074YY)
作者简介:赵超(1995—),女,硕士研究生,研究方向为农产品精深加工与食品生物技术。E-mail:2268017612@qq.com
*通信作者:张铁华(1970—),男,教授,博士,研究方向为农产品精深加工与食品生物技术。E-mail:zhangth@jlu.edu.cn