表1 响应面试验设计因素与水平
Table 1 Code and level of independent variables used for response surface analysis
刘婷婷,张 晶,刘 阳,宋云禹,张闪闪,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:以毛葱为原料,利用超声波微波协同法提取毛葱水溶性多糖。以多糖得率为考察指标,在单因素试验的基础上,通过响应面分析方法确定毛葱水溶性多糖提取的最佳工艺为液料比17∶1(m L/g)、超声波功率360 W、微波功率200 W、协同时间16 m in,此条件下毛葱水溶性多糖得率为(11.92±0.13)%。溶解性实验结果表明:该毛葱水溶性多糖可溶于水,不溶于有机溶剂;显色反应实验结果表明:该毛葱水溶性多糖含有糖醛酸,但不含淀粉及酚类物质。紫外光谱分析显示该毛葱水溶性多糖无明显的核酸和蛋白质的特征吸收峰,傅里叶变换红外光谱分析显示该毛葱水溶性多糖具有多糖类的特征吸收峰。高效凝胶渗透色谱法分析该毛葱水溶性多糖的重均分子质量,可初步得出该毛葱水溶性多糖不是由均一组分构成的。
关键词:毛葱;水溶性多糖;超声波微波协同法
毛葱,学名为“分蘖葱头(Allium cepa L. var.agrogatum Don)”,是洋葱的丛生变种,属百合科葱属类植物[1-2]。毛葱原产于中亚、西亚等地,因其具有适宜黑土地生长、生长周期短等特点,20世纪初在我国东北地区广泛种植[3-4]。毛葱是一种既可生食也可烹制[5]的食物,广受大众喜爱。其可食鳞茎中富含糖类、蛋白质等基本物质[6],还具有含硫化合物、黄酮类化合物等多种活性成分[7],研究已证实毛葱中含有的甲基烯丙基三硫等含硫化合物具有抑制血小板和血栓素A2合成的作用[8]。现阶段对毛葱有效成分的研究大多集中在毛葱油[9]、黄酮类化合物[5]等方面,对毛葱多糖类化合物的研究鲜见报道。
植物多糖是由植物代谢产生的聚合度很高的多聚物,具有多种生物活性,是目前研究最多的一类多糖[10]。近年来,多糖的提取方法有化学提取法、酶解法、物理强化法及将不同技术进行综合使用的方法[11]。超声波微波协同法是一种将2 种不同方法进行综合利用的提取技术,具有提取时间短、提取效率高等特点[12],已被广泛应用在物质的制备与提取等方面[13-14],如复合膜的制备[15]、海蒿子多糖的提取[16]、富硒蛹虫草硒多糖的提取[17]等。
本研究使用超声波微波协同法提取毛葱水溶性多糖,通过响应面试验筛选出最佳提取工艺参数,并对所提取的毛葱水溶性多糖进行初步鉴定与分析,为毛葱的高附加值综合利用提供一定的参考依据。
1.1 材料与试剂
毛葱 吉林省乌拉街镇农贸市场;无水乙醇、三氯甲烷、正丁醇等均为分析纯 北京化工厂。
1.2 仪器与设备
UW ave-1000型微波-紫外-超声波三位一体合成萃取反应仪 上海新仪微波化学科技有限公司;IR PRESTIGE-21傅里叶变换红外光谱仪 日本岛津公司;EX 224型电子天平 奥豪斯公司(上海)有限公司;KDC-1042型低速离心机 安徽中科中佳科学仪器有限公司;SHB-B95A型循环水式真空泵 郑州长城科工贸有限公司;UV 2100紫外-可见分光光度计 美国Unico公司;515型高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 毛葱水溶性多糖提取工艺流程
毛葱→去皮、除杂→破碎→调整液料比→超声波微波协同法浸提→过滤→离心(3 800 r/m in,15 m in)→上清液脱蛋白(1/5 Sevag试剂,V(正丁醇)∶V(氯仿)=1∶4,振荡20 m in)→浓缩→醇沉(4 倍体积分数90%乙醇溶液,12 h,4 ℃)→离心(3 800 r/m in,15 m in)→沉淀→冻干→毛葱水溶性多糖
1.3.2 超声波微波协同法提取毛葱水溶性多糖单因素与响应面试验
1.3.2.1 单因素试验
选取液料比、超声波功率、微波功率、协同时间为考察因素。提取温度80 ℃,液料比设定为10∶1、15∶1、20∶1、25∶1、30∶1 (m L/g),超声波功率设定为250、300、350、400、450 W,微波功率设定为100、150、200、250、300 W,协同时间设定为5、10、15、20、25 m in,以毛葱水溶性多糖得率为考察指标进行试验。每组单因素试验做3 组平行试验。单因素试验中不变的因素设定为液料比20∶1(m L/g),超声波功率300 W,微波功率200 W,协同时间20 m in。
1.3.2.2 超声波微波协同法响应面试验优化
根据单因素试验结果,对1.3.2节中的4 个单因素进行响应面试验设计,确定毛葱水溶性多糖提取方法的最佳提取工艺参数,因素与水平如表1所示。
表1 响应面试验设计因素与水平
Table 1 Code and level of independent variables used for response surface analysis

1.3.3 毛葱水溶性多糖得率的计算方法
式中:m1为冻干后毛葱水溶性多糖的质量/g;m0为毛葱中干物质质量/g;Y为得率/%。
1.3.4 毛葱水溶性多糖显色反应的测定1.3.4.1 碘-碘化钾反应实验
参照朱磊[18]方法,配制质量分数2%的碘化钾溶液,加入适量的碘使溶液呈淡棕黄色,之后取1 m L淀粉溶液(1 mg/mL)、1 mL毛葱水溶性多糖溶液(1 mg/mL)、1 m L水,分别加入碘-碘化钾溶液,观察颜色变化。如果毛葱水溶性多糖中含有淀粉则呈现出蓝色。
1.3.4.2 三氯化铁反应实验
参照朱磊[18]方法,毛葱水溶性多糖溶液(1 mg/m L)中加入适量氯化铁,观察颜色变化。
1.3.4.3 硫酸-咔唑反应实验
参照刘莹等[19]方法,精确称取0.125 g咔唑,溶于100 m L乙醇溶液(体积分数95%)置棕色瓶中4 ℃保存备用。将含有10 μg毛葱水溶性多糖的溶液2 m L缓慢加入盛有12 m L浓硫酸的大试管中,置于冰水中冷却,然后在沸水浴中加热10 m in,冷却至室温,之后加入咔唑乙醇溶液0.4 m L,充分混匀,室温放置30 min,观察颜色变化。
1.3.5 毛葱水溶性多糖结果分析
1.3.5.1 紫外光谱分析
参照张艳荣等[20]方法,精确称取少许毛葱水溶性多糖溶解于蒸馏水中,配制成0.1 m g/m L的溶液,在200~500 nm波长处扫描,检测波长在260 nm及280 nm处是否存在核酸及蛋白质的特征吸收峰。
1.3.5.2 傅里叶红外光谱分析
参照李晋等[21]方法,称取毛葱水溶性多糖2 mg,加入200 mg烘干至恒质量的KBr,置研钵中研磨均匀,用电动压片机压片,在4 000~400 cm-1范围进行红外扫描。
1.3.5.3 毛葱水溶性多糖溶解性的测定
称取4 份冷冻干燥后的毛葱水溶性多糖,分别加入冷水、热水、体积分数95%乙醇溶液和无水乙醚,观察毛葱水溶性多糖的溶解性。
1.3.5.4 高效凝胶渗透色谱分析
高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)条件:515型高效液相色谱仪;TSK-Gel G3000PWXL色谱柱;RID-10A示差折光检测器;流动相为0.2 mol/L NaCl溶液;流速为0.6 m L/min;柱温和检测器温度均为35 ℃,进样量为20 μL。采用GPC软件计算毛葱水溶性多糖的重均分子质量(mw)。
2.1 单因素试验结果
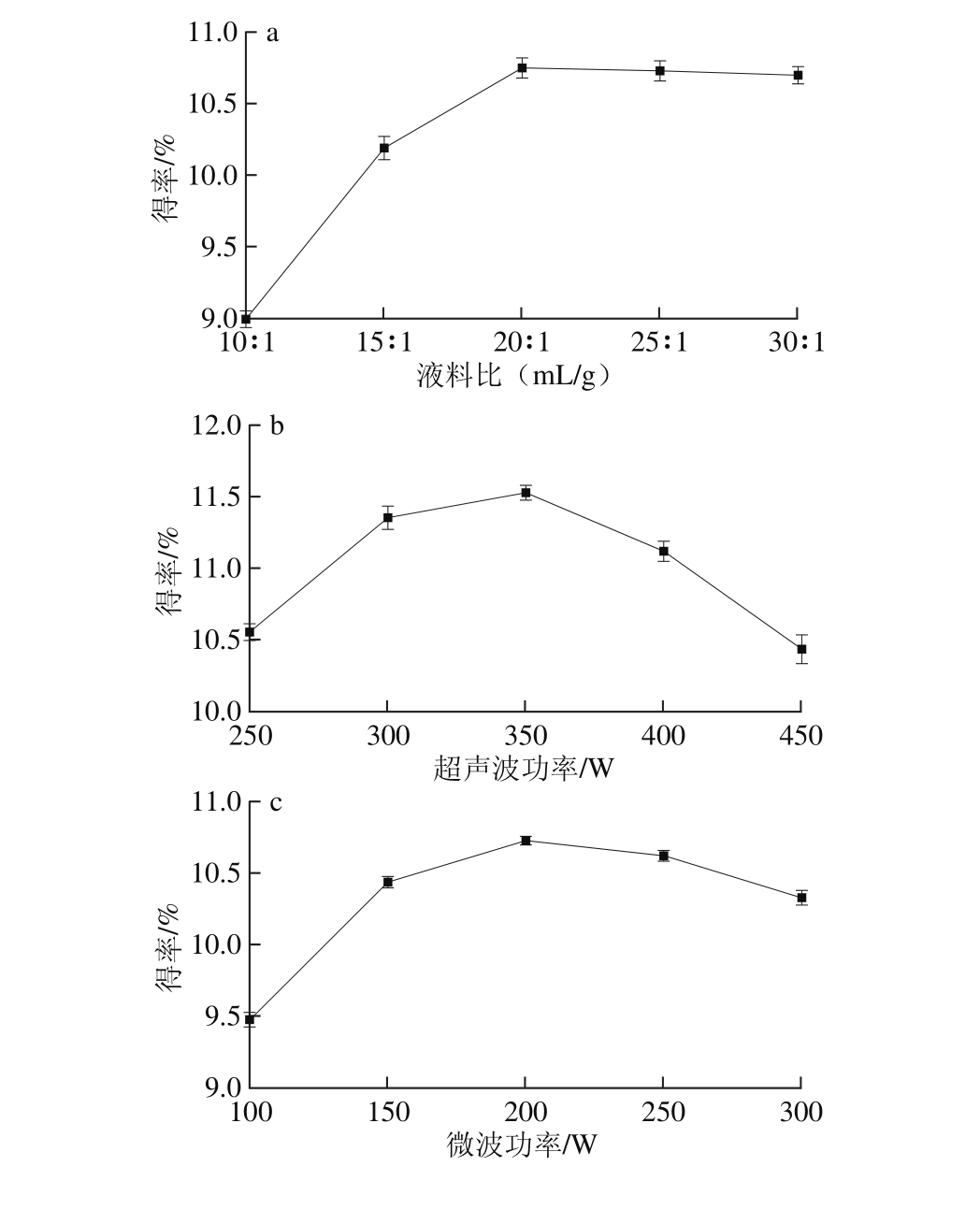

图1 液料比(a)、超声波功率(b)、微波功率(c)及协同时间(d)对毛葱水溶性多糖得率的影响
Fig. 1 Effects of liquid/material ratio (a), ultrasonic power (b),m icrowave power (c) and irradiation time (d) on the yield of water-solub le polysaccharide from tillering onion
由图1a可知,液料比在10∶1~20∶1(m L/g)时,毛葱水溶性多糖的得率呈现上升的趋势,当液料比大于20∶1(m L/g)时,毛葱水溶性多糖得率呈现稳定趋势。适量的增加溶剂有利于提升毛葱水溶性多糖的得率[22],当毛葱水溶性多糖充分溶出后,继续增加溶剂其得率变化不显著。因此,选取液料比15∶1、20∶1、25∶1(m L/g)进行响应面优化试验。
由图1b可知,超声波功率对毛葱水溶性多糖得率影响较大,超声波功率为200~350 W时,毛葱水溶性多糖得率随着超声波功率的增加呈现上升趋势,当超声波功率超过350 W时,随着超声波功率的继续增加,毛葱水溶性多糖得率呈现下降趋势。超声波的空化作用及剪切作用有助于多糖溶出[23],增加毛葱水溶性多糖的得率,但过大的超声波功率可能破坏多糖的糖苷键[24],使毛葱水溶性多糖得率降低。因此,选取超声波功率300、350、400 W进行响应面优化试验。
由图1c可知,微波功率在100~300 W之间,随着微波功率的增加,毛葱水溶性多糖的得率呈现先上升后下降的趋势,当微波功率为200 W时,毛葱水溶性多糖的得率最高,微波有助于提升物料内部温度使多糖加速溶出[25],增加毛葱水溶性多糖得率,但微波功率过大会阻碍介质渗入[26],导致毛葱水溶性多糖得率下降。因此,选取微波功率150、200、250 W进行响应面优化试验。
由图1d可知,协同时间对毛葱水溶性多糖的得率有一定的影响,随着协同时间的延长,毛葱水溶性多糖得率增加,当协同时间超过15 m in时,继续延长协同时间,毛葱水溶性多糖得率呈现稳定趋势。超声波与微波协同作用有助于毛葱水溶性多糖溶出[27],并且可缩短提取时间,本研究选取协同时间10、15、20 m in进行响应面优化试验。
2.2 响应面法优化工艺条件
2.2.1 Box-Behnken试验设计与结果分析
根据单因素试验结果,对2.1节中4 个单因素进行响应面优化设计,结果见表2。
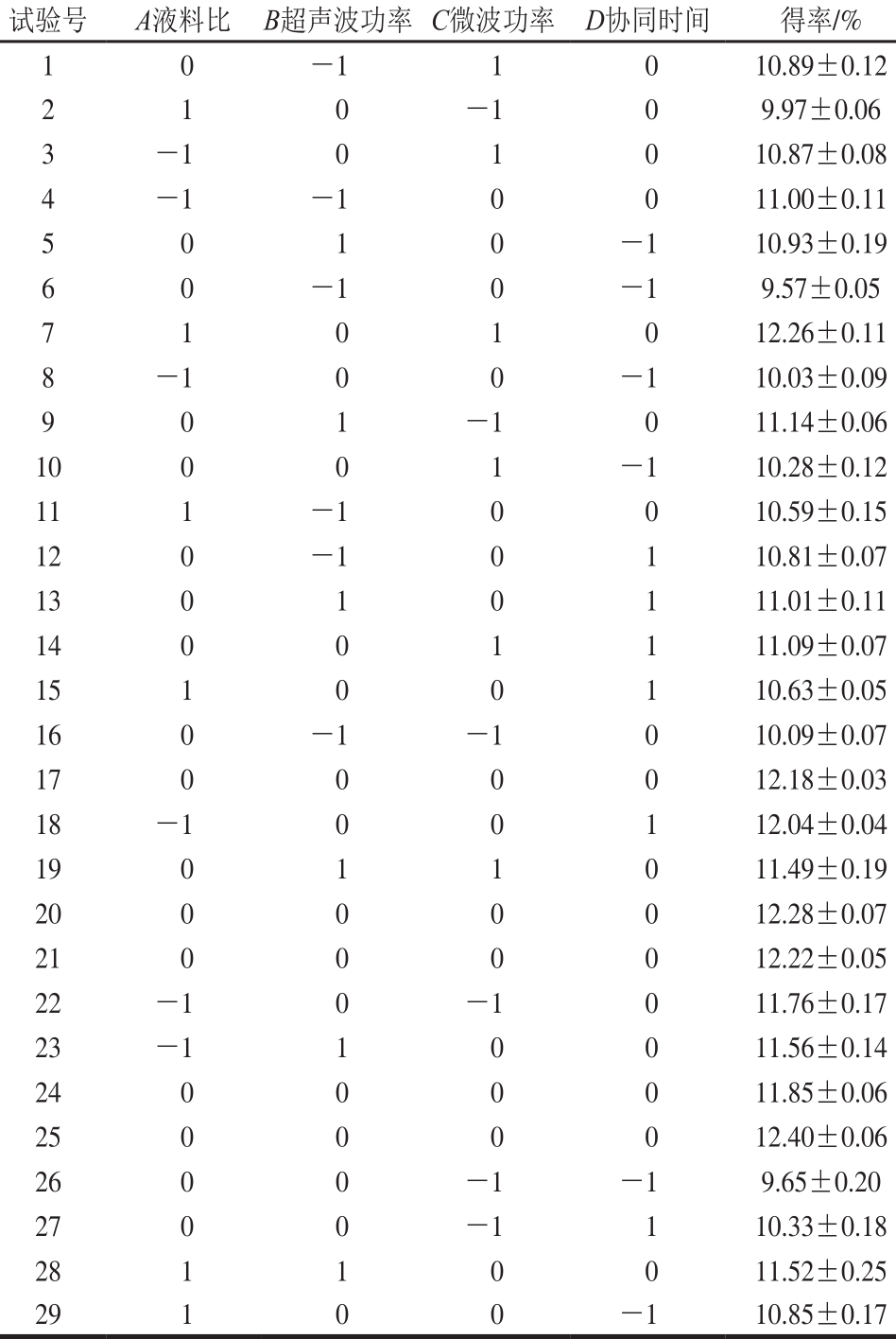
表2 Box-Behnken试验设计及结果
Table 2 Box-Behnken design w ith experimental resu lts
2.2.2 回归方程的建立与显著性检验
表3 回归模型方差分析
Table 3 Analysis of variance for regression model
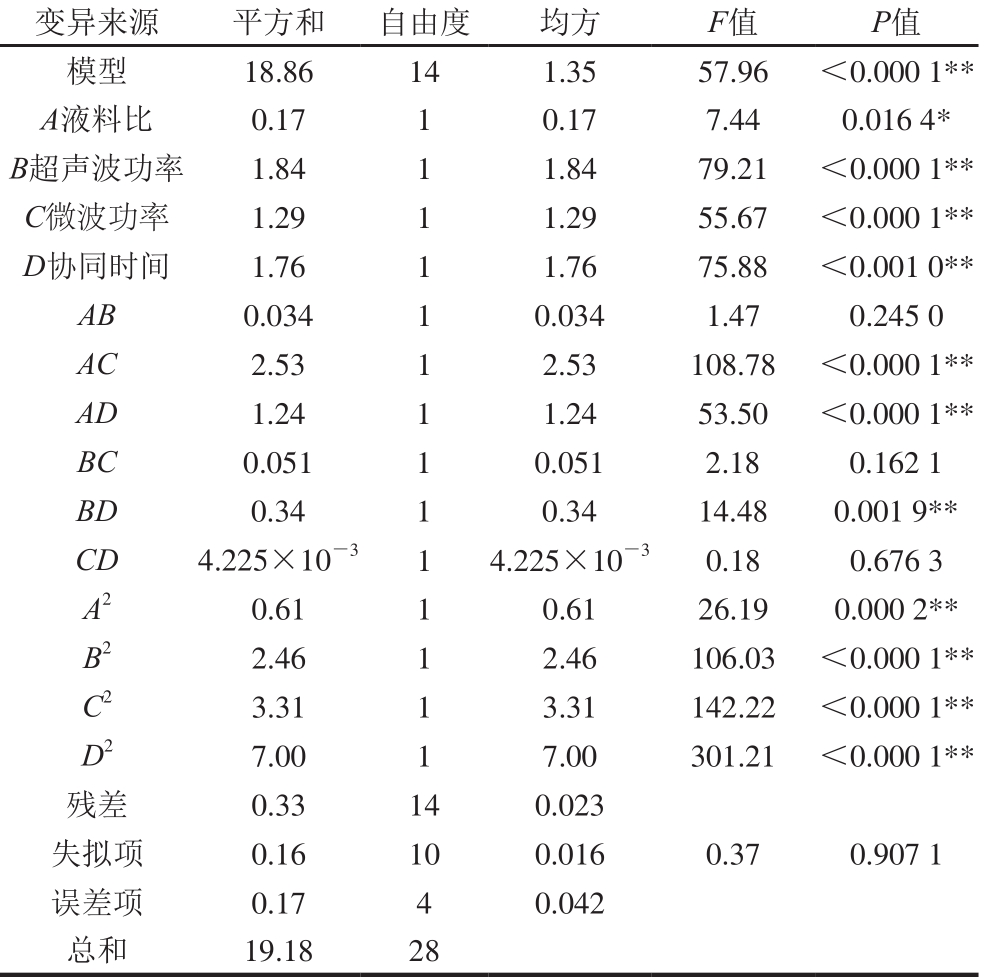
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
利用Design-Expert 8.0软件,通过对多项式回归分析,得到的拟合全变量二次回归方程模型为:Y=12.19-0.12A+0.39B+0.33C+0.38D+0.093AB+0.79AC-0.56AD-0.11BC-0.29BD+0.033CD-0.31A2-0.62B2-0.71C2-1.04D2。
由表3可知,该模型P值小于0.000 1,表明回归模型极显著;失拟项P值为0.907 1大于0.05,模型失拟不显著,试验误差小;回归决定系数R2值为0.983 0,校正决定系数R2Adj值为0.966 1,只有AB、BC、CD交互作用不显著,说明该模型拟合程度较好,可以用来分析和预测毛葱水溶性多糖的提取工艺。

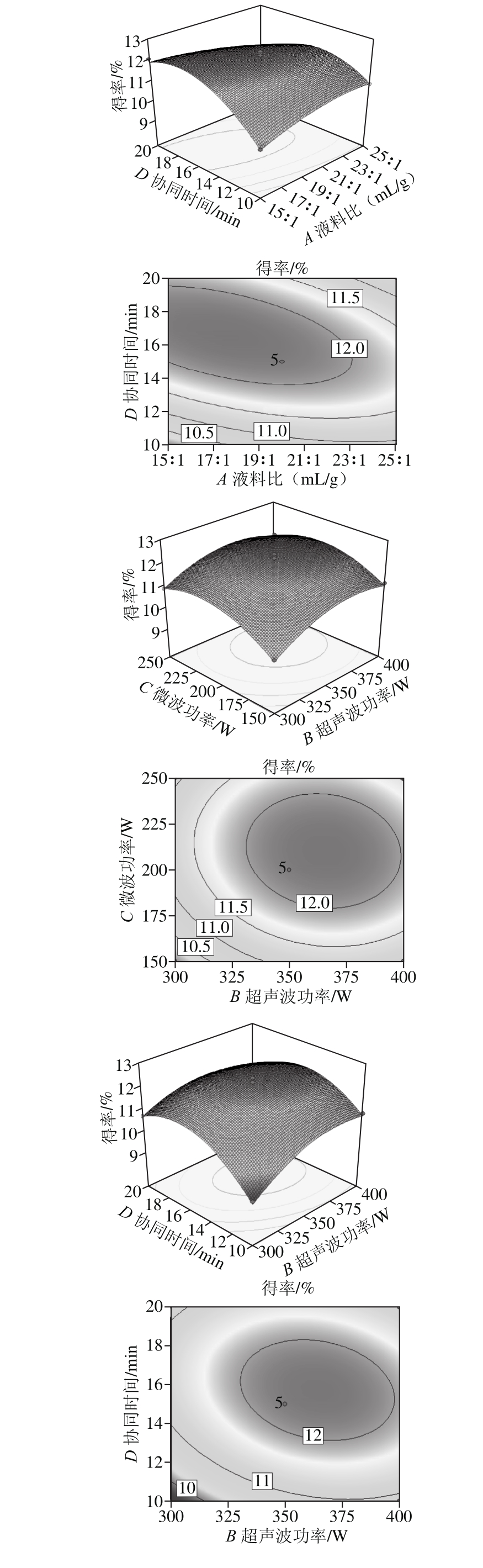

图2 毛葱水溶性多糖交互作用的响应面及等高线图
Fig. 2 Response surface and contour p lots show ing the interactive effects of variables on polysaccharide yield
由图2可知,液料比(A)与微波功率(C)、液料比(A)与协同时间(D)及超声波功率(B)与协同时间(D)3组因素的交互作用对毛葱水溶性多糖得率的影响显著,表现为响应面曲面陡峭,等高线呈椭圆形。
2.2.3 优化提取工艺参数的验证
对回归模型进行响应面分析,得到最佳工艺条件为液料比17.35∶1 (m L/g)、超声波功率360.79 W、微波功率196.27 W、协同时间16.47 m in时,毛葱水溶性多糖得率为12.30%。考虑到实际操作,选用液料比17∶1(m L/g),超声波功率360 W,微波功率200 W,协同时间16 m in进行验证实验,此时得率为(11.92±0.13)%,达到预测值的96.91%。与马钊等[28]通过传统水提法提取洋葱多糖的最佳工艺参数对比,超声波微波协同法提取多糖在时间上由240 min缩短为16 m in,多糖得率提升了7.77%。
2.3 毛葱水溶性多糖溶解性实验与显色反应实验结果
表4 毛葱水溶性多糖的溶解性
Table 4 Solubility of the polysaccharide from tillering onion
表5 毛葱水溶性多糖的显色反应
Table 5 Color reaction of the polysaccharide
注:-.阴性;+.阳性。
由表4可知,毛葱水溶性多糖可溶于冷水,易溶于热水;不溶于乙醇、无水乙醚等有机溶剂。由表5可知,碘-碘化钾反应呈阴性,表明毛葱水溶性多糖中不存在淀粉;三氯化铁反应呈阴性,表明毛葱水溶性多糖中不含酚类物质;硫酸-咔唑反应呈阳性,表明毛葱水溶性多糖中含有糖醛酸。
2.4 紫外光谱分析结果
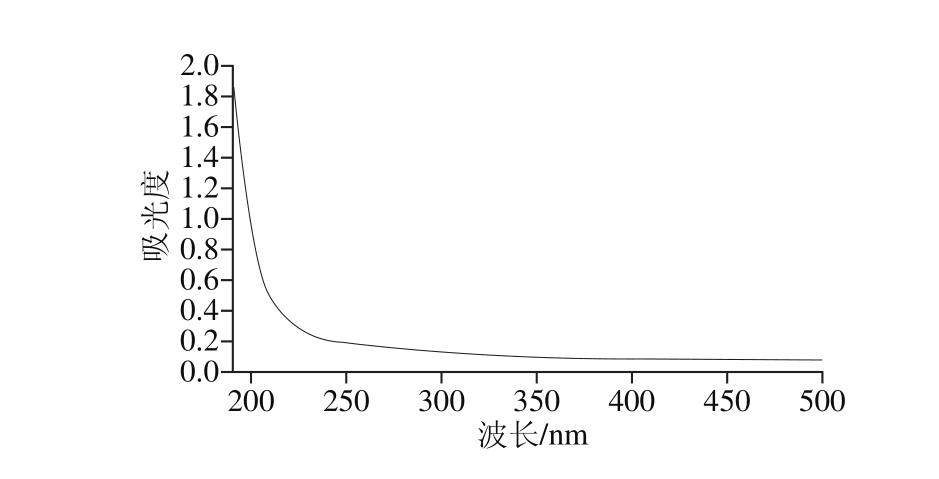
图3 毛葱水溶性多糖的紫外-可见光谱扫描
Fig. 3 Ultraviolet-visible absorption spectrum of the polysaccharide
由图3可知,毛葱水溶性多糖在260 nm和280 nm波长处未见核酸和蛋白质的特征吸收峰,初步确定该毛葱水溶性多糖排除核酸与蛋白质的干扰,可以继续进行傅里叶红外光谱分析。
2.5 傅里叶红外光谱分析结果

图4 毛葱水溶性多糖的傅里叶红外光谱图
Fig. 4 FI-IR spectrum of the polysaccharide
由图4可知,毛葱水溶性多糖在3 433.29 cm-1波数处有较强且宽的吸收峰,3 400 cm-1波数附近出现的吸收峰是由糖类分子内或分子间O—H伸缩振动引起的[29];2 927.94 cm-1波数处出现的吸收峰是CH3或CH2的C—H伸缩振动峰[30],1 631.78 cm-1波数处的吸收峰是羧基的C=O键的非对称伸缩振动峰,进一步表明了糖醛酸的存在,1 411.89 cm-1波数处出现的吸收峰是C—O的变角振动[31-32];1 300~1 000 cm-1波数之间存在的吸收峰是吡喃环的醚键(C—O—C)和羟基的伸缩振动[33],817.82 cm-1波数处的吸收峰为α-型吡喃糖的C—H弯曲振动[34]。
2.6 HPGPC分析毛葱水溶性多糖重均分子质量结果
由图5可知,毛葱水溶性多糖出现5 个尖峰且分布较为分散,15.323 m in时出现的峰较高且较宽。由表6可知,保留时间在10.507、14.323、15.323、16.757 m in时所对应的重均分子质量分别为195 000、4 070、1 480、350 D,17.523 min时出现的是洗脱液NaCl的吸收峰,可忽略不计。通过重均分子质量初步分析可得出超声波微波协同法所提取的毛葱水溶性多糖不是由均一组分构成的。

图5 毛葱水溶性多糖的凝胶色谱图
Fig. 5 HPGPC chromatogram of the polysaccharide
表6 HPGPC测定结果
Tab le 6 Resu lts of HPGPC analysis

采用超声波微波协同方法提取毛葱水溶性多糖,通过响应面优化试验,得到实际最佳工艺条件为液料比17∶1(m L/g)、超声波功率360 W、微波功率200 W、协同时间16 m in,此时多糖得率达到(11.92±0.13)%。
对所提取的毛葱水溶性多糖进行初步研究,溶解性实验结果得出该毛葱水溶性多糖溶于水、不溶于有机溶剂;显色反应实验结果得出该毛葱水溶性多糖不含淀粉及酚类物质,含有糖醛酸。紫外光谱分析显示该毛葱水溶性多糖无核酸和蛋白质的特征吸收峰,傅里叶红外光谱分析得出该毛葱水溶性多糖具有糖类典型的特征吸收峰。HPGPC分析显示该毛葱水溶性多糖不是由均一组分构成的。
参考文献:
[1] 廖春龙, 阮征, 印遇龙, 等. 洋葱化学成分、生理保健功能和我国洋葱加工现状与发展趋势[J]. 食品工业科技, 2010, 31(8): 409-412;416. DOI:10.13386/j.issn1002-0306.2010.08.029.
[2] 杨晓红, 刘银燕, 赵然, 等. 分蘖葱头和薤白氨基酸的含量测定[J]. 人参研究, 1995(4): 31-33. DO I:10.19403/j.cnki.1671-1521.1995.04.011.
[3] 赵靖, 宋述尧, 韩玉珠, 等. 分蘖洋葱和普通洋葱营养品质的比较[J].西北农林科技大学学报, 2015, 43(1): 106-110. DOI:10.13207/j.cnki.jnwafu.2015.01.007.
[4] 刘超, 高炯杰. 超声波辅助法提取毛葱黄酮的工艺研究[J]. 食品研究与开发, 2015, 36(18): 50-54. DOI:10.3969/j.issn.1005-6521.2015.18.013.
[5] 郭文场, 刘东宝, 周淑荣, 等. 毛葱的栽种和开发利用(1)[J]. 特种经济动植物, 2011, 14(4): 45-47. DOI:10.3969/j.issn.1001-4713.2011.04.022.
[6] 李鹏. 从分蘖葱头中提取抗氧化活性成分的研究[D]. 长春: 长春工业大学, 2013: 1-8.
[7] FAN J, LI H T, ZHANG H Y, et al. Op tim ize conditions for extracting crude oil from Alliums cepa. L. var. agrogatum Don using response surface methodology, 2013(5): 304-311. DOI:10.1016/j.ieri.2013.11.108.
[8] 张晓叶. 分蘖葱头药理作用及化学成分的研究[C]//2011年全国药物化学学术会议: 药物的源头创新论文摘要集. 广州: 中国药学会药物化学专业委员会, 2011: 223.
[9] 贾帆. 毛葱油的提取、组分分析及微胶囊的制备研究[D]. 长春: 长春工业大学, 2014: 1-2.
[10] 王恒禹, 刘玥, 姜猛, 等. 多糖在食品工业中的应用现状[J]. 食品科学, 2013, 34(21): 431-438. DOI:10.7506/spkx1002-6630-201321084.
[11] 张燕, 张树淼, 王飞, 等. 近年来植物多糖提取方法研究进展[J]. 农产品加工, 2015 (6): 65-68; 72. DOI:10.3969/jissn.1671-9646(X).2015.06.021.
[12] ZENG H L, AHGNG Y, LIN S, et al. U ltrasonic-m icrowave synergistic extraction (UMSE) and molecularweight distribution of polysaccharides from Fortunella margarita (Lour.) Sw ingle[J].Separation and Purifi cation Techno logy, 2015, 144: 97-106.DOI:10.106/j.seppur.2015.02.015.
[13] ZENG W C, ZHANG Z, GAO H, et al. Characterization of antioxidant polysaccharides from auricular using m icrowave assisted extraction[J].Carbohydrate Polymers, 2012, 89(2): 694-700.
[14] WANG Z, SUN X X , LIAN Z X, et al. The effects of ultrasonic/microwave assisted treatment on the properties of soy protein isolate/m icrocrystalline wheat-bran cellulose fi lm[J]. Journal of Food Engineering, 2013, 114(2): 183-191. DOI:10.1016/j.jfoodeng.2012.08.004.
[15] 刘婷婷, 张颖, 李娜, 等. 超声波微波协同制备玉米醇溶蛋白/壳聚糖复合膜工艺优化[J]. 食品科学, 2016, 37(20): 1-5. DOI:10.7506/spkx1002-6630-201620001.
[16] 许福泉, 冯媛媛, 赵艳景, 等. 超声波微波协同提取海蒿子多糖工艺[J].食品科学, 2012, 33(22): 103-106.
[17] 张国财, 赵博, 刘春延, 等. 响应面法优化超声波-微波协同提取富硒蛹虫草硒多糖工艺[J]. 食品科学, 2016, 37(12): 33-39. DOI:10.7506/spkx1002-6630-201612006.
[18] 朱磊. 黑木耳多糖分离纯化、理化性质及抗疲劳功能的研究[D]. 哈尔滨: 东北林业大学, 2008: 44-45.
19] 刘莹, 赵杰. 褐蘑菇多糖的理化性质初步研究[J]. 湖北农业科学,2012, 51(5): 981-982; 1013.
[20] 张艳荣, 樊红秀, 刘鸿铖, 等. 人参多糖提取工艺优化及其组成分析[J]. 食品科学, 2015, 36(20): 37-42. DOI:10.7506/spkx1002-6630-201520007.
[21] 李晋, 徐怀德, 米林峰. 洋葱多糖的分离纯化及单糖组成研究[J].中国食品学报, 2012, 12(2): 202-206. DOI:10.16429/j.1009-7848.2012.02.032.
[22] 张君萍. 沙葱籽油和多糖的提取及其降血脂作用[D]. 南京: 南京农业大学, 2011: 57-70.
[23] ZHU C P, ZHAI X C, LI L Q, et al. Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J]. Food Chem istry, 2015, 177: 139-146. DOI:10.1016/j.foodchem.2015.01.022.
[24] 刘航, 国旭丹, 马雨洁, 等. 超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J]. 食品科学, 2013, 34(14): 45-50. DOI:10.7506/spkx1002-6630-201314010.
[25] 陈小梅, 甘纯玑, 陈彩玲, 等. 响应面法优化微波辅助提取浒苔多糖工艺[J]. 食品研究与开发, 2011, 32(4): 44-48.
[26] 陈红, 张艳荣, 王大为, 等. 微波协同酶法提取玉米须多糖工艺的优化研究[J]. 食品科学, 2010, 31(10): 42-46. DOI:10.7506/spkx1002-6630-201010009.
[27] CHEN Y Y, GU X H, H S Q, et al. Optim ization of ultrasonic/m icrow ave assisted extraction (UMAE) of polysaccharides from Inonotus obliquus and evaluation of its anti-tumor activities[J].International Journal of Biological Macromolecules, 2010, 46(4): 429-435. DOI:10.1016/j.ijbiomac.2010.02.003.
[28] 马钊, 李景明, 李丽梅, 等. 洋葱多糖提取工艺的研究[J]. 食品工业科技, 2005, 26(5): 98-99. DOI:10.13386/j.issn1002-0306.2005.05.027.
[29] 刘健影. 银耳多糖提取工艺优化及其在饮料中的应用[D]. 长春: 吉林农业大学, 2015: 26-27.
[30] 王大为, 赵鑫, 董欣, 等. 发芽对绿豆皮膳食纤维结构及性质的影响[J].食品科学, 2016, 37(23): 111-117. DOI:10.7506/spkx1002-6630-201623019.
[31] 扈瑞平. 沙葱多糖的分离、纯化和结构鉴定及其生物学活性的研究[D]. 呼和浩特: 内蒙古农业大学, 2010: 46-47.
[32] ZHAO C Z,DIAO Y L,WANG A Z, et al. Structural characters and protecting β-cells of a polysaccharide from flowers of Inula japonica[J]. International Journal of Biological Macromolecules, 2017,101(8): 16-23. DOI:10.1016/j.ijbiomac.2017.03.044.
[33] CA I W R, GU X H, TANG J. Ex traction, purification, and characterization of the polysaccharides from Opuntia milpa alta[J].Carbohyd rate Polymers, 2008, 71(3): 403-410. DOI:10.1016/j.carbpol.2007.06.008.
[34] XIE J H, XIE M Y, NIE S P, et al. Isolation, chem ical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) lljinskaja[J]. Food Chem istry, 2010,119(4): 1626-1632. DOI:10.1016/j.foodchem.2009.09.055.
Optim ization of Ultrasonic M icrowave-Assisted Extraction and Structural Analysis of Water-Soluble Polysaccharide from Tillering Onion
LIU Tingting, ZHANG Jing, LIU Yang, SONG Yunyu, ZHANG Shanshan, WANG Dawei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:This paper reports the optim ization of the ultrasonic m icrow ave-assisted extraction of w ater-soluble polysaccharides from tillering onion by one-factor-at-a-time method and response surface methodology. The response was polysaccharide yield. The optimum conditions were determined as follows: liquid-to-solid ratio, 17:1 (m L/g); ultrasonic power, 360 W; microwave power, 200 W; and irradiation time, 16 min. Under the optimized conditions, the polysaccharide yield was (11.92 ± 0.13)%. Solubility results showed that the extracted polysaccharide was soluble in water but insoluble in organic solvents. The results of color reaction experiments showed that the water-soluble polysaccharide did not contain starch or phenolic compounds but contained uronic acid. As indicated by ultraviolet-visible spectroscopy measurement, the water-soluble polysaccharide had no characteristic absorption peaks of nucleic acid and protein. Fourier transform infrared spectroscopy showed that the water-soluble polysaccharide had the characteristic absorption peak of polysaccharide. The weight average molecular weight was analyzed by high performance gel permeation chromatography. It was found that the water-soluble polysaccharide was not composed of homogeneous components.
Key words:tillering onion; water-soluble polysaccharide; ultrasonic microwave-assisted extraction
DOI:10.7506/spkx1002-6630-201722042
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2017)22-0284-07
引文格式:
刘婷婷, 张晶, 刘阳, 等. 毛葱水溶性多糖的超声波微波协同法提取工艺优化及结构分析[J]. 食品科学, 2017, 38(22):284-290. DOI:10.7506/spkx1002-6630-201722042. http://www.spkx.net.cn
LIU Tingting, ZHANG Jing, LIU Yang, et al. Optim ization of ultrasonic m icrowave-assisted extraction and structural analysis of water-soluble polysaccharide from tillering onion[J]. Food Science, 2017, 38(22): 284-290. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722042. http://www.spkx.net.cn
收稿日期:2017-06-10
基金项目:吉林农业大学人才计划项目(20160509)
作者简介:刘婷婷(1984—),女,副教授,博士,研究方向为谷物食品科学与副产物高值化利用。E-mail:xcpyfzx@163.com
*通信作者:王大为(1960—),男,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com