钱卓真1,2,汤水粉2,罗方方2,王丽娟2,位绍红2
(1.厦门大学材料学院,福建 厦门 361005;2.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
摘 要:建立高效液相色谱-串联质谱同时定量检测石斑鱼血浆、肌肉组织、肝脏组织中阿维菌素、伊维菌素、甲氨基阿维菌素苯甲酸盐方法。样品经乙腈提取,碱性氧化铝固相萃取柱和LC-C18固相萃取柱串联净化,Thermo Hypersil Gold C18色谱柱分离,10 mmol/L乙酸铵-0.1%甲酸溶液和乙腈梯度洗脱,电喷雾正离子模式下以多反应监测方式检测,基质匹配法外标定量。分别以环境水体中阿维菌素上下限质量浓度(4、8 ng/m L)、伊维菌素上下限质量浓度(6、12 ng/m L)作为受试质量浓度开展生物富集、消除实验,并对石斑鱼的食用安全进行了风险评估。结果表明,阿维菌素和伊维菌素在2.5~200 ng/m L范围内,甲氨基阿维菌素苯甲酸盐在0.25~20 ng/m L范围内,线性回归系数均大于0.99。方法检出限分别为2.5、2.5、0.25 ng/m L(血浆),1、1、0.1 μg/kg(肌肉组织),2.5、2.5、0.25 μg/kg(肝脏组织),方法定量限分别为5、5、0.5 ng/m L(血浆),2、2、0.2 μg/kg(肌肉组织),5、5、0.5 μg/kg(肝脏组织)。3 个添加量的平均回收率为74.6%~93.6%,日内相对标准偏差为2.3%~10.9%,日间相对标准偏差为9.2%~12.6%。阿维菌素、伊维菌素均属于非生物累积性物质,在石斑鱼体内代谢规律相同,均按一级动力学过程从体内消除。本研究条件下,环境水体中药物质量浓度是石斑鱼肌肉组织中药物残留质量浓度及消除时间的重要因素。为保证食用安全,环境水体中阿维菌素质量浓度达到4~8 ng/m L时,石斑鱼浸浴72 h后安全食用时间为22 d;环境水体中伊维菌素质量浓度达到6~12 ng/m L时,石斑鱼浸浴72 h后安全食用时间为39 d。
关键词:石斑鱼;阿维菌素类药物残留;食用安全风险评估
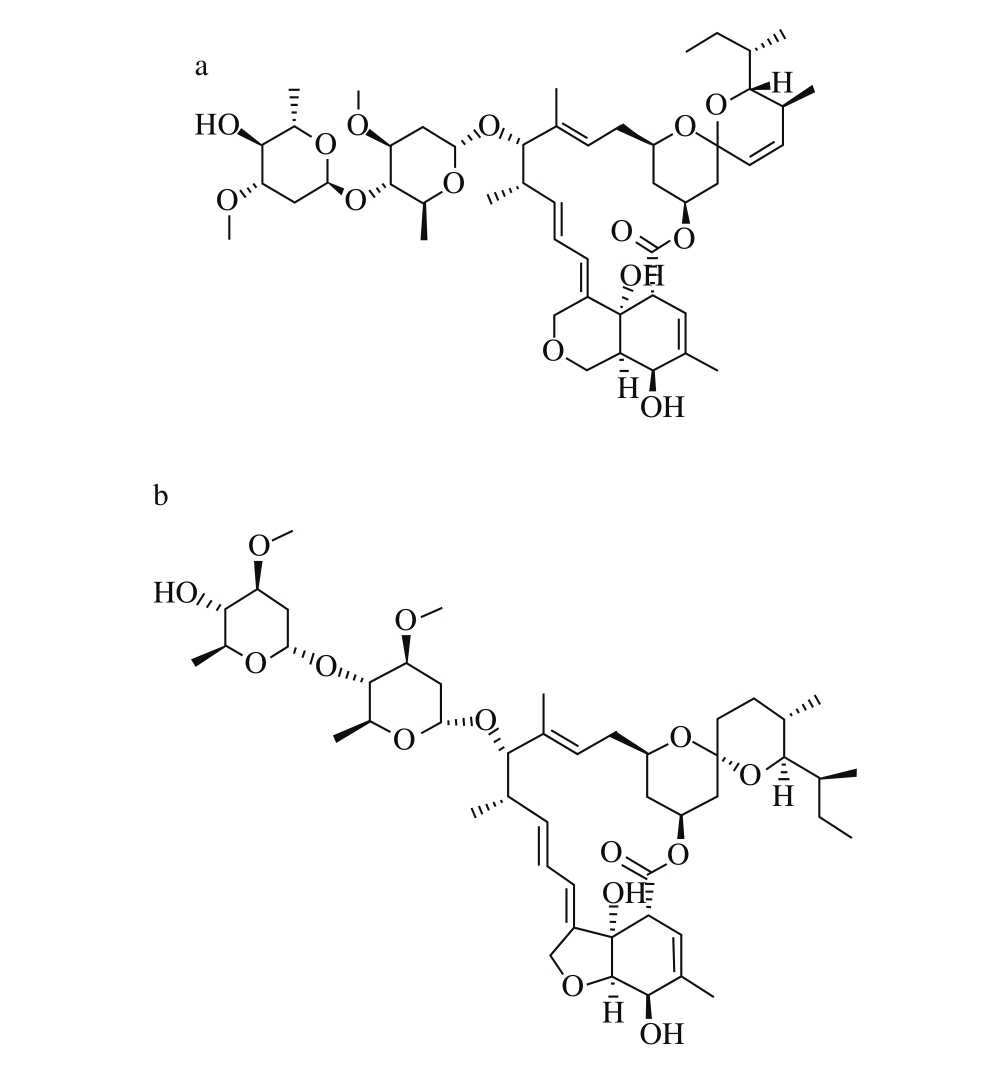
阿维菌素类药物是现今广泛使用的农用杀虫剂,由链霉菌中阿维链霉菌发酵产生,包括阿维菌素、甲氨基阿维菌素苯甲酸盐、伊维菌素等药物[1-2],结构见图1。阿维菌素通过W ilk inson催化剂作用得到伊维菌素,而经过化学结构修饰得到甲氨基阿维菌素苯甲酸盐。按照世界卫生组织五级分类标准,阿维菌素类药物具有神经毒性和发育毒素[3],仍将其列为高毒化合物。

图1 阿维菌素(a)、伊维菌素(b)和甲氨基阿维菌素苯甲酸盐(c)的分子结构
Fig. 1 M olecular structures of abamectin (a), ivermectin (b) and emamectin benzoate (c)
福建是我国石斑鱼及制品的最大生产基地,并且远销国内外。石斑鱼不仅具有极高的营养价值,且年产值超过百亿元。然而随着近年福建工农业的高速发展及城镇化的推进,农业生产中大量使用的阿维菌素类杀虫剂随着各类环境迁徙进入水环境[4-5]。这不仅对水生环境造成危害[6-7],而且对石斑鱼产生非靶标毒害作用[8],并造成石斑鱼中阿维菌素类药物残留过剩。已有文献报道多集中在动物肌肉组织、牛乳和植物中阿维菌素类药物残留测定[9-12],而现有关于鱼类组织中阿维菌素类药物残留测定的研究多集中在肌肉组织中单种药物残留测定,缺少对鱼类各组织中多种阿维菌素类药物同时测定的系统研究。本研究参考已有方法[13-14],建立了石斑鱼血浆、肌肉组织、肝脏组织中阿维菌素、伊维菌素、甲氨基阿维菌素苯甲酸盐多残留测定的高效液相色谱-串联质谱法,该方法简单、操作性强,且有良好的准确度和精密度。其次,依据本研究建立的残留测定方法,对污染水体中阿维菌素、伊维菌素在石斑鱼肌肉组织中的富集和消除规律进行研究,并进行食用安全性评估研究。
1.1 材料与试剂
参照前期课题组开展的鲈鱼实验[15],实验用健康石斑鱼共计300 尾,平均体质量200 g,饲养于福建省水产研究所水产养殖实验基地。实验前对石斑鱼进行暂养,保持水温(25±2)℃,pH 8.0,盐度30‰,正常充气并投喂空白配合饲料,日饲量不超过初始体质量的3%,14 d后挑选体色活力均正常者进行给药实验。
标准品阿维菌素(纯度92%)、伊维菌素(纯度96%)、甲氨基阿维菌素苯甲酸盐(纯度98%) 德国Dr. Ehrensorfer公司;乙腈、甲酸、乙酸乙酯、正己烷(均为色谱纯) 美国Tidea公司;乙酸、无水硫酸钠、乙酸铵、氯化钠(均为化学纯) 国药集团化学试剂有限公司;碱性氧化铝固相萃取柱(500 mg,3 m L)、LC-C18固相萃取柱(500 m g,3 m L) 美国Supelco公司;Bond Elut C18固相萃取柱(500 m g,3 m L)美国Agilent公司;Oasis HLB固相萃取柱(200 mg,3 m L) 美国Waters公司;0.22 µm尼龙微孔滤膜天津市津腾实验设备有限公司。
1.2 仪器与设备
TSQ ULTRA高效液相色谱-串联质谱仪 美国ThermoFisher Scientific公司;AB204-E型、PL203型电子分析天平 美国M ettler Toledo公司;DT5-5型低速台式离心机、GT16-3高速台式离心机 北京时代北利离心机有限公司;TDL-80-2B低速离心机 上海安亭科学仪器厂;MS3型旋涡混合器 德国IKA公司;ZZDCH16水浴氮吹仪 广州智真生物科技有限公司;R系列旋转蒸发仪 上海申生科技有限公司;KQ3200E超声波清洗仪昆山市超声仪器有限公司;M illi-Q型超纯水仪 美国M illipore公司。
1.3 方法
1.3.1 标准溶液配制
准确称取阿维菌素10.9 mg、伊维菌素10.4 mg、甲氨基阿维菌素苯甲酸盐10.2 mg(称取标准品的质量为按纯度修正过的质量),用乙腈分别配制成100 μg/m L的标准储备液;于-18 ℃条件下避光保存,有效期6 个月。准确移取阿维菌素标准储备液100 μL、伊维菌素标准储备液100 μL、甲氨基阿维菌素苯甲酸盐标准储备液10 μL,乙腈稀释并定容至10 m L容量瓶,配制成混合标准中间液,于4 ℃条件下避光保存,有效期为1 个月。实验采用基质匹配标准曲线法,现配现用,移取适量混合标准中间液,用空白血浆样品提取液、空白肌肉样品提取液、空白肝脏样品提取液分别制作成3 条基质标准曲线。
1.3.2 田间试验
阿维菌素喷洒至作物及土壤,模拟实际生产中药物较严重漂移和用药土壤流失的情况,连续一周测试该种植区附近水域中阿维菌素含量。收集到的水体混合均匀,避光冷藏待测。随后,开展以伊维菌素为喷洒药物的田间试验,重复上述步骤。
1.3.3 生物富集、消除实验
田间试验表明,种植区附近污染水域中阿维菌素质量浓度为4~8 ng/m L,伊维菌素质量浓度为6~12 ng/m L。模拟种植区附近污染水域中阿维菌素药物对石斑鱼的影响,开展石斑鱼单次浸浴单种药物72 h的药物富集及消除实验。实验组分为给药组和对照组,每池约为70 尾鱼。结合田间试验获得水中阿维菌素残留质量浓度情况,即低质量浓度4 ng/m L和高质量浓度8 ng/m L,分别浸浴72 h,72 h后彻底换水;结合田间试验获得水中伊维菌素残留质量浓度情况,即低质量浓度6 ng/m L和高质量浓度12 ng/m L,分别浸浴72 h,72 h后彻底换水。
分别于给药后0.5、1.5、2.5、4.5、7.0、10.5、23.75、34.5、47.5、58.5、72.0、82.5、95.5、175、239.5、311.5、408、528 h和744 h时随机捞取浸浴4 ng/m L阿维菌素的石斑鱼进行样品采集;分别于给药后0.5、1.5、2.5、4.5、7.0、11.0、24.0、35.0、47.5、58.5、72.0、82.5、95.5、175.5、239.5、311.5、407.5、528、629.5、745.5 h和936 h随机捞取浸浴8 ng/m L阿维菌素的石斑鱼进行样品采集;每个时间点3 尾石斑鱼,每3 尾采集样品混合作为一个样,即每个时间点有3 个平行样。
分别于给药后0.5、1.25、2.25、4.25、7.5、11.0、24.5、34.5、48.0、59.0、72.0、82.5、97.0、144、216、312、408、528 h和600 h随机捞取浸浴6 ng/m L伊维菌素的石斑鱼进行样品采集;分别于给药后0.5、1.25、2.25、4.25、7.5、11.0、24.5、34.5、48.0、58.5、72.0、82.5、97.0、144、192、311.5、414、530、720.5、937 h和1 200 h随机捞取浸浴12 ng/m L伊维菌素的石斑鱼进行样品采集;每个时间点3 尾石斑鱼,每3 尾采集样品混合作为一个样。
1.3.4 仪器分析条件
Thermo Hypersil Gold C18色谱柱(50 mm×2.1 mm,1.9 μm);柱温35 ℃;流动相A为10 mmol/L乙酸铵-0.1%甲酸溶液,流动相B为乙腈;流速0.25 m L/m in;梯度洗脱程序见表1。电喷雾电离(electrospray ionization,ESI)源正离子扫描模式;多反应监测模式;喷雾电压3 200 V;鞘气压力15 arb;辅助气压力5 arb;离子传输管温度350 ℃;雾化室加热温度150 ℃;碰撞气1.5 m torr;母离子、子离子和碰撞能量见表2;Q1半峰宽为0.7 D,Q3半峰宽为0.7 D。
表1 梯度洗脱程序
Tab le 1 Gradient elution program
表2 阿维菌素、伊维菌素、甲氨基阿维菌素苯甲酸盐质谱参数
Table 2 M ass spectral parameters for abamectin, ivermectin and emamectin benzoate
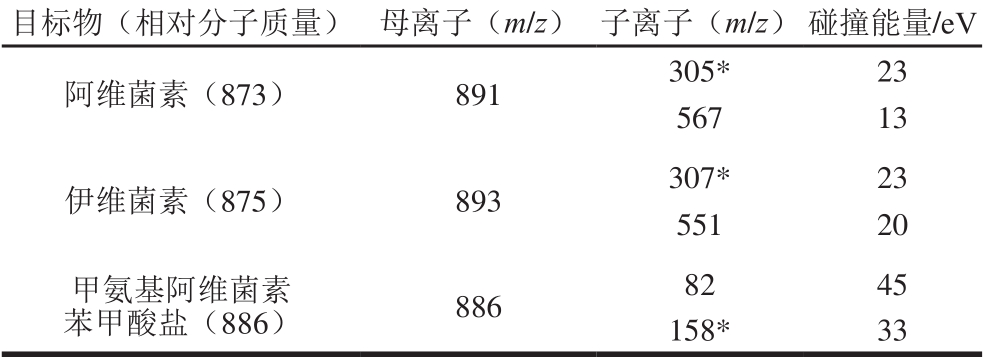
注:*.定量离子。
1.3.5 血浆样品前处理
准确量取石斑鱼血浆1 m L于5 m L塑料离心管中,加入乙腈2 m L,涡旋混合1 m in,8 000 r/m in离心3 m in,取上清液于10 m L离心管。加入无水硫酸钠1 g,涡旋30 s,3 000 r/m in离心5 m in。上清液转入预先用5 m L乙腈活化的碱性氧化铝固相萃取柱,并用5 m L乙腈洗涤碱性氧化铝固相萃取柱,收集全部流出液。流出液在50 ℃条件下氮吹至干,加入梯度洗脱的初始流动相溶液1.0 m L超声溶解,过0.22 µm滤膜后待测分析。
1.3.6 肌肉、肝脏样品前处理
称取试样肌肉(5±0.05)、肝脏(2±0.02)g于100 m L塑料离心管中,加入无水硫酸钠5 g,涡旋30 s。加入乙腈15 m L,涡旋1 m in,超声10 m in,3 500 r/m in离心5 m in,再用乙腈10 m L重复提取离心1 次。合并上清液,转入预先用5 m L乙腈活化的碱性氧化铝固相萃取柱,并用6 m L乙腈洗涤碱性氧化铝固相萃取柱,收集全部流出液至100 m L鸡心瓶中,40 ℃条件下减压旋转蒸发至近干。
肌肉样品处理:直接加入梯度洗脱的初始流动相溶液1.0 m L超声溶解,过0.22 µm滤膜后待测分析。
肝脏样品进一步净化,加入2.5 m L乙腈超声溶解,再加入乙腈饱和正己烷1 m L,涡旋混合1 min,3 000 r/m in离心5 m in,取下清液,加入水2.5 m L,混合备用。混合液转入预先用5 m L乙腈、5 m L 50%乙腈溶液(体积比1∶1)活化的LC-C18固相萃取柱,3 m L水淋洗,8 m L酸化乙腈溶液(含0.3%乙酸)洗脱,收集所有洗脱液。洗脱液50 ℃氮吹至干,加入梯度洗脱的初始流动相溶液1.0 m L超声溶解,过0.22 µm滤膜后待测分析。
1.3.7 生物富集系数
通常以生物富集系数(bio logical concen tration factor,BCF)作为描述生物对污染物质富集效应的指标,以此度量污染物在生物体累积的趋势,按公式(1)计算。
式中:CB为阿维菌素类药物在石斑鱼肌肉组织中平均稳态残留浓度/(μmol/L);CW为阿维菌素类药物在水中平均浓度/(μmol/L);K1为吸收速率常数;K2为消除速率常数。
研究表明,鱼类对污染物的富集作用强弱与污染物的辛醇-水分配系数(Kow)、水溶解度(S)等密切相关[16-17],如公式(2)、(3)所示。
1.3.8 食用安全评估
在食用安全性方面,可以根据消除后期测定的组织药物质量浓度及规定的最高残留限量(maximum residue lim it,MRL),计算各组织药物质量浓度降至MRL所需时间(w ithdrawal time,WDT),按公式(4)计算:
式中:WDT为休药期/d;MRL为最高残留限量/(μg/kg);Co为残留消除半对数曲线的纵截距/(μg/kg);Ke为残留消除曲线速率常数。
1.4 数据处理
采用W inNonlin 5.2软件非房室模型统计矩原理处理数据。
2.1 色谱及质谱条件的优化
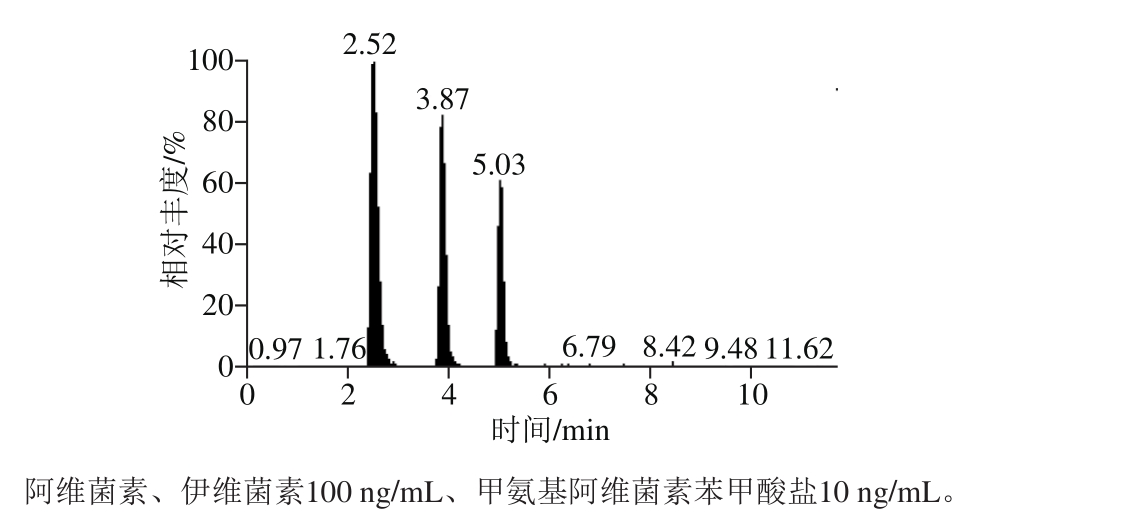
图2 阿维菌素类药物在多反应监测模式下总离子流图
Fig. 2 Total ion chrom atogram of avermectins under multip le reaction monitoring mode
3 种阿维菌素类药物属于分子质量大且极性较弱的化合物,适用于反相C18色谱柱分离。比较了甲醇和乙腈2 种有机相对分离度和峰形的影响。结果表明,以乙腈作为流动相,3 种阿维菌素类药物峰形尖锐,响应值较大。阿维菌素、伊维菌素在ESI正离子源条件下,[M+Na]+和[M+NH4]+的离子化效率最高。选择[M+Na]+作为母离子,得到的碎片峰信息不稳定;而选择[M+NH4]+作为母离子,可以得到稳定且丰富的碎片离子[18]。其次,样品基质对[M+Na]+具有明显的基质抑制效应。因此,本研究选用[M+NH4]+作为母离子。在流动相中加入10 mmol/L乙酸铵溶液可以抑制[M+Na]+,促进母离子[M+NH4]+的响应值;同时加入0.1%甲酸溶液来增强待测物的离子化。在最佳色谱及质谱条件下,甲氨基阿维菌素苯甲酸盐、阿维菌素、伊维菌素保留时间分别为2.52、3.87、5.03 m in,标准品图谱见图2。
2.2 样品前处理条件的优化
2.2.1 样品提取
阿维菌素、伊维菌素、甲氨基阿维菌素苯甲酸盐均属于弱极性化合物,溶于有机溶剂。实验考察了甲醇、乙酸乙酯、乙腈对3 种目标物的提取效果。结果表明,甲醇提取效率低,乙酸乙酯容易乳化,而乙腈不仅提取效率高,且利于后续的净化[19],所以最终选用乙腈作为提取剂。为了有效除去石斑鱼组织中的水分,防止减压旋转时的爆沸现象,本研究采用无水硫酸钠作为除水剂。
2.2.2 样品净化
常用的净化方法有液液萃取法和固相萃取法。血浆和肌肉组织中脂肪含量较少,仅采用固相萃取净化法。肝脏样品基质较为复杂,脂含量高,因而采用液液萃取和固相萃取相结合的净化方法。同时,本研究比较了不同类型的固相萃取柱的净化效果。结果表明,碱性氧化铝固相萃取柱和C18固相萃取柱的净化效率相当,但C18固相萃取柱净化步骤较为繁琐,因此采用碱性氧化铝固相萃取柱净化血液及肌肉组织提取液。但肝脏组织的成分比较复杂,单独采用碱性氧化铝柱或C18柱均未能取得良好的净化效果[20]。因此,本研究采用碱性氧化铝固相萃取柱和C18固相萃取柱串联净化的方法进行净化,取得良好的净化效果。

图3 洗脱液中乙酸比例(A)和洗脱液体积(B)对目标物回收率的影响
Fig. 3 Effects of different proportions of acetic acid in the eluent (A)and eluent volumes (B) on recovery
表3 方法准确度和精密度测定结果(血浆)
Tab le 3 Figures of merit of the method for the determ ination of analytes in p lasma
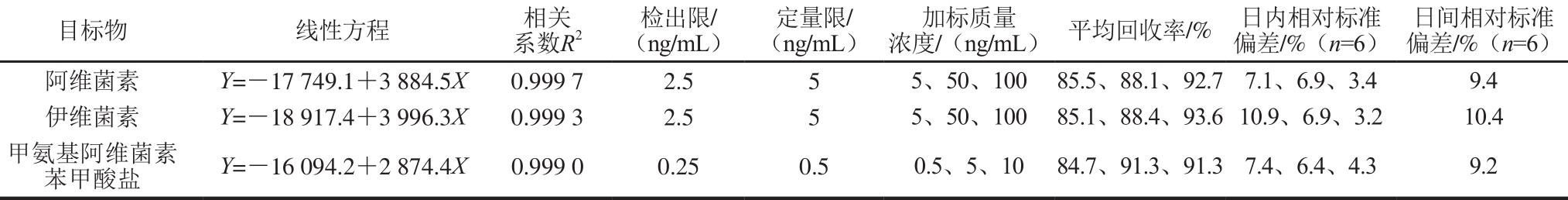
表4 方法准确度和精密度测定结果(肌肉组织)
Table 4 Figures of merit of the method for the determ ination of analytes in muscle
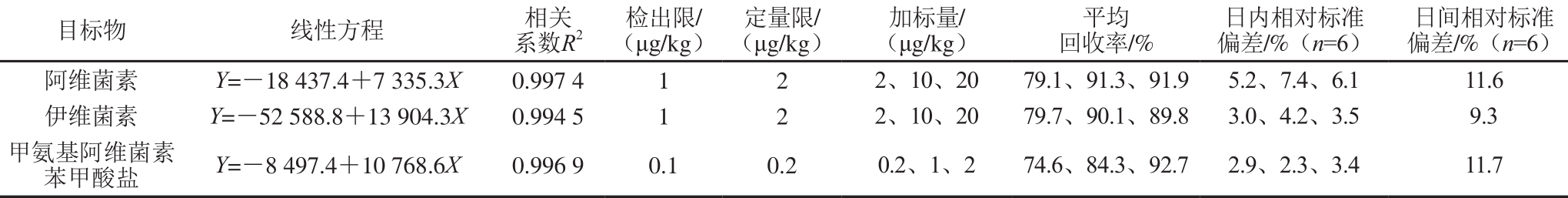
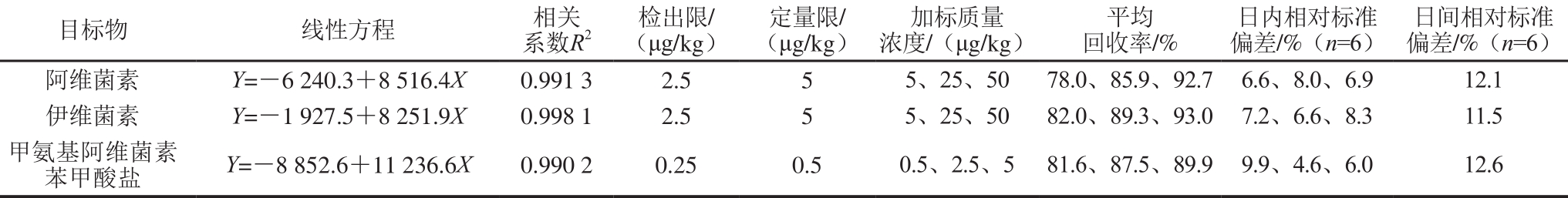
表5 方法准确度和精密度测定结果(肝脏组织)
Table 5 Figures of m erit of the m ethod for the determ ination of analytes in liver
实验比较了LC-C18、Bond Elut C18和Oasis HLB串联固相萃取柱对目标物净化效果和回收率的影响。结果表明,LC-C18净化效果最佳,总体回收率最高。实验对串联固相萃取柱LC-C18的淋洗液和洗脱液进行优化。3 m L的纯水淋洗液对目标物无损失;随着淋洗液中乙腈比例的增大,目标物损失也随着增大,故实验选用纯水作为淋洗液。洗脱液选用对目标化合物溶解性较好的乙腈溶液,同时加入一定量的酸,用于促进目标物从C18固相萃取柱上洗脱下来。由图3A可知,洗脱液中乙酸的比例达到0.3%时,目标物基本可以全部被洗脱下来。为了较充分地将目标物洗脱下来,故选择8 m L酸化乙腈(含0.3%乙酸)作为最终洗脱液体积,见图3B。
2.3 标准曲线、线性范围、检出限和定量限
在电喷雾有机质谱电离条件下,生物样品提取液具有明显的基质抑制效应,这主要来源于血浆、肌肉、肝脏样品中内源性物质[21]。为了消除基质效应带来的定量偏差[22],实验采用基质匹配标准曲线法,移取适量混合标准中间液,用空白样品提取液分别配制成不同质量浓度基质标准溶液,阿维菌素和伊维菌素质量浓度分别为2.5、5、10、25、50、100 ng/m L和200 ng/m L,甲氨基阿维菌素苯甲酸盐质量浓度分别为0.25、0.5、1、2.5、5、10 ng/m L和20 ng/m L。各组分质量浓度与其色谱峰面积呈良好的线性关系,线性相关系数均大于0.99,如表3~5所示。
2.4 方法准确度和精密度
以阴性石斑鱼血浆、肌肉组织、肝脏组织为研究对象,进行标准添加实验,分别以低、中、高3 个添加水平进行加标回收实验、每个质量浓度水平做6 个平行实验,考察方法的准确度及精密度。如表3~5所示,血浆、肌肉组织、肝脏组织中药物加标回收率在70%~110%,日内相对标准偏差不大于15%。15 d内血浆、肌肉组织、肝脏组织分别在中等添加水平下进行6 次加标实验,考察方法日间精密度,相对标准偏差不大于15%。方法的精密度和准确度均能满足药物残留监测需求。
2.5 阿维菌素类药物在石斑鱼体内的生物富集
根据田间试验,环境水体中阿维菌素类药物质量浓度先迅速上升至一相对恒定质量浓度,前3 d阿维菌素、伊维菌素分别维持在质量浓度4~8 ng/m L和6~12 ng/m L,随后在光照和水流的影响下逐渐降低,1 周后水体中阿维菌素类药物质量浓度降低至检测限以下。因此,前3 d是阿维菌素类药物从水体进入石斑鱼体内的主要蓄积时间。本研究从模拟的实际情况出发,分别以环境水体中阿维菌素类药物上限、下限质量浓度作为受试质量浓度开展生物富集、消除实验。
阿维菌素和伊维菌素Kow分别为9 900、1 615,根据公式(2),阿维菌素BCF为647,伊维菌素BCF为163;阿维菌素和伊维菌素S分别为7.8×10-3、4.0 mg/L,根据公式(3),阿维菌素BCF为9 551,伊维菌素BCF为283。然而在2 种水体质量浓度条件下,根据公式(1)求得的阿维菌素BCF分别为20.75、29.12,伊维菌素BCF分别为26.79、44.71,实际值均远小于预测的BCF值,这可能与阿维菌素类药物的相对分子质量和分子体积相关。Brooke等[23]研究表明污染物在鱼体中的BCF值与污染物相对分子质量大小密切相关,相对分子质量小于350,BCF与相对分子质量呈现线性增长关系;而当相对分子质量大于350,BCF随相对分子质量的增大而减小。大分子质量的阿维菌素、伊维菌素阻止了水体中的药物透过鱼鳃、皮肤的分子膜进入石斑鱼,导致了较小的BCF值。这与实际实验结果相符,肌肉组织中阿维菌素类药物质量浓度较低,这与张卫卫[24]、邢丽红[25]等的研究结果相似。Opperhuizen等[26]研究也表明疏水性化合物在鱼体内的BCF值与其分子立体构型相关,当有机化合物的分子宽度大于0.95 nm,阻止向分子膜的转运。分子体积较大的阿维菌素、伊维菌素不易由分子膜转运,从而也导致了较小的BCF值。根据国际生物蓄积性标准BCF值大于5 000判断,阿维菌素、伊维菌素均属于非生物累积性物质。
2.6 石斑鱼肌肉组织中药物残留规律及食用安全评估
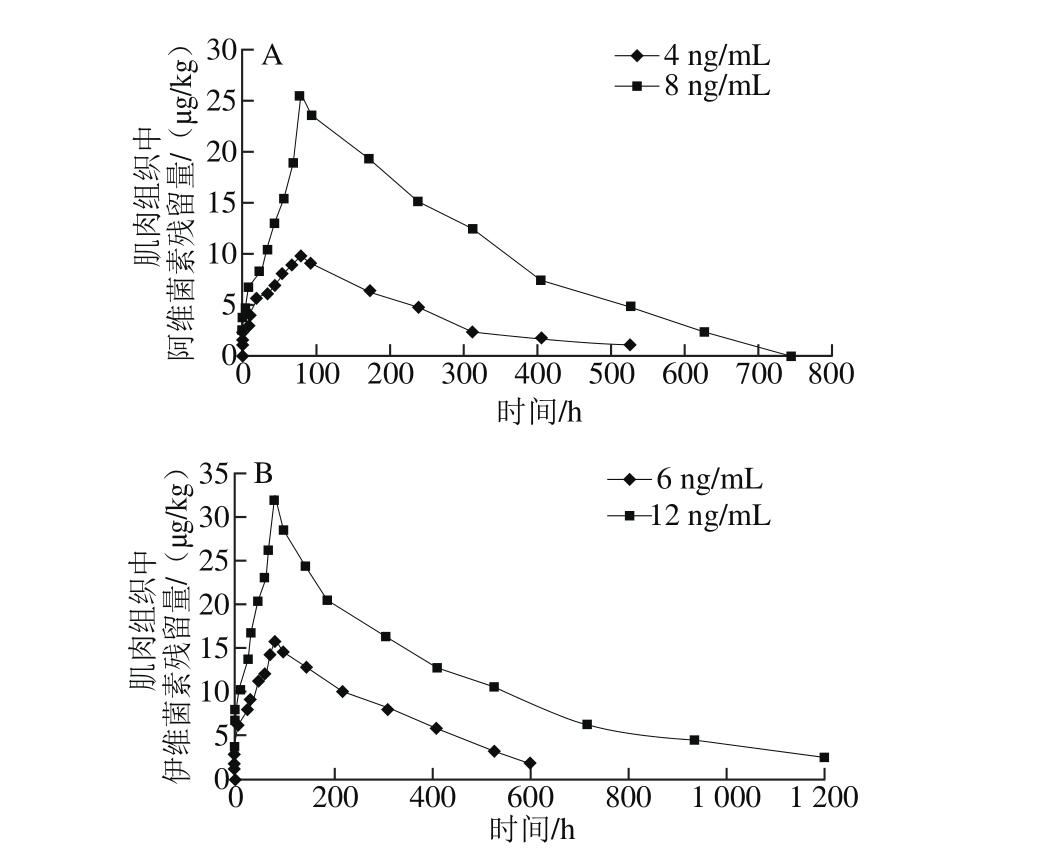
图4 阿维菌素(A)和伊维菌素(B)在石斑鱼肌肉组织组织中的药时曲线
Fig. 4 Concentration-time relationships for abamectin (A) and ivermectin (B) in muscle tissue of grouper
肌肉是鱼类最重要的可食组织,也是食品安全管理者和消费者共同关注的重点,因此应重点监测肌肉组织中药物残留的含量。如图4A所示,当环境水体中阿维菌素质量浓度达到4 ng/m L,2.5 h内肌肉组织中阿维菌素含量低于定量限,82.5 h达到峰值9.72 μg/kg,随后阿维菌素含量逐渐下降,408 h(17 d)时降至定量限以下;而当环境水体中阿维菌素质量浓度达到8 ng/m L,1.5 h即可检出阿维菌素,82.5 h达到峰值25.54 μg/kg,随后阿维菌素含量逐渐下降,直到745.5 h(31 d)才未检出阿维菌素。如图4B所示,当环境水体中伊维菌素质量浓度达到6 ng/m L,1.25 h肌肉组织中伊维菌素含量为2.2 μg/kg,82.5 h达到峰值15.56 μg/kg,随后伊维菌素含量逐渐下降,600 h(25 d)伊维菌素含量降至定量限;而当环境水体中伊维菌素质量浓度达到12 ng/m L,0.5 h时即可检出伊维菌素,82.5 h达到峰值31.64 μg/kg,随后伊维菌素含量缓慢减少,1 200 h(50 d)肌肉组织中伊维菌素含量才降至定量限。
综合表明,石斑鱼肌肉组织中阿维菌素含量随着浸浴时间延长而快速上升,石斑鱼肌肉组织对阿维菌素类药物吸收较快,但蓄积浓度不高,滞留时间较长,消除较为缓慢。这与阿维菌素在鲫鱼肌肉组织中的消除规律[27]、伊维菌素在虹鳟鱼肌肉组织中的消除规律[28]和伊维菌素在吉富罗非鱼肌肉组织中的消除规律[29]相似。阿维菌素、伊维菌素在石斑鱼体内代谢规律相同,均按一级动力学过程从体内消除,但石斑鱼肌肉组织中伊维菌素蓄积含量相对较高,消除较为缓慢,滞留时间更长。本研究石斑鱼单次浸浴4、8 ng/m L阿维菌素海水72 h后,消除半衰期分别为107.12、143.48 h,平均滞留时间分别为175.43、205.78 h;单次浸浴6、12 ng/m L伊维菌素海水72 h后,消除半衰期分别为192.07、327.23 h,平均滞留时间分别为222.64、402.73 h。同一种药物的消除半衰期和平均滞留时间均随着环境水体中药物质量浓度的增加而迅速地非线性增长,这说明同一种药物的给药剂量对该类药物在石斑鱼体内的代谢消除影响较大[30]。且肌肉组织中的药物消除时间随着环境水体中药物质量浓度的升高而迅速增长,当环境水体中药物质量浓度增至原水体质量浓度2 倍时,阿维菌素消除时间由原来408 h增至745.5 h,伊维菌素消除时间由原来600 h增至1 200 h。因此,在该研究条件下,环境水体中药物质量浓度是石斑鱼肌肉组织中药物残留质量浓度及消除时间的重要因素。
本研究中阿维菌素、伊维菌素是按照一级动力学过程从石斑鱼体内消除的,即在消除后期服从指数消除:Ci = Co×e-Ket。2 种质量浓度条件下阿维菌素的Co分别为15.04、38.71,Ke分别为0.005、0.004;2 种质量浓度条件下伊维菌素的Co分别为22.51、33.53,Ke分别为0.004、0.002。但目前我国水产品无阿维菌素、伊维菌素MRL,以日本肯定列表中规定阿维菌素在鳗科类肌肉组织中的MRL为5 μg/kg,通过公式(4)计算,2 种质量浓度条件下阿维菌素在肌肉组织中的理论WDT值为220.26、511.67 h,即9、22 d。由于各国均未规定水产品中伊维菌素MRL,本实验出于食用安全考虑,以同类药物阿维菌素MRL作为伊维菌素的MRL,通过公式(4)计算,2 种质量浓度条件下伊维菌素在肌肉组织中的理论WDT值为376.13、951.50 h,即16、39 d。因此,为保证食用者的安全,环境水体中阿维菌素质量浓度达到4~8 ng/m L时,石斑鱼浸浴72 h后安全食用时间为22 d;环境水体中伊维菌素质量浓度达到6~12 ng/m L时,石斑鱼浸浴72 h后安全食用时间为39 d。
本研究系统地建立了高效液相色谱-串联质谱法检测石斑鱼血浆、肌肉组织和肝脏组织中阿维菌素、伊维菌素、甲氨基阿维菌素苯甲酸盐残留的方法,并对色谱条件、质谱条件、样品提取净化方法进行了优化,方法灵敏度高,准确度、精密度和各项技术指标均满足国内外残留检测的相关要求。同时在模拟实验条件下,获得种植区附近水域中阿维菌素类药物含量,即阿维菌素质量浓度4~8 ng/m L、伊维菌素质量浓度6~12 ng/m L。以此作为受试质量浓度,采用研究所建立的检测方法,开展污染水体中阿维菌素、伊维菌素在石斑鱼肌肉组织中的富集、消除实验,并进行石斑鱼食用安全风险评估,有利于管理部门对水环境污染中的阿维菌素类药物的危害有充分的认识,从而保障人们的食用安全健康。
参考文献:
[1] SODERLUND D M, ADAMS P M, BLOOMQUIST J R. Differences in the action of avermectin B1a on the GABAA receptor comp lex o f mouse and rat[J]. Biochem ical and Biophysical Research Communications, 1987, 146(2): 692-698. DOI:10.1016/0006-291X(87)90584-5.
[2] SODERLUND D M, BLOOMQUIST J R, WONG F, et al. Molecular neurology: im p lications for insecticide action and resistance[J].Pesticide Science, 1989, 26(4): 359-374. DOI:10.1002/ps.2780260404.
[3] MARTENIES S E, PERRY M J. Environmental and occupational pesticide exposure and human sperm parameters: a systematic rev iew[J]. Tox ico logy, 2013, 307: 66-73. DO I:10.1016/j.tox.2013.02.005.
[4] 张卫. 农药阿维菌素在环境中的降解和代谢研究[D]. 杭州: 浙江大学, 2004: 7-15.
[5] 陈然. 农田中阿维菌素在水体和土壤中的残留特征研究[D]. 西安:西南交通大学, 2016: 5-9.
[6] 董加沙, 何绪刚, 邓闵, 等. 阿维菌素对池塘水质和浮游生物群落结构的短期影响[J]. 水产科学, 2015, 34(9): 546-554. DOI:10.16378/j.cnki.1003-1111.2015.09.003.
[7] 张卫卫, 符贵红, 王元, 等. 阿维菌素在模拟水产养殖生态系统中的蓄积与消除规律[J]. 中国水产科学, 2016, 23(1): 225-232.DOI:10.3724/SP.J.1118.2016.15113.
[8] 程敏红, 杨小立, 庞强, 等. 乙酸铜和阿维菌素对斜带石斑幼鱼毒性效应的研究[J]. 水产科学, 2014, 33(18): 469-475. DOI:10.3969/j.issn.1003-1111.2014.08.001.
[9] 张文娟, 连庚寅, 郭晓喜, 等. 超高效液相色谱-串联质谱法测定10 种食品中的阿维菌素类药物残留[J]. 食品科学, 2012, 33(18): 226-231.
[10] 侯改成, 谭艾娟, 吕世明, 等. 超高效液相色谱-串联质谱法同时检测牛乳中4 种驱虫药物残留[J]. 食品科学, 2015, 36(6): 216-219.DOI:10.7506/spkx1002-6630-201506041.
[11] 王文兰, 刘艳辉, 祖岫杰, 等. 鱼肌肉中阿维菌素和伊维菌素药物残留测定的样品前处理[J]. 分析实验室, 2015, 34(4): 475-479.DOI:10.13595/j.cnki.issn1000-0720.2015.0107.
[12] 杨君宏, 何继红, 侯晓林, 等. ELISA方法检测牛组织中的阿维菌素类药物残留[J]. 中国兽医杂志, 2014, 50(9): 70-71. DOI:10.3969/j.issn.0529-6005.2014.09.025.
[13] 何红梅, 赵华, 张春荣, 等. 超高效液相色谱-串联质谱法测定粮谷中阿维菌素类杀虫剂残留[J]. 分析化学, 2013, 41(11): 1627-1632.DOI:10.3724/SP.J.1096.2013.21248.
[14] 易锡斌, 梁玉树, 黄晓琴, 等. UPLC-MS/MS同时测定蔬菜中阿维菌素等5 种常用农药残留量[J]. 分析测试学报, 2015, 34(7): 892-835.DOI:10.3969/j.issn.1004-4957.2015.07.013.
[15] 钱卓真, 吴成业, 刘智禹, 等. 阿维菌素在鲈鱼肌肉组织中的残留与消除规律[J]. 南方水产科学, 2013, 9(6): 52-57. DOI:10.3969/j.issn.2095-0780.2013.06.009.
[16] VEITH G D, DEFOE D L, BERGSTEDT B V. Measuring and estimating the bioconcentration factor of chem icals in fish[J]. Journal of the Fisheries Research Board of Canada, 1979, 36(9): 1040-1048.DOI:10.1139/f79-146.
[17] KENAGA E E, GORING C A I. Relationship betw een w ater solubility, soil sorption, octanol/water partitioning, and concentration of chem icals in biota[M]//Aquatic Toxicology. West Conshohocken,PA: American Society for Testing and M aterials, 1980: 78-115.DOI:10.1520/STP27410S.
[18] 郑卫东, 胡江涛, 阴文娅, 等. 高效液相色谱-串联质谱测定猪肝中阿维菌素、伊维菌素残留[J]. 食品科学, 2011, 32(4): 185-188.
[19] 赫欣睿, 高旭东, 叶永丽, 等. SPE-HPLC法检测牛肉及牛奶中阿维菌素残留[J]. 黑龙江畜牧兽医, 2016(15): 268-272. DOI:10.13881/j.cnki.hljxmsy.2016.1431.
[20] 张启迪, 邹明, 刘文华, 等. 阿维菌素残留检测中不同SPE柱净化效果的比较研究[J]. 中国动物检疫, 2007, 24(12): 29-30. DOI:10.3969/j.issn.1005-944X.2007.12.016.
[21] DE HOYOS O, CUARTAS O Y, PEÑUELA M G. Development and validation of a highly sensitive quantitative/confi rmatory method for the determ ination of ivermectin residues in bovine tissues by UHPLCMS/MS[J]. Food Chem istry, 2017, 221: 891-897. DOI:10.1016/j.foodchem.2016.11.077.
[22] 董蔚, 郭凯, 李贺贺, 等. QuEChERS-GC-MS联用法检测大麦中14种邻苯二甲酸酯类塑化剂及基质效应的影响[J]. 食品科学, 2016,37(24): 156-163. DOI:10.7506/spkx1002-6630-201624024.
[23] BROOKE D N, DOBBS A J, W ILLIAMS N. Octano l: w ater partition coefficients (P): measurement, estimation and interpretation,particularly for chem icals w ith P greater than 105[J]. Ecotoxicology and Environmental Safety, 1986, 11(3): 251-260. DOI:10.1016/0147-6513(86)90099-0.
[24] 张卫卫, 湛嘉, 王元, 等. 药浴暴露下阿维菌素在异育银鲫体内蓄积和消除规律[J]. 海洋渔业, 2014, 36(5): 461-468. DOI:10.3969/j.issn.1004-2490.2014.05.011.
[25] 邢丽红, 孙伟红, 冷凯良, 等. 阿维菌素在鲈组织中的富集及消除规律研究[J]. 中国渔业质量与标准, 2013, 3(4): 63-69.
[26] OPPERHULZEN A, VAN DER VELDE E W, GOBAS F, et al.Relationship between bio-cencentration in fish and steric factors of hydrophobic chem icals[J]. Chemosphere, 1985, 14(11/12): 1871-1896.DOI:10.1016/0045-6535(85)90129-8.
[27] 陈静. 鲫鱼肌肉中阿维菌素类残留检测和消除规律研究[D]. 重庆:西南农业大学, 2008.
[28] SHAIKH B, RUMMEL N, GIESEKER C, et al. Residue dep letion of tritium-labeled ivermection in rainbow trout fo llow ing oral adm inistration[J]. Aquaculture, 2007, 272(1/2/3/4): 192-198.DOI:10.1016/j.aquaculture.2007.08.050.
[29] 李世凯, 江敏, 吴昊, 等. 伊维菌素在吉富罗非鱼体内的药物动力学[J]. 西北农林科技大学学报(自然科学版), 2016, 44(8): 32-40.DOI:10.13207/j.cnki.jnwafu.2016.08.006.
[30] 王广基. 药物代谢动力学[M]. 北京: 化学工业出版社, 2005: 64-85;315-318.
Determ ination and Food Safety Risk Assessment of Avermectin Residues in Grouper
QIAN Zhuozhen1,2, TANG Shuifen2, LUO Fangfang2, WANG Lijuan2, WEI Shaohong2
(1. College of Materials, Xiamen University, Xiamen 361005, China; 2. Key Laboratory of Cultivation and High-Valued Utilization of Marine Organisms in Fujian Province, Fisheries Research Institute of Fujian, Xiamen 361013, China)
Abstract:A multi-residue method based on high performance liquid chromatography-tandem mass spectrometry (HPLCMS/MS) was developed for the quantitative determ ination of abamectin, ivermectin and emamectin benzoate in grouper plasma, muscle and liver. The target analytes were extracted w ith acetonitrile and then cleaned up w ith an alkaline alum ina column/LC-C18SPE column. The analytes were separated on a Thermo Hypersil Gold C18column by gradient elution w ith 0.1% form ic acid-10 mmol/L ammonium acetate as mobile phase A and acetonitrile as mobile phase B, and detected by multiple reaction monitoring (MRM) w ith electrospray ionization (ESI) under positive ion mode. The target compounds were quantified by the matrix-matched external standard method. Both pesticides could move into water through various environmental routes. Therefore, the bioaccumulation and elim ination of avermectin and ivermectin in groupers were studied by bath administration at the upper and lower concentration limits (4 and 8 ng/m L for avermectin, and 6 and 12 ng/m L for ivermectin) in environmental water. Meanwhile, the food safety risk of the pesticide residues in fish was assessed. The results showed that the calibration curves were linear (R2> 0.99) in the concentration range of 2.5–200 ng/m L for abamectinand ivermectin and 0.25–20 ng/m L for emamectin benzoate. The lim its of detection (LOD) for abamectin, ivermectin and emamectin benzoate were 2.5, 2.5 and 0.25 ng/m L in plasma, 1, 1 and 0.1 μg/kg in muscle, 2.5, 2.5 and 0.25 μg/kg in liver,respectively. The limits of quantification (LOQ) were 5, 5 and 0.5 ng/m L in plasma, 2, 2 and 0.2 μg/kg in muscle, 5, 5 and 0.5 μg/kg in liver, respectively. The average recoveries at three spiked levels ranged from 74.6% to 93.6%. Intra-day and inter-day relative standard deviations (RSDs) were 2.3%–10.9% and 9.2%–12.6%, respectively. Abamectin and ivermectin were no-bioaccumulative substances and their elim ination processes in grouper conformed to a fi rst order kinetics equation.Under the conditions of this study, drug concentration was an important factor affecting the residual drug concentration and elim ination time in grouper muscle tissues. Gouper was safe for consumption 22 and 39 days after 72 h bath adm inistration for 4–8 ng/m L abamectin and 6–12 ng/m L ivermectin, respectively.
Key words:grouper; avermectin residues; food safety risk assessment
收稿日期:2017-02-06
基金项目:福建省海洋经济创新发展区域示范项目(闽台重要海洋生物资源高值化开发技术公共服务平台,2014FJPT01);厦门南方海洋研究中心项目(福建重要海洋经济生物种质库与资源高效开发技术公共服务平台,14PZY017NF17);福建省海洋与渔业科技项目(KJXH-2010-007);福建省海洋高新产业发展专项(闽海洋高新[2014]18号);国家海洋局海洋公益性行业科研专项(201505034-4)
作者简介:钱卓真(1981—),女,助理研究员,博士,研究方向为海洋环境污染物及水产品质量安全。
E-mail:qianzhuozhen@126.com
DOI:10.7506/spkx1002-6630-201722046
中图分类号:R155.5
文献标志码:A
文章编号:1002-6630(2017)22-0309-08
引文格式:
钱卓真, 汤水粉, 罗方方, 等. 石斑鱼中阿维菌素类药物多残留测定及食用安全风险评估[J]. 食品科学, 2017, 38(22):309-316. DOI:10.7506/spkx1002-6630-201722046. http://www.spkx.net.cn
QIAN Zhuozhen, TANG Shuifen, LUO Fangfang, et al. Determ ination and food safety risk assessment of avermectin residues in grouper[J]. Food Science, 2017, 38(22): 309-316. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722046. http://www.spkx.net.cn