
图1 芸豆成分实时荧光PCR特异性检测图谱
Fig. 1 Specificity of real-time fluorescent PCR for detection of kidney bean com ponent
孙良广1,黄文婧2,*
(广西梧州食品药品检验所,广西 梧州 543002)
摘 要:目的:建立基于实时荧光聚合酶链式反应(polymerase chain reaction,PCR)技术检测莲蓉制品中芸豆成分的方法。方法:以芸豆pvsbe2基因高度保守区域设计特异性引物和探针,通过对莲子及其他富含淀粉类植物DNA进行扩增,以验证方法的特异性;以1 ng/μL的芸豆DNA进行系列稀释,确定此法检测灵敏度;对含有1%芸豆与莲子的混合样品的DNA模板进行10 倍梯度稀释,确定重量检测灵敏度;并应用此方法和PCR方法对市场样品进行了检测,对建立的荧光PCR方法进行验证。结果:该检测方法具有高度特异性,与莲子及其他高淀粉植物无交叉反应;DNA质量浓度的检测灵敏度达到1 pg/μL,重量检测灵敏度可达0.01%。含芸豆成分的莲蓉月饼扩增阳性,检测结果与食品标签相符。结论:本研究建立的实时荧光PCR方法具有特异性强、灵敏度高、快速简便的特点,更适合莲蓉制品中芸豆成分的快速检测。
关键词:莲蓉制品;芸豆成分;检测;实时荧光PCR
近年来,由于莲子价格的不断攀升,不少厂家为了节约成本会用芸豆馅料冒充莲蓉馅料。芸豆内除含有维生素、无机盐等营养成分外,还含有一种对人体有害的成分——血球凝集素,该成分经高温烹调后可被破坏。但是如果在芸豆加工过程中,烹调时间短或翻炒不均匀,致使芸豆不熟,可引起食物中毒[1]。芸豆在消化吸收过程中会产生过多的气体,造成胀肚。故消化功能不良、有慢性消化道疾病的人应尽量少食。还有一些对豆类蛋白敏感人群,如误食豆制品,可能会引起过敏性皮炎或严重的会产生休克。这些不适宜食用芸豆类食品的人群若误食没有标示有芸豆成分的莲蓉月饼,可能会造成不可预计的严重后果。
芸豆的检测依据GB/T 23814—2009《莲蓉制品中芸豆成分定性PCR检测方法》莲蓉制品中芸豆成分定性聚合酶链式反应(polymerase chain reaction,PCR)检测方法[2],该方法为普通PCR法,主要过程为通过特异性基因序列扩增后用凝胶成像的方式鉴别,此法步骤繁琐,干扰因素较多,不利于批量检测。通过查阅大量文献[3-26]后,参照GB/T 23814—2009标准中的芸豆特异性基因序列,设计特异性引物和探针,建立莲蓉制品中芸豆成分的实时荧光PCR检测方法,此法具有反应快速、特异性强、灵敏度高、结果清晰等优点,更适合实验室的批量和快速检测。
1.1 材料与试剂
用于芸豆成分特异性检测样品皆由本实验室提供,包括:白芸豆、红芸豆、花芸豆、黑芸豆、大豆、莲子、玉米、红薯、小麦、薏米、板栗、花生、土豆、魔芋共14 种物种。市售莲蓉月饼(包括20 种标示为纯莲蓉月饼,15 种未标示出莲蓉含量,5 种标示有白芸豆成分,以下统称为莲蓉月饼)共40 份。
Hi-DNAsecure Plant Kit高效植物基因组DNA提取试剂盒(货号:DP350-02) 天根生化科技(北京)有限公司;LabServ Plant DNA Kit磁珠法植物DNA提取试剂盒(货号:KFR-804096) 赛默飞世尔科技(中国)有限公司;植物基因组DNA提取试剂盒(货号:T003L)广州迪澳生物科技有限公司;Taq DNA聚合酶、dNTP、10×PCR Buffer TaKaRa生物工程公司;2×ES PCR M aster M ix (货号:CW 0690M)、DNA标准M arker(100 bp ladder)(货号:CW 0636S) 北京康为世纪生物科技有限公司。
1.2 仪器与设备
M inispin台式高速离心机 德国Eppendorf公司;M IN IB-1 0 0F恒温金属浴 杭州米欧仪器有限公司)、XA 205DU电子天平 德国梅特勒-托利多公司;LightCycler96荧光定量PCR仪 瑞士罗氏公司;Thermo Fisher Duo磁珠提取仪、OSE-260微量分光光度计天根生化科技有限公司;C1000 Touch PCR仪、PowerPac Basic电泳仪、Gel Doc XR+凝胶成像分析仪 美国伯乐公司。
1.3 方法
1.3.1 引物与探针设计合成
荧光PCR检测上游引物:ATGAATTGTACGG TGAAGGATGG;下游引物:GGACTGTAAACAAACA CAGGTAGC;探针:FAM-5’-TCGCAGTCTCGTTG T CACCTCCA-3’-BHQ1;普通PCR引物参照GB/T 23814—2009标准,引物和探针由深圳华大基因科技有限公司合成。
1.3.2 样品制备
将芸豆样品去皮烤干后用粉碎机打成粉末,其他物种样品均用粉碎机打碎后取样用于DNA的提取。莲蓉月饼样本取月饼馅料用于DNA提取。
取含1%芸豆与莲子的混合样品的DNA模板进行10 倍逐级稀释,使芸豆在混合样品中的含量为1%、0.1%、0.01%。用于含量检测灵敏度的测定。
1.3.3 DNA提取
将含有1%芸豆的样品、纯芸豆样品、随机抽取5批莲蓉月饼,取样量均为(40±2)mg。采用Tiangen(天根)的Hi-DNAsecure Plant Kit高效植物基因组DNA提取试剂盒、迪澳的植物基因组DNA提取试剂盒和LabServ Plant DNA Kit磁珠法植物DNA提取试剂盒在Thermo Fisher Duo磁珠提取仪上提取,按照试剂盒说明书进行。用OSE-260型微量分光光度计测定DNA质量浓度和对比不同试剂盒的DNA提取效果。
1.3.4 实时荧光PCR反应
实时荧光PCR采用25 μL反应体系:10×PCR Bu ffer 2.5 μL,dNTP(2.5mm o l/L)1 μL,M gC l2(25 mm o l/L)3 μL,上、下游引物(50 mm o l/L)各0.07 μL,探针(50 mmol/L)0.05 μL,Taq酶(5 U/μL)0.3 μL,50%甘油0.2 μL,模板DNA 5 μL,补水至25 μL。PCR反应条件:95 ℃预变性3 m in,95 ℃变性5 s,55 ℃退火60 s,同时收集荧光,进行45 个循环。
1.3.5 实时荧光PCR的特异性实验
选取白芸豆、红芸豆、花芸豆、黑芸豆、大豆、莲子、玉米、红薯、小麦、薏米、板栗、花生、土豆、魔芋的DNA作为PCR的模板,以去离子水为阴性对照模板,进行实时荧光PCR扩增,检测荧光引物的特异性。
1.3.6 实时荧光PCR的灵敏度实验
取白芸豆提取出的DNA模版进行稀释至1 ng/μL,然后再进行一系列梯度稀释,将系列稀释的DNA模版进行荧光PCR扩增,测试荧光PCR法的检测灵敏度。取质量分数1%芸豆与莲子的混合样品的DNA模板进行10 倍系列稀释,使芸豆在混合样品中的含质量分数1%、0.1%、0.01%,作为PCR反应得模板,进行实时荧光PCR扩增,测试方法的含量检测灵敏度。
1.3.7 芸豆PCR扩增
普通PCR反应体系:2×Es PCR M aster M ix 12.5 μL,上、下游引物各1 μL(20 pmol/μL),RNase-Free Water 7.5 μL,模板DNA 3 μL。PCR反应程序为:94 ℃预变性5 m in;94 ℃变性30 s;56 ℃退火30 s;72 ℃延伸30 s,35 个循环后,72 ℃延伸5 m in。
普通PCR扩增反应结束后,PCR扩增产物以2.0%琼脂糖凝胶电泳检测,并记录结果。
2.1 DNA提取方法比较实验
3 种DNA提取方法的提取下列样本,对样本DNA含量和纯度(以A260nm/A280nm表示)进行测定,结果见表1。
由于莲蓉月饼馅料中含有大量的糖分和油脂,会影响DNA的提取效果,依据GB/T 23814—2009标准要求,当A260nm/A280nm在1.4以上时,可用于PCR扩增,1.7~2.0之间时,PCR扩增效果好[2],通过3 种试剂盒提取的DNA质量浓度和纯度数据对比,最终确定用迪澳的植物基因组DNA提取试剂盒提取莲蓉月饼样本(A260nm/A280nm均能达到1.4以上),用天根的高效植物基因组DNA提取试剂盒提取植物类样本(A260nm/A280nm均能达到1.8以上)。确保后续PCR扩增不会受DNA纯度的影响干扰实验结果的判定。
2.2 实时荧光PCR法特异性检测结果

图1 芸豆成分实时荧光PCR特异性检测图谱
Fig. 1 Specificity of real-time fluorescent PCR for detection of kidney bean com ponent
采用本试剂盒对富含淀粉植物DNA进行实时荧光PCR扩增,结果显示,只有4 种芸豆样品的DNA有明显的S型扩增曲线(Ct值在19.66~22.56之间),其余10 种植物DNA均未出现明显的S型扩增曲线(图1)。结果表明,本研究建立的方法所设计的引物和探针具有高度的种属特异性。
2.3 实时荧光PCR法灵敏度测试结果
以质量浓度为1、0.1、0.01、0.005、0.001、0.000 5 ng/μL的芸豆DNA为模板,进行荧光PCR扩增,从扩增图谱(图2)可以看出,在0.001 ng/μL以上的芸豆DNA中均出现了明显的S型扩增曲线。其Ct值依次为25.91、29.65、33.21、34.59、35.84。本实验结果表明,该方法检测灵敏度为0.001 ng/μL(即1 pg/μL)。与国标采用的普通PCR方法相比较检测灵敏度为0.5 ng,检测的灵敏度更高,是普通PCR的500 倍。

图2 芸豆成分DNA质量浓度灵敏度实时荧光PCR检测扩增图谱
Fig. 2 Amp lification curves show ing the sensitivity of real-time fluorescent PCR for detection of different concentrations of kidney bean DNA
将1.3.2节1%、0.1%、0.01%三个稀释梯度的芸豆混合样品DNA进行实时荧光PCR扩增,此3 个浓度的芸豆混合样品均有明显S型扩增曲线(图3),Ct值依次为27.90、31.45、34.57。结果表明,该方法能检测出原料产品中0.01%的芸豆成分。

图3 芸豆成分实时荧光PCR重量灵敏度检测图谱
Fig. 3 Amp lification curves show ing the sensitivity of real-time fluorescent PCR for detection of different proportions of kidney bean component
表1 实验样品DNA提取结果
Tab le 1 Resu lts of DNA extraction from experimental sam p les

2.4 使用荧光PCR方法和普通PCR方法检测市售莲蓉月饼的芸豆成分
将市售的40 批次不同厂家不同种类的莲蓉月饼进行DNA提取后,分别用普通PCR法和实时荧光PCR法检测进行相互验证,检测结果见图4、5及表2。

图4 市售样品检测结果
Fig. 4 Am p lification curves for commercial sam p les
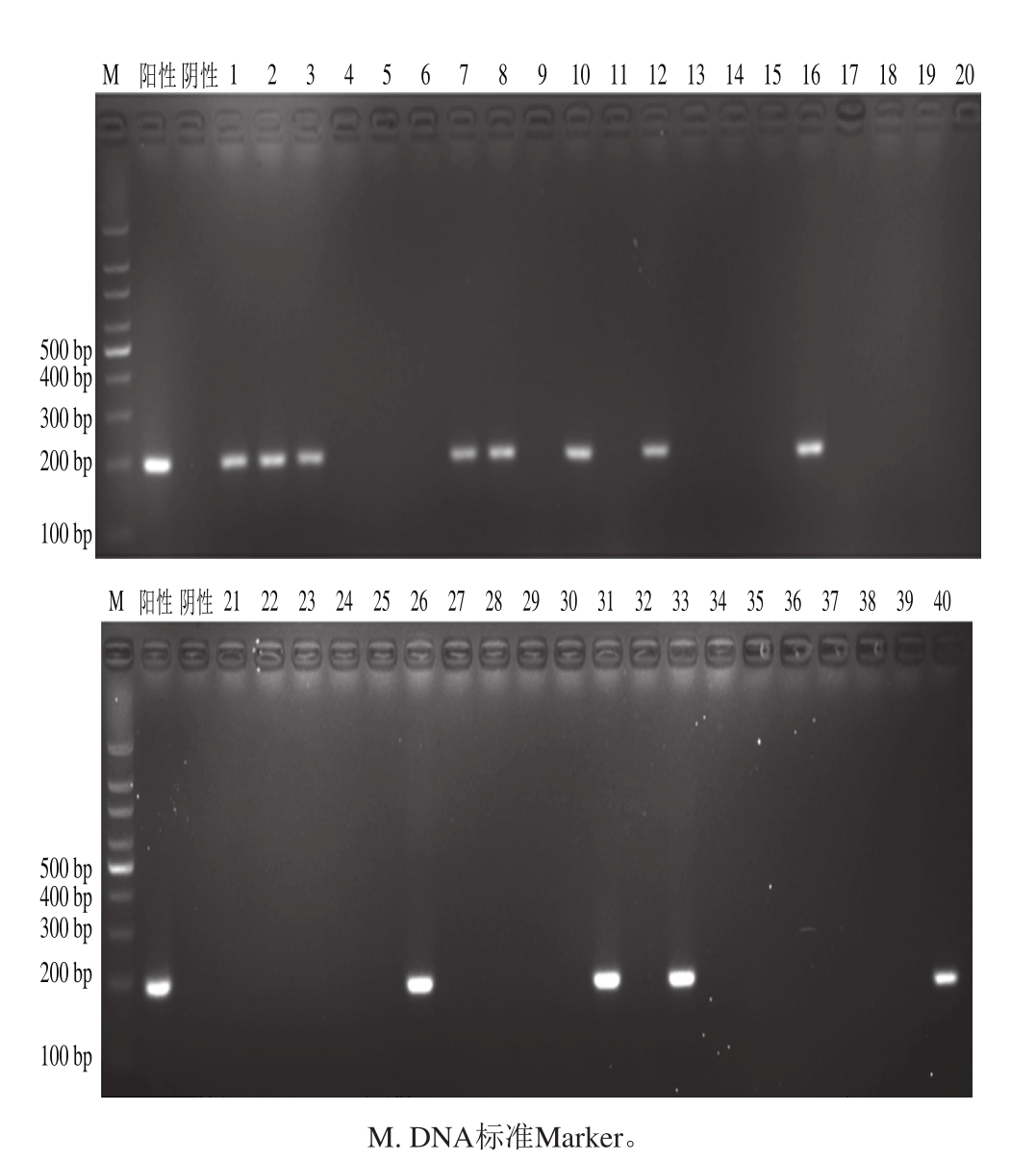
图5 莲蓉制品中芸豆成分DNA凝胶电泳图谱
Fig. 5 Gel electrophoresis of am p lified DNA from kidney bean in lotus seed paste product
通过以上实时荧光PCR和普通PCR比较结果表明,1、2、3、17、18这5 批含有芸豆成分的莲蓉月饼使用实时荧光PCR法检测均呈现阳性扩增,与食品标签标识完成一致;而使用普通PCR法检测,17、18号样品含有芸豆成分未出现目的条带,与食品标签标识不一致,存在漏检现象。标识纯莲蓉月饼的为20 种,实时荧光PCR法检出有芸豆成分为10 种,检出率50%,普通PCR法检出芸豆成分为5 种,检出率25%。未标示莲蓉含量的月饼共15 种,实时荧光PCR法检出有芸豆成分为8种,检出率53.3%,普通PCR法检出芸豆成分为4 种,检出率26.7%。
表2 市售样品用实时荧光PCR和普通PCR法检测结果比对
Tab le 2 Com parison of the results of real time fluorescence PCR and conventional PCR for commercial sam p les
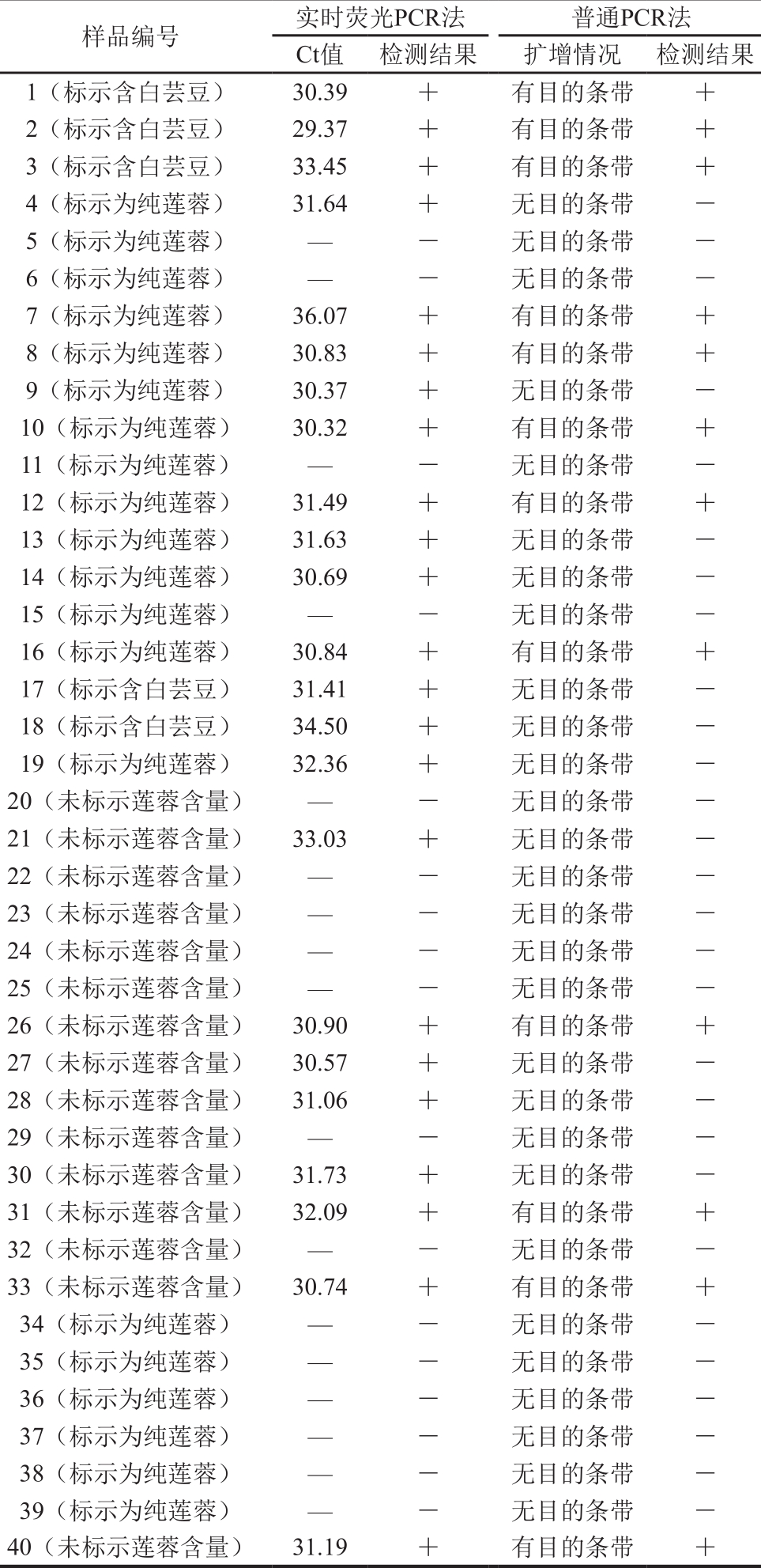
注:—.无数据;+.阳性;-.阴性。
荧光PCR自1995年由美国App lied Biosystem s公司推出开始问世,该技术不仅实现了PCR技术从定性到定量的飞跃,而且比普通PCR特异性更强、操作更加方便快捷,并有效地解决了常规PCR污染及对操作人员健康隐患的问题。目前,荧光PCR已经得到了较为广泛的应用。荧光定量PCR技术在常规PCR的基础上,在PCR扩增过程中加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;刚开始时,探针结合在DNA任意一条单链上;PCR扩增时,Taq酶的5’端-3’端外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步[26]。
本研究建立的芸豆实时荧光PCR方法对莲蓉制品中的芸豆成分进行定性检测,DNA质量浓度灵敏度可到达1 pg/μL,比标准灵敏度0.5 ng提升近500 倍,含量检测灵敏度可达到0.01%。对40 种市售月饼进行检测,结果实时荧光PCR法芸豆成分检出率57.5%,普通PCR法芸豆成分检出率30%,实时荧光PCR法比普通PCR法检出率高出将近一倍。对5 种外包装标识有芸豆成分的莲蓉月饼检测结果表明,实时荧光PCR法检测准确率为100%,普通PCR法检测准确率只有60%。由于莲蓉制品为深加工产品,在加工过程中DNA遭到严重破坏,而且受物理、化学或生物等因子的影响使DNA质量降低[27],莲蓉制品中还含有大量的糖分和油脂[28],都是可能导致了普通PCR法检测结果准确率不高的因素。而实时荧光PCR法由于灵敏度高,能实时记录扩增情况,受干扰因素少,检测准确度高,可免去电泳,无需触毒,操作更简便,也更快速、安全,因此更适合目前市场的检测需求。
据相关报道[29-30],目前国内莲蓉制品特别是莲蓉月饼的馅料存在各种掺假现象,主要是在莲蓉中掺入白芸豆蓉,再加入莲子香精制作出所谓的纯莲蓉馅料。在月饼国家标准中对莲蓉馅料有着明确的规定,只有莲籽质量分数为100%,才可称为纯莲蓉类。从以上检测结果验证了媒体的报道并非夸大其词,莲蓉掺假问题普遍存在。本方法,能更精准更快速的对莲蓉掺假进行检测,也可对有莲蓉掺假行为的生产企业起到震慑作用,对打击以次充好、以劣充优的销售乱象起重要作用。能更好地规范市场次序,保障好消费者权益和身体健康。
参考文献:
[1] 高伟红. 抢救15 例芸豆中毒的临床体会[J]. 现代诊断与治疗, 2002,13(3): 181. DOI:1001-8174(2002)03-0181-01.
[2] 国家质量监督检验检疫总局, 国家标准化管理委员会. 莲蓉制品中芸豆成分定性PCR检测方法: GB/T 23814—2009[S]. 北京: 中国标准出版社.
[3] 余澍琼, 张吉红, 赵旭东, 等. 掺杂玉米茶叶的基因DNA提取与PCR检测方法建立[J]. 湖北农业科学, 2013, 52(22): 5614-5617.DOI:0439-8114(2013)22-5615-03.
[4] 徐琼, 张奕南, 顾文佳, 等. Taq Man实时荧光PCR法定量检测生肉中猪源性成分的建立[J]. 食品科技, 2016, 41(2): 309-313. DOI:1005-9989(2016)02-0309-05.
[5] 王德莲, 刘冬虹, 许丽珠, 等. 鱼翅制品中鲨鱼源性成分的实时荧光PCR检测方法[J]. 现代食品科技, 2015, 31(4): 169-173.DOI:10.13982/j.m fst.1673-9078.2015.4.047.
[6] 汪永信, 程潇, 安虹, 等. 实时荧光PCR法同时检测食物中大豆和芹菜致敏原成分[J]. 生物技术通报, 2016, 32(1): 69-73. DOI:10.13560/j.cnki.bioteeh.bul1.1985.2016.01.012.
[7] 王爱迪, 冉晓华, 陈磊, 等. 超强磁性微球提取深加工转基因食品DNA[J]. 食品科学, 2013, 34(10): 122-125. DOI:10.7506/spx1002-6630-201310026.
[8] 韩建勋, 吴亚君, 王斌, 等. 实时荧光PCR法快速检测食用淀粉中的木薯成分[J]. 检验检疫学刊, 2015, 25(6): 4-8.
[9] 刘小艳, 傅春玲, 李培, 等. 实时荧光PCR法快速检测奶制品中掺入的大米源性成分[J]. 食品工业科技, 2014, 35(3): 283-288.
[10] RODRIGUES N P, GIV ISIEZ P E, QUEIROGA R C. M ilk adulteration: Detection of bovine m ilk in bulk goat m ilk produced by smallholders in northeastern Brazil by a duplex PCR assay[J].Journal of Dairy Science, 2012, 95(5): 2749-2752. DOI:10.3168/jds.2011-5235.
[11] DEMEKE T, JENKINS G R. Infuence of DNA extraction methods,PCR inhibitors and quantifcation methods on real-time PCR assay of biotechnology: derived traits[J]. Analytical and Bioanalytical Chem istry, 2010, 396(6): 1977-1990.
[12] 吴亚君, 王斌, 刘鸣畅, 等. 阿胶中马和驴成分的实时荧光PCR检测[J]. 食品科学, 2014, 35(8): 85-88. DOI:10.7506/spx1002-6630-20140816.
[13] FANG X, ZHANG C. Detection of adulterated murine components in meat products by Taq M an real-time PCR[J]. Food Chem istry, 2016,192(1): 485-490. DOI:10.1016/j.foodchem.2015.07.020.
[14] WU Y J, YANG Y G, WANG B, et al. A real-time PCR method targeting camel ingredient for food authentication[J]. AOAC International, 2015, 98(6): 1640-1644. DOI:10.5740/jaoacint.15-155.
[15] AHIRWAR R, NAHAR P. Screening and Identification of a DNA aptamer to concanavalin a and its application in food analysis[J].Agricultural and Food Chem istry, 2015, 63(16): 4104-4111.DOI:10.1021/acs.jafc.5b00784.
[16] 王佳慧, 吴爽, 李楠, 等. 常见肉类中鸭源性成分荧光PCR检测方法的建立[J]. 食品安全质量检测学报, 2016, 7(2): 825-828.
[17] 陈笑芸, 汪小福, 周育, 等. 转基因大豆深加工DNA鉴定技术研究[J].中国食品学报, 2013, 13(4): 156-161. DOI:1009-7848(2013)04-0156-07.
[18] DRUM L B, MAYER W. Development and validation of a Taq Man real-time PCR assay for the identification and quantification of roe deer (Capreolus capreolus) in food to detect food adulteration[J] Food Chemistry, 2015, 178: 319-326. DOI:10.1021/acs.jafc.5b00784.
[19] PARDO M A. Evaluation of a dual-probe real time PCR system for detection of mandarin in commercial orange juice[J]. Food Chem istry,2015, 172: 377-384. DOI:10.1016/j.foodchem.2014.09.096.
[20] VIETINA M, AGRIMONTI C, MARM IROLI N. Detection of plant oil DNA using high resolution melting (HRM) post PCR analysis:a tool for disclosure of olive oil adulteration[J]. Food Chem istry, 2013,141(4): 3820-3826. DOI:10.1016/j.foodchem.2013.06.075.
[21] GIRISH P S, HAUNSHI S, VAITHIYANATHAN S, et al. A rapid method for authentication of Buffalo (Bubalus bubalis) meat by A lkaline Lysis method of DNA extraction and species specific polymerase chain reaction[J]. Food Science and Technology, 2013,50(1): 141-146. DOI:10.1007/s13197-011-0230-6.
[22] 许如苏, 周广彪, 魏霜, 等. 锁核酸探针多重荧光PCR快速检测肉制品中4 种动物肉掺假的研究[J]. 检验检疫学刊, 2016, 26(2): 12-16.
[23] 沙才华, 黄海超, 廖秀云, 等. 食品中牛源性成分荧光PCR检测方法的建立[J]. 畜禽业, 2016(8): 56-58. DOI:1008-0414(2016)08-0156-03.
[24] 左泽彦, 孙瑞方. 实时荧光PCR检测食品中牛及猪源性成分[J].贵州农业科学, 2016, 44(4): 130-132. DOI:1001-3601(2016)04-0177-0130-03.
[25] 刘艳艳, 霍胜楠, 梁水美, 等. 化妆品中动物源性成分多重试试荧光PCR检验方法的研究[J]. 日用化学工业, 2016, 46(8): 479-484.DOI:10.13218/j.cnki.csdc.2016.08.011.
[26] 陈志宣, 龚国利. 常见阿胶伪品的荧光PCR分子检测[J]. 陕西科技大学学报, 2015, 33(3): 135-139. DOI:1000-5811(2015)03-0135-05.
[27] 金红, 赵昕, 王永, 等. 转基因作物深加工产品的DNA提取方法研究[J].华北农学报, 2006, 21(2): 53-56. DOI:1000-7091(2006)02-0053-04.
[28] 国家质量监督检验检疫总局, 国家标准化管理委员会. 月饼: GB/T 19855—2015[S]. 北京: 中国标准出版社, 2005.
[29] 戴先任. 月饼“变心”是商家“背叛”消费者[J]. 公民导刊, 2015(10): 56.
[30] 宗春霞. 今年月饼吃健康[J]. 食品指南, 2011(9): 8-10.
A Real-Time PCR Assay for Rapid Detection of Kidney Bean Component in Lotus Seed Paste Product
SUN Liangguang1, HUANG Wenjing2,*
(Wuzhou Institutes Food and Drug Control, Wuzhou 543002, China)
Abstract:Objective: This study aimed to establish a real-time PCR method for rapid detection of kidney bean components in Lotus seed paste product. Methods: Specific primers and probes were designed based on the highly conserved region of the pvsbe2 gene of Phaseolus coccineus L. Specificity was confi rmed by DNA amplification of lotus seeds and other starchrich plants. In addition, 1 ng/μL DNA of kidney bean was gradually diluted to determ ine its sensitivity. The DNA template of a mixture sample which contained 1% kidney bean and lotus seeds was 10-fold diluted to verify the weight sensitivity.And this method and PCR were applied to determ ine market samples for further validation. Results: This method had a high specificity which displayed no cross reaction w ith lotus seeds and other starch-rich plants. The sensitivity for detecting kidney bean DNA concentration and the proportion of kidney bean component were 1 pg/μL and 0.01%, respectively.The detection results indicated that positive amplification appeared in kidney bean present in lotus-seed-paste moon cake,which conformed to the food labels. Conclusions: The real-time fluorescent PCR method established in this study has the characteristics of high specificity and sensitivity and is suitable for fast detection of kidney bean component in lotus seed paste products.
Key words:Lotus seed paste product; kidney bean component; detection; real-time polymerase chain reaction
DOI:10.7506/spkx1002-6630-201722049
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)22-0330-05
引文格式:
孙良广, 黄文婧. 实时荧光PCR技术快速检测莲蓉制品中芸豆成分[J]. 食品科学, 2017, 38(22): 330-334. DOI:10.7506/spkx1002-6630-201722049. http://www.spkx.net.cn
SUN Liangguang, HU ANG Wenjing. A real-time PCR assay for rapid detection of kidney bean component in lotus seed paste product[J]. Food Science, 2017, 38(22): 330-334. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201722049. http://www.spkx.net.cn
收稿日期:2016-11-08
作者简介:孙良广(1985—),男,主管中药师,学士,主要从事食品药品安全检验检测研究。E-mail:sunliangguang@163.com。
*通信作者:黄文婧(1984—),女,执业药师,学士,主要从事食品药品安全检验检测研究。E-mail:47990584@qq.com