向富友1,2,李利军1,2,*,程 昊1,2
(1.广西科技大学生物与化学工程学院,广西 柳州 545006;2.广西糖资源绿色加工重点实验室,广西 柳州 545006)
摘 要:以新生CaSO3的形貌和结构为出发点,探讨了其在糖汁清净过程中的作用机理。新生CaSO3絮凝物呈现出疏松多孔的表面结构,对糖汁中悬浮的胶体微粒具有很强的吸附能力。实验数据拟合结果表明,新生CaSO3对糖汁清净过程符合准二级动力学模型和Temkin吸附等温线。热力学参数显示出CaSO3的吸附是自发吸热的过程。同时,通过X射线衍射图谱和傅里叶变换红外光谱对絮凝物的成分和结构进行分析,进一步研究了新生CaSO3在糖汁清净过程中的吸附与包埋机制。
关键词:亚硫酸钙;糖汁清净;形貌和结构;机理
糖汁清净过程是制糖工业中的一道关键工序,其目的是最大程度地除去糖汁中的非糖成分以及提高糖汁pH值,从而减少蔗糖的转化率[1]。蔗汁中溶解的杂质包括还原糖、色素、氨基酸、有机酸和无机盐等,其中色素的组成成分十分复杂,一部分来自于甘蔗中所含有的叶绿素、黄酮和多酚类化合物,另一部分则是由甘蔗中无色或者颜色很淡的物质经过各种化学反应而生成的深色物质,如类黑精、黑色素等;无机盐主要是含有Ca、P、Mg、Na、K、Si、S、Al和Cl等元素的物质。不溶解的杂质主要为泥土、淀粉和蔗蜡等[2]。清净效果不仅影响糖汁的过滤性和蔗糖结晶,并且还会影响清汁色泽、蔗糖晶体的形貌以及杂质含量。然而,糖汁中悬浮的胶体微粒性质十分稳定,在重力的作用下不易沉降下来。因此,研究糖汁微粒间的相互作用以及絮凝沉降过程尤为重要[3]。在过去的几十年中,亚硫酸法因其流程短、能耗低、操作简单而被广泛运用。其清净工艺的原理是通过石灰乳与SO2反应生成CaSO3微粒来吸附糖汁中的非糖杂质,通常用石灰乳将糖汁预灰至pH 6.2~6.5之间,SO2则可通过燃烧硫磺制成,硫熏pH值维持在7.2~7.3附近,这样沉淀后得到的凊汁可以达到pH 7.0的最佳状态。糖汁在进入沉淀池前加热至沸腾,以排除残留的空气和促进CaSO3生成,最后在絮凝剂的作用下,通过压缩双电层、架桥、网捕、卷扫等机制发生絮凝沉降,从而降低糖汁的色值和提高糖纯度[4-6]。一方面,CaSO3作为一种吸附剂,在糖汁清净过程中吸附并凝聚糖汁中的酚类、色素等非糖成分;另一方面,CaSO3作为一种促凝剂,通过压缩双电层,影响糖汁中胶体粒子的稳定性,使糖汁小微粒凝聚形成大颗粒;同时SO2还具有一定的还原性,能有效抑制酶促褐变和非酶褐变以及还原色素和色素前驱体中的不饱和双键,从而达到降低糖汁色值的目的[7]。因此,吸附和凝聚是CaSO3对糖汁起清净作用的关键。目前,国内外在糖汁清净工艺优化和改进方面的研究较多,对清净机理的研究较少。CaSO3的结构和表面物理化学性质在很大程度上影响着糖汁清净过程中的主要化学反应和清净效率[8]。本实验以糖汁亚硫酸法清净工艺为研究对象,通过探讨吸咐非糖成分后的CaSO3沉淀(新生CaSO3)的微观形貌和化学结构,进一步研究新生CaSO3微粒的吸附特性和凝聚性能。
1.1 材料与试剂
一级赤砂糖 柳州市露塘糖业有限责任公司;盐酸、氢氧化钠、无水氯化钙、阴离子型聚丙烯酰胺(polyacrylamide,PAM) 汕头西陇化工股份有限公司;亚硫酸 广州化学试剂厂。
1.2 仪器与设备
扫描电子显微镜(scanning electron microscope,SEM) 德国卡尔蔡司有限公司;X射线衍射(X-ray diffraction,XRD)仪 丹东浩元仪器有限公司;傅里叶变换红外光谱仪 美国海洋光学公司;UV-2000型紫外-可见分光光度计 上海精密仪器仪表有限公司;AR124CN型分析天平 奥豪斯仪器(上海)有限公司;2WAJ-改型阿贝折射仪 上海物理学仪器厂。
1.3 方法
1.3.1 糖汁制备与清净
在室温条件下,准确称量一定质量赤砂糖将其溶于蒸馏水中,并用磁力搅拌器使其充分溶解,配制得到10 °Brix的回溶糖浆。取100 mL配制的糖汁于250 mL烧杯中,加热到70 ℃,加入0.3 g氧化钙充分分散于糖汁中,用亚硫酸调节糖汁pH值至7.0±0.1,在200 r/min条件下搅拌2 min。然后加热糖汁到100 ℃,再加入2 mg/kg的PAM溶液0.1 mL,于40 r/min条件下轻微搅拌5 min,室温条件下静置30 min,最后通过过滤分离絮凝物和澄清汁(糖液),得到新生CaSO3,并做进一步的分析。将上述糖汁换成二次蒸馏水,在其他条件相同的情况下实验,得到没有吸附糖汁杂质的CaSO3微粒(对照CaSO3),并对其做形貌和结构分析。
1.3.2 新生CaSO3的XRD分析
采用XRD仪分析其化学组成和晶体结构:配置铜靶X射线管和一个衍射光束单色器,λ=1.541 78 Å,在室温下进行扫描,扫描范围10~80°,扫描速率为0.02°/s。
1.3.3 新生CaSO3的傅里叶变换红外光谱分析
采用KBr压片法,准确称取4 mg样品和0.2 g KBr粉末于研钵内研磨,充分混合后进行压片,测试分辨率4 cm-1,扫描64 次,测试范围400~4 000 cm-1。
1.3.4 新生CaSO3的SEM分析
采用SEM分析新生CaSO3的微观形貌,将样品撒在样品台上的双面胶上,用洗耳球从不同方向吹拂粉料,使新生CaSO3均匀地粘在双面胶上,测试电压为15 kV。
1.3.5 色值、吸附量的测定
依照国际机构糖品分析统一方法国际委员会的统一规定进行色值测定。即调节糖液pH值至7后,经0.45 µm的滤膜抽滤,收集滤液并测定其温度和在560 nm波长处的吸光度。按照公式(1)计算糖液色值,按照公式(2)、(3)计算吸附量。
式中:IU为色值;A为在560 nm波长处所测得的吸光度;b为比色皿的厚度/cm;ρ为样液溶质的质量浓度/(g/mL),ρ=折光锤度×视密度(折光锤度和视密度均通过查表得到)。

式中:q为糖汁从初始色值降为最终色值的CaSO3的吸附量/(mg/g);E为CaSO3吸附效率;IU前、IU后分别为清净前、后糖汁的色值;m为CaSO3的质量/g;N为吸附系数/mg,表示色值下降对应的1 g CaSO3的吸附量。
1.3.6 吸附等温线的研究
吸附等温线主要采用Langmuir方程(式(4))、Freundlich方程(式(5))以及Temkin方程(式(6)、(7))进行拟合。

式中:ρe为吸附平衡CaSO3的质量浓度/(mg/L);qe为CaSO3微粒的平衡吸附量/(mg/g);qm为CaSO3微粒的最大吸附量/(mg/g);KL和KF分别为Langmuir与Freundlich吸附系数/(J/mol);n为Freundlich模型的吸附常数,表吸附强度;B为Temkin模型的相关常数;R为理想气体常数,8.314×10-3J/(mol·K);T为温度/K;b为吸附热的相关常数;AT为Temkin模型的平衡常数。
Langmuir吸附等温线[9]是一种理想的吸附模型,假设固体表面是均匀的,吸附是单分子层吸附且被吸附分子之间没有相互作用,整个吸附是动态平衡的过程。Freundlich吸附等温线[10]是一个经验方程,假设吸附的表面是不均匀的且呈多分子层吸附,吸附热随着吸附程度的增加而大幅度下降。Temkin吸附等温线[11-12]是Langmuir吸附等温线的延伸,认为吸附的表面具有均匀的结合位点,意味着在没有结合吸附质时,所有的结合位都是等价的具有相同的结合能。由于吸附质与吸附剂之间存在相互作用,吸附热随着表面覆盖度的增大而线性下降。这种相互作用既包括直接偶极子之间的耦合(动态交互作用),也包括间接的静电相互作用(化学相互作用)。
1.3.7 吸附热力学的研究
在糖汁清净过程中CaSO3作为一种吸附剂,可能伴随着吸热或放热现象的发生,吸附过程中的标准热力学函数如吸附自由能(ΔG)、吸附焓变(ΔH)与吸附熵变(ΔS)可以通过公式(8)~(10)计算[13-14]。

式中:Kd为平衡常数;T为温度/K;R为理想气体常数。
1.3.8 吸附动力学的研究
利用吸附动力学模型进一步研究CaSO3吸附机理和潜在的速率控制步骤(如质量传递、扩散控制以及化学反应等)。吸附动力学模型常采用准一级动力学模型(式(11))和准二级动力学模型(式(12))进行拟合[15]。

式中:qt为t时CaSO3的吸附量/(mg/g);qe为CaSO3的平衡吸附量/(mg/g);k1为准一级动力学模型的速率常数/min-1;k2为准二级动力学模型的速率常数/(g/(mg·min))。
2.1 新生CaSO3的XRD晶体结构
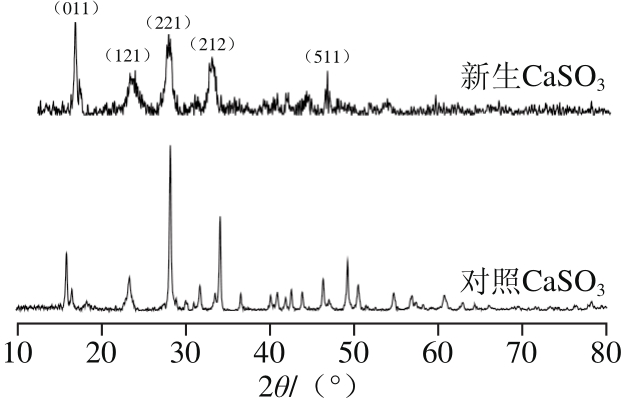
图1 CaSO3沉淀的XRD图谱
Fig. 1 XRD patterns of calcium sulphite particles
由CaSO3沉淀的XRD图谱(图1)可知,2θ分别为15°、28°、34°、49°对应的特征峰,无论位置还是衍射峰强度都与标准卡片上的亚硫石膏(39-0725)物相拟合,说明沉淀得到的是亚硫石膏物相(CaSO3)2·H2O,其中SO2含量为49.60%,CaO含量为43.42%,水的含量为6.98%[16]。新生CaSO3相比于对照CaSO3,对应(121)、(221)、(212)等主要晶面的半峰宽在逐渐变宽,且峰强度在逐渐下降,说明与对照CaSO3相比,新生CaSO3微粒结晶度降低,无定型程度上升,这是由于CaSO3微粒对非糖杂质的吸附包埋作用影响了新生CaSO3微粒的生长,从而使其变得更小且更加无序[17]。
2.2 新生CaSO3的傅里叶变换红外光谱特征
对新生CaSO3进行傅里叶变换红外光谱分析,得到0~4 500 cm-1范围内的谱图(图2),在1 640 cm-1和3 400 cm-1两处的吸收峰分别是由于水分子中的H—O—H的扭曲振动和伸缩振动所引起[18]。950~1 000 cm-1波段范围内的吸收带、492 cm-1和520 cm-1的特征峰证明了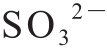 的存在[19]。其中1 100~1 170 cm-1波段范围内为
的存在[19]。其中1 100~1 170 cm-1波段范围内为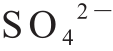 的特征吸收带,亚硫酸钙-硫酸钙((CaSO4)x·(CaSO3)1-x·0.5H2O)固溶物则可通过在1 215 cm-1处的唯一特征峰表征出来[20],这是由于CaSO3在生成的过程中容易被氧化,CaSO3晶格中的部分
的特征吸收带,亚硫酸钙-硫酸钙((CaSO4)x·(CaSO3)1-x·0.5H2O)固溶物则可通过在1 215 cm-1处的唯一特征峰表征出来[20],这是由于CaSO3在生成的过程中容易被氧化,CaSO3晶格中的部分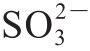 被
被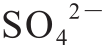 替代所导致,因此不可避免地出现此处的红外吸收峰[21]。其中2 850 cm-1和2 925 cm-1两处的吸收峰分别是C—H的对称伸缩振动和非对称伸缩振动引起的,这是CaSO3吸附了有机非糖分的作用结果[22]。新生CaSO3在1 107、1 138、1 215 cm-1处的特征峰的锋强度相比于对照CaSO3相同位置出现明显下降,说明CaSO3对糖汁非糖分的吸附和包埋作用减少了CaSO3向CaSO4的转化。
替代所导致,因此不可避免地出现此处的红外吸收峰[21]。其中2 850 cm-1和2 925 cm-1两处的吸收峰分别是C—H的对称伸缩振动和非对称伸缩振动引起的,这是CaSO3吸附了有机非糖分的作用结果[22]。新生CaSO3在1 107、1 138、1 215 cm-1处的特征峰的锋强度相比于对照CaSO3相同位置出现明显下降,说明CaSO3对糖汁非糖分的吸附和包埋作用减少了CaSO3向CaSO4的转化。
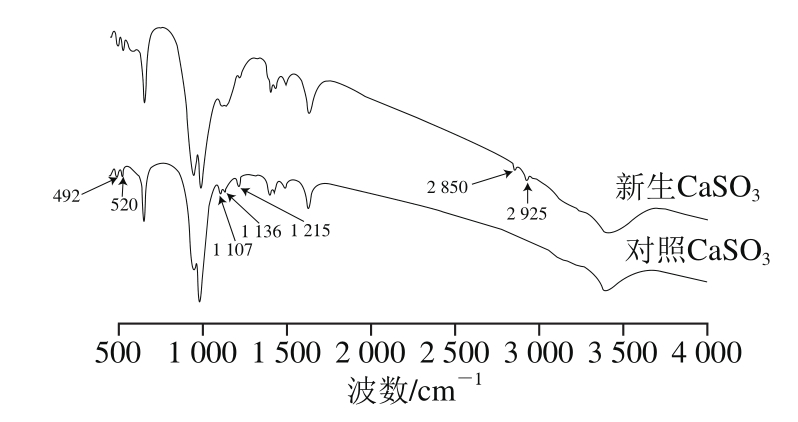
图2 CaSO3沉淀的傅里叶变换红外光谱图
Fig. 2 FT-IR spectra of calcium sulphite particles
2.3 新生CaSO3的SEM图像分析

图3 CaSO3微粒的SEM图
Fig. 3 SEM images of calcium sulphite particles
通过图3中SEM图的对比可以发现,与对照CaSO3相比,新生CaSO3的微观形貌发生了明显的变化,对照CaSO3的微观形貌为花瓣状(图3B、B1),颗粒的表面比较光滑;而新生CaSO3的微观形貌则表现为球形状的聚集体,颗粒表面呈现出粗糙多孔的结构(图3A、A1),这是由于新生CaSO3颗粒内部吸附和包裹了大量糖汁杂质。
2.4 CaSO3对糖汁非糖分的吸附等温线
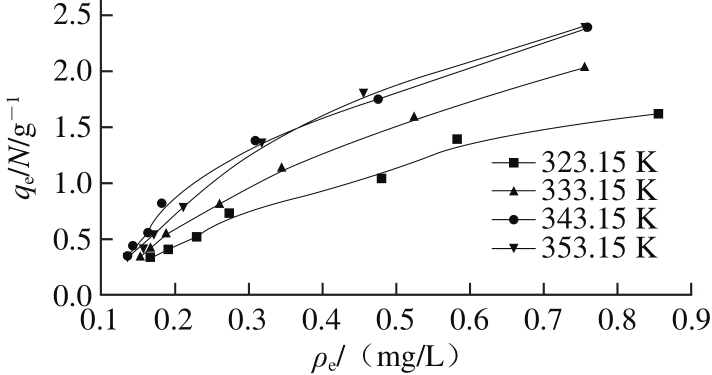
图 4 CaSO3对糖汁非糖分的Langmuir吸附等温线
Fig. 4 Adsorption isotherms of calcium sulphite for non-sucrose components
由图4可知,在CaSO3相同吸附平衡质量浓度下,CaSO3对糖汁非糖分的平衡吸附量随着温度的升高而逐渐增大,说明吸附过程主要以化学吸附为主。不同温度条件下的CaSO3的平衡吸附量均并未出现最大值,说明Langmuir吸附模型并不适用于该糖汁清净体系[23]。将吸附等温线数据采用Freundlich模型与Temkin模型进行拟合,其拟合结果见图5,各个温度下的拟合回归参数见表1。
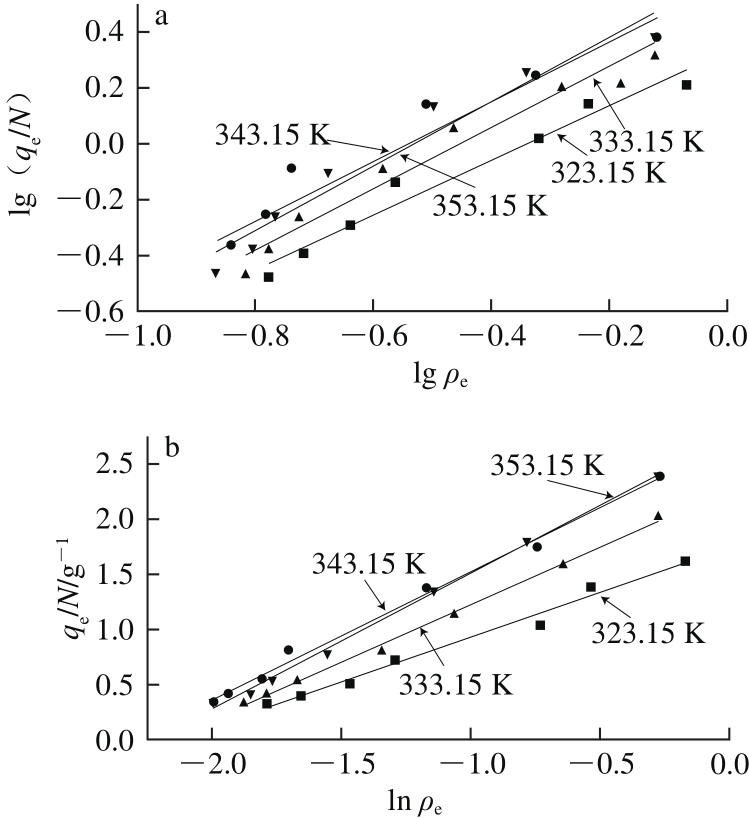
图5 CaSO3对糖汁非糖分的吸附等温线Freundlich模型拟合(a)和Temkin模型拟合(b)的结果
Fig. 5 Linear plots of Freundlich (a) and Temkin (b) equations for calcium sulphite adsorption of non-sucrose components
表1 Freundlich模型与Temkin模型的拟合回归参数
Table 1 Fitting parameters of Freundlich and Temkin isotherms

从数据拟合结果可以看出,Freundlich模型与Temkin模型在不同温度下的拟合相关系数R2均高于0.9,说明模型的拟合度都比较高,表明了吸附剂CaSO3与糖汁中的杂质微粒存在着直接或者间接的相互作用,并且随着温度的升高,其作用程度更加强烈。这是由于在CaSO3表面分布着大量的Ca2+,使其具有很强的吸附活性,能与糖汁中带负电的悬浮微粒相结合,而提高温度有助于增强这种相互结合的能力。但是相比于Freundlich模型,Temkin模型的拟合度更高(R2>0.98),因此采用Temkin模型能够更好地描述该吸附过程[24]。
2.5 CaSO3对糖汁非糖分的吸附热力学
根据Temkin方程拟合数据可得lnKd与1/T关系图(图6)(此处Kd为Temkin方程中的AT)。得方程y=-601.07x+3.99,根据此直线的斜率(k=-601.07),通过Van’t Hoff方程、Gibbs方程和Gibbs-Helmholtz方程[25]可计算出CaSO3吸附过程中的相关热力学参数(表2)。

图6 ln Kd与1/T的关系图
Fig. 6 Plot of ln Kdversus 1/T for calcium sulphite
表2 CaSO3对糖汁非糖分的吸附热力学参数
Table 2 Thermodynamic parameters for calcium sulphite adsorption of non-sucrose components

从表2数据可以看出,吸附自由能ΔG<0,说明CaSO3对糖汁非糖分的吸附过程是自发进行的,其数值随着温度的升高逐渐增大,ΔH(4.99 kJ/mol)>0,说明吸附过程表现出吸热和化学吸附的特点,在实验温度范围内,升高温度对吸附有利;ΔS>0,说明CaSO3吸附糖汁非糖分是熵推动的过程,即糖汁中悬浮的胶体微粒对CaSO3具有较高的亲和性,吸附过程在固液界面处充分进行[26]。
2.6 CaSO3对糖汁非糖分的吸附动力学
从图7的拟合结果可以发现,准二级动力学模型的拟合值(R2=0.980)高于准一级动力学模型的拟合值(R2=0.903),因此CaSO3对糖汁非糖分的吸附过程采用准二级动力学模型描述更好。这也进一步说明了吸附速率控制步骤主要由化学吸附过程所决定。
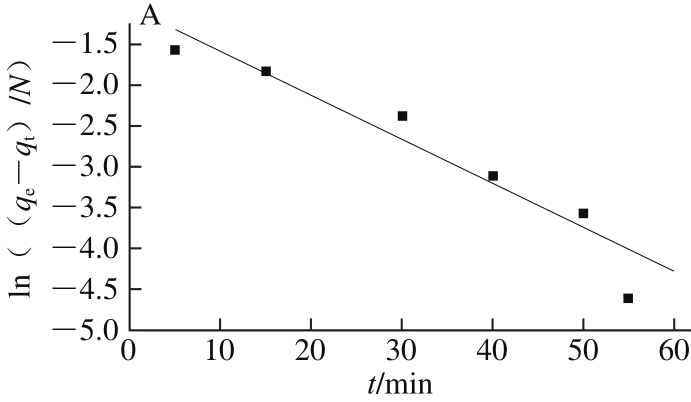
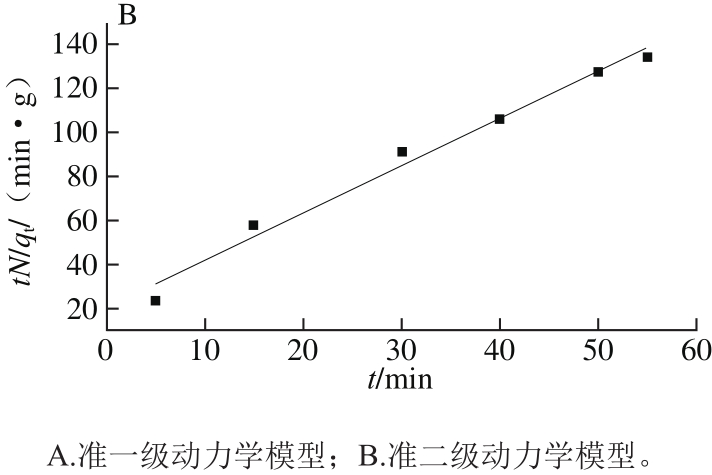
图7 CaSO3对糖汁非糖分的吸附动力学拟合结果
Fig. 7 Adsorption kinetic models for the removal of non-sucrose components by calcium sulphite
根据吸附动力学、热力学和等温线的结果可知,CaSO3对糖汁的清净过程主要以化学吸附为主,且随着温度的升高,吸附作用逐渐增强。CaSO3的整个吸附过程如图8所示。
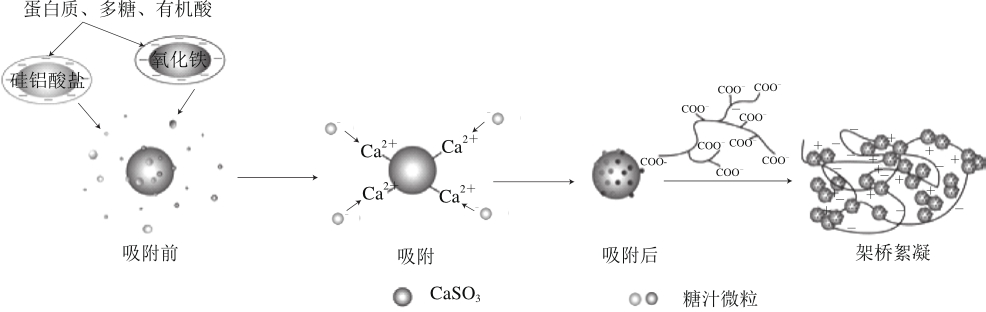
图8 CaSO3与糖汁微粒的相互作用示意图
Fig. 8 Schematic diagram of the interaction between calcium sulphite and sugar juice particles
据相关报道,糖汁中悬浮的胶体微粒主要是一些铁的氧化物和硅铝化合物,它们在吸附了蛋白质、多糖以及有机酸等物质后使其表面呈现出负电荷状态,由于糖汁中存在着不同且复杂的胶体体系,因此糖汁微粒没有固定的等电点[27-28]。CaSO3表面的Ca2+与糖汁微粒表面带负电的基团具有很强的亲和性,通过这种电中和作用,达到吸附的目的。同时由于胶体微粒的双电层被压缩,表面带电的蛋白质、多糖和有机酸等物质因变性而导致糖汁微粒十分不稳定,并使其倾向于和其他微粒聚集在一起形成大的絮体,具有更大的尺寸、分子质量和稳定结构,并同时将非糖杂质包埋在里面。最后在絮凝剂架桥作用下,大块絮凝物连接在一起,糖汁再经过其网捕、卷扫等作用后被澄清。亚硫酸法糖汁清净过程的机制也在很大程度上取决于絮凝剂的种类、用量以及糖汁微粒的表面物理化学性质[29-30]。
通过研究新生CaSO3的晶体结构以及对糖汁中非糖成分的吸附特性,探讨了亚硫酸法糖汁清净过程的机制。新生CaSO3微粒表面呈现出疏松多孔的结构;CaSO3吸附非糖组分的过程符合Temkin吸附等温线和准二级动力学模型;热力学参数表明吸附过程是吸热且自发进行的过程,进一步说明了CaSO3对糖汁非糖分的吸附主要以化学吸附为主;由于吸附和包埋的作用,CaSO3的结晶度下降并减少了向CaSO4的转化。
参考文献:
[1] THAI C C D, DOHERTY W O S. Characterisation of sugarcane juice particles that inf l uence the clarif i cation process[J]. International Sugar Journal, 2012, 114(1366): 719-724.
[2] YADAV R L, PRASAD S R, SINGH R, et al. Recycling sugarcane trash to conserve soil organic carbon for sustaining yields of successive ratoon crops in sugarcane[J]. Bioresource Technology, 1994, 49(3):231-235. DOI:10.1016/0960-8524(94)90045-0.
[3] GREGORY J. Monitoring particle aggregation processes[J]. Advances in Colloid & Interface Science, 2009, 147/148: 109-123. DOI:10.1016/j.cis.2008.09.003.
[4] DOHERTY W O S, EDYE L A. An overview on the chemistry of clarification of cane sugar juice[J]. Proceedings of the Australian Society of Sugar Cane Technologists, 1999, 21: 381-388.
[5] RAO P V K J, DAS M, DAS S K. Changes in physical and thermophysical properties of sugarcane, palmyra-palm and date-palm juices at dif f erent concentration of sugar[J]. Journal of Food Engineering, 2009,90(4): 559-566. DOI:10.1016/j.jfoodeng.2008.07.024.
[6] EGGLESTON G, MONGE A, OGIER B E. Sugarcane factory performance of cold, intermediate, and hot lime clarification processes[J]. Journal of Food Processing and Preservation, 2003,26(6): 433-454. DOI:10.1111/j.1745-4549.2003.tb00495.x.
[7] 黄永春, 鲁聿伦, 杨锋, 等. 超声强化亚硫酸钙法吸附糖汁中的非糖分[J]. 食品科学, 2010, 31(22): 81-85.
[8] THAI C C D, DOHERTY W O S, BRUCE R C. The composition of sugarcane juices derived from burnt cane and whole green cane crop[J]. Proceedings of the Australian Society of Sugar Cane Technologists, 2011, 33: 1-9.
[9] KHENNICHE L, BENISSAD-AISSANI F. Adsorptive removal of phenol by coffee residue activated carbon and commercial activated carbon: equilibrium, kinetics, and thermodynamics[J].Journal of Chemical & Engineering Data, 2010, 55(11): 4677-4686.DOI:10.1021/je100302e.
[10] EL-GOHARY F, TAWFIK A. Decolorization and COD reduction of disperse and reactive dyes wastewater using chemical-coagulation followed by sequential batch reactor (SBR) process[J]. Desalination,2009, 249(3): 1159-1164. DOI:10.1016/j.desal.2009.05.010.
[11] PURSELL C J, CHANDLER B D, MANZOLI M, et al. CO adsorption on supported gold nanoparticle catalysts: application of the temkin model[J]. Journal of Physical Chemistry C, 2012, 116(20): 11117-11125. DOI:10.1021/jp3022826.
[12] SAMADI N, HASANZADEH R, RASAD M. Adsorption isotherms,kinetic, and desorption studies on removal of toxic metal ions from aqueous solutions by polymeric adsorbent[J]. Journal of Applied Polymer Science, 2015, 132(11): 86-93. DOI:10.1002/app.41642.
[13] BUSHRA R, NAUSHAD M, ADNAN R, et al. Polyaniline supported nanocomposite cation exchanger: synthesis, characterization and applications for the efficient removal of Pb2+ion from aqueous medium[J]. Journal of Industrial and Engineering Chemistry, 2015,21(8): 1112-1118. DOI:10.1016/j.jiec.2014.05.022.
[14] DING L, DENG H, LU X, et al. Adsorptive removal of 2,4-dichlorophenoxyacetic acid (2,4-D) from aqueous solutions using MIEX resin[J]. Industrial and Engineering Chemistry Research, 2012,51(34): 11226-11235. DOI:10.1021/ie300469h.
[15] MING Z, LI H X, SANG S L, et al. Sorption of polycyclic aromatic hydrocarbons (PAHs) by dietary fiber extracted from wheat bran[J].Chemical Speciation & Bioavailability, 2016, 28(1/2/3/4): 13-17. DOI:10.1080/09542299.2015.1136569.
[16] GLEASON C L, ROCHELLE G T. Nucleation and crystal growth of calcium sulf i te hemihydrate[J]. Environmental Progress, 1991, 10(3):225-233. DOI:10.1002/ep.670100324.
[17] BAKIR H, ZHANG Z Y, ZBIK M S, et al. Understanding fl occulation properties of soil impurities present in the factory sugarcane supply[J].Journal of Food Engineering, 2016, 189: 55-63. DOI:10.1016/j.jfoodeng.2016.05.025.
[18] PODSTAWKA E, OZAKI Y, PRONIEWICZ L M. Part Ⅰ: surfaceenhanced Raman spectroscopy investigation of amino acids and their homodipeptides adsorbed on colloidal silver[J]. Applied Spectroscopy,2004, 58(5): 570-580. DOI:10.1366/000370204774103408.
[19] FROST R L, KEEFFE E C. Raman spectroscopic study of the sulf i tebearing minerals scotlandite, hannebachite and orschallite: implications for the desulfation of soils[J]. Journal of Raman Spectroscopy, 2009,40(3): 244-248. DOI:10.1002/jrs.2089.
[20] GADALLA A M, GUPTA A. Characterization of the product of the thiosulfate process for desulfurization of flue gases[J]. Industrial& Engineering Chemistry Research, 1994, 33(5): 1145-1149.DOI:10.1021/ie00029a011.
[21] GUAN B H, FU H L, YU J, et al. Direct transformation of calcium sulf i te to α-calcium sulfate hemihydrate in a concentrated Ca-Mg-Mn chloride solution under atmospheric pressure[J]. Fuel, 2011, 90(1):36-41. DOI:10.1016/j.fuel.2010.08.020.
[22] THAI C C D, MOGHADDAM L, DOHERTY W O S. The inf l uence of non-sucrose impurities on calcium phosphate fl oc structure and size in sugar solutions[J]. Journal of Food Engineering, 2016, 181: 20-27.DOI:10.1016/j.jfoodeng.2016.02.019.
[23] GHOSAL P S, GUPTA A K. Development of a generalized adsorption isotherm model at solid-liquid interface: a novel approach[J].Journal of Molecular Liquids, 2017, 240: 21-24. DOI:10.1016/j.molliq.2017.05.042.
[24] PURSELL C J, HARTSHORN H, WARD T, et al. Application of the Temkin model to the adsorption of CO on gold[J]. Journal of Physical Chemistry C, 2011, 115(48): 23880-23892. DOI:10.1021/jp207103z.
[25] KWIATKOWSKI M. Numerical analysis of nitrogen adsorption isotherms on active carbons by an employment of the new LBET class models[J]. Journal of Colloid & Interface Science, 2007, 313(2):428-439. DOI:10.1016/j.jcis.2007.04.073.
[26] SUTEU D, BILIUTA G, RUSU L, et al. Cellulose cellets as new type of adsorbent for the removal of dyes from aqueous media[J]. Environmental Engineering & Management Journal, 2015, 5(3): 525-535.
[27] THAI C C, BAKIR H, DOHERTY W O. Insights to the clarif i cation of sugar cane juice expressed from sugar cane stalk and trash[J].Journal of Agricultural & Food Chemistry, 2012, 60(11): 2916-2923.DOI:10.1021/jf204998b.
[28] PRATI P, MORETTI R H. Study of clarif i cation process of sugar cane juice for consumption[J]. Ciência e Tecnologia de Alimentos, 2010,30(3): 776-783. DOI:10.1590/S0101-20612010000300033.
[29] FELLOWS C M, DOHERTY W O S. Insights into bridging flocculation[J]. Macromolecular Symposia, 2005, 231(1): 1-10.DOI:10.1002/masy.200590012.
[30] HENDERSON R, SHARP E, JARVIS P, et al. Identifying the linkage between particle characteristics and understanding coagulation performance[J]. Water Science & Technology Water Supply, 2006,6(1): 31-38.
Mechanism of Action of Newly Generated Calcium Sulphite in Sugar Cane Juice Clarif i cation
XIANG Fuyou1,2, LI Lijun1,2,*, CHENG Hao1,2
(1. College of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China;2. Guangxi Key Laboratory of Green Processing of Sugar Resources, Liuzhou 545006, China)
Abstract:In this study, we investigated the mechanism of action of calcium sulphite in the clarif i cation of sugar cane juice on the basis of the morphology and structure of calcium sulphite particles. The results revealed that the surface of calcium sulphite particles showed a porous and loose structure, leading to better removal of colloidal particles suspended in sugar cane juice. The kinetic data were described better by the pseudo-second-order kinetic model. The adsorption isotherm was fi tted with the Temkin model and thermodynamic parameters suggested that the adsorption process was a spontaneous and endothermic process. Furthermore, the calcium sulphite particles were thoroughly characterized by X-ray diffraction and Fourier transform infrared spectroscopy in order to further understand the mechanism of calcium sulphite adsorption and trapping in sugar juice clarif i cation.
Key words:calcium sulphite; sugar juice clarif i cation; morphology and structure; mechanism
DOI:10.7506/spkx1002-6630-201723007
中图分类号:TS244+.2
文献标志码:A
文章编号:1002-6630(2017)23-0039-06
引文格式:
向富友, 李利军, 程昊. 新生亚硫酸钙在糖汁清净过程中的机理[J]. 食品科学, 2017, 38(23): 39-44.
DOI:10.7506/spkx1002-6630-201723007. http://www.spkx.net.cn
XIANG Fuyou, LI Lijun, CHENG Hao. Mechanism of action of newly generated calcium sulphite in sugar cane juice clarification[J]. Food Science, 2017, 38(23): 39-44. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723007. http://www.spkx.net.cn
收稿日期:2016-09-25
基金项目:国家自然科学基金地区科学基金项目(31560466);
广西高等学校高水平创新团队及卓越学者计划资助项目(桂教人[2014]7号)
作者简介:向富友(1992—),男,硕士研究生,研究方向为化学工程与技术。E-mail:xiangfuyou1992@126.com
*通信作者:李利军(1966—),男,教授,博士,研究方向为生化过程检测与控制以及应用化学。E-mail:lilijun0562@sina.com