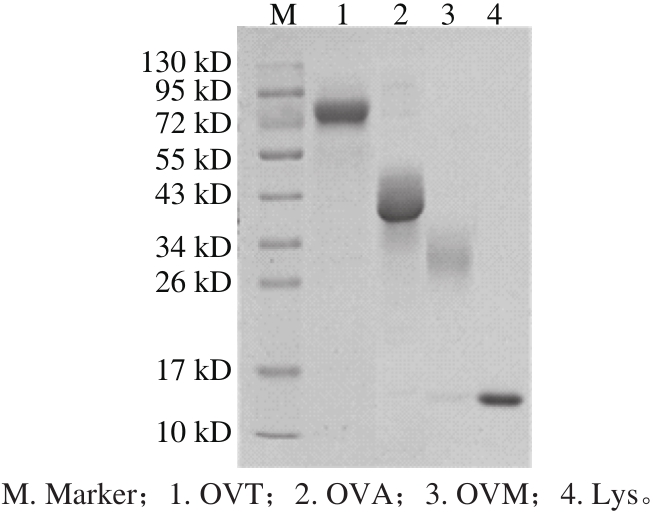
图1 鸡蛋主要过敏原的SDS-PAGE图
Fig. 1 SDS-PAGE patterns of major egg white allergens
刘 珂1,2,熊丽姬1,2,高金燕2,陈红兵1,3,佟 平1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
摘 要:为探究热加工对鸡蛋主要过敏原结构的影响,对鸡蛋清中的4 种过敏原进行不同条件的热加工,并利用圆二色光谱、紫外-可见光光谱、外源荧光光谱对加热前后过敏原的空间结构进行表征。结果表明,卵转铁蛋白对热不稳定,随加热时间的延长和温度的升高,分子结构逐渐展开,芳香族残基和疏水基团暴露于分子表面;轻微加热使卵白蛋白分子的二级结构更加有序,吸光度减小,表面疏水性增大,随着加热程度的增大,其二级结构变得无序,分子发生聚集;加热后卵类黏蛋白的二级结构较为稳定,轻微加热其分子展开,吸光度和荧光强度增大,继续加热使蛋白分子部分聚集;热处理使溶菌酶分子的有序性下降,芳香族残基和疏水基团逐渐暴露,但随着加热程度的增加,蛋白分子发生部分聚集。本实验结果为后续研究加热对鸡蛋过敏原致敏性的影响提供理论依据。
关键词:热加工;鸡蛋过敏原;光谱分析;结构
鸡蛋富含优质蛋白、碳水化合物、脂肪及微量元素[1],营养价值丰富,且价格相对低廉,适用人群广泛,颇受人们喜爱。但是,鸡蛋过敏也是常见于婴幼儿和儿童的食物过敏反应[2]。鸡蛋蛋清中的主要过敏原有4 种[3],分别是卵类黏蛋白(ovomucoid,OVM)、卵白蛋白(ovalbumin,OVA)、卵转铁蛋白(ovotransferrin,OVT)和溶菌酶(lysozyme,Lys)。过敏原的致敏性与结构密切相关,加热作为一种最常见的加工方式,能够改变过敏原蛋白的结构,暴露或隐藏过敏原蛋白的表位,从而使其致敏性发生变化[4-6]。因此,对过敏原结构的研究显得十分必要。
目前常采用光谱分析技术对蛋白质的空间结构进行表征,常用的包括圆二色光谱(circular dichroism,CD)、荧光光谱和紫外-可见光(ultraviolet-visible,UVVis)光谱等[7]。其中,CD是样品在左右偏振光的照射下产生的吸收光谱,在测定蛋白质二级结构的应用中越来越广泛[8]。UV-Vis光谱及荧光光谱主要表征蛋白质的三级结构,UV-Vis光谱可考察蛋白质展开的变化,而荧光光谱可表征蛋白质分子表面疏水性的变化。本研究采用离子层析方法对OVT、OVA和Lys进行分离纯化,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对分离得到的3 种过敏原以及购买的OVM的纯度和性质进行鉴定,采用不同的加热条件对鸡蛋4 种主要过敏原进行加热处理,并通过CD、UV-Vis光谱、荧光光谱来表征热加工对鸡蛋过敏原结构的影响。
1.1 材料与试剂
白壳鸡蛋 市售。
OVM(纯度大于90%) 美国Sigma公司;预染Marker 德国Fermentas公司;牛血清白蛋白标准品 生工生物工程(上海)股份有限公司;其他常规试剂均为分析纯。
1.2 仪器与设备
迷你型蛋白垂直电泳仪、GS-800光密度扫描仪、Model680酶标仪 美国Bio-Rad公司;96孔可拆酶标板丹麦NUNC公司;恒温水浴锅 德国Kottermann公司;J-810 CD仪 日本分光公司;TU-1901 UV-Vis分光光度计 北京普析通用仪器有限公司;F-4500荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 鸡蛋主要过敏原的分离纯化
参照周煌[9]的方法,采用CM Sepharose Fast Flow阳离子交换柱初步分离OVT、OVA和Lys,然后用羟基磷灰石柱层析进一步纯化。1.3.2 鸡蛋主要过敏原的纯度分析
收集分离所得3 种过敏原,采用不连续SDS-PAGE对分离所得3 种过敏原及OVM进行分析,将10 μL样品与10 μL上样缓冲液混合后,取15 μL上样,采用质量分数为12%的分离胶和质量分数为5%的浓缩胶,电流设置为6 mA、30 min和12 mA、90 min。电泳后,凝胶经考马斯亮蓝显色,脱色后在GS-800光密度扫描仪上对凝胶进行分析。
1.3.3 鸡蛋主要过敏原的质量浓度的测定
采用考马斯亮蓝法测定鸡蛋中4 种主要过敏原的质量浓度。将牛血清白蛋白作为标准蛋白,制作标准曲线,获得方程y=0.002x-0.002(R2=0.997),在0~500 μg/mL范围内具有良好的线性关系。根据该方程计算4 种主要过敏原质量浓度,以备后续热处理和结构测定质量浓度的选择。
1.3.4 鸡蛋主要过敏原的热加工处理
将鸡蛋4 种主要过敏原OVT、OVA、OVM和Lys溶液稀释至0.5 mg/mL,分别置于100 ℃水浴中恒温加热10、15、20、25 min,80、90 ℃水浴恒温加热25 min,加热完成后置于冰水中冷却,备用。1.3.5 鸡蛋主要过敏原的CD分析
采用CD分析热处理前后4 种主要过敏原的二级结构变化。将OVT溶液稀释至0.25 mg/mL,OVA、OVM和Lys稀释至0.5 mg/mL。远紫外波长扫描范围设定为190~240 nm,扫描速率为100 nm/min,光径为0.1 cm,间隔0.1 nm,带宽0.1 nm,平行测样3 次。通过在线CD分析网站(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)对数据进行分析,结果以平均摩尔椭圆率θ表示,单位为deg·cm2/dmol。
1.3.6 鸡蛋主要过敏原的UV光谱分析
采用UV光度计检测加热处理前后4 种主要过敏原展开情况的变化。将样品蛋白溶液稀释成为0.1 mg/mL,波长扫描范围为250~350 nm,波长间隔为1.0 nm,扫描速率中等,带宽为2.0 nm,响应时间为0.2 s。
1.3.7 鸡蛋主要过敏原的外源性荧光光谱分析
采用以8-苯氨基-1-萘磺酸(8-a n i l i n o-1-naphthalenesulfonate,ANS)为荧光探针的荧光光谱,分析热处理前后4 种主要过敏原表面疏水性变化。样品蛋白溶液用磷酸盐缓冲液(0.02 mmol/L,pH 7.4)稀释成0.1 mg/mL,以超纯水作为空白。在4 mL稀释好的样品中,加入20 μL 5 μmol/L ANS混匀,室温避光反应2 h。荧光色谱测量条件为:激发波长390 nm,发射波长范围400~650 nm,狭缝宽度为5.0 nm,光径1 cm,扫描速率为1 200 nm/min。
1.4 数据分析
采用Origin Pro 8软件对CD、UV-Vis、荧光3 种光谱结果进行作图;并采用IBM SPSS Statistics 22.0软件的单因素方差分析法对二级结构含量、UV-Vis及荧光特征吸收峰的最大吸光度的数据进行显著性分析。
2.1 鸡蛋主要过敏原分离纯化与鉴定

图1 鸡蛋主要过敏原的SDS-PAGE图
Fig. 1 SDS-PAGE patterns of major egg white allergens
利用SDS-PAGE对实验室分离纯化的OVT、OVA和Lys以及购买的OVM的纯度及分子质量进行分析,如图1所示,OVT分子质量约为76 kD,OVA分子质量约为43 kD,OVM分子质量约为28 kD,Lys分子质量约为14.3 kD。经Quantity One软件对电泳图进行分析,OVT、OVA、OVM和Lys的纯度均达到98%以上。
2.2 鸡蛋主要过敏原热加工后的二级结构变化
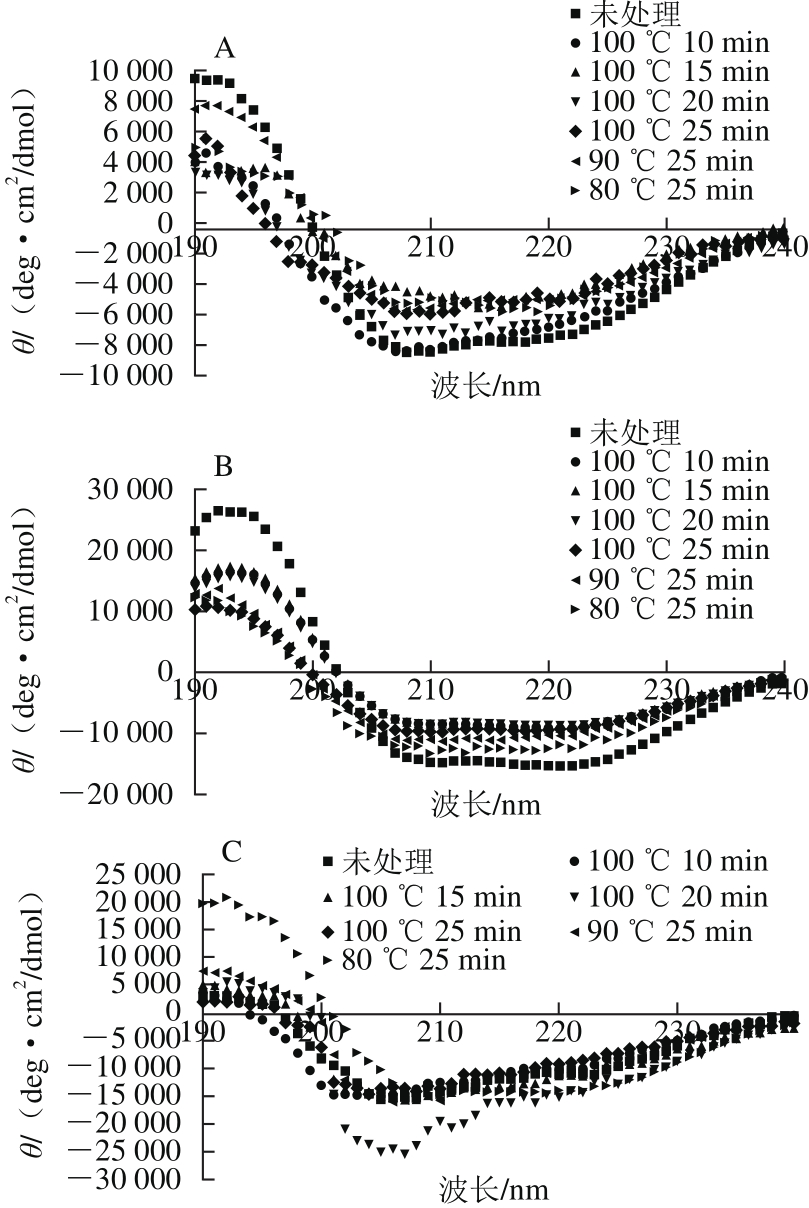

图2 不同加热条件处理前后4 种鸡蛋过敏原CD图
Fig. 2 Effect of heat treatment under different conditions on secondary structure of four egg white allergens measured by CD spectroscopy
表1 不同加热条件处理前后4 种鸡蛋过敏原二级结构的含量
Table 1 Secondary structure contents of four white allergens subjected to different heating conditions%
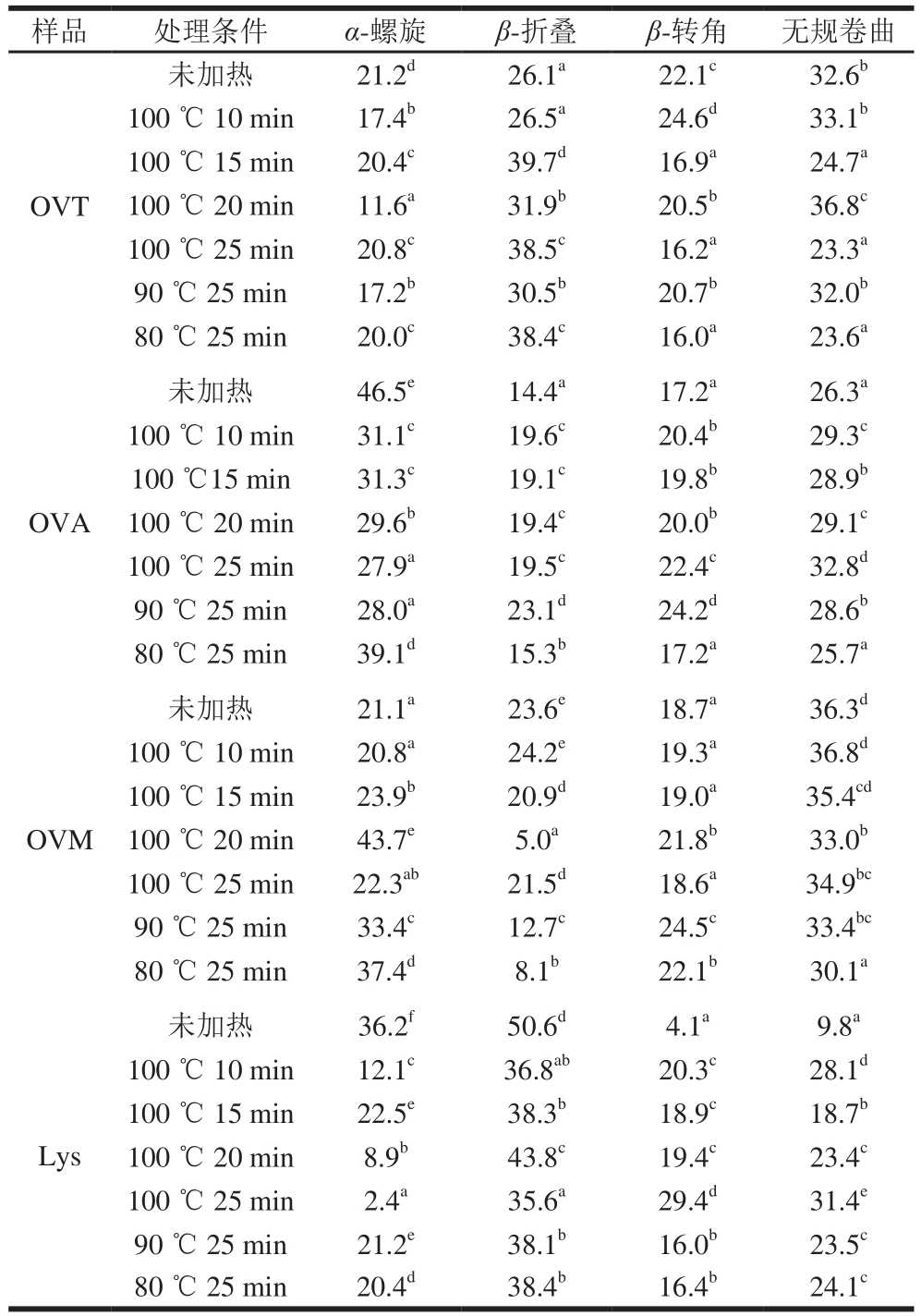
注:同种蛋白同列肩标小写字母不同表示差异显著(p<0.05)。
由图2A可知,未加热处理的OVT的光谱曲线,在192 nm处有一个正峰,208 nm和222 nm处呈负峰,这表明具有典型的α-螺旋结构;同时在195 nm有一个正峰,215 nm处有一个负峰,这是β-折叠的典型结构,说明未加热OVT具有α-螺旋和β-折叠结构。加热处理后,在208 nm和222 nm处的负峰峰值降低,在192 nm和195 nm处的正峰峰值也降低,且曲线波动较大。而从表1中明显可知,与未处理的OVT相比,不同加热温度下的α-螺旋和β-转角含量之间均存在显著性差异(p<0.05),加热破坏了OVT的二级结构[10]。加热后α-螺旋含量降低,β-折叠含量增加,β-转角和无规卷曲发生不同程度的变化,进一步证实了OVT受热不稳定[11]。
OVA热处理前后二级结构的变化,如图2B所示。从未处理OVA的CD图中可看出,OVA具有典型α-螺旋和β-折叠结构。表1显示,与未加热蛋白相比,100 ℃下加热不同时间,α-螺旋向其他二级结构形式转化;随时间的延长α-螺旋含量逐渐下降,但β-折叠的含量并无显著差异(P>0.05),25 min时无规卷曲含量最多,说明此条件下蛋白质分子最为无序。在80 ℃下加热25 min,与未加热OVA相比,无规卷曲含量略有下降,分子的有序性增加,这可能是因为热处理使天然OVA向更为稳定的S型转化[12],使结构变的更加稳定和有序;但随着加热温度的升高,达到并超过S-OVA的变性温度86 ℃,分子逐渐由有序变得无序。
OVM热处理前后二级结构的变化如图2C所示。从表1中可知,80 ℃加热25 min、100 ℃加热20 min的二级结构含量与未加热的差别较大,但当条件达到100 ℃加热25 min时,结构含量又与未加工OVM相似,说明加热对OVM二级结构的改变是可逆的,OVM耐热性较强。
从图2D中可明显看出未加热Lys存在典型的α-螺旋和β-折叠结构,说明Lys为α+β型蛋白质。表1显示,与未加热Lys相比,加热均会使其二级结构发生显著变化(p<0.05),α-螺旋和β-折叠含量降低,β-转角和无规卷曲含量升高。在100 ℃下,随着加热时间的延长,α-螺旋和β-折叠比例先升高后降低,β-转角和无规卷曲先降低后升高;而在相同加热时间下,除了α-螺旋的含量外,80、90 ℃的处理并没有造成其他二级结构含量有显著差异(p<0.05)。加热能不同程度地改变Lys的二级结构,其中100 ℃加热25 min时变化最大,无规卷曲含量最高,二级结构遭到破坏的程度最大。
2.3 鸡蛋主要过敏原热加工后的三级结构变化

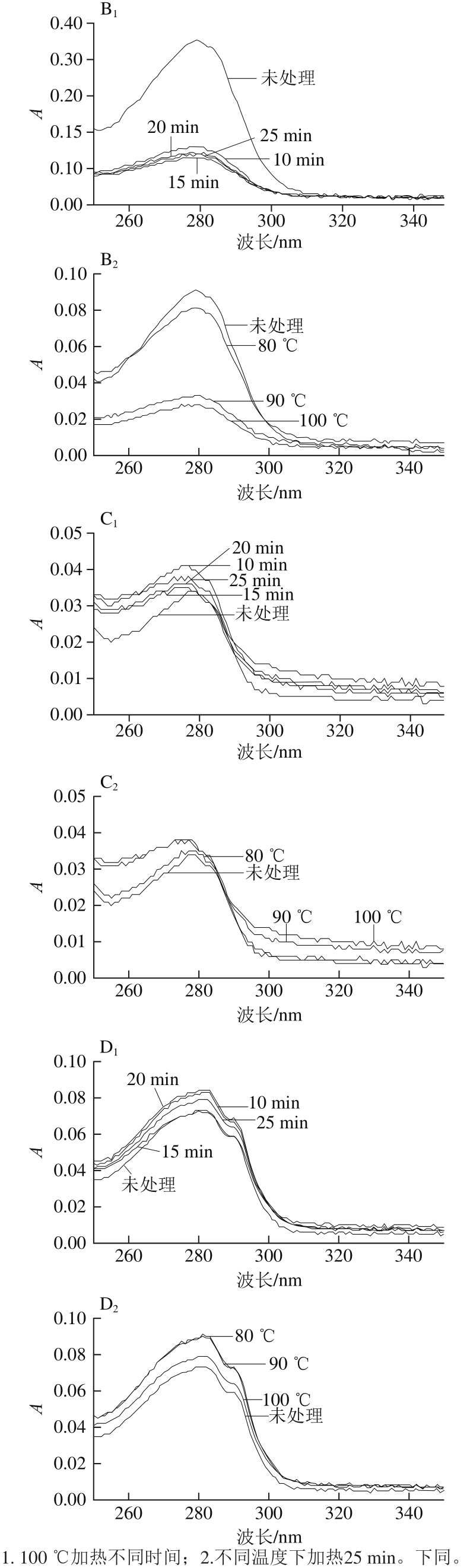
图3 不同加热条件下4 种鸡蛋过敏原的UV-Vis光谱图
Fig. 3 UV-Vis spectra of four egg white allergens subjected to different heating conditions
从图3A中可看出,未加热OVT的UV-Vis光谱在280 nm左右有特征吸收峰,主要是由其肽链上色氨酸(tryptophan,Trp)和酪氨酸(tyrosine,Tyr)残基的芳杂环π→π*跃迁引起的[13]。随着加热时间的延长和加热温度的升高,OVT的UV最大吸收峰的吸光度逐渐升高,OVT分子逐渐展开,使得Trp和Tyr残基暴露在蛋白质分子表面。但值得注意的是,加热15 min和20 min的结果基本无差别,表明当OVT结构展开到一定程度后,从15 min到20 min的时间间隔并不影响其展开,当继续加热至25 min时,结构进一步展开。因此,OVT结构的展开程度与加热程度有关。
从图3B中可看出,OVA的UV-Vis光谱图在280 nm处有特征吸收峰,与未加热样品相比,加热后最大吸收峰的吸光度降低。在100 ℃下,随时间的延长,最大吸收峰的吸光度先降低,超过15 min后又略微升高,但变化幅度并不大。加热时间相同,UV最大吸收峰的吸光度随温度的升高而呈现极显著性降低(p<0.01),80 ℃时天然构象逐渐转变为S-构象,因为有序的二级结构增多,具有UV吸收的芳香族氨基酸残基部分由分子表面被包埋至分子内部;而随着温度升高到90 ℃甚至100 ℃,S-OVA变性,蛋白质分子发生聚集,可能掩盖了部分暴露于分子表面的Trp和Tyr残基,使得吸光度大幅度降低。
OVM的UV-Vis光谱如图3C所示,在280 nm处出现特征吸收峰。加热后的样品在280 nm波长处特征峰的吸光度均增加,但持续加热后,吸光度略升高后又有所降低,说明加热使分子展开,后又发生部分聚集;同样加热25 min,90 ℃和100 ℃的条件对样品没有显著差异(P>0.05),但比80 ℃更能引起三级结构的变化,使芳香族残基暴露于分子表面。
从图3D中可看出,在280 nm处出现特征吸收峰。加热后Lys的最大吸收峰的吸光度比未加热的大,表明加热会使其结构展开。但是100 ℃加热15 min其吸光度与未加热基本相同,而继续加热至20 min,吸光度又升高,然后25 min后又略降低;80 ℃和90 ℃加热25 min后样品的吸光度都升高,且几乎完全重合,而当升高到100 ℃时,吸光度下降,表明加热使其结构展开,后又发生部分聚集,造成Trp和Tyr残基的部分包埋。
2.4 鸡蛋主要过敏原热加工后的疏水性变化
疏水基团的相互作用是维持蛋白质三级结构最重要的作用力之一,ANS作为一种有效的荧光探针,通过非共价结合到蛋白质分子的非极性区域中,这时荧光光谱会随着所处环境非极性的增加而发生蓝移,且荧光强度也会随之提高[14]。利用ANS这个性质,可以衡量与ANS结合的蛋白质部位的极性变化,ANS与蛋白质结合的荧光强度与蛋白的表面疏水性呈正相关[15],本研究利用ANS荧光探针检测OVT、OVA、OVM、Lys加热处理前后蛋白表面疏水性的差异。

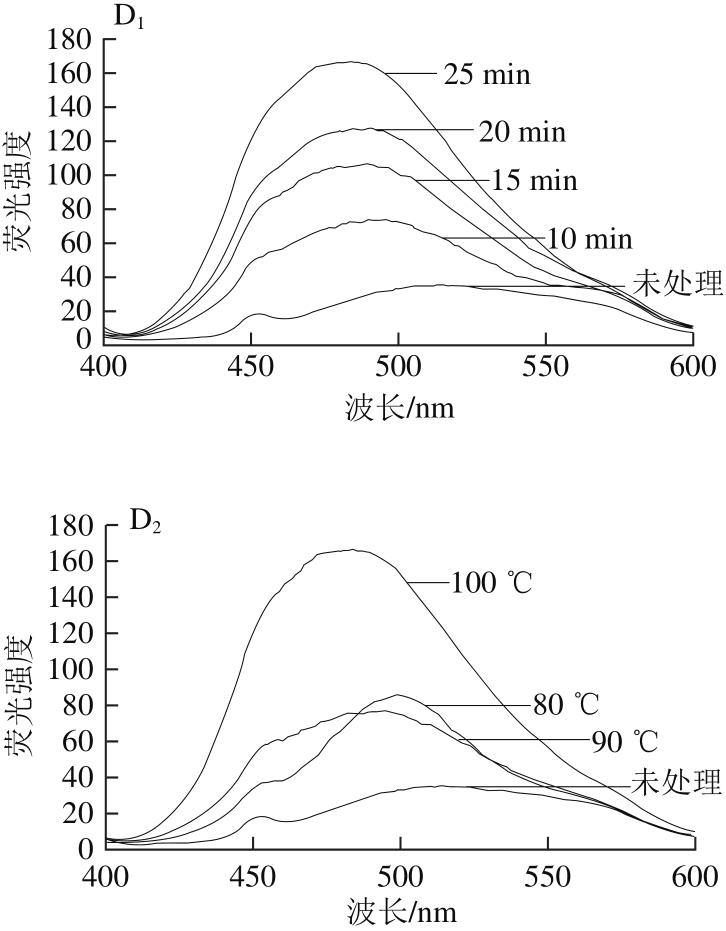
图 4 不同加热条件下4 种鸡蛋过敏原的外源性荧光光谱图
Fig. 4 Extrinsic fl uorescent spectra of four egg white allergens subjected to different heating conditions
如图4A所示,与未加热相比,加热后OVT的荧光强度极显著增加(p<0.01),且随着加热温度的升高和加热时间的延长,荧光强度逐渐增加,但100 ℃加热15 min和20 min的光谱曲线几乎重合,并没有明显变化(P>0.05),这与UV-Vis光谱趋势一致。加热处理后样品的最大荧光强度峰值所对应的波长(λmax)发生了不同程度的蓝移,这表明溶液中OVT周围微环境的极性发生了变化。加热可能破坏了OVT的三级结构,随加热程度的增加,蛋白分子由折叠逐渐展开,暴露出原本包埋在分子内部的疏水基团,表现为荧光强度的增强。
图4B中,与未加工OVA相比,加热后的荧光强度极显著增加(p<0.01),λmax发生了不同程度的蓝移。随时间的增加,荧光强度的变化无明显规律。相同加热时间下,80 ℃比90 ℃和100 ℃所引起荧光强度变化更大,这可能是因为加热使得分子内部振动增强,维系蛋白空间结构的次级键遭到破坏,导致分子内部的疏水基团暴露;而更高的加热温度使分子发生聚集,有可能包埋了一部分疏水基团,使得荧光强度比80 ℃时降低。
OVM加热前后的外源性荧光光谱图如图4C所示,与未加热样品相比,加热后的OVM的荧光强度增加,这表明加热使蛋白分子展开,暴露出分子内部的疏水基团。100 ℃下,加热10 min时荧光强度变化最大,而随着时间的延长,荧光强度又有所降低,但15 min与25 min热处理后蛋白的光谱图并无明显差别(P>0.05),且与天然OVM相近;同样地,80 ℃加热后荧光强度变化最大,随着温度的升高,荧光强度又有所降低,且90 ℃和100 ℃所引起的图谱变化并无显著区别(P>0.05),这表明热处理达到一定的强度时,蛋白分子可能发生聚集,暴露出的部分疏水基团被掩埋。
从溶菌酶加热前后的外源性荧光光谱图(图4D)中可看出,加热后样品的荧光强度增加,且λmax发生了不同程度的蓝移,这表明加热使溶菌酶的三级结构发生变化,分子变得松散,内部的疏水基团暴露。一般情况下,随着温度的升高和加热时间的延长,Lys的荧光强度增强,表面疏水性越大。
3.1 热加工对OVT结构的影响
Tong Ping等[10]研究加热对OVT的结构及致敏性的影响,发现加热温度高于80 ℃时,其致敏性显著降低,二级结构被破坏,且UV吸光度和外源性荧光强度随着加热处理的温度或者处理时间而增加,二硫键断裂和重排。本研究通过3 种光谱学技术对OVT加热前后的结构变化进行表征,发现蛋白质加热前后在空间结构上存在较大差异,与Tong Ping等[10]研究结果基本一致。OVT具有典型的α-螺旋结构和β-折叠结构,且不耐受高温,加热能破坏其二级结构,结构由有序变为无序;且随着加热时间的延长和温度的升高,其三级结构展开,结构变得松散,暴露出生色基团[16],表面疏水性增大。
3.2 热加工对OVA结构的影响
OVA是一种热不稳定性蛋白[17-18],热加工过程中,其空间结构发生了不同程度的变化。Kato等[19]在早年的研究中表明蛋清热处理会造成OVA结构的改变,使OVA分子内α-螺旋和β-转角向β-折叠转化,分子间β-折叠结构的交联使分子结构展开,暴露出疏水基团,进而产生聚合物。本研究表明,OVA经热加工后,α-螺旋含量显著降低(p<0.05),β-折叠及β-转角含量均有所增加,与Kato等[19]研究的二级结构变化有所不同,很可能是因为全蛋清中的其他蛋白成分会对OVA结构的变化造成影响;另外,轻微加热使OVA分子展开,分子表面的芳香氨基酸残基被包埋,使吸光度减小,而分子内部的疏水基团暴露出来,表面疏水性增强;加热程度的增加又使分子发生聚集,表面疏水性降低。相同加热时间下,80 ℃时无规卷曲含量有所降低,为结构变化界限的温度,可能与OVA分子由天然构象向更加稳定的S型转化有关。张银等[20]也表明,加热时OVA分子的展开一方面暴露出疏水残基而趋于聚合,一方面掩藏在分子内部的表位暴露出来,二者的相互作用使抗原性随加热的温度和时间不断变化;而当加热温度超过80 ℃以上,OVA分子充分伸展,暴露的巯基基团使分子间形成二硫键,促进蛋白质分子间相互作用而产生大量聚合物,表面疏水性的降低,这一点与本研究结果一致,同时其抗原性也大幅度降低。Golias等[21]也已证实加热引起OVA的二级结构变化,能够改变其消化性和抗原表位的构象,最终导致其致敏性的降低。
3.3 热加工对OVM结构的影响
OVM具有3 个由二硫键连接的稳定的结构域[22],使它对热处理及胰蛋白酶酶解都相当稳定[23],而且去除OVM的蛋清致敏性比全蛋清低[24],所以OVM是蛋清中致敏性最强的蛋白质[25]。在本研究设置的热加工过程中,OVM二级结构较为稳定,且二级结构含量的变化存在可逆性。与未加工OVM相比,轻微加热使蛋白分子展开,芳香族氨基酸残基暴露于分子表面;但持续加热后,吸光度又略有降低,且疏水基团暴露,荧光强度增强,后随加热强度的增加又有降低的趋势,有可能加热程度的增加使分子部分聚集。史晓霞[26]研究发现,OVM经热处理后,其过敏原性逐渐降低,且加热影响OVM分子内部的电荷分布及氨基酸残基结合的牢固程度,致使其二级结构相互转化,分子有序性降低,具有UV吸收的氨基酸残基暴露于分子表面,表面疏水性随加热温度的升高而降低。此结果与本研究略有不同,可能是因为提取OVM所用方法不同,导致加热对蛋白结构的影响不同。此外,Rupa等[27]研究表明加热导致的OVM构象的变化也会影响CD4+细胞的分化激活和细胞因子的释放,使其致敏性降低。
3.4 热加工对Lys结构的影响
鸡蛋Lys是一种对热不稳定的球状蛋白[28-29],Sassi等[30]研究表明,Lys在22~92 ℃范围内会因分子间相互作用而使其二级结构局部或全部重排。本研究发现,加热处理使Lys的α-螺旋和β-折叠结构含量降低,β-转角和无规卷曲含量增加,Lys有序结构变为无序。随着加热时间的延长和温度的升高,蛋白质疏水基团暴露,表面疏水性逐渐增大;而吸光度先升高后降低,则可能是深程度的热处理使分子结构重排,部分蛋白聚集,掩埋了部分芳香族氨基酸。
经加热处理后,鸡蛋中4 种主要过敏原的结构发生不同程度的变化。热处理使OVT的二级结构遭到破坏;随时间的延长和温度的升高,OVT分子逐渐展开,芳香族残基和疏水基团暴露于分子表面。轻微加热时,OVA分子转化为更为稳定的S-OVA,二级结构更加有序,芳香族残基被包埋至分子内部,表面疏水性增大;随着加热程度的增大,OVA二级结构由有序到无序,分子发生聚集,芳香族残基和疏水性基团被掩埋。OVM的二级结构对热较为稳定;轻微加热其分子展开,吸光度和荧光强度增大,继续加热使蛋白分子部分聚集,包埋了部分芳香族氨基酸残基和疏水基团。Lys为球状蛋白,热处理使其球状链结构展开,有序性下降,芳香族残基和疏水基团逐渐暴露,但随着热处理时间的延长和温度的升高,蛋白分子发生部分聚集。综上所述,本实验结果可为后续研究加热对鸡蛋过敏原致敏性的影响提供理论依据。
参考文献:
[1] 关蕴良, 杜剑云. 试论鸡蛋的营养价值[J]. 中国保健营养(下旬刊),2012, 22(12): 5509. DOI:10.969/j.issn.1004-7484(x).2012.12.770.
[2] HEINE R G, LASKE N, HILL D J. The diagnosis and management of egg allergy[J]. Current Allergy and Asthma Reports, 2006, 6(2): 145-152.
[3] JACOBSEN B, HOFFMANN-SOMMERGRUBER K, HAVE T T, et al. The panel of egg allergens, Gal d1-Gal d5: their improved purification and characterization[J]. Molecular Nutrition and Food Research, 2008, 52(Suppl 1): 176-185. DOI:10.1002/mnfr.200700414.
[4] GOMAA A, BOYE J. Impact of irradiation and thermal processing on the immunochemical detection of milk and egg allergens in foods[J].Food Research International, 2015, 74: 275-283. DOI:10.1016/j.foodres.2015.05.023.
[5] CLAUDE M, LUPI R, BOUCHAUD G, et al. The thermal aggregation of ovalbumin as large particles decreases its allergenicity for egg allergic patients and in a murine model[J]. Food Chemistry, 2016, 203:136-144. DOI:10.1016/j.foodchem.2016.02.054.
[6] RAHAMAN T, VASILJEVIC T, RAMCHANDRAN L. Effect of processing on conformational changes of food proteins related to allergenicity[J]. Trends in Food Science & Technology, 2016, 49: 24-34. DOI:10.1016/j.tifs.2016.01.001.
[7] 张婉舒. 光谱法解析人乳β-酪蛋白二级结构及其对脂肪球膜结构的影响[D]. 哈尔滨: 东北农业大学, 2014: 2-5.
[8] CHAKRABORTY A, BASAK S. pH-Induced structural transitions of caseins[J]. Journal of Photochemistry and Photobiology B: Biology,2007, 87(3): 191-199. DOI:10.1016/j.jphotobiol.2007.04.004.
[9] 周煌. 鸡蛋清过敏原卵转铁蛋白和溶菌酶二级标准物质的研制[D].南昌: 南昌大学, 2014: 13-27.
[10] TONG Ping, GAO Jinyan, CHEN Hongbing, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610. DOI:10.1016/j.foodchem.2011.08.084.
[11] 袁小军, 马美湖. 禽蛋中卵转铁蛋白的研究进展[J]. 家禽科学,2009(5): 40-44.
[12] 黄群, 马美湖, 蔡朝霞, 等. S-构型转化对卵白蛋白微观结构的影响[J].光谱学与光谱分析, 2011, 31(12): 3319-3322. DOI:10.3964/j.is sn.1000-0593(2011)12-3319-04.
[13] 潘明喆, 李斌, 孟宪军. 木糖醇对大豆分离蛋白结构和起泡特性的影响[J]. 食品科学, 2016, 37(15): 63-68. DOI:10.7506/spkx1002-6630-201615011.
[14] 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用[J]. 实验技术与管理, 2010, 27(2): 33-36; 40.
[15] 陈蓁蓁, 张宁, 张文申, 等. 蛋白质分子荧光探针研究及其应用新进展[J]. 分析化学, 2006, 34(9): 1341-1347.
[16] 袁小军. 卵转铁蛋白的分离纯化、结构表征及体外抗菌研究[D]. 武汉: 华中农业大学, 2011: 61-77.
[17] JOO K, KATO Y. Assessment of allergenic activity of a heatcoagulated ovalbumin after in vivo digestion[J]. Bioscience Biotechnology Biochemistry, 2006, 70(3): 591-597. DOI:10.1271/bbb.70.591.
[18] MARTOS G, LOPEZ-EXPOSITO I, BENCHARITIWONG R, et al.Mechanisms underlying differential food allergy response to heated egg[J]. Journal of Allergy and Clinical Immunology, 2011, 127(4):990-997. DOI:10.1016/j.jaci.2011.01.057.
[19] KATO A, TAKAGI T. Formation of intermolecular beta-sheet structure during heat denaturation of ovalbumin[J]. Journal of Agricultural and Food Chemistry, 1988, 36(6): 1156-1159.DOI:10.1021/jf00084a007.
[20] 张银, 佟平, 麻小娟, 等. 热加工及超高压处理对卵白蛋白抗原性的影响[J]. 食品科学, 2010, 31(19): 250-253.
[21] GOLIAS J, SCHWARZER M, WALLNER M, et al. Heat-induced structural changes affect OVA-antigen processing and reduce allergic response in mouse model of food allergy[J]. PLoS ONE, 2012, 7:e37156. DOI:10.1371/journal.pone.0037156.
[22] DJURTOFT R, PEDERSEN H S, AABIN B, et al. Studies of food allergens: soybean and egg proteins[J]. Advances in Experimental Medicine and Biology, 1991, 289: 281-293.
[23] FUJIMURA Y, TACHIBANA H, ETO N, et al. Antigen binding of an ovomucoid specific antibody is affected by a carbohydrate chain located on the light chain variable region[J]. Bioscience Biotechnology Biochemistry, 2000, 64(11): 2298-2305. DOI:10.1271/bbb.64.2298.
[24] URISU A, ANDO H, MORITA Y, et al. Allergenic activity of heated and ovomucoid-depleted egg white[J]. Journal of Allergy of Clinical Immunology, 1997, 100(2): 171-176. DOI:10.1016/S0091-6749(97)70220-3.
[25] BARTNIKAS L M, SHEEHAN W J, PHIPATANAKUL W.Ovomucoid is not superior to egg white testing in predicting tolerance to baked egg[J]. Journal of Allergy and Clinical Immunology: in Practice, 2013, 1: 354-360. DOI:10.1016/j.jaip.2013.04.002.
[26] 史晓霞. 蛋清卵类粘蛋白分离纯化、结构表征及其过敏原性的研究[D]. 武汉: 华中农业大学, 2012: 43-48.
[27] RUPA P, ACHNARR L, MINE Y. Effect of heat denaturation of egg white proteins ovalbumin and ovomucoid on CD4+T cell cytokine production and human mast cell histamine production[J]. Journal of Functional Foods, 2015, 18: 28-34. DOI:10.1016/j.jff.2015.06.030.
[28] 赵龙飞, 徐亚军. 鸡蛋清中溶菌酶的应用性研究[J]. 食品工业, 2006,27(3): 19-20.
[29] 王晶. 鸡蛋贮藏期间三种蛋白质结构与功能性质的变化研究[D]. 武汉: 华中农业大学, 2012: 43-45.
[30] SASSI P, GIUGLIARELLI A, PAOLANTONI M, et al. Unfolding and aggregation of lysozyme: a thermodynamic and kinetic study by FTIR spectroscopy[J]. Biophysical Chemistry, 2011, 158(1): 46-53.DOI:10.1016/j.bpc.2011.05.002.
Effect of Thermal Processing on Structure of Four Major Egg White Allergens
LIU Ke1,2, XIONG Liji1,2, GAO Jinyan2, CHEN Hongbing1,3, TONG Ping1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. School of Food Science and Technology, Nanchang University, Nanchang 330047, China;3. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Abstract:In order to explore the impact of thermal processing on the structure of egg white allergens, four major allergens in hen’s egg white were heated under different conditions of temperature and time. Circular dichroism, ultraviolet and fluorescence spectroscopy were used to detect the spatial structure of allergens. Results showed that ovotransferrin was unstable to heat, and its molecular structure was unfolded, with the aromatic residues and hydrophobic groups exposed on the molecular surface after heating. The secondary structure of ovalbumin became more ordered, ultraviolet absorbance value decreased, and surface hydrophobicity increased when it was heated slightly; however, with increasing temperature and heating time, ovalbumin became unordered and aggregated. The secondary structure of ovomucoid was relatively stable, and its molecules were unfolded after mild heating, leading to increased absorption and fl uorescence intensities, and then aggregated partly after further heating. The secondary structure of lysozyme became disordered with the aromatic residues and hydrophobic groups gradually exposed after heating, but with increasing degree of heating, part of lysozyme became aggregated. The present study may provide a theoretical basis for studying the effect of heating on the allergenicity of egg allergens.
Key words:thermal processing; egg white allergens; spectral analysis; structure
DOI:10.7506/spkx1002-6630-201723009
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)23-0051-08
引文格式:
刘珂, 熊丽姬, 高金燕, 等. 热加工对鸡蛋中4 种主要过敏原结构的影响[J]. 食品科学, 2017, 38(23): 51-58.
DOI:10.7506/spkx1002-6630-201723009. http://www.spkx.net.cn
LIU Ke, XIONG Liji, GAO Jinyan, et al. Effect of thermal processing on structure of four major egg white allergens[J]. Food Science,2017, 38(23): 51-58. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723009. http://www.spkx.net.cn
收稿日期:2016-09-28
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102205);国家自然科学基金青年科学基金项目(31301524);江西省科技厅重点研发计划项目(20161BBG70062);江西省自然科学基金重点项目(20133ACB20009);食品科学与技术国家重点实验室项目(SKLF-ZZA-201612;SKLF-QN-201514)
作者简介:刘珂(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:liuke0916@163.com
*通信作者:佟平(1984—),女,副研究员,博士,研究方向为食品营养与安全。E-mail:tongping@ncu.edu.cn