表1 SBSE活性成分组成
Table 1 Contents of fl avonoids, proanthocyanidins and total phenols in SBSE
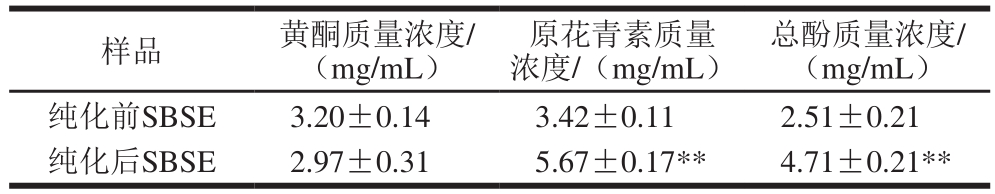
注:**.与纯化前相比,差异极显著(p<0.01)。
张佳婵1,王昌涛1,2,*,刘 瑶1,石秀芹1,赵 丹1,李 萌1,王成涛2,3,孙宝国2,3
(1.北京工商大学理学院,植物资源研究开发北京市重点实验室,北京 100048;2.北京工商大学 北京食品营养与人类健康高精尖创新中心,北京 100048;3.北京工商大学食品学院,食品添加剂与配料工程研究中心,北京 100048)
摘 要:以沙棘粕为研究对象,经乙醇提取、大孔吸附树脂纯化获得沙棘粕醇提取物(sea buckthorn seed extracts,SBSE)。以秀丽隐杆线虫为模式生物,研究SBSE的抗衰老作用及其可能机制。本研究考察了不同质量浓度范围内SBSE对秀丽隐杆线虫生命周期、生殖能力和应激抵御能力的影响,探索了SBSE对线虫抗氧化酶活力以及衰老相关基因表达水平的作用,从基因水平探索SBSE的抗衰老可能机制。结果:SBSE可以显著延长秀丽隐杆线虫的存活时间(p<0.05),减轻脂褐素水平的积累;0.05 mg/mL SBSE处理后秀丽隐杆线虫子代数量为(246.40±21.11)个,显著高于空白对照组的(205.80±20.42)个(p<0.05);对热应激和氧化应激有显著的防御效果(p<0.05);此外,SBSE提高了秀丽隐杆线虫体内超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的活力,降低了秀丽隐杆线虫促衰老基因age-1、daf-2的表达水平,提高了抗衰老基因sir-2.1的表达。该结果表明SBSE或许通过提高抗氧化酶活力以及改变衰老相关基因的表达水平来发挥抗衰老的功效。
关键词:沙棘粕醇提取物;秀丽隐杆线虫;抗氧化酶;抗衰老
衰老是生命过程的必然规律,是指机体各组织、器官功能随年龄增长而发生退行性变化的过程[1]。自由基学说是目前解释衰老的重要学说之一。近年来人们专注于对抗衰老活性成分效果及作用机制的研究,发现葡萄籽提取物、黄芪提取物、人参提取物等能直接清除自由基、提高抗氧化酶的活力以及降低丙二醛(malondialdehyde,M D A)的含量,发挥抗衰老的作用[2-4]。沙棘(Hippophae rhamnoides L.)是我国西部生态治理的优选植物,其果、叶、籽中均含有丰富的营养成分,目前已有研究证实了沙棘果汁、果油、果渣以及叶提取物在抗衰老方面的卓越功效[5-6]。
沙棘粕是沙棘籽经过脱油处理后的副产物,含有较多纤维素、半纤维素等物质,一般作为饲料或废弃物丢弃,造成资源的浪费[7]。经文献调研,沙棘粕中仍含有丰富的黄酮、多酚、原花青素等物质[8-11],具有显著的抗菌、抗氧化功效。但是相关研究内容多集中在对其成分定性定量分析以及化学水平功效的评价方面,鲜有研究将其应用于抗衰老模式生物——秀丽隐杆线虫,评价秀丽隐杆线虫的抗衰老指标。本课题前期摸索也已证实其在细胞水平显著的抗衰老能力。
秀丽隐杆线虫生命周期短、易饲养、自我繁殖能力强、与人类具有相似的衰老过程,因此越来越多抗衰老方面的研究选择其作为模式生物[12-15]。有研究证实了线虫寿命的长短与抵御应激的能力存在正相关,增强抵御能力的措施同样可以延长线虫寿命[16-21]。
本实验以秀丽隐杆线虫为模式生物,从线虫生理指标(寿命、生殖能力)、抵御应激能力(热应激、氧化应激)、体内抗氧化酶活力、基因水平4 个方面研究沙棘粕醇提取物(sea buckthorn seed extracts,SBSE)的抗衰老功效及作用机制。
1.1 材料与试剂
沙棘粕由青海康普生物科技股份有限公司提供,均烘干粉碎过筛;大肠埃希菌OP50和野生秀丽隐杆线虫品系N2均由北京市农林科学院惠赠。
芦丁、原花青素 中国药品生物制品检定所;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、盐酸(均为分析纯)北京化工厂;大孔吸附树脂DM130、蛋白胨、酵母粉、琼脂、胰蛋白胨 国药集团化学试剂有限公司;胡桃醌 天津一方科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒 碧云天生物技术有限公司;微量样品总RNA提取试剂盒、FastQuant RT Kit(含gDNase)、SYBR Green 天根生物科技(北京)有限公司。
1.2 仪器与设备
ECLIPSE E100扫描电子显微镜 日本Nikon公司;BS2202S型电子天平 北京赛多利斯仪器系统有限公司;DSHZ-300恒温水浴振荡器 太仓市实验设备厂;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;YJ-2450医用超净工作台 苏州净化设备厂;SPx-250BF-2生化培养箱 上海福玛实验设备有限公司;FC Multiskan酶标仪 赛默飞世尔(上海)仪器有限公司;Anke 3-30K台式高速冷冻离心机 德国Sigma公司。
1.3 方法
1.3.1 SBSE制备及初步分离
于35 ℃,将80%乙醇与经粉碎干燥处理的沙棘粕以8∶1(V/m)的比例混合,提取1.5 h后3 000×g离心15 min,分离上清液,按照相同方法重复提取2 次,合并上清液,真空旋转蒸发得到浓缩粗SBSE。
利用大孔吸附树脂初步分离提纯所得浓缩粗SBSE。DM130树脂为载体,湿树脂(20 g)乙醇湿法装柱(2.0 cm×35 cm)。上样体积10 mL(15 mg/mL),吸附时间60 min,解吸液为80%乙醇,解吸时间为65 min。将解吸液真空旋转蒸发浓缩,并于-80 ℃、3 Pa的条件下冷冻干燥48 h,得到SBSE。
取适量SBSE,用少量二甲基亚砜(dimethylsulfoxide,DMSO)溶液溶解,控制DMSO体积分数小于1%,过0.22 μm无菌滤膜获得SBSE浓缩液,秀丽隐杆线虫正式实验前用大肠埃希菌OP50菌液稀释至相应质量浓度。
1.3.2 主要活性成分的测定
将冷冻干燥后SBSE配制成10 mg/mL溶液,用于测定黄酮、原花青素以及总酚的质量浓度。
黄酮含量按照硝酸铝-亚硝酸钠比色法测定[22];原花青素含量按照香草醛比色法测定[23];总酚含量按照福林试剂还原比色法测定[22]。
1.3.3 秀丽隐杆线虫培养
参考文献[2 4]的方法,配制线虫基本培养基(nematode growth media,NGM),每个NGM平板加入200 μL大肠埃希菌OP50菌液,用玻璃涂布棒涂布均匀,培养皿边缘留出约0.5 cm为无菌区,涂布后的培养皿于37 ℃过夜培养。将L3或L4期秀丽隐杆线虫接种于涂布后的NGM培养基上,将培养基置于20 ℃生化培养箱中培养,观察秀丽隐杆线虫的生长情况并定期更换培养基。
1.3.4 秀丽隐杆线虫生命周期实验
参考文献[24]的方法,实验分为实验组和对照组。实验组中,将同期化的L4期秀丽隐杆线虫转移到含有4 种不同质量浓度SBSE(在大肠埃希菌OP50菌液中质量浓度分别为1.00、0.50、0.10、0.05 mg/mL)培养基中,对照组则以M9缓冲液代替。每个质量浓度设置3 个平行,每个平板约为30 条秀丽隐杆线虫,置于20 ℃培养,记为实验的第0天。在秀丽隐杆线虫的产卵期(第1~4天),每天将秀丽隐杆线虫挑至新的相应培养基中。隔天记录秀丽隐杆线虫的存活、死亡、删除数量,直至所有秀丽隐杆线虫死亡。
死亡及删除判断方法:用接种针刺激秀丽隐杆线虫,若刺激2 次以上均无反应,则可以判断秀丽隐杆线虫死亡;若秀丽隐杆线虫钻到培养基中、丢失、爬到培养皿壁上干死、生殖道外翻,则应被删除。
1.3.5 秀丽隐杆线虫急性热应激实验
分组及处理方法同1.3.4节。参考文献[24]方法,每组准备10 个平板,每个平板约30 条秀丽隐杆线虫。置于35 ℃培养箱中培养,此时设为0 h。每隔2~3 h将培养皿取出,记录秀丽隐杆线虫的存活、死亡数量。观察过后丢弃,以防温度改变对实验结果造成影响。共进行3 次独立实验。
死亡及删除判断方法同1.3.4节。
1.3.6 秀丽隐杆线虫生殖实验
分组及处理方法同1.3.4节,但采用同期化L3期秀丽隐杆线虫进行实验。参考文献[24]方法,每组设置10 个平行,每个平板1 条秀丽隐杆线虫,置于20 ℃培养。将秀丽隐杆线虫开始产卵的当天记为第1天,每天将秀丽隐杆线虫挑至新的相应培养皿中,至产卵期结束,约3~5 d。将所有平板置于20 ℃培养孵化,统计每条秀丽隐杆线虫在平板中孵化出线虫的总数即为该线虫的产卵量。共进行3 次独立实验。
1.3.7 秀丽隐杆线虫氧化应激实验
分组方法同1.3.4节,但采用同期化L3期秀丽隐杆线虫进行实验。参考文献[25]方法,每组设定3 个平行,每个平板约40 条秀丽隐杆线虫。每天将秀丽隐杆线虫挑至新的相应培养皿中,培养5 d后,分别转移到浓度为500 μmol/L的胡桃醌NGM培养基中,每组3 板,每板30 条。每间隔2 h观察秀丽隐杆线虫死亡情况并记录,至所有秀丽隐杆线虫死亡,实验重复3 次。倒置荧光显微镜观察秀丽隐杆线虫脂褐素水平,激发波长340~380 nm,发射波长430 nm。
1.3.8 抗氧化酶活力测定
分组方法同1.3.4节,但采用同期化L3期秀丽隐杆线虫进行实验。每组设定3 个平行,每个平板约40 条秀丽隐杆线虫。每天将秀丽隐杆线虫挑至新的相应培养皿中,培养5 d后,用M9缓冲液冲洗NGM培养基表面秀丽隐杆线虫至离心管。生理盐水洗涤并加入200 μL生理盐水于液氮中反复冻融3 次,离心取上清液测定SOD、CAT和GSH-Px活力及蛋白质质量浓度。实验重复3 次。
实验严格按照SOD、CAT和GSH-Px检测试剂盒说明书进行样品测定。
1.3.9 抗衰老相关基因表达水平的测定
分组方法同1.3.4节,但采用同期化L3期秀丽隐杆线虫进行实验。每组设定3 个平行,每个平板约40 条线虫。每天将秀丽隐杆线虫挑至新的相应培养皿中,培养5 d后,用M9缓冲液冲洗NGM培养基表面线虫至离心管。生理盐水洗涤后放入-80 ℃冰箱备用。依次进行线虫RNA的提取、RNA纯度及完整性的鉴定、合成cDNA以及利用半定量实时荧光定量聚合酶链式反应(quantitative real-time PCR,qRT-PCR)方法监测秀丽隐杆线虫体内相关抗氧化基因mRNA表达水平。实验重复3 次。
1.4 数据统计分析
实验数据利用SPSS 19.0 数据处理软件进行统计学处理,组间比较采用单因素ANOVA分析,两两比较采用t检验,以p<0.05为差异有统计学意义,所得结果以 ±s表示。
2.1 SBSE活性成分
表1 SBSE活性成分组成
Table 1 Contents of fl avonoids, proanthocyanidins and total phenols in SBSE

注:**.与纯化前相比,差异极显著(p<0.01)。
表1显示,SBSE纯化前、后均含有丰富的黄酮、原花青素以及总酚。10 mg/mL纯化前SBSE中黄酮占3 类物质总量的35%以上,原花青素占37.5%,总酚质量浓度为(2.51±0.21)mg/mL,占27.5%。SBSE经大孔吸附树脂纯化后,对原花青素和总酚具有富集作用,原花青素所占比例提升至42%,总酚质量浓度增加至(4.71±0.21)mg/mL,与纯化前相比差异极显著(p<0.01)。
2.2 SBSE对秀丽隐杆线虫寿命的影响
表2 SBSE对秀丽隐杆线虫寿命的影响
Table 2 Effect of SBSE on lifespan of Caenorhaditis elegans
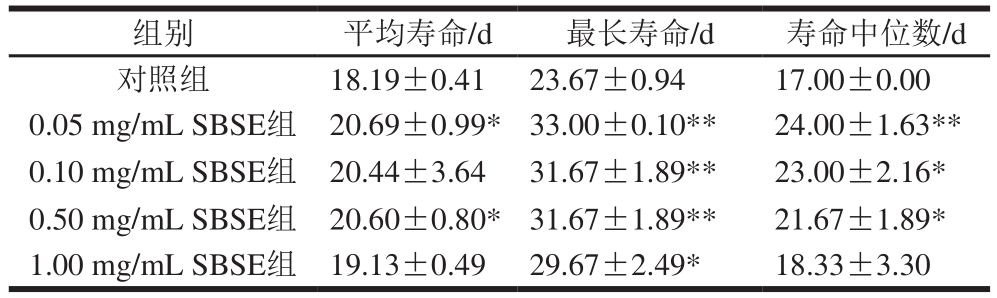
注:*.与对照组相比差异显著(p<0.05);**.与对照组相比差异极显著(p<0.01)。下同。
自然寿命是进行抗衰老研究分析的首选指标。本项目测定了4 个质量浓度条件下SBSE对秀丽隐杆线虫寿命的影响,对其平均寿命、最长寿命以及寿命中位数进行分析,结果见表2。SBSE处理组秀丽隐杆线虫的平均寿命、最长寿命以及寿命中位数均高于对照组。0.05 mg/mL与0.50 mg/mL SBSE组秀丽隐杆线虫的平均寿命显著高于对照组(p<0.05),并且0.05~0.50 mg/mL的SBSE组最长寿命均极显著高于对照组(p<0.01),0.05、0.10 mg/mL和0.50 mg/mL SBSE组寿命中位数与对照组差异极显著(p<0.01)或显著(p<0.05),说明SBSE可以显著延长秀丽隐杆线虫寿命。但是,当质量浓度达到1.00 mg/mL时,秀丽隐杆线虫平均寿命与寿命中位数与对照组无显著差异(P>0.05),最长寿命显著高于对照组(p<0.05),说明高质量浓度SBSE对秀丽隐杆线虫存活率有一定影响。
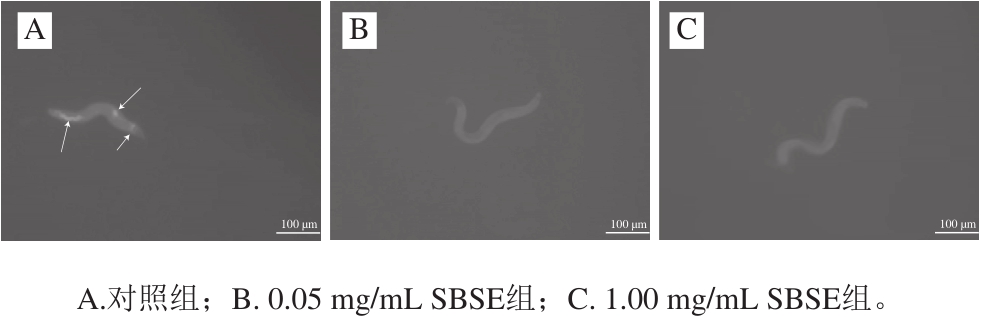
图1 SBSE对秀丽隐杆线虫脂褐素荧光强度的影响
Fig. 1 Effect of SBSE on lipofuscin fl uorescent intensity of Caenorhabditis elegans
参照文献[25]对线虫节点的筛选,以对照组存活率20%为节点,收集秀丽隐杆线虫,荧光倒置显微镜观察脂褐素水平。由图1(图中箭头指示为荧光处)可知,SBSE可以减缓秀丽隐杆线虫的衰老,延长平均存活时间,减少脂褐素的积累。
2.3 SBSE对秀丽隐杆线虫生殖能力的影响
表3 各组秀丽隐杆线虫子代数量
Table 3 Number of offsprings of Caenorhaditis elegans in each group

正常秀丽隐杆线虫的子代数量在200~350 个,且对环境极其敏感。有报道指出,在很多生物中存在着寿命的延长要以牺牲生殖为代价[26],但也有报道指出白藜芦醇[27]、淫羊藿总黄酮[28]可以延长秀丽隐杆线虫的寿命同时不影响生殖能力。本研究通过秀丽隐杆线虫生殖能力实验发现(表3),SBSE在延长秀丽隐杆线虫寿命的同时,并没有对生殖能力造成影响。0.05 mg/mL SBSE组秀丽隐杆线虫子代数量达到(246.40±21.11)个,显著高于对照组20%以上(p<0.05)。且SBSE处理组子代数量在第2、3天达到高峰,与对照组相比差异极为显著(p<0.01)。
2.4 SBSE对秀丽隐杆线虫的抗急性热应激效应的影响
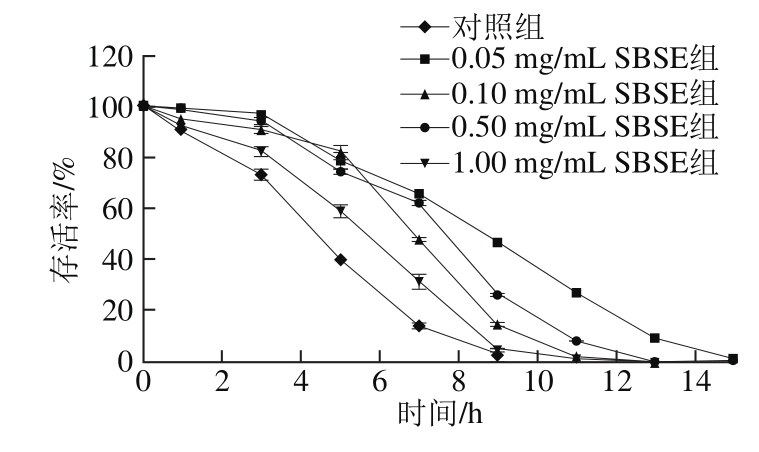
图2 秀丽隐杆线虫对热应激效应的生存曲线
Fig. 2 Survival curves of Caenorhaditis elegans against heat stress
本研究探讨了35 ℃条件下,不同质量浓度SBSE干预秀丽隐杆线虫抵抗热应激的能力变化。由图2可知,与对照组相比,SBSE组秀丽隐杆线虫生存曲线右移,说明抵抗热应激效应的能力均有所增强。
表4 SBSE对热应激各组秀丽隐杆线虫寿命的影响
Table 4 Effect of SBSE on lifespan of Caenorhaditis elegansin in each group with heat stress
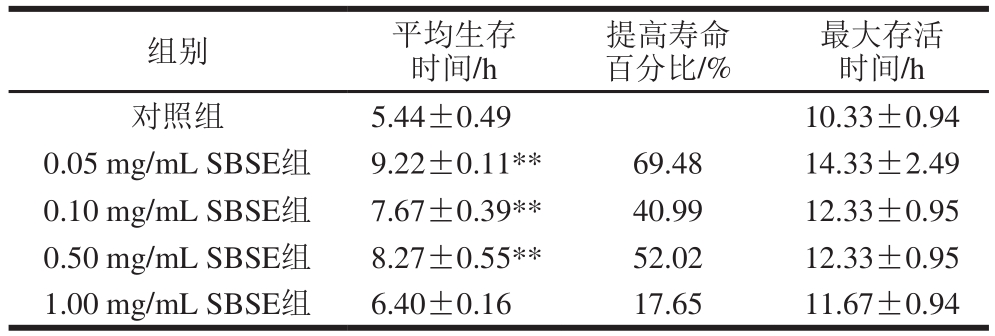
由表4可知,0.05 mg/mL的SBSE组秀丽隐杆线虫平均生存时间最长,比对照组提高69.48%(p<0.01),0.10、0.50 mg/mL的SBSE组秀丽隐杆线虫平均生存时间也均极显著高于对照组(p<0.01)。
2.5 SBSE对秀丽隐杆线虫抗氧化应激效应的影响
衰老是生物体各器官功能开始逐步降低的一种生理现象,是一个缓慢的渐进过程,自由基学说是目前解释衰老的重要学说之一。机体正常代谢在产生代谢产物的同时,还会产生活性氧副产物,如超氧阴离子自由基(O2-·)、过氧化氢(H2O2)、羟自由基(·OH),活性氧含量过多会造成机体内氧化系统与抗氧化系统的失衡,加速衰老[1]。胡桃醌可以诱导线虫发生体内氧化还原反应,产生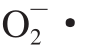 ,诱发线虫氧化应激[29]。
,诱发线虫氧化应激[29]。

图3 秀丽隐杆线虫对氧化应激效应的生存曲线
Fig. 3 Survival curves of Caenorhaditis elegans against oxidative stress
本实验选择胡桃醌作为强氧化剂,构建氧化损伤环境,将SBSE处理后的秀丽隐杆线虫转移至氧化损伤环境中,通过测定秀丽隐杆线虫存活率来检测SBSE是否可以帮助机体抵御氧化损伤。由图3可知,与胡桃醌对照组相比,SBSE处理后秀丽隐杆线虫生存时间均有所延长,抵御氧化应激的能力普遍提高。
表5 SBSE对氧化应激秀丽隐杆线虫寿命的影响
Table 5 Effect of SBSE on lifespan of Caenorhaditis elegans in each group with oxidative stress
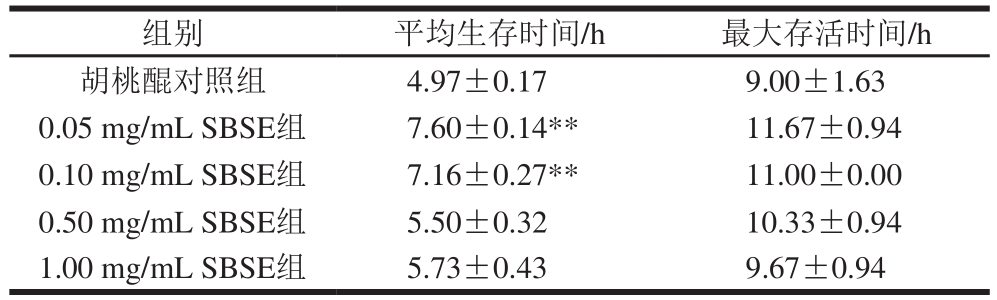
由表5可知,其中0.05、0.10 mg/mL处理后的秀丽隐杆线虫平均生存时间极显著高于胡桃醌对照组(p<0.0 1),分别由(4.9 7±0.1 7)h提高到(7.60±0.14)h和(7.16±0.27)h。

图 4 SBSE对胡桃醌损伤组秀丽隐杆线虫脂褐素荧光强度的影响
Fig. 4 Effect of SBSE on lipofuscin fl uorescent intensity of Caenorhabditis elegans with juglone-induced oxidative stress
以胡桃醌对照组存活率20%为节点,收集线虫,荧光倒置显微镜观察脂褐素水平,结果见图4(图中箭头所指处为荧光处)。经SBSE处理后,秀丽隐杆线虫的脂褐素水平明显降低,由此可见,SBSE可以保护秀丽隐杆线虫以抵御氧化应激损伤。
2.6 SBSE对秀丽隐杆线虫抗氧化酶活力情况的影响
SOD能催化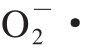 发生歧化反应,生成H2O2和O2;H2O2在CAT的催化下产生水和O2。GSH-Px能催化GSH变为氧化型GSH,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。这3 种酶都是生物体内重要的抗氧化酶[30]。
发生歧化反应,生成H2O2和O2;H2O2在CAT的催化下产生水和O2。GSH-Px能催化GSH变为氧化型GSH,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。这3 种酶都是生物体内重要的抗氧化酶[30]。
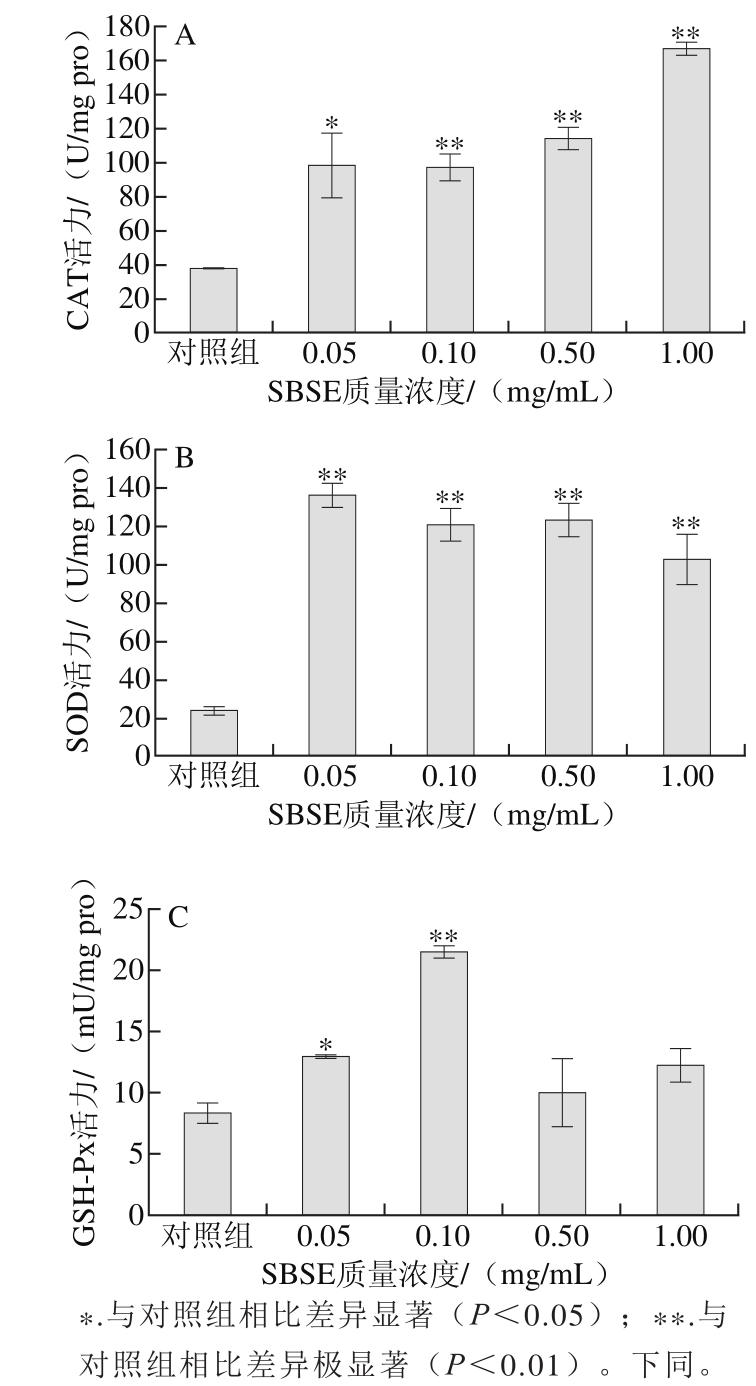
图5 SBSE对秀丽隐杆线虫CAT(A)、SOD(B)、GSH-Px(C)活力的影响
Fig. 5 Effect of SBSE on CAT (A), SOD (B) and GSH-Px (C) activity of Caenorhabditis elegans
由图5可知,在考察质量浓度范围内,SBSE均可以显著提高秀丽隐杆线虫体内SOD、CAT和GSH-Px活力(p<0.05)。0.05 mg/mL的SBSE组的CAT活力由(37.80±0.30)U/mg pro显著提高到(98.33±19.32)U/mg pro(p<0.05),其他质量浓度均极显著高于对照组(p<0.01),CAT酶活力存在剂量依赖关系;SBSE组的SOD活力均极显著高于对照组(p<0.01);GSH-Px活力在SBSE质量浓度低于0.10 mg/mL时,呈现剂量依赖关系,当SBSE质量浓度高于0.10 mg/mL时,与对照组相比,未发现明显差异(P>0.05)。
2.7 SBSE对秀丽隐杆线虫衰老相关基因表达情况的影响基因age-1、sir-2.1、sod-3、daf-2等能通过胰岛素-类胰岛素信号转导通路(insulin/IGF-1,IIS)调节秀丽隐杆线虫寿命[31-34]。其中age-1、daf-2基因进入衰老期后表达量增加,显示促进衰老作用;而sir-2.1、sod-3进入衰老期后表达量下降,显示延缓衰老的作用。
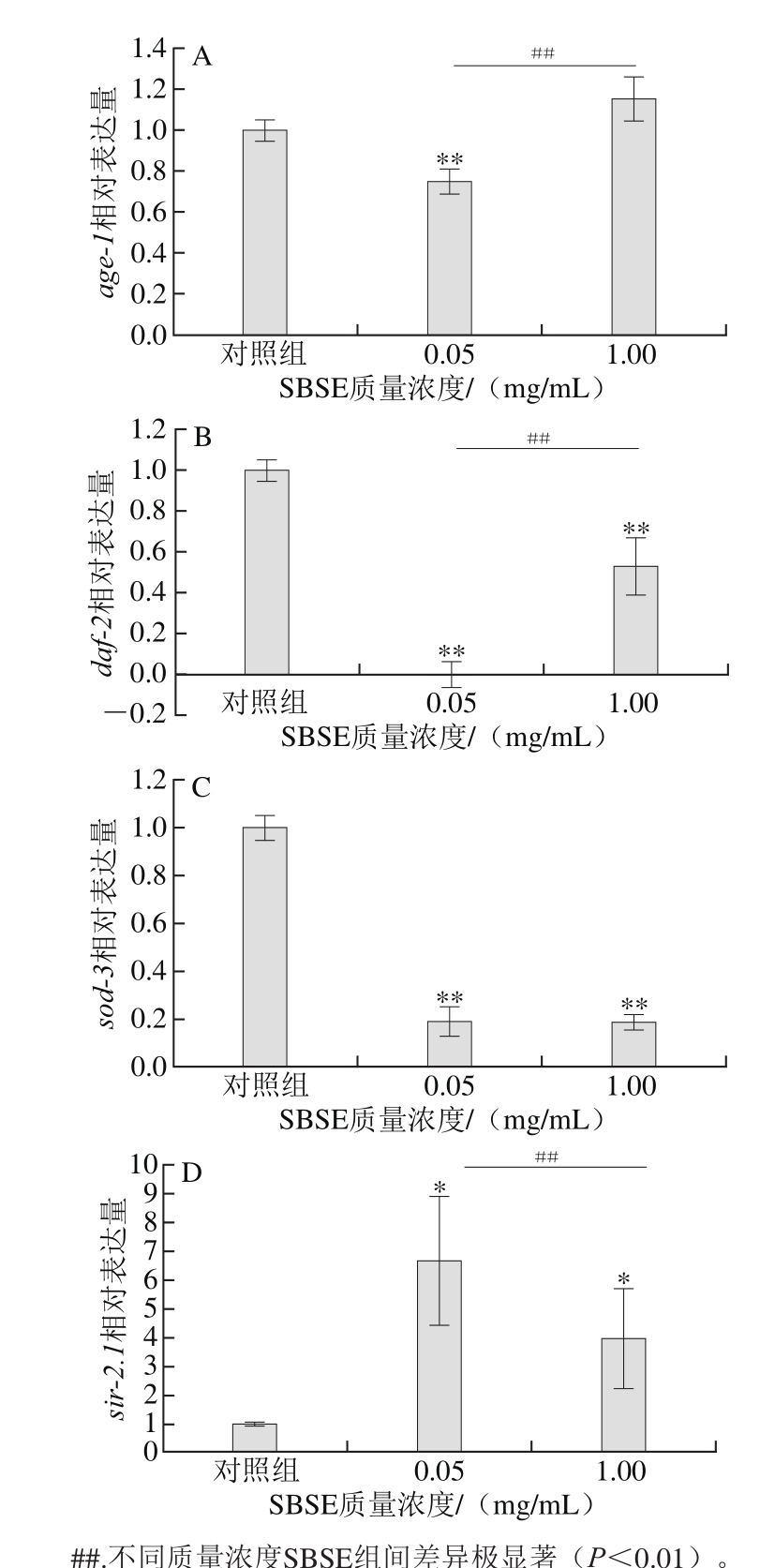
图6 SBSE对秀丽隐杆线虫抗氧化基因age-1(A)、daf-2(B)、sod-3(C)、sir-2.1(D)表达情况的影响
Fig. 6 Effect of SBSE on the expression of age-1(A), daf-2(B), sod-3(C)and sir-2.1(D) in Caenorhabditis elegans
由图6可知,与对照组相比,0.05 mg/mL SBSE作用下,促衰老基因age-1表达量极显著降低(p<0.01),1.00 mg/mL SBSE对age-1的影响不显著(P>0.05),与低剂量组0.05 mg/mL相比有极显著性差异(p<0.01);促衰老相关基因daf-2在SBSE刺激下,表达水平极显著降低(p<0.01),且低剂量组与高剂量组之间有极显著性差异(p<0.01)。与对照组相比抗衰老相关基因sod-3在SBSE作用下表达量极显著降低(p<0.01),2 个SBSE组间差异不显著(P>0.05);与对照组相比,sir-2.1基因的表达量显著上升(p<0.05),且低剂量组与高剂量组间差异极显著(p<0.01)。
衰老以及与衰老相关的疾病是日趋严重的医学问题和社会问题。Brenner[12]发现了秀丽隐杆线虫的遗传调控机制,自此以后,秀丽隐杆线虫便作为模式生物,广泛应用于抗衰老物质的筛选和抗衰老分子机制的研究中。本实验以沙棘产业副产物沙棘粕为研究对象,依照课题组前期研究条件提取分离纯化得到SBSE,以模式生物——秀丽隐杆线虫为研究载体,探讨了SBSE的抗衰老功效及作用机制。
本实验通过初步分析发现:SBSE纯化前、后,均含有黄酮、原花青素以及总酚,其中,大孔吸附树脂的纯化对原花青素和总酚有富集作用,两者质量浓度与纯化前相比具有极显著差异(p<0.01)。该结果为SBSE在秀丽隐杆线虫抗衰老方面的研究提供了参考依据。
自然寿命是进行抗衰老研究分析的首选指标。在有关天然产物延长线虫寿命方面,目前存在2 种不同结果:一种为某种物质只能延长胁迫条件下线虫的寿命,而不能延长非环境胁迫条件下的线虫寿命。如绿茶中表没食子酸只有在热应激和氧化应激环境中才能延长线虫寿命,而在自然条件下则无显著影响[35];Chen Wei等[36]在研究白藜芦醇对线虫寿命的影响时,发现白藜芦醇只能在氧化应激环境下有效延长线虫的寿命。另一种结果为某种物质不仅可以延长胁迫环境下线虫的寿命,也可以延长非环境胁迫条件下的线虫寿命。例如,黄酮类化合物淫羊藿苷不仅可延长自然环境条件下的线虫寿命,也可以延长热应激和氧化应激条件下的线虫寿命[28];Wilson等[37]在研究蓝莓多酚时也发现其能延长自然环境和热应激环境下线虫的寿命。本实验所用样品SBSE也可归于后一种结果:0.05 mg/mL的SBSE提高秀丽隐杆线虫寿命的效果最显著;对胡桃醌诱导的氧化应激损伤也具有一定的抵御作用,其中0.05、0.10 mg/mL处理后的线虫平均生存时间极显著提高(p<0.01)。通过荧光检测线虫脂褐素水平发现,SBSE处理下自发荧光减弱,有效降低了脂褐素的积累。
在秀丽隐杆线虫的研究中,部分科学家认为延长寿命和生殖均需要资源,而体内的资源有限,因此长寿和生殖能力之间存在“利弊权衡”[26]。本实验通过对秀丽隐杆线虫生理指标和生化指标的分析发现:SBSE可以显著提高秀丽隐杆线虫的自然寿命(p<0.05),对其生殖能力也具有显著促进作用(p<0.05)。与此同时,淫羊藿提取物[28]、白藜芦醇[27]等也不仅能延长线虫寿命,而且能提高其生殖能力。可见,并非本结果与“利弊权衡”理论不合,说明该结果是有一定指导意义的。
IIS是一个高度保守且最为详尽的寿命调控环节[32]。在线虫体内,IIS对于发育、代谢和衰老的调节均起到关键作用,该信号通路通过控制磷酸化daf-16转移因子来调控[32-33]。在氧化应激和热应激条件下,daf-16能激活下游因子SOD-3,SOD-3能清除体内过多的超氧化物和自由基,减少氧化损伤[33-34]。daf-2是线虫中表达的胰岛素受体家族的唯一成员,激活daf-16或抑制daf-2是调节IIS延缓线虫衰老的关键[31]。许多被证实有延长线虫寿命作用的植物活性成分或药物,其抗衰老作用机制多与该信号通路密切相关。本实验并未对daf-16基因表达水平进行检测,但是对其下游分子促衰老基因age-1、daf-2和抗衰老基因sir-2.1、sod-3进行了考察。SBSE可以极显著降低age-1、daf-2表达水平(p<0.01),显著提高sir-2.1的表达(p<0.05),对sod-3基因表达水平有极显著抑制作用(p<0.01),但是对SOD活力有极显著促进作用(p<0.01),这说明基因转录水平的变化并不足以反映蛋白翻译水平以及蛋白活性的变化。该结果也预示着SBSE与IIS通路可能有关。为进一步证实SBSE与IIS通路的可能作用机制,还需进一步以IIS关键位点进行突变的突变株(如daf-16(mu86)突变株和daf-2(e1370)突变株)为研究载体,进行后续研究。
综上所述,SBSE可能是通过IIS调控秀丽隐杆线虫抗衰老相关基因的表达水平,降低体内脂褐素的积累,增加其对抗急性热应激和氧化应激的抵御能力,使得线虫寿命显著延长(p<0.05)。
参考文献:
[1] VAN RAAMSDONK J M, HEKIMI S. Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans[J]. PLoS Genetics, 2009, 5(2): e1000361. DOI:10.1371/journal.pgen.1000361.
[2] JIAO J J, WEI Y, CHEN J N, et al. Anti-aging and redox state regulation effects of A-type proanthocyanidins-rich cranberry concentrate and its comparison with grape seed extract in mice[J].Journal of Functional Foods, 2017, 30: 63-73.
[3] 钟灵, 王振富, 文德鉴. 黄芪多糖抗衰老作用的实验研究[J].中国应用生理学杂志, 2013, 29(4): 350-352. DOI:10.13459/j.cnki.cjap.2013.04.007.
[4] 李燕. 银耳多糖的抗衰老作用及其机制研究[D]. 上海: 第二军医大学, 2004: 3.
[5] NEGI P S, CHAUHAN A S, SADIA G A, et al. Antioxidant and antibacterial activities of various seabuckthorn (Hippophae rhamnoides L.)seed extracts[J]. Food Chemistry, 2006, 92(1): 119-124. DOI:10.1016/j.foodchem.2004.07.009.
[6] WANI T A, WANI S M, AHMAD M, et al. Bioactive profile,health benefits and safety evaluation of sea buckthorn (Hippophae rhamnoides L.): a review[J]. Cogent Food and Agriculture, 2016, 2(1):1128519. DOI:10.1080/23311932.2015.1128519.
[7] SURYAKUMAR G, GUPTA A. Medicinal and therapeutic potential of sea buckthorn (Hippophae rhamnoides L.)[J]. Journal of Ethnopharmacology, 2011, 138(2): 268-278. DOI:10.1016/j.jep.2011.09.024.
[8] YASUKAWA K, KITANAKA S, KAWATA K, et al. Anti-tumor promoters phenolics and triterpenoid from Hippophae rhamnoides[J].Fitoterapia, 2009, 80(3): 164-167. DOI:10.1016/j.ftote.2009.01.006.
[9] KIM J S, KWON Y S, SA Y J, et al. Isolation and identifcation of sea buckthorn (Hippophae rhamnoides) phenolics with antioxidant activity and α-glucosidase inhibitory ef f ect[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 138-144. DOI:10.1021/jf103130a.
[10] MICHEL T, DESTANDAU E, FLOCH G L, et al. Antimicrobial,antioxidant and phytochemical investigations of sea buckthorn (Hippophaë rhamnoides L.) leaf, stem, root and seed[J]. Food Chemistry, 2012,131(3): 754-760. DOI:10.1016/j.foodchem.2011.09.029.
[11] TULSAWANI R. Ninety day repeated gavage administration of Hipphophae rhamnoides extract in rats[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2483-2489. DOI:10.1016/j.fct.2010.06.018.
[12] BRENNER S. The genetics of Caenorhabditis elegans[J]. Genetics,1974, 77(1): 71-94.
[13] LAKOWSKI B, HEKIMI S. The genetics of caloric restriction in Caenorhabditis elegans[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(22): 13091-13096.DOI:10.1073/pnas.95.22.13091.
[14] 吕婷. 利用模式生物秀丽隐杆线虫对植物提取物抗衰老的研究[D].南京: 南京师范大学, 2014: 5-9.
[15] 游牧, 胡云虎. 秀丽隐杆线虫在抗衰老领域应用的研究进展[J]. 中国美容医学杂志, 2016, 25(2): 104-107.
[16] COLLINS J J, EVASON K, KORNFELD K. Pharmacology of delayed aging and extended lifespan of Caenorhabditis elegans[J].Experimental Gerontology, 2006, 41(10): 1032-1039. DOI:10.1016/j.exger.2006.06.038.
[17] TEJEDA-BENITEZ L, OLIVERO-VERBEL J. Caenorhabditis elegans: a biological model for research in toxicology[J]. Reviews of Environmental Contamination and Toxicology, 2016, 237: 1-35.DOI:10.1007/978-3-319-23573-8_1.
[18] BALLA K M, TROEMEL E R. Caenorhabditis elegans as a model for intracellular pathogen infection[J]. Cellular Microbiology, 2013, 15(8):1313-1322. DOI:10.1111/cmi.12152.
[19] TROEMEL E R, FÉLIX M A, WHITEMAN N K, et al. Microsporidia are natural intracellular parasites of the nematode, Caenorhabditis elegans[J]. PLoS Biology, 2008, 6(12): 2736-2752. DOI:10.1371/journal.pbio.0060309.
[20] MELOV S, RAVENSCROFT J, MALIK S, et al. Extension of lifespan with superoxide dismutase/catalase mimetics[J]. Science, 2000,289: 1567-1569. DOI:10.1126/science.289.5484.1567.
[21] ISHII N. The role of stress in ageing: research on the nematode,Caenorhabditis elegans[J]. British Journal of Dermatology, 2005,153(Suppl 2): 1-5. DOI:10.1111/j.1365-2133.2005.06963.x
[22] THABTI I, ELFALLEH W, HANNACHI H, et al. Identification and quantification of phenolic acids and flavonol glycosides in Tunisian Morus, species by HPLC-DAD and HPLC-MS[J].Journal of Functional Foods, 2012, 4(1): 367-374. DOI:10.1016/j.jff.2012.01.006.
[23] SARNOSKI P J, JOHNSON J V, REED K A, et al. Separation and characterisation of proanthocyanidins in Virginia type peanut skins by LC-MSn[J]. Food Chemistry, 2012, 131(3): 927-939. DOI:10.1016/j.foodchem.2011.09.081.
[24] JIANG Y, CHEN J D, WU Y, et al. Sublethal toxicity endpoints of heavy metals to the nematode Caenorhabditis elegans[J]. PLoS ONE,2016, 11(1): e0148014. DOI:10.1371/journal.pone.0148014.
[25] 王浩, 王红. 紫薯提取物对秀丽隐杆线虫抗氧化作用的影响[J/OL].食品科学, 2016(2016-11-14)[2017-05-03]. http://www.spkx.net.cn/CN/abstract/abstract39809.shtml.
[26] 王艳菊. 葡萄籽原花青素对秀丽隐杆线虫生命周期的影响[D]. 北京: 北京林业大学, 2014: 13-17.
[27] 王芳, 田仕夫, 邬树伟, 等. 白藜芦醇对线虫寿命的影响及分子机理研究[J]. 食品工业科技, 2011, 32(12): 126-128. DOI:10.13386/j.issn1002-0306.2011.12.037.
[28] 蔡外娇, 张新民, 黄建华, 等. 淫羊藿总黄酮延缓秀丽隐杆线虫衰老的实验研究[J]. 中国中西医结合杂志, 2008, 28(6): 522-525.
[29] DE CASTRO E, DE CASTRO S H, JOHNSON T E. Isolation of longlived mutants in Caenorhabditis elegans using selection for resistance to juglone[J]. Free Radical Biology & Medicine, 2004, 37(2): 139-145.DOI:10.1016/j.freeradbiomed.2004.04.021.
[30] 黄润庭, 李宗军, 谭雅, 等. 湘西香醋对秀丽隐杆线虫体内抗氧化作用[J]. 食品科学, 2016, 37(7): 208-212. DOI:10.7506/spkx1002-6630-201607038.
[31] KIMURA K D, TISSENBAUM H A, LIU Y, et al. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J]. Science, 1997, 277: 942-946.
[32] TISSENBAUM H A, RUVKUN G. An insulin-like signaling pathway affects both longevity and reproduction in Caenorhabditis elegans[J].Genetics, 1998, 148(2): 703-717.
[33] MUKHOPADHYAY A, OH S W, TISSENBAUM H A. Worming pathways to and from DAF-16/FOXO[J]. Experimental Gerontology,2006, 41(10): 928-934. DOI:10.1016/j.exger.2006.05.020.
[34] CHEN A T, GUO C, ITANI O A, et al. Longevity genes revealed by integrative analysis of isoform-specificdaf-16/FOXO mutants of Caenorhabditis elegans[J]. Genetics, 2015, 201(2): 613-629.DOI:10.1534/genetics.115.177998.
[35] ZHANG L Z, JIE G L, ZHANG J J. et al. Significant longevityextending effects of EGCG on Caenorhabditis elegans under stress[J]. Free Radical Biology and Medicine, 2009, 46(3): 414-421.DOI:10.1016/j.freeradbiomed.2008.10.041.
[36] CHEN Wei, REZAIZADEHNAJAFI L, WINK M. Influence of resveratrol on oxidative stress resistance and life span in Caenorhabditis elegans[J]. Journal of Pharmacy and Pharmacology,2013, 65(5): 682-688. DOI:10.1111/jphp.12023.Epub2013Jan31.
[37] WILSON M A, SHUKITT-HALE B, KALT W, et al. Blueberry polyphenols increase lifespan and thermo tolerance in Caenorhabditis elegans[J].Ageing Cell, 2006, 5(1): 59-68. DOI:10.1111/j.1474-9726.2006.00192.x.
Anti-Aging Effect and Its Mechanism of Ethanol Extract from Sea Buckthorn Seed Meal in Caenorhabditis elegans
ZHANG Jiachan1, WANG Changtao1,2,*, LIU Yao1, SHI Xiuqin1, ZHAO Dan1, LI Meng1, WANG Chengtao2,3, SUN Baoguo2,3
(1. Beijing Key Laboratory of Plant Resources Research and Development, School of Science, Beijing Technology and Business University, Beijing 100048, China; 2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University, Beijing 100048, China; 3. Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China)
Abstract:In the present study, the anti-aging effect of sea buckthorn seed extracts (SBSE) obtained by ethanol extraction and macroporous resin purif i cation was evaluated using Caenorhabditis elegans as a model organism and its underlying mechanism was discussed as well. The effect of different concentrations of SBSE was investigated on the lifespan,reproductive capability, heat and oxidative stress defense of C. elegans. In order to explore the anti-aging mechanism of SBSE at the gene level, the activity of antioxidant enzymes and the expression levels of related genes were determined. The results indicated that SBSE could signif i cantly prolong the lifespan of C. elegans (P < 0.05), and reduce the accumulation of lipofuscin. Meanwhile, the number of C. elegans offsprings treated with 0.05 mg/mL of SBSE (246.40 ± 21.11) was signif i cantly bigger than the control (205.80 ± 20.42) (P < 0.05). SBSE could signif i cantly enhance the heat and oxidative stress defense (P < 0.05). Furthermore, SBSE increased the activity of superoxide dismutase, catalase and glutathione peroxidase, down-regulated the pro-aging gene expression levels of age-1 and daf-2, and up-regulated the anti-aging gene expression levels of sir-2.1. Therefore, SBSE possess an anti-aging effect by increasing the activity of antioxidant enzymes and changing the expression of aging-related genes.
Key words:sea buckthorn seed extracts; Caenorhabditis elegans; antioxidant enzymes; anti-aging
DOI:10.7506/spkx1002-6630-201723023
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)23-0141-08
收稿日期:2017-05-04
基金项目:国家自然科学基金面上项目(31571801)
作者简介:张佳婵(1987—),女,实验师,硕士,研究方向为食品生物技术。E-mail:xiaochan8787@163.com
*通信作者:王昌涛(1975—),男,教授,博士,研究方向为生物化工。E-mail:wangct@th.btbu.edu.cn
引文格式:
张佳婵, 王昌涛, 刘瑶, 等. 沙棘粕醇提取物对秀丽隐杆线虫的抗衰老功效及其机制[J]. 食品科学, 2017, 38(23):141-148.
DOI:10.7506/spkx1002-6630-201723023. http://www.spkx.net.cn
ZHANG Jiachan, WANG Changtao, LIU Yao, et al. Anti-aging effect and its mechanism of ethanol extract from sea buckthorn seed meal in Caenorhabditis elegans[J]. Food Science, 2017, 38(23): 141-148. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201723023. http://www.spkx.net.cn